
- •П.А. Киселев, с.Б. Бокуть курс лекций по физической химии
- •Введение
- •Лекция 1. Газовые законы
- •1.1. Температура и нулевой закон термодинамики
- •1.2. Законы поведения идеальных газов: уравнение состояния идеального газа
- •1.3. Кинетическое уравнение газов
- •1.4. Уравнение состояния реальных (неидеальных) газов. Уравнение Ван-дер-Ваальса
- •1.5. Закон парциальных давлений Дальтона
- •Лекция 2. Первое начало термодинамики и термохимия
- •2.1. Вводная часть
- •2.2. Некоторые понятия, используемые в термодинамике
- •2.3. Формулировка первого начала термодинамики
- •2.4. Применение первого начала термодинамики к различным процессам
- •2.5. Теплота химической реакции (общие положения)
- •2.6. Закон Гесса
- •2.7. Следствие из закона Гесса
- •Лекция 3. Второе начало термодинамики и его применение
- •3.1. Основной смысл и значение второго закона термодинамики
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировка и математическое выражение второго начала термодинамики
- •3.4. Изменение энтропии изолированной системы
- •3.5. Статистическая природа второго начала термодинамики
- •Лекция 4. Третье начало термодинамики. Расчеты изменения энтропии при различных процессах
- •4.1. Формулировка третьего начала термодинамики
- •4.2. Абсолютные и стандартные значения энтропии
- •4.3. Расчеты изменения энтропии в различных процессах
- •1. Расчеты изменения энтропии при изотермических процессах
- •2. Расчет изменения энтропии в неизотермических процессах
- •3. Расчет изменения энтропии сложного процесса
- •4.4. Расчет изменения энтропии при протекании химического процесса
- •4.5. Критерии направления протекания процессов и достижения равновесных состояний в открытых и закрытых системах. Понятие об энергии Гиббса
- •Лекция 5. Химические реакции как открытые в термодинамическом смысле системы. Направление протекания химических реакций. Равновесные химические реакции
- •5.1. Понятие о химическом потенциале
- •5.2. Экзергонические и эндергонические реакции
- •5.3. Взаимосвязь энтальпийного и энтропийного факторов в качестве критерия самопроизвольного протекания химической реакции
- •5.4. Понятие о равновесии химической реакции. Обратимые и необратимые реакции
- •5.5. Уравнение изотермы химической реакции и вывод закона действующих масс
- •5.6. Зависимость константы химического равновесия от температуры
- •Лекция 6. Химическое равновесие в гетерогенных и гомогенных системах
- •6.1. Взаимосвязь химического потенциала с другими термодинамическими функциями
- •6.2. Летучесть
- •6.3. Идеальный раствор
- •6.4. Фазовая диаграмма содержит зоны, линии и тройную точку
- •6.5. Уравнение Клаузиуса-Клапейрона
- •6.6. Коллигативные свойства растворов
- •6.7. Понижение точки замерзания и повышение точки кипения растворов
- •6.8. Осмотическое давление
- •6.9. Растворы электролитов
- •Лекция 7. Растворы электролитов
- •7.1. Общие сведения о теории электролитической диссоциации
- •7.2. Сильные и слабые электролиты
- •7.3. Закон разведения
- •7.4. Сильные электролиты
- •7.5. Ионная сила
- •7.6. Произведение растворимости
- •7.7. Электролитическая диссоциация воды
- •7.8. Концентрация водородных ионов
- •7.9. Буферные растворы
- •7.10. Механизм действия буферных растворов
- •7.11. Буферная емкость
- •Лекция 8. Основные понятия химической кинетики
- •8.1. Химическая реакция
- •8.2. Механизм химической реакции
- •8.3. Исходные, конечные и промежуточные вещества
- •8.4. Глубина превращения реакции
- •8.5. Гомогенные и гетерогенные реакции
- •8.6. Скорость химической реакции
- •8.7. Измерение скорости реакции
- •8.8. Порядок реакции и константа скорости реакции
- •8.9. Молекулярность реакции
- •8.10. Количественные соотношения между скоростью реакции и концентрацией реагента
- •8.11. Реакция второго порядка
- •8.12. Уравнение скорости реакции третьего порядка
- •8.13. Уравнение скорости реакции нулевого порядка
- •8.14. Определение порядка реакции
- •8.15. Теоретические основы химической кинетики
- •8.15.1. Теория активных соударений
- •8.15.2. Теория активированного (переходного) комплекса (переходного состояния)
- •8.15.3. Вывод основного уравнения теории переходного состояния
- •8.15.4. Термодинамическая форма основного уравнения теории переходного состояния
- •8.15.5. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса
- •Лекция 9. Основы кинетики и механизма ферментативных реакций. Гомогенный и гетерогенный катализ
- •9.1. Понятие катализа
- •9.2. Основы теории гомогенного катализа
- •9.3. Основы теории гетерогенного катализа
- •9.4. Ферменты как биологические катализаторы
- •9.5. Кинетика реакций, катализируемых ферментами
- •9.6. Физический смысл величин Km и Vmax
- •9.7. Уравнение Михаэлиса-Ментен и ферментативные механизмы
- •9.8. Общее уравнение скорости
- •Лекция 10. Электрохимия
- •10.1. Введение в электрохимию
- •10.2. Термодинамика электрохимических систем
- •10.3. Электродный потенциал
- •10.4. Двойной электрический слой на границе между металлом и раствором электролита
- •10.5. Зависимость плотности заряда от концентрации электролита
- •Лекция 11.Электродные и безэлектродные электрохимические системы
- •11.1. Правила записи эдс и электродных потенциалов электрохимических систем
- •11.2. Типы электродов
- •11.3. Диффузионный и межжидкостный потенциалы
- •На электродах протекают реакции
- •11.5. Концентрационные цепи
- •Лекция 12. Поверхностные явления и адсорбция
- •12.1. Общая характеристика поверхностных явлений
- •12.2. Поверхностные явления в дисперсных системах
- •12.3. Поверхностное натяжение и природа вещества
- •12.4. Термодинамика поверхностных явлений в однокомпонентных системах
- •12.5. Равновесие фаз при искривленной поверхности раздела. Капиллярность
- •12.6. Уравнение Томсона
- •12.7. Капиллярные явления
- •Лекция 13. Адсорбция
- •13.1. Уравнение адсорбции Гиббса
- •13.2. Обзор сорбционных явлений
- •13.3. Природа адсорбционного взаимодействия
- •13.4. Термическое уравнение адсорбции. Изотерма адсорбции
- •13.5. Мономолекулярная адсорбция и изотерма Ленгмюра
- •Литература
- •Содержание
7.9. Буферные растворы
Буферными растворами называются растворы с устойчивой концентрацией водородных ионов и, следовательно, с определенным значением рН, почти не зависящим от разведения и лишь слабо изменяющимся при прибавлении к раствору небольших количеств сильной кислоты или щелочи.
Такими свойствами обладают растворы, содержащие слабую кислоту или слабое основание совместно с их солью. Рассмотрим для примера раствор, содержащий уксусную кислоту и ацетат натрия. В этом случае процесс диссоциации характеризуется уравнением
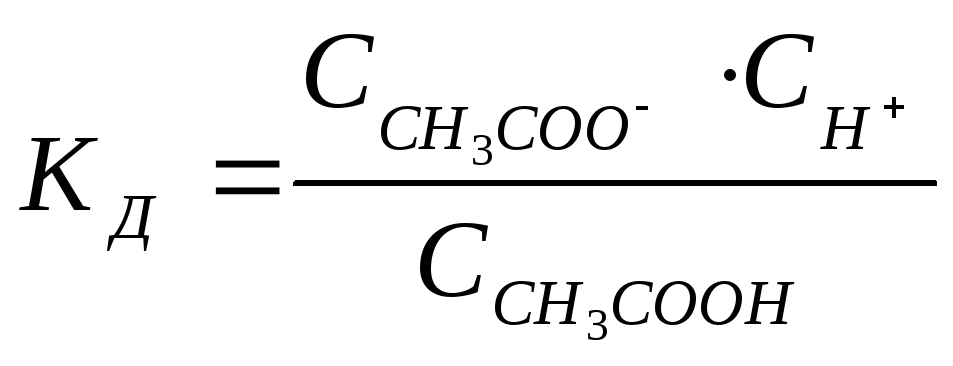 . (7.18)
. (7.18)
Присутствие ацетата практически полностью подавляет диссоциацию самой кислоты. Поэтому можно считать, что концентрация ССН3СООН практически равна исходной концентрации кислотыСк. Концентрация ацетата равна концентрациихСсоли, т.е. произведению концентрации соли на степень ее диссоциации. В результате получим
![]() . (7.19)
. (7.19)
Для разбавленных растворов = 1.
Тогда рН буфера будет:
![]() , (7.20)
, (7.20)
или
![]() , (7.21)
, (7.21)
или
![]() . (7.22)
. (7.22)
Для основных буферов:
![]() (7.23)
(7.23)
Величина рН – буферных растворов зависит:
от показателя константы диссоциации слабой кислоты или слабого основания;
от соотношения компонентов буферного раствора.
рН = рК+1 – зона буферного действия раствора.
В этом интервале значений рН наиболее четко поддерживается активная кислотность среды.
7.10. Механизм действия буферных растворов
При рассмотрении механизма действия буферов необходимо ответить на два вопроса:
Почему рН буферного раствора не меняется при разбавлении?
Почему рН буферного раствора не меняется при добавлении небольших количеств сильных кислот или сильных оснований?
При разведении константы диссоциации слабых кислот или оснований не меняются. Отношение концентраций кислоты и соли также остается постоянным. В результате рН сохраняется.
При добавлении сильной кислоты к буферу Н+-ионы реагируют с солевой компонентой и превращаются в недиссоциированную форму. Концентрация Н+ионов уменьшается, концентрация слабой кислоты увеличивается, степень диссоциации уменьшается, а рН раствора практически не меняется.
При добавлении сильной щелочи ОН-–ионы реагируют с кислотой. Сильное основание заменяется на эквивалентное количество слабого электролита воды. Причины неизменения рН заключаются в превращении сильного основания в слабый электролит.
7.11. Буферная емкость
Буферной емкостью называется количество моль-эквивалентов сильной кислоты или сильного основания, которые можно добавить к 1 л буферного раствора, чтобы рН изменилась на одну единицу.
Буферная система крови. В норме рН крови находится в пределах 7,4 + 0,04. Хотя какой-то вклад в буферные свойства вносит гемоглобин и другие белки, а также фосфаты, все же главным компонентом буферной системы крови служит пара бикарбонат натрия/угольная кислота.
Лекция 8. Основные понятия химической кинетики
8.1. Химическая реакция
Химической реакцией можно считать любое изменение вещества, при котором образуется или разрывается химическая связь между атомами. Химическая реакция характеризуется механизмом ее протекания и глубиной протекания.
8.2. Механизм химической реакции
Химические реакции, как правило, не происходят путем непосредственного взаимодействия исходных молекул с прямым переходом их в молекулы продуктов реакции. В большинстве случаев реакции протекают в несколько стадий. Например, окисление ионов двухвалентного железа в кислом растворе молекулярным кислородом состоит из ряда стадий:
Fe2+ + O2 Fe3+ + O2-
O2- + H+ HO2·
Fe2+ + HO2· Fe3+ + HO2-
HO2- + H+ H2O2
H2O2 + Fe2+ Fe3+ + OH- + OH·
Fe2+ + OH· Fe3+ + OH-
OH- + H+ H2O.
Общее стехиометрическое уравнение реакции:
4Fe2++ 4H++O24Fe3++ 2H2O.
Этот сложный путь оказывается, тем не менее, неизмеримо более выгодным, так как ни на одном из семи этапов не требуется встречи более чем двух частиц и ни на одном из этапов не требуется соударения одноименно заряженных частиц.
Совокупность стадий, из которых складывается химическая реакция, носит название механизма химической реакции.
