
- •П.А. Киселев, с.Б. Бокуть курс лекций по физической химии
- •Введение
- •Лекция 1. Газовые законы
- •1.1. Температура и нулевой закон термодинамики
- •1.2. Законы поведения идеальных газов: уравнение состояния идеального газа
- •1.3. Кинетическое уравнение газов
- •1.4. Уравнение состояния реальных (неидеальных) газов. Уравнение Ван-дер-Ваальса
- •1.5. Закон парциальных давлений Дальтона
- •Лекция 2. Первое начало термодинамики и термохимия
- •2.1. Вводная часть
- •2.2. Некоторые понятия, используемые в термодинамике
- •2.3. Формулировка первого начала термодинамики
- •2.4. Применение первого начала термодинамики к различным процессам
- •2.5. Теплота химической реакции (общие положения)
- •2.6. Закон Гесса
- •2.7. Следствие из закона Гесса
- •Лекция 3. Второе начало термодинамики и его применение
- •3.1. Основной смысл и значение второго закона термодинамики
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировка и математическое выражение второго начала термодинамики
- •3.4. Изменение энтропии изолированной системы
- •3.5. Статистическая природа второго начала термодинамики
- •Лекция 4. Третье начало термодинамики. Расчеты изменения энтропии при различных процессах
- •4.1. Формулировка третьего начала термодинамики
- •4.2. Абсолютные и стандартные значения энтропии
- •4.3. Расчеты изменения энтропии в различных процессах
- •1. Расчеты изменения энтропии при изотермических процессах
- •2. Расчет изменения энтропии в неизотермических процессах
- •3. Расчет изменения энтропии сложного процесса
- •4.4. Расчет изменения энтропии при протекании химического процесса
- •4.5. Критерии направления протекания процессов и достижения равновесных состояний в открытых и закрытых системах. Понятие об энергии Гиббса
- •Лекция 5. Химические реакции как открытые в термодинамическом смысле системы. Направление протекания химических реакций. Равновесные химические реакции
- •5.1. Понятие о химическом потенциале
- •5.2. Экзергонические и эндергонические реакции
- •5.3. Взаимосвязь энтальпийного и энтропийного факторов в качестве критерия самопроизвольного протекания химической реакции
- •5.4. Понятие о равновесии химической реакции. Обратимые и необратимые реакции
- •5.5. Уравнение изотермы химической реакции и вывод закона действующих масс
- •5.6. Зависимость константы химического равновесия от температуры
- •Лекция 6. Химическое равновесие в гетерогенных и гомогенных системах
- •6.1. Взаимосвязь химического потенциала с другими термодинамическими функциями
- •6.2. Летучесть
- •6.3. Идеальный раствор
- •6.4. Фазовая диаграмма содержит зоны, линии и тройную точку
- •6.5. Уравнение Клаузиуса-Клапейрона
- •6.6. Коллигативные свойства растворов
- •6.7. Понижение точки замерзания и повышение точки кипения растворов
- •6.8. Осмотическое давление
- •6.9. Растворы электролитов
- •Лекция 7. Растворы электролитов
- •7.1. Общие сведения о теории электролитической диссоциации
- •7.2. Сильные и слабые электролиты
- •7.3. Закон разведения
- •7.4. Сильные электролиты
- •7.5. Ионная сила
- •7.6. Произведение растворимости
- •7.7. Электролитическая диссоциация воды
- •7.8. Концентрация водородных ионов
- •7.9. Буферные растворы
- •7.10. Механизм действия буферных растворов
- •7.11. Буферная емкость
- •Лекция 8. Основные понятия химической кинетики
- •8.1. Химическая реакция
- •8.2. Механизм химической реакции
- •8.3. Исходные, конечные и промежуточные вещества
- •8.4. Глубина превращения реакции
- •8.5. Гомогенные и гетерогенные реакции
- •8.6. Скорость химической реакции
- •8.7. Измерение скорости реакции
- •8.8. Порядок реакции и константа скорости реакции
- •8.9. Молекулярность реакции
- •8.10. Количественные соотношения между скоростью реакции и концентрацией реагента
- •8.11. Реакция второго порядка
- •8.12. Уравнение скорости реакции третьего порядка
- •8.13. Уравнение скорости реакции нулевого порядка
- •8.14. Определение порядка реакции
- •8.15. Теоретические основы химической кинетики
- •8.15.1. Теория активных соударений
- •8.15.2. Теория активированного (переходного) комплекса (переходного состояния)
- •8.15.3. Вывод основного уравнения теории переходного состояния
- •8.15.4. Термодинамическая форма основного уравнения теории переходного состояния
- •8.15.5. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса
- •Лекция 9. Основы кинетики и механизма ферментативных реакций. Гомогенный и гетерогенный катализ
- •9.1. Понятие катализа
- •9.2. Основы теории гомогенного катализа
- •9.3. Основы теории гетерогенного катализа
- •9.4. Ферменты как биологические катализаторы
- •9.5. Кинетика реакций, катализируемых ферментами
- •9.6. Физический смысл величин Km и Vmax
- •9.7. Уравнение Михаэлиса-Ментен и ферментативные механизмы
- •9.8. Общее уравнение скорости
- •Лекция 10. Электрохимия
- •10.1. Введение в электрохимию
- •10.2. Термодинамика электрохимических систем
- •10.3. Электродный потенциал
- •10.4. Двойной электрический слой на границе между металлом и раствором электролита
- •10.5. Зависимость плотности заряда от концентрации электролита
- •Лекция 11.Электродные и безэлектродные электрохимические системы
- •11.1. Правила записи эдс и электродных потенциалов электрохимических систем
- •11.2. Типы электродов
- •11.3. Диффузионный и межжидкостный потенциалы
- •На электродах протекают реакции
- •11.5. Концентрационные цепи
- •Лекция 12. Поверхностные явления и адсорбция
- •12.1. Общая характеристика поверхностных явлений
- •12.2. Поверхностные явления в дисперсных системах
- •12.3. Поверхностное натяжение и природа вещества
- •12.4. Термодинамика поверхностных явлений в однокомпонентных системах
- •12.5. Равновесие фаз при искривленной поверхности раздела. Капиллярность
- •12.6. Уравнение Томсона
- •12.7. Капиллярные явления
- •Лекция 13. Адсорбция
- •13.1. Уравнение адсорбции Гиббса
- •13.2. Обзор сорбционных явлений
- •13.3. Природа адсорбционного взаимодействия
- •13.4. Термическое уравнение адсорбции. Изотерма адсорбции
- •13.5. Мономолекулярная адсорбция и изотерма Ленгмюра
- •Литература
- •Содержание
5.6. Зависимость константы химического равновесия от температуры
Для установления зависимости константы химического равновесия от температуры рассмотрим состояние равновесия химической реакции при произвольных Т1иТ2. Предположим, чтоНoиSoв интервале температур отТ1доТ2остаются постоянными, тогда константы химического равновесия приТ1иТ2могут быть выражены:
G1o = - RT lnK1 G1o = Нo –T1So;
G2o= -RTlnK2и соответственноG2o=Нo–T2So.
Решим систему приведенных уравнений относительно константы равновесия химической реакции:
![]() (1),
(1),
![]() (2).
(2).
Вычтем из первого уравнения второе:
![]()
или
![]() (5.21)
(5.21)
(интегральная форма уравнения изобары).
Полученная зависимость позволяет определить смещение состояния равновесия при изменении температуры. Предположим, что Ho0 – эндотермическая реакция, тогда при увеличении температуры (Т2Т1) величинаlnK1/K20, что выполняется при условииK1 K2(K1/K21), т.е. равновесие химической реакции смещается в сторону образования продуктов реакции. Уменьшение температуры (Т2Т1) приведет соответственно к смещению равновесия в сторону образования исходных веществ.
При условии, что реакция
– экзотермическая (Ho0),
повышение температуры (Т2
Т1)
определяет
![]() ,
из чего следует, чтоK1K2(K1/K21),
т.е. равновесие экзотермической реакции
при повышении температуры смещается в
сторону образования исходных участников
реакции, и соответственно, понижение
температуры проведения реакции – в
сторону продуктов.
,
из чего следует, чтоK1K2(K1/K21),
т.е. равновесие экзотермической реакции
при повышении температуры смещается в
сторону образования исходных участников
реакции, и соответственно, понижение
температуры проведения реакции – в
сторону продуктов.
Часто для анализа
направления смещения равновесия
химической реакции при изменении
температуры удобно пользоваться
дифференциальной формой уравнения
изобары
![]() .
.
1) H0;
![]()
![]() dT0 –
для экзотермической реакции увеличение
температуры приводит к уменьшению
константы химического равновесия, еслиdT0 уменьшениеtприводит к ростуK(константы химического равновесия);
dT0 –
для экзотермической реакции увеличение
температуры приводит к уменьшению
константы химического равновесия, еслиdT0 уменьшениеtприводит к ростуK(константы химического равновесия);
2) H0;dT0 – для эндотермической реакции увеличение температуры ведет к увеличениюK;
3) Т0 – для экзотермической реакции уменьшениеtведет к уменьшениюКхимического равновесия.
Проведенный анализ зависимостей константы химического равновесия показывает, что смещение системы из состояния равновесия путем внешнего воздействия (изменение температуры, давления, концентрации) приводит к увеличению энергии Гиббса, и самопроизвольно могут протекать те процессы, которые противодействуют возрастанию G, т.е. процессы, связанные с уменьшением энергии Гиббса, что является термодинамическим обоснованием принципа Ле-Шателье.
Принцип смещения равновесия химической реакции, сформулированный Ле-Шателье, а затем Брауном, можно выразить следующим образом: если на систему, находящуюся в устойчивом равновесии, подействовать извне, изменив какое-нибудь из условий, определяющих равновесие, то в системе усилится то из направлений процесса, течение которого ослабляет влияние произведенного воздействия, и положение сместится в том же направлении.
Лекция 6. Химическое равновесие в гетерогенных и гомогенных системах
6.1. Взаимосвязь химического потенциала с другими термодинамическими функциями
С точки зрения термодинамики живые клетки представляют собой открытые системы. Как указывалось ранее, открытой называется система, которая обменивается с внешней средой материей и энергией. Основополагающие термодинамические уравнения, написанные для изолированных и закрытых систем, должны быть в этом случае модифицированы. В них необходимо ввести члены, отражающие изменения массы системы. В этом случае дифференцирование уравнения для термодинамических функций U,НиGбудут иметь следующий вид:
![]() (6.1)
(6.1)
![]() (6.2)
(6.2)
![]() (6.3)
(6.3)
где – химический потенциал,n– число молей соответствующего компонента. Каждому компоненту системы в уравнении соответствует свой членdn. Если в правой части каждого уравнения все переменные, за исключениемn1, будут оставаться постоянными, то мы получим следующий ряд равенств:
![]()
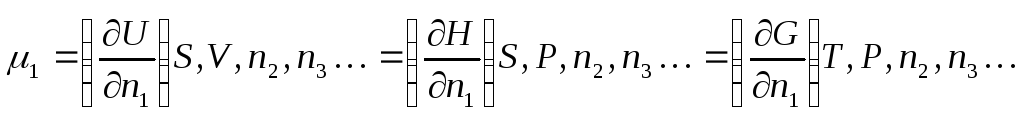
а также из уравнения (6.1)
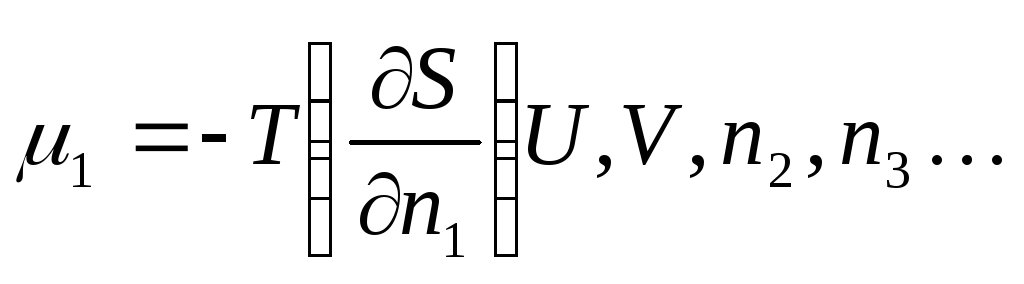
Из приведенных выше уравнений видно, что в зависимости от того, какие величины остаются постоянными, химический потенциал представляет собой парциальную молярную внутреннюю энергию, энтальпию или свободную энергию. Поскольку химические процессы в живых клетках и в большинстве экспериментальных систем in vitroпротекают при постоянной температуре и при постоянном давлении, наиболее полезным является определение химического потенциала как парциальной молярной свободной энергии. При обсуждении свободной энергии Гиббса мы подчеркиваем значение этой величины как критерия равновесия в системах при постоянныхТиР: равновесие достигается приG= 0.
Следовательно, когда свободная энергия перестает в системе меняться, химический потенциал любого компонента системы остается постоянным.
Таким образом, условие равновесия может быть записано как I= 0 приРиТ=const.
Аналогично тому, как мы определяли стандартные изменения для других термодинамических функций и получали стандартные ΔН°,ΔS°и ΔG°, мы можем определить также стандартный химический потенциалμ°как изменение свободной энергии на 1 моль вещества, образующегося, расходующегося или переходящего из одной фазы в другую в своем стандартном состоянии (т.е. при давлении в 1 атм, при определенной температуре и в стандартной эталонной форме).
