
- •П.А. Киселев, с.Б. Бокуть курс лекций по физической химии
- •Введение
- •Лекция 1. Газовые законы
- •1.1. Температура и нулевой закон термодинамики
- •1.2. Законы поведения идеальных газов: уравнение состояния идеального газа
- •1.3. Кинетическое уравнение газов
- •1.4. Уравнение состояния реальных (неидеальных) газов. Уравнение Ван-дер-Ваальса
- •1.5. Закон парциальных давлений Дальтона
- •Лекция 2. Первое начало термодинамики и термохимия
- •2.1. Вводная часть
- •2.2. Некоторые понятия, используемые в термодинамике
- •2.3. Формулировка первого начала термодинамики
- •2.4. Применение первого начала термодинамики к различным процессам
- •2.5. Теплота химической реакции (общие положения)
- •2.6. Закон Гесса
- •2.7. Следствие из закона Гесса
- •Лекция 3. Второе начало термодинамики и его применение
- •3.1. Основной смысл и значение второго закона термодинамики
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировка и математическое выражение второго начала термодинамики
- •3.4. Изменение энтропии изолированной системы
- •3.5. Статистическая природа второго начала термодинамики
- •Лекция 4. Третье начало термодинамики. Расчеты изменения энтропии при различных процессах
- •4.1. Формулировка третьего начала термодинамики
- •4.2. Абсолютные и стандартные значения энтропии
- •4.3. Расчеты изменения энтропии в различных процессах
- •1. Расчеты изменения энтропии при изотермических процессах
- •2. Расчет изменения энтропии в неизотермических процессах
- •3. Расчет изменения энтропии сложного процесса
- •4.4. Расчет изменения энтропии при протекании химического процесса
- •4.5. Критерии направления протекания процессов и достижения равновесных состояний в открытых и закрытых системах. Понятие об энергии Гиббса
- •Лекция 5. Химические реакции как открытые в термодинамическом смысле системы. Направление протекания химических реакций. Равновесные химические реакции
- •5.1. Понятие о химическом потенциале
- •5.2. Экзергонические и эндергонические реакции
- •5.3. Взаимосвязь энтальпийного и энтропийного факторов в качестве критерия самопроизвольного протекания химической реакции
- •5.4. Понятие о равновесии химической реакции. Обратимые и необратимые реакции
- •5.5. Уравнение изотермы химической реакции и вывод закона действующих масс
- •5.6. Зависимость константы химического равновесия от температуры
- •Лекция 6. Химическое равновесие в гетерогенных и гомогенных системах
- •6.1. Взаимосвязь химического потенциала с другими термодинамическими функциями
- •6.2. Летучесть
- •6.3. Идеальный раствор
- •6.4. Фазовая диаграмма содержит зоны, линии и тройную точку
- •6.5. Уравнение Клаузиуса-Клапейрона
- •6.6. Коллигативные свойства растворов
- •6.7. Понижение точки замерзания и повышение точки кипения растворов
- •6.8. Осмотическое давление
- •6.9. Растворы электролитов
- •Лекция 7. Растворы электролитов
- •7.1. Общие сведения о теории электролитической диссоциации
- •7.2. Сильные и слабые электролиты
- •7.3. Закон разведения
- •7.4. Сильные электролиты
- •7.5. Ионная сила
- •7.6. Произведение растворимости
- •7.7. Электролитическая диссоциация воды
- •7.8. Концентрация водородных ионов
- •7.9. Буферные растворы
- •7.10. Механизм действия буферных растворов
- •7.11. Буферная емкость
- •Лекция 8. Основные понятия химической кинетики
- •8.1. Химическая реакция
- •8.2. Механизм химической реакции
- •8.3. Исходные, конечные и промежуточные вещества
- •8.4. Глубина превращения реакции
- •8.5. Гомогенные и гетерогенные реакции
- •8.6. Скорость химической реакции
- •8.7. Измерение скорости реакции
- •8.8. Порядок реакции и константа скорости реакции
- •8.9. Молекулярность реакции
- •8.10. Количественные соотношения между скоростью реакции и концентрацией реагента
- •8.11. Реакция второго порядка
- •8.12. Уравнение скорости реакции третьего порядка
- •8.13. Уравнение скорости реакции нулевого порядка
- •8.14. Определение порядка реакции
- •8.15. Теоретические основы химической кинетики
- •8.15.1. Теория активных соударений
- •8.15.2. Теория активированного (переходного) комплекса (переходного состояния)
- •8.15.3. Вывод основного уравнения теории переходного состояния
- •8.15.4. Термодинамическая форма основного уравнения теории переходного состояния
- •8.15.5. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса
- •Лекция 9. Основы кинетики и механизма ферментативных реакций. Гомогенный и гетерогенный катализ
- •9.1. Понятие катализа
- •9.2. Основы теории гомогенного катализа
- •9.3. Основы теории гетерогенного катализа
- •9.4. Ферменты как биологические катализаторы
- •9.5. Кинетика реакций, катализируемых ферментами
- •9.6. Физический смысл величин Km и Vmax
- •9.7. Уравнение Михаэлиса-Ментен и ферментативные механизмы
- •9.8. Общее уравнение скорости
- •Лекция 10. Электрохимия
- •10.1. Введение в электрохимию
- •10.2. Термодинамика электрохимических систем
- •10.3. Электродный потенциал
- •10.4. Двойной электрический слой на границе между металлом и раствором электролита
- •10.5. Зависимость плотности заряда от концентрации электролита
- •Лекция 11.Электродные и безэлектродные электрохимические системы
- •11.1. Правила записи эдс и электродных потенциалов электрохимических систем
- •11.2. Типы электродов
- •11.3. Диффузионный и межжидкостный потенциалы
- •На электродах протекают реакции
- •11.5. Концентрационные цепи
- •Лекция 12. Поверхностные явления и адсорбция
- •12.1. Общая характеристика поверхностных явлений
- •12.2. Поверхностные явления в дисперсных системах
- •12.3. Поверхностное натяжение и природа вещества
- •12.4. Термодинамика поверхностных явлений в однокомпонентных системах
- •12.5. Равновесие фаз при искривленной поверхности раздела. Капиллярность
- •12.6. Уравнение Томсона
- •12.7. Капиллярные явления
- •Лекция 13. Адсорбция
- •13.1. Уравнение адсорбции Гиббса
- •13.2. Обзор сорбционных явлений
- •13.3. Природа адсорбционного взаимодействия
- •13.4. Термическое уравнение адсорбции. Изотерма адсорбции
- •13.5. Мономолекулярная адсорбция и изотерма Ленгмюра
- •Литература
- •Содержание
13.4. Термическое уравнение адсорбции. Изотерма адсорбции
Для данной пары адсорбент – адсорбат величина адсорбции аилиГопределяется двумя основными термодинамическими параметрами состояния: температуройТи давлениемРдля газообразного состояния адсорбата илиТи концентрациейСпри адсорбции из растворов. Все три величины связаны функциональной зависимостью, называемой термическим уравнением обратимой сорбции:
f= (a,Р,T) = 0 или= (Г,С,Т) = 0. (13.18)
В теории адсорбции особенно часто рассматривают адсорбционное равновесие при условии, что один из параметров, входящих в термическое уравнение, поддерживается постоянным. Например, а =f(P)ТилиГ = (С)Т. Адсорбия, если она выражена не как избыток, а как полное содержание, всегда возрастает с повышением равновесного давления (концентраци). Так как адсорбция – процесс экзотермический, то при повышении температуры величина адсорбции снижается.
Уравнение, связывающее величину адсорбции с температурой при постоянном равновесном давлении а = f(T)Pили постоянной равновесной концентрацииГ = (Т)С,носит название соответственно изобары или изопикны адсорбции. Уравнение видаР=f(Т)а(изостера адсорбции) связывает равновесное давление с температурой при постоянном адсорбированном количестве.
Переход вещества из газовой фазы в адсорбированное состояние в известном смысле аналогичен фазовому переходу пар-жидкость. Поэтому для такого перехода может быть выведена формула, аналогичная формуле Клаузиуса-Клапейрона. Однако в этом случае в формулу входит частная производная давления по температуре при постоянном значении адсорбции (Р/Т)a:
![]() , (13.19)
, (13.19)
где qst– изостерическая теплота адсорбции, которая очень близка к выведенной ранее дифференциальной теплоте.
Для математического описания адсорбции необходимо уравнение, которое связывает зависимость равновесной величины адсорбции от концентрации адсорбата в объемной фазе при различных температурах, а также правильно предсказывает изменение теплоты адсорбции от заполнения адсорбента.
Однако форма изотермы адсорбции на твердых телах зависит от многих параметров: свойств адсорбента и адсорбата, взаимодействия адсорбтив/адсорбат, взаимодействия молекул адсорбата между собой в газовой фазе и в адсорбированном состоянии. В области малых давлений (концентраций) и малых заполнений поверхности взаимодействия между молекулами адсорбата незначительны и зависимость а = f(P)T сводится к простейшей форме, называемой законом Генри:
а = kPили а =kC. (13.20)
Коэффициент пропорциональности k– коэффициент Генри – является мерой интенсивности адсорбции. При больших давлениях (концентрациях) и больших заполнениях адсорбцию часто выражают эмпирическим уравнением Фрейндлиха
![]() , (13.21)
, (13.21)
где х– количество адсорбированного вещества,m– масса адсорбента,иn– константы, характерные для каждой адсорбционной системы. Причем 1/nвсегда правильная дробь (01/n 1). По Г. Фрейндлиху,nне зависит от заполнения, хотя это не вполне точно. Этим уравнением часто пользуются для ориентировочной оценки адсорбции.
13.5. Мономолекулярная адсорбция и изотерма Ленгмюра
Первое теоретическое уравнение изотермы адсорбции было предложено И. Ленгмюром в 1914 году. Теория Ленгмюра основана на трех основных положениях:
Адсорбция происходит на дискретных адсорбционных центрах, которые могут иметь различную природу.
При адсорбции соблюдается строгое стехиометрическое условие –на одном центре адсорбируется одна молекула.
Адсорбционные центры энергетически однородны и независимы, т.е. адсорбция на одном центре не влияет на адсорбцию на других центрах.
На основании этих положений скорость адсорбции Vaдcпропорциональна давлению газа и числу свободных центров. Если общее число центроваm, то при адсорбции, равнойа, число свободных центров равно (аm – а).
Поэтому
Vaдc = kaдc P (am – a). (13.22)
Наряду с адсорбцией идет процесс десорбции:
Vдес.=kдес. а. (13.23)
При равновесии Vaдc =Vдес или
kaдc P (am – a) = kдес. а. (13.24)
Обозначим kдес./kадс.=b, аа/аm=Q, гдеQ–относительное заполнение поверхности, получим:
![]() или
или
![]() . (13.25)
. (13.25)
Это уравнение изотермы адсорбции называется уравнением Ленгмюра. Константа bносит название константы адсорбционного равновесия, или адсорбционного коэффициента.
Константа равновесия связана со стандартными изменениями энергии Гиббса. Если
RTlnb= –Go, так какGo=Ho+TSo,
то
![]() . (13.26)
. (13.26)
Следовательно
![]() . (13.27)
. (13.27)
Таким образом, адсорбционный коэффициент bсвязан со стантартной энтропиейS° и со стандартной теплотой адсорбцииq = –H°.
Очень часто аm называют «емкость монослоя». На рис.13.3 показана кривая, выражающая изотерму адсорбции по Ленгмюру
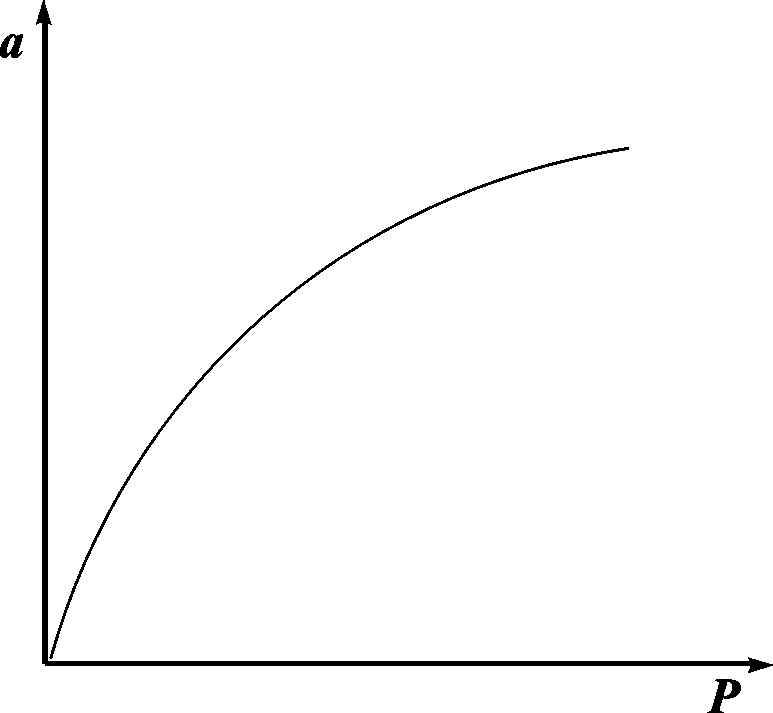
Рис. 13.3. Изотерма адсорбции по Ленгмюру
При очень малых заполнениях и, следовательно, очень малых давлениях Рв знаменателе, согласно (13.25),bр1. Поэтому в этой областиа = аmbp, т.е. переходит в уравнение Генри. При очень высоких давленияхbp1 и а = аm, т.е. величина адсорбции перестает зависеть от давления, поскольку все центры уже заняты.
Для расчета параметров am иbуравнение Ленгмюра представляют в виде
![]() . (13.28)
. (13.28)
Тангенс угла наклона этой линии равен 1/amb, а отрезок, отсекаемый на оси ординат, равен1/am.
Уравнение Ленгмюра, полученное на основании модели локализованной адсорбции газов на поверхности твердого тела, часто хорошо описывает адсорбцию растворенных веществ на поверхности жидкости (поверхность раздела раствор/газ), при которой адсорбция не локализована, так как молекулы подвижны и образуют двумерную газо- или жидкообразную пленку.
Обусловлено это тем, что основные положения модели Ленгмюра соблюдаются при адсорбции из растворов: поверхность жидкости идеально однородна, взаимодействие адсорбированных молекул в адсорбционном слое мало отличается от их взаимодействия в растворе. Оно к тому же ослаблено за счет взаимодействия молекул растворенного вещества с молекулами растворителя и практически не влияет на адсорбцию.
Уравнение Ленгмюра связано с уравнением состояния адсорбционной пленки – уравнением Гиббса. Так,
![]() ,
,
а по уравнению Ленгмюра
![]() ;
;
тогда
![]()
или
![]() . (13.29)
. (13.29)
После интегрирования в пределах от одои от 0 доСполучим:
![]() ,
,
и, наконец,
![]() , (13.30)
, (13.30)
где Гсвязано с площадью, занимаемой 1 моль
адсорбированного вещества в мономолекулярном
слое, следующим соотношением:
![]() .
.
