
- •П.А. Киселев, с.Б. Бокуть курс лекций по физической химии
- •Введение
- •Лекция 1. Газовые законы
- •1.1. Температура и нулевой закон термодинамики
- •1.2. Законы поведения идеальных газов: уравнение состояния идеального газа
- •1.3. Кинетическое уравнение газов
- •1.4. Уравнение состояния реальных (неидеальных) газов. Уравнение Ван-дер-Ваальса
- •1.5. Закон парциальных давлений Дальтона
- •Лекция 2. Первое начало термодинамики и термохимия
- •2.1. Вводная часть
- •2.2. Некоторые понятия, используемые в термодинамике
- •2.3. Формулировка первого начала термодинамики
- •2.4. Применение первого начала термодинамики к различным процессам
- •2.5. Теплота химической реакции (общие положения)
- •2.6. Закон Гесса
- •2.7. Следствие из закона Гесса
- •Лекция 3. Второе начало термодинамики и его применение
- •3.1. Основной смысл и значение второго закона термодинамики
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировка и математическое выражение второго начала термодинамики
- •3.4. Изменение энтропии изолированной системы
- •3.5. Статистическая природа второго начала термодинамики
- •Лекция 4. Третье начало термодинамики. Расчеты изменения энтропии при различных процессах
- •4.1. Формулировка третьего начала термодинамики
- •4.2. Абсолютные и стандартные значения энтропии
- •4.3. Расчеты изменения энтропии в различных процессах
- •1. Расчеты изменения энтропии при изотермических процессах
- •2. Расчет изменения энтропии в неизотермических процессах
- •3. Расчет изменения энтропии сложного процесса
- •4.4. Расчет изменения энтропии при протекании химического процесса
- •4.5. Критерии направления протекания процессов и достижения равновесных состояний в открытых и закрытых системах. Понятие об энергии Гиббса
- •Лекция 5. Химические реакции как открытые в термодинамическом смысле системы. Направление протекания химических реакций. Равновесные химические реакции
- •5.1. Понятие о химическом потенциале
- •5.2. Экзергонические и эндергонические реакции
- •5.3. Взаимосвязь энтальпийного и энтропийного факторов в качестве критерия самопроизвольного протекания химической реакции
- •5.4. Понятие о равновесии химической реакции. Обратимые и необратимые реакции
- •5.5. Уравнение изотермы химической реакции и вывод закона действующих масс
- •5.6. Зависимость константы химического равновесия от температуры
- •Лекция 6. Химическое равновесие в гетерогенных и гомогенных системах
- •6.1. Взаимосвязь химического потенциала с другими термодинамическими функциями
- •6.2. Летучесть
- •6.3. Идеальный раствор
- •6.4. Фазовая диаграмма содержит зоны, линии и тройную точку
- •6.5. Уравнение Клаузиуса-Клапейрона
- •6.6. Коллигативные свойства растворов
- •6.7. Понижение точки замерзания и повышение точки кипения растворов
- •6.8. Осмотическое давление
- •6.9. Растворы электролитов
- •Лекция 7. Растворы электролитов
- •7.1. Общие сведения о теории электролитической диссоциации
- •7.2. Сильные и слабые электролиты
- •7.3. Закон разведения
- •7.4. Сильные электролиты
- •7.5. Ионная сила
- •7.6. Произведение растворимости
- •7.7. Электролитическая диссоциация воды
- •7.8. Концентрация водородных ионов
- •7.9. Буферные растворы
- •7.10. Механизм действия буферных растворов
- •7.11. Буферная емкость
- •Лекция 8. Основные понятия химической кинетики
- •8.1. Химическая реакция
- •8.2. Механизм химической реакции
- •8.3. Исходные, конечные и промежуточные вещества
- •8.4. Глубина превращения реакции
- •8.5. Гомогенные и гетерогенные реакции
- •8.6. Скорость химической реакции
- •8.7. Измерение скорости реакции
- •8.8. Порядок реакции и константа скорости реакции
- •8.9. Молекулярность реакции
- •8.10. Количественные соотношения между скоростью реакции и концентрацией реагента
- •8.11. Реакция второго порядка
- •8.12. Уравнение скорости реакции третьего порядка
- •8.13. Уравнение скорости реакции нулевого порядка
- •8.14. Определение порядка реакции
- •8.15. Теоретические основы химической кинетики
- •8.15.1. Теория активных соударений
- •8.15.2. Теория активированного (переходного) комплекса (переходного состояния)
- •8.15.3. Вывод основного уравнения теории переходного состояния
- •8.15.4. Термодинамическая форма основного уравнения теории переходного состояния
- •8.15.5. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса
- •Лекция 9. Основы кинетики и механизма ферментативных реакций. Гомогенный и гетерогенный катализ
- •9.1. Понятие катализа
- •9.2. Основы теории гомогенного катализа
- •9.3. Основы теории гетерогенного катализа
- •9.4. Ферменты как биологические катализаторы
- •9.5. Кинетика реакций, катализируемых ферментами
- •9.6. Физический смысл величин Km и Vmax
- •9.7. Уравнение Михаэлиса-Ментен и ферментативные механизмы
- •9.8. Общее уравнение скорости
- •Лекция 10. Электрохимия
- •10.1. Введение в электрохимию
- •10.2. Термодинамика электрохимических систем
- •10.3. Электродный потенциал
- •10.4. Двойной электрический слой на границе между металлом и раствором электролита
- •10.5. Зависимость плотности заряда от концентрации электролита
- •Лекция 11.Электродные и безэлектродные электрохимические системы
- •11.1. Правила записи эдс и электродных потенциалов электрохимических систем
- •11.2. Типы электродов
- •11.3. Диффузионный и межжидкостный потенциалы
- •На электродах протекают реакции
- •11.5. Концентрационные цепи
- •Лекция 12. Поверхностные явления и адсорбция
- •12.1. Общая характеристика поверхностных явлений
- •12.2. Поверхностные явления в дисперсных системах
- •12.3. Поверхностное натяжение и природа вещества
- •12.4. Термодинамика поверхностных явлений в однокомпонентных системах
- •12.5. Равновесие фаз при искривленной поверхности раздела. Капиллярность
- •12.6. Уравнение Томсона
- •12.7. Капиллярные явления
- •Лекция 13. Адсорбция
- •13.1. Уравнение адсорбции Гиббса
- •13.2. Обзор сорбционных явлений
- •13.3. Природа адсорбционного взаимодействия
- •13.4. Термическое уравнение адсорбции. Изотерма адсорбции
- •13.5. Мономолекулярная адсорбция и изотерма Ленгмюра
- •Литература
- •Содержание
12.4. Термодинамика поверхностных явлений в однокомпонентных системах
Для однокомпонентной жидкости поверхностное натяжение численно равно работе внешних сил при обратимом изотермическом увеличении площади поверхности на единицу при постоянном объеме (т.е. увеличению энергии ГельмгольцаF). Таким образом,F = . По уравнению Гиббса-Гельмгольца
![]() . (12.3)
. (12.3)
Обозначая полную поверхностную энергию через ,можно переписать уравнение (12.3) для поверхности:
![]() . (12.4)
. (12.4)
При повышении температуры кинетическая энергия движущихся молекул увеличивается, поверхностное натяжение при этом уменьшается. При приближении к критической температуре Ткр. плотности сосуществующих фаз (жидкости и пара) сближаются. При достиженииТкр. граница раздела фаз исчезает и поверхностное натяжение становится равным нулю. Для многих веществ экспериментально показано, что в не очень широком температурном интервале уменьшениес температурой выражается формулой
![]() , (12.5)
, (12.5)
где
– константа, а![]() – поверхностное натяжение при выбранной
начальной температуре. Величинадля разных жидкостей составляет 0,0020,004 К-1.
– поверхностное натяжение при выбранной
начальной температуре. Величинадля разных жидкостей составляет 0,0020,004 К-1.
12.5. Равновесие фаз при искривленной поверхности раздела. Капиллярность
На практике нередко приходится иметь дело с искривленной поверхностью раздела. Например, поверхность капли выпукла, а поверхность жидкости в смачиваемом капилляре вогнута.
Понятно, что молекула жидкости, находящаяся на выпуклой поверхности, будет испытывать равнодействующую силу, направленную в глубь жидкости, меньшую, чем на плоской поверхности. На вогнутой поверхности, наоборот, эта сила больше. Поэтому, если на плоской поверхности давление в обеих сосуществующих фазах одинаково, то на искривленной поверхности в условиях равновесия возникает добавочное давление, направленное в сторону той фазы, по отношению к которой поверхность вогнута. Другими словами, при равновесии давление в фазе, отделенной от другой фазы вогнутой поверхности, больше. Эта разность давлений, возникающая по обе стороны искривленной поверхности жидкости, носит название капиллярного (или лапласова) давления.
Величина капиллярного давления зависит от кривизны поверхности и поверхностного натяжения и выражается уравнением Лапласа.
Рассмотрим элементарный участок искривленной поверхности с площадью
S=l1 l2. (12.6)
Если r1иr2– радиусы кривизны криволинейных отрезковl1иl2, то площадьSравна
S=l1 l2=r1 1r22, (12.7)
где 1и2– соответствующие центральные углы (рис. 12.1).
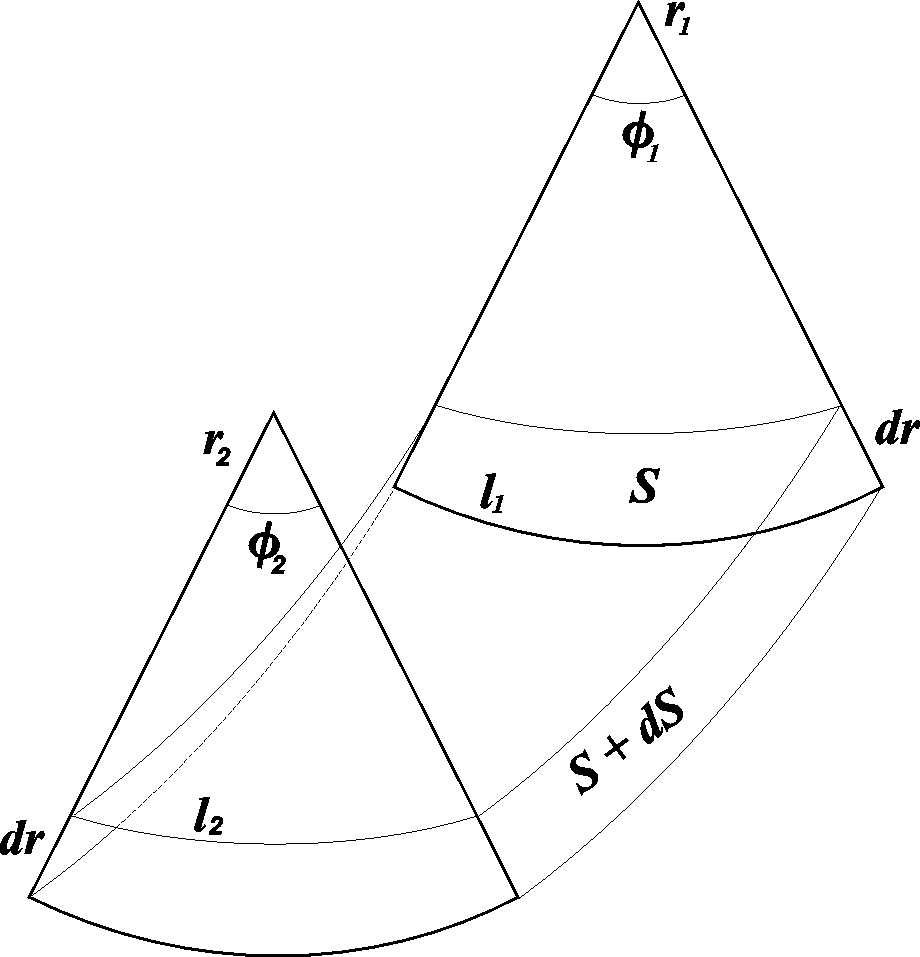
Рис. 12.1. Элементарный участок искривленной поверхности
Если под действием, вызванным разностью давлений Рпо обе стороны поверхности, сама поверхность сместилась на величинуdrбез изменения кривизны, то произошло увеличение этой поверхности на величинуdS. Затраченная работаdWможет быть вычислена двумя способами: работаdWравна произведению силы на путь:
dW=РSdr, (12.8)
но эта же работа dWравна произведению поверхностного натяжения на прирост поверхности:
dW=dS. (12.9)
Поэтому
dS=РSdr =12r1r2Рdr. (12.10)
Найдем dS:
dS=12 (r1+dr)(r2+dr) -12r1r2. (12.11)
После несложных преобразований, пренебрегая членом (dr)2как величиной бесконечно малой второго порядка, получим:
dS=12r1dr-12r2dr. (12.12)
Подставим уравнение (12.12) в уравнение (12.11) и разделим обе части уравнения на r1r212 , получим формулу Лапласа, выражающую избыток давления со стороны вогнутой поверхности:
![]() . (12.13)
. (12.13)
Если поверхность сферическая, то r1 =r2и лапласово давление равно
![]() . (12.14)
. (12.14)
Вследствие существования лапласова давления величина давления насыщенного пара жидкости при данной температуре зависит от формы поверхности.
