
- •2.1. Предмет термодинаміки і термодинамічний метод.
- •2.2. Основні поняття та визначення.
- •3.1. Термодинамічна система:
- •3.2. Термодинамічні процеси та стани: рівноважні й нерівноважні.
- •4.1. Зміст термодинамічного процесу: теплота і робота
- •5.1. Теплота процесу: поняття теплоємності тіла.
- •5.2. Масова, об'ємна й мольна теплоємності
- •5.3. Закон збереження і перетворення енергії
- •5.4. Внутрішня енергія
- •5.5. Перше начало термодинаміки
- •5.6. Ентальпія.
- •6.1. Термічне рівняння стану
- •6.2. Фізичний зміст теплоємностей.
- •7.1. Ентропія
- •7.2. Теплові діаграми.
- •8.1. Внутрішня енергія, ентальпія й ентропія ідеального газу.
- •8.3. Основні властивості газових сумішей
- •8.5 Парціальні тиски
- •9.1. Термодинамічний метод дослідження процесів
- •Ізохорний процес
- •9.3. Ізобарний процес
- •9.4. Ізотермічний процес
- •9.5. Адіабатний процес
- •9.6. Політропні процеси
- •9.7. Політропний процес
- •. Другий закон термодинаміки: його значення й сфера застосування
- •10.2. Формулювання другого начала термодинаміки
- •11.1. Умови роботи теплових машин
- •11.2. Кругові термодинамічні процеси, або цикли
- •11.3. Термодинамічний аналіз кругових процесів: баланс теплоти й роботи в теплових машинах
- •11.4. Термічний к. К. Д. І холодильний коефіцієнт циклів
- •12.1. Прямий оборотний цикл Карно та його термічний ккд
- •12.2. Зворотний оборотний цикл Карно та його холодильний коефіцієнт
- •12.3. Перша теорема Карно
- •12.4. Середньоінтегральна температура підведення (відводу) тепла й еквівалентний цикл Карно.
- •12.5. Узагальнений (регенеративний) цикл Карно
- •12.6. Абсолютна термодинамічна температура
- •13.1. Властивості оборотних і необоротних циклів та математичне вираження другого закону термодинаміки
- •13.2. Зміни ентропії в оборотних і необоротних процесах
- •13.3. Принцип зростання ентропії та фізичний зміст другого закону термодинаміки
- •13.4. Ентропія та статистичний характер другого закону термодинаміки
- •13.5. Третій закон термодинаміки (теорема Нернста)
- •14.1. Максимальна робота й функції стану.
- •14.2. Термодинамічні потенціали.
- •Графічне представлення співвідношень характеристичних функцій
- •Канонічі рівняння стану
- •14.4. Рівняння Гіббса-Гельмгольца
- •14.5. Хімічний потенціал і нерівність Гіббса
- •14.6. Загальні умови рівноваги термодинамічної системи
- •15.1. Властивості реальних газів
- •15.2. Рівняння стану Ван-дер-Ваальса
- •15.3. Аналіз рівняння Ван-дер-Ваальса - закон відповідних станів
- •Фазові переходи й фазові діаграми речовин; рівняння Клапейрона - Клаузіуса
- •16.2. Рівняння Клапейрона - Клаузіуса
- •Одержання пари та її характерні стани
- •Основні параметри станів водяної пари.
5.4. Внутрішня енергія
5.4.1. Під внутрішньою енергією газу розуміється вся енергія, укладена в тілі або системі тел. Цю енергію можна представити у вигляді суми окремих видів енергій: кінетичної енергії молекул, що включає енергію поступального й обертового руху молекул, а також коливального руху атомів у самій молекулі; енергії електронів; внутрішньоядерної енергії; енергії взаємодії між ядром молекули й електронами; потенційній енергії або енергії положення молекул у якому-небудь зовнішнім полі сил; енергії електромагнітного випромінювання. Внутрішня енергія тіла дорівнює
![]()
де Uma — внутрішня кінетична енергія молекул; Ua0T — внутрішня потенційна енергія молекул; U0 — постійна інтегрування.
Внутрішню кінетичну енергію можна розділити на наступні складові:
![]()
де
![]() —
кінетична енергія поступального руху
молекул;
—
кінетична енергія поступального руху
молекул;
![]() — кінетична енергія, обертового руху
молекул;
Ukoл
—
енергія коливального руху ядер атомів
молекули відносно один одного.
— кінетична енергія, обертового руху
молекул;
Ukoл
—
енергія коливального руху ядер атомів
молекули відносно один одного.
Величина
U0
являє
собою нульову енергію або внутрішню
енергію при температурі абсолютного
нуля. Як відомо, при Т
=
0 тепловий рух молекул і атомів, що
входять у молекули, припиняється, але
рух часток усередині атомів триває.
Наприклад, рух електронів в атомах не
є тепловим рухом і має місце при будь-яких
температурах, у тому числі й при Т
=
0. Тому що абсолютне значення внутрішньої
енергії методами термодинаміки визначити
неможливо, те при термодинамічному
аналізі системи доводиться мати справу
не з абсолютними значеннями внутрішньої
енергії, а з її .зміною в результаті
процесів, що відбуваються, тому для
рішення більшості термодинамічних
завдань
![]() значення
не потрібно і її звичайно уважають
рівною нулю.
значення
не потрібно і її звичайно уважають
рівною нулю.
У технічній термодинаміці розглядаються тільки такі процеси, у яких змінюються кінетична й потенційна складові внутрішньої енергії. Тому в поняття внутрішньої енергії будемо надалі включати для ідеальних газів кінетичну енергію руху молекул і енергію коливальних рухів атомів у молекулі, а для реальних газів ще додатково й потенційну складову енергії, пов'язану з наявністю сил взаємодії між молекулами й залежну від відстані між ними.
Відлік внутрішньої енергії при цьому може провадитися від будь-якого умовного нуля. Так, наприклад, для ідеальних газів прийнято вважати внутрішню енергію при t0 — 0° С рівною нулю.
<N B > Ідеальними називають такі гази, в яких відсутні сили взаємного тяжіння й відштовхування між молекулами, а самі молекули розглядаються як матеріальні точки, які не мають ні об'єму, ні маси(тобто їх розміри нехтувано малі у порівнянні з міжмолекулярними відстанями та об'ємом газу).>>
Оскільки кінетична складова внутрішньої енергії цілком визначається температурою тіла, а потенційна її складова при заданій температурі залежить ще й від питомого об'єму (відстані між молекулами), то повна внутрішня енергія буде функцією двох параметрів, і в даному стані тіла буде мати цілком визначену величину.
Такі величини, як було встановлено раніше, називаються параметрами, або функціями, стану. Отже, внутрішня енергія, будучи параметром стану, являє собою одночасно однозначну безперервну й кінцеву функцію стану системи.
Внутрішня енергія є адитивним або екстенсивним параметром, тому що її величина залежить від маси тіла. Внутрішня енергія складної системи, віднесена до 1 кг, дорівнює сумі внутрішніх енергій її окремих складових, тобто
![]()
5.4.2. Із закону збереження енергії випливає, що термодинамічна система в кожному своєму стані може мати тільки одне значення внутрішньої енергії. Якщо припустити, що система в даному стані може мати різні значення внутрішньої енергії, то ми могли б використовувати цю різницю без зміни стану системи. Таке положення суперечить закону збереження енергії. Тому зміна внутрішньої енергії газу не буде залежати від характеру або шляху процесу, повністю визначаючись заданими початковими й кінцевим його станами:
![]()
Це наочно
ілюструється мал. 5-1.
У всіх процесах

зміна внутрішньої енергії буде така ж сама. У кругових процесах зміна внутрішньої енергії дорівнює нулю:
Приріст du, як і будь-якого параметра, є повним диференціалом, Оскільки стан газу цілком визначається основними парамет-рами стану, внутрішню енергію можна представити як функцію будь-яких двох параметрів стану: |
|
![]()
або повні диференціали внутрішньої енергії:

Внутрішня
енергія ідеального газу, у якому
відсутньої сили взаємодії між молекулами,
не залежить від об'єму або тиску а
залежить тільки від
температури,
тому
![]()
Отже, похідна від внутрішньої енергії ідеального газу по температурі є повна похідна:
![]() (5-7)
(5-7)
5.4.3. Це
положення було доведено Джоулем, що
виконав 1845 р. наступний дослід. У
калориметр із водою містилися дві
посудини, з'єднані між собою трубкою із
краном (мал.
5-2).
У першій посудині перебувало повітря
під тиском. Із другої посудини повітря
було видалене. Температура всієї
установки визначалася декількома
термометрами.
Після того як температура в калориметрі тривалий час залишалася постійною і рівною температурі повітря в приміщенні, кран між посудинами відкривався, і частина повітря з першої посудини потрапляла в другий.
При перевірці температури в калориметрі виявилося, що вона залишилася незмінної, отже, у досліді теплота не поглиналася й не виділялася (Q = 0). Зовнішня робота L повітря при перетіканні в посудину із жорсткими стінками за умови, що там був вакуум, також не відбувалася (L = 0).
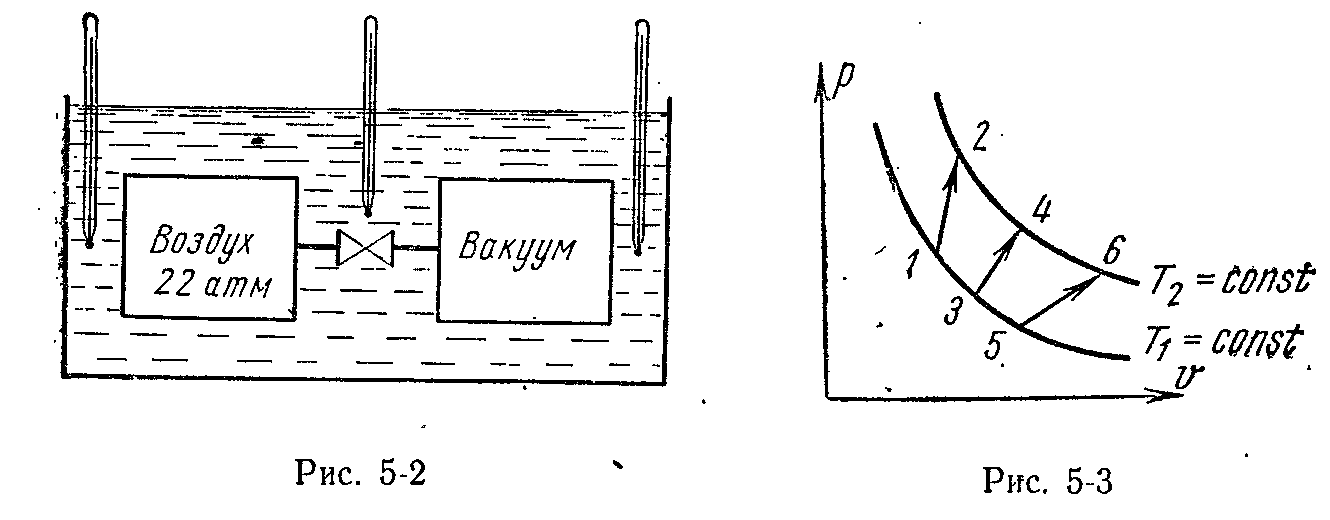
За таких умов внутрішня енергія повітря також повинна була залишитися незмінною. Оскілки в умовах досліду незмінними залишалися тільки температура й внутрішня енергія, Джоуль зробив висновок, що внутрішня енергія газу залежить тільки від температури: u = f(T).
Це положення в точності справедливо тільки для ідеальних газів.
Висновки Джоуля можуть бути віднесені із припустимою для практики погрішністю й до реальних газів, якщо вони перебувають при високих температурах і малих тисках. Тому для наближених розрахунків можна вважати, що внутрішня енергія реальних газів при зазначених умовах є функцією тільки однієї температури.
Якщо на
рv-діаграмі
(рис.5-3)
між ізотермами
Т1
і
Т2
зобразити ряд довільних процесів 1-2,
3-4, 5-6,
які мають різні початкові й кінцеві
об'єми й тиски, то зміна внутрішньої
енергії ідеального газу у всіх цих
процесів буде однаковим, тобто
![]()
![]()

