
- •2.1. Предмет термодинаміки і термодинамічний метод.
- •2.2. Основні поняття та визначення.
- •3.1. Термодинамічна система:
- •3.2. Термодинамічні процеси та стани: рівноважні й нерівноважні.
- •4.1. Зміст термодинамічного процесу: теплота і робота
- •5.1. Теплота процесу: поняття теплоємності тіла.
- •5.2. Масова, об'ємна й мольна теплоємності
- •5.3. Закон збереження і перетворення енергії
- •5.4. Внутрішня енергія
- •5.5. Перше начало термодинаміки
- •5.6. Ентальпія.
- •6.1. Термічне рівняння стану
- •6.2. Фізичний зміст теплоємностей.
- •7.1. Ентропія
- •7.2. Теплові діаграми.
- •8.1. Внутрішня енергія, ентальпія й ентропія ідеального газу.
- •8.3. Основні властивості газових сумішей
- •8.5 Парціальні тиски
- •9.1. Термодинамічний метод дослідження процесів
- •Ізохорний процес
- •9.3. Ізобарний процес
- •9.4. Ізотермічний процес
- •9.5. Адіабатний процес
- •9.6. Політропні процеси
- •9.7. Політропний процес
- •. Другий закон термодинаміки: його значення й сфера застосування
- •10.2. Формулювання другого начала термодинаміки
- •11.1. Умови роботи теплових машин
- •11.2. Кругові термодинамічні процеси, або цикли
- •11.3. Термодинамічний аналіз кругових процесів: баланс теплоти й роботи в теплових машинах
- •11.4. Термічний к. К. Д. І холодильний коефіцієнт циклів
- •12.1. Прямий оборотний цикл Карно та його термічний ккд
- •12.2. Зворотний оборотний цикл Карно та його холодильний коефіцієнт
- •12.3. Перша теорема Карно
- •12.4. Середньоінтегральна температура підведення (відводу) тепла й еквівалентний цикл Карно.
- •12.5. Узагальнений (регенеративний) цикл Карно
- •12.6. Абсолютна термодинамічна температура
- •13.1. Властивості оборотних і необоротних циклів та математичне вираження другого закону термодинаміки
- •13.2. Зміни ентропії в оборотних і необоротних процесах
- •13.3. Принцип зростання ентропії та фізичний зміст другого закону термодинаміки
- •13.4. Ентропія та статистичний характер другого закону термодинаміки
- •13.5. Третій закон термодинаміки (теорема Нернста)
- •14.1. Максимальна робота й функції стану.
- •14.2. Термодинамічні потенціали.
- •Графічне представлення співвідношень характеристичних функцій
- •Канонічі рівняння стану
- •14.4. Рівняння Гіббса-Гельмгольца
- •14.5. Хімічний потенціал і нерівність Гіббса
- •14.6. Загальні умови рівноваги термодинамічної системи
- •15.1. Властивості реальних газів
- •15.2. Рівняння стану Ван-дер-Ваальса
- •15.3. Аналіз рівняння Ван-дер-Ваальса - закон відповідних станів
- •Фазові переходи й фазові діаграми речовин; рівняння Клапейрона - Клаузіуса
- •16.2. Рівняння Клапейрона - Клаузіуса
- •Одержання пари та її характерні стани
- •Основні параметри станів водяної пари.
Ізохорний процес
Процес, що протікає при постійному об'ємі, називають ізохорним (dv = 0, або v = const).
Подібний процес може здійснюватися робочим тілом (газом), що перебуває в циліндрі (мал. 7-1, а), при нерухомому поршні, якщо до робочого тіла підводиться теплота від джерела теплоти I або відводиться теплота до холодильника ІІ.
Рівняння ізохорного процесу може бути отримано, якщо в рівнянні стану ідеального газу pv = RT прийняти v = const. Тоді
![]()
На мал. 7-1,а представлений графік процесу. Крива процесу називається изохорой.
При постійному об'ємі тиск газу змінюється прямо пропорційно абсолютним температурам:
![]() (7-1)
(7-1)

Рис. 7-1
Зовнішня робота газу при v = const дорівнює нулю, тому що dv = 0. Отже,
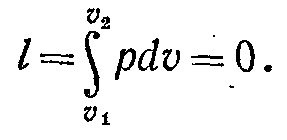
Корисна зовнішня робота (що є у розпорядженні) l', яка може бути передана зовнішньому об'єкту роботи, дорівнює

З отриманого вираження видно, що корисна зовнішня робота l' в ізохорному процесі дорівнює роботі проштовхування l' = p1 v – p2 v .
Наприклад, проштовхування нестисливої рідини по каналу від одного перетину до іншого.
Основне рівняння першого закону термодинаміки (5-9) при dl = 0 приймає вигляд
![]() (
7-1)
(
7-1)
Кількість теплоти, що бере участь у процесі при постійній теплоємності, дорівнює
 (7-2)
(7-2)
Таким чином, при ізохорному процесі вся теплота, що підводиться або відводиться від робочого тіла, витрачається тільки на зміну внутрішньої енергії, як це й показано на схемі (мал. 7-1, б).
При змінній теплоємності в процесі 1-2

Якщо процес 1-2 здійснюється зі збільшенням тиску, теплота в ньому підводиться, при цьому збільшуються внутрішня енергія й температура газу. Якщо тиск у процесі знижується, то теплота відводиться, зменшуються внутрішня енергія й температура газу (мал. 7-1).
Зміну ентропії в оборотному ізохорному процесі визначаємо з рівняння (6-42):
![]() (7-3)
(7-3)
але при V = const ln v2/v1 = 0, тому зміна ентропії при постійній теплоємності дорівнює
 (7-4)
(7-4)
Як видно з даного рівняння, ізохора на Ts-діаграмі являє собою логарифмічну криву 1-2 і протікає так, що при збільшенні ентропії збільшується й температура (мал. 7-2,а).
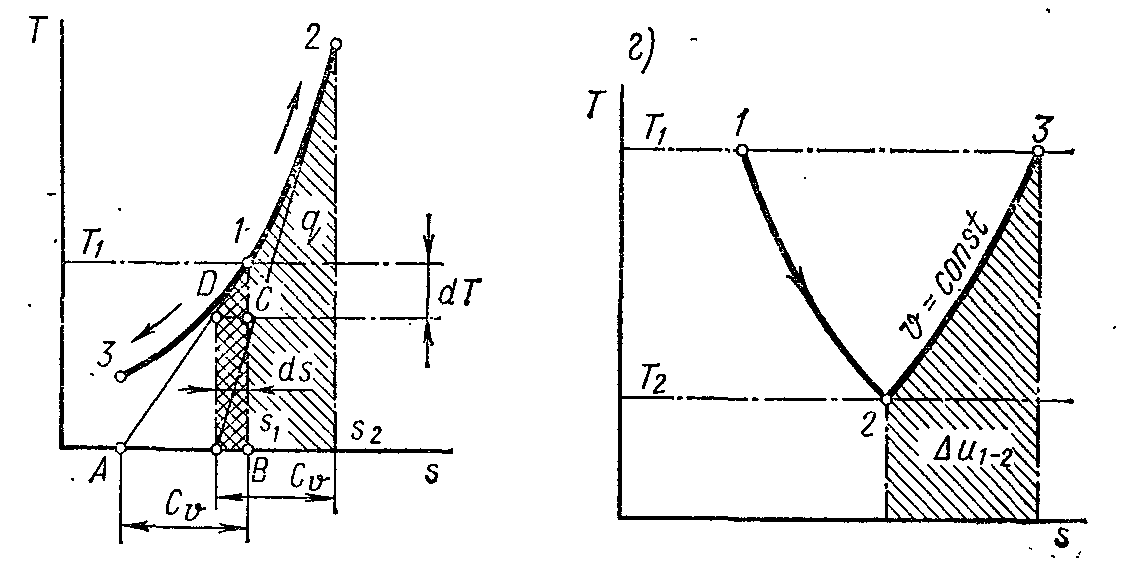
Рис.7-2 , а – б
Зображення термодинамічного процесу в sТ-діаграмі має ряд зручностей.
Елементарна площа (на мал. 7-2,а заштрихована кліткою), побудована на абсцисі ds при температурі T1, визначається добутком T1ds і в масштабі показує елементарний теплообмін із зовнішнім середовищем; тобто площа під процесом 1-2 або 1-3 на sТ-діаграмі дає в масштабі кількість підведеної (при збільшенні s) або відведеної (при зменшенні s) теплоти.
Відповідно до вираження (7-2) ця ж площа в даному процесі v = сonst показує також зміну внутрішньої енергії робочого тіла.
Крім того, якщо в точці 1 ізохорного процесу (мал. 7-2, а) провести дотичну 1А, то піддотична АВ у певному масштабі для цього процесу являє собою сv. Дійсно, відклавши від точки 1 відрізок 1С, що відповідає елементарній зміні температури dТ, і провівши горизонталь CD до перетинання з дотичною 1A, можна одержати трикутник D1C, подібний до трикутника А1В. З подоби трикутників
АВ/DC = 1В/1С.
Оскільки 1В = Т\ 1С = dТ\ DC = ds, то AB·dT = T·ds = dq.
Зіставлення отриманого співвідношення з вираженням (7-1) показує, що АВ = сv , що й потрібно було довести. Таким чином, піддотична до кривої 1-2 у будь-якій її точці дає значення істинної теплоємності сv.
Отже, ізохорні процеси газів з більшою теплоємністю відповідно до співвідношення (7-4) зображуються на sТ-діаграмі більш пологими кривими (наприклад, трьохатомних газів у порівнянні із двохатомними газами).
Ізохори різних об'ємів є еквідистантними кривими, що мають при одній і тій же температурі однакові кутові коефіцієнти.
Ізохори, побудовані для різних об'ємів, зміщені одна щодо іншої на відстань, яка визначається рівнянням (7-3) при Т = const (див. мал. 7-3):
![]()
Чим більше об'єм газу, тим далі знаходиться ізохора від осі ординат.

Рис. 7-3
Оскільки в усіх термодинамічних процесах ідеальних газів, що протікають у тому самому інтервалі температур, внутрішня енергія змінюється на те саме значення, то площа під ізохорним процесом на sТ-діаграмі дає в інтервалі температур Т2 - T1 зміну внутрішньої енергії в будь-якому іншому термодинамічному процесі, що протікає в цьому ж інтервалі температур. Так, наприклад, якщо в інтервалі температур від Т1 до Т2 протікає довільний оборотний процес, показаний кривою 1-2 на рис.7-3,б, для визначення зміни внутрішньої енергії ∆u1-2 у цьому процесі достатньо провести криву ізохорного процесу 2-3 того ж робочого тіла й у тім же інтервалі температур і виміряти під цим процесом площу (на мал. 7-3,б заштрихована).
