
- •2.1. Предмет термодинаміки і термодинамічний метод.
- •2.2. Основні поняття та визначення.
- •3.1. Термодинамічна система:
- •3.2. Термодинамічні процеси та стани: рівноважні й нерівноважні.
- •4.1. Зміст термодинамічного процесу: теплота і робота
- •5.1. Теплота процесу: поняття теплоємності тіла.
- •5.2. Масова, об'ємна й мольна теплоємності
- •5.3. Закон збереження і перетворення енергії
- •5.4. Внутрішня енергія
- •5.5. Перше начало термодинаміки
- •5.6. Ентальпія.
- •6.1. Термічне рівняння стану
- •6.2. Фізичний зміст теплоємностей.
- •7.1. Ентропія
- •7.2. Теплові діаграми.
- •8.1. Внутрішня енергія, ентальпія й ентропія ідеального газу.
- •8.3. Основні властивості газових сумішей
- •8.5 Парціальні тиски
- •9.1. Термодинамічний метод дослідження процесів
- •Ізохорний процес
- •9.3. Ізобарний процес
- •9.4. Ізотермічний процес
- •9.5. Адіабатний процес
- •9.6. Політропні процеси
- •9.7. Політропний процес
- •. Другий закон термодинаміки: його значення й сфера застосування
- •10.2. Формулювання другого начала термодинаміки
- •11.1. Умови роботи теплових машин
- •11.2. Кругові термодинамічні процеси, або цикли
- •11.3. Термодинамічний аналіз кругових процесів: баланс теплоти й роботи в теплових машинах
- •11.4. Термічний к. К. Д. І холодильний коефіцієнт циклів
- •12.1. Прямий оборотний цикл Карно та його термічний ккд
- •12.2. Зворотний оборотний цикл Карно та його холодильний коефіцієнт
- •12.3. Перша теорема Карно
- •12.4. Середньоінтегральна температура підведення (відводу) тепла й еквівалентний цикл Карно.
- •12.5. Узагальнений (регенеративний) цикл Карно
- •12.6. Абсолютна термодинамічна температура
- •13.1. Властивості оборотних і необоротних циклів та математичне вираження другого закону термодинаміки
- •13.2. Зміни ентропії в оборотних і необоротних процесах
- •13.3. Принцип зростання ентропії та фізичний зміст другого закону термодинаміки
- •13.4. Ентропія та статистичний характер другого закону термодинаміки
- •13.5. Третій закон термодинаміки (теорема Нернста)
- •14.1. Максимальна робота й функції стану.
- •14.2. Термодинамічні потенціали.
- •Графічне представлення співвідношень характеристичних функцій
- •Канонічі рівняння стану
- •14.4. Рівняння Гіббса-Гельмгольца
- •14.5. Хімічний потенціал і нерівність Гіббса
- •14.6. Загальні умови рівноваги термодинамічної системи
- •15.1. Властивості реальних газів
- •15.2. Рівняння стану Ван-дер-Ваальса
- •15.3. Аналіз рівняння Ван-дер-Ваальса - закон відповідних станів
- •Фазові переходи й фазові діаграми речовин; рівняння Клапейрона - Клаузіуса
- •16.2. Рівняння Клапейрона - Клаузіуса
- •Одержання пари та її характерні стани
- •Основні параметри станів водяної пари.
Графічне представлення співвідношень характеристичних функцій

Канонічі рівняння стану
Потенціал |
Природні змінні |
Фундаментальне рівняння |
Співвідношення Максвелла |
|
S, V |
|
|
І
|
S, p |
|
|
F
|
V, T |
|
|
Ф
|
p, T |
|
|
Властивості характеристичних функцій
функціями функціями функціямфункціяфункціями Теплотехника
ФункціїФункції, що описують будь-які термодинамічні властивості, називаються характеристичними функціями або термодинамічними потенціалами системи. Найбільш важливими характеристичними функціями є:
Ентальпія
I = I (S, p),
внутрішня енергія
U = U (S, v),
ізохорно-ізотермічний потенціал, або вільна енергія,
F = F (T, v),
ізобарно-ізотермічний потенціал, або вільна ентальпія,
Z = Z (T, p).
До основних властивостей характеристичних функцій належать наступні.
1. Термодинамічні потенціали відрізняються від інших функцій тим, що мають більше просту структуру й певне фізичне значення.
2. Параметри стану системи дорівнюють частинним похідним від термодинамічного потенціалу, узятим по тим же параметрам.
3. У результаті диференціювання термодинамічного потенціалу утворюється повний диференціал даної функції.
4. Використовуючи характеристичні функції, записані в диференціальному вигляді, можна одержати будь-які термодинамічні параметри системи.
5. Термодинамічний потенціал всієї системи складається зі значень потенціалу її частин, тобто має властивість адитивності.
6. Характеристичні функції встановлюють залежність між різними термодинамічними властивостями речовини. Так, наприклад, перші похідні від потенціалу характеризують термічні властивості (тобто величини, вимірювані безпосередньо приладами - об'єм, температура, тиск), а другі похідні відповідають калоричним властивостям системи (це величини, виражені в одиницях теплоти - теплоємність, ентропія, ентальпія, внутрішня енергія).
"Теплотехника"
7. Частинні похідні характеристичних функцій дозволяють складати рівняння теплоємностей Cv і Cp, рівняння стану й інші термодинамічні залежності.
8. Функція є характеристичною тільки при певних параметрах. При виборі інших змінних вона втрачає свої властивості, тому що в такому випадку частинні похідні не виражають термодинамічні властивості системи.
14.4. Рівняння Гіббса-Гельмгольца
Замінивши у вираженнях для F і Ф ентропію S відповідно до рівнянь ( 3-20) через — (д F /дТ)V і — (дФ/дТ)p , одержимо
![]() ( 3-22)
( 3-22)
Рівняння (3.22) називаються рівняннями Гіббса-Гельмгольца. За допомогою цих рівнянь по відомих вираженнях для F і Ф можна знайти внутрішню енергію та ентальпію тіла, або, навпаки, за відомим значенням U або Т визначити F або Ф.
Оскільки

то рівняння Гіббса - Гельмгольца можна записати ще й так:
![]()
Проінтегрував кожне із цих рівнянь по Т, одержимо
 (
3-23)
(
3-23)
Рівняння (3.23), що отримуються шляхом інтегрування рівнянь Гіббса-Гельмгольца, дозволяють за відомим значенням U і І обчислити F і Ф. Довільні функції ψ1 і ψ2 можуть бути визначені різними способами, зокрема, зіставленням отриманих співвідношень для F і Ф с їхніми вираженнями для ідеального газу.
Доречно вказати ще на одну форму рівнянь Гіббса-Гельмгольца, що робить більше ясним зв'язок між виконаною роботою й поглиненою теплотою в процесах V = const, Т = const і р = const.
Оскільки при постійних V і Т ∆F = — L'T,Vmax і ∆U = QV, а при постійних р і Т ∆Ф = — L'T,pmax і ∆I = Qp те, написавши рівняння Гіббса— Гельмгольца при зазначених умовах для двох прилеглих станів і віднявши їх друг із друга, одержимо
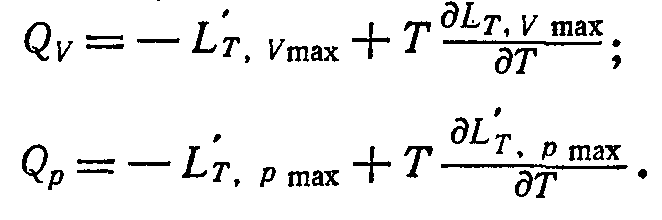
Ці рівняння називають рівняннями максимальної роботи Гіббса— Гельмгольца при незмінних Т, V і Т, р відповідно.



 =
=


 =
=


 =
=

 =
=
