
- •Учебно-методические разработки для самостоятельной работы студентов по курсу «Теоретические основы защиты окружающей среды»
- •Часть II
- •Специальные методы очистки сточных вод и основные методы сепарации твердых отходов
- •Введение
- •Глава 1. Химические методы очистки сточных вод
- •1.1 Нейтрализация
- •1.1.1. Нейтрализация смешиванием
- •1.1.2. Нейтрализация добавлением реагентов
- •1.1.3. Нейтрализация фильтрованием кислых вод через нейтрализующие материалы
- •1.2. Нейтрализация кислыми газами
- •1.2.1. Окисление и восстановление
- •1.2.2. Окисление пероксидом водорода
- •1.2.3. Окисление кислородом воздуха
- •1.2.4. Озонирование
- •Контрольные вопросы
- •Глава 2. Явление осмоса и его использование при очистке сточных вод
- •2.1. Осмотическое давление
- •2.2. Биологическая роль осмотического давления
- •2.3. Законы осмотического давления
- •2.4. Термодинамика осмотического давления
- •Контрольные вопросы
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси
- •3.1. Явления электролиза, поляризации и перенапряжения
- •3.1.1 Электролиз
- •3.1.2. Кривая напряжения
- •3.1.3. Электродвижущие силы разложения
- •3.1.4. Потенциал разложения
- •3.1.5. Концентрационная поляризация
- •3.1.6. Деполяризация
- •3.1.7. Перенапряжение
- •3.2. Электрокапиллярные явления
- •3.2.1. Зависимость поверхностного напряжения от заряда
- •3.2.2. Влияние адсорбции на электрокапиллярную кривую
- •3.2.3. Проблема абсолютных потенциалов
- •3.3. Электрокинетические явления
- •3.3.1. Диффузионный двойной слой и электрокинетический потенциал
- •3.3.2. Емкость двойного слоя
- •3.3.3. Электроосмос
- •3.3.4. Потенциал течения
- •3.3.5. Электрофорез
- •3.3.6. Потенциалы осаждения
- •3.4. Электрохимические методы очистки сточных вод
- •3.4.1. Анодное окисление и катодное восстановление
- •3.4.2. Электрокоагуляция
- •3.4.3. Электрофлотация
- •3.4.4. Электродиализ
- •Контрольные вопросы
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов
- •4.1. Процессы измельчения и дробления
- •4.1.1. Назначение операций дробления и измельчения
- •4.1.2. Степень дробления и измельчения
- •4.1.3. Стадиональность и схемы дробления и измельчения
- •4.1.4. Удельная поверхность диспергированного материала
- •4.1.5. Современные представления о разрушении твердого материала
- •4.1.6. Механические свойства твердых тел при простых видах деформации
- •4.1.7. Законы дробления
- •4.1.8. Способы дробления, классификация машин для дробления и измельчения
- •4.2. Процесс грохочения
- •4.2.1. Основные понятия и назначение грохочения
- •4.2.2. Просеивающая поверхность
- •4.2.3. Способы определения гранулометрического состава
- •4.2.4. Ситовый анализ
- •4.2.5. Характеристики крупности
- •4.2.6. Аналитическое представление характеристик крупности
- •4.2.7. Дифференциальные функции распределения по крупности
- •4.2.8. Вычисление поверхности и числа частиц по уравнениям суммарной характеристики крупности
- •4.2.9. Эффективность процесса грохочения
- •4.2.10. «Легкие», «трудные» и «затрудняющие» частицы
- •4.2.11. Вероятность прохождения частиц через отверстия сита
- •4.2.12. Факторы, влияющие на процесс грохочения
- •4.3. Электромагнитная сепарация. Физические основы процесса
- •4.4. Электростатическая сепарация. Физические основы процесса
- •4.5. Электродинамическая сепарация
- •4.6. Сепарация твердых материалов по коэффициенту трения
- •4.7. Сепарация на основе явления смачиваемости
- •4.8. Аэросепарация
- •4.9. Составление балансной схемы переработанного твердого сырья
- •4.9.1. Баланс материалов при переработке твердых отходов
- •4.9.2. Технологические и технико-экономические показатели переработки твердых отходов
- •Контрольные вопросы
- •Варианты домашнего задания по курсу «Теоретические основы защиты окружающей среды»
- •1. Отстаивание, сгущение, осветление.
- •2. Флотация
- •3. Экстракция
- •4. Дробление и грохочение
- •5. Измельчение и классификация
- •6. Магнитное и электрическое разделение
- •Примеры выполнения домашних заданий
- •Темы заданий для курсовых работ по курсу «Теоретические основы защиты окружающей среды»
- •Пример выполнения курсовой работы
- •Литература
- •Оглавление
- •Глава 1. Химические методы очистки сточных вод 6
- •Глава 2. Явление осмоса и его использование при очистке сточных вод 20
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси 31
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов 73
Контрольные вопросы
1. Какие основные методы очистки сточных вод применяются в настоящее время?
2. Какие типы процессов можно выделить при описании процесса нейтрализации сточных вод?
3. Как и где применяется процесс нейтрализации смешиванием?
4. Как и где применяется процесс нейтрализации с добавлением реагентов?
5. Как и где применяется процесс нейтрализации кислых вод через нейтрализующие материалы?
6. Как и где применяется процесс нейтрализации кислыми газами?
7. Как и где применяются процессы окисления и восстановления при очистке сточных вод?
8. В чем заключается особенность окисления сточных вод пероксидом водорода?
9. В чем заключается особенность окисления сточных вод кислородом воздуха?
10. В чем заключается особенность очистки сточных вод методом озонирования?
Глава 2. Явление осмоса и его использование при очистке сточных вод
2.1. Осмотическое давление
Ряд животных и растительных тканей (например, кожа, свиной пузырь, пергамент) обладает свойством свободно пропускать воду и задерживать растворенные в ней вещества. Такие полупроницаемые перегородки можно изготавливать и искусственным путем, например, из коллоидных пленок, целлофана.
Если раствор отделен от чистого растворителя полупроницаемой перегородкой, то растворитель просачивается через нее в раствор. Это явление называется осмосом.
Гидростатическое давление, которое нужно приложить к раствору, чтобы задержать осмос, называется осмотическим давлением раствора. Оно наблюдается также на границе двух растворов разной концентрации, разделенных полупроницаемой перегородкой. В этом случае растворитель течет от более разбавленного раствора к более концентрированному, т.е. в направлении уравнивания их концентраций.
Можно непосредственно наблюдать осмос и измерять осмотическое давление в осмометре, простейшая форма которого изображена на рис.2.1.
Принцип работы осмометра следующий. Сосуд А наполнен раствором и закрыт внизу полупроницаемой перегородкой, например свиным пузырем. Если его опустить в сосуд В с чистым растворителем (или с менее концентрированным раствором), то растворитель проникает вследствие осмоса в сосуд А и уровень жидкости в нем поднимается до тех пор, пока избыточный столб жидкости высотой h не уравновесит осмотического давления.
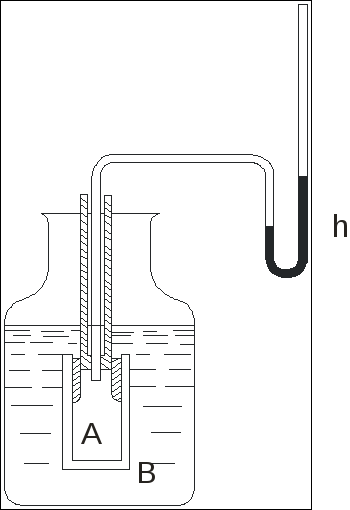
Рис.2.1. Принципиальная схема осмометра
Пленки из некоторых нерастворимых солей образуют отличные полупроницаемые перегородки, особенно для водных растворов веществ с высоким молекулярным весом, как тростниковый сахар, с которым было сделано очень много измерений. Наилучшими являются пленки из железистоцианистой меди, примененные в исследованиях Пфефера.
Следует подчеркнуть, что осмотическое давление возникает лишь на границе между раствором и растворителем (или раствором другой концентрации), если эта граница образована полупроницаемой перегородкой. Раствор, налитый в обыкновенный сосуд, не оказывает на его стенки никакого иного давления, кроме обычного гидростатического. Поэтому правильнее рассматривать осмотическое давление не как свойство растворенного вещества, или растворителя, или даже самого раствора, а как свойство системы из растворителя и раствора с полупроницаемой перегородкой между ними. Величина осмотического давления раствора изменяется в зависимости от концентрации второго граничащего с ним раствора. Наибольшее значение ее, получаемое на границе с чистым растворителем, и есть то, что обычно называют осмотическим давлением данного раствора.
В известной степени аналогом осмометра является прибор Рамзая, примененный им в ряде исследований для измерения парциального давления водорода в газовой смеси. Изготовленный из палладиевой жести и наполненный смесью водорода и азота под атмосферным давлением, прибор Рамзая работает на следующем принципе. Палладиевая жесть, нагретая выше 300 °С, служит отличной полупроницаемой перегородкой, свободно пропускающей водород и задерживающей остальные газы. Парциальное давление водорода в нем меньше 1 атм. на величину парциального давления азота. Если прибор опустить в чистый водород с давлением 1 атм., то последний будет диффундировать в сосуд до тех пор, пока парциальное давление водорода внутри сосуда также не станет равным 1 атм. Манометр, очевидно, покажет приращение давления, равное парциальному давлению азота. Если рассматривать водород как растворитель, а азот как растворенное вещество, то будет наблюдаться довольно большое сходство с тем, что происходит в осмометре, наполненном раствором и погруженном в растворитель.
Руководствуясь подобными аналогиями, Вант-Гофф и Нернст природу осмотического давления объяснили односторонними ударами растворенных частиц о полупроницаемую перегородку, вызывающими ее перемещение в сторону растворителя, если она способна двигаться, и, наоборот, течение растворителя в раствор, если она закреплена неподвижно. Такое объяснение сути осмотического давления было до недавнего времени очень распространенным. В действительности это неверно. В опыте Рамзая ничего не изменится от удаления азота из сосуда, и азот не играет никакой роли в перемещении водорода. Последнее объясняется тем, что число ударов молекул водорода о полупроницаемую стенку больше с той стороны, где его парциальное давление выше, и поэтому больше водорода переходит через эту стенку в направлении от большего давления к меньшему, чем обратно. Сходным образом осмос можно приписать тому, что концентрация молекул растворителя и число их встреч с полупроницаемой перегородкой больше в чистом растворителе, чем в растворе, и это вызывает течение первого в последний.
До сих пор нет вполне достоверной и общепризнанной кинетической теории осмотического давления, что связано с отсутствием такой же теории для растворов вообще. Это не мешает тому, что осмотическое давление может быть связано точными термодинамическими зависимостями с другими измеримыми свойствами растворов, так как выводы термодинамики вообще не зависят от внутренних механизмов явлений.
