
- •Учебно-методические разработки для самостоятельной работы студентов по курсу «Теоретические основы защиты окружающей среды»
- •Часть II
- •Специальные методы очистки сточных вод и основные методы сепарации твердых отходов
- •Введение
- •Глава 1. Химические методы очистки сточных вод
- •1.1 Нейтрализация
- •1.1.1. Нейтрализация смешиванием
- •1.1.2. Нейтрализация добавлением реагентов
- •1.1.3. Нейтрализация фильтрованием кислых вод через нейтрализующие материалы
- •1.2. Нейтрализация кислыми газами
- •1.2.1. Окисление и восстановление
- •1.2.2. Окисление пероксидом водорода
- •1.2.3. Окисление кислородом воздуха
- •1.2.4. Озонирование
- •Контрольные вопросы
- •Глава 2. Явление осмоса и его использование при очистке сточных вод
- •2.1. Осмотическое давление
- •2.2. Биологическая роль осмотического давления
- •2.3. Законы осмотического давления
- •2.4. Термодинамика осмотического давления
- •Контрольные вопросы
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси
- •3.1. Явления электролиза, поляризации и перенапряжения
- •3.1.1 Электролиз
- •3.1.2. Кривая напряжения
- •3.1.3. Электродвижущие силы разложения
- •3.1.4. Потенциал разложения
- •3.1.5. Концентрационная поляризация
- •3.1.6. Деполяризация
- •3.1.7. Перенапряжение
- •3.2. Электрокапиллярные явления
- •3.2.1. Зависимость поверхностного напряжения от заряда
- •3.2.2. Влияние адсорбции на электрокапиллярную кривую
- •3.2.3. Проблема абсолютных потенциалов
- •3.3. Электрокинетические явления
- •3.3.1. Диффузионный двойной слой и электрокинетический потенциал
- •3.3.2. Емкость двойного слоя
- •3.3.3. Электроосмос
- •3.3.4. Потенциал течения
- •3.3.5. Электрофорез
- •3.3.6. Потенциалы осаждения
- •3.4. Электрохимические методы очистки сточных вод
- •3.4.1. Анодное окисление и катодное восстановление
- •3.4.2. Электрокоагуляция
- •3.4.3. Электрофлотация
- •3.4.4. Электродиализ
- •Контрольные вопросы
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов
- •4.1. Процессы измельчения и дробления
- •4.1.1. Назначение операций дробления и измельчения
- •4.1.2. Степень дробления и измельчения
- •4.1.3. Стадиональность и схемы дробления и измельчения
- •4.1.4. Удельная поверхность диспергированного материала
- •4.1.5. Современные представления о разрушении твердого материала
- •4.1.6. Механические свойства твердых тел при простых видах деформации
- •4.1.7. Законы дробления
- •4.1.8. Способы дробления, классификация машин для дробления и измельчения
- •4.2. Процесс грохочения
- •4.2.1. Основные понятия и назначение грохочения
- •4.2.2. Просеивающая поверхность
- •4.2.3. Способы определения гранулометрического состава
- •4.2.4. Ситовый анализ
- •4.2.5. Характеристики крупности
- •4.2.6. Аналитическое представление характеристик крупности
- •4.2.7. Дифференциальные функции распределения по крупности
- •4.2.8. Вычисление поверхности и числа частиц по уравнениям суммарной характеристики крупности
- •4.2.9. Эффективность процесса грохочения
- •4.2.10. «Легкие», «трудные» и «затрудняющие» частицы
- •4.2.11. Вероятность прохождения частиц через отверстия сита
- •4.2.12. Факторы, влияющие на процесс грохочения
- •4.3. Электромагнитная сепарация. Физические основы процесса
- •4.4. Электростатическая сепарация. Физические основы процесса
- •4.5. Электродинамическая сепарация
- •4.6. Сепарация твердых материалов по коэффициенту трения
- •4.7. Сепарация на основе явления смачиваемости
- •4.8. Аэросепарация
- •4.9. Составление балансной схемы переработанного твердого сырья
- •4.9.1. Баланс материалов при переработке твердых отходов
- •4.9.2. Технологические и технико-экономические показатели переработки твердых отходов
- •Контрольные вопросы
- •Варианты домашнего задания по курсу «Теоретические основы защиты окружающей среды»
- •1. Отстаивание, сгущение, осветление.
- •2. Флотация
- •3. Экстракция
- •4. Дробление и грохочение
- •5. Измельчение и классификация
- •6. Магнитное и электрическое разделение
- •Примеры выполнения домашних заданий
- •Темы заданий для курсовых работ по курсу «Теоретические основы защиты окружающей среды»
- •Пример выполнения курсовой работы
- •Литература
- •Оглавление
- •Глава 1. Химические методы очистки сточных вод 6
- •Глава 2. Явление осмоса и его использование при очистке сточных вод 20
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси 31
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов 73
1.2. Нейтрализация кислыми газами
Для нейтрализации щелочных сточных вод в последнее время используют отходящие газы, содержащие CO2, SO2, NO2, N2O3. Применение кислых газов позволяет не только нейтрализовать сточные воды, но и одновременно проводить высокоэффективную очистку газов от вредных компонентов. Процесс нейтрализации газов может быть проведен в реакторах с мешалкой (рис.1.2).
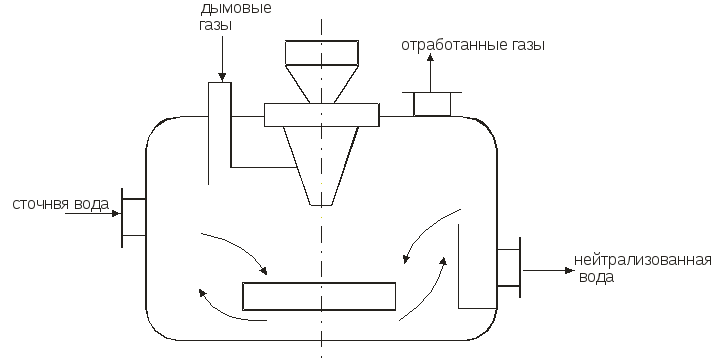 Рис.
1.2. Схема установки для нейтрализации
кислыми газами
Рис.
1.2. Схема установки для нейтрализации
кислыми газами
Дымовые газы вентилятором подают в кольцевое пространство вокруг вала мешалки и распределяют мешалкой в виде пузырьков и струй в сточной воде, поступающей внутрь реактора. Благодаря большой поверхности контакта между водой и газами происходит быстрая нейтрализация сточной воды.
Количество кислого газа необходимого для нейтрализации может быть определено по уравнению массоотдачи:
![]() , (1)
, (1)
где
![]() - количество кислого газа, необходимого
для нейтрализации;
- количество кислого газа, необходимого
для нейтрализации;![]() - фактор ускорения;
- фактор ускорения;![]() - коэффициент массоотдачи в жидкой
среде;
- коэффициент массоотдачи в жидкой
среде;![]() - поверхность контакта фаз;
- поверхность контакта фаз;![]() - движущая сила процесса.
- движущая сила процесса.
Коэффициент
![]() рассчитывают по формулам для различных
массообменных аппаратов. Нейтрализация
щелочных вод используется в ряде
производств, в том числе и в асбестоцементном
производстве.
рассчитывают по формулам для различных
массообменных аппаратов. Нейтрализация
щелочных вод используется в ряде
производств, в том числе и в асбестоцементном
производстве.
Сточная вода из усреднителя должна поступать в смеситель, где предварительно нейтрализуется частью воды, выходящей из абсорбера (рис.1.3).
.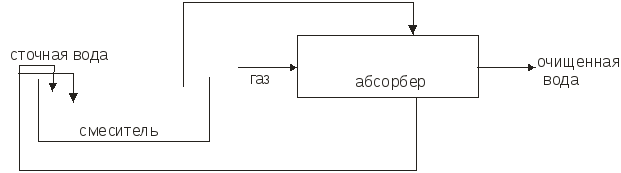
Рис.1.3. Схема установки для нейтрализации с абсорбером
В смесителе протекают следующие реакции:
OH-+HCO3-H2O+CO32-,
Cu2++CO32-CaCO3.
Осаждение происходит в циркуляционной емкости. Предварительную нейтрализацию сточной воды проводят с целью получения на входе в абсорбер смеси с таким водородным показателем, при котором смесь при окончательной нейтрализации в абсорбере дымовыми газами не образует карбонатных отложений. При этом в абсорбере протекают следующие реакции:
2OH+CO2H2O+CO32-,
CO32-+CO2+H2O2HCO3-.
Отношение объемных расходов циркулирующей и сточной воды, при которой образуется смесь, не выделяющая карбонатных отложений, зависит от состава сточной воды и составляет от 2,5 до 4. Для нейтрализации применяют абсорбент с крупнодырчатыми провальными тарелками и большим свободным сечением. Нейтрализации сточных вод дымовыми газами является примером ресурсосберегающей технологии.
1.2.1. Окисление и восстановление
Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорат кальция, бихромат калия, пероксид водорода, кислород воздуха, пероксосерные кислоты, озон, пиролюзит и др. В процессе окисления токсичные загрязнители, содержащиеся в сточных водах, переходят в менее токсичные и которые удаляют из воды.
Хлор и вещества, содержащие активный хлор, являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, гидросульфида, метилсернистых соединений фенолов, цианидов и др. При введении Cl2 в воду образуется хлорноватистая кислота и соляная кислота.
Cl2+H2O=HOCl+HCl.
Затем происходит диссоциация хлорноватистой кислоты, причем степень ее диссоциации зависит от рH среды. При рH=4 молекулярный Cl практически отсутствует:
HOCl=H++OCl-.
Сумма Cl2+HOCl+OCl- называется свободным активным хлором. В присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин NH2Cl и дихлорамин NH4Cl2. Хлор в виде хлорамина называется связанный активным хлором. Процесс хлорирования происходит в хлораторах периодического и непрерывного действия (в кислородных и вакуумных). Хлорирование происходит в емкостях, включенных в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода удаляется. Например, при обезвреживании сточных вод от цианидов процесс проводят в щелочной среде (рH=9). Цианиды можно окислить до элементарного азота и диоксида углерода по уравненеиям:
CN- + 2OH + Cl2 → CNO-- + 2Cl-- + H2O,
2CNO + 4OH + 3Cl2 → CO2 + 6Cl-- + N2 + 2H2O.
Источниками активного хлора может быть также хлорат кальция, гипохлориты, хлораты и диоксид хлора: CaOCl2; Ca(ClO)2.
Сильным окислителем является хлорат натрия NaClO2, который разлагается с выделением ClO2.
При окислении цианидов активным хлором процесс можно проводить в одну ступень до получения цианидов:
CN + OCl-CNO- + Cl-,
CNO- + 2H2OCO32- + NH4-.
Скорость процесса зависит от рН среды. При рН=5,3 за сутки обезвреживается 80% цианидов.
На второй стадии процесса вводят дополнительное количество окислителя и реакция протекает по уравнению:
2CNO + 3OCl- + H2O2CO2 + N2 + 2OH + 3Cl.
Во время второй стадии РН поддерживается 5-10 . Потребность реагентов Xi (кг/сутки) для окисления рассчитывается по формуле:
Xi=XClQn/a,
где XCl - расход активного хлора, необходимого для окисления нужного количества цианидов [кг/м3]; Q - расход воды, м3/сут; n - коэффициент избытка реагента (n = 1.2 ÷ 1.3); а - содержание активного хлора в реагенте, доли единицы.
Схема установки хлоратора представлена на рис. 1.4.
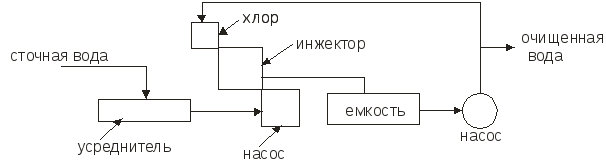
Рис.1.4. Схема хлоратора
