
- •Учебно-методические разработки для самостоятельной работы студентов по курсу «Теоретические основы защиты окружающей среды»
- •Часть II
- •Специальные методы очистки сточных вод и основные методы сепарации твердых отходов
- •Введение
- •Глава 1. Химические методы очистки сточных вод
- •1.1 Нейтрализация
- •1.1.1. Нейтрализация смешиванием
- •1.1.2. Нейтрализация добавлением реагентов
- •1.1.3. Нейтрализация фильтрованием кислых вод через нейтрализующие материалы
- •1.2. Нейтрализация кислыми газами
- •1.2.1. Окисление и восстановление
- •1.2.2. Окисление пероксидом водорода
- •1.2.3. Окисление кислородом воздуха
- •1.2.4. Озонирование
- •Контрольные вопросы
- •Глава 2. Явление осмоса и его использование при очистке сточных вод
- •2.1. Осмотическое давление
- •2.2. Биологическая роль осмотического давления
- •2.3. Законы осмотического давления
- •2.4. Термодинамика осмотического давления
- •Контрольные вопросы
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси
- •3.1. Явления электролиза, поляризации и перенапряжения
- •3.1.1 Электролиз
- •3.1.2. Кривая напряжения
- •3.1.3. Электродвижущие силы разложения
- •3.1.4. Потенциал разложения
- •3.1.5. Концентрационная поляризация
- •3.1.6. Деполяризация
- •3.1.7. Перенапряжение
- •3.2. Электрокапиллярные явления
- •3.2.1. Зависимость поверхностного напряжения от заряда
- •3.2.2. Влияние адсорбции на электрокапиллярную кривую
- •3.2.3. Проблема абсолютных потенциалов
- •3.3. Электрокинетические явления
- •3.3.1. Диффузионный двойной слой и электрокинетический потенциал
- •3.3.2. Емкость двойного слоя
- •3.3.3. Электроосмос
- •3.3.4. Потенциал течения
- •3.3.5. Электрофорез
- •3.3.6. Потенциалы осаждения
- •3.4. Электрохимические методы очистки сточных вод
- •3.4.1. Анодное окисление и катодное восстановление
- •3.4.2. Электрокоагуляция
- •3.4.3. Электрофлотация
- •3.4.4. Электродиализ
- •Контрольные вопросы
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов
- •4.1. Процессы измельчения и дробления
- •4.1.1. Назначение операций дробления и измельчения
- •4.1.2. Степень дробления и измельчения
- •4.1.3. Стадиональность и схемы дробления и измельчения
- •4.1.4. Удельная поверхность диспергированного материала
- •4.1.5. Современные представления о разрушении твердого материала
- •4.1.6. Механические свойства твердых тел при простых видах деформации
- •4.1.7. Законы дробления
- •4.1.8. Способы дробления, классификация машин для дробления и измельчения
- •4.2. Процесс грохочения
- •4.2.1. Основные понятия и назначение грохочения
- •4.2.2. Просеивающая поверхность
- •4.2.3. Способы определения гранулометрического состава
- •4.2.4. Ситовый анализ
- •4.2.5. Характеристики крупности
- •4.2.6. Аналитическое представление характеристик крупности
- •4.2.7. Дифференциальные функции распределения по крупности
- •4.2.8. Вычисление поверхности и числа частиц по уравнениям суммарной характеристики крупности
- •4.2.9. Эффективность процесса грохочения
- •4.2.10. «Легкие», «трудные» и «затрудняющие» частицы
- •4.2.11. Вероятность прохождения частиц через отверстия сита
- •4.2.12. Факторы, влияющие на процесс грохочения
- •4.3. Электромагнитная сепарация. Физические основы процесса
- •4.4. Электростатическая сепарация. Физические основы процесса
- •4.5. Электродинамическая сепарация
- •4.6. Сепарация твердых материалов по коэффициенту трения
- •4.7. Сепарация на основе явления смачиваемости
- •4.8. Аэросепарация
- •4.9. Составление балансной схемы переработанного твердого сырья
- •4.9.1. Баланс материалов при переработке твердых отходов
- •4.9.2. Технологические и технико-экономические показатели переработки твердых отходов
- •Контрольные вопросы
- •Варианты домашнего задания по курсу «Теоретические основы защиты окружающей среды»
- •1. Отстаивание, сгущение, осветление.
- •2. Флотация
- •3. Экстракция
- •4. Дробление и грохочение
- •5. Измельчение и классификация
- •6. Магнитное и электрическое разделение
- •Примеры выполнения домашних заданий
- •Темы заданий для курсовых работ по курсу «Теоретические основы защиты окружающей среды»
- •Пример выполнения курсовой работы
- •Литература
- •Оглавление
- •Глава 1. Химические методы очистки сточных вод 6
- •Глава 2. Явление осмоса и его использование при очистке сточных вод 20
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси 31
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов 73
3.3.6. Потенциалы осаждения
Если заряженные частицы движутся в жидкости, то в последней в направлении этого движения возникает электрическое поле. Это движение можно, например, наблюдать при оседании взвешенного осадка в жидкости, наполняющей вертикальную трубку, если вверх и вниз ее ввести электроды. Возникающая между последними разность потенциалов называется потенциалом осаждения.
Это явление, открытое Дорном (1878), обратно электрофорезу и подчиняется тем же законам. Оно не нашло еще интересных применений.
3.4. Электрохимические методы очистки сточных вод
Для очистки сточных вод от различных растворимых и диспергированных примесей применяют процессы анодного окисления, катодного восстановления, электрокоагуляции, электрофлотации и электродиализа. Все эти процессы протекают на электродах при пропускании через воду постоянного электрического тока. Электрохимические методы позволяют извлекать из сточных вод ценные продукты по относительно простой автоматизированной технологической схеме очистки без использования химических реагентов.
Эффективность электрохимических методов оценивается рядом факторов: плотностью тока, напряжением, коэффициентом полезного использования напряжения, выходом по току, выходом по энергии. Напряжение в электролизе складывается из разности электродных потенциалов и падением напряжения в растворе:
![]() , (3.6)
, (3.6)
где
![]() и
и![]() - величина соответственно анодной и
катодной поляризации;
- величина соответственно анодной и
катодной поляризации;![]() и
и![]() - равновесные потенциалы анода и катода;
- равновесные потенциалы анода и катода;![]() и
и![]() - падение напряжения в электролите и
диафрагме.
- падение напряжения в электролите и
диафрагме.
Падение напряжения в электролите (сточной воде) при отсутствии пузырьков определяется по закону Ома:
![]() , (3.7)
, (3.7)
где
i - плотность тока в сточной воде, А/см2;
р
- удельное сопротивление, Ом·см;
![]() - расстояние между электродами, см.
- расстояние между электродами, см.
При
выделении газовых пузырьков, вследствие
удлинения потока между электродами
![]() возрастает. Соотношение (3.8) называют
коэффициентом полезного использования
напряжения:
возрастает. Соотношение (3.8) называют
коэффициентом полезного использования
напряжения:
![]() . (3.8)
. (3.8)
Выход по току - это отношение теоретически необходимого количества (Закон Фарадея) к практически затраченному , которое выражают в долях единицы или в процентах.
3.4.1. Анодное окисление и катодное восстановление
На первый взгляд этот процесс тривиален. На положительном электроде - аноде ионы отдают электроны, т.е. протекает реакция электрохимического окисления, на отрицательном электроде катода происходит присоединение электронов, т.е. протекают реакции восстановления.
Эти процессы используются для очистки сточных вод от растворимых примесей - роданидов, цианидов, аминов, спиртов, альдегидов, нитросоединений, азотокрасителей, сульфидов, меркиптанов и др.
В результате электрохимического окисления вещества, находящиеся в сточных водах, полностью распадаются с образованием СО2, NH3 и воды, т.е. более простых нетоксичных вещества, которые удаляются более простыми методами.
В качестве анода используют различные нерастворимые электролитические материалы - графит, магнетит, диоксиды свинца, марганца, рутения, которые наносят на катоды, изготавливаемые из молибдена, сплава вольфрама с железом, никелем, из графита нержавеющей стали и др. материалов покрытых молибденом, вольфрамом или их сплавами. Процесс, как правило, проводят в электролизерах с диафрагмой или без нее. Кроме основных процессов электроокисления и восстановления одновременно может протекать электрофлотация, электрофорез, электрокоагуляция.
Сточные воды, содержащие цианиды - это продукты черной, цветной металлургии и химической промышленности. В состав вод простых цианидов (KCN, NaCN) входят комплексные цианиды (Zn, Cu, Fe). рH таких растворов равен 8÷12.
Анодное окисление протекает по схеме:
![]() ,
,
![]() .
.
Окисление может быть проведено и с образованием азота:
![]() .
.
Обычно
дня повышения электропроводности
сточных вод и снижения энергии к водам
добавляют
![]() .
.
Получаем
![]() ,
,
![]() ,
,
![]() .
.
Роданиды разрушаются по схеме.
![]() .
.
Сульфид-ионы при рН= 7 окисляются до сульфатов. При РН<7 может образоваться элементарная сера.
Окисление фенолов в присутствии хлоридов в сточной воде протекает по реакции
![]() ,
,
![]() 4,
4,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Катодное восстановление применяют для удаления из сточных вод ионов металлов с получением осадков для перевода загрязняющего компонента в менее токсичные соединения или в легко выводимую из воды форму (осадок). Его можно использовать для очистки сточных вод от ионов тяжелых металлов Pb2+, Sn2+, Ng2+, Cu2+, As3+, Cr6+.
Катодное восстановление металлов происходит по схеме:
![]() .
.
При этом металлы, осаждающиеся на катоде, могут быть рекуперированы. Например, при восстановлении соединений Сг была достигнуты высокая степень очистки - концентрация снижалась с 1000 до 1 мг/л. При электролизе сточных вод, содержащих Н2СrO7 оптимальное значение pН=2, а плотность тока 0,2÷2 а/дм2. Реакция восстановления протекает следующим образом:
![]() .
.
Очистку сточных вод от ионов Hg2+, Pb2+, Cd2+, Cu2+ проводят на катодах, состоящих из смеси угольного и сернистого порошков в соотношении C:S от 80:20 до 20:80 при pН < 7. Примером реакции, обеспечивающей удаление загрязнения в газовую фазу, является очистка от нитратов аммония: восстановление нитрата аммония на графитовом электроде, который разлагается при нагревании до элементарного азота:
![]() ,
,
![]() .
.
Повышенная токсичность органических веществ, как правило, связана с наличием в молекуле атомов галогенов, альдегидной, аминной, нитратной, нитритной групп. Таким образом, продукты восстановления (например, альдегидов и кетонов) - спирты и углеводороды будут менее токсичны. Потеря атома галогена приводит к тому же результату:
![]() .
.
Рассмотрим процесс анодного растворения, на примере железа. В щелочной среде реакция идет в две стадии:
1)
![]() ;
;
2)
![]() или
или
![]() .
.
На первой стадии, включающей адсорбцию гидроксида на железном электроде и потерю первого электрона, образуется промежуточное кислородосодержащее соединение одновалентного железа. На второй стадии реакция протекает по двум возможным направлениям и завершается образованием двух- или трехвалентного железа. Общая скорость процесса анодного растворения лимитируется второй стадией (рис.3.11).
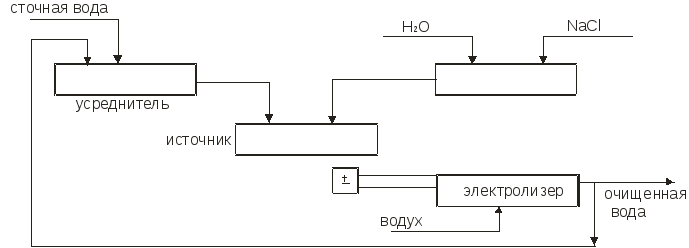 Рис.
3.11. Схема установки химической очистки
воды
Рис.
3.11. Схема установки химической очистки
воды
В кислой среде протекает следующая реакция:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Лимитирующей
стадией является предпоследняя реакция.
Скорость электрохимического растворения
металла определяется величиной тока,
которая зависит от приложенного
напряжения (потенциала анода)
![]() .
Процессы анодного окисления используются
для очистки сточных вод целлюлозно-бумажных,
нефтеперерабатывающих, нефтехимических
и других заводов.
.
Процессы анодного окисления используются
для очистки сточных вод целлюлозно-бумажных,
нефтеперерабатывающих, нефтехимических
и других заводов.
