
- •Учебно-методические разработки для самостоятельной работы студентов по курсу «Теоретические основы защиты окружающей среды»
- •Часть II
- •Специальные методы очистки сточных вод и основные методы сепарации твердых отходов
- •Введение
- •Глава 1. Химические методы очистки сточных вод
- •1.1 Нейтрализация
- •1.1.1. Нейтрализация смешиванием
- •1.1.2. Нейтрализация добавлением реагентов
- •1.1.3. Нейтрализация фильтрованием кислых вод через нейтрализующие материалы
- •1.2. Нейтрализация кислыми газами
- •1.2.1. Окисление и восстановление
- •1.2.2. Окисление пероксидом водорода
- •1.2.3. Окисление кислородом воздуха
- •1.2.4. Озонирование
- •Контрольные вопросы
- •Глава 2. Явление осмоса и его использование при очистке сточных вод
- •2.1. Осмотическое давление
- •2.2. Биологическая роль осмотического давления
- •2.3. Законы осмотического давления
- •2.4. Термодинамика осмотического давления
- •Контрольные вопросы
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси
- •3.1. Явления электролиза, поляризации и перенапряжения
- •3.1.1 Электролиз
- •3.1.2. Кривая напряжения
- •3.1.3. Электродвижущие силы разложения
- •3.1.4. Потенциал разложения
- •3.1.5. Концентрационная поляризация
- •3.1.6. Деполяризация
- •3.1.7. Перенапряжение
- •3.2. Электрокапиллярные явления
- •3.2.1. Зависимость поверхностного напряжения от заряда
- •3.2.2. Влияние адсорбции на электрокапиллярную кривую
- •3.2.3. Проблема абсолютных потенциалов
- •3.3. Электрокинетические явления
- •3.3.1. Диффузионный двойной слой и электрокинетический потенциал
- •3.3.2. Емкость двойного слоя
- •3.3.3. Электроосмос
- •3.3.4. Потенциал течения
- •3.3.5. Электрофорез
- •3.3.6. Потенциалы осаждения
- •3.4. Электрохимические методы очистки сточных вод
- •3.4.1. Анодное окисление и катодное восстановление
- •3.4.2. Электрокоагуляция
- •3.4.3. Электрофлотация
- •3.4.4. Электродиализ
- •Контрольные вопросы
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов
- •4.1. Процессы измельчения и дробления
- •4.1.1. Назначение операций дробления и измельчения
- •4.1.2. Степень дробления и измельчения
- •4.1.3. Стадиональность и схемы дробления и измельчения
- •4.1.4. Удельная поверхность диспергированного материала
- •4.1.5. Современные представления о разрушении твердого материала
- •4.1.6. Механические свойства твердых тел при простых видах деформации
- •4.1.7. Законы дробления
- •4.1.8. Способы дробления, классификация машин для дробления и измельчения
- •4.2. Процесс грохочения
- •4.2.1. Основные понятия и назначение грохочения
- •4.2.2. Просеивающая поверхность
- •4.2.3. Способы определения гранулометрического состава
- •4.2.4. Ситовый анализ
- •4.2.5. Характеристики крупности
- •4.2.6. Аналитическое представление характеристик крупности
- •4.2.7. Дифференциальные функции распределения по крупности
- •4.2.8. Вычисление поверхности и числа частиц по уравнениям суммарной характеристики крупности
- •4.2.9. Эффективность процесса грохочения
- •4.2.10. «Легкие», «трудные» и «затрудняющие» частицы
- •4.2.11. Вероятность прохождения частиц через отверстия сита
- •4.2.12. Факторы, влияющие на процесс грохочения
- •4.3. Электромагнитная сепарация. Физические основы процесса
- •4.4. Электростатическая сепарация. Физические основы процесса
- •4.5. Электродинамическая сепарация
- •4.6. Сепарация твердых материалов по коэффициенту трения
- •4.7. Сепарация на основе явления смачиваемости
- •4.8. Аэросепарация
- •4.9. Составление балансной схемы переработанного твердого сырья
- •4.9.1. Баланс материалов при переработке твердых отходов
- •4.9.2. Технологические и технико-экономические показатели переработки твердых отходов
- •Контрольные вопросы
- •Варианты домашнего задания по курсу «Теоретические основы защиты окружающей среды»
- •1. Отстаивание, сгущение, осветление.
- •2. Флотация
- •3. Экстракция
- •4. Дробление и грохочение
- •5. Измельчение и классификация
- •6. Магнитное и электрическое разделение
- •Примеры выполнения домашних заданий
- •Темы заданий для курсовых работ по курсу «Теоретические основы защиты окружающей среды»
- •Пример выполнения курсовой работы
- •Литература
- •Оглавление
- •Глава 1. Химические методы очистки сточных вод 6
- •Глава 2. Явление осмоса и его использование при очистке сточных вод 20
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси 31
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов 73
1.2.2. Окисление пероксидом водорода
Пероксид водорода является бесцветной жидкостью и в любых соотношениях смешивается с водой. Он может быть использован для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов, активных красителей. Пероксид водорода в кислой и щелочной средах разлагается по следующим схемам:
2H++H2O2+2C2H2O,
2OH-+H2O2+2C2H2O+2O2-.
В кислой среде более отчетливо выражена окислительная функция, а в щелочной - восстановительная. В кислой среде пероксид водорода переводит соли двухвалентного железа в соли трехвалентного, азотистую кислоту - в азотную, сульфиды - в сульфаты. Цианиды и цианиты окисляются в щелочной среде при рН=9 ÷ 12.
В разбавленных растворах процесс окисления органических веществ протекает медленно, поэтому используют катализаторы: ионы металлов переменной валентности (Fe2+, Cu2+, Mn2+, Co2+, Cr2+, Ag+). Например, процесс окисления пероксидом водорода с солями Fe протекает весьма эффективно при рН=3 ÷ 4,5. Продуктами окисления являются муконовая и леиновая кислоты.
В процессах водообработки используют не только окислительные, но и восстановительные свойства H2O2. В нейтральной и слабощелочной средах он легко взаимодействует с хлором и гипохлоридом, переводя их в хлориды:
H2O2+Cl2O2+2HCl,
NaClO + H2O2NaCl+O2+H2O.
Эти реакции используют при дехлорировании воды. Избыток пероксида водорода можно удалять, обрабатывая его диоксидом марганца:
MnO2+ H2O2+2HClMnCl2+2H2O+O2.
1.2.3. Окисление кислородом воздуха
Кислород воздуха используют при очистке воды от железа, для окисления соединений двухвалентного железа в трехвалентное с последующим отделением от воды гидроксида железа. Реакция окисления в водном растворе протекает по схеме:
4Fe2++O2+2H2O=4Fe3++4OH-,
Fe3++3H2O=Fe(OH)3+3H+.
Окисление проводят при аэрировании воздуха через сточную воду в башнях с хордовой посадкой. Образующийся гидроскид железа отстаивают в контактном резервуаре, а затем отфильтровывают. Использование колонн с кусковой посадкой нецелесообразно, т.к. происходит зарастание насадки. Возможен процесс упрощенной аэрации. В этом случае под поверхностью фильтра разбрызгивают воду, которая падает на поверхность фильтрующей загрузки. При контакте капель воды с воздухом происходит окисление железа.
Кислородом воздуха окисляют также сульфидные стоки целлюлозных, нефтеперерабатывающих и нефтехимических заводов. Процесс окисления серы, гидросульфидной и сульфидной серы протекает через ряд стадий при изменении валентности серы с –2 до +6.
S2-S1SnO62-S2O32-SO42-.
Необходимо отметить, что при окислении гидросульфида и сульфида до тиосульфата рН раствора повышается, при окислении гидросульфида до сульфита и сульфата рН раствора понижается, а при окислении сульфида до сульфита и сульфата рН раствора не изменяется. С повышением температуры и давления скорость реакции и глубина окисления сульфидов и гидросульфидов увеличивается. Теоретически на окисление 1 г сульфидной серы расходуется 1 г кислорода воздуха. Принципиальная схема очистки приведена на рис.1.5.
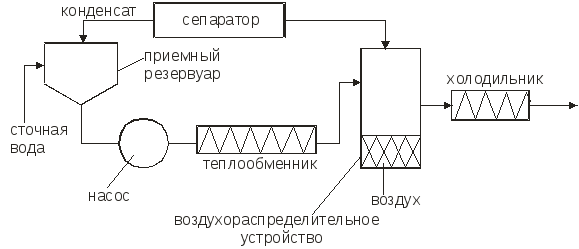
Рис.1.5. Схема установки для окисления кислородом воздуха
