
- •Учебно-методические разработки для самостоятельной работы студентов по курсу «Теоретические основы защиты окружающей среды»
- •Часть II
- •Специальные методы очистки сточных вод и основные методы сепарации твердых отходов
- •Введение
- •Глава 1. Химические методы очистки сточных вод
- •1.1 Нейтрализация
- •1.1.1. Нейтрализация смешиванием
- •1.1.2. Нейтрализация добавлением реагентов
- •1.1.3. Нейтрализация фильтрованием кислых вод через нейтрализующие материалы
- •1.2. Нейтрализация кислыми газами
- •1.2.1. Окисление и восстановление
- •1.2.2. Окисление пероксидом водорода
- •1.2.3. Окисление кислородом воздуха
- •1.2.4. Озонирование
- •Контрольные вопросы
- •Глава 2. Явление осмоса и его использование при очистке сточных вод
- •2.1. Осмотическое давление
- •2.2. Биологическая роль осмотического давления
- •2.3. Законы осмотического давления
- •2.4. Термодинамика осмотического давления
- •Контрольные вопросы
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси
- •3.1. Явления электролиза, поляризации и перенапряжения
- •3.1.1 Электролиз
- •3.1.2. Кривая напряжения
- •3.1.3. Электродвижущие силы разложения
- •3.1.4. Потенциал разложения
- •3.1.5. Концентрационная поляризация
- •3.1.6. Деполяризация
- •3.1.7. Перенапряжение
- •3.2. Электрокапиллярные явления
- •3.2.1. Зависимость поверхностного напряжения от заряда
- •3.2.2. Влияние адсорбции на электрокапиллярную кривую
- •3.2.3. Проблема абсолютных потенциалов
- •3.3. Электрокинетические явления
- •3.3.1. Диффузионный двойной слой и электрокинетический потенциал
- •3.3.2. Емкость двойного слоя
- •3.3.3. Электроосмос
- •3.3.4. Потенциал течения
- •3.3.5. Электрофорез
- •3.3.6. Потенциалы осаждения
- •3.4. Электрохимические методы очистки сточных вод
- •3.4.1. Анодное окисление и катодное восстановление
- •3.4.2. Электрокоагуляция
- •3.4.3. Электрофлотация
- •3.4.4. Электродиализ
- •Контрольные вопросы
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов
- •4.1. Процессы измельчения и дробления
- •4.1.1. Назначение операций дробления и измельчения
- •4.1.2. Степень дробления и измельчения
- •4.1.3. Стадиональность и схемы дробления и измельчения
- •4.1.4. Удельная поверхность диспергированного материала
- •4.1.5. Современные представления о разрушении твердого материала
- •4.1.6. Механические свойства твердых тел при простых видах деформации
- •4.1.7. Законы дробления
- •4.1.8. Способы дробления, классификация машин для дробления и измельчения
- •4.2. Процесс грохочения
- •4.2.1. Основные понятия и назначение грохочения
- •4.2.2. Просеивающая поверхность
- •4.2.3. Способы определения гранулометрического состава
- •4.2.4. Ситовый анализ
- •4.2.5. Характеристики крупности
- •4.2.6. Аналитическое представление характеристик крупности
- •4.2.7. Дифференциальные функции распределения по крупности
- •4.2.8. Вычисление поверхности и числа частиц по уравнениям суммарной характеристики крупности
- •4.2.9. Эффективность процесса грохочения
- •4.2.10. «Легкие», «трудные» и «затрудняющие» частицы
- •4.2.11. Вероятность прохождения частиц через отверстия сита
- •4.2.12. Факторы, влияющие на процесс грохочения
- •4.3. Электромагнитная сепарация. Физические основы процесса
- •4.4. Электростатическая сепарация. Физические основы процесса
- •4.5. Электродинамическая сепарация
- •4.6. Сепарация твердых материалов по коэффициенту трения
- •4.7. Сепарация на основе явления смачиваемости
- •4.8. Аэросепарация
- •4.9. Составление балансной схемы переработанного твердого сырья
- •4.9.1. Баланс материалов при переработке твердых отходов
- •4.9.2. Технологические и технико-экономические показатели переработки твердых отходов
- •Контрольные вопросы
- •Варианты домашнего задания по курсу «Теоретические основы защиты окружающей среды»
- •1. Отстаивание, сгущение, осветление.
- •2. Флотация
- •3. Экстракция
- •4. Дробление и грохочение
- •5. Измельчение и классификация
- •6. Магнитное и электрическое разделение
- •Примеры выполнения домашних заданий
- •Темы заданий для курсовых работ по курсу «Теоретические основы защиты окружающей среды»
- •Пример выполнения курсовой работы
- •Литература
- •Оглавление
- •Глава 1. Химические методы очистки сточных вод 6
- •Глава 2. Явление осмоса и его использование при очистке сточных вод 20
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси 31
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов 73
3.1.3. Электродвижущие силы разложения
Как говорилось выше, электродвижущая сила разложения Ep должна быть равной по величине и обратной по закону электродвижущей силе того гальванического элемента, который образуется при электролизе. Следует, однако, отметить, что из-за побочных осложнений обе электродвижущие силы редко вполне совпадают.
Электродвижущая сила разложения водных растворов всех неорганических оснований и кислородных кислот между гладкими платиновыми электродами одна и та же: около 1,7 В при 20°C с колебаниями не больше 0,05 В в обе стороны. Объясняется это тем, что все они при электролизе дают одни и те же электродные реакции: выделение водорода на катоде и кислорода на аноде. Электродвижущая сила разложения в этих случаях равна электродвижущей силе водородно-кислородного элемента, которая действительно не зависит от рода и концентрации электролита.
Соли щелочных или щелочноземельных металлов дают при электролизе одни и те же продукты на электродах. Например, суммарная схема электродных реакций при электролизе раствора Na2SO4 может быть представлена в следующем виде:
Na*+ H2O + ē = NaOH + 1/2H2
и
SO4 + H2O = H2SO4 + 1/2O2 + 2ē.
Их электродвижущая сила разложения, однако, выше, чем для кислот и щелочей, а именно 2,1÷2,2 В, так как образование щелочи на катоде повышает положительный потенциал водородного электрода, а образование кислоты на аноде повышает отрицательный потенциал кислородного электрода. В кислотах и щелочах этого явления нет, так как избыток их поддерживает равенство pH около обоих электродов. Если металл находится ниже водорода в ряду напряжений, то величина Ep другая и зависит от рода металла. Она, например, равна 0,8 и 0,7 В для растворов AgNO3 и Ag2SO4 и 1,5 В для раствора CuSO4. Объясняется это тем, что здесь электродный процесс на катоде иной, чем в рассмотренных выше примерах: выделяется не водород, а серебро или медь.
При сравнении величин Ep с электродвижущими силами соответствующих обратимых элементов следовало бы брать последние для тех же активностей, какие имеет электролизуемый раствор, однако и тогда не следует ожидать полного согласия из-за уже упоминавшейся и ниже более подробно рассматриваемой необратимости многих электродных процессов.
3.1.4. Потенциал разложения
Вместо измерения электродвижущих сил разложения следует находить потенциал разложения каждого электрода отдельно. Для этого обыкновенно применяют схему, изображенную на рис. 3.2, и ее варианты.
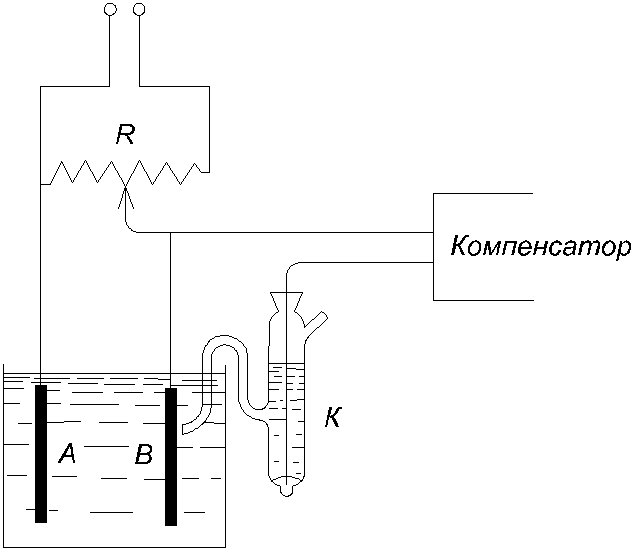
Рис. 3.2. Измерение кривой напряжения
Ток, отбираемый от потенциометра, поляризует ячейку AB; потенциал электрода A измеряют обычным методом против вспомогательного неполяризующего электрода K, например каломельного. Дополнительную электродвижущую силу, равную iw, необходимую для преодоления омического сопротивления, по возможности уменьшают, подводя носик сифона вспомогательного электрода вплотную к измеряемому электроду, или же ее вычитают из измеренных E. Измерение силы тока производят или во время прохождения поляризующего тока, или непосредственно после его выключения. Второй, так называемый коммутаторный метод, при котором чередуют включение поляризующего тока и цепи, измеряющей ток поляризации, раньше считали более точным, что оказалось неверным. Им, однако, пользуются для изучения скорости возникновения и падения поляризации после включения или выключения поляризующего тока.
Зависимость силы тока от поляризующего потенциала дает такие же кривые напряжения, как изображенная на рис. 3.1. Разность потенциалов разложения обоих электродов равна, очевидно, электродвижущей силе разложения данного раствора; если один из электродов не поляризующийся, то она совпадает с потенциалом разложения второго электрода.
Большей частью, по крайней мере, при не слишком больших силах поляризующего тока, потенциалы разложения металлов на платине равны по величине и обратны по знаку электродным потенциалам этих металлов с соответствующими поправками на активности раствора. Например, для меди в 1 н. растворе Cu++(точнее, при активности Cu++, равной единице) получим 0,34 В. Почти ту же величину, немного увеличенную из-за концентрационной поляризации, имеет потенциал разложения медного раствора той же концентрации на платине. Когда он достигается, платина начинает покрываться мелью и превращаться в медный электрод. При выделении газов на электродах, а также в некоторых других случаях нарушается из-за перенапряжения.
