
- •Учебно-методические разработки для самостоятельной работы студентов по курсу «Теоретические основы защиты окружающей среды»
- •Часть II
- •Специальные методы очистки сточных вод и основные методы сепарации твердых отходов
- •Введение
- •Глава 1. Химические методы очистки сточных вод
- •1.1 Нейтрализация
- •1.1.1. Нейтрализация смешиванием
- •1.1.2. Нейтрализация добавлением реагентов
- •1.1.3. Нейтрализация фильтрованием кислых вод через нейтрализующие материалы
- •1.2. Нейтрализация кислыми газами
- •1.2.1. Окисление и восстановление
- •1.2.2. Окисление пероксидом водорода
- •1.2.3. Окисление кислородом воздуха
- •1.2.4. Озонирование
- •Контрольные вопросы
- •Глава 2. Явление осмоса и его использование при очистке сточных вод
- •2.1. Осмотическое давление
- •2.2. Биологическая роль осмотического давления
- •2.3. Законы осмотического давления
- •2.4. Термодинамика осмотического давления
- •Контрольные вопросы
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси
- •3.1. Явления электролиза, поляризации и перенапряжения
- •3.1.1 Электролиз
- •3.1.2. Кривая напряжения
- •3.1.3. Электродвижущие силы разложения
- •3.1.4. Потенциал разложения
- •3.1.5. Концентрационная поляризация
- •3.1.6. Деполяризация
- •3.1.7. Перенапряжение
- •3.2. Электрокапиллярные явления
- •3.2.1. Зависимость поверхностного напряжения от заряда
- •3.2.2. Влияние адсорбции на электрокапиллярную кривую
- •3.2.3. Проблема абсолютных потенциалов
- •3.3. Электрокинетические явления
- •3.3.1. Диффузионный двойной слой и электрокинетический потенциал
- •3.3.2. Емкость двойного слоя
- •3.3.3. Электроосмос
- •3.3.4. Потенциал течения
- •3.3.5. Электрофорез
- •3.3.6. Потенциалы осаждения
- •3.4. Электрохимические методы очистки сточных вод
- •3.4.1. Анодное окисление и катодное восстановление
- •3.4.2. Электрокоагуляция
- •3.4.3. Электрофлотация
- •3.4.4. Электродиализ
- •Контрольные вопросы
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов
- •4.1. Процессы измельчения и дробления
- •4.1.1. Назначение операций дробления и измельчения
- •4.1.2. Степень дробления и измельчения
- •4.1.3. Стадиональность и схемы дробления и измельчения
- •4.1.4. Удельная поверхность диспергированного материала
- •4.1.5. Современные представления о разрушении твердого материала
- •4.1.6. Механические свойства твердых тел при простых видах деформации
- •4.1.7. Законы дробления
- •4.1.8. Способы дробления, классификация машин для дробления и измельчения
- •4.2. Процесс грохочения
- •4.2.1. Основные понятия и назначение грохочения
- •4.2.2. Просеивающая поверхность
- •4.2.3. Способы определения гранулометрического состава
- •4.2.4. Ситовый анализ
- •4.2.5. Характеристики крупности
- •4.2.6. Аналитическое представление характеристик крупности
- •4.2.7. Дифференциальные функции распределения по крупности
- •4.2.8. Вычисление поверхности и числа частиц по уравнениям суммарной характеристики крупности
- •4.2.9. Эффективность процесса грохочения
- •4.2.10. «Легкие», «трудные» и «затрудняющие» частицы
- •4.2.11. Вероятность прохождения частиц через отверстия сита
- •4.2.12. Факторы, влияющие на процесс грохочения
- •4.3. Электромагнитная сепарация. Физические основы процесса
- •4.4. Электростатическая сепарация. Физические основы процесса
- •4.5. Электродинамическая сепарация
- •4.6. Сепарация твердых материалов по коэффициенту трения
- •4.7. Сепарация на основе явления смачиваемости
- •4.8. Аэросепарация
- •4.9. Составление балансной схемы переработанного твердого сырья
- •4.9.1. Баланс материалов при переработке твердых отходов
- •4.9.2. Технологические и технико-экономические показатели переработки твердых отходов
- •Контрольные вопросы
- •Варианты домашнего задания по курсу «Теоретические основы защиты окружающей среды»
- •1. Отстаивание, сгущение, осветление.
- •2. Флотация
- •3. Экстракция
- •4. Дробление и грохочение
- •5. Измельчение и классификация
- •6. Магнитное и электрическое разделение
- •Примеры выполнения домашних заданий
- •Темы заданий для курсовых работ по курсу «Теоретические основы защиты окружающей среды»
- •Пример выполнения курсовой работы
- •Литература
- •Оглавление
- •Глава 1. Химические методы очистки сточных вод 6
- •Глава 2. Явление осмоса и его использование при очистке сточных вод 20
- •Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси 31
- •Глава 4. Физические основы процессов переработки твердых бытовых отходов 73
3.1.7. Перенапряжение
Если потенциал выделения отличается от термодинамического обратимого электродного потенциала, то мы имеем перенапряжение. Поясним это явление несколькими примерами. Черненая платина, насыщенная водородом под атмосферным давлением, дает в растворе с активностью H+, равной единице, водородный электрод, потенциал которого в водородной шкале равен нулю. Этот электрод почти совершенно обратим. Выделение водорода на катоде из черненой платины, если сила тока не очень велика, начинается при том же потенциале. С точки зрения термодинамики равновесных процессов замена платины другим нерастворимым металлом не должна влиять на величину потенциала разложения, поскольку такой металл не участвует в электродном процессе и служит лишь проводником электронов. На самом деле уже замена черненой платины гладкой платиной вызывает повышение потенциала разложения водорода на 0,2 В, а на ртути он растет еще значительно больше. Этот избыточный потенциал, повышающий положение водорода в ряду напряжений, и называется перенапряжением. Перенапряжение водорода можно найти как электродвижущую силу разложения в цепи, составленной из данного водородного электрода и другого обратимого водородного электрода.
Осуществить обратимые кислородные электроды вообще невозможно. На любом металле кислород дает перенапряжение, которое увеличивает его потенциал разложения, т.е. понижает его в ряду напряжений. На гладкой платине перенапряжение кислорода равно примерно 0,5 В. Обратимая электродвижущая сила кислородно-водородного элемента при атмосферном давлении равна 1,23 В. Если при электродах из гладкой платины опыт дает для электродвижущей силы разложения 1,7 В, то это объясняется тем, что к ней прибавляются перенапряжение кислорода, а также небольшое перенапряжение водорода.
Измерять перенапряжение можно разными способами. Чаще всего применяют методы, описанные в параграфе 3.14. Такие измерения производились многократно и не всегда с согласными результатами, так как перенапряжение сильно зависит от чистоты металла и состояния его поверхности. Иногда различают перенапряжение, отвечающее началу выделения пузырьков газа (или другого продукта электролиза) на электроде, и перенапряжения, которое отвечает изгибу на кривой напряжения. Обе величины могут не совпадать из-за пересыщения или других осложняющих причин.
Так как перенапряжение, особенно водородное, имеет большое теоретическое и прикладное значение, то ему было посвящено много экспериментальных и теоретических исследований. Несмотря на это многие стороны вопроса продолжают и сейчас оставаться неясными.
3.2. Электрокапиллярные явления
3.2.1. Зависимость поверхностного напряжения от заряда
Ртуть на границе с водой образует выпуклый мениск из-за поверхностного натяжения. Сообщая ртути заряд, можно изменить ее поверхностное натяжение и кривизну мениска. Это явление легко наблюдать в простом приборе, называемом капиллярным электрометром (рис. 3.3).

Рис. 3.3. Капиллярный электрометр
В U-образную трубку и в шарик прибора наливают ртуть и вводят в них электроды. Поверх ртути наливают раствор электролита, лучше всего 2н. серную кислоту. При соединении обоих электродов с источником тока ртуть получает заряд, ее поверхностное натяжение изменяется, и мениск в капилляре U-образной трубки перемещается.
Этим прибором раньше часто пользовались при измерении электродвижущих сил в качестве нулевого инструмента, но для точных измерений он не годится, так как его чувствительность не превосходит 0,5÷1 мВ.
Изменение поверхностного натяжения ртути с величиной заряда связано с образованием двойного электрического слоя на ее границе с раствором. Поверхность ртути на границе с ним заряжается положительно. Этот заряд ей сообщают ионы ртути, переходящие на нее из раствора, даже если их концентрация в растворе ничтожна, так как электролитическая упругость растворения ртути очень мала.
Положительные заряды на поверхности ртути друг от друга отталкиваются, что уменьшает ее поверхностное натяжение по сравнению с тем, которое она имела бы в отсутствие заряда. Если сообщить ртути извне отрицательный потенциал (катодная поляризация), то число положительных зарядов на ее поверхности уменьшится, и поверхностное натяжение растет до тех пор, пока потенциал не дойдет до величины, отвечающей компенсации всего заряда с поверхности. В этой точке поверхностное натяжение ртути достигает максимума. Дальнейшее повышение отрицательного потенциала сообщает ртути отрицательный заряд, и поверхностное натяжение ее снова начинает падать из-за взаимного отталкивания перешедших на ее поверхность отрицательных зарядов.
Описанные явления, называемые электрокапиллярными, были впервые изучены Липманом (1873). Приведенное выше их объяснение было дано Нернстом (1894), подтвердившим его прибавлением к раствору возрастающих количеств CN, связывающих Hg2++ в прочный комплекс. Уменьшение концентрации последних в растворе сдвигало потенциал ртути в отрицательную сторону и вызывало те же изменения в поверхностном натяжении, как и катодная поляризация внешним током.
Описанная зависимость поверхностного натяжения ртути или другого материала от приложенного поляризующего потенциала E изображается электрокапиллярной кривой, близкой к параболе. Типичный пример ее дан на рис. 3.4 (ртуть на границе с чистой водой).
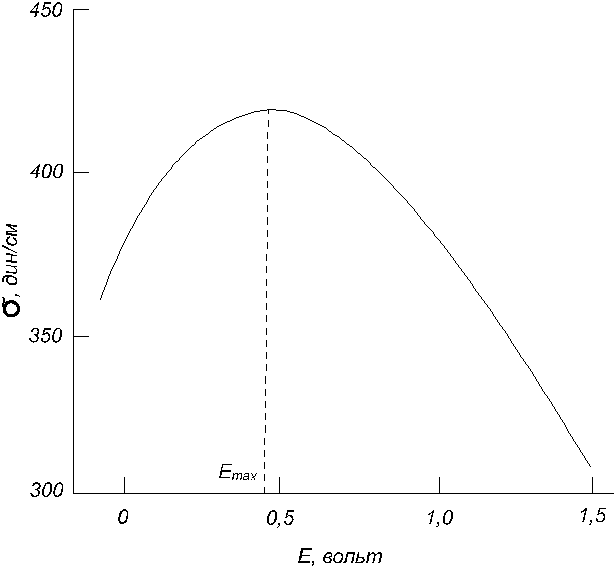
Рис. 3.4. Электрокапиллярная кривая
Максимум ее отвечает максимальной величине поверхностного натяжения, когда заряд поверхности ртути равен нулю. Он наступает при некотором потенциале Emax.
Изучение электрокапиллярных кривых в разных растворах велось Гюи (1903 – 1906) и рядом других авторов.
Для получения электрокапиллярных кривых обычно пользуются капиллярным электрометром Липмана (рис.3.5).
Прибор представляет собой наполненную ртутью суженную внизу трубку капилляра, опущенную в раствор. Его соединяют с отрицательным электродом поляризующего источника тока, положительный электрод которого соединяют с неполяризующимся вспомогательным электродом, например каломельным, опущенным в тот же раствор. Смещенный при поляризации мениск в конце капилляра возвращают в прежнее положение поднятием или опусканием резервуара со ртутью. Поверхностное натяжение измеряют высотой столба ртути, поддерживаемого мениском.
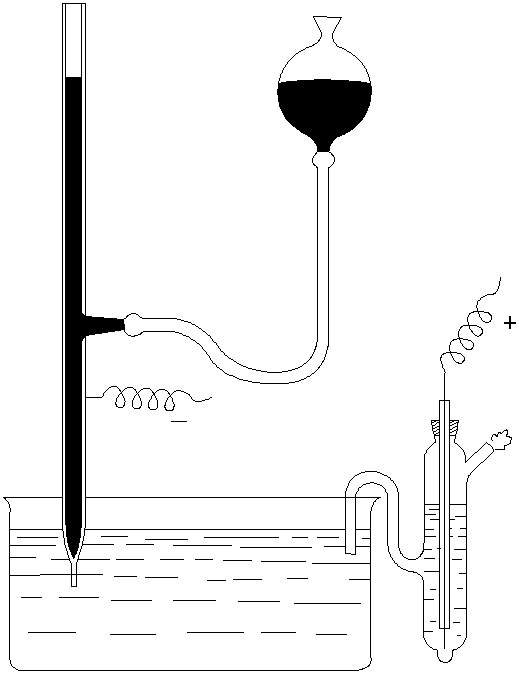
Рис. 3.5. Схема капиллярного электрометра Липмана
Электрокапиллярная кривая выражается уравнением
![]() . (3.2)
. (3.2)
где ε - заряд, преходящий (в виде ионов) из раствора на ртуть при увеличении ее поверхности на 1 см2 при постоянном потенциале E.
Уравнение
(3.2) может быть выведено из уравнения
адсорбции Гиббса и уравнения для
зависимости электродного потенциала
от концентрации ионов. В более общем
виде уравнение электрокапиллярной
кривой было получено А.Н. Фрумкиным
(1922). Им же (1919) была выполнена проверка
уравнения (3.2). Величина
![]() находилась из наклона электрокапиллярных
кривых, а ε - путем измерения заряда,
переносимого каплями ртути, вытекающими
из капилляра. Этот заряд перечислялся
затем на 1см2
поверхности капель. Результаты проверки
представлены в табл.3.1.
находилась из наклона электрокапиллярных
кривых, а ε - путем измерения заряда,
переносимого каплями ртути, вытекающими
из капилляра. Этот заряд перечислялся
затем на 1см2
поверхности капель. Результаты проверки
представлены в табл.3.1.
Таблица 3.1
Проверка уравнения электрокапиллярной кривой
|
Раствор |
ε 106 |
– |
|
1н. NaCl+Hg2Cl2 |
47 |
50 |
|
1н. KOH+HgO |
17 |
21 |
|
1н .H2SO4+Hg2SO4 |
39 |
39 |
|
1н.KNO3+0.01н.KJ+Hg2J2 |
90 |
86 |
|
1н. KOH+C4H9OH+HgO |
-1.3 |
-1.5 |
