
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия и физико-химические методы анализа»
- •Содержание
- •Часть I. Химические методы анализа
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов (в присутствии вольфрама)
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Выполнение реакций обнаружения анионов
- •Обнаружение карбонатов.
- •Обнаружение нитратов
- •Обнаружение ортофосфатов
- •Обнаружение силикатов
- •Обнаружение сульфидов
- •Обнаружение сульфатов
- •Обнаружение хлоридов
- •Вопросы для самоподготовки
- •Гравиметрия (весовой анализ)
- •Цель и задачи работы
- •Программа работы Приборы и реактивы.
- •Определение сульфатов
- •Ход работы.
- •Определение железа
- •Ход работы.
- •Определение никеля
- •Ход работы.
- •Вопросы для самоподготовки
- •Протолитометрический анализ
- •Ход работы
- •Контрольная задача. Определение уксусной кислоты.
- •Вопросы для самоподготовки.
- •Перманганатометрия.
- •Приготовление первичного стандарта щавелевой кислоты
- •Ход работы:
- •Контрольная задача. Определение железа (II)
- •Ход работы:
- •Вопросы для самоподготовки.
- •Иодометрия
- •Стандартизация рабочего раствора тиосульфата натрия (вторичного стандарта).
- •Ход работы:
- •Контрольная задача: Определение меди (II).
- •Ход определения:
- •Вопросы для самоподготовки.
- •Комплексонометрия.
- •Цель и задачи работы.
- •Оборудование и реактивы:
- •Программа работы
- •Определение кальция
- •Ход работы:
- •Определение железа
- •Ход работы
- •Вопросы для самоподготовки
- •Часть II. Инструментальные методы анализа
- •Определение калия по методу градуировочного графика
- •Ход работы:
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания калия в анализируемом растворе
- •Фотометрический анализ
- •Выбор светофильтра
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания меди (II) в анализируемом растворе
- •Определение железа (III) методом градуировочного графика
- •Фототурбидиметрия.
- •Ход работы:
- •Приготовление стандартных растворов и раствора сравнения:
- •Построение градуировочного графика:
- •Контрольная задача. Определение содержания в растворе.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Приборы и реактивы:
- •Ход работы:
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача Определение содержания сахара в анализируемом образце:
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Ход работы:
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Вопросы для самоподготовки
- •Потенциометрия
- •Цель и задачи работы
- •Программа работы
- •Определение хлородородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования.
- •Приборы и реактивы
- •Ход работы
- •Установление титра рабочего раствора
- •Подготовка анализируемого образца к титрованию
- •Подготовка иономера к работе в режиме определения рН
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце
- •Вопросы для самоподготовки.
- •Кондуктометрия.
- •Цель и задачи работы.
- •Программа работы.
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Приборы и реактивы:
- •Ход работы:
- •12.2.1.1. Установление титра рабочего раствора :
- •12.2.1.2. Подготовка анализируемого образца к титрованию:
- •12.2.1.3. Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси:
- •Определение ионовив их смеси.
- •Приборы и реактивы:
- •Подготовка анализируемого образца к титрованию:проводят по пункту 12.2.1.2.
- •Контрольная задача. Определение содержания солей никеля (II) и кальция в испытуемой смеси
- •Вопросы для самоконтроля.
- •13. Газохроматографический метод определения содержания токсичных микропримесей
- •13.1. Цель работы:
- •13.2. Объекты и средства исследования.
- •13.3. Программа работы
- •13.3.1. Приготовление градуировочных смесей
- •Условия хроматографирования с капиллярными колонками:
- •Литература:
Вопросы для самоподготовки
В чем принципиальное отличие дробного метода анализа от систематического? Каковы преимущества и недостатки методов друг перед другом?
Какой метод, дробный или систематический, следует применить при обнаружении нескольких ионов в смеси, состав которой приблизительно известен?
Назовите критерии оценки аналитических реакций.
Какие реакции называются общими, специфическими, частными?
Дайте определения понятиям "качественная реакция", "селективность реакции", "предел обнаружения".
Назовите признаки по которым классифицируются аналитические реакции.
Какова аналитическая классификация катионов по сероводородному методу анализа?
На чем основано деление катионов и анионов на аналитические группы в систематическом анализе?
Что такое групповой реагент? Каким требованиям он должен отвечать? Как проверить полноту осаждения ионов?
Каков порядок осаждения катионов в систематическом ходе анализа? Почему анализ начинают с обнаружения иона
 ?
?Назовите групповые реагенты аналитических групп по сероводородному методу.
Что такое маскирование ионов? В каких случаях эта операция применяется?
Какие методы и способы группового и селективного разделения ионов вы знаете?
Вычислите
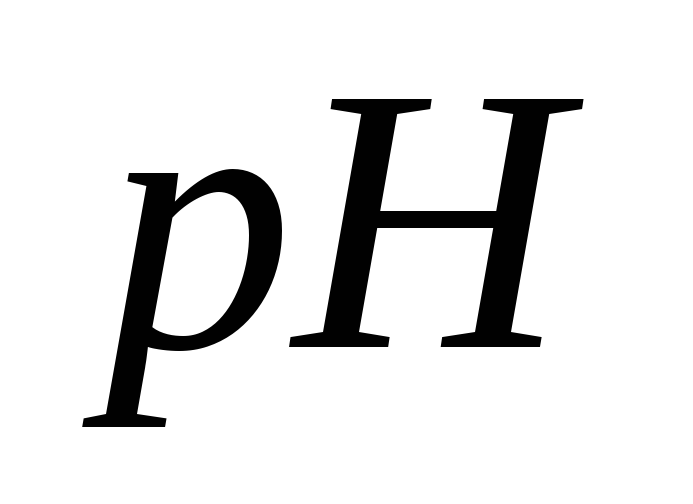 раствора серной кислоты с молярной
концентрацией эквивалента 0,005 моль/дм3
(считая кислоту сильной по обеим
степеням диссоциации).
раствора серной кислоты с молярной
концентрацией эквивалента 0,005 моль/дм3
(считая кислоту сильной по обеим
степеням диссоциации).Рассчитайте молярную концентрацию ионов
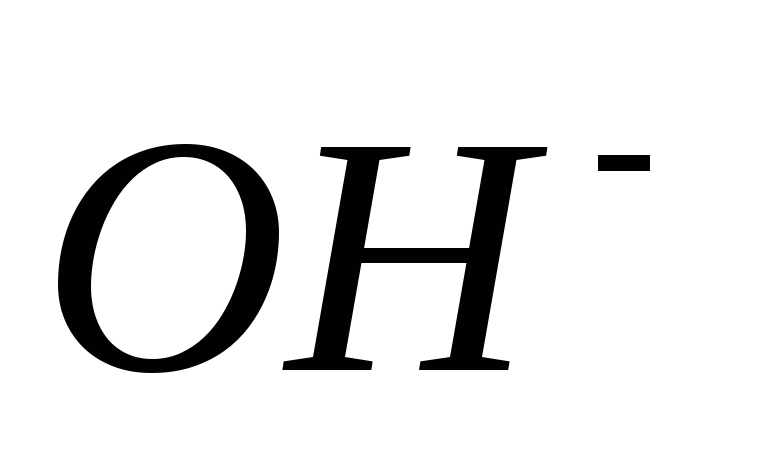 в растворе с
в растворе с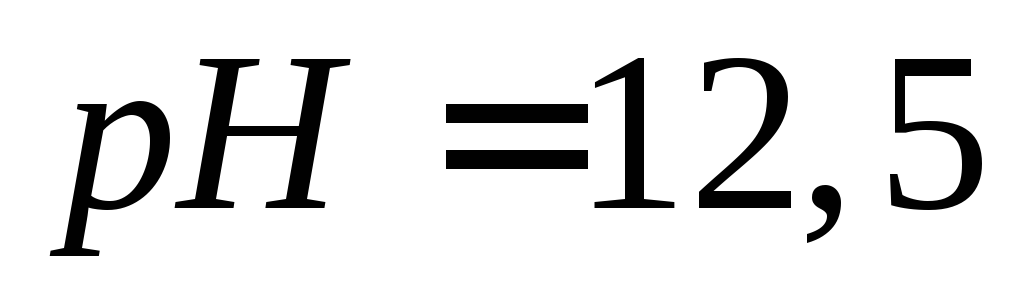 .
.Вычислите
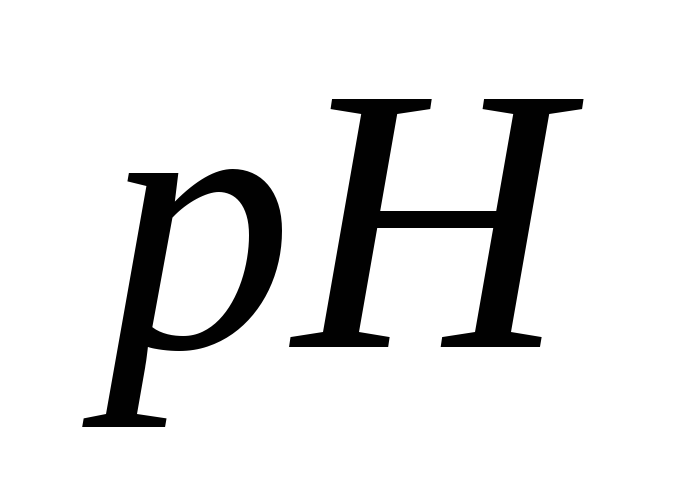 раствора, содержащего в 1 дм30,2 г гидроксида натрия.
раствора, содержащего в 1 дм30,2 г гидроксида натрия.Рассчитайте
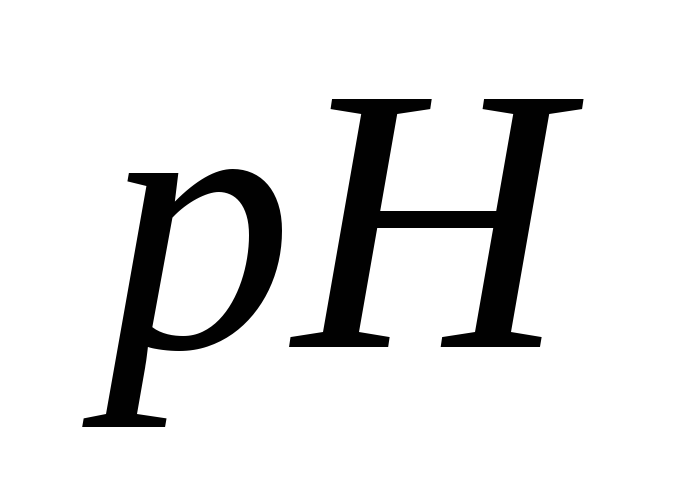 0,1 моль/дм3раствора уксусной
кислоты.
0,1 моль/дм3раствора уксусной
кислоты.Рассчитайте
 0,01 моль/дм3раствора гидроксида
аммония.
0,01 моль/дм3раствора гидроксида
аммония.Рассчитайте константу гидролиза, степень гидролиза и
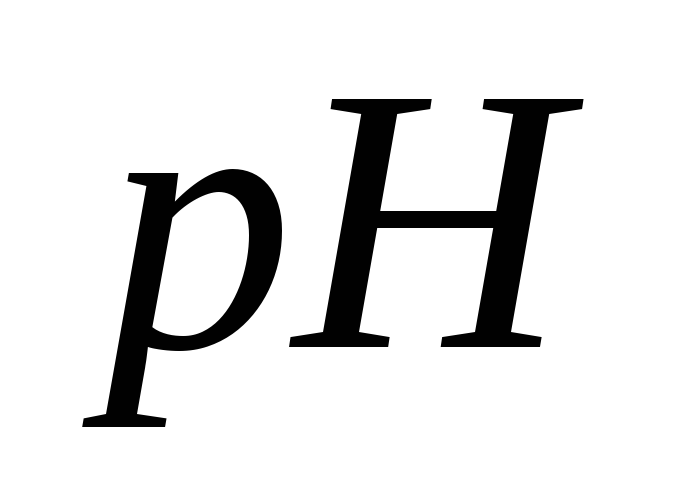 0,1 моль/дм3раствора роданида
аммония. Какие факторы усиливают и
какие подавляют гидролиз?
0,1 моль/дм3раствора роданида
аммония. Какие факторы усиливают и
какие подавляют гидролиз?Вычислите
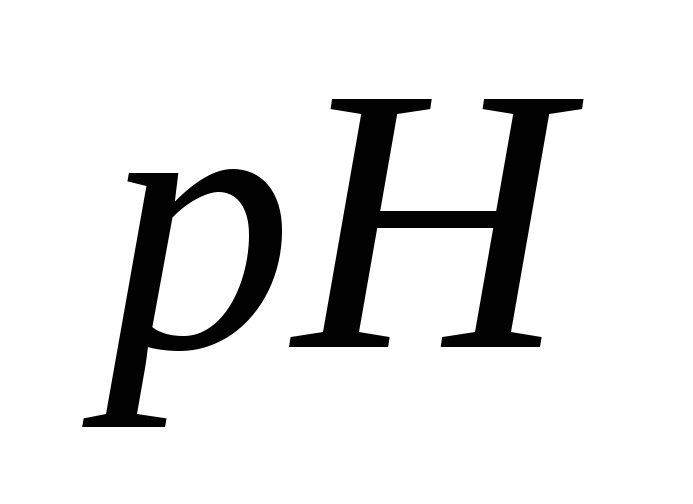 ацетатной буферной смеси, содержащей
по 0,1 моль/дм3уксусной кислоты
и ацетата натрия. Для чего применяются
буферные растворы? Что такое буферная
емкость?
ацетатной буферной смеси, содержащей
по 0,1 моль/дм3уксусной кислоты
и ацетата натрия. Для чего применяются
буферные растворы? Что такое буферная
емкость?Как изменится
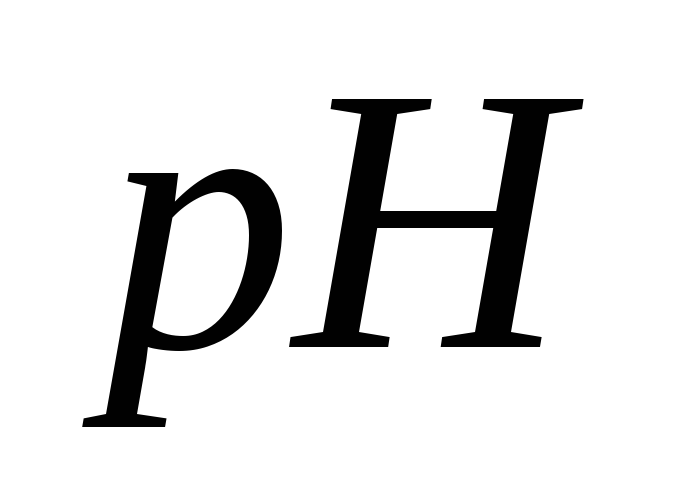 аммонийной буферной смеси, содержащей
по 0,1 моль в 1 дм3гидроксида
и хлорида аммония, при добавлении к
1 дм3смеси 0,01 моль соляной
кислоты.
аммонийной буферной смеси, содержащей
по 0,1 моль в 1 дм3гидроксида
и хлорида аммония, при добавлении к
1 дм3смеси 0,01 моль соляной
кислоты.Вычислите произведение растворимости гидроксида магния, если его растворимость в 1 дм3воды равна 0,0120 г.
Вычислите растворимость хлорида свинца в воде, если ПР =
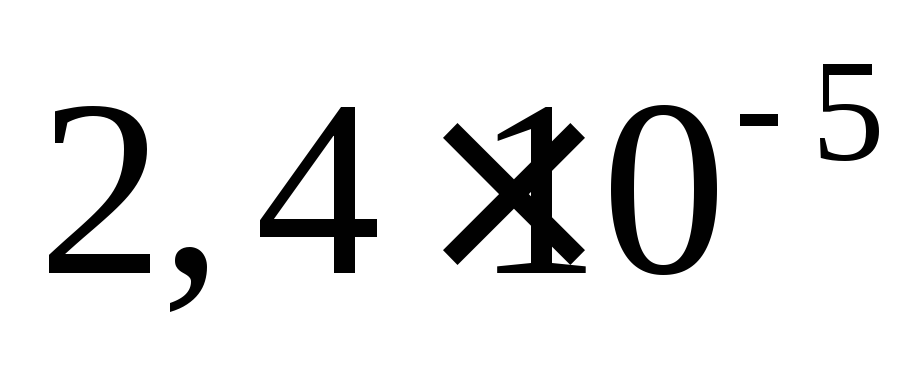 .
.Выпадет ли осадок, если смешать 30 см 0,003 моль/дм3раствора хромата калия и 20 см30,0002 моль/дм3раствора нитрата серебра? (ПР =
 ).
).
Гравиметрия (весовой анализ)
Цель и задачи работы
Усвоение принципов гравиметрического анализа, его теории и практики. Отработка навыков проведения определений элементов и веществ, технологии выполнения отдельных операций: осаждение, декантация, фильтрование, сушка, прокаливание, взвешивание и др. Изучение условий применения различных реагентов — осадителей. Выполнение контрольного определения (анализ раствора вещества неизвестной концентрации).
Программа работы Приборы и реактивы.
Муфельная печь;
Технохимические весы;
Аналитические весы;
Водяная баня;
Эксикатор;
Стеклянные палочки;
Стеклянные воронки;
Фарфоровые тигли;
Стеклянные фильтры № 3-20;
Щипцы тигельные;
Термостат;
Химические стаканы вместимостью 100, 200 и 250 см3;
Мерный цилиндр вместимостью 100 см3;
Пипетки;
Колба Бунзена;
Водоструйный или вакуумный насос;
Беззольные фильтры «синяя лента», «красная лента»;
Хлорид бария, водный раствор, С = 3 моль/дм3;
Хлороводородная кислота, водный раствор, С = 6 моль/дм3и С = 2 моль/дм3;
Гидроксид аммония, водный раствор, = 10% (масс.) и С = 2 моль/дм3;
Нитрат аммония, водный раствор, = 2% (масс);
Азотная кислота, концентрированная;
Диметилглиоксим динатриевая соль, водный раствор, = 1% (масс);
Йод, водно-спиртовой раствор, С = 0.025 моль/дм3;
Карбонат натрия, водный раствор,С = 1 моль/дм3;
Уксусная кислота концентрированная и водный раствор, = 20% (масс),= 5% (масс);
Пероксид водорода, водный раствор, = 30% (масс);
Гидроксид натрия, водный раствор, С = 2 моль/дм3;
Нитрон, раствор в 5%-ной уксусной кислоте, С = 0,1 моль/дм3;
-Нитрозо--нафтола (свежеприготовленный раствор). Растворяют 8 г-нитрозо--нафтола в 300 см3 концентрированной уксусной кислоты и разбавляют до 500 см3дистиллированной водой.
