
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия и физико-химические методы анализа»
- •Содержание
- •Часть I. Химические методы анализа
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов (в присутствии вольфрама)
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Выполнение реакций обнаружения анионов
- •Обнаружение карбонатов.
- •Обнаружение нитратов
- •Обнаружение ортофосфатов
- •Обнаружение силикатов
- •Обнаружение сульфидов
- •Обнаружение сульфатов
- •Обнаружение хлоридов
- •Вопросы для самоподготовки
- •Гравиметрия (весовой анализ)
- •Цель и задачи работы
- •Программа работы Приборы и реактивы.
- •Определение сульфатов
- •Ход работы.
- •Определение железа
- •Ход работы.
- •Определение никеля
- •Ход работы.
- •Вопросы для самоподготовки
- •Протолитометрический анализ
- •Ход работы
- •Контрольная задача. Определение уксусной кислоты.
- •Вопросы для самоподготовки.
- •Перманганатометрия.
- •Приготовление первичного стандарта щавелевой кислоты
- •Ход работы:
- •Контрольная задача. Определение железа (II)
- •Ход работы:
- •Вопросы для самоподготовки.
- •Иодометрия
- •Стандартизация рабочего раствора тиосульфата натрия (вторичного стандарта).
- •Ход работы:
- •Контрольная задача: Определение меди (II).
- •Ход определения:
- •Вопросы для самоподготовки.
- •Комплексонометрия.
- •Цель и задачи работы.
- •Оборудование и реактивы:
- •Программа работы
- •Определение кальция
- •Ход работы:
- •Определение железа
- •Ход работы
- •Вопросы для самоподготовки
- •Часть II. Инструментальные методы анализа
- •Определение калия по методу градуировочного графика
- •Ход работы:
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания калия в анализируемом растворе
- •Фотометрический анализ
- •Выбор светофильтра
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания меди (II) в анализируемом растворе
- •Определение железа (III) методом градуировочного графика
- •Фототурбидиметрия.
- •Ход работы:
- •Приготовление стандартных растворов и раствора сравнения:
- •Построение градуировочного графика:
- •Контрольная задача. Определение содержания в растворе.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Приборы и реактивы:
- •Ход работы:
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача Определение содержания сахара в анализируемом образце:
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Ход работы:
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Вопросы для самоподготовки
- •Потенциометрия
- •Цель и задачи работы
- •Программа работы
- •Определение хлородородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования.
- •Приборы и реактивы
- •Ход работы
- •Установление титра рабочего раствора
- •Подготовка анализируемого образца к титрованию
- •Подготовка иономера к работе в режиме определения рН
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце
- •Вопросы для самоподготовки.
- •Кондуктометрия.
- •Цель и задачи работы.
- •Программа работы.
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Приборы и реактивы:
- •Ход работы:
- •12.2.1.1. Установление титра рабочего раствора :
- •12.2.1.2. Подготовка анализируемого образца к титрованию:
- •12.2.1.3. Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси:
- •Определение ионовив их смеси.
- •Приборы и реактивы:
- •Подготовка анализируемого образца к титрованию:проводят по пункту 12.2.1.2.
- •Контрольная задача. Определение содержания солей никеля (II) и кальция в испытуемой смеси
- •Вопросы для самоконтроля.
- •13. Газохроматографический метод определения содержания токсичных микропримесей
- •13.1. Цель работы:
- •13.2. Объекты и средства исследования.
- •13.3. Программа работы
- •13.3.1. Приготовление градуировочных смесей
- •Условия хроматографирования с капиллярными колонками:
- •Литература:
Определение железа
Определение железа (III) основано на прямом титровании его раствором ЭДТА в присутствии салициловой или сульфосалициловой кислот, тайрона, роданидов, хромазурола S, бензогидроксамовой кислоты. Реакция протекает по уравнению
![]()
Железо (III) образует с ЭДТА
один из самых устойчивых комплексов,
![]() .
Высокое значение константы устойчивости
комплексоната железа позволяет проводить
титрование в кислых средах при
.
Высокое значение константы устойчивости
комплексоната железа позволяет проводить
титрование в кислых средах при![]() <3.
Наиболее удобно проводить титрование
при
<3.
Наиболее удобно проводить титрование
при![]() =2,5,
при данной кислотности раствора логарифм
условной константы устойчивости
комплексоната железа равен
=2,5,
при данной кислотности раствора логарифм
условной константы устойчивости
комплексоната железа равен
![]() .
Титрование железа возможно и при более
низких значениях
.
Титрование железа возможно и при более
низких значениях![]() раствора, но при этом значительно
возрастает коэффициент побочных реакций
ЭДТА, что приводит к уменьшению условной
константы устойчивости комплексоната
железа, следовательно, к увеличению
погрешности определения.
раствора, но при этом значительно
возрастает коэффициент побочных реакций
ЭДТА, что приводит к уменьшению условной
константы устойчивости комплексоната
железа, следовательно, к увеличению
погрешности определения.
Железо (II) также образует с ЭДТА комплекс,
но устойчивость этого комплекса (![]() )
значительно меньше устойчивости
комплексоната железа (III). При
)
значительно меньше устойчивости
комплексоната железа (III). При![]() =2,5
железо (II) с ЭДТА не взаимодействует,
поэтому перед титрованием его необходимо
окислить до железа (III) нагреванием с
=2,5
железо (II) с ЭДТА не взаимодействует,
поэтому перед титрованием его необходимо
окислить до железа (III) нагреванием с
![]() или добавлением пероксида водорода.
Определение в кислых средах более
избирательно. Определению железа (III)
не мешают
или добавлением пероксида водорода.
Определение в кислых средах более
избирательно. Определению железа (III)
не мешают![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ,
,
![]() .
.
Ход работы
Анализируемый раствор в мерной колбе вместимостью 100 мл доводят до метки дистиллированной водой и тщательно перемешивают.
В коническую колбу для титрования переносят аликвотную часть раствора (10 см3), добавляют 5 см3ацетатного буферного раствора, нагревают до 60 °С, добавляют 1 см3раствора сульфосалициловой кислоты и титруют раствором ЭДТА до изменения окраски раствора от красно-фиолетовой к желтой.
Титрование повторяют 3-5 раз до получения не менее трех сходящихся результатов титрования. Результаты заносят в таблицу 6.2:
Результаты титрования раствора железа (III) раствором ЭДТА.
Таблица 6.2.
|
№ п/п |
V( Na2H2Y), См3 |
С(1/1 Na2H2Y), моль/дм3 |
V(Fe(III), см3 |
С(1/1 Fe(III), моль/дм3 |
Т(Fe(III), г/см3 |
|
|
|
|
|
|
|
Используя средний объем титранта, израсходованного на титрование, рассчитывают содержание железа (III) в растворе и количество определяемого вещества, учитывая, что в точке эквивалентности образуется комплекс состава 1:1.
Вопросы для самоподготовки
Перечислите основные требования к реакциям, применяемым в методе комплексометрического титрования?
Какие факторы влияют на величину титрования?
Чем объясняется ограниченность применения неорганических реагентов в комплексометрическом титровании?
Назовите способы обнаружения конечной точки титрования.
Объясните сущность прямого, обратного, вытеснительного и косвенного приёмов комплексометрического титрования. В каких случаях применяется каждый из названных приёмов?
Что такое металлохромные индикаторы?
Напишите равновесие в растворе металлохромного индикатора.
Приведите графическую формулу ЭДТА. Какова дентатность ЭДТА?
Какова стехиометрия компонентов ЭДТА? Приведите графическую формулу комплексов двух- и трёхзарядных ионов металлов с ЭДТА.
Напишите уравнения реакций образования протонированных, нормальных и гидроксокомплексов ЭДТА.
Как готовят раствор ЭДТА?
Какие вещества могут быть использованы для стандартизации раствора ЭДТА?
В каких условиях проводят титрование ионов кальция раствором ЭДТА?
Как проводят комплексометрическое определение кальция и магния при совместном присутствии?
Почему следует удалить аммонийные соли при титровании кальция в присутствии магния?
В каких условиях проводят титрование железа (III) раствором ЭДТА? Укажите состав комплекса железа с сульфосалициловой кислотой в условиях проведения титрования.
Почему ионы трёхвалентных металлов титруют раствором ЭДТА в кислой среде, а щёлочноземельных — в щелочной?
Как можно предотвратить образование гидроксидов ионов металлов
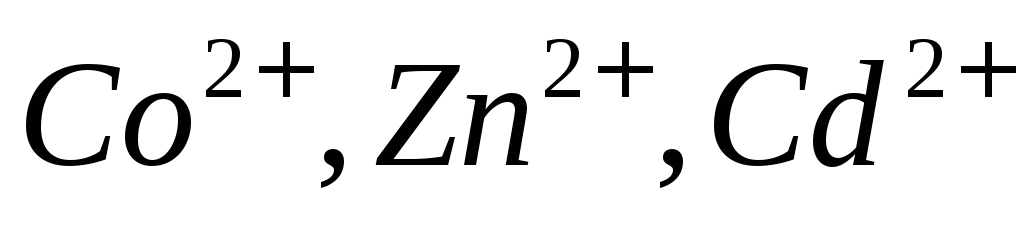 при их титровании раствором ЭДТА в
щелочной среде?
при их титровании раствором ЭДТА в
щелочной среде?Предложите способ комплексометрического определения ионов
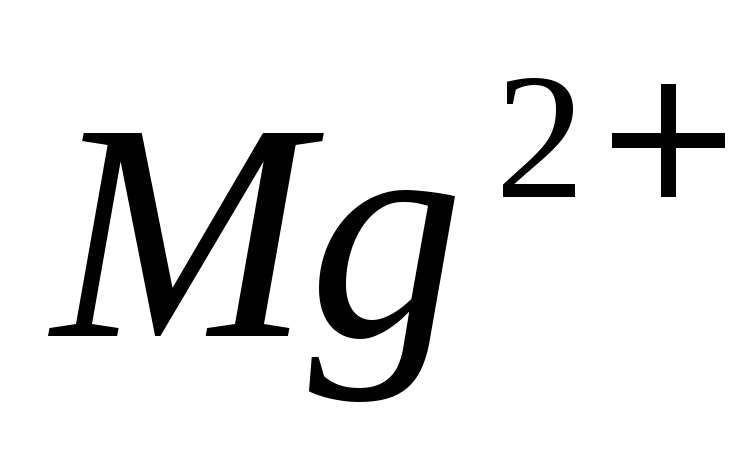 в присутствии
в присутствии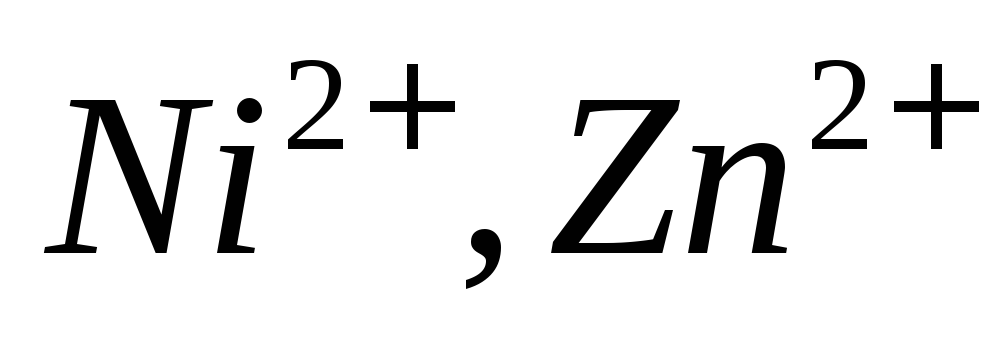 ,
ионов
,
ионов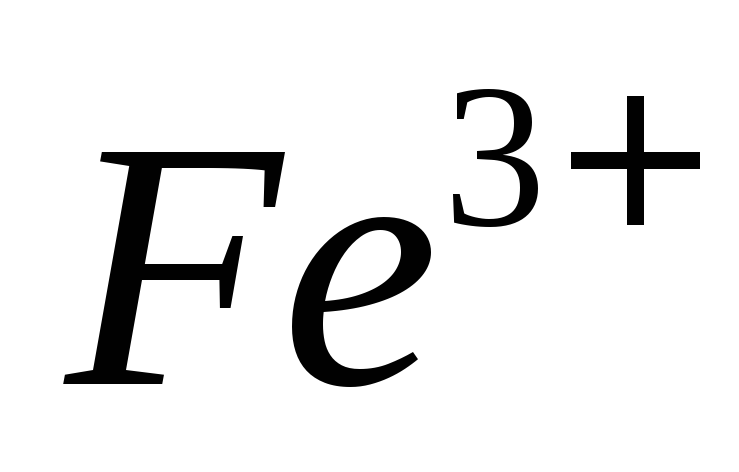 в присутствии
в присутствии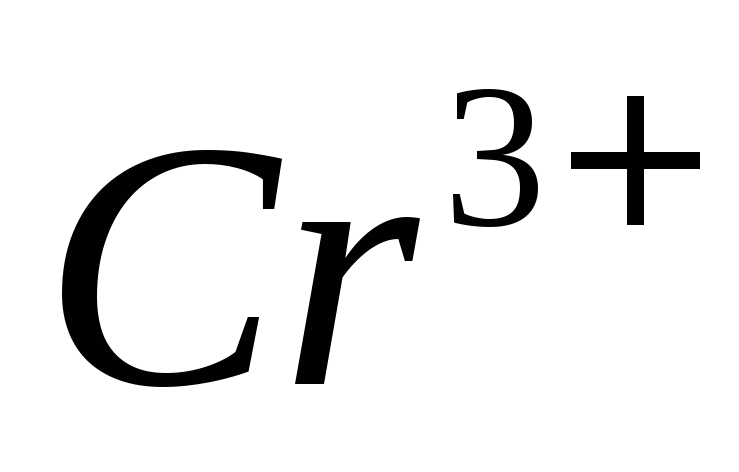 ,
ионов
,
ионов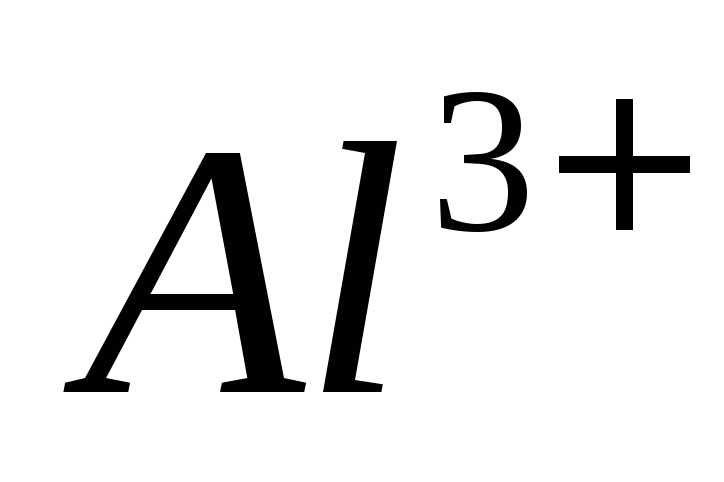 в присутствии
в присутствии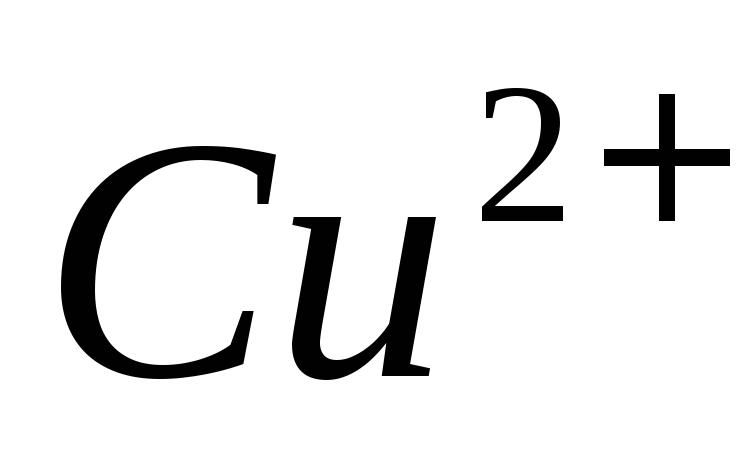 .
.Рассчитайте навеску металлического цинка для установления характеристик ЭДТА методом отдельных навесок, чтобы на её титрование после растворения расходовалось 10,00 мл 0,0505 М раствора ЭДТА. Ответ: 0,0330 г.
Из навески 1,200 г образца, содержащего хромат калия, приготовлен раствор в мерной колбе вместимостью 100 мл. К 25,00 мл полученного раствора прилит избыток раствора нитрата свинца. Полученный осадок отфильтровали, промыли, перевели в раствор и обработали 10,00 мл 0,1000 М раствора ЭДТА, избыток которого оттитровали 8,00 мл 0,05105 М раствора
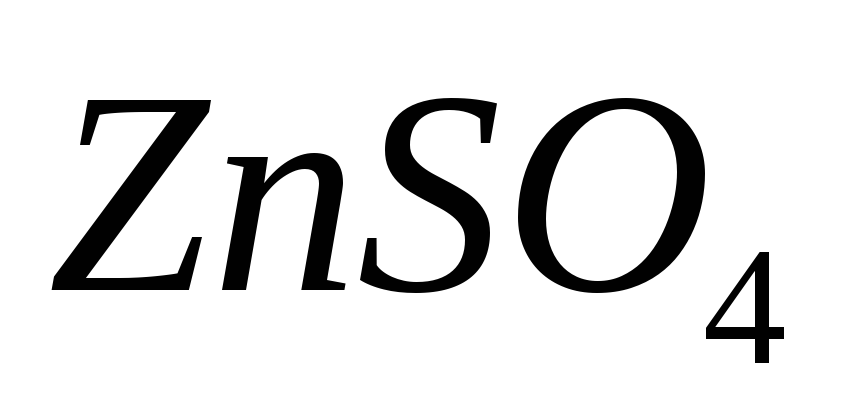 .
Рассчитайте процентное содержание
хромат-ионов в образце.
Ответ: 23,27%.
.
Рассчитайте процентное содержание
хромат-ионов в образце.
Ответ: 23,27%.Вычислите процентное содержание
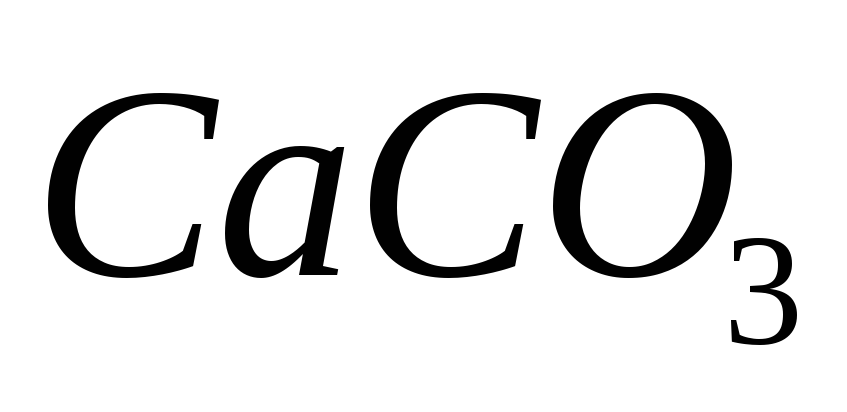 и
и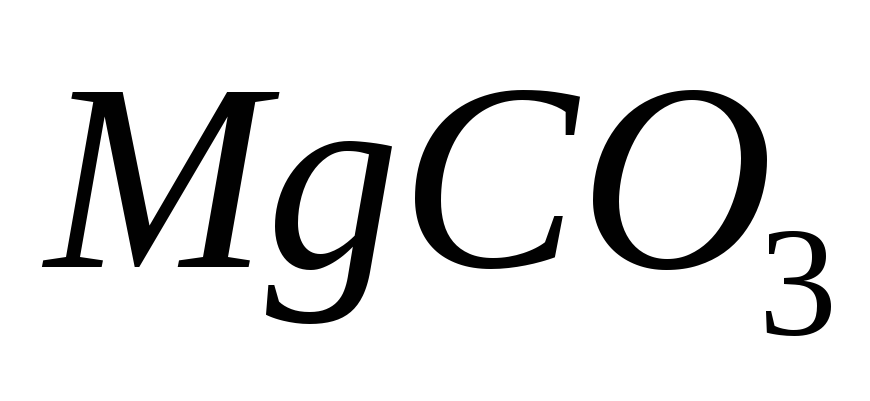 в известняке, если после растворения
1,0000 г пробы и соответствующей обработки
раствора довели водой до 100 мл, на
титрование 20 мл для определения суммы
в известняке, если после растворения
1,0000 г пробы и соответствующей обработки
раствора довели водой до 100 мл, на
титрование 20 мл для определения суммы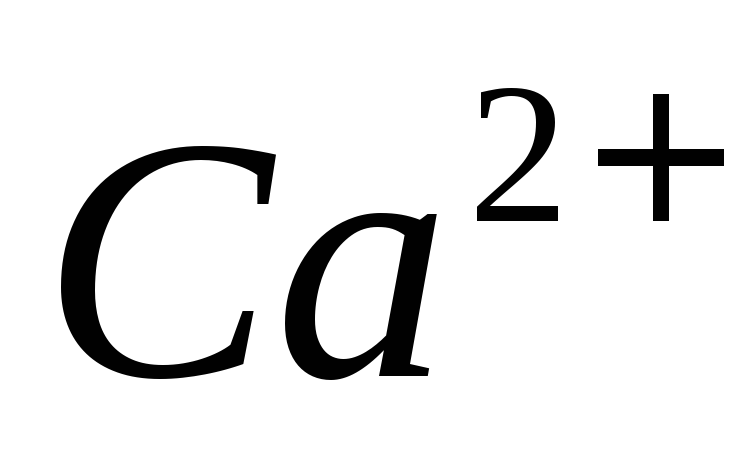 и
и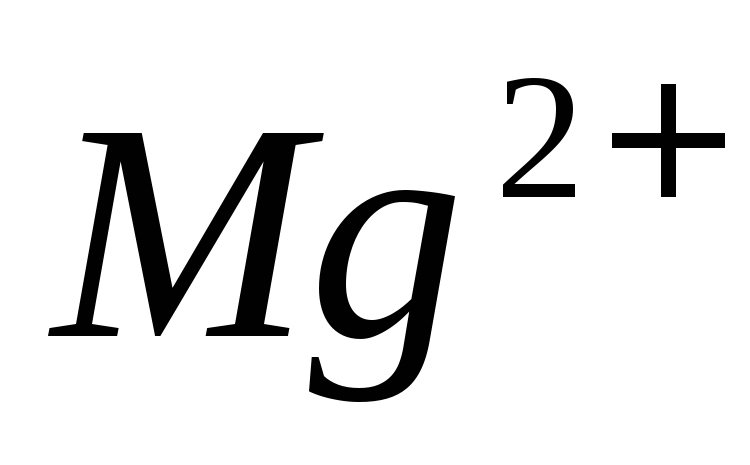 затратили 19,25 мл 0,05140 М раствора ЭДТА,
а на титрование
затратили 19,25 мл 0,05140 М раствора ЭДТА,
а на титрование израсходовали 6,26 мл раствора ЭДТА.
Ответ:
израсходовали 6,26 мл раствора ЭДТА.
Ответ: — 16,0 %;
— 16,0 %;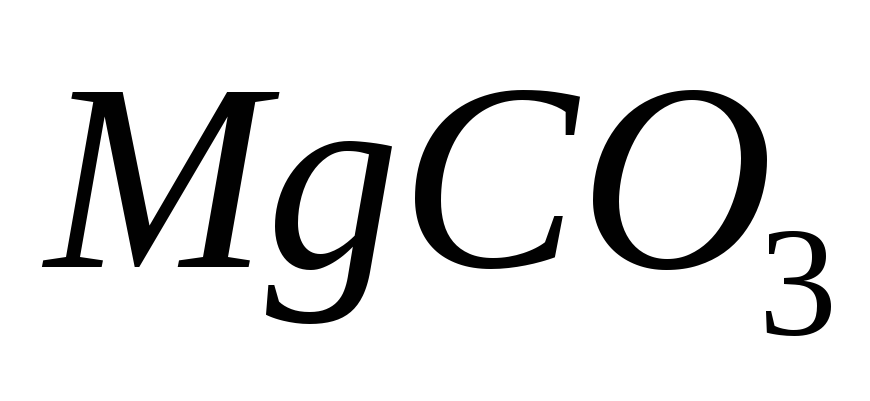 — 28,1 %.
— 28,1 %.
Инструментальные методы анализа
