
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия и физико-химические методы анализа»
- •Содержание
- •Часть I. Химические методы анализа
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов (в присутствии вольфрама)
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Выполнение реакций обнаружения анионов
- •Обнаружение карбонатов.
- •Обнаружение нитратов
- •Обнаружение ортофосфатов
- •Обнаружение силикатов
- •Обнаружение сульфидов
- •Обнаружение сульфатов
- •Обнаружение хлоридов
- •Вопросы для самоподготовки
- •Гравиметрия (весовой анализ)
- •Цель и задачи работы
- •Программа работы Приборы и реактивы.
- •Определение сульфатов
- •Ход работы.
- •Определение железа
- •Ход работы.
- •Определение никеля
- •Ход работы.
- •Вопросы для самоподготовки
- •Протолитометрический анализ
- •Ход работы
- •Контрольная задача. Определение уксусной кислоты.
- •Вопросы для самоподготовки.
- •Перманганатометрия.
- •Приготовление первичного стандарта щавелевой кислоты
- •Ход работы:
- •Контрольная задача. Определение железа (II)
- •Ход работы:
- •Вопросы для самоподготовки.
- •Иодометрия
- •Стандартизация рабочего раствора тиосульфата натрия (вторичного стандарта).
- •Ход работы:
- •Контрольная задача: Определение меди (II).
- •Ход определения:
- •Вопросы для самоподготовки.
- •Комплексонометрия.
- •Цель и задачи работы.
- •Оборудование и реактивы:
- •Программа работы
- •Определение кальция
- •Ход работы:
- •Определение железа
- •Ход работы
- •Вопросы для самоподготовки
- •Часть II. Инструментальные методы анализа
- •Определение калия по методу градуировочного графика
- •Ход работы:
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания калия в анализируемом растворе
- •Фотометрический анализ
- •Выбор светофильтра
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания меди (II) в анализируемом растворе
- •Определение железа (III) методом градуировочного графика
- •Фототурбидиметрия.
- •Ход работы:
- •Приготовление стандартных растворов и раствора сравнения:
- •Построение градуировочного графика:
- •Контрольная задача. Определение содержания в растворе.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Приборы и реактивы:
- •Ход работы:
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача Определение содержания сахара в анализируемом образце:
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Ход работы:
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Вопросы для самоподготовки
- •Потенциометрия
- •Цель и задачи работы
- •Программа работы
- •Определение хлородородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования.
- •Приборы и реактивы
- •Ход работы
- •Установление титра рабочего раствора
- •Подготовка анализируемого образца к титрованию
- •Подготовка иономера к работе в режиме определения рН
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце
- •Вопросы для самоподготовки.
- •Кондуктометрия.
- •Цель и задачи работы.
- •Программа работы.
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Приборы и реактивы:
- •Ход работы:
- •12.2.1.1. Установление титра рабочего раствора :
- •12.2.1.2. Подготовка анализируемого образца к титрованию:
- •12.2.1.3. Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси:
- •Определение ионовив их смеси.
- •Приборы и реактивы:
- •Подготовка анализируемого образца к титрованию:проводят по пункту 12.2.1.2.
- •Контрольная задача. Определение содержания солей никеля (II) и кальция в испытуемой смеси
- •Вопросы для самоконтроля.
- •13. Газохроматографический метод определения содержания токсичных микропримесей
- •13.1. Цель работы:
- •13.2. Объекты и средства исследования.
- •13.3. Программа работы
- •13.3.1. Приготовление градуировочных смесей
- •Условия хроматографирования с капиллярными колонками:
- •Литература:
Приборы и реактивы:
Кондуктометр КП – 001.
Магнитная мешалка.
Стакан вместимостью 250 см3.
Мерная колба вместимостью 100 см3.
Бюретка вместимостью 25 см3.
Пипетка вместимостью 10 см3.
Гидроксид натрия, раствор
 = 0,1 моль/дм3.
= 0,1 моль/дм3.Борная кислота, раствор
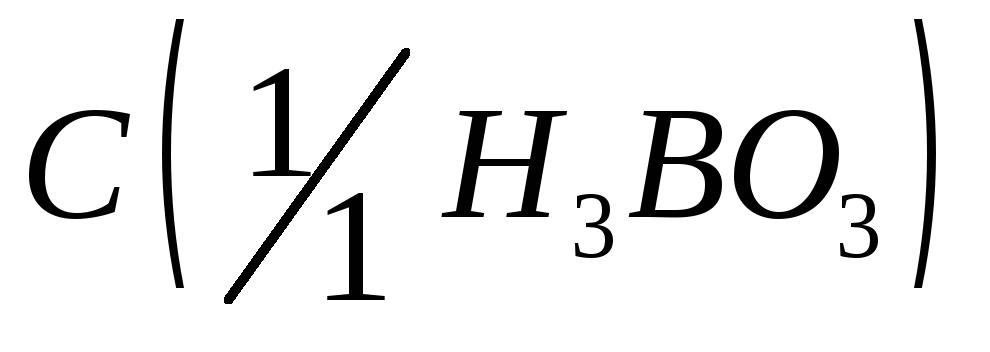 = 1 моль/дм3.
= 1 моль/дм3.Гидрохлорид гидроксиламина, раствор
 = 1 моль/дм3 .
= 1 моль/дм3 .
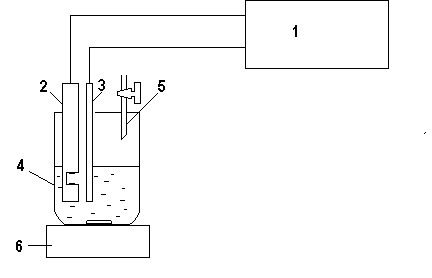
Рис. 12.1. Схема установки для кондуктометрического титрования: 1. Измерительный преобразователь кондуктометра. 2. Кондуктометрический датчик. 3. Температурный датчик. 4. Ячейка. 5. Бюретка. 6. Магнитная мешалка.
Ход работы:
12.2.1.1. Установление титра рабочего раствора :
проводят по пункту 11.2.1.1.
12.2.1.2. Подготовка анализируемого образца к титрованию:
Испытуемый раствор переносят в мерную колбу объемом 100 см3 и доводят его объем до метки дистиллированной водой.
12.2.1.3. Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси:
Пипеткой переносят аликвотную часть раствора (10 см3) в ячейку для кондуктометрического титрования и доводят объем его до 250 см3 дистиллированной водой.
Опускают кондуктометрический датчик и якорь магнитной мешалки в раствор. Раствор должен полностью покрывать рабочую часть датчика.
Включают перемешивание и нажимают кнопку включения на измерительном преобразователе кондуктометра. Записывают значение удельной электропроводности раствора.
При непрерывном перемешивании из бюретки приливают раствор гидроксида натрия (с точным титром определенным по пункту 12.2.1.I) порциями по 0,5 см3 и регистрируют электропроводность получаемых растворов.
Титрование повторяют 3-5 раз.
Результаты измерений записать в таблицу 12.1:
Данные для построения кривой кондуктометрического титрования.
Таблица 12.1.
|
№ точки |
Объем раствора титранта
|
Удельная электропроводность
|
|
|
|
|
|
|
Строят кривые титрования в координатах
 и координатах
и координатах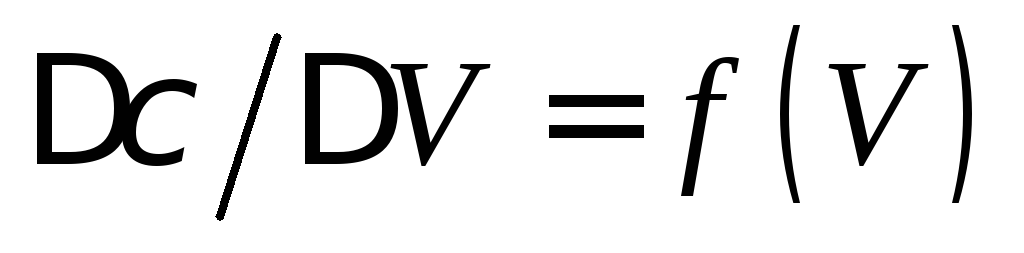 (см. пункт 12.2.1.4).
(см. пункт 12.2.1.4).Находят средний объем раствора
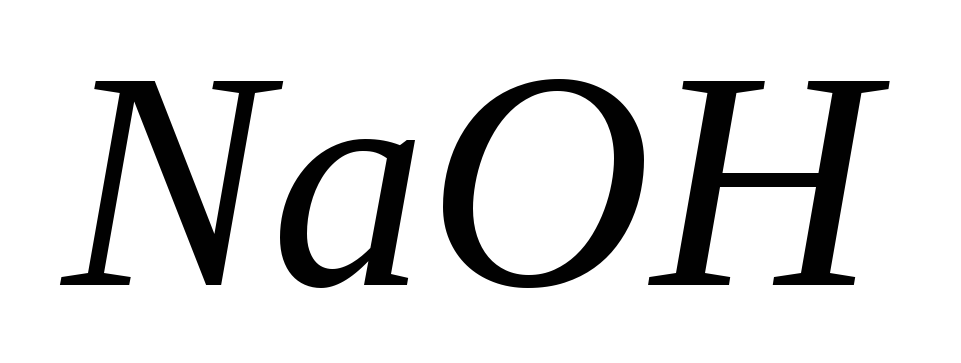 ,
израсходованный на титрование, и
выполняют расчет содержания борной
кислоты и солянокислого гидроксиламина
в испытуемом образце в граммах по
известной формуле с учетом разбавления.
,
израсходованный на титрование, и
выполняют расчет содержания борной
кислоты и солянокислого гидроксиламина
в испытуемом образце в граммах по
известной формуле с учетом разбавления.
Определение ионовив их смеси.
Определение ионов
![]() и
и![]() основано на реакции комплексообразования
ионов металлов с двунатриевой солью
этилендиаминтетрауксусной кислоты
(ЭДТА, сокращенная запись
основано на реакции комплексообразования
ионов металлов с двунатриевой солью
этилендиаминтетрауксусной кислоты
(ЭДТА, сокращенная запись![]() ).
В зависимости от
).
В зависимости от![]() среды при титровании могут образовываться
средние и протонированные комплексонаты,
а также различные продукты диссоциации
этилендиаминтетрауксусной кислоты.
среды при титровании могут образовываться
средние и протонированные комплексонаты,
а также различные продукты диссоциации
этилендиаминтетрауксусной кислоты.
При титровании ЭДТА
солей металлов в растворах, не содержащих
буферных смесей, на кривой титрования
имеется максимум, соответствующий точке
эквивалентности. До точки эквивалентности
электропроводность раствора растет за
счет увеличения концентрации наиболее
подвижных ионов
![]() в соответствии с реакцией, происходящей,
например, при
в соответствии с реакцией, происходящей,
например, при![]() :
:
![]()
После точки эквивалентности
электропроводность раствора уменьшается
в результате связывания
![]() избытком титранта в малодиссоциированную
кислоту:
избытком титранта в малодиссоциированную
кислоту:
![]()
![]()
Если при титровании
образуется средний комплексонат высокой
устойчивости, характеризующийся
![]() (например,
(например,![]() ),
то титрование можно проводить в отсутствии
буферного раствора. Титрование иона
),
то титрование можно проводить в отсутствии
буферного раствора. Титрование иона![]() проводят в присутствии аммиачного
буферного раствора. При этом не происходит
разрушения ранее образовавшегося
комплексоната никеля, так как
проводят в присутствии аммиачного
буферного раствора. При этом не происходит
разрушения ранее образовавшегося
комплексоната никеля, так как![]() .
.
