
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия и физико-химические методы анализа»
- •Содержание
- •Часть I. Химические методы анализа
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов (в присутствии вольфрама)
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Выполнение реакций обнаружения анионов
- •Обнаружение карбонатов.
- •Обнаружение нитратов
- •Обнаружение ортофосфатов
- •Обнаружение силикатов
- •Обнаружение сульфидов
- •Обнаружение сульфатов
- •Обнаружение хлоридов
- •Вопросы для самоподготовки
- •Гравиметрия (весовой анализ)
- •Цель и задачи работы
- •Программа работы Приборы и реактивы.
- •Определение сульфатов
- •Ход работы.
- •Определение железа
- •Ход работы.
- •Определение никеля
- •Ход работы.
- •Вопросы для самоподготовки
- •Протолитометрический анализ
- •Ход работы
- •Контрольная задача. Определение уксусной кислоты.
- •Вопросы для самоподготовки.
- •Перманганатометрия.
- •Приготовление первичного стандарта щавелевой кислоты
- •Ход работы:
- •Контрольная задача. Определение железа (II)
- •Ход работы:
- •Вопросы для самоподготовки.
- •Иодометрия
- •Стандартизация рабочего раствора тиосульфата натрия (вторичного стандарта).
- •Ход работы:
- •Контрольная задача: Определение меди (II).
- •Ход определения:
- •Вопросы для самоподготовки.
- •Комплексонометрия.
- •Цель и задачи работы.
- •Оборудование и реактивы:
- •Программа работы
- •Определение кальция
- •Ход работы:
- •Определение железа
- •Ход работы
- •Вопросы для самоподготовки
- •Часть II. Инструментальные методы анализа
- •Определение калия по методу градуировочного графика
- •Ход работы:
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания калия в анализируемом растворе
- •Фотометрический анализ
- •Выбор светофильтра
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания меди (II) в анализируемом растворе
- •Определение железа (III) методом градуировочного графика
- •Фототурбидиметрия.
- •Ход работы:
- •Приготовление стандартных растворов и раствора сравнения:
- •Построение градуировочного графика:
- •Контрольная задача. Определение содержания в растворе.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Приборы и реактивы:
- •Ход работы:
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача Определение содержания сахара в анализируемом образце:
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Ход работы:
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Вопросы для самоподготовки
- •Потенциометрия
- •Цель и задачи работы
- •Программа работы
- •Определение хлородородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования.
- •Приборы и реактивы
- •Ход работы
- •Установление титра рабочего раствора
- •Подготовка анализируемого образца к титрованию
- •Подготовка иономера к работе в режиме определения рН
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце
- •Вопросы для самоподготовки.
- •Кондуктометрия.
- •Цель и задачи работы.
- •Программа работы.
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Приборы и реактивы:
- •Ход работы:
- •12.2.1.1. Установление титра рабочего раствора :
- •12.2.1.2. Подготовка анализируемого образца к титрованию:
- •12.2.1.3. Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси:
- •Определение ионовив их смеси.
- •Приборы и реактивы:
- •Подготовка анализируемого образца к титрованию:проводят по пункту 12.2.1.2.
- •Контрольная задача. Определение содержания солей никеля (II) и кальция в испытуемой смеси
- •Вопросы для самоконтроля.
- •13. Газохроматографический метод определения содержания токсичных микропримесей
- •13.1. Цель работы:
- •13.2. Объекты и средства исследования.
- •13.3. Программа работы
- •13.3.1. Приготовление градуировочных смесей
- •Условия хроматографирования с капиллярными колонками:
- •Литература:
Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце
В стакан для титрования отбирают аликвотную часть анализируемого раствора (5-10 см3).
Проводят ориентировочное и точное титрование раствором
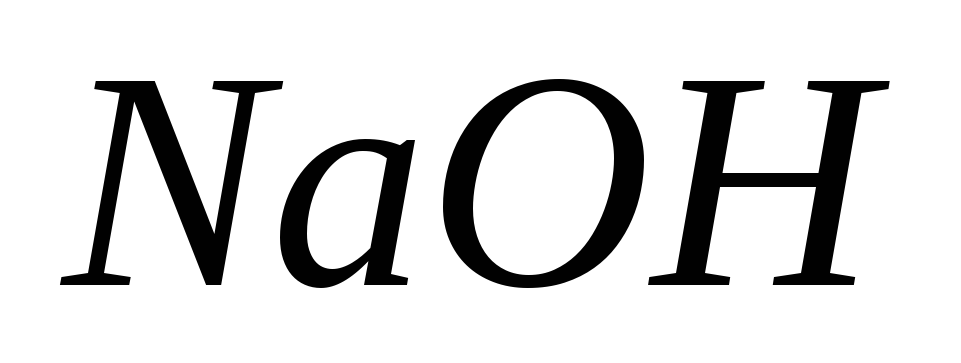 с точным титром, обнаруживая два скачка
потенциала (первый – небольшой и второй
– основной). Результаты записывают в
таблицу 11.1.
с точным титром, обнаруживая два скачка
потенциала (первый – небольшой и второй
– основной). Результаты записывают в
таблицу 11.1.
Таблица 11.1.
|
№ точки |
Объем раствора титранта, см3 |
РН |
рН/V |
|
|
|
|
|
Титрование повторяют 2-3 раза.
Строят кривые титрования в координатах
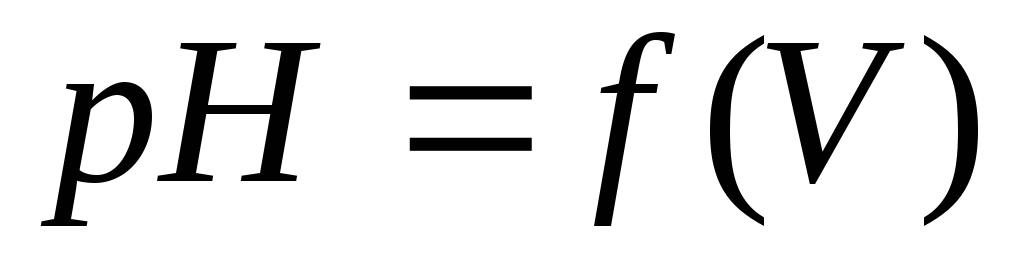 и
и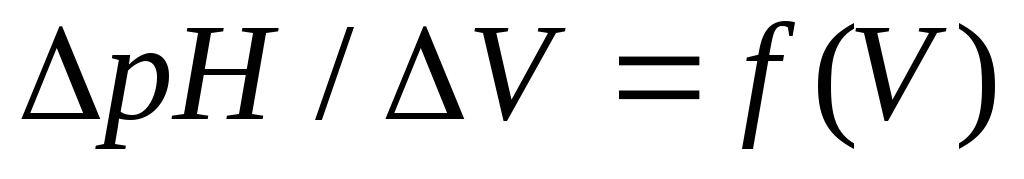 .
.По второму скачку находят средний объем раствора
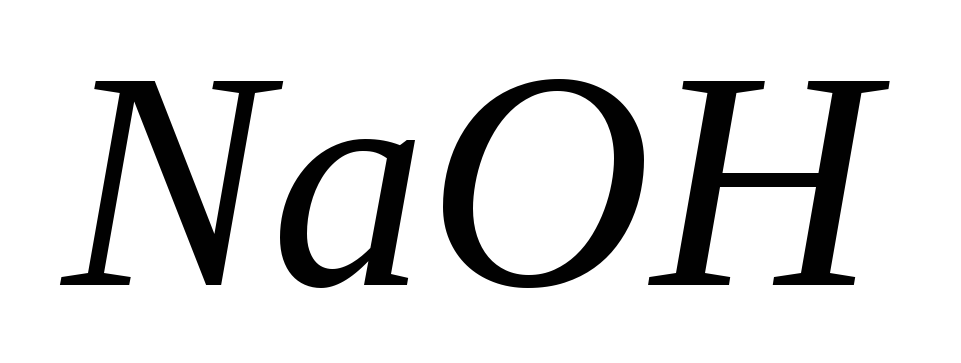 ,
израсходованный на титрование суммы
кислот.
,
израсходованный на титрование суммы
кислот.Для определения содержания хлороводородной кислоты отбирают аликвотную часть испытуемого раствора (10 см3), к ней приливают двойной объем ацетона и проводят потенциометрическое титрование раствором
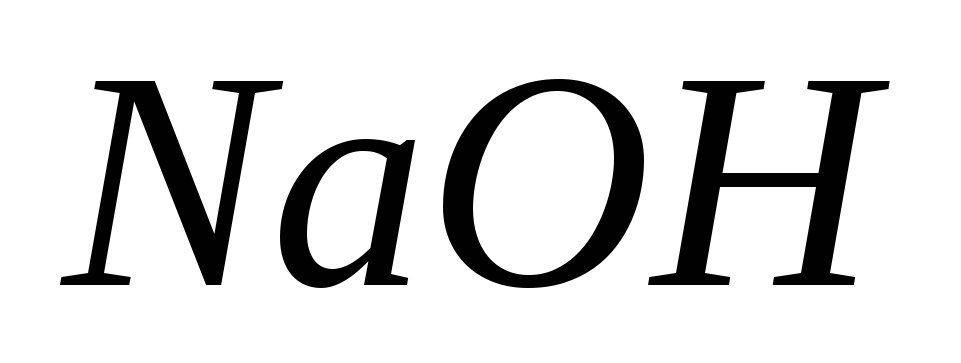 c точным титром (см. пункт 11.2.1.1).
c точным титром (см. пункт 11.2.1.1).Титрование повторяют 2-3 раза.
Строят кривые титрования в координатах
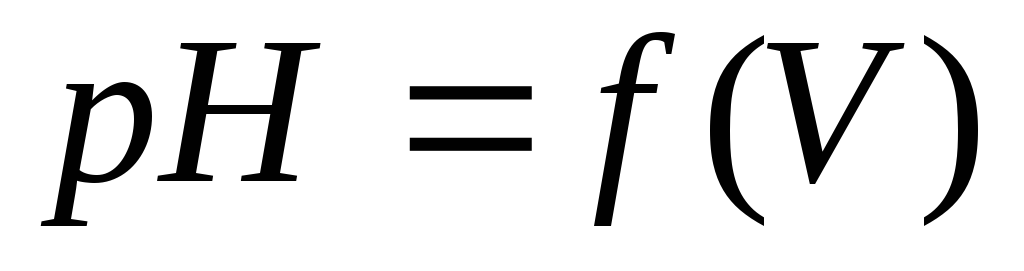 и
и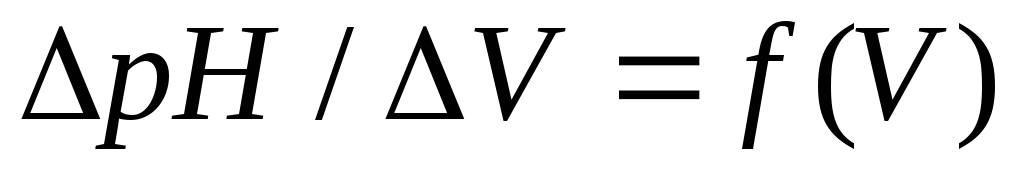 и находят средний объем раствора
и находят средний объем раствора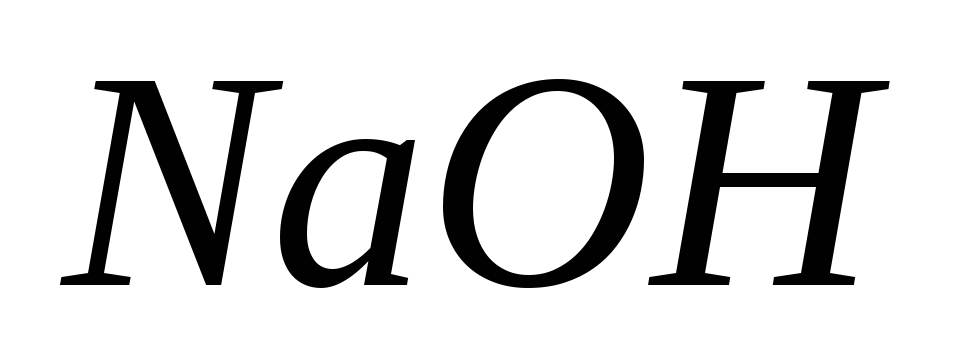 ,
пошедшего на титрование хлороводородной
кислоты, по первому скачку потенциала.
,
пошедшего на титрование хлороводородной
кислоты, по первому скачку потенциала.Рассчитывают содержание хлороводородной кислоты в граммах и молях по известной формуле.
Рассчитывают содержание уксусной кислоты в граммах и молях (по разности объемов титранта, затраченных на суммарное титрование обоих кислот в водном растворе и на титрование хлороводородной кислоты в водно-ацетоновой среде).
Вопросы для самоподготовки.
На чем основаны потенциометрические методы анализа?
Что представляют собою электроды I,IIиIIIрода? Приведите примеры.
Какие функции выполняют индикаторные электроды и какие – электроды сравнения? Какие требования к ним предъявляются?
На каком принципе основана работа ионселективных электродов? Их классификация и принцип действия.
В чем сущность потенциометрического определения рНраствора? Какие индикаторные электроды могут быть использованы для определениярН?
Указать область применения, достоинства и недостатки прямой потенциометрии.
В чем сущность некомпенсационного метода потенциометрического титрования и титрования под током?
Чем обусловлен выбор пары электродов? Выбор координат для построения кривых титрования? Привести примеры с использованием различных типов реакций: нейтрализации, редоксиметрии, осаждения, комплексообразования.
Как найти точку эквивалентности при потенциометрическом титровании?
В чем достоинства и недостатки метода потенциометрического титрования? Назовите области его применения.
Кондуктометрия.
Цель и задачи работы.
Изучение возможностей и аппаратурного оформления кондуктометрии, овладение приемами практического применения кондуктометрического титрования.
Программа работы.
Определение слабой кислоты и соли слабого основания в их смеси.
При титровании сильным основанием смесей кислот с солями слабых оснований в растворе реализуются следующие равновесия:
![]()
![]()
Из расчета теоретических
кривых титрования следует, что при
значениях
![]() — сначала реагирует кислота, а затем
вытесняется слабое основание из его
соли; при
— сначала реагирует кислота, а затем
вытесняется слабое основание из его
соли; при![]() — реакция вытеснения слабого основания
из соли предшествует реакции взаимодействия
кислоты с титрантом; при значениях
— реакция вытеснения слабого основания
из соли предшествует реакции взаимодействия
кислоты с титрантом; при значениях![]() — обе реакции протекают параллельно,
дифференцированное титрование невозможно.
— обе реакции протекают параллельно,
дифференцированное титрование невозможно.
Для борной кислоты
![]() ;
для гидрохлорида гидроксиламина
;
для гидрохлорида гидроксиламина![]() ;
следовательно
;
следовательно![]() ,
то есть сначала титруется соль
гидроксиламина, а затем кислота.
,
то есть сначала титруется соль
гидроксиламина, а затем кислота.
