
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия и физико-химические методы анализа»
- •Содержание
- •Часть I. Химические методы анализа
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов (в присутствии вольфрама)
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Выполнение реакций обнаружения анионов
- •Обнаружение карбонатов.
- •Обнаружение нитратов
- •Обнаружение ортофосфатов
- •Обнаружение силикатов
- •Обнаружение сульфидов
- •Обнаружение сульфатов
- •Обнаружение хлоридов
- •Вопросы для самоподготовки
- •Гравиметрия (весовой анализ)
- •Цель и задачи работы
- •Программа работы Приборы и реактивы.
- •Определение сульфатов
- •Ход работы.
- •Определение железа
- •Ход работы.
- •Определение никеля
- •Ход работы.
- •Вопросы для самоподготовки
- •Протолитометрический анализ
- •Ход работы
- •Контрольная задача. Определение уксусной кислоты.
- •Вопросы для самоподготовки.
- •Перманганатометрия.
- •Приготовление первичного стандарта щавелевой кислоты
- •Ход работы:
- •Контрольная задача. Определение железа (II)
- •Ход работы:
- •Вопросы для самоподготовки.
- •Иодометрия
- •Стандартизация рабочего раствора тиосульфата натрия (вторичного стандарта).
- •Ход работы:
- •Контрольная задача: Определение меди (II).
- •Ход определения:
- •Вопросы для самоподготовки.
- •Комплексонометрия.
- •Цель и задачи работы.
- •Оборудование и реактивы:
- •Программа работы
- •Определение кальция
- •Ход работы:
- •Определение железа
- •Ход работы
- •Вопросы для самоподготовки
- •Часть II. Инструментальные методы анализа
- •Определение калия по методу градуировочного графика
- •Ход работы:
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания калия в анализируемом растворе
- •Фотометрический анализ
- •Выбор светофильтра
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания меди (II) в анализируемом растворе
- •Определение железа (III) методом градуировочного графика
- •Фототурбидиметрия.
- •Ход работы:
- •Приготовление стандартных растворов и раствора сравнения:
- •Построение градуировочного графика:
- •Контрольная задача. Определение содержания в растворе.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Приборы и реактивы:
- •Ход работы:
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача Определение содержания сахара в анализируемом образце:
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Ход работы:
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Вопросы для самоподготовки
- •Потенциометрия
- •Цель и задачи работы
- •Программа работы
- •Определение хлородородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования.
- •Приборы и реактивы
- •Ход работы
- •Установление титра рабочего раствора
- •Подготовка анализируемого образца к титрованию
- •Подготовка иономера к работе в режиме определения рН
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце
- •Вопросы для самоподготовки.
- •Кондуктометрия.
- •Цель и задачи работы.
- •Программа работы.
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Приборы и реактивы:
- •Ход работы:
- •12.2.1.1. Установление титра рабочего раствора :
- •12.2.1.2. Подготовка анализируемого образца к титрованию:
- •12.2.1.3. Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси:
- •Определение ионовив их смеси.
- •Приборы и реактивы:
- •Подготовка анализируемого образца к титрованию:проводят по пункту 12.2.1.2.
- •Контрольная задача. Определение содержания солей никеля (II) и кальция в испытуемой смеси
- •Вопросы для самоконтроля.
- •13. Газохроматографический метод определения содержания токсичных микропримесей
- •13.1. Цель работы:
- •13.2. Объекты и средства исследования.
- •13.3. Программа работы
- •13.3.1. Приготовление градуировочных смесей
- •Условия хроматографирования с капиллярными колонками:
- •Литература:
Комплексонометрия.
Цель и задачи работы.
Закрепление знаний теории реакций комплексообразования и комплексометрического титрования на примере комплексонометрии. Получение навыков комплексонометрического титрования, использования металлоиндикаторов, проведения расчетов результатов анализа и их обработки.
Контрольная задача — определение ионов металлов в растворах неизвестной концентрации.
Оборудование и реактивы:
Бюретка вместимостью 25 см3;
Мерные колбы вместимостью 100, 250 и 500 см3;
Колбы для титрования вместимостью 250 см3;
Пипетки Мора на 5, 10, 15, 25 см3;
Аналитические весы с разновесами;
Набор ареометров;
ЭДТА, раствор
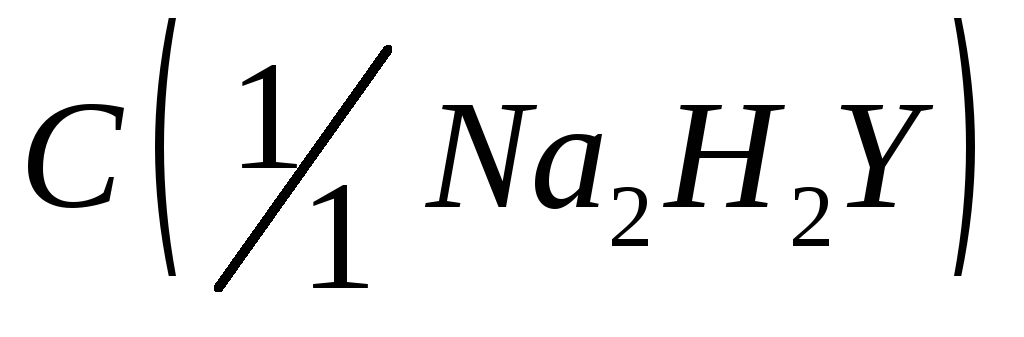 = 0,025 моль/дм3;
= 0,025 моль/дм3;Хлорид кальция, раствор
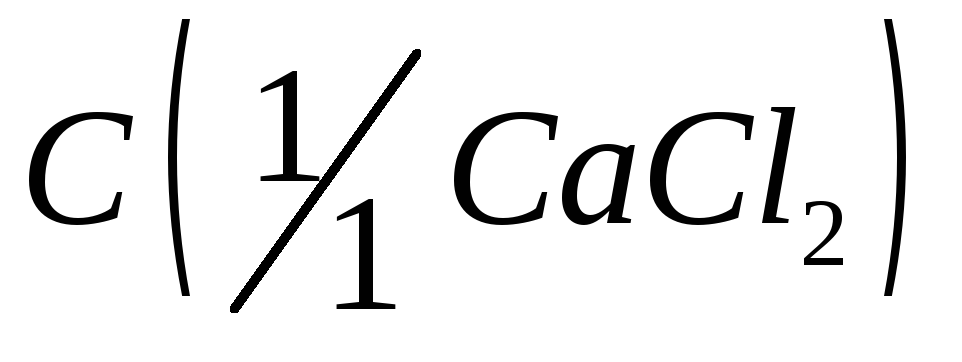 = 0,025 моль/дм3;
= 0,025 моль/дм3;Хлорид железа (III), раствор
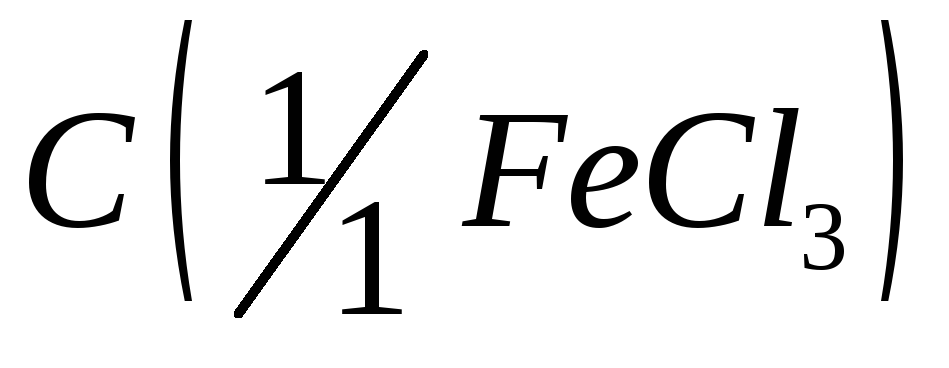 = 0,025 моль/дм3;
= 0,025 моль/дм3;Аммиачный буферный раствор с
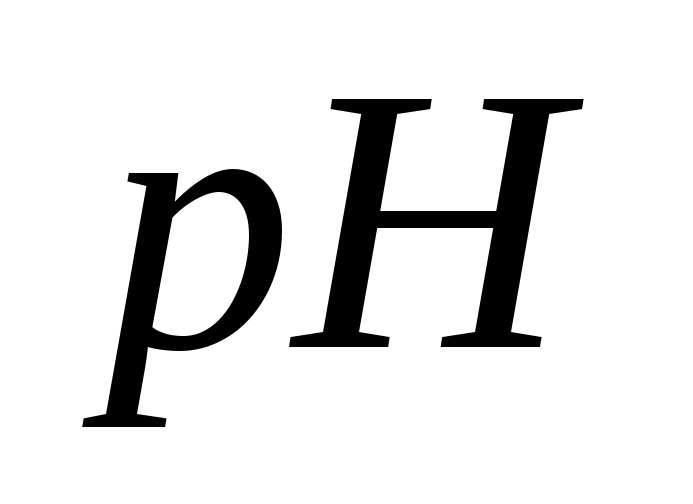 =10;
=10;Ацетатный буферный раствор,
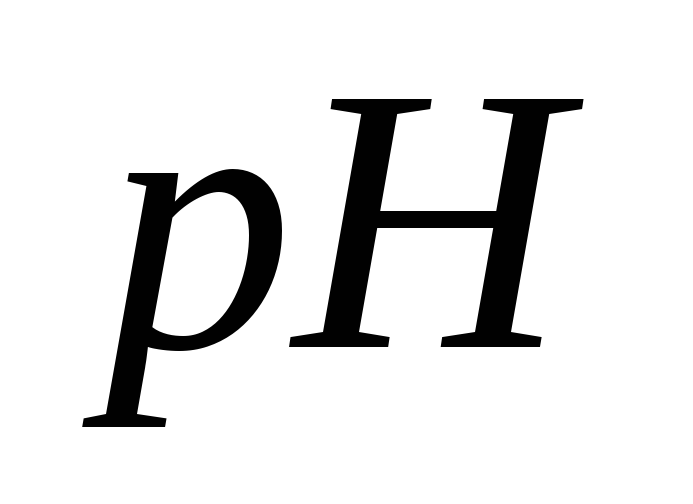 = 4,5;
= 4,5;Комплексонат магния,
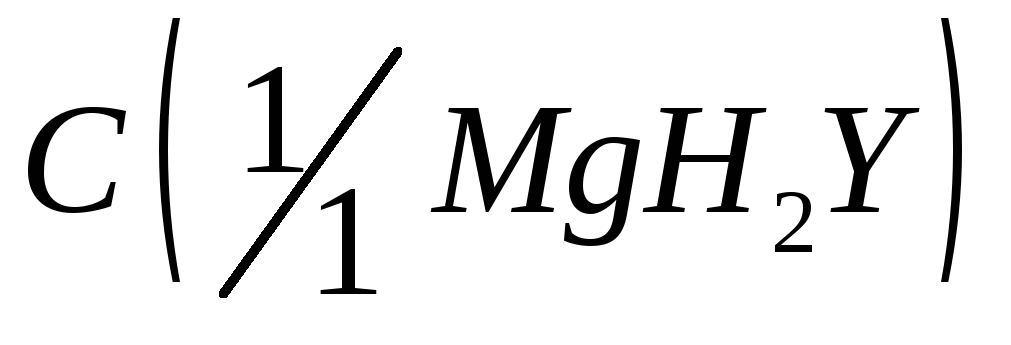 = 0,025 моль/дм3;
= 0,025 моль/дм3;Эриохромовый черный Т, смесь с хлоридом натрия в отношении 1:100;
Сульфосалициловая кислота, раствор
 = 5%-й раствор.
= 5%-й раствор.
Программа работы
Определение кальция
Комплексонометрическое
определение кальция основано на прямом
титровании его раствором двунатриевой
соли - этилендиаминтетрауксусной кислоты
-
![]() (ЭДТА) в присутствии мурексида,
эриохромового черного Т или другого
индикатора.
(ЭДТА) в присутствии мурексида,
эриохромового черного Т или другого
индикатора.
Реакция протекает по следующему уравнению:
![]()
Образующийся
хелат обладает невысокой устойчивостью,
![]() Ионы водорода, выделяющиеся в процессе
титрования, приводят к смещению равновесия
данной реакции в сторону разрушения
комплекса.
Ионы водорода, выделяющиеся в процессе
титрования, приводят к смещению равновесия
данной реакции в сторону разрушения
комплекса.
Оптимальным
![]() для определения ионов кальция будет
для определения ионов кальция будет![]() =11.
=11.
При титровании с эриохромовым черным Т изменение окраски в конечной точке титрования недостаточно четкое, что можно объяснить незначительной устойчивостью образующегося металлоиндикаторного комплекса. Для получения более резкого изменения окраски индикатора в конечной точке титрования к анализируемому раствору перед титрованием можно добавить небольшое количество комплексоната магния. Переход окраски индикатора в конечной точке титрования становится очень четким. При этом протекает реакция:
![]()
Исчезает окраска комплекса магния с эриохромовым черным Т, и появляется окраска свободного индикатора.
Ход работы:
Анализируемый раствор переносят в мерную колбу вместимостью 100 см3доводят до метки дистиллированной водой и тщательно перемешивают.
В коническую колбу для титрования переносят аликвотную часть раствора (10 см3), добавляют 5 см3аммиачного буферного раствора, 1 см3раствора комплексоната магния, индикатора эриохромового черного Т на кончике шпателя и после полного растворения индикатора титруют раствором ЭДТА до изменения окраски индикатора от красно-фиолетовой к синей.
Титрование повторяют 3-5 раз до получения не менее трех сходящихся результатов титрования. Результаты заносят в таблицу 6.1:
Результаты титрования раствора кальция раствором ЭДТА.
Таблица 6.1.
|
№ п/п |
V( Na2H2Y), см3 |
С(1/1 Na2H2Y), моль/дм3 |
V(Са), см3 |
С(1/1 Са), моль/дм3 |
Т(Са), г/см3 |
|
|
|
|
|
|
|
Используя средний объем титранта, израсходованного на титрование, рассчитывают содержание кальция в растворе и количество определяемого вещества, учитывая что в точке эквивалентности образуется комплекс состава 1:1.
