
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия и физико-химические методы анализа»
- •Содержание
- •Часть I. Химические методы анализа
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов (в присутствии вольфрама)
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Выполнение реакций обнаружения анионов
- •Обнаружение карбонатов.
- •Обнаружение нитратов
- •Обнаружение ортофосфатов
- •Обнаружение силикатов
- •Обнаружение сульфидов
- •Обнаружение сульфатов
- •Обнаружение хлоридов
- •Вопросы для самоподготовки
- •Гравиметрия (весовой анализ)
- •Цель и задачи работы
- •Программа работы Приборы и реактивы.
- •Определение сульфатов
- •Ход работы.
- •Определение железа
- •Ход работы.
- •Определение никеля
- •Ход работы.
- •Вопросы для самоподготовки
- •Протолитометрический анализ
- •Ход работы
- •Контрольная задача. Определение уксусной кислоты.
- •Вопросы для самоподготовки.
- •Перманганатометрия.
- •Приготовление первичного стандарта щавелевой кислоты
- •Ход работы:
- •Контрольная задача. Определение железа (II)
- •Ход работы:
- •Вопросы для самоподготовки.
- •Иодометрия
- •Стандартизация рабочего раствора тиосульфата натрия (вторичного стандарта).
- •Ход работы:
- •Контрольная задача: Определение меди (II).
- •Ход определения:
- •Вопросы для самоподготовки.
- •Комплексонометрия.
- •Цель и задачи работы.
- •Оборудование и реактивы:
- •Программа работы
- •Определение кальция
- •Ход работы:
- •Определение железа
- •Ход работы
- •Вопросы для самоподготовки
- •Часть II. Инструментальные методы анализа
- •Определение калия по методу градуировочного графика
- •Ход работы:
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания калия в анализируемом растворе
- •Фотометрический анализ
- •Выбор светофильтра
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания меди (II) в анализируемом растворе
- •Определение железа (III) методом градуировочного графика
- •Фототурбидиметрия.
- •Ход работы:
- •Приготовление стандартных растворов и раствора сравнения:
- •Построение градуировочного графика:
- •Контрольная задача. Определение содержания в растворе.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Приборы и реактивы:
- •Ход работы:
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача Определение содержания сахара в анализируемом образце:
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Ход работы:
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Вопросы для самоподготовки
- •Потенциометрия
- •Цель и задачи работы
- •Программа работы
- •Определение хлородородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования.
- •Приборы и реактивы
- •Ход работы
- •Установление титра рабочего раствора
- •Подготовка анализируемого образца к титрованию
- •Подготовка иономера к работе в режиме определения рН
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце
- •Вопросы для самоподготовки.
- •Кондуктометрия.
- •Цель и задачи работы.
- •Программа работы.
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Приборы и реактивы:
- •Ход работы:
- •12.2.1.1. Установление титра рабочего раствора :
- •12.2.1.2. Подготовка анализируемого образца к титрованию:
- •12.2.1.3. Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси:
- •Определение ионовив их смеси.
- •Приборы и реактивы:
- •Подготовка анализируемого образца к титрованию:проводят по пункту 12.2.1.2.
- •Контрольная задача. Определение содержания солей никеля (II) и кальция в испытуемой смеси
- •Вопросы для самоконтроля.
- •13. Газохроматографический метод определения содержания токсичных микропримесей
- •13.1. Цель работы:
- •13.2. Объекты и средства исследования.
- •13.3. Программа работы
- •13.3.1. Приготовление градуировочных смесей
- •Условия хроматографирования с капиллярными колонками:
- •Литература:
Контрольная задача: Определение меди (II).
Определение основано
на взаимодействии ионов
![]() и
и![]() и последующем титровании образовавшегося
в эквивалентном количестве
и последующем титровании образовавшегося
в эквивалентном количестве![]() стандартным раствором
стандартным раствором![]()
![]()
![]()
Ход определения:
Исследуемый раствор, содержащий ионы
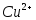 ,
в мерной колбе разбавляют дистиллированной
водой до метки и тщательно перемешивают.
,
в мерной колбе разбавляют дистиллированной
водой до метки и тщательно перемешивают.Аликвотные части анализируемого раствора пипеткой переносят в 3 конические колбы для титрования, добавляют по 2—3 г твердого
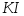 и 5 см3раствора
и 5 см3раствора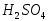 .
.Колбы закрывают стеклянными пробками, которые перед титрованием обмывают дистиллированной водой и оставляют на 10-15 мин в темном месте.
Выделившийся
 после завершения реакции титруют
стандартным раствором
после завершения реакции титруют
стандартным раствором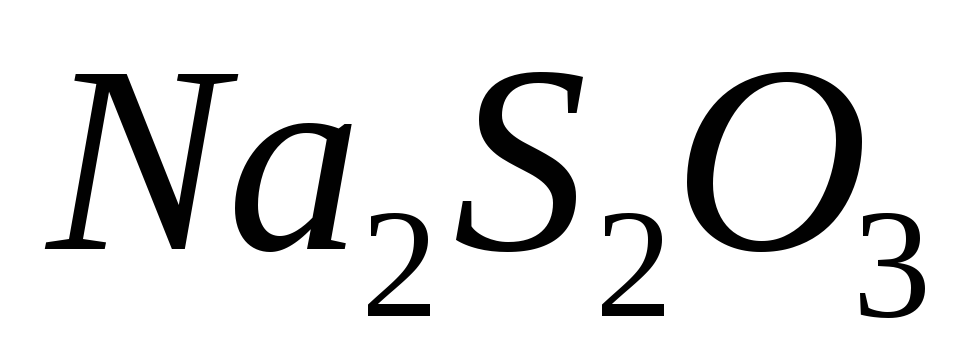 в присутствии крахмала.
в присутствии крахмала.Результаты заносят в таблицу 5.2:
Результаты титрования раствора,
содержащего ионы
![]() ,
раствором
тиосульфата натрия.
,
раствором
тиосульфата натрия.
Таблица 5.2.
|
№ п/п |
V(Na2S2О3), см3 |
С(1/1Na2S2О3), моль/дм3 |
V(Cu2+), см3 |
С(1/1 Cu2+), моль/дм3 |
Т(Cu2+), г/см3 |
|
|
|
|
|
|
|
Используя средний объем титранта, израсходованного на титрование, рассчитывают содержание меди (II), учитывая, что в точке эквивалентности
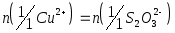 .
Содержание
.
Содержание (в г) вычисляют по формулам:
(в г) вычисляют по формулам:
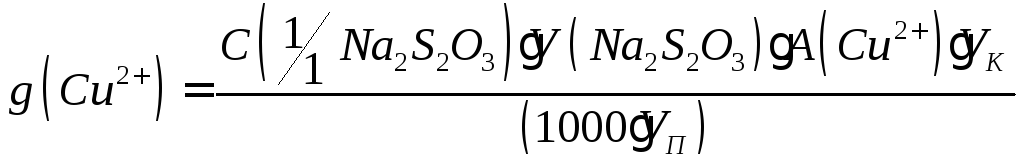
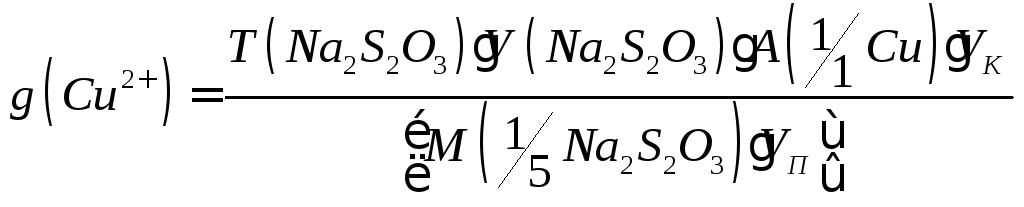
где
![]() ,
,![]() — вместимость колбы и пипетки
соответственно.
— вместимость колбы и пипетки
соответственно.
Вопросы для самоподготовки.
Почему иодид калия нельзя использовать для прямого титрования меди?
Напишите реакции, протекающие при титриметрическом определении: а) белильной извести, нитратов, железа (III), пероксида водорода, брома, хлора, хрома (VI), хрома (III), сульфидов, сульфитов иодометрически; б) пероксида водорода, нитратов, диоксида марганца, кальция (II), марганца (II) перманганатометрически.
Каковы особенности приготовления стандартного раствора
 и условия его хранения?
и условия его хранения?Почему фактор эквивалентности
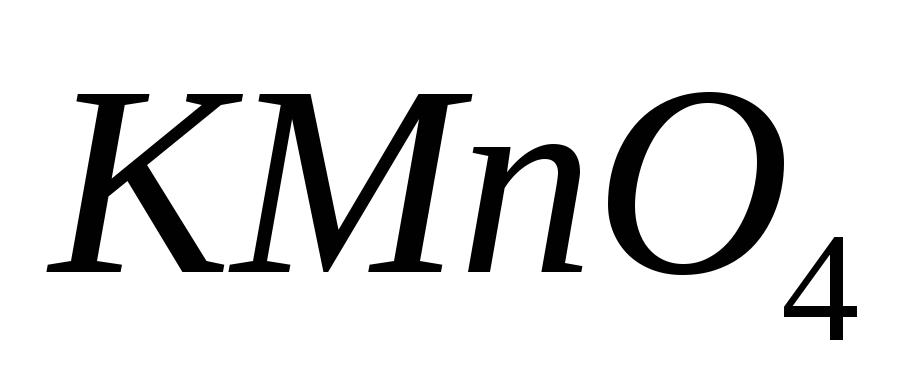 различен при проведении реакций в
кислой, щелочной или нейтральной средах?
Рассчитайте его значение в этих средах.
различен при проведении реакций в
кислой, щелочной или нейтральной средах?
Рассчитайте его значение в этих средах.Какие вещества применяют для установки характеристик раствора
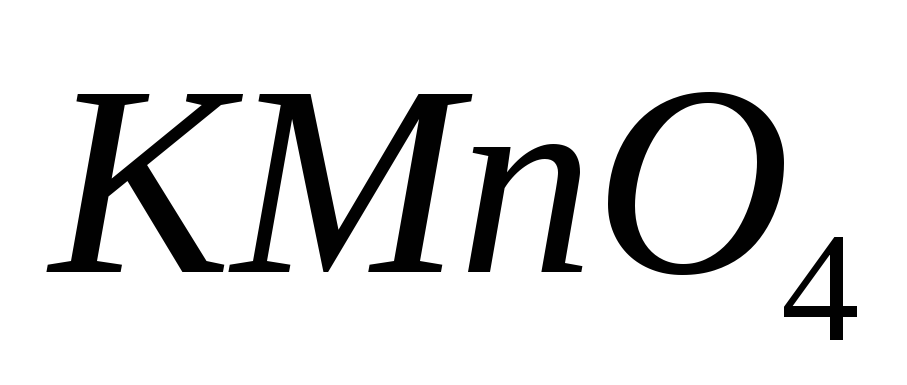 ?
Какие требования к ним предъявляют?
?
Какие требования к ним предъявляют?Как определить перманганатометрическим методом вещества, не обладающие окислительно-восстановительными свойствами, например
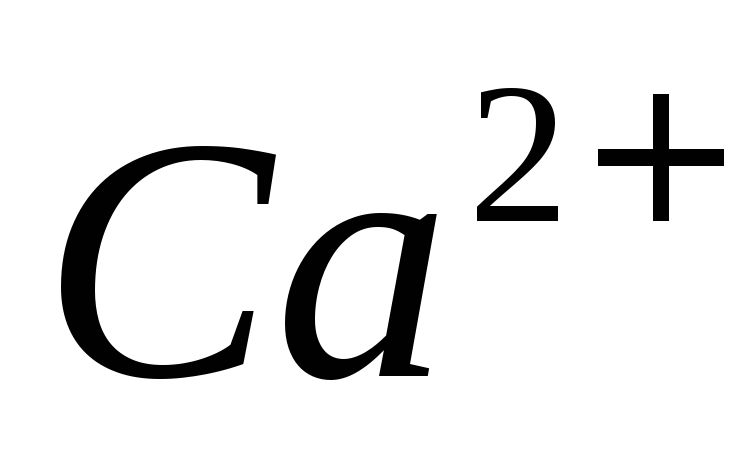 ?
?Как определить окислители перманганатометрическим методом:
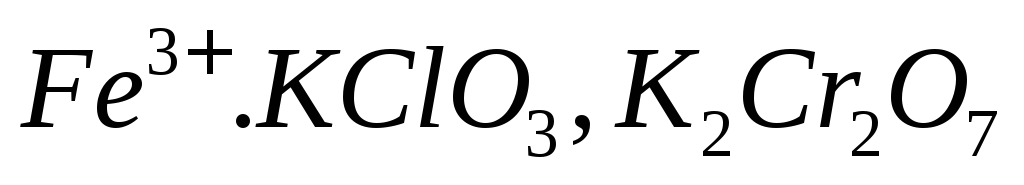 ?
?Вычислите молярную концентрацию эквивалентов раствора
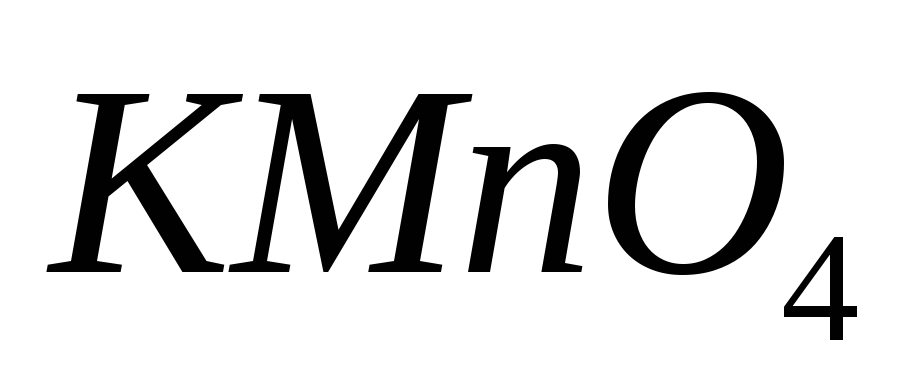 с Т= 0,005815 г/мл при использовании его в
качестве титра в кислой и нейтральной
средах.
с Т= 0,005815 г/мл при использовании его в
качестве титра в кислой и нейтральной
средах.В каких условиях проводят определение ионов
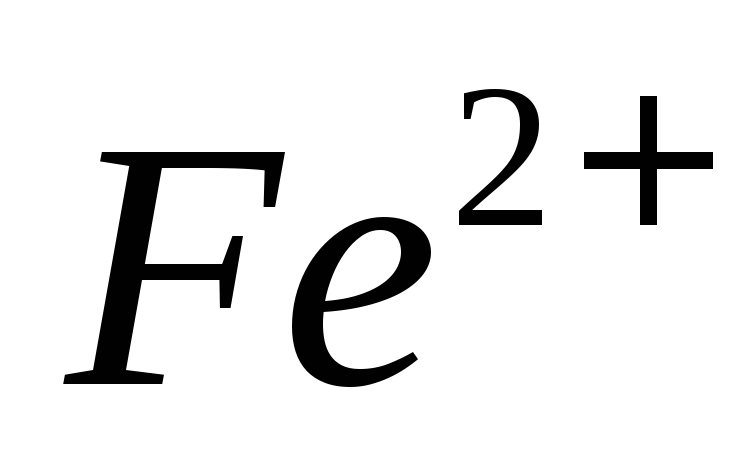 при отсутствии хлорид-ионов
перманганатометрическим методом?
при отсутствии хлорид-ионов
перманганатометрическим методом?В мерной колбе вместимостью 100 мл приготовлен раствор, содержащий 0,6384 г
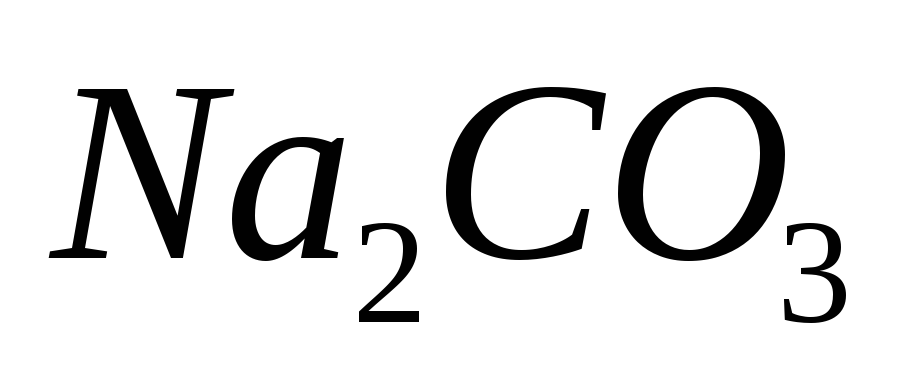 .
Какой объём 0,09349
.
Какой объём 0,09349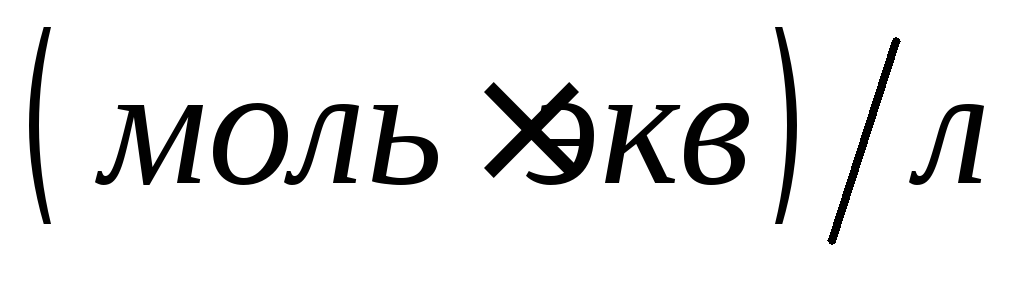 раствора
раствора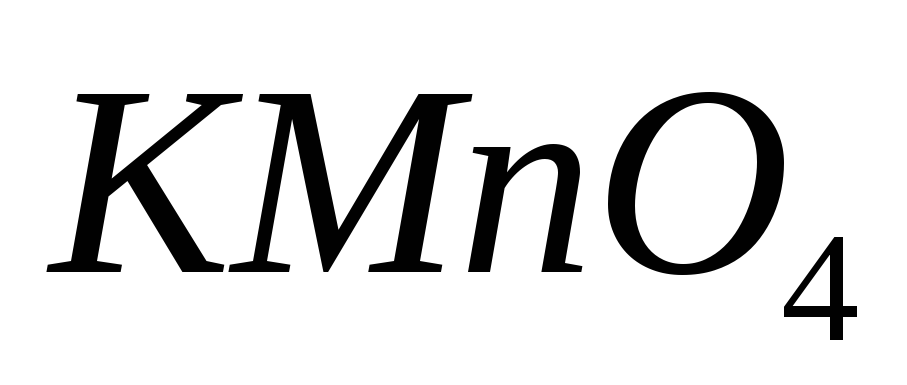 будет израсходован на титрование 10,00
мл раствора оксалата натрия? Рассчитайте
константу равновесия
окислительно-восстановительной реакции,
пользуясь таблицей окислительно-восстановительных
потенциалов.
будет израсходован на титрование 10,00
мл раствора оксалата натрия? Рассчитайте
константу равновесия
окислительно-восстановительной реакции,
пользуясь таблицей окислительно-восстановительных
потенциалов.На титрование раствора
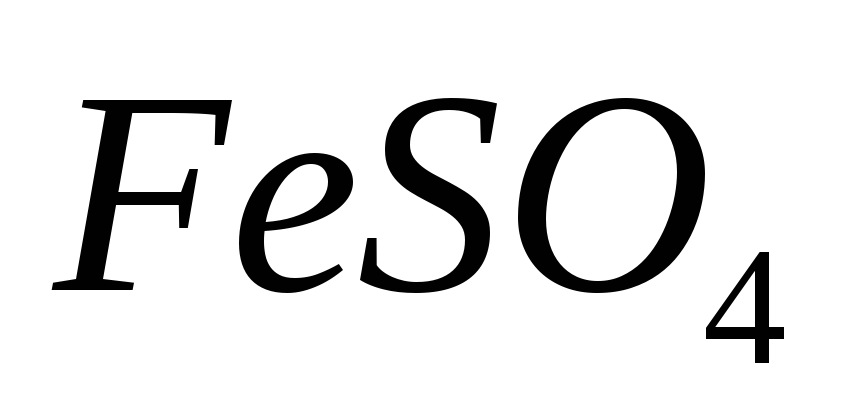 израсходовано 17,25 мл раствора
израсходовано 17,25 мл раствора с
с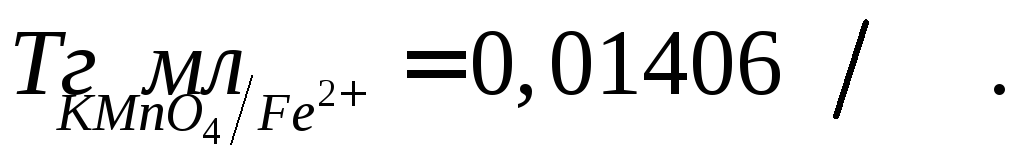 Сколько граммов железа содержится в
пробе?
Сколько граммов железа содержится в
пробе?Сравните достоинства и недостатки бихроматометрии с другими методами титриметрического анализа с использованием окислительно-восстано-вительных реакций.
Почему титрование растворов бихромата проводят в кислой среде?
Напишите окислительно-восстановительные реакции для дифениламина.
Рассчитайте погрешность титрования железа (II) бихроматом: а) в присутствии фосфорной кислоты ; б) в отсутствии фосфорной кислоты.
Как устанавливают конец титрования при броматометрическом титровании сурьмы (III)?
