
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия и физико-химические методы анализа»
- •Содержание
- •Часть I. Химические методы анализа
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов (в присутствии вольфрама)
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Обнаружение ионов
- •Выполнение реакций обнаружения анионов
- •Обнаружение карбонатов.
- •Обнаружение нитратов
- •Обнаружение ортофосфатов
- •Обнаружение силикатов
- •Обнаружение сульфидов
- •Обнаружение сульфатов
- •Обнаружение хлоридов
- •Вопросы для самоподготовки
- •Гравиметрия (весовой анализ)
- •Цель и задачи работы
- •Программа работы Приборы и реактивы.
- •Определение сульфатов
- •Ход работы.
- •Определение железа
- •Ход работы.
- •Определение никеля
- •Ход работы.
- •Вопросы для самоподготовки
- •Протолитометрический анализ
- •Ход работы
- •Контрольная задача. Определение уксусной кислоты.
- •Вопросы для самоподготовки.
- •Перманганатометрия.
- •Приготовление первичного стандарта щавелевой кислоты
- •Ход работы:
- •Контрольная задача. Определение железа (II)
- •Ход работы:
- •Вопросы для самоподготовки.
- •Иодометрия
- •Стандартизация рабочего раствора тиосульфата натрия (вторичного стандарта).
- •Ход работы:
- •Контрольная задача: Определение меди (II).
- •Ход определения:
- •Вопросы для самоподготовки.
- •Комплексонометрия.
- •Цель и задачи работы.
- •Оборудование и реактивы:
- •Программа работы
- •Определение кальция
- •Ход работы:
- •Определение железа
- •Ход работы
- •Вопросы для самоподготовки
- •Часть II. Инструментальные методы анализа
- •Определение калия по методу градуировочного графика
- •Ход работы:
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания калия в анализируемом растворе
- •Фотометрический анализ
- •Выбор светофильтра
- •Построение градуировочного графика
- •Контрольная задача. Определение содержания меди (II) в анализируемом растворе
- •Определение железа (III) методом градуировочного графика
- •Фототурбидиметрия.
- •Ход работы:
- •Приготовление стандартных растворов и раствора сравнения:
- •Построение градуировочного графика:
- •Контрольная задача. Определение содержания в растворе.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Приборы и реактивы:
- •Ход работы:
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача Определение содержания сахара в анализируемом образце:
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Ход работы:
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Вопросы для самоподготовки
- •Потенциометрия
- •Цель и задачи работы
- •Программа работы
- •Определение хлородородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования.
- •Приборы и реактивы
- •Ход работы
- •Установление титра рабочего раствора
- •Подготовка анализируемого образца к титрованию
- •Подготовка иономера к работе в режиме определения рН
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце
- •Вопросы для самоподготовки.
- •Кондуктометрия.
- •Цель и задачи работы.
- •Программа работы.
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Приборы и реактивы:
- •Ход работы:
- •12.2.1.1. Установление титра рабочего раствора :
- •12.2.1.2. Подготовка анализируемого образца к титрованию:
- •12.2.1.3. Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси:
- •Определение ионовив их смеси.
- •Приборы и реактивы:
- •Подготовка анализируемого образца к титрованию:проводят по пункту 12.2.1.2.
- •Контрольная задача. Определение содержания солей никеля (II) и кальция в испытуемой смеси
- •Вопросы для самоконтроля.
- •13. Газохроматографический метод определения содержания токсичных микропримесей
- •13.1. Цель работы:
- •13.2. Объекты и средства исследования.
- •13.3. Программа работы
- •13.3.1. Приготовление градуировочных смесей
- •Условия хроматографирования с капиллярными колонками:
- •Литература:
Иодометрия
Цель и задачи работы.
Закрепление знаний теории окислительно-восстановительного равновесия и титриметрического анализа с применением окислительно-восстановительных реакций. Получение навыков титрования и проведения расчетов результатов анализа и их обработки. Контрольная задача – определение окислителей в растворах неизвестной концентрации.
Оборудование и реактивы:
Бюретка вместимостью 25 см3;
Мерные колбы вместимостью 00, 250 и 500 см3 ;
Колбы для титрования вместимостью 250 см3 ;
Пипетки Мора на 5, 10, 15, 25 см3;
Аналитические весы с разновесами;
Набор ареометров;
Бихромат калия
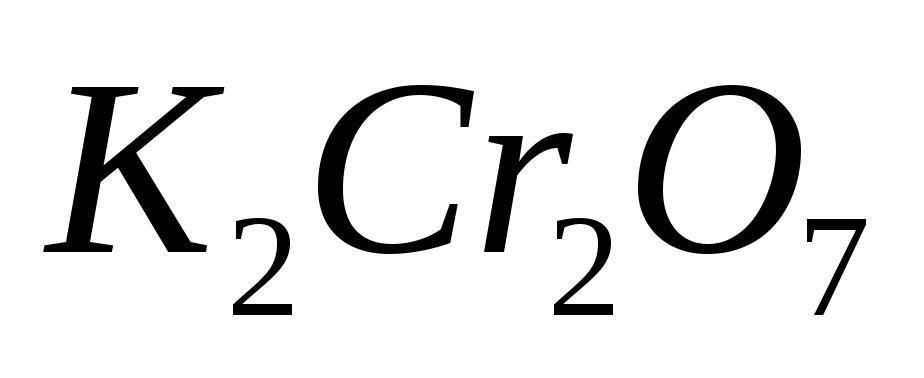 ,
х.ч. или ч.д.а.;
,
х.ч. или ч.д.а.;Тиосульфат натрия
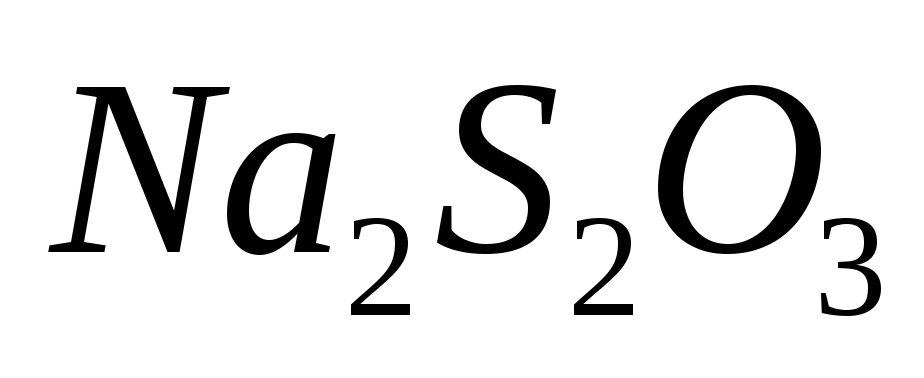 ,
х.ч. или ч.д.а.;
,
х.ч. или ч.д.а.;Иодид калия
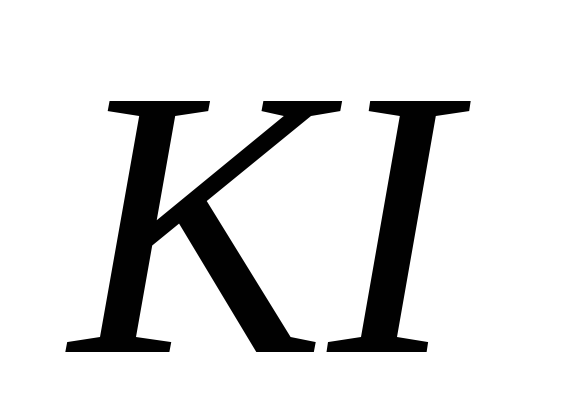 ,
х.ч. или ч.д.а.;
,
х.ч. или ч.д.а.;Серная кислота, раствор
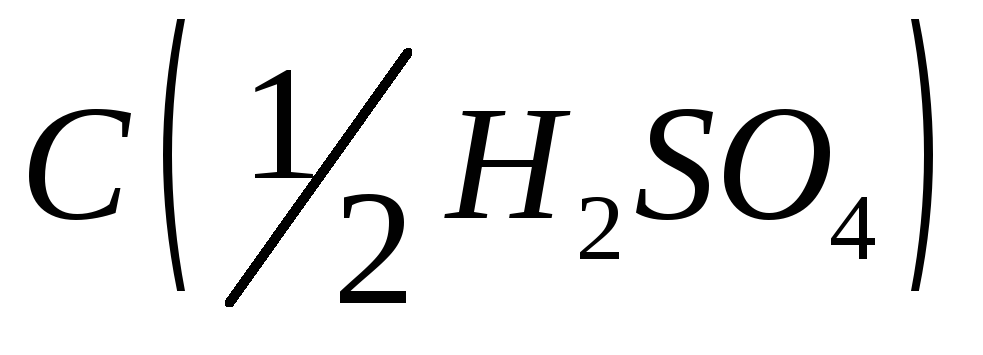 = 2 моль/дм3;
= 2 моль/дм3;Сульфат меди (II), раствор
 = 0,5 моль/дм3;
= 0,5 моль/дм3;Крахмал, водный раствор.
Программа работы
Определение меди (II)
Приготовление первичного стандарта бихромата калия С(1/6K2Сr2О7) = 0,05 моль/дм3
Выполняют по п. 3.2.1.1.
из реактива
![]() квалификации х.ч учитывая, чтоэкв.
квалификации х.ч учитывая, чтоэкв.![]() .
.
Приготовление рабочего раствора тиосульфата натрия С(1/1Na2S2О3) = 0,05 моль/дм3(вторичного стандарта)
Выполняют по п. 3.2.1.1.
из реактива
![]() квалификации х.ч учитывая, чтоэкв.
квалификации х.ч учитывая, чтоэкв.![]() .
Для приготовления растворов рекомендуется
свежепрокипяченная (в течение часа)
вода, так как бактерии разлагают растворы
тиосульфата. Для подавления роста
бактерий можно добавлять такие вещества,
как хлороформ, бензоат натрия или
.
Для приготовления растворов рекомендуется
свежепрокипяченная (в течение часа)
вода, так как бактерии разлагают растворы
тиосульфата. Для подавления роста
бактерий можно добавлять такие вещества,
как хлороформ, бензоат натрия или
![]() .
Кипячение воды и добавление небольших
количеств (0,1г/ дм3)
.
Кипячение воды и добавление небольших
количеств (0,1г/ дм3)![]() способствует удалению
способствует удалению![]() ,
влияющего на характеристики раствора.
Раствор хранят в темном месте в хорошо
закрытой посуде. Стандартизацию раствора
,
влияющего на характеристики раствора.
Раствор хранят в темном месте в хорошо
закрытой посуде. Стандартизацию раствора
![]() проводят обычно через5—7дней.
проводят обычно через5—7дней.
Стандартизация рабочего раствора тиосульфата натрия (вторичного стандарта).
Важнейшими факторами,
определяющими устойчивость раствора
тиосульфата, являются значения
![]() ,
присутствие микроорганизмов, концентрация
раствора, присутствие атмосферного
кислорода, примесей ионов тяжелых
металлов (катализаторов
окисления тиосульфата кислородом
воздуха), воздействие прямого солнечного
света.
,
присутствие микроорганизмов, концентрация
раствора, присутствие атмосферного
кислорода, примесей ионов тяжелых
металлов (катализаторов
окисления тиосульфата кислородом
воздуха), воздействие прямого солнечного
света.
Первичными стандартами
для растворов
![]() могут быть окислители:
могут быть окислители:![]() ,
выделяющие при взаимодействии с избытком
иодид-ионов эквивалентное количество
иода, который титруют стандартизируемым
раствором тиосульфата. Способ
стандартизации бихроматом калия основан
на реакциях:
,
выделяющие при взаимодействии с избытком
иодид-ионов эквивалентное количество
иода, который титруют стандартизируемым
раствором тиосульфата. Способ
стандартизации бихроматом калия основан
на реакциях:
![]()
![]()
Ход работы:
В коническую колбу для титрования переносят пипеткой аликвотную часть раствора установочного вещества
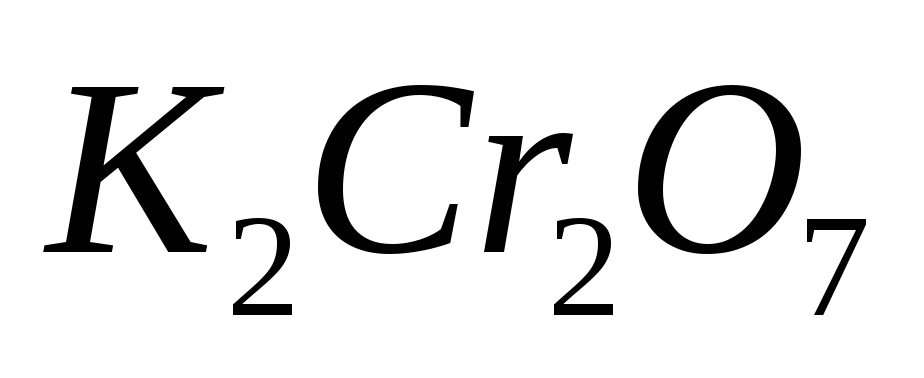 ,
добавляют10см3
раствора
,
добавляют10см3
раствора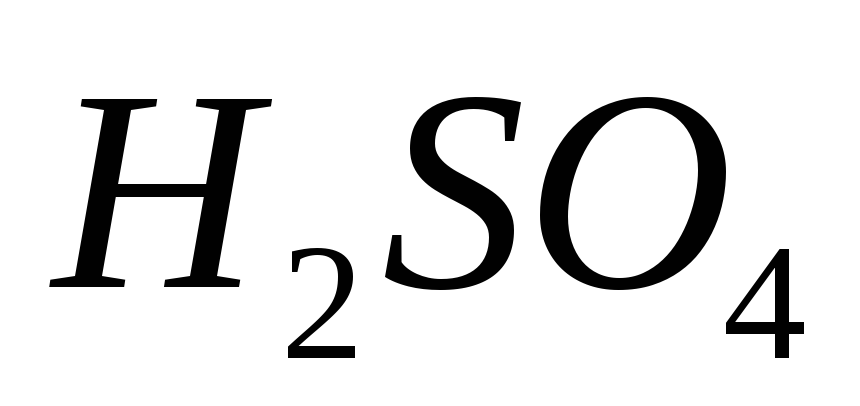 и 1г кристаллического
и 1г кристаллического
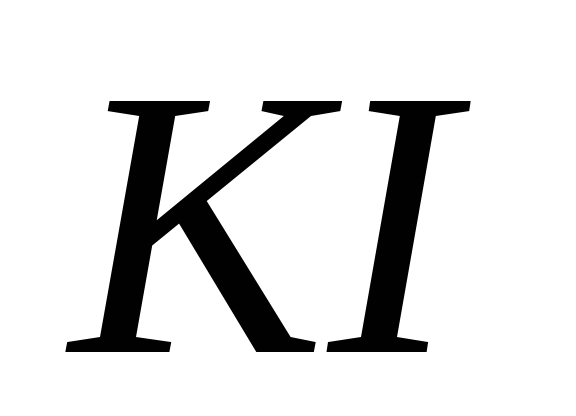 (или соответствующий объем его
концентрированного раствора).
(или соответствующий объем его
концентрированного раствора).Колбы закрывают стеклянными пробками, содержимое перемешивают, дают постоять 5—10мин в темном месте пока не завершится реакция.
Выделившийся
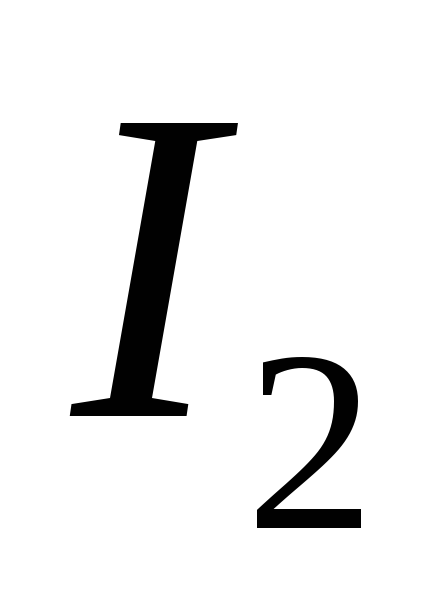 титруют раствором
титруют раствором
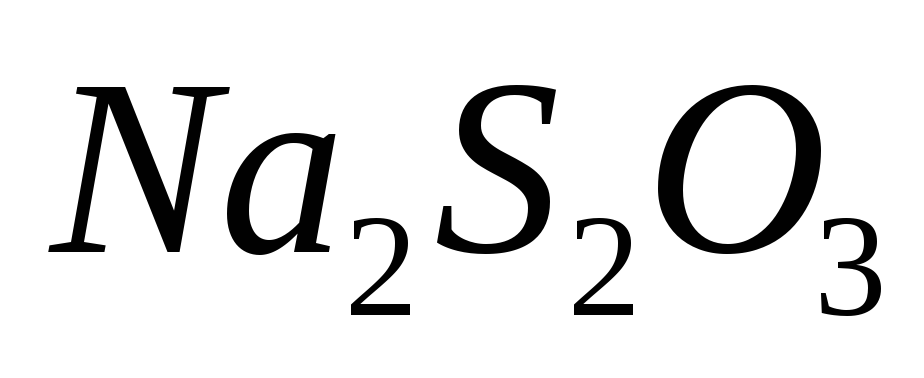 до тех пор, пока окраска не станет
слабо-желтой.
до тех пор, пока окраска не станет
слабо-желтой.Затем титруемый раствор разбавляют водой приблизительно в 2 раза, добавляют индикатор крахмал и продолжают титрование до перехода окраски раствора из синей в светло-зеленую (ионы
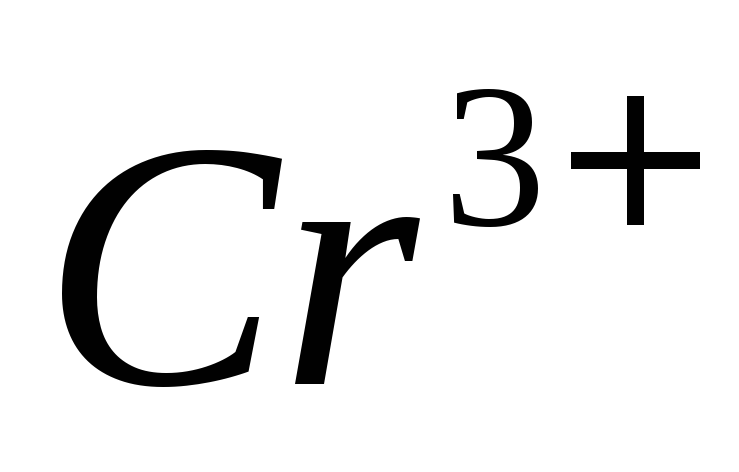 ).
).Проводят 3-5 титрований. Результаты заносят в таблицу 5.1:
Результаты стандартизации раствора тиосульфата натрия.
Таблица 5.1.
|
№ п/п |
V(K2Сr2О7), См3 |
С(1/6K2Сr2О7), моль/дм3 |
V(Na2S2О3), см3 |
С(1/1Na2S2О3), моль/дм3 |
Т(Na2S2О3), г/см3 |
|
|
|
|
|
|
|
Используя средний
объем титранта, затраченного на
титрование, рассчитывают характеристики
раствора
![]() .
При расчете учитывают, что в точке
эквивалентности число молей эквивалента
титруемого вещества и титранта равны:
.
При расчете учитывают, что в точке
эквивалентности число молей эквивалента
титруемого вещества и титранта равны:![]() .
.
