
- •ПРЕДИСЛОВИЕ
- •Глава 1. Организация службы инфекционной помощи в России
- •Глава 2. Инфекционные болезни. Заболеваемость и смертность
- •Глава 3. Вакцинопрофилактика инфекционных болезней. Календарь прививок
- •Глава 4. Последипломное образование по специальности «Инфекционные болезни»
- •РАЗДЕЛ I. МЕТОДЫ ДИАГНОСТИКИ
- •Глава 5. Клинические методы
- •Глава 6. Лабораторные методы
- •Приложения к главе 6. Лабораторные методы
- •Клинический анализ крови
- •Цель
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Интерпретация результатов
- •Факторы, влияющие на результат
- •Осложнения
- •Клинический анализ мочи
- •Цель
- •Показания
- •Подготовка к исследованию
- •Методика исследования
- •Факторы, влияющие на результат
- •Биохимический анализ крови
- •Цель
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Интерпретация результатов
- •Факторы, влияющие на результат
- •Осложнения
- •Анализ желчи
- •Цель
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Осложнения
- •Альтернативные методы
- •Клинический анализ кала
- •Цель
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Оценка копрограммы при протозоозах, гельминтозах, микозах
- •Факторы, влияющие на результат
- •Исследование спинномозговой жидкости
- •Методы исследования
- •Осложнения при Люмбальной пункции
- •Взятие спинномозговой жидкости для исследования
- •Визуальная оценка спинномозговой жидкости
- •Биохимическое исследование спинномозговой жидкости
- •Микробиологические методы*
- •Иммунологические методы*
- •Полимеразная цепная реакция*
- •Глава 7. Инструментальные методы
- •Электрокардиография
- •Цель
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Интерпретация результатов
- •Осложнения
- •Рентгенография
- •Цели
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Интерпретация результатов
- •Альтернативные методы
- •Электроэнцефалография
- •Цель
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Интерпретация результатов
- •Факторы, влияющие на результат
- •Осложнения
- •Электронейромиография
- •Цель
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Интерпретация результатов
- •Осложнения
- •Альтернативные методы
- •Компьютерная томография
- •Цель
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Интерпретация результатов
- •Осложнения
- •Альтернативные методы
- •Магнитно-резонансная томография
- •Цель
- •Показания
- •Абсолютные противопоказания
- •Относительные противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Интерпретация результатов
- •Осложнения
- •Альтернативные методы
- •Ультразвуковая диагностика. Эхокардиография
- •Цель
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •10. Осложнения
- •12. Альтернативные методы
- •Эзофагогастродуоденоскопия
- •Цели
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Оценка результата
- •Осложнения
- •Альтернативные методы
- •Ректороманоскопия, колоноскопия
- •Цели
- •Показания
- •Противопоказания
- •Подготовка к исследованию
- •Методика исследования
- •Интерпретация результатов
- •Осложнения
- •Альтернативные методы
- •Глава 8. Немедикаментозные методы лечения инфекционных болезней
- •Режим
- •Диетотерапия
- •Физиотерапия
- •Санаторно-курортное лечение
- •Глава 9. Фармакотерапия
- •9.1. АНТИБАКТЕРИАЛЬНЫЕ ПРЕПАРАТЫ. ЭТИОТРОПНАЯ ТЕРАПИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
- •9.2. ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИЕ БАКТЕРИОФАГИ КАК СРЕДСТВО АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
- •9.3. ПРОТИВОГРИБКОВЫЕ ПРЕПАРАТЫ
- •9.4. ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ
- •9.5. ПРОТИВОПАРАЗИТАРНЫЕ ПРЕПАРАТЫ
- •9.6. ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ
- •9.7. БИОДОСТУПНОСТЬ ВОЗБУДИТЕЛЯ
- •9.8. МЕХАНИЗМЫ РЕЗИСТЕНТНОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ
- •9.9. ИММУНОТЕРАПИЯ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
- •9.10. ПОБОЧНОЕ ДЕЙСТВИЕ АНТИМИКРОБНЫХ ПРЕПАРАТОВ
- •Глава 11. Катарально-респираторный синдром
- •Глава 12. Экзантемы, энантемы, первичный аффект
- •Глава 13. Лимфаденопатия
- •Глава 14. Синдром желтухи
- •Глава 15. Синдром поражения желудочно-кишечного тракта при инфекционных болезнях
- •Глава 16. Гепатолиенальный синдром
- •Глава 17. Поражение почек при инфекционных болезнях
- •Глава 18. Поражение центральной нервной системы при инфекционных болезнях
- •Глава 19. Поражение периферической нервной системы при инфекционных болезнях
- •Диагностика
- •Лечение
- •20.1. САЛЬМОНЕЛЛЕЗЫ
- •20.2. ШИГЕЛЛЕЗ
- •20.3. ЭШЕРИХИОЗЫ
- •20.4. ПИЩЕВЫЕ ТОКСИКОИНФЕКЦИИ
- •20.5. ХОЛЕРА
- •20.6. ЗАБОЛЕВАНИЯ, ВЫЗЫВАЕМЫЕ НАГ-ВИБРИОНАМИ
- •20.7. ИЕРСИНИОЗЫ
- •20.8. КАМПИЛОБАКТЕРИОЗ
- •20.9. ЛИСТЕРИОЗ
- •20.10. БРУЦЕЛЛЕЗ
- •20.11. ТУЛЯРЕМИЯ
- •20.12. СИБИРСКАЯ ЯЗВА
- •20.13. СТРЕПТОКОККОВЫЕ ИНФЕКЦИИ
- •20.14. ПНЕВМОКОККОВЫЕ ИНФЕКЦИИ
- •20.15. СТАФИЛОКОККОВЫЕ ИНФЕКЦИИ
- •20.16. МЕНИНГОКОККОВАЯ ИНФЕКЦИЯ
- •20.17. СЕПСИС
- •20.18. ДИФТЕРИЯ
- •20.19. ГЕМОФИЛЬНАЯ ИНФЕКЦИЯ
- •20.20. ЛЕГИОНЕЛЛЕЗЫ
- •20.21. ВОЗВРАТНЫЕ ТИФЫ
- •20.22. ЛЕПТОСПИРОЗ
- •20.24. СТОЛБНЯК
- •20.25. БОТУЛИЗМ
- •20.27. РИККЕТСИОЗЫ
- •20.28. ОРНИТОЗ
- •20.29. РЕСПИРАТОРНЫЙ МИКОПЛАЗМОЗ
- •Приложение к главе 20. Лепра
- •Коды по МКБ-10
- •Этиология
- •Эпидемиология
- •Меры профилактики: специфические, неспецифические. Мероприятия в очаге
- •Профилактика лепры
- •Патоморфология и патогенез
- •Клиническая классификация
- •Клинические и лабораторные диагностические тесты
- •Показания к дополнительным методам диагностики и консультациям специалистов
- •Лечение
- •Показания к госпитализации
- •Лечебная диета
- •Специфическая этиотропная терапия на дому и в стационаре
- •Патогенетическая терапия
- •Интенсивная терапия и реанимация
- •Сроки госпитализации
- •Диспансерное наблюдение
- •Санаторно-курортное лечение
- •Глава 21. Вирусные инфекции
- •21.1. ВИРУСНЫЕ ГЕПАТИТЫ 21.1.1. Гепатит А
- •21.2. ВИЧ-ИНФЕКЦИЯ
- •Профилактика
- •Патогенез
- •Клиническая картина

Кроме того, не существует коммерческих тест-систем для обнаружения маркеров SEN-вируса в биологических жидкостях организма.
Лечение
Терапия TTV- и SEN-инфекции не разработана.
21.2. ВИЧ-ИНФЕКЦИЯ
ВИЧ-инфекция - хроническая инфекционная болезнь, вызванная ВИЧ (human immunodeficiency virus infection - HIV-infection). ВИЧ-инфекция - медленно прогрессирующее антропонозное заболевание с контактным механизмом передачи возбудителя, характеризующееся поражением иммунной системы с развитием СПИДа. Клинические проявления СПИДа, приводящие к гибели инфицированного человека, - оппортунистические (вторичные) инфекции, злокачественные новообразования и аутоиммунные процессы.
КОДЫ ПО МКБ-10
В20 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде инфекционных и паразитарных болезней.
В21 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде злокачественных новообразований.
В22 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде других уточненных болезней.
В23 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде других состояний.
В24 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), неуточнен-ная.
Z21 Бессимптомный инфекционный статус, вызванный вирусом иммунодефицита человека (ВИЧ).
ЭТИОЛОГИЯ Возбудитель
Описано два типа - ВИЧ-1 и ВИЧ-2, различающиеся по структурным и антигенным характеристикам. На территории Российской Федерации эпидемиологическое значение имеет ВИЧ-1 (основной возбудитель заболевания).
Систематика ВИЧ
ВИЧ относят к царству Viridae семейству Retroviridae роду Lentiviridae.
ОСНОВНЫЕ СВОЙСТВА ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА Строение вирусной частицы
Вирус имеет округлую форму и сложную структуру. Диаметр вириона составляет 100-120 нм. Специфические белки вируса представлены в таблице (табл. 21.8).
* Молекулярный вес белков измеряют в килодальтонах (кДа); gp - гликопротеины; р - протеины.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
В центре вириона располагается геном вируса, представленный двумя нитями РНК, внутренними протеинами p7 и p9, а также ферментами - обратной транс-криптазой (ревертазой), протеазой, РНКазой и интегразой (эндонуклеазой). Геном окружает внутренняя белковая оболочка. В состав внутренней оболочки ВИЧ-1 входят протеины p17, p24 и p55. Протеины p16, p25 и p56 образуют внутреннюю оболочку ВИЧ-2. Наружная липидная оболочка ВИЧ-1 пронизана гликопро-теином gp160, состоящим из трансмембранного (gp41) и высокоиммуногенного (gp120) фрагмента. Оболочечные белки gр41 и gр120 соединены нековалентной связью и формируют на поверхности вириона отростки, обеспечивающие присоединение ВИЧ к рецепторам клеток-мишеней человека. Геном вируса содержит 9 генов - три структурных и шесть регуляторных. Геном является изменчивой структурой за счет антигенного дрейфа. Существует ряд вариантов вируса [основная группа М, состоящая из нескольких подтипов (клад): А, В, С, D, Е, F, G, Н, I, J, K; группы O, N, Р].
Устойчивость вируса в окружающей среде
Вестественных условиях ВИЧ (в высушенном состоянии) сохраняет активность в течение нескольких часов; в жидкостях, содержащих большое количество вирусных частиц, таких, как кровь и эякулят, - в течение нескольких дней.
Взамороженной сыворотке крови активность вируса определяют на протяжении нескольких лет.
Нагревание до 56 °C в течение 30 мин приводит к снижению инфекционного титра вируса в 100 раз. При более высокой температуре (70-80 °C) вирус погибает через 10 мин. Вирус чувствителен к 70% раствору этанола (Этиловый спирт♠), 0,5% раствору гипохлорита натрия, 1% раствору глутаральдегида, 6% раствору водорода пероксида, 5% раствору лизола, эфира или ацетона.
ВИЧ относительно мало чувствителен к ультрафиолетовому облучению и ионизирующей радиации.
ЭПИДЕМИОЛОГИЯ Источник (резервуар) вируса иммунодефицита человека
Источник ВИЧ-инфекции - ВИЧ-инфицированные люди, находящиеся на любой стадии заболевания, независимо от наличия или отсутствия клинических проявлений болезни, в том числе в периоде инкубации.
Механизмы, пути и факторы передачи
Основной механизм передачи инфекции - контактный. Существуют естественные и искусственные пути передачи. К естественным путям передачи относят половой (при половых контактах) и вертикальный (от инфицированной матери ребенку в период беременности, родов или при грудном вскармливании).
Искусственный (артифициальный) путь передачи - парентеральный - реализуется при проникновении вируса в кровь при различных манипуляциях, связанных с нарушением целостности слизистых оболочек и кожных покровов.
К числу факторов, влияющих на вероятность инфицирования полового партнера ВИЧ, относят титр вируса у источника инфекции; наличие у реципиента различных заболеваний половых органов; интенсивность контакта.
Современная эпидемиология ВИЧ-инфекции исключает существование аэрозольного, фекально-орального и трансмиссивного механизмов передачи вируса.
Восприимчивость человека к ВИЧ практически стопроцентная. Фактором невосприимчивости к заражению ВИЧ может быть отсутствие определенных специфических
рецепторов. В настоящее время выделяют гены, контролирующие синтез молекул, участвующих в проникновении ВИЧ в клетки хозяина. Таким образом, люди, имеющие гомозиготный генотип по этим генам, устойчивы к заражению ВИЧ половым путем; лица с гетерозиготным генотипом - менее устойчивы. Было установлено, что длительно контактирующие с ВИЧ-инфицированными и при этом не заразившиеся люди имеют генетический вариант CCR5-32, представляющий собой мутацию в гене, отвечающем за экспрессию корецептора CCR5 на поверхности лимфоцитов. Однако этот признак не ассоциируют с невосприимчивостью к ВИЧ при переливании крови или при внутривенном введении психоактивных веществ.
ВИЧ-инфекция распространена повсеместно. Вместе с тем распространенность ВИЧинфекции крайне неравномерна в различных регионах, разных возрастных, социальных и профессиональных группах. Наибольшее количество ВИЧ-инфицированных проживают в Центральной Африке (к югу от пустыни Сахары) и на Карибских островах. Важным показателем считают прирост числа новых случаев. В начале 80-х гг. ХХ в. максимальное количество случаев ВИЧ-инфекции регистрировали в Центральной Африке и в США, а к концу 2000 г. в эпидемию были
вовлечены уже все континенты. В России ВИЧ-инфекцию регистрируют с 1985 г., первоначально среди иностранцев, преимущественно выходцев из Африки, а с 1987 г. - среди граждан СССР. С 2006 г. ВИЧ-инфекцию обнаруживают и регистрируют во всех субъектах РФ.
До середины 90-х гг. ХХ в. в РФ основным путем передачи ВИЧ считали половой. Это определяло своеобразие эпидемического процесса инфекции. Со второй половины 1996 г. произошла смена ведущего пути передачи инфекции. Первое место заняло «инъекционное» заражение, как правило, среди наркоманов, практикующих парентеральное введение психоактивных веществ. В последние годы увеличивается значимость гетеросексуального пути передачи ВИЧ-инфекции. Об этом свидетельствует не только увеличение количества инфицированных (основной фактор риска для которых - гетеросексуальные контакты), но и рост доли инфицированных женщин. Вследствие этого повышается вероятность передачи ВИЧ-инфекции от матери к ребенку.
МЕРЫ ПРОФИЛАКТИКИ
Знание эпидемиологических и клинических особенностей ВИЧ-инфекции позволило разработать комплекс профилактических и противоэпидемических мероприятий. Профилактика только неспецифическая. Попытки создать вакцину до настоящего времени успеха не имели.
Неспецифическая профилактика
Неспецифическая профилактика заключается в предотвращении половой и перинатальной передачи ВИЧ; в контроле безопасности переливаемых компонентов крови и ее препаратов, а также в предупреждении передачи инфекции при проведении медицинских манипуляций. Большое значение имеет также оказание специфической специализированной медицинской помощи.
ПАТОГЕНЕЗ
Дифференцировочный антиген CD4+ (СD - аббревиатура от Cell Differention antigen) и неспецифические (независящие от наличия CD4+) компоненты - рецепторы для ВИЧ. CD4+ - гликопротеид с молекулярной массой 55 000 кД, по своему строению схожий с определенными участками Ig. Аналогичное строение имеет и белок вируса gp120; это и определяет способность проникновения вирионов в клетку.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Рецептор CD4+, расположенный на мембране иммунокомпетентных клеток, выполняет функцию распознавания антигенов (вместе с белками HLA - главного комплекса гистосовместимости II класса).
В организме человека существует целый ряд иммунокомпетентных, соматических и других клеток, несущих рецепторы для ВИЧ (табл. 21.9).
Оболочка ВИЧ содержит белки человеческого комплекса гистосовместимости I и II классов, поэтому проникновение вируса в организм не вызывает реакции
отторжения. Фиксация вирионов на поверхности клетки-мишени происходит при участии гликопротеина gp120. Гликопротеин gp41 обеспечивает слияние вирусной оболочки с мембраной клетки-мишени. Двухцепочечная РНК вируса проникает в клетку, где с помощью обратной транскриптазы происходит синтез одноцепочечной провирусной ДНК. Затем происходит формирование двухце-почечной ДНК, встраивающейся в ДНК клетки с помощью интегразы. Вирусная ДНК выполняет функцию матрицы для синтеза РНК, собирающей новую вирусную частицу.
Нередко при репликации ВИЧ возникают генетические ошибки. Таким образом происходит образование разных подтипов вируса.
После проникновения ВИЧ в СD4+-клетки начинается его репликация: чем активнее CD4+- клетки, тем интенсивнее репродукция вируса. Поэтому регуляторы, активирующие СD4+- клетки, обеспечивают увеличение репликации вируса.
К подобным регуляторам относят ФНО; фактор, стимулирующий колонии гра-нулоцитов и макрофагов (колониестимулирующий фактор) и ИЛ-6.
ИФН и трансформирующий фактор роста - регуляторы, тормозящие репликацию вируса. Как показали исследования, ФНО-α активирует транскрипцию провирусной ДНК ВИЧ-1 в хронически инфицированных Т-клетках и макрофагах. Моноциты, синтезирующие ФНО-α, не только индуцируют экспрессию ВИЧ-инфицированными клетками, но и стимулируют активацию латентного провируса. Регистрируют одновременную активность ФНО-α, ИЛ-6 и фактора, стимулирующего колонии гранулоцитов и макрофагов.
Иммунопатогенетические признаки ВИЧ-инфекции - дефицит Т-звена и В-звена иммунной системы; недостаток компонентов комплемента и фагоцитов; снижение функций неспецифических факторов защиты. Поликлональная активация В-лимфоцитов приводит, с одной стороны, к гипергаммаглобулинемии, а с другой - к ослаблению способности клеток продуцировать вируснейтрализую-щие антитела. Происходит увеличение количества ЦИК и образование антител к лимфоцитам; это вызывает еще большее уменьшение числа CD4+-Т- лимфоцитов. Отмечают развитие аутоиммунных процессов. Поражение иммунной системы при ВИЧ-инфекции носит системный характер.
Наряду с дефицитом CD4+-лимфоцитов в течение болезни нарастает функциональная недостаточность СD8+-лимфоцитов, NK-клеток (естественных киллеров) и нейтрофилов. При ухудшении иммунного статуса развиваются различные инфекционные, аллергические, аутоиммунные и лимфопролиферативные заболевания, а также синдром, свойственный болезни иммунных комплексов (эти факторы определяют клиническую картину ВИЧинфекции).
На начальных стадиях заболевания в организме вырабатываются вируснейтра-лизующие антитела, подавляющие активность свободно циркулирующих вирусов. Однако такие антитела не действуют на вирусы, находящиеся в клетках (провиру-сы). С течением времени (обычно после 5-6 лет) происходит истощение защитных возможностей иммунной системы и, следовательно, накопление вируса в крови.
КЛИНИЧЕСКАЯ КАРТИНА
Продолжительность инкубационного периода ВИЧ-инфекции составляет от 2 нед до 6 мес и более.
Период первичных клинических проявлений (острая стадия)
Острая стадия ВИЧ-инфекции может протекать скрыто или сопровождаться множественными неспецифическими симптомами. В 50-70% случаев наступает период первичных клинических проявлений, при этом отмечают лихорадку, ЛАП, эритематозную или макулопапулезную сыпь на лице, туловище и конечностях; миалгии или артралгии. Реже больные жалуются на диарею, головную боль,
тошноту, рвоту. Возможно увеличение печени и селезенки. Неврологические симптомы - менингоэнцефалит или серозный менингит - обнаруживают примерно у 12% больных. Длительность острой стадии инфекции - от нескольких дней до 2 мес. Как правило, из-за сходства признаков острой стадии с симптомами гриппа и других распространенных заболеваний распознать ВИЧ-инфекцию на данном этапе сложно. Кроме того, часто период острой стадии протекает бессимптомно. В течение данного периода подтвердить диагноз можно только при помощи ПЦР. ПЦР позволяет обнаружить РНК вируса. Иногда определяют протеин p24 - антиген ВИЧ.
Антитела к ВИЧ в период острой стадии, как правило, не обнаруживают. В первые 3 мес после заражения антитела к ВИЧ появляются у 90-95% пациентов, через 6 мес - у остальных 5-9%, а в более поздние сроки - только у 0,5-1%. В стадии СПИДа регистрируют существенное снижение содержания антител в крови.
Бессимптомный период
Следующий период ВИЧ-инфекции - бессимптомный, продолжающийся несколько лет - пациенты чувствуют себя удовлетворительно и ведут обычный образ жизни.
Генерализованная лимфаденопатия
После острой инфекции возможно развитие персистирующей генерализованной ЛАП. В исключительных случаях болезнь может сразу прогрессировать вплоть до терминальной стадии (СПИД).
При персистирующей генерализованной ЛАП отмечают увеличение как минимум двух групп ЛУ (от 1 см и более у взрослых, за исключением паховых ЛУ, и от 0,5 см - у детей), сохраняющееся не менее 3 мес. Наиболее часто увеличиваются шейные, затылочные и подмышечные ЛУ.
Продолжительность стадии персистирующей генерализованной ЛАП составляет 5-8 лет. В течение всего периода регистрируют периодические уменьшение и увеличение ЛУ. В стадию ЛАП отмечают постепенное снижение уровня CD4+-лимфоцитов. Пациентов, страдающих
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
бессимптомной инфекцией или персисти-рующей генерализованной ЛАП, выявляют при случайном обследовании (как правило, больные активно к врачу не обращаются).
Общая продолжительность инкубационного и бессимптомного периодов варьирует от 2 до 10-15 лет (в отдельных случаях и более).
Период вторичных клинических проявлений
За бессимптомным периодом следует симптоматическая хроническая фаза ВИЧ-инфекции, характеризующаяся развитием различных заболеваний вирусной, бактериальной, грибковой и протозойной природы, нередко протекающих благоприятно при традиционных методах лечения. Как правило, регистрируют повторные заболевания (отиты, синуситы и трахеобронхиты, тонзиллиты); поверхностные поражения кожи, слизистых оболочек (локализованная форма рецидивирующего простого герпеса, рецидивирующий опоясывающий герпес, кандидоз слизистых оболочек, дерматомикозы и себорея).
С течением времени такие инфекции приобретают затяжной характер и устойчивость к стандартным методам лечения, что обусловливает развитие более серьезных осложнений. Пациента могут беспокоить лихорадка, повышенная ночная потливость, диарея, потеря веса.
На фоне нарастающей иммуносупрессии развиваются тяжелые прогрессирующие заболевания, которые обычно не встречаются у людей с нормально функционирующей иммунной системой. Такие состояния называют СПИД-индикаторными.
Классификация
Согласно принятой в Российской Федерации классификации (приказ Минздравсоцразвития РФ от 17 марта 2006 г. № 166), выделяют следующие стадии ВИЧ-инфекции.
1.Инкубации.
2.Первичных проявлений, в которой выделяют: A. бессимптомную ВИЧ-инфекцию;
Б. острую ВИЧ-инфекцию без вторичных заболеваний; B. острую ВИЧ-инфекцию с вторичными заболеваниями.
3.Латентная (субклиническая).
4.Вторичных заболеваний.
A. Потеря массы тела менее 10%; грибковые, вирусные, бактериальные поражения кожи и слизистых оболочек; повторные фарингиты и синуситы; опоясывающий лишай. Фазы:
◊ прогрессирование:
-при отсутствии АРВТ;
-на фоне АРВТ; ◊ ремиссия:
-спонтанная;
-после ранее проводимой АРВТ; - на фоне АРВТ.
Б. Потеря массы тела более 10%; необъяснимая диарея или лихорадка более 1 мес; волосатая лейкоплакия; туберкулез легких; стойкие повторные вирусные, бактериальные, грибковые, протозойные поражения внутренних органов; локализованная саркома Капоши; повторный или диссеминированный опоясывающий лишай. Фазы: ◊ прогрессирование: - при отсутствии АРВТ; - на фоне АРВТ; ◊ ремиссия: - спонтанная;
- после ранее проводимой АРВТ; - на фоне АРВТ.
B. Кахексия; генерализованные вирусные, бактериальные, микобактери-альные, грибковые, протозойные, паразитарные заболевания, в том числе кандидоз пищевода, бронхов, трахеи, легких; пневмоцистная пневмония; внелегочный туберкулез; диссеминированная саркома Капоши; атипичные микобактериозы; злокачественные опухоли; поражения ЦНС различной этиологии. Фазы:
◊ прогрессирование:
-при отсутствии АРВТ;
-на фоне АРВТ; ◊ ремиссия:
-спонтанная;
-после ранее проводимой АРВТ; - на фоне АРВТ. 5. Терминальная.
Основные симптомы ВИЧ-инфекции и динамика их развития
Стадия первичных клинических проявлений начинается с периода серокон-версии [иногда в самом начале диагностируют острую (лихорадочную) стадию]. Стадия 2 наблюдается у 5070% пациентов и нередко предшествует наступлению сероконверсии. Клинические признаки острой стадии (часто имеют неспецифи-
ческий характер) - выраженная интоксикация, слабость, лихорадка, лимфаде-нопатия, эритематозно-макулезная сыпь, боли в мышцах и суставах, катаральные явления (иногда в сочетании с сыпью на коже), увеличение печени и селезенки: тонзиллит, полиаденит. Возможны преходящие нарушения деятельности ЦНС (от головных болей до острой обратимой энцефалопатии с потерей ориентации, памяти и нарушениями сознания, серозного менингита или менингоэнцефали-та). В сыворотке крови обнаруживают антитела к ВИЧ (не постоянно). Нередко антитела к ВИЧ выявляют в конце острой стадии. Острая стадия развивается не у всех пациентов, а вследствие трудности ее диагностики число таких случаев оценить сложно. Манифестное течение периода острой сероконверсии при ВИЧинфекции - неблагоприятный признак быстрого прогрессирования заболевания. Продолжительность лихорадочного состояния - от 1-2 нед до 1 мес. Подтвердить диагноз можно путем обнаружения методом ПЦР РНК ВИЧ, иногда определяется антиген ВИЧ - протеин р24.
Субклиническая стадия 3 наступает либо сразу после острой стадии, либо начинает стадию первичных проявлений. Этот период характеризуют положительные серологические реакции на ВИЧ при проведении ИФА и иммунного блот-тинга (ИБ) при отсутствии клинических признаков заболевания. Длительность субклинической стадии варьирует от 2-3 мес до нескольких лет.
В бессимптомную стадию возможно развитие персистирующей генерализованной ЛАП (в среднем продолжительность инфекционного процесса составляет от 6 мес до 5 лет). В данный период единственный клинический симптом заболевания - генерализованная ЛАП - увеличение ЛУ (не менее 1 см в диаметре) в двух или более несоприкасающихся внепаховых локусах, сохраняющее свой объем в течение по меньшей мере 3 мес при отсутствии какоголибо текущего заболевания. Помимо генерализованной ЛАП, наблюдают увеличение печени, селезенки; астенический синдром. Наблюдается постепенное снижение уровня CD4+- лимфоцитов. Общая продолжительность инкубационного и бессимптомного периодов от 2 до 10-15 лет и более.
Стадию вторичных заболеваний характеризуют развивающиеся на фоне иммунодефицита бактериальные, вирусные, грибковые, протозойные инфекции или опухолевые процессы. Стадию 4А рассматривают как переходный период от персистирующей генерализованной ЛАП к СПИД-ассоциированному комплексу. При этом длительность
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
инфекционного процесса составляет 3-7 лет и более. Отмечают более выраженный астенический синдром, снижение умственной и физической работоспособности, ночную потливость, периодические подъемы температуры до субфебрильных цифр, неустойчивый стул, потерю массы тела менее 10%. Эта стадия заболевания протекает без выраженных оппортунистических инфекций и инвазий, а также без развития саркомы Капоши и других злокачественных опухолей. Возможны различные заболевания кожи (иногда это обострившиеся прежние, но чаще - приобретенные), обусловленные грибковым, вирусным, бактериальным или другим поражением - себорейный или аллергический дерматит, псориаз, папулезная сыпь. Грибковое поражение кожи приводит к развитию онихомикоза, дерматомикоза стоп (кистей, голеней и других участков тела). Вирусные поражения - простой герпес, опоясывающий лишай, остроконечные кондиломы, контагиозный моллюск, бородавки. Стафилококковые и стрептококковые фолликулиты, импетиго и эктима - признаки бактериальных инфекций. На слизистых оболочках обнаруживают афты; развивается ангуляр-ный хейлит, гингивит. Нередко развиваются рецидивирующие инфекции верхних дыхательных путей, включая бактериальные синуситы.
Признаки прогрессирования заболевания (стадия 4Б) - общие симптомы без генерализации оппортунистических инфекций или опухолей, появляющиеся в более поздние стадии заболевания. Характерны необъяснимые длительная
лихорадка перемежающегося или постоянного типа и хроническая диарея (длительность симптомов - всегда больше месяца), потеря более 10% массы тела. Могут иметь место поражения кожи и слизистых оболочек грибковой (орофа-рингеальный кандидоз, реже - генитальной и перианальной областей), вирусной (волосатая лейкоплакия, повторный или рецидивирующий Herpes Zoster), телеангиэктазии, геморрагические высыпания, лейкопластический васкулит, гиперальгезивный псевдотромбофлебитический синдром и локализованная форма саркомы Капоши. При бактериальных поражениях кожи и слизистых оболочек возможно развитие вегетирующей, шанкриформной и диффузной форм хронической пиодермии, целлюлита, пиомиозита, пиогенных гранулем, фурункулов и абсцессов. Выявляют бактериальные (в том числе легочный туберкулез), вирусные, грибковые и протозойные поражения внутренних органов (без диссеминации).
Наблюдается тенденция к анемии, тромбоцитопении и лейкопении, обусловленной главным образом лимфопенией и лишь в незначительной степени - ней-тропенией. Вирус активно размножается и оказывает супрессорное воздействие на иммунную систему; нарастают признаки иммунодефицита. Определяют уменьшение количества CD4+-лимфоцитов до 200300 мкл-1, CD8+-лимфоцитов - до 1300 мкл-1; при этом соотношение количества CD4+/CD8+- лимфоцитов снижается
до 0,5.
Стадия 4В соответствует развернутому СПИДу. Как правило, симптомы данной стадии обнаруживают при длительно текущем инфекционном процессе (более 5 лет). Нарастающий иммунодефицит приводит к развитию двух основных клинических проявлений СПИДа: оппортунистические инфекции, вызванные условно-патогенной флорой, и новообразования. Любые патогенные микроорганизмы вызывают необычно тяжелое течение соответствующей инфекции.
Клинические состояния, возникающие на стадии 4В
Основные протозойные инфекции - токсоплазмоз головного мозга, протекающий в форме энцефалита, и криптоспоридиоз, характеризующийся длительной (более месяца) диареей. Наблюдаются случаи изоспоридиоза, микроспоридиоза, висцерального лейшманиоза, лямблиоза и амебиаза.
Группу грибковых инфекций составляют кандидоз пищевода и трахеи, бронхов и легких, пневмония, вызванная P. jirovecii; экстрапульмональный криптококкоз (протекает, как
правило, в форме менингита) или менингоэнцефалита. Нередко развиваются диссеминированные эндемичные микозы - гистоплазмоз, кокци-диоидоз и аспергиллез.
Основные вирусные заболевания - инфекции, вызванные ВПГ. ВПГ приводит к развитию длительно (более месяца) сохраняющихся признаков поражения кожи и слизистых оболочек; а также обусловливает возникновение генерализованной формы инфекции (любой продолжительности) с вовлечением в патологический процесс бронхов, легких, пищевода и нервной системы. У ВИЧ-инфицированных пациентов диагностируют ЦМВИ не только печени, селезенки и ЛУ, но и других органов (как правило, развивается генерализованная форма заболевания, с поражением сетчатой оболочки глаз, ЦНС, легких, пищевода и толстой кишки). Реже обнаруживают диссеминированный опоясывающий лишай, прогрессирующую мультифокальную лейкоэнцефалопатию (паповавирус), инфекцию, вызванную
ЭБВ.
Наиболее часто развивающиеся бактериальные инфекции - атипичный дис-семинированный микобактериоз с поражением легких, кожи, периферических ЛУ, ЖКТ, ЦНС и других органов; внелегочный туберкулез; нетифоидная сальмо-неллезная септицемия. Реже диагностируют стафилококковую и стрептококковую бактериемию, а также легионеллез.
Индикаторные опухолевые процессы СПИДа - диссеминированная саркома Капоши (при этом отмечают не только дерматологические признаки, но и поражения внутренних органов) и первичные неходжкинские лимфомы головного мозга (реже - другой локализации). Этиологию вторичных заболеваний, осложняющих 4-ю стадию ВИЧ-инфекции, во многом определяют бытовые, климатические и природные условия проживания больного ВИЧинфекцией.
Диагноз стадии 4В может быть поставлен на основании выраженных признаков энцефалопатии или кахексии - результата непосредственного действия вируса на ЦНС и органы пищеварительной системы. К таким признакам относят значительную непроизвольную потерю массы тела (более 10% от первоначальной), наличие хронической диареи и лихорадки (интермиттирующей или постоянной) на протяжении месяца и более, а также хроническую слабость. При этом оппортунистические инфекции или новообразования нередко отсутствуют.
В этот период развивается тромбоцитопения и глубокая иммуносу-прессия. Количество Т- лимфоцитов составляет <700-800 мкл-1, CD4+-лимфоцитов - <200 мкл-1, происходит резкое уменьшение числа CD8+-лимфоцитов до 400-500 мкл-1. Отношение количества CD4+/CD8+- лимфоцитов не превышает 0,3. При уменьшении количества CD4+-лимфоцитов до 50 мкл-
1 возрастает вероятность летального исхода. Развивается несостоятельность системы гуморального иммунитета. Болезнь прогрессирует, наступает терминальная, 5-я стадия, заканчивающаяся фатально.
Осложнения
Осложнениями ВИЧ-инфекции считают вторичные заболевания, развивающиеся на фоне иммунодефицита. Механизм их возникновения связан либо с угнетением клеточного и гуморального иммунитета (инфекционные болезни и опухоли), либо с прямым воздействием ВИЧ (например, поражения ЦНС).
Микобактериозы
Примерно у 65% больных ВИЧ-инфекцией диагностируют туберкулез как впервые возникшее заболевание, у остальных пациентов обнаруживают реактивацию процесса. ВИЧ существенно влияет на состояние иммунной системы (и на иммунореактивность) при туберкулезе, нарушает дифференцировку макрофагов и препятствует образованию специфических гранулем. В то время как на ранних стадиях ВИЧ-инфекции морфология
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
специфического воспаления существенно не меняется, на стадии СПИДа гранулемы просто не формируются. Особенность туберкулеза легких у больных ВИЧ-инфекцией - тяжелое течение заболевания с поражением бронхов и образованием свищей плевры, перикарда и ЛУ. Как правило, в 75-100% случаев у больных ВИЧ-инфекцией развивается легочная форма туберкулеза, однако по мере нарастания иммунодефицита у 25-70% пациентов отмечают диссеминацию и развитие внелегочных форм заболевания. Туберкулез - одна из основных причин смерти пациентов в России на стадии 4В (СПИД). Процессы, происходящие в легких больных СПИДом людей, - формирование корневой аденопатии и милиарных высыпаний; возникновение преимущественно интерстициальных изменений и образование плеврального выпота. При этом отмечают снижение количества случаев, сопровождающихся распадом легочной ткани, а следовательно, и числа больных, в мокроте которых при микроскопии и посеве обнаруживают микобактерии туберкулеза. Весьма характерным считают частое развитие туберкулезной микобактериемии у больных СПИДом, как правило, осложненной септическим шоком и нарушением функций различных органов. Нередко наблюдают поражение ЛУ (особенно шейных), костей, ЦНС, мозговых оболочек и органов пищеварительной системы; описаны абсцессы простаты и печени. Примерно у 60-80% ВИЧ-инфицированных пациентов туберкулез протекает
только с поражением легких, у 30-40% выявляют изменения других органов.
Группу возбудителей «нетуберкулезных» микобактериозов составляют представители различных видов микобактерий. Заболевания у человека вызывают 18 разновидностей микобактерий, 4 вида микроорганизмов обладают сравнительно высокой патогенностью для людей, а 14 видов относят к условно-патогенным. Атипичный микобактериоз, вызванный M. avium (входят в состав комплекса M. avium complex - МАС), - суперинфекция, составляющая группу СПИД-ассоциированных оппортунистических инфекций. До пандемии ВИЧинфекции атипичный микобактериоз диагностировали крайне редко, как правило, у лиц с выраженной иммуносупрессией (например, при трансплантации органов и тканей, после длительной кортикостероидной терапии, у онкологических больных). У пациентов, страдающих ВИЧ-инфекцией, иногда развивается дис-семинированная форма МАСинфекции. В терминальной стадии регистрируют локализованную или генерализованную формы заболевания. При локализованной МАС-инфекции обнаруживают абсцессы кожи и поражения ЛУ, а при генерализованной - общеинтоксикационный и желудочно-кишечный синдромы, а также синдром экстрабилиарной обструкции. Признаки общеинтоксикационного синдрома - лихорадка, астенизация, снижение массы тела, тяжелая анемия, лейкопения, повышение активности аланиновой трансаминазы в сыворотке крови. При желудочно-кишечном синдроме возникает хроническая диарея, боли в животе; отмечают гепатоспленомегалию, мезаденит и синдром мальабсорбции. Экстрабилиарная обструкция обусловлена перипортальным и перипанкреатиче-ским лимфаденитом, приводящим к билиарному блоку и токсическому гепатиту. Основой диагностики атипичных микобактериозов считают выделение гемокуль-туры микобактерий Пневмоцистная пневмония
Возбудитель - P. jirovecii. Инфицирование происходит воздушно-капельным, аэрогенным, ингаляционным и трансплацентарным путем (редко). Пневмоцисты обладают высокой тропностью к легочной ткани, поэтому даже в фатальных случаях патологический процесс редко выходит за пределы легких (это связывают с крайне низкой вирулентностью возбудителя). Клинические формы пневмоцисто-за - интерстициальная пневмония и реактивный альвеолит. Симптомы неспецифичны. Продолжительность инкубационного периода пневмоцистной пневмонии от 8-10 дней до 5 нед. Начало заболевания трудно отличить от других инфекций респираторного тракта. Характерно раннее появление одышки (частота дыхательных движений до 30-50 в минуту), которая сопровождается сухим или влажным кашлем со скудной, вязкой (иногда пенистой) мокротой, цианозом, повышением температуры тела. Плевральные боли и кровохарканье возникают редко. При аускультации
выслушивают жесткое или ослабленное дыхание (локально или над всей поверхностью легких), сухие хрипы. По мере прогрессирования пневмонии могут нарастать симптомы дыхательной и сердечно-сосудистой недостаточности. Рентгенологическая картина вначале неспецифическая, затем обнаруживают прикорневое снижение пневматизации легочной ткани и усиление интерстициального рисунка. Более чем в половине случаев визуализируют билатеральные облако-видные инфильтраты (симптом «бабочки»), а в разгаре заболевания - обильные очаговые тени («ватное» легкое). В дальнейшем на рентгенограммах определяют преимущественно паренхиматозную пневмонию. В 10-30% случаев отмечают асимметричные, как правило, верхнедолевые инфильтраты. При проведении КТ обнаруживают периферические инфильтраты (иногда с очагами распада), снижение прозрачности («матовое стекло») и эмфизематозные участки. Пневмоторакс - наиболее часто возникающее осложнение.
При исследовании крови определяют гипохромную анемию, лейкоцитоз (до 50 × 109/л) и эозинофилию. При проведении биохимического анализа крови обнаруживают повышение активности ЛДГ до 700-800 МЕ/л. Определение РаО2 позволяет выявить артериальную гипоксемию. Диагноз подтверждают обнаружением пневмоцист в мокроте, лаваже бронхов с помощью различных методов (иммунофлюоресценция, окрашивание образцов по Романовскому-Гимзе и Граму), а также проводят ПЦР-диагностику.
Открытую биопсию легкого выполняют при прогрессирующем течении заболевания. Макроскопически во время операции легкое больного выглядит увеличенным, уплотненным, консистенция его напоминает резину; отмечают буллезные и эмфизематозные изменения, обнаруживают полости распада. Интраальвеолярный пенистый экссудат, диффузные альвеолярные повреждения, эпителиоидные гранулемы, десквамативный интерстициальный пневмонит, интерстициальные лимфоидные инфильтраты - гистологические изменения в ткани легкого при пневмоцистной пневмонии. Выживаемость больных СПИДом при развитии пневмоцистной пневмонии не превышает 55%. Прогноз значительно ухудшается, если лечение начинают на фоне ОДН, тяжелой гипоксии или при лейкопении. Летальность у больных СПИДом составляет от 52,5 до 100%, а при осуществлении
ИВЛ - 58-100%. Цитомегаловирусная инфекция
ЦМВИ, как правило, протекает латентно. Однако иногда диагностируют клинически выраженные формы заболевания, обусловленные первичным инфицированием ЦМВ, а также реинфекцией или реактивацией вируса в зараженном организме. Генерализованная ЦМВИ, сопровождающаяся появлением клинических симптомов, занимает важное место в структуре оппортунистических заболеваний ВИЧ-инфицированных. Ее регистрируют у 20-40% больных СПИДом, не принимающих антиретровирусные препараты. ЦМВИ - непосредственная причина смерти 10-20% ВИЧ-инфицированных. Вероятность возникновения и тяжесть течения ЦМВИ связывают со степенью иммуносупрессии. Если количество CD4+-лимфоцитов в крови составляет 100-200 мкл-1, то манифестную ЦМВИ диагностируют у 1,5% ВИЧ-инфицированных. При уменьшении числа CD4+-лимфоцитов до 50-100 мкл-1 вероятность развития ЦМВИ увеличивается почти в 4 раза. При тотальном снижении CD4+-лимфоцитов (<50 мкл-1) заболевание регистрируют практически у половины инфицированных пациентов. Если содержание CD4+-лимфоцитов в крови достаточно велико (>200 мкл-1), то манифестацию ЦМВИ отмечают редко. ЦМВИ, как правило, развивается постепенно, при этом обнаруживают симптомы-предвестники, предшествующие формированию выраженных органных нарушений. У взрослых отмечают длительную волнообразную лихорадку неправильного типа с подъемами температуры тела выше 38,5 °С, слабость, быструю утомляемость, потерю аппетита, существенное снижение веса; реже - потливость (преимущественно по ночам), артралгии или миалгии. При поражении легких появляется постепенно усиливающийся сухой или со скудной мокротой кашель. На аутопсии
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
обнаруживают фиброателектаз легких с кистами и инкапсулированными абсцессами. Наиболее тяжелый признак ЦМВИ - ретинит (диагностируют у 25-30% пациентов). Больные жалуются на плавающие пятна перед глазами, затем происходит снижение остроты зрения. Потеря зрения необратима в результате воспаления и некроза сетчатки. При ЦМВ-эзофагите у больного при глотании возникает боль за грудиной. При эндоскопии в типичном случае визуализируют обширную поверхностную язву слизистой оболочки пищевода или желудка. Гистологические методы позволяют обнаружить клетки цитомегалии (гигантские многоядерные клетки с внутриядерными включениями) в биоптате; с помощью метода ПЦР можно определить ДНК вируса. ЦМВ может поражать различные органы пищеварительной системы, но чаще развивается колит. Пациента беспокоят
боли в животе, жидкий стул, похудание и потеря аппетита. Перфорация кишки - наиболее грозное осложнение. Как возможные клинические симптомы ЦМВИ диагностируют также восходящий миелит и полиневропатию (подострого течения); энцефалит, характеризующийся деменцией; ЦМВ-гепатит с одновременным поражением желчных путей и развитием склерозирующего холангита; адреналит, проявляющийся резкой слабостью и снижением АД. Иногда возникает эпидидимит, цервицит, панкреатит.
Специфическое поражение сосудов преимущественно микроциркуляторного русла и сосудов мелкого калибра - морфологическая особенность патологического процесса при ЦМВИ. Для постановки клинического диагноза «ЦМВИ» необходимо проводить лабораторные исследования. Наличие в крови больного антител класса IgM (или высоких титров антител класса IgG), а также присутствие ДНК вируса в слюне, моче, сперме и вагинальном секрете недостаточно для подтверждения диагноза манифестной ЦМВИ. Обнаружение вируса (его антигенов или ДНК) в крови имеет диагностическое значение. Достоверным критерием высокой активности ЦМВ, доказывающим его этиологическую роль в развитии тех или иных клинических симптомов, служит вирусная нагрузка ЦМВ. При повышении вирусной нагрузки в плазме в 10 раз вероятность развития ЦМВИ возрастает в 3 раза. Определение высокой концентрации ДНК вируса в лейкоцитах крови и плазме требует безотлагательного начала этиотропной терапии.
Токсоплазмоз
Токсоплазмоз - заболевание, вызываемое T. gondii, чаще всего возникающее при уровне CD4+-лимфоцитов <100 мкл-1. Попадание токсоплазм в организм человека приводит к формированию объемных образований в ЦНС (в 50-60% случаев) и появлению первичных эпилептических припадков (в 28% случаев). Токсоплазма - внутриклеточный паразит; заражение человека происходит при употреблении в пищу продуктов (мясо и овощи), содержащих ооцисты или тканевые цисты. Полагают, что развитие токсоплазмоза - реактивация латентной инфекции, поскольку при наличии в сыворотке крови антител к токсоплазме вероятность возникновения токсоплазмоза увеличивается в 10 раз. Однако примерно у 5% ВИЧ-инфицированных на момент постановки диагноза токсоплаз-моза антитела к T. gondii отсутствуют. Заражение обычно происходит в детском возрасте. Цисты токсоплазм сохраняются до 10-15 лет, преимущественно в тканях головного мозга и органа зрения, а также во внутренних органах. Патоморфологические изменения при токсоплазмозе имеют фазовый характер. В паразитемической фазе токсоплазмы поступают в регионарные ЛУ, затем проникают в кровеносное русло и распространяются по органам и тканям. Во 2-й фазе происходит фиксация токсоплазм в висцеральных органах, приводящая к развитию некротических и воспалительных изменений и образованию мелких гранулем. В течение третьей (заключительной) стадии токсоплазмы в тканях формируют истинные цисты; воспалительная реакция исчезает, очаги некроза подвергаются обызвествлению. Хотя токсоплазмы могут поражать все органы и ткани, как правило, у ВИЧ-инфицированных регистрируют церебральную форму заболевания. Отмечают лихорадку, головные боли, в 90% случаев разнообразную очаговую неврологическую симптоматику (гемипарез, афазия, психические и некоторые другие нарушения). При отсутствии адекватного лечения
развиваются спутанность сознания, оглушенность, сопор и кома в результате отека головного мозга. При выполнении МРТ или КТ с контрастированием обнаруживают множественные очаги с кольцевидным усилением и перифокальным отеком, реже - единичный очаг. Дифференциальную диагностику проводят с лимфо-мой головного мозга, опухолями другой этиологии, СПИД-дементным синдромом, мультифокальной лейкоэнцефалопатией и туберкулемами. Почти в каждом случае диагностируют преимущественное поражение определенных органов и систем.
Иногда токсоплазмоз протекает без формирования объемных образований в головном мозге (по типу герпетического энцефалита или менингоэнцефа-лита). Внемозговые локализации токсоплазмоза (например, интерстициальная пневмония, миокардит, хориоретинит и поражение органов пищеварительной системы) у ВИЧ-инфицированных с выраженным иммунодефицитом регистрируют в 1,5-2% случаев. Максимальное количество очагов внемозговой локализации обнаруживают при исследовании зрительного аппарата глаза (примерно в 50% случаев). Диссеминация (по меньшей мере две локализации) происходит в 11,5% случаев. Диагностировать токсоплазмоз крайне сложно. Ликвор при спинномозговой пункции может быть интактным. Диагноз токсоплазмоза устанавливают на основании клинической картины, данных МРТ или КТ, а также при наличии антител к токсоплазме в сыворотке крови и ДНК токсоплазмы в биоматериале. Саркома Капоши
Саркома Капоши - многоочаговая сосудистая опухоль, поражающая кожу, слизистые оболочки и внутренние органы. Развитие саркомы Капоши связывают с HHV-8, который впервые обнаружили в коже больного с этой опухолью. В отличие от эндемического и классического вариантов заболевания, эпидемическую форму саркомы регистрируют только у ВИЧ-инфицированных (преимущественно у гомосексуалов).
В патогенезе саркомы Капоши ведущую роль отводят не злокачественному перерождению клеток, а нарушению продукции цитокинов, контролирующих клеточную пролиферацию. Инвазивный рост для данной опухоли нехарактерен. При гистологическом исследовании саркомы Капоши обнаруживают усиленную пролиферацию веретенообразных клеток, сходных с эндотелиальными и глад-комышечными клетками сосудов. Саркома у ВИЧинфицированных протекает неодинаково. У одних больных диагностируют легкую форму заболевания, у других - более тяжелую. Клинические признаки саркомы Капоши разнообразны. Чаще всего развиваются поражения кожи, ЛУ, органов пищеварительной системы и легких. Разрастание опухоли может приводить к лимфатическому отеку окружающих тканей. В 80% случаев поражение внутренних органов сочетается с вовлечением в патологический процесс кожи. На начальных стадиях заболевания на коже или слизистой оболочке формируются небольшие возвышающиеся красно-лиловые узлы, нередко возникающие на месте травмы. Вокруг узловых элементов иногда обнаруживают мелкие темные пятна или желтоватый ободок (напоминают синяки). Диагноз саркомы Капоши ставят с учетом гистологических данных. При биопсии пораженных участков отмечают пролиферацию веретенообразных клеток, диапедез эритроцитов; обнаруживают содержащие гемосидерин макрофаги, а также воспалительные инфильтраты. Одышка - первый признак поражения легких при саркоме Капоши, иногда наблюдают кровохарканье. На рентгенограммах грудной клетки определяют двусторонние затемнения в нижних долях легких, сливающиеся с границами средостения и контуром диафрагмы; нередко обнаруживают увеличение прикорневых ЛУ. Саркому Капоши следует дифференцировать с лимфомами и микобактериальной инфекцией, протекающей с поражением кожи. У 50% больных диагностируют поражение органов пищеварительной системы, а в тяжелых случаях возникает кишечная непроходимость или кровотечение. Вовлечение в патологический процесс желчных путей приводит к развитию подпеченочной желтухи.
Летальность и причины смерти
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Смерть больных ВИЧ-инфекцией наступает либо от прогрессирования вторичных заболеваний, либо от любых других сопутствующих заболеваний, не связанных с ВИЧ. Генерализованный туберкулез - основная причина гибели больных
СПИДом. Кроме того, причиной смерти считают легочную патологию (с последующим развитием ДН) и манифестную ЦМВИ. В последнее время регистрируют увеличение летальности вследствие цирроза печени, обусловленного наличием ХГC на фоне хронической алкогольной интоксикации. Прогрессирование хронического гепатита в цирроз у таких пациентов происходит в течение 2-3 лет.
ДИАГНОСТИКА Клиническая диагностика
Для диагностики ВИЧ-инфекции необходимо лабораторное подтверждение. Проводят клиническую диагностику вторичных или сопутствующих заболеваний на фоне ВИЧинфекции; это позволяет определить тяжесть состояния больного, показания к госпитализации и тактику лечения.
Специфическая и неспецифическая лабораторная диагностика
Для подтверждения диагноза ВИЧ-инфекции используют вирусологический, молекулярногенетический (ПЦР) и серологические методы (ИФА) и ИБ.
Антитела к ВИЧ определяют через 2 нед с момента заражения. При регистрации первого положительного результата ИФА повторяют. После получения второго положительного ответа данную сыворотку крови направляют на исследование в территориальный центр профилактики и борьбы со СПИДом, где проводят ИБ, результаты которого оценивают как положительные, сомнительные или отрицательные.
При обнаружении в сыворотке крови пациента антител к любым двум или трем гликопротеинам оболочки ВИЧ (gp41, gp120 и gp160) одновременно пробы считают положительными. При отсутствии в сыворотке крови антител ко всем антигенам пробы оценивают как отрицательные. Если в крови обнаруживают антитела к одному гликопротеину ВИЧ или каким-либо другим его протеинам, пробы считают сомнительными, требующими проведения повторного исследования.
Выделение и идентификация культуры ВИЧ (вирусологический метод) - достоверный критерий оценки инфицирования. В силу сложности проведения данное исследование используют в научных целях в исключительно трудных для диагностики случаях.
Количественный анализ в ПЦР позволяет оценить репликативную активность вируса; определить «вирусную нагрузку». В стадии первичных проявлений «вирусная нагрузка» составляет обычно несколько тысяч копий в 1 мл крови. В стадии вторичных заболеваний концентрация ВИЧ достигает сотен тысяч копий в 1 мл сыворотки крови и миллиона копий вируса в стадии 4В.
Стойкая высокая концентрация ВИЧ на ранней стадии болезни - неблагоприятный прогностический признак, свидетельствующий о высокой вирулентности штамма.
Первичная диагностика ВИЧ-инфекции - ответственная процедура, требующая тщательного анализа данных, ибо постановка неправильного диагноза может иметь тяжелые последствия для больного (депрессивная реакция, суицидальная попытка, СПИДофобия).
Стандарт диагностики
Обнаружение в ИФА антител к ВИЧ с последующим подтверждением их специфичности ИБ - стандартная процедура.
Показания к консультациям других специалистов
Перед началом АРТ всех пациентов с ВИЧ-инфекцией осматривает терапевт, невролог, оториноларинголог и офтальмолог для определения противопоказаний к назначению тех или иных препаратов. Кроме того, больных, употреблявших ранее или применяющих постоянно психоактивные вещества, направляют на консультацию к наркологу. Всех пациентов с легочной патологией, особенно при неэф-
фективности антибактериальной терапии, осматривает фтизиатр. Консультации других специалистов осуществляют по показаниям, в зависимости от выявленной патологии (вторичных или сопутствующих заболеваний), для определения объема дополнительных обследований или решения вопроса о переводе больного в узкоспециализированное отделение или стационар.
Пример формулировки диагноза
При постановке диагноза указывают нозологическую единицу заболевания - ВИЧ-инфекция по МКБ-10, затем - стадию ВИЧ-инфекции, вторичные заболевания и фазу. Если на фоне ВИЧ-инфекции хотя бы одно из вторичных заболеваний имеет степень проявления, соответствующую критериям СПИДа, то после стадии заболевания указывают «(СПИД)».
Например
Z21 Бессимптомный инфекционный статус, вызванный вирусом иммунодефицита человека (ВИЧ).
ВИЧ-инфекция, стадия 3 (субклиническая).
B20.4 Болезнь, вызванная ВИЧ, с проявлениями кандидоза.
ВИЧ-инфекция, стадия вторичных заболеваний 4А, фаза спонтанной ремиссии: орофарингеальный кандидоз в анамнезе.
B20.6 Болезнь, вызванная ВИЧ, с проявлениями пневмонии, вызванной P. jirovecii.
ВИЧ-инфекция, стадия вторичных заболеваний 4В (СПИД), фаза прогресси-рования при отсутствии АРТ: пневмоцистная пневмония, кандидоз полости рта и пищевода.
B20.2 Болезнь, вызванная ВИЧ, с проявлениями цитомегаловирусного заболевания.
ВИЧ-инфекция, стадия вторичных заболеваний 4В (СПИД), фаза ремиссии на фоне АРТ: манифестная ЦМВИ с поражением сетчатки в анамнезе.
Показания к госпитализации
Госпитализацию больных ВИЧ-инфекцией осуществляют с учетом тяжести состояния и клинических данных, в зависимости от наличия вторичных или сопутствующих заболеваний.
ЛЕЧЕНИЕ Режим и диета Режим и диету больным назначают соответственно установленным нозологическим формам. Медикаментозная терапия Этиотропная терапия
Современный арсенал лекарственных препаратов позволяет подавить репликацию ВИЧ у большей части больных, как правило, на довольно длительный срок и замедлить прогрессирование заболевания в стадию СПИД.
Антиретровирусные препараты, разрешенные к применению в Российской Федерации.
• НИОТ: абакавир, абакавир + ламивудин, диданозин, зидовудин, зидовудин + абакавир + ламивудин, зидовудин + ламивудин, ламивудин, ставудин, тенофо-вир, тенофовир + эмтрицитабин, фосфазид.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
•ННИОТ: эфавиренз, невирапин, этравирин, рилпивирин.
•ИП: атазанавир, дарунавир, индинавир, лопинавир + ритонавир, нелфинавир (не используется), ритонавир (практически не используется как ИП, применяют в качестве бустера), саквинавир, типранавир, фосампренавир.
•Ингибиторы фузии (слияния): энфувиртид.
•ИИ: ралтегравир, долутегравир.
•Антагонисты CCR5-рецепторов (АР): маравирок.
•Фиксированная комбинация ННИОТ + НИОТ: рилпивирин + тенофовир + эмтрицитабин (табл. 21.10)

Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Факторы, учитываемые при решении вопроса о назначении антиретровирусных препаратов.
•Степень иммунодефицита (оценивают на основании количества CD4+-лимфоцитов).
•Риск прогрессирования болезни (определяют по уровню РНК ВИЧ в крови).
•Готовность и желание пациента начать лечение.
•Возраст пациента.
•Наличие ко-инфекции ВИЧ/ХГВ и/или ВИЧ/ХГС.
•Наличие вторичных и сопутствующих заболеваний, нефропатии.
•Эпидемиологические особенности (дискордантная пара, подготовка пациента к применению вспомогательных репродуктивных технологий).
•Осведомленность пациента о возможных побочных эффектах препаратов и об изменении качества жизни.
•Выбор стартовой терапии для достижения стойкого вирусологического ответа и сохранение максимального выбора комбинаций препаратов для последующего использования.
•Фармакоэкономическая целесообразность выбора различных схем антивирусной терапии (АРВТ).
Для начала АРВТ существуют определенные показания. Разработаны различные схемы применения препаратов (схемы 1-го, 2-го и 3-го ряда), составленные с учетом проведенных клинических исследований эффективности антиретровирус-ных препаратов (АРВП) (табл. 21.11, 21.12).
Таблица 21.11. Показания к проведению АРВТ (при уровне доказательной базы менее AI решение о необходимости назначения АРВТ принимают коллегиально)

Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Возникновение мутантных штаммов вируса - одна из основных причин вирусологической неудачи АРВТ.
Принципы изменения режима АРВТ при неэффективности схемы первого ряда
Наиболее важными принципами выбора препаратов для новой схемы АРВТ при вирусологической неэффективности текущей схемы АРВТ являются следующие: ◊ проводить смену АРВТ по результатам теста на резистентность (AII); ◊ при наличии возможностей осуществлять замену препаратов внутри фармакологических групп (АН);
◊включать в схему по крайней мере 2, а лучше 3 АРВП (принадлежащих к ≥2 фармакологическим группам), которые обладают активностью против данной популяции вируса по результатам проведенных тестов на резистентность;
◊при оценке резистентных свойств вируса следует учитывать результаты всех тестов на резистентность и сведения обо всех принимавшихся ранее АРВП;
◊устранить факторы, препятствовавшие адекватному ответу на прежнюю или текущую схему терапии;
◊менять схему терапии по причине вирусологической неэффективности следует как можно быстрее во избежание накопления дополнительных мутаций резистентности, сужающих спектр активных АРВП для применения в будущем. Исключения составляют ламивудин и эмтрицитабин;
◊не прерывать АРВТ за исключением случаев тяжелых побочных эффектов;
◊если АРВТ прервана, тест на резистентность назначается не позднее 2 нед перерыва;
◊не ограничиваться добавлением еще одного АРВП к неэффективной схеме
АРВТ.
Схемы лечения пациентов с множественной резистентностью к АРВП
Множественная резистентность к АРВП - это наличие резистентности к препаратам различных фармакологических групп. Лечение пациентов с таким видом резистентности представляет наиболее сложную задачу, требует повышенного внимания врача. Даже при правильно интерпретированных результатах исследования резистентности вируса только опытный специалист по лечению ВИЧ-инфекции должен начинать, прекращать или менять АРВТ.
Рекомендуется следующее.
•Индивидуальный режим наблюдения, более частый клинический и лабораторный мониторинг (BIII).
•Назначение препаратов в соответствии с исследованием профиля резистентности вируса методом секвенирования генома.
•Для лечения больных с множественной резистентностью к АРВП возможно назначение в одной схеме ИП и ННИОТ; ИП, ННИОТ и ИИ; двух ИП с соответствующей коррекцией доз.
•С учетом наименьшего риска мутаций в схемах лечения таких больных - дарунавир/ритонавир в дозировке 600/100 мг 2 р/сут (BII).
•В схемах лечения используются ингибиторы интегразы, ингибиторы слияния,
АР.
•В целях быстрого подавления вирусной нагрузки рекомендуется введение в схему энфувиртида в качестве 3-го или 4-го компонента. По достижении вирусологической и иммунологической эффективности проводится переключение с энфувиртида на ралтегравир.
•Симплификация схем лечения больным, у которых была зафиксирована резистентность к антивирусным препаратам, не допускается.
Принцип подхода к лечению пациентов с ВИЧ-инфекцией - пожизненное применение антиретровирусных препаратов.
Патогенетическая терапия и схемы лечения вторичных заболеваний, наиболее часто регистрируемых у ВИЧ-инфицированных пациентов
При лечении больных ВИЧ-инфекцией немаловажную роль играет терапия вторичных и сопутствующих заболеваний. В большинстве случаев лечение таких болезней имеет приоритет перед началом АРВТ, поскольку тяжесть состояния пациента определяет наличие той или иной нозологии.
Цитомегаловирусная инфекция Лечение манифестной ЦМВИ.
•Проводят 3-недельную терапию ганцикловиром в дозе 5 мг/кг 2 р/сут в/в медленно в течение часа.
•Назначают валганцикловир в дозе 900 мг 2 р/сут внутрь в течение 3 нед (менее предпочтительно).
Лечение и вторичная профилактика активной ЦМВИ.
•Применяют валганцикловир внутрь по 900 мг 1 р/сут в течение 30 дней.
•Проводят 4-недельную терапию ганцикловиром по 5 мг/кг 1 р/сут в/в капель-но в течение часа (менее предпочтительно).
ГИ, вызванная ВПГ 3-го типа (Varicella-Zoster), лечение проводят не менее 10 дней.
•Назначают ацикловир по 800 мг 5 р/сут (внутрь) или по 750-1000 мг 3 р/сут (в/в).
•Применяют валацикловир по 1 г 3 р/сут (внутрь).
•Используют фамцикловир по 500 мг 3 р/сут в течение 7-10 дней (внутрь). Пневмоцистная пневмония Схема выбора.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
• Триметоприм/сульфаметоксазол, 5/25 мг/кг внутрь или в/в капельно каждые 6 ч в течение 28 сут.
Альтернативные схемы.
• Клиндамицин в дозе 600-900 мг в/в каждые 6-8 ч.
Первичная и вторичная профилактика пневмоцистной пневмонии (при уровне CD4+- лимфоцитов <200 мкл-1): триметоприм/сульфаметоксазол, 80/400 мг 2 р/сут через день до повышения количества CD4+-лимфоцитов ≥200 мкл-1. При непереносимости триметоприма/сульфаметоксазола используют дапсон, 100 мг внутрь 1 р/сут. При рО2 <70 мм рт.ст. или альвеолярно-артериолярном градиенте по кислороду >35 мм рт.ст.
назначается преднизолон 1 мг/кг с последующим уменьшением дозы, а также оксигенотерапия до повышения количества CD4+-лимфоцитов ≥200 мкл-1.
Токсоплазмоз (чаще диагностируют церебральную форму)
Лечение токсоплазмоза начинают при малейшем подозрении на данное заболевание, не дожидаясь результатов обследования.
Схема выбора.
• Пириметамин/сульфадоксин (25/500 мг), 200 мг (8 таблеток) из расчета по пириметамину в 1-й день, далее 50 мг (при массе тела <60 кг) или 75 мг (при массе тела >60 кг) в сутки в сочетании с фолинатом кальция (по 25 мг) в/м не менее 6 нед (до элиминации не менее 75% очагов на МРТ головного мозга).
Альтернативные схемы.
Триметоприм/сульфаметоксазол, 5/25 мг/кг внутрь или в/в капельно 2 р/сут не менее 6 нед (до элиминации не менее 75% очагов на МРТ головного мозга). Вторичная профилактика токсоплазмоза - половинные дозы лечебного курса в течение 6 мес после достижения уровня CD4+-лимфоцитов >200 мкл-1.
Саркома Капоши
АРТ - основной метод, позволяющий предотвратить прогрессирование заболевания и добиться клинического улучшения. При тяжелой форме саркомы Капоши, протекающей с вовлечением в патологический процесс внутренних органов, назначают проспидия хлорид в дозе 100 мг в/м в течение 30 сут; или доксоруби-цин липосомальный в дозе 20 мг/м2, повторяют через 2-3 нед; или даунорубицин липосомальный в дозе 40 мг/м2, повторяют через 2-3 нед.
Кандидозный стоматит Схема выбора.
•Флуконазол 100 мг внутрь 1 р/сут до достижения клинического эффекта. Альтернативные схемы.
•Флуконазол по 100 мг/сут до исчезновения симптомов.
•Нистатин в дозе 500 000 ЕД 5 р/сут.
•Кетоконазол 200 мг внутрь 1 р/сут.
Кандидозный эзофагит Схема выбора.
• Флуконазол в дозе 400 мг в 1-е сутки, далее 200 мг/сут внутрь в течение 2-3 нед.
Альтернативные схемы.
•Итраконазол 100-200 мг 2 р/сут в течение 2-3 нед.
•Амфотерицин В 0,3-0,7 мг/кг/сут в/в капельно в течение 5-7 сут.
•Вориконазол, с учетом рекомендуемой насыщающей дозы. Криптококковая инфекция с поражением центральной нервной системы
Схема выбора.
•Амфотерицин B [липидный комплекс] (Амфолип♠), амфотерицин B [холестерилсульфатный комплекс] (Амфоцил♠) 0,7 мг/кг/сут в/в капельно в сочетании с 5- флуцитзиномρ внутрь по 100 мг/кг/сут в течение 4-6 нед (индукционная схема). Затем назначают флуконазол в дозе 400 мг/сут в течение 2 мес или до санации ликвора. Заключительный этап - поддерживающая терапия флуконазолом (200 мг/сут) до повышения количества CD4+-лимфоцитов ≥200 мкл-1.
Альтернативные схемы.
•Амфотерицин В в дозе 0,7-1,0 мг/кг/сут в/в в течение 2 нед в сочетании с флуконазолом внутрь по 400 мг/сут в течение 8-10 нед.
•Итраконазол по 200 мг 2 раза в день в течение до 8 нед.
•Флуконазол внутрь по 400-800 мг/сут в комбинации с 5-флуцитзиномr внутрь по 100 мг/кг/сут в течение 6-10 нед.
•Используют амфотерицин В липосомальный по 4 мг /кг/сут в/в капельно в течение 2 нед. Затем флуконазол по 400 мг/сут в течение 8-10 нед.
•Вориконазол, с учетом рекомендуемой насыщающей дозы. Микобактериальная инфекция
При лечении микобактериозов, обнаруженных у ВИЧ-инфицированных, назначают стандартные препараты и используют обычные схемы дозирования.
Особенности терапии микобактериальной инфекции у ВИЧ-инфицированных пациентов.
• При уменьшении количества СD4+-лимфоцитов (<100 мкл-1) пациентам
назначают рифампицин или рифабутин не реже 3 раз в неделю, поскольку более редкий прием препаратов приводит к формированию резистентности возбудителя. Длительность лечения определяют индивидуально.
•При сильном снижении количества СD4+-лимфоцитов (<50 мкл-1) для терапии туберкулеза используют не менее 4 препаратов в течение 2 мес; затем оставляют 2 препарата (их применяют в течение 4,5 мес). Если при анализе мокроты после 2 мес лечения получают положительные результаты, то терапию проводят в течение последующих 7 мес.
•При обнаружении внелегочных форм туберкулеза назначают стандартные схемы лечения туберкулеза легких. Исключение составляют милиарный туберкулез, туберкулез костей и суставов, туберкулезный менингит (лечение проводят в течение 12 мес).
•Нельзя одновременно начинать лечение туберкулеза и ВИЧ-инфекции вследствие наложения побочных эффектов используемых препаратов, неблагоприятных лекарственных взаимодействий, требований к соблюдению режима приема препаратов и вероятности парадоксальных реакций, связанных с восстановлением иммунной системы. АРТ и противотуберкулезное лечение можно начинать одновременно при резком уменьшении СD4+- лимфоцитов до 50 мкл-1 (если пациент хорошо переносит противотуберкулезную терапию).
•Не рекомендуют при проведении противотуберкулезной терапии использовать ИП и ННИОТ, за исключением эфавиренза, ритонавира и комбинации ритонавира и саквинавира.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Гепатит
Принципы лечения ХГC у больных ВИЧ-инфекцией соответствуют таковым у пациентов без ВИЧ-инфекции. ХГC у больных ВИЧ-инфекцией может приводить к увеличению частоты и скорости прогрессии цирроза печени, печеночно-клеточному раку, высокому риску повышения активности аминотрансфераз на
фоне АРТ.
Лечение ГC показано всем ВИЧ-инфицированным с ВИЧ/ХГC (при наличии РНК ВГC в крови).
Начальный этап противовирусной терапии ХГC у больных ВИЧ-инфекцией представлен в таблице (табл. 21.13).
Таблица 21.13. Начальные этапы противовирусной терапии хронического вирусного гепатита С у пациентов с ВИЧ-инфекцией
В настоящее время появились новые препараты с прямым противовирусным действием в отношении ВГC, которые могут применяться без ИФН (± рибавирин) и способны привести к элиминации HCV за 12-24 нед в зависимости от исходного состояния печени. Из всего имеющегося спектра таких препаратов в Российской Федерации в настоящее время зарегистрированы препараты для лечения только при инфекции, вызванной 1-м генотипом ВГC.
К ним относятся:
1)интерфероновые схемы: симепревир, который используется в сочетании с пэгилированным ИФН-α и рибавирином;
2)безинтерфероновые схемы: омбитасвир + паритапревир + дасабувир + рито-
навир, даклатасвир, асунапревир.
Лечение такими препаратами и используемые схемы аналогичны как у больных без ВИЧинфекции, так и у ВИЧ-инфицированных. Однако при одновременном лечении ВИЧинфекции и ВГC с использованием безинтерфероновых схем следует учитывать межлекарственные взаимодействия.
Назначение иммуноглобулинов больным ВИЧ-инфекцией можно рассматривать как патогенетическую терапию.
Показания к применению иммуноглобулинов.
•Иммунодефицит (с заместительной целью).
•Идиопатические тромбоцитопении с аутоиммунным механизмом развития (по 20 г белка в сутки).
•Тяжелые бактериальные и вирусные вторичные и сопутствующие заболевания.
Дозы препаратов и курс лечения зависят от степени иммунодефицита, тяжести состояния пациента, а также препарата группы иммуноглобулинов.
Медико-социальная экспертиза
При проведении медико-социальной экспертизы ВИЧ-инфицированных учитывают выраженность клинических признаков заболевания (стадию ВИЧ-инфекции). Социальные причины - невозможность дальнейшего выполнения работы (напри-
мер, хирург, стоматолог, акушер-гинеколог, реаниматолог, медицинский персонал, производящий парентеральные манипуляции, работники станции переливания крови и заводов биомедицинских препаратов, в профессиональную обязанность которых входит приготовление препаратов для парентерального введения) - основание для определения стойкой утраты трудоспособности.
В случае невозможности профессиональной переориентации указанных лиц может быть оформлена III группа инвалидности.
Вопросы временной нетрудоспособности решают строго индивидуально, на основании тяжести и продолжительности различных клинических признаков, руководствуясь «Инструкцией о правилах экспертизы временной нетрудоспособности для застрахованных лиц», с последующими дополнениями и исправлениями.
Для определения степени стойкой утраты трудоспособности больных ВИЧ-инфекцией используют индекс Карновского.
•Если индекс Карновского составляет 100-90%, то активность пациента полностью сохранена.
•Способность пациента к напряженной физической работе ограничена (может выполнять легкую работу) при значении индекса 80-70%.
•Если величина индекса Карновского не превышает 60-30%, то пациент способен передвигаться и ухаживать за собой, но не может работать (лежит или сидит менее 50% периода бодрствования).
•Ограничение способности ухаживать за собой, пациент лежит или сидит более 50% времени бодрствования - значение индекса составляет 40-30%.
•Индекс Карновского не превышает 20-10%; при этом больной полностью обездвижен и не может ухаживать за собой.
В течение стадии первичных клинических проявлений ВИЧ-инфекции (стадии 2 и 3) трудоспособность пациентов полностью сохранена (индекс Карновского -
90-100%).
На стадии вторичных заболеваний (стадия 4А) трудоспособность больных также сохранена полностью (индекс Карновского - 90-100%). Вместе с тем у некоторых пациентов отмечают развитие стойких астенических расстройств и формирование психоорганического синдрома; это приводит к снижению способности к трудовой деятельности в полном объеме (индекс Карновского - 70-80%). В таком случае, учитывая характер профессиональной деятельности, рекомендуют оформить больному III группу инвалидности.
На более поздних стадиях ВИЧ-инфекции (стадия 4Б) отмечают учащение рецидивов вторичных заболеваний и возникает необходимость в госпитализации (неоднократно) большинства больных, что приводит к стойкой утрате трудоспособности (индекс Карновского - 50-80%). В таком случае пациента переводят на II или III группу инвалидности. Исключение составляют стойкие поражения ПНС с выраженными
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
нарушениями двигательных функций (индекс Карновского составляет 10-40%). Пациенту оформляют I группу инвалидности.
На стадии вторичных заболеваний (стадия 4В) у всех больных обнаруживают стойкое нарушение трудоспособности (индекс Карновского - 10-50%). В зависимости от характера и тяжести поражений рекомендуют устанавливать I или II группу инвалидности. Диспансеризация
В Российской Федерации Федеральным законом от 30 марта 1995 г. № 38-ФЗ «О предупреждении распространения в Российской Федерации заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ-инфекции)» закреплены принципы:
◊бесплатного лекарственного обеспечения больных ВИЧ-инфекцией в амбулаторных условиях (п. 1 ст. 4 Федерального закона № 38-ФЗ);
◊запрета дискриминации при оказании медицинской помощи в специализированных и неспециализированных медицинских организациях в равной степени частной и государственной систем здравоохранения (ст. 14 Федерального закона № 38-ФЗ).
Спринятием Федерального закона от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» медицинская помощь и лекарственное обеспечение осуществляются в соответствии с порядками и стандартами оказания медицинской помощи по профилю соответствующего заболевания.
Сцелью организации медицинской помощи больным ВИЧ-инфекцией и для увеличения продолжительности и улучшения качества их жизни, а также для проведения противоэпидемических мероприятий необходимо обеспечить максимальный охват диспансерным наблюдением ВИЧ-инфицированных пациентов.
Все обследования ВИЧ-инфицированного пациента выполняют только после получения добровольного информированного согласия. Рекомендуют активно приглашать ВИЧинфицированных пациентов на периодические обследования, но при этом нельзя нарушать права людей на отказ от обследования и лечения. Пациент также имеет право на выбор медицинского учреждения.
Диспансеризацию ВИЧ-инфицированных пациентов проводят, руководствуясь нормативными документами.
•Порядок оказания медицинской помощи взрослому населению при заболевании, вызываемом вирусом иммунодефицита человека (ВИЧ-инфекции) (утвержден приказом Минздрава России от 8 ноября 2012 г. № 689н).
•Порядок оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий) (утвержден приказом Минздрава России от 1 ноября 2012 г.
№ 572н).
•Стандарт специализированной медицинской помощи при болезни, вызванной вирусом иммунодефицита человека (ВИЧ-инфекции) (утвержден приказом Минздрава России от 9 ноября 2012 г. № 758н).
•Стандарт первичной медико-санитарной помощи при болезни, вызванной вирусом иммунодефицита человека (ВИЧ-инфекции) (утвержден приказом Минздрава России от 24 декабря 2012 г. № 1511н).
•СанПин 3.1.5 2826-10 «Профилактика ВИЧ-инфекции».
При постановке ВИЧ-инфицированного пациента на диспансерный учет необходимо ознакомить его с алгоритмом и целью диспансерного наблюдения, графиком посещения
лечащего врача и узких специалистов, возможностью выполнения лабораторных и инструментальных исследований. При этом необходимо согласие пациента на проведение диспансерного наблюдения (или отказ от медицинской помощи) в письменном виде.
Мероприятия, проводимые при первичном обследовании
•Осмотр лечащего врача (консультирование, сбор анамнеза, полное физикаль-ное обследование).
•Регистрация вторичных заболеваний, их динамики и течения.
•Регистрация сопутствующих заболеваний.
•Оценка качества жизни пациента (по шкале Карновского).
•Рентгенография органов грудной клетки (если исследование не выполняли в течение последних 6 мес).
•УЗИ органов брюшной полости (печень, желчный пузырь, поджелудочная железа) и почек.
•ЭКГ.
•Консультация офтальмолога (исследуют глазное дно).
•Консультация оториноларинголога (исследуют остроту слуха и состояние вестибулярной функции).
•Консультация невропатолога.
•Консультация стоматолога.
•Консультация гинеколога (для женщин).
•Консультация терапевта.
•Исследование сыворотки или плазмы крови на антитела к ВИЧ с помощью стандартных лабораторных технологий, разрешенных к применению в Российской Федерации.
•Общий анализ крови (гемоглобин и гематокрит, тромбоциты, эритроциты и лейкоциты, лейкоцитарная формула, СОЭ).
•Биохимический анализ крови (креатинин и мочевина, активность АЛТ, АСТ, ЩФ, ЛДГ, КФК, амилазы или липазы, билирубин и его фракции, глюкоза, общий белок и фракции, общий холестерин и его фракции).
•Общий анализ мочи.
•Определения маркеров ВГB, ВГC.
•Серологический анализ - для обнаружения маркеров сифилиса, антител к ЦМВ, токсоплазме, ВПГ, P. jirovecii.
•Исследование кала на яйца глистов и на простейших; посев для диагностики сальмонеллеза.
•Проба с туберкулином или диаскин-тест с консультацией врача-фтизиатра.
•Определение показателей иммунного статуса.
•ПЦР для определения концентрации РНК ВИЧ в сыворотке крови. Повторные плановые обследования проводят для своевременного выявления
показаний к назначению АРТ (или для ее коррекции). Объем планового повторного обследования зависит от стадии болезни и уровня CD4+-лимфоцитов.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Сроки проведения первичных и повторных осмотров осуществляются согласно «Стандарту специализированной медицинской помощи при болезни, вызванной вирусом иммунодефицита человека (ВИЧ-инфекции)», утвержденному приказом Минздрава России от 9 ноября 2012 г. № 758н и «Стандарту первичной медико-санитарной помощи при болезни, вызванной вирусом иммунодефицита человека (ВИЧ-инфекцией)», утвержденному приказом Минздрава России от 24 декабря 2012 г. № 1511н.
Консультации врача-инфекциониста больных ВИЧ-инфекцией, не получающих АРТ, осуществляются 2 раза в год, при проведении АРТ - 4 раза в год; узких специалистов (гинеколог, невролог, оториноларинголог, офтальмолог, терапевт) - при постановке на учет; далее эти специалисты, а также другие узкие специалисты консультируют больных при наличии показаний.
Рентгенографию (или флюорографию) органов грудной клетки и диаскин-тест необходимо выполнять 2 раза в год, УЗИ органов брюшной полости и почек - 1 раз в год или чаще при наличии показаний. Исследование головного мозга с помощью метода КТ или МРТ рекомендуют выполнять по показаниям при резком снижении количества CD4+-лимфоцитов (<200 мкл-1).
Внеплановые обследования необходимо проводить при обнаружении любых признаков прогрессирования ВИЧ-инфекции или при развитии сопутствующих заболеваний. По решению лечащего врача выполняют дополнительные исследования.
Прогноз
Прогноз заболевания, вызванного ВИЧ, в целом неблагоприятный, поскольку препараты, приводящие к полной элиминации вируса, отсутствуют. Внедрение АРТ позволило резко уменьшить число летальных исходов и значительно увеличить продолжительность и качество жизни ВИЧ-инфицированных.
Тактика проведения диагностических и лечебных мероприятий по оказанию медицинской помощи при болезни, вызванной ВИЧ у взрослого населения, представлена в табл. 21.1421.16.
Таблица 21.14. Тактика проведения лечебно-диагностических мероприятий при первичном обращении ВИЧ-инфицированного за медицинской помощью

Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/


Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/


21.3. ГРИПП
Грипп (Grippus, Influenza) - острая инфекционная болезнь с аэрозольным механизмом передачи возбудителя, характеризующаяся массовым распространением, кратковременной лихорадкой, интоксикацией и поражением респираторного тракта.
КОДЫ ПО МКБ-10
J10 Грипп, вызванный идентифицированным вирусом гриппа. J10.0 Грипп с пневмонией, вирус гриппа идентифицирован. J10.1 Грипп с другими респираторными проявлениями, вирус гриппа идентифицирован.
J10.8 Грипп с другими проявлениями, вирус гриппа идентифицирован. J11 Грипп, вирус не идентифицирован. J11.0 Грипп с пневмонией, вирус не идентифицирован.
J11.1 Грипп с другими респираторными проявлениями, вирус не идентифицирован.
J11.8 Грипп с другими проявлениями, вирус не идентифицирован. ЭТИОЛОГИЯ Возбудители гриппа - ортомиксовирусы (семейство Orthomyxoviridae) - РНК-содержащие сложноорганизованные вирусы. Семейство включает род Influenzavirus, содержащий вирусы 3 серотипов: А,ВиС. Диаметр вирусной частицы 80-120 нм. Вирион сферической формы (реже нитевидный). В центре вириона расположен нуклеокапсид. Геном представлен
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
однонитевой молекулой РНК, имеющей у серотипов А и В по 8 сегментов и 7 сегментов у серотипа С. Капсид состоит из нуклеопротеина (NP) и белков полимеразного комплекса (P), окружен слоем матриксных и мембранных белков (М). Снаружи от этих структур расположена наружная липопротеиновая оболочка, несущая на своей поверхности сложные белки (гликопротеины): гемагглютинин (Н) и нейраминидазу (N). Таким образом, вирусы гриппа имеют внутренние и поверхностные антигены. Внутренние антигены представлены типоспецифическими антигенами NP- и М-белками. Антитела к внутренним антигенам не оказывают существенного защитного действия. Поверхностные антигены - гемагглютинин и нейраминидаза - определяют подтип вируса и индуцируют продукцию специфических защитных антител.
Для вирусов серотипа А характерна постоянная изменчивость поверхностных антигенов, причем изменения Н- и N-антигенов происходят независимо друг от друга. Известно 15 подтипов гемагглютинина и 9 - нейраминидазы. Вирусы серотипа В более стабильны (выделяют 5 подтипов). Антигенная структура вирусов серотипа С не подвержена изменениям, нейраминидаза у них отсутствует. Необычайная изменчивость вирусов серотипа А обусловлена двумя процессами: антигенным дрейфом (точечные мутации в сайтах генома, не выходящие за пределы штамма) и антигенным шифтом (полное изменение структуры антигена с образова-
нием нового штамма). Причина антигенного шифта - замена целого сегмента РНК в результате обмена генетическим материалом между вирусами гриппа человека и животных. Согласно современной классификации вирусов гриппа, предложенной ВОЗ в 1980 г., принято описывать серотип вируса, его происхождение, год выделения и подтип поверхностных антигенов. Например, вирус гриппа А, Москва/10/99/ Н3 N2. Вирусы серотипа А обладают наиболее высокой вирулентностью и имеют наибольшее эпидемиологическое значение. Их выделяют от человека, животных и птиц. Вирусы серотипа В выделяют только от людей; по вирулентности и эпидемиологической значимости они уступают вирусам серотипа А. Вирусам гриппа С присуща низкая репродуктивная активность. В окружающей среде устойчивость вирусов средняя. Они чувствительны к высоким температурам (более 60 °С), действию ультрафиолетового излучения и жирорастворителей, однако некоторое время сохраняют вирулентные свойства при низких температурах (в течение недели не погибают при температуре 40 °С). Чувствительны к табельным дезинфектантам.
ЭПИДЕМИОЛОГИЯ
Основной источник вируса - больной гриппом человек с клинически выраженным или стертым течением болезни. Эпидемиологическая значимость больного человека определяется количеством вируса в отделяемом ВДП и выраженностью катарального синдрома. В инкубационном периоде заболевания рассеивание вирусов неинтенсивное. Отсутствие катаральных симптомов ограничивает распространение вирусов в окружающей среде (поэтому эпидемиологическая опасность больного незначительна). Больные дети с тяжелым течением болезни - наиболее интенсивный источник вируса. Однако они представляют меньшую эпидемиологическую опасность, чем взрослые с легким течением болезни, так как сохраняют активность и имеют множественные контакты дома, в транспорте и на работе. После 7 сут болезни выделить вирус от больного в большинстве случаев не удается. Длительное выделение вируса выявляют у больных с тяжелым и осложненным течением заболевания. При определенных условиях вирусы серотипов Н1N1, Н2N2 и Н3N2 могут выделяться от больных в течение 3-4 нед, а вирусы гриппа В - до 30 сут. Остаточные катаральные явления в дыхательных путях способствуют передаче возбудителя окружающим, поэтому реконвалесценты могут служить источником вируса в здоровых коллективах. Источником вируса могут быть также лица с инаппаратным течением инфекционного процесса и транзиторные вирусоносители.
По данным исследований, 50-80% взрослых людей, инфицированных вирусами гриппа, не обращаются за медицинской помощью. Механизм передачи вируса - аэрозольный. Путь передачи - воздушно-капельный. Роль воздушно-пылевого пути незначительна. Из поврежденных клеток эпителия дыхательных путей вирус попадает в воздух с каплями слюны, слизи и мокроты при дыхании, разговоре, кашле и чихании. Сохранность вируса гриппа в воздушной среде зависит от степени дисперсности аэрозоля, содержащего вирусные частицы, а также от воздействия на него света, влаги, высоких температур. Возможно заражение через предметы, загрязненные выделениями больного (игрушки, посуду, полотенца и др.). Вирус сохраняет свою вирулентность в жилых помещениях в течение 2-9 ч. С уменьшением относительной влажности воздуха срок выживания вируса при повышении температуры воздуха до +32 °С уменьшается до 1 ч. Важное значение имеют данные о сроках выживания вируса гриппа на объектах внешней среды. Вирусы гриппа А (Бразилия)
11/78 (H1N1) и В (Иллинойс, США) 1/79 сохранялись на металле и пластмассе 24-48 ч, а на бумаге, картоне и тканях - 8-12 ч. Вирусы оставались вирулентными на руках человека в течение 5 мин. В мокроте вирус гриппа сохраняет вирулентность 2-3 нед, а на поверхности стекла - до 10 сут.
Восприимчивость людей к гриппу высокая. До настоящего времени нет убедительных данных о наличии генетически обусловленной устойчивости людей к вирусам гриппа А и В. Однако это справедливо для первого контакта с патогеном.
В связи с широким распространением гриппа, у новорожденных выявляют специфичные к вирусу гриппа антитела, полученные от матери через плаценту и молоко, обусловливающие временную резистентность. Титры противовирусных антител в крови ребенка и матери практически одинаковы. Материнские антитела к вирусу гриппа выявляют у детей, получающих грудное молоко, до 9-10 мес жизни (однако титр их постепенно снижается), а при искусственном вскармливании - только до 2-3 мес. Пассивный иммунитет, полученный от матери, - неполноценный, поэтому при вспышках заболевания в родильных домах заболеваемость у новорожденных выше, чем среди их матерей. Постинфекционный иммунитет типоспе-цифичен: при гриппе А сохраняется не менее трех лет, при гриппе В - 3- 6 лет.
Для гриппа характерно эпидемическое, а нередко и пандемическое распространение в относительно короткие сроки, что зависит от следующих факторов: высокой частоты легких форм заболевания и короткого инкубационного периода, аэрозольного механизма передачи возбудителя, высокой восприимчивости людей к возбудителю, появления в каждой эпидемии (пандемии) нового серовара возбудителя, к которому население не имеет иммунитета, типоспецифичности постинфекционного иммунитета, не дающего защиты от других штаммов вируса.
МЕРЫ ПРОФИЛАКТИКИ Специфические
Для специфической профилактики гриппа используют инактивированные гриппозные вакцины, которые состоят из цельных (цельновирионные вакцины) или расщепленных вирионов (сплит-вакцины), а также из смеси поверхностных вирусных белков - гемагглютинина и нейраминидазы (субъединичные вакцины). Антигенный состав вакцин ежегодно корригируется на основании рекомендаций ВОЗ, под эгидой которой производится постоянный мониторинг антигенного состава циркулирующих штаммов вируса гриппа. Вакцинацию проводят в осенне-зимний период. Защитный эффект сохраняется не менее года. Вакцинация снижает уровень заболеваемости и способствует более легкому неосложненному течению болезни. Рекомендуются следующие вакцины: вакцина для профилактики гриппа [инактивированная] + азоксимера бромид (Гриппол♠, Гриппол плюс♠), вакцина для профилактики гриппа [инактивированная] (Ваксигрип♠, Инфлювак♠, Флюарикс♠, Флюваксин♠, Бегривак♠, Агриппал S1♠), вакцина гриппозная субъединичная инактивированная виросомальная (Инфлексал V♠).
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
1В эпидемическом сезоне 2018/2019 гг. в России будет доступна для иммунизации первая четырехвалентная субъединичная вакцина для профилактики гриппа «Гриппол® Квадривалент»*, производства компании ООО «НПО Петровакс Фарм». Одна
доза вакцины «Гриппол® Квадривалент» содержит по 5 мкг гемагглютинина каждого из актуальных штаммов вируса гриппа 2-х подтипов А (H1N1 и H3N2), 2-х подтипов В (B/Ямагата + В/Виктория) и 500 мкг иммуноадъюванта Полиоксидоний, не содержит консервант. Производство вакцины «Гриппол® Квадривалент» будет осуществляется в Московской области по полному циклу в соответствии со стандартами GMP, в готовой индивидуальной шприц-дозе. Вакцина «Гриппол® Квадривалент» разработана на основе вакцин семейства Гриппол® и показана для иммунизации лиц в возрасте от 18 лет и старше. По результатам клинических исследований у взрослых в возрасте от 18 до 60 лет вакцина «Гриппол® Квадривалент» соответствует критериям иммуногенности EMA CPMP и имеет высокий профиль безопасности, сопоставимый с тривалентными вакцинами.
На правах рекламы
* Находится на стадии регистрации. Неспецифические
Профилактику гриппа сводят к изоляции пациентов, оказанию врачебной помощи на дому при появлении эпидемических вспышек. На время эпидемии в стационарах отменяют визиты к больным, ограничивают посещение детьми зрелищных мероприятий. Лица, находящиеся в постоянном контакте с больным, должны носить 4-слойные марлевые повязки (маски) как в больницах, так и в домашних условиях.
Для неспецифической профилактики применяют: химиопрепараты [римантадин, осельтамивир, умифеновир (Арбидол♠)]; препараты ИФН (Гриппферон♠, Гриппферон♠ с лоратадином) и индукторы ИФН.
Применяют методы и средства, предупреждающие заражение (адаптогены, витамины, закаливание).
Необходимо проветривать помещение, где находятся больные. Рекомендовано ультрафиолетовое облучение и влажная обработка помещений 0,2-0,3% раствором хлорамина Б или другими дезинфицирующими средствами. Белье, полотенца и носовые платки больных необходимо кипятить, а полы и мебель следует обрабатывать дезинфицирующими растворами.
ПАТОГЕНЕЗ
Вирус гриппа обладает эпителиотропными свойствами. Попадая в организм, он репродуцируется в цитоплазме клеток цилиндрического эпителия слизистой оболочки дыхательных путей. Репликация вируса происходит в течение 4-6 ч, чем объясняется короткий инкубационный период. Пораженные вирусом гриппа клетки дегенерируют, некротизируются и отторгаются. Инфицированные клетки начинают вырабатывать и выделять ИФН, препятствующий дальнейшему распространению вируса. Защите организма от вирусов способствуют неспецифические термолабильные В-ингибиторы и секреторные антитела класса IgA. Метаплазия цилиндрического эпителия снижает его защитную функцию. Патологический процесс охватывает ткани, выстилающие слизистые оболочки и сосудистую сеть. Эпителиотропность вируса гриппа клинически выражена в виде трахеита, но поражение может затрагивать крупные бронхи, иногда гортань или глотку. Уже в инкубационном периоде выражена вирусемия, продолжающаяся около 2 сут. Клинические проявления вирусемии - токсические и токсико-аллергические реакции. Такое действие оказывают как вирусные частицы, так и продукты распада эпителиальных клеток. Интоксикация при гриппе обусловлена в первую очередь накоплением эндогенных биологически активных веществ (простагландина Е2, серотонина, гистамина). Установлена
роль свободных радикалов кислорода, поддерживающих воспалительный процесс, лизосомальных ферментов, а также про-теолитической активности вирусов в реализации их патогенного действия.
Важное звено патогенеза - поражение кровеносной системы. Изменениям в большей степени подвержены сосуды микроциркуляторного русла. Вследствие токсического действия вируса гриппа и его компонентов на сосудистую стенку повышается ее проницаемость, что обусловливает появление у больных геморрагического синдрома. Повышение сосудистой проницаемости и повышенная «ломкость» сосудов приводят к отеку слизистой оболочки дыхательных путей и легочной ткани, множественным кровоизлияниям в альвеолы и интерстиций легких, а также практически во все внутренние органы.
При интоксикации и обусловленных ею нарушениях легочной вентиляции и гипоксемии происходит нарушение микроциркуляции: замедляется скорость венуло-капиллярного кровотока, увеличивается способность эритроцитов и тромбоцитов к агрегации, возрастает проницаемость сосудов, снижается фибриноли-тическая активность и нарастает вязкость крови. Все это может привести к ДВС -
важному звену патогенеза ИТШ или локальному тромбообразованию. Нарушения гемодинамики, микроциркуляции и гипоксия способствуют возникновению дистрофических изменений в миокарде.
Нарушение циркуляции крови, вызванное поражением сосудов, играет важную роль в поражении ЦНС и вегетативной нервной системы. Влияние вируса на рецепторы сосудистого сплетения желудочков мозга способствует гиперсекреции СМЖ, внутричерепной гипертензии, циркуляторным расстройствам, ОНГМ. Высокая васкуляризация в области гипоталамуса и гипофиза, осуществляющих нейрове-гетативную, нейроэндокринную и нейрогуморальную регуляцию, обусловливает возникновение комплекса функциональных расстройств нервной системы.
В остром периоде заболевания развивается симпатикотония, приводящая к гипертермии, сухости и бледности кожного покрова, учащению пульса. При снижении токсикоза отмечают признаки возбуждения парасимпатического отдела вегетативной нервной системы: заторможенность, сонливость, снижение температуры тела, урежение пульса, падение АД, мышечная слабость, адинамия (астеновегетативный синдром).
Значительная роль в патогенезе гриппа и его осложнений, а также в развитии воспалительных изменений дыхательных путей принадлежит бактериальной микрофлоре, активация которой способствует повреждению эпителия и развитию иммуносупрессии. Аллергические реакции при гриппе возникают на антигены как самого вируса, так и бактериальной микрофлоры, а также на продукты распада пораженных клеток. Пролонгирование катарально-респираторного синдрома может быть связано с коинфекцией другими респираторными вирусами.
Тяжесть заболевания отчасти обусловлена вирулентностью вируса гриппа, но в большей степени - состоянием иммунной системы макроорганизма.
КЛИНИЧЕСКАЯ КАРТИНА Инкубационный период от 10-12 ч до 9 сут. Классификация
Клиническая картина гриппа может существенно варьировать в зависимости от возраста больных и состояния их иммунной системы; серотипа вируса, его вирулентности и т.д.
Выделяют:
◊ неосложненный грипп; ◊ осложненный грипп. По тяжести течения выделяют: ◊ легкое;
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
◊ средней тяжести; ◊ тяжелое.
Иногда выделяют молниеносное течение заболевания. Тяжесть неосложненного гриппа определяется выраженностью и продолжительностью интоксикации.
Основные симптомы и динамика их развития
Болезнь начинается остро. Появляются чувство разбитости, ломота в мышцах и суставах, познабливание. Температура может повышаться в диапазоне от суб-фебрильной до гипертермического уровня в течение нескольких часов, достигая максимума к концу 1-х суток заболевания. Уровень лихорадки отражает выраженность интоксикации, но полностью отождествлять эти понятия нельзя. Иногда при высокой температуре признаки интоксикации выражены слабо (часто у молодых людей, заболевших гриппом, вызванным вирусом гриппа А - Н1N1). Гипертермия у них кратковременная, и в дальнейшем заболевание протекает в средней степени тяжести. Длительность лихорадочного периода - 2-5 сут, редко до 6-7 сут, а затем температура литически снижается.
Головная боль - основной признак интоксикации и один из первых симптомов заболевания. Она обычно локализована в лобной части, особенно в области надбровных дуг, иногда носит ретроорбитальный характер. У пожилых людей головная боль часто диффузная. Выраженность ее варьирует, но в большинстве случаев умеренная. Сильная головная боль в сочетании с бессонницей, галлюцинациями, многократной рвотой возникает у больных с тяжелым течением заболевания, нередко сопровождаясь менингеальным синдромом. У взрослых, в отличие от детей, судорожный синдром развивается редко. Во время мучительного сухого кашля, сочетающегося с рвотой, появляются сильные боли в верхних отделах прямых мышц живота и межреберных мышцах на линии прикрепления диафрагмы к грудной клетке.
Катаральный синдром - второй ведущий синдром при гриппе (у большинства больных представлен трахеитом), но часто отступает на второй план. В ряде случаев этот синдром выражен слабо или отсутствует, особенно при заболевании в теплое время года. Длительность проявления катарального синдрома - 7-10 сут, дольше всего сохраняется кашель. Слизистая оболочка носоглотки сухая, гиперемированная, отечная. Набухание носовых раковин затрудняет дыхание. Ринорея в первые дни скудная или отсутствует, позднее появляются серозные, слизистые или сукровичные выделения из носа. С первого дня болезни появляются першение и сухость за грудиной. Слизистая задней стенки глотки гиперемированная и сухая.
Тоны сердца приглушены, иногда выслушивается систолический шум на верхушке. У трети больных имеется относительная брадикардия, у 60% пациентов пульс соответствует температуре тела. Иногда выявляют тахикардию. Стойкая тахикардия в разгар болезни прогностически неблагоприятна, особенно у лиц старших возрастных групп с хроническими заболеваниями сердца, сосудов и органов дыхания. У больных гриппом выявляют снижение АД. У пациентов с гипертонической болезнью в периоде реконвалесценции возможно развитие гипертонического криза. После эпидемии гриппа возрастает смертность от острого нарушения мозгового кровообращения и инфаркта сердца среди пациентов группы риска (атеросклероз, гипертоническая болезнь).
Язык густо обложен белым налетом, не утолщен. Аппетит снижен. Диспепсический синдром на фоне лихорадки и интоксикации обычно обусловлен наличием другой кишечной инфекции вирусной (ротавирусы, норавирусы) или бактериальной этиологии. Сыпи при гриппе не бывает, печень и селезенка не увеличены. Нарушения мочеотделения при неосложненной форме гриппа не возникают.
При неосложненном гриппе характерны лейкопения с нейтропенией, а также относительный лимфоцитоз и моноцитоз. СОЭ у большинства больных нормальная. При
рентгенологическом исследовании легких в остром периоде заболевания выявляют усиление сосудистого рисунка.
Осложнения
Пневмония - одно из частых осложнений гриппа. Развившиеся на фоне вирусной инфекции пневмонии относят к первичным вирусно-бактериальным (чаще всего стрептококковой и стафилококковой этиологии). Они чаще развиваются у пациентов группы «высокого риска»: с хроническими заболеваниями легких и сердца, лиц пожилого возраста.
Постгриппозные пневмонии развиваются в конце 1-й - начале 2-й недели болезни. Антибактериальное лечение дает хорошие результаты. Пневмонии могут иметь как интерстициальный, так и очаговый характер. Постгриппозные пневмонии опасны для лиц старших возрастных групп.
Молниеносная форма болезни с тяжелым течением может закончиться смертью на 2-3-и сутки (развивается острый геморрагический отек легких на фоне резкой
интоксикации). С первых часов возникает высокая лихорадка, быстро нарастают одышка и цианоз. Появляется кровянистая, иногда пенистая мокрота. На рентгенограммах выявляют очаги затемнения округлой или неправильной формы. Приглушение перкуторного звука отсутствует или выражено незначительно. В последующие дни на фоне высокой температуры и резкой одышки нарастает ДН, развиваются гипоксическая кома и коллапс.
Тяжелое осложнение гриппа - ОНГМ. Для него характерны: сильная головная боль, рвота, судороги, оглушенность, потеря сознания, повышение АД, одышка, тахикардия, менингеальный синдром, застойные явления на глазном дне.
Частые осложнения гриппа - синуситы и отиты; реже - пиелонефрит и пие-лоцистит. Возможны и другие осложнения: диэнцефальный синдром, менинго-энцефалит и астеновегетативный синдром. На тяжесть течения и исход болезни оказывают влияние сопутствующая хроническая патология и нейроэндокринные нарушения.
Летальность и причины смерти
В период крупных эпидемий летальность не превышает 1-2%. Причиной смерти при тяжелой форме гриппа могут быть: отек мозга, геморрагический отек легких, острая сосудистая недостаточность.
ДИАГНОСТИКА
Диагностика гриппа в период эпидемической вспышки не представляет трудности. Она основана на выявлении типичных проявлений заболевания (интоксикации, катарального синдрома преимущественно в виде трахеита).
Для быстрой диагностики гриппа применяют метод иммунофлюоресценции (выявляют антигены вируса в мазках и отпечатках из носа). Для постановки окончательного диагноза необходимо выделить возбудитель из полученного от больного клинического материала путем заражения культур клеток или куриных эмбрионов и провести идентификацию выделенного вируса. Ретроспективно диагноз устанавливают по увеличению титра антител в парных сыворотках крови больных.
Дифференциальная диагностика
Дифференциальную диагностику при гриппе проводят с двумя группами инфекционных заболеваний: протекающими с катарально-респираторным синдромом и характеризующимися ранним развитием лихорадочно-интоксикационного синдрома.
В 1-ю группу входят другие ОРВИ, при которых (в отличие от гриппа) кашель, насморк, боль и першение в горле предшествуют повышению температуры и не сопровождаются общими
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
симптомами интоксикации (отсутствуют или возникают на 2-3-и сутки течения заболевания, выражены умеренно, однако могут длиться дольше, чем при гриппе). Сочетание лихорадки, интоксикации и ЛАП с катаральными явлениями позволяет исключить грипп и предположить наличие кори, иер-синиоза или ИМ. Поскольку при гриппе органы пищеварения в патологический процесс не вовлекаются, это позволяет исключить данное заболевание при сочетании лихорадки и катаральных явлений с диспепсическим синдромом. В этом случае возможно наличие вирусных диарей (ротовирусных, норавирусных), а также иерсиниоза или кори у взрослых.
Для многих острых форм инфекционных болезней в первые 1-2 сут характерна гриппоподобная клиническая картина. При этом следует учитывать отличительные особенности гриппа: сильный озноб выявляют редко, пик интоксикации на 1-2-е сутки течения заболевания, ЛАП, увеличения селезенки и печени никогда не наблюдается; со 2-3-х суток выражен трахеит, длительность лихорадки (при нео-сложненной форме) - 3-4 сут (не более 5-6 сут), характерна относительная бради-кардия или соответствие частоты сердечных сокращений уровню температуры тела.
На практике грипп ошибочно диагностируют при стрептококковых заболеваниях (скарлатине, ангине, роже), внебольничной пневмонии (до появления характерных симптомов), менингококковой инфекции, малярии, пиелите, риккетсио-зах, брюшном тифе и сальмонеллезе (до появления диспепсического синдрома), лептоспирозе (в теплое время года), ВГA, ГЛ, трихинеллезе.
В сложных для диагностики случаях врач должен оценить тяжесть состояния больного, необходимость и сроки повторного осмотра или экстренной госпитализации. При этом следует избегать назначения антибиотиков и жаропонижающих ЛС, поскольку они могут существенно затруднить дальнейшую диагностику и создать иллюзию улучшения состояния больного.
Пример формулировки диагноза
J11.0 Грипп, тяжелое течение. Осложнение: правосторонняя нижнедолевая пневмония. Показания к госпитализации
Госпитализации подлежат пациенты с тяжелым или осложненным течением гриппа, а также с рядом сопутствующих заболеваний: тяжелыми формами сахарного диабета, хронической ИБС, хронической обструктивной болезнью легких, болезнями крови, заболеваниями ЦНС.
К синдромальным показаниям для госпитализации относят: высокую лихорадку (выше 40 °С), нарушения сознания, многократную рвоту, менингеальный синдром, геморрагический синдром, судорожный синдром, ДН, сердечно-сосудистую недостаточность.
Госпитализацию и изоляцию больных проводят также по эпидемиологическим показаниям (общежития, интернаты, детские дома, гостиницы, транспорт, воинские коллективы, учреждения пенитенциарной системы).
ЛЕЧЕНИЕ Режим. Диета
Рекомендован постельный режим в течение всего лихорадочного периода. Назначают полноценное питание, включая молочнокислые продукты, фруктовые и овощные соки. Для дезинтоксикации применяют обильное теплое питье до 1,5-2 л/сут (чай, соки, отвар шиповника, отвар липового цвета, минеральные щелочные воды, молоко).
Медикаментозное лечение
Противовирусные препараты показаны при среднетяжелом и тяжелом течении болезни, а также больным с сопутствующей патологией, обострение которой может представлять угрозу жизни. Этиотропное лечение включает назначение ЛС адамантанового ряда (например,
римантадина). Римантадин (Ремантадин♠) обладает противовирусной активностью в отношении штаммов вируса гриппа А. Эффективен при назначении в первые 2 сут течения заболевания. Принимают внутрь после еды (запивая водой) по схеме: в 1-е сутки - 300 мг в три приема; на 2-е и 3-и сутки - 200 мг в два приема; на 4-е сутки - 100 мг одномоментно. Римантадин (Альгирем♠¤) - 0,2% раствор римантадина в сиропе (для лечения
гриппа А у детей). Курс лечения: 4 сут в соответствии с возрастным режимом дозирования. При лечении гриппа, вызванного вирусами серотипов А и В, эффективны ингибиторы нейраминидазы (осельтамивир - Тамифлю♠, назначаемый по 150 мг в два приема в течение 5- 7 сут). Препарат выбора - умифеновир (Арбидол♠) (группа индолов) - противовирусное ЛС с интерферониндуцирую-щими, иммуномодулирующими и антиоксидантными свойствами. Эффективен в отношении вирусов А и В. Назначают по 600 мг/сут в 3 приема в течение 5-7 сут. Занамивир (Реленза♠) - вводится ингаляционно 2 раза в сутки 5 сут.
Альтернативные ЛС - ИФН и индукторы ИФН. Наиболее распространенные препараты ИФН: интерферон лейкоцитарный человеческий и рекомбинант-ные соединения (ИФН-α2, например, Гриппферон♠, Гриппферон♠ с лоратади-ном). Применяют также индукторы ИФН: тилорон, меглюмина акридонацетат (Циклоферон♠), Кагоцел♠, рибонуклеат натрия (Ридостин♠).
Проводят дезинтоксикацию: 5% раствором декстрозы (Глюкозы♠) или декстра-ном [ср. мол. масса 35 000-45 000] (Реополиглюкин♠). Назначают вазо- и кар-диопротекторные препараты. Для предупреждения или лечения начинающегося отека мозга (или легких)
назначают фуросемид по 40-80 мг/сут. С этой же целью вводят преднизолон по 300-500 мг/сут. При гипертермии показаны препараты ацетилсалициловой кислоты и парацетамола с тщательным учетом противопоказаний. Для улучшения мозгового кровообращения назначают пентоксифиллин. Больным с тяжелой формой заболевания необходима оксигенотерапия (ингаляции кислородно-воздушной смесью).
Следует постоянно следить за проходимостью верхних дыхательных путей, проводить аспирацию мокроты и слизи при помощи электроотсоса. Необходима коррекция нарушений кислотно-щелочного состояния крови. При появлении сердечной недостаточности применяют сердечные гликозиды (ландыша травы ликозидρ, уабаин), 10% раствор Сульфокамфокаина♠.
При наличии бактериальных осложнений (пневмония, отит, синусит и др.) применяют антибиотики.
Примерные сроки нетрудоспособности При неосложненном течении - 5-7 сут и до 14-21 сут при присоединении пневмонии.
21.4. ГРИПП ПТИЦ У ЧЕЛОВЕКА
Грипп птиц - острая зоонозная инфекционная болезнь с преимущественно фекальнооральным механизмом передачи возбудителя. Характеризуется выраженным ЛИС, поражением легких с развитием РДС и высокой летальностью.
КОД ПО МКБ-10
J10 Грипп, вызванный идентифицированным вирусом. ЭТИОЛОГИЯ
Возбудитель - вирус гриппа А рода Influenza virus семейства Orthomyxoviridae. Его относят к оболочечным вирусам. Вирион имеет неправильную или овальную форму, покрыт липидной оболочкой, пронизанной гликопротеиновыми шипами (спикулами). Они определяют гемагглютинирующую (Н) или нейраминидазную (N) активность вируса и выступают его основными антигенами. Современный «человеческий» вирус гриппа имеет комбинации
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
антигенов Н1, Н2, Н3 и N1, N2. По данным сероархеологических исследований, тяжелая пандемия 1889-1890 гг. была вызвана подтипом Н2N2, умеренная эпидемия 1900-1903 гг. - подтипом Н3N2, пандемия «испанка» 1918-1919 гг. - Н1N1, содержащим дополнительный
белок, полученный от вируса гриппа птиц. Эпизоотии гриппа птиц последних лет связаны с подтипами Н5N1, Н5N2, Н5N8, Н5N9, Н7N1, Н7N3, Н7N4, Н7N7.
В популяциях диких птиц циркулируют подтипы Н1, Н2, Н3, N2, N4, т.е. аналогичные вирусу гриппа А человека.
Разные подтипы этого вируса обладают неодинаковой вирулентностью. Наиболее вирулентен подтип Н5N1, который в последние годы приобрел ряд необычных свойств: высокую патогенность для людей, способность непосредственно инфицировать людей, способность вызывать гиперпродукцию провоспалитель-ных цитокинов, сопровождающуюся развитием ОРДС, способность вызывать мультиорганные нарушения, включая поражение мозга, печени, почек и других органов, резистентность к противовирусному препарату римантадину; устойчивость к воздействию ИФН.
Вирус гриппа птиц, в отличие от вирусов гриппа человека, более устойчив в окружающей среде. При температуре 36 °С он погибает за 3 ч, 60 °С - за 30 мин, при термической обработке пищевых продуктов (кипячение, жарка) - мгновенно. Хорошо переносит замораживание. В птичьем помете выживает до 3 мес, в воде при температуре 22 °С - 4 сут, а при 0 °С - более месяца. В тушках птиц сохраняет активность до года. Инактивируется обычными дезинфицирующими средствами.
ЭПИДЕМИОЛОГИЯ
Основной резервуар вируса в природе - перелетные водоплавающие птицы, принадлежащие к отрядам Anseriformes (дикие утки и гуси) и Charadriiformes (цапли, ржанки и крачки). Наибольшее значение имеют дикие утки. Вирусы гриппа в Евразии и Америке эволюционируют независимо, поэтому миграция между континентами не играет роли в распространении вируса, решающее значение имеют перелеты по долготе. Для России важными в этом отношении выступают центральноазиатский-индийский и восточноазиатский-австралийский пути миграции. Они включают маршруты, идущие в Сибирь через Малайзию, Гонконг и Китай, т.е. регионы, где идет интенсивное формирование новых вариантов вируса. Менее значимы восточно-африканско-европейский и западнотихоокеанский пути.
У диких водоплавающих птиц вирус не вызывает клинически выраженного заболевания, хотя описана масштабная тяжелая эпизоотия гриппа у полярных крачек. Репликация вируса у пернатых происходит преимущественно в кишечнике, и, соответственно, выделяется он в окружающую среду с фекалиями, в меньшей степени - со слюной и респираторным материалом. В 1 г фекалий содержится количество вируса, достаточное для инфицирования 1 млн голов домашней птицы.
Основной механизм передачи вируса у птиц - фекально-оральный. Водоплавающие птицы (утки) способны передавать вирус трансовариально и, таким образом, служат его естественным природным резервуаром и распространяют по путям своей миграции. Они выступают главным источником инфекции для домашних птиц, которые, напротив, болеют тяжелыми формами гриппа, сопровождающимися их массовой гибелью (до 90%). Наиболее опасен подтип Н5N1. Заражение происходит в условиях свободного содержания и возможности контакта со своими дикими собратьями. Особенно это характерно для стран Юго-Восточной Азии (Китай, Гонконг, Таиланд, Вьетнам и другие государства), где наряду с крупными птицеводческими фермами есть множество мелких крестьянских хозяйств. Вирус гриппа птиц способен поражать млекопитающих: котиков, китов, норок, лошадей и, что особенно важно, свиней. Случаи проникновения вируса в популяцию последних были
отмечены в 1970, 1976, 1996 и 2004 гг. Эти животные также могут быть поражены вирусом гриппа человека. В настоящее время восприимчи-
вость людей к подобным вирусам птиц низкая. Все случаи заражения зафиксированы у тех, кто длительно и тесно контактировал с больной птицей. Поставленный в Великобритании эксперимент по введению в организм добровольцев различных субтипов вируса дал отрицательный результат.
В Таиланде, где население составляет 60 млн человек, во время эпизоотии, поразившей 2 млн птиц, достоверно установлено 12 случаев заболевания у людей. Всего к 2007 г. зарегистрировано около 300 эпизодов «птичьего» гриппа у людей. Официально зафиксировано 2 случая заражения от больного человека. Таким образом, можно заключить, что межвидовой барьер в настоящее время является достаточно прочным.
Однако имеются факты, позволяющие считать, что грипп птиц может потенциально представлять серьезную угрозу. Во-первых, даже единичные случаи заражения людей от птиц и от больных свидетельствуют о том, что непреодолимость межвидового барьера не абсолютна; фактическое количество случаев заражения от домашней птицы, а возможно, и от больных людей, учитывая реальную обстановку в очагах эпизоотии, может быть во много раз больше. Во время эпизоотии гриппа Н7N7 в Голландии заболели 77 человек, 1 умер. У лиц, контактировавших с больными, обнаружены высокие титры антител, что тоже указывает на возможность передачи вируса от человека к человеку, но с утратой вирулентности. Вовторых, мутагенный потенциал вируса гриппа птиц, особенно подтипа H5N1, весьма велик. В-третьих, свиньи восприимчивы к вирусам гриппа птиц и гриппа человека, поэтому возможна встреча вирусов в организме животного, их гибридизация и возникновение вирусов-ассортантов, обладающих высокой вирулентностью, свойственной вирусу гриппа птиц, и в то же время способных передаваться от человека к человеку. В связи с массовым распространением гриппа птиц эта вероятность возросла. В-четвертых, генетическими методами доказано, что пандемия испанки 1918-1919 гг. имела «птичье» происхождение. В- пятых, в современных условиях благодаря процессам глобализации, наличию быстрых видов транспорта возможность распространения вируса-ассортанта резко возрастает.
МЕРЫ ПРОФИЛАКТИКИ Специфические
Глобальный мониторинг под эгидой ВОЗ позволяет быстро обнаружить опасный вирус и начать массовое производство вакцины. Массовая вакцинация может быть начата через 9 мес. В настоящее время важно качественно проводить противоэпидемические мероприятия, нацеленные на снижение распространенности человеческого гриппа. В частности, необходимо увеличить количество вакцинированных, что снизит уровень заболеваемости, а возможно, и восприимчивость к новому варианту вируса.
Неспецифические
Основной метод борьбы с гриппом птиц - полное истребление поголовья пернатых на зараженных фермах, причем лица, контактирующие с ними и осуществляющие их уничтожение, должны работать в респираторах и спецодежде. Большое значение придают дезинфекции с использованием нетоксичных для человека четвертичных аммониевых соединений (ацепур). Они легко нейтрализуются мылами и другими детергентами. Проводят карантинные мероприятия, запрещают вывоз птицы и яиц из пораженных регионов. В окружающих хозяйствах и птицефермах осуществляют вакцинацию, но ее эффективность и целесообразность сомнительны. Наличие у вакцинированных птиц антител затрудняет мониторинг, так как не позволяет дифференцировать с заражением, также есть сведения о том, что вакцинация способствует мутации вируса.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
ВРоссию занос инфекции возможен с перелетными птицами. Однако условия ведения сельского хозяйства в России (преимущественно закрытое содержание птицы, малая вероятность контакта со свиньями, менее тесный контакт людей и животных, чем в ЮгоВосточной Азии) позволяют практически исключить возможность возникновения вирусаассортанта. В связи с этим основные мероприятия следует направить на предупреждение заноса вируса из стран, где он может появиться. Для этого следует ужесточить санитарный контроль на границе, рекомендовать ношение респираторных масок, их профилактическая эффективность достигает 98%.
ПАТОГЕНЕЗ
Внастоящее время механизм развития гриппа, вызванного вирусом Н5N1, у человека изучен недостаточно. Установлено, что место его репликации - это не только эпителиальные клетки дыхательных путей, но и энтероциты. Принимая во внимание общебиологические и иммунопатологические процессы, можно предполагать, что патогенез гриппа А (Н5N1) у человека будет развиваться по тем же механизмам.
Различные гемагглютинины вирусов гриппа птиц отличаются способностью к распознаванию и связыванию с рецептором - сиаловой кислотой, связанной в олигосахариде клеточных мембран с галактозой. Гемагглютинины вирусов гриппа человека взаимодействуют с остатками этой кислоты, объединенной 2,6 связью с галактозой, а гемагглютинин вирусов гриппа птиц распознает ее в 2,3 связи с остатками галактозы. Тип связи концевой сиаловой кислоты и конформационная подвижность олигосахаридов поверхностных лектинов - основные элементы межвидового барьера для вирусов гриппа птиц и человека. Лектины эпителиальных клеток трахеи человека включают лектины с типом связи 2,6 и не содержат олигосахаридов с типом связи 2,3, характерных для эпителиальных клеток кишечного тракта и дыхательных путей птиц. Изменения биологических свойств высокопатогенного штамма вируса А (Н5N1), появление у него способности преодолевать межвидовой барьер могут привести к поражению различных типов клеток у человека с развитием более тяжелых форм болезни. В клинической картине такой патологии наряду с катаральным синдромом развивается поражение ЖКТ.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период при гриппе А (Н5N1) составляет 2-3 дня с колебаниями от 1 до 7 дней.
Основные симптомы и динамика их развития
Начало болезни острое. Выражены симптомы интоксикации. Температура тела с первых часов болезни повышается до 38 °С, часто достигая гиперпиретических значений. Лихорадочный период удлиняется до 10-12 дней, а при тяжелом течении с летальным исходом - до последних часов жизни больного. Характерны озноб, мышечные и суставные боли. В разгар болезни (2-3-й день) присоединяется катаральный синдром, проявляющийся развитием бронхита, бронхиолита, ларингита; могут быть признаки ринита. Характерны боль в горле и «пылающий» орофарингит. В этот период у большинства больных развивается первичная вирусная пневмония. При этом появляются одышка, продуктивный кашель, возможно с примесью крови. Над легкими выслушиваются жесткое дыхание, влажные разнокалиберные хрипы, крепитация. На рентгенограмме грудной клетки в ранние сроки определяют неспецифические изменения в виде диффузных, мультифокальных или отдельных инфильтратов, имеющих тенденцию к быстрому распространению и слиянию. Характерно прогрессирующее течение, нарастание одышки и развитие ОРДС. Наряду с интоксикацией и катаральным синдромом развивается поражение ЖКТ, проявляющееся повторной рвотой, секреторной диареей и болями в животе. Возможно
увеличение печени, сопровождающееся повышением активности трансфе-раз сыворотки крови. У трети больных развиваются ОПН, креатининемия. У большинства больных
наблюдают признаки поражения нервной системы, возможны нарушения сознания, развитие энцефалита. В гемограмме регистрируют лейкопению, лимфопению, тромбоцитопению. Могут быть варианты течения болезни с лихорадкой, диареей и отсутствием признаков поражения органов дыхания.
Осложнения
Инфекция опасна развитием вирусной пневмонии, поражением почек, печени, кроветворных органов. Именно эти последствия часто приводят к смерти больных. Установлено, что место репликации вируса гриппа подтипа Н5N1 у людей (по крайней мере, у погибших в результате заболевания) - это не только респираторный тракт, но и кишечник.
Факторы риска развития тяжелых форм гриппа А (Н5N1) у людей: возраст пациента (у детей пяти лет и младше симптомы заболевания выражены неярко), длительность проявления болезни до госпитализации (отсрочка от госпитализации), анатомический уровень поражения респираторного тракта, степень лейкопении периферической крови, наличие полиорганной дисфункции.
Летальность и причины смерти
Летальность составляет 50-80%. Чаще всего больные умирают от осложнений на 2-й неделе болезни.
ДИАГНОСТИКА
Правильная постановка диагноза в ранние сроки - это отправной пункт для организации целенаправленного лечения, своевременного проведения противоэпидемических мероприятий и определения прогноза. Однако на пути диагностики гриппа птиц существуют определенные объективные трудности, связанные со сходством клинической картины этого заболевания и других ОРВИ.
Предварительный диагноз гриппа А (Н5N1) может быть поставлен на основании следующих данных эпидемиологического анамнеза и клинических проявлений: наличие сообщений о вспышках гриппа А (Н5N1) среди популяции птиц и животных или о случаях смерти домашней птицы в регионе проживания больного; контакт с больным человеком, у которого подтверждено инфицирование вирусом гриппа (Н5N1), за 7 дней до появления первых клинических признаков; контакт с больным ОРЗ неясной этиологии, в том числе закончившимся летально, за 7 дней до появления первых клинических признаков; указание больного на выезд в страну или на территорию, где есть сообщения о неблагополучной эпидемиологической и/или эпизоотической обстановке по гриппу А (Н5N1); наличие профессионального риска инфицирования; высокая лихорадка в сочетании с затрудненным дыханием, кашлем; диарея (при отсутствии примеси крови в фекалиях).
Окончательный диагноз может быть поставлен после лабораторного подтверждения.
Лабораторная диагностика основана на методах вирусологического исследования, серологических реакциях, ИФА и ПЦР.
Дифференциальная диагностика
Учитывая, что при гриппе А (Н5N1) возникают симптомы поражения дыхательных путей, необходимо проводить дифференциальную диагностику с другими ОРВИ: гриппом человека (А, В), ТОРС, парагриппом, респираторно-синцитиальной, аденовирусной и энтеровирусной инфекциями, а также легионел-лезом и орнитозом.
Показания к консультации других специалистов При развитии ОДН - консультация реаниматолога. Пример формулировки диагноза
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
J10 Грипп, вызванный вирусом H5N1, тяжелое течение; осложнение - пневмония, ОДН. Показания к госпитализации
Клиническая картина респираторной инфекции у пациента, имевшего контакт с больной птицей.
ЛЕЧЕНИЕ Режим. Диета
При подтверждении диагноза гриппа А (Н5N1) лечение проводят в боксирован-ном отделении стационара. В течение всего острого периода болезни необходимо соблюдать постельный режим. Рекомендована полноценная диета, богатая витаминами и содержащая достаточное количество жидкости.
Медикаментозная терапия Этиотропная терапия
В настоящее время из этиотропных препаратов наиболее эффективен осельта-мивир (Тамифлю♠) - противовирусный препарат, относящийся к классу ингибиторов нейраминидазы. Его назначают в дозе 75 мг внутрь 2 р/сут в течение 7 дней. Возможно увеличение дозы до 300 мг. Можно также применять римантадин (Ремантадин♠, Альгирем♠¤).
Патогенетические средства
В патогенетической терапии ведущая роль принадлежит дезинтоксикации. По клиническим показаниям используют внутривенное введение кристаллоид-ных растворов для коррекции кислотно-основного равновесия и электролитного баланса.
При тяжелых клинических формах заболевания показаны глюкокортикоиды, апротинины. При развитии ОРДС лечение проводят в условиях реанимационного отделения с обязательной респираторной поддержкой, вводят сурфактант.
Симптоматическую терапию осуществляют по показаниям.
Из стационара реконвалесцентов выписывают не ранее чем через 7 дней после восстановления нормальной температуры тела.
Всем контактирующим с больными гриппом А (Н5N1) показано медицинское наблюдение в течение 7 дней, с измерением температуры тела 2 раза в день. При ее повышении, появлении кашля и затрудненного дыхания следует немедленно обратиться за медицинской помощью.
При первых признаках заболевания и/или после контакта с заболевшим рекомендуется использование топических препаратов рекомбинантного интерферона (Гриппферон♠, Гриппферон♠ с лоратадином).
21.5. АДЕНОВИРУСНАЯ ИНФЕКЦИЯ
Аденовирусная инфекция - острая вирусная антропонозная болезнь с различными механизмами передачи возбудителя, характеризующаяся преимущественным поражением слизистых оболочек респираторного тракта, глаз, кишечника и лимфоидной ткани.
КОДЫ ПО МКБ-10 В34.0 Аденовирусная инфекция неуточненная
В30.0 Кератоконъюнктивит, вызванный аденовирусами ЭТИОЛОГИЯ
Возбудители ДНК-вирусы рода Mastadenovirus (вирусы млекопитающих) семейства Adenoviridae. Известно 80 видов (сероваров) аденовируса.
Аденовирусы имеют голый капсид, средний диаметр вириона 60-90 нм. Зрелый вирус состоит из 252 капсомеров, включая 240 гексонов, которые образуют грани и 12 пентонов, образующих вертикали. Геном представлен линейной молекулой двунитевой ДНК. Гексоны содержат реактивные детерминанты семейства и типоспецифические антигенные детерминанты, действующие при высвобождении гексонов в составе вириона и ответственные за проявление токсического эффекта.
Пентоны содержат малые антигены вируса и реактивный растворимый антиген семейства, обнаруживаемый в инфицированных клетках. Очищенные нити содержат главный типоспецифический антиген. Пентоны и нити обуславливают гемагглютинирующие свойства вирусов.
Каждый вирион имеет не менее 7 антигенных детерминант. Поверхностные антигены структурных белков видо- и типоспецифичны. Антигены гексонов содержат и родо-, и группоспецифичные детерминанты. Нуклеокапсид - компле-ментсвязывающий антиген, одинаковый для различных серотипов.
Антигенные свойства положены в основу классификации аденовирусов. Все аденовирусы обладают единым комплементсвязывающим антигеном, что позволяет выявлять их в РСК с помощью группоспецифической сыворотки.
Аденовирусы устойчивы в окружающей среде: сохраняются в замороженном состоянии, адаптируются к температуре от 4 до 50 °С, в воде при +4 °С сохраняют жизнедеятельность 2 года, на стекле, одежде вирус выживает от 10 до 45 дней. Резистентны к эфиру и другим растворителям липидов. Погибают от воздействия ультрафиолетового излучения, хлора, при температуре 56 °С погибают через 30 мин.
Для человека патогенны 49 сероваров аденовирусов, наибольшее значение имеют 1, 3, 4, 5, 6, 7, 8, 12, 14, 21-й серовары, причем типы 1, 2, 5, 6 чаще вызывают заболевания у дошкольников; типы 3, 4, 7, 14, 21 - у взрослых.
ЭПИДЕМИОЛОГИЯ И ПРОФИЛАКТИКА
Источником возбудителя инфекции являются больной человек, который выделяет вирус в окружающую среду на протяжении всей болезни, и вирусоноситель. Максимальные сроки вирусовыделения составляют 40-50 дней. Аденовирусные конъюнктивиты могут быть нозокомиальной инфекцией.
Аденовирусы в окружающую среду выделяются из верхних дыхательных путей, с фекалиями, слезами.
Механизм передачи - аэрогенный, фекально-оральный.
Пути передачи - воздушно-капельный, пищевой, контактно-бытовой. Возможно внутриутробное инфицирование плода.
Восприимчивость. Болеют преимущественно дети и лица молодого возраста. Сезонность не имеет решающего значения, но в холодное время года заболеваемость возрастает, за исключением фаринго-конъюнктивальной лихорадки, которая встречается преимущественно летом. Характер эпидемического процесса во многом определяется сероваром аденовируса. Эпидемии, вызванные аденовирусами типов 1, 2, 5, наблюдаются редко, вызванные типами 3, 7, - постоянно. После перенесенной болезни формируется видоспецифический иммунитет.
В профилактике аденовирусных заболеваний основная роль принадлежит методам повышения неспецифической резистентности организма (закаливание, рациональное питание). Во время эпидемических вспышек контактным лицам назначают человеческий
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
лейкоцитарный интерферон, более безопасные препараты рекомбинантного интерферона, индукторы ИФН. В очаге проводят текущую дезинфекцию. Разобщение детей во время вспышек аденовирусных инфекций должно быть не менее 10 дней после выявления последнего больного.
ПАТОГЕНЕЗ
Впатологический процесс вовлекаются различные органы и ткани: респираторный тракт, лимфоидная ткань, конъюнктива глаза, кишечник, мочевой пузырь, головной мозг. При этом заболевания, вызываемые 3, 7, 11, 14, 21-м типами, протекают остро с быстрой элиминацией возбудителя. Серотипы 1, 2, 5, 6 вызывают легко протекающие болезни, но могут длительно персистировать в лимфоидной ткани миндалин, аденоидов, мезентериальных ЛУ и т.д. Наиболее часто входными воротами являются верхние отделы респираторного тракта или слизистая конъюнктив. Из верхнего отдела респираторного тракта вирусы могут бронхогенным путем достигать альвеол, иногда вызывая пневмонию, преимущественно у детей младших возрастных групп.
Первичная репродукция вируса происходит в эпителиальных клетках слизистой оболочки дыхательных путей и кишечника, в конъюнктиве глаза и лимфоид-ной ткани (миндалины, мезентериальные ЛУ). Аденовирусы, циркулируя в крови, поражают эндотелий сосудов. В пораженных эпителиальных клетках образуются внутриядерные включения овальной или округлой формы, содержащие ДНК вируса. Клетки увеличиваются в размерах, подвергаются деструкции, при этом под эпителием накапливается серозная жидкость. Это приводит к экссудативному воспалению слизистых оболочек, к образованию фибринозных пленок и некрозу. Наблюдается лимфоидная инфильтрация в глубоких слоях стенок трахеи и бронхов.
Впросвете бронхов содержится серозный экссудат с примесью макрофагов и единичных лейкоцитов.
Помимо местных изменений, аденовирусы оказывают общее токсическое воздействие на организм с клиническими проявлениями интоксикации.
Характерно поражение печени, кишечника, лимфоидной системы, почек, надпочечников с развитием в них гигантоклеточного метаморфоза.
Аденовирусы могут проникать через плаценту, вызывая поражение плода, аномалии развития, пневмонии новорожденных.
Аденовирусы 3, 4, 8, 19-го серотипов ответственны за развитие конъюнктивита, а серовары 40, 41 обуславливают развитие гастроэнтерита.
КЛИНИЧЕСКАЯ КАРТИНА Инкубационный период от 5 до 14 дней.
Аденовирусная инфекция отличается полиморфизмом клинических проявлений. В клинической картине могут преобладать симптомы, свидетельствующие о поражении респираторного тракта, глаз, кишечника, мочевого пузыря, а также лимфоидной ткани, возможно развитие менингоэнцефалита.
Вбольшинстве случаев симптомы интоксикации выражены умеренно даже при высокой лихорадке. Температура повышается с первых дней болезни, ее продолжительность может варьировать от 5-7 дней до 2 нед. Иногда субфебрилитет сохраняется до 4-6 нед, может быть двухволновая лихорадка, редко наблюдается три волны.
Всвязи с тропностью аденовирусов к лимфоидной ткани с первых дней болезни появляется затрудненное носовое дыхание, одутловатость лица, обильный серозно-слизистый ринит (особенно у младших детей). Характерный признак болезни - фарингит с выраженным экссудативным компонентом. Фарингит характеризуется умеренной болью в горле или першением вследствие гиперплазии лимфоидных образований на фоне отечной и
гиперемированной слизистой оболочки задней стенки глотки. Миндалины увеличены, у некоторых больных видны белые, нежные, легко снимающиеся шпателем наложения.
В большинстве случаев аденовирусная инфекция сопровождается умеренно выраженной ЛАП. Увеличиваются шейные, поднижнечелюстные, медиастиналь-ные и мезентериальные ЛУ.
Кашель умеренный, непродолжительный, чаще у детей, клинические признаки бронхита у взрослых встречаются достаточно редко. В то же время почти у каждого 5-го заболевшего ребенка развивается острый стенозирующий ларинготрахеит, который протекает тяжело, с выраженным экссудативным компонентом. У некоторых больных детей отмечается обструктивный синдром, имеющий отечную или смешанную формы, который может сохраняться до 3 нед. При этом кашель влажный, навязчивый, выдох затруднен, одышка смешанного типа. Аускультативно определяется большое количество влажных разнокалиберных и единичных сухих хрипов. У маленьких детей возможно развитие бронхита, бронхиолита.
Изменения со стороны сердечно-сосудистой системы практически отсутствуют.
У части больных имеет место гепатолиенальный синдром, иногда с повышением уровня трансфераз (АЛТ, АСТ).
Мезаденит проявляется либо на фоне других проявлений аденовирусной инфекции, либо как основной синдром. Главный клинический признак при этом - остро возникающие сильные, приступообразные боли в животе, преимущественно в нижней части, нередко в правой подвздошной области, иногда в околопупочной. Тошнота, могут быть рвота, диарея.
Уподавляющего числа заболевших имеет место конъюнктивит. Вначале он бывает односторонним, второй глаз поражается позже. Различают катаральный, фолликулярный и пленчатый конъюнктивит. Последняя форма особенна типична. Конъюнктива век гиперемирована, зерниста, несколько набухшая; может быть небольшое выделение секрета. Через 1-3 дня на конъюнктиве появляются белые или серовато-белые пленчатые налеты. Частый симптом - отек век.
Увзрослых больных при аденовирусной инфекции могут быть клинические признаки геморрагического цистита.
Есть наблюдения развития острого энцефалита. Среди различных серотипов аденовирусов в связи с острыми энцефалитами наиболее часто упоминается 7-й серотип.
В самостоятельную форму болезни выделена фаринго-конъюнктивальная лихорадка, имеющая довольно четкую клиническую картину с высокой 4-7-дневной температурой, общетоксическим синдромом, ринофарингитом, пленчатым конъюнктивитом.
Осложнения: наиболее частыми осложнениями являются отиты, синуситы и пневмония, обусловленные присоединением вторичной инфекции.
Нередко на фоне аденовирусной инфекции диагностируется обострение хронического тонзиллита.
ДИАГНОСТИКА Лабораторные методы исследования
Гемограмма - у большинства заболевших нормоцитоз, но возможны как лейкоцитоз, так и лейкопения. Серологическая диагностика используется для ретроспективной расшифровки острого респираторного вирусного заболевания. Наиболее широко и часто используют две реакции - РТГА и РСК.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Методами экспресс-диагностики являются реакции непрямой гемадсорбции, метод ИФА и иммунофлюоресцентный метод. Иммунофлюоресцентный метод позволяет в течение 3-4 ч с момента взятия материала обнаружить антигены аденовирусов в клетках эпителия носовой полости больных, взятых в первые дни инфекционного процесса. Обнаружение антигенов аденовирусов в ядрах эпителиальных клеток свидетельствует о латентном течении инфекционного процесса, наличие антигенов в цитоплазме позволяет диагностировать острое заболевание.
Дифференциальная диагностика
Дифференциальная диагностика проводится с другими ОРВИ. Нередко приходится ее проводить с дифтерией ротоглотки, дифтерией глаза, ангиной. Аденовирусное заболевание имеет ряд сходных симптомов с ИМ. С явлениями фарингита, конъюнктивита, гепатолиенального синдрома, диареей и продолжительной лихорадкой протекает иерсиниоз. Необходимо иметь в виду брюшной тиф, коксиеллез.
Показанием к консультации хирурга является развитие аденовирусного мезаде-нита, протекающего с выраженными болями в животе и рвотой, что может симулировать острую хирургическую патологию. Консультация офтальмолога - при поражении глаз.
ЛЕЧЕНИЕ
Лечение большинства больных проводится в домашних условиях. Госпитализации подлежат больные с тяжелой формой болезни, при наличии осложнений, сопутствующих заболеваний, а также по эпидемическим показаниям. В лихорадочном периоде необходим постельный режим. Питание должно быть полноценным и богатым витаминами, содержать достаточное количество жидкости.
Большинство больных при неосложненной форме аденовирусного заболевания в этиотропной терапии не нуждаются. При выраженной мотивации пациента и при тяжелом течении инфекционного процесса показан умифеновир (Арбидол♠), препараты ИФН и их индукторы.
Среди натуральных ИФН могут быть использованы следующие: ИФН-α (Интерферон человеческий лейкоцитарный♠) (вводится аэрозольно), интерлок(для лечения конъюнктивита), ИФН-α (Лейкинферон♠¤) (вводят в/м, ингаляционно)
100 тыс. МЕ.
В последнее время широкое применение получили препараты рекомбинантного интерферона, наиболее безопасного по сравнению с лейкоцитарным. ИФН-α2 реком-бинантный входит в состав топических препаратов: капель и спрея Гриппферон♠, мази назальной Гриппферон♠ с лоратадином. Содержание ИФН - 10 тыс. МЕ.
Антибиотики показаны только при пневмониях и других осложнениях бактериальной природы.
Симптоматическая терапия по показаниям. Прогноз обычно благоприятный. Выписка реконвалесцентов проводится после полного клинического выздоровления.
21.6. РИНОВИРУСНАЯ ИНФЕКЦИЯ
Риновирусная инфекция - острое респираторное вирусное заболевание, сопровождающееся симптомами поражения слизистой оболочки носа, носоглотки и маловыраженными симптомами интоксикации.
Заболевания, вызванные риновирусами, называют заразным насморком. В зарубежной литературе - Common cold.
КОД ПО МКБ-10
J20.6. ЭТИОЛОГИЯ
Риновирусы [HRV-(A-C)] - human rhinoviruses, принадлежат к роду Enterovirus семейства Picornoviridae.
Существует более 110 серотипов риновирусов человека. Размеры вируса 15-30 нм. Геном представлен нефрагментированной однонитевой РНК. В составе вириона нет липидов и углеводов. Рецептором риновирусов является межклеточная адгезивная молекула I (ICAM-I), которая экспрессируется на эпителиальных клетках, фибробластах и эндотелиальных клетках. Репликация РНК происходит в цитоплазме.
Риновирусы малоустойчивы в окружающей среде, однако могут сохранять заразительность на предметах обихода и руках. Они устойчивы к растворителям липидов, быстро инактивируются при низких значениях pH, в течение 10 мин погибают при температуре +56 °С, при +4 °С сохраняются длительно. При высушивании погибают через несколько минут.
ЭПИДЕМИОЛОГИЯ Риновирусы распространены повсеместно.
Источниками возбудителя инфекции являются больной человек и вирусоноси-тель. Длительность заразного периода в среднем 5-7 дней (с колебаниями от 1 до 28 дней). Больной становится заразным с последних дней инкубационного периода и особенно заразен
впериод максимального проявления катаральных симптомов, особенно быстро заболевание распространяется среди детей в организованных и закрытых коллективах. В отличие от других респираторных вирусов риновирусы обладают более низкой заразительностью. Вирус
вокружающую среду выделяется при кашле и чихании.
Механизм передачи - аспирационной.
Пути передачи: воздушно-капельный, контактный (через предметы личного пользования). Восприимчивость высокая.
Встречается во всех возрастных группах, что объясняется чрезвычайно высоким разнообразием типов риновируса и кратковременностью иммунитета.
Нередко риновирусы являются причиной внутрибольничной инфекции. Среди острых респираторных вирусных заболеваний у взрослых риновирусная инфекция составляет от 1015% до 28%. Почти у одной трети больных регистрируют одновременное участие в инфекционном процессе 2 серотипов вируса, у 10% - до 3, иногда 4 серотипа возбудителя. Эпидемические вспышки, связанные с риновиру-сами, развиваются редко, преимущественно в осенне-зимний период. На характер течения риновирусной инфекции оказывают влияние природные условия региона. Так, в Арктике и Антарктиде риновирусная инфекция протекает тяжелее и возникает чаще, чем в регионах умеренного климата.
МЕРЫ ПРОФИЛАКТИКИ
Специфическая профилактика не разработана. Неспецифические меры профилактики не отличаются от таковых при других ОРВИ. Проводятся обычные противоэпидемические мероприятия в очаге воздушно-капельной инфекции.
ПАТОМОРФОЛОГИЯ И ПАТОГЕНЕЗ
Входными воротами инфекции является слизистая оболочка носа. Патологический процесс ограничивается ВДП. В отличие от других ОРВИ, при риновирус-ной инфекции в первую очередь страдает плоский эпителий, покрывающий носовые ходы. Характерны значительный отек и набухание слизистой носовых ходов. Отмечаются гиперсекреция и десквамация эпителия без некроза. Секреторные клетки эпителия продуцируют слизь, и они же обладают адсорбционной функцией. В состав слизи входят факторы неспецифической защиты: муцин,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
лизоцим, лактоферрин и опсонины. Макрофаги, содержащиеся в назальном секрете, выделяют противовоспалительные цитокины. Развитие местного иммунитета связано с иммунным механизмом Т- и В-клеток. Т-клетки определяют цитотоксические хел-перные функции, В-клетки продуцируют секреторный IgА, который локализуется под эпителиальной мембраной и является первой линией защиты организма. IgА связывается с вирусами и блокирует их адгезию к клеткам эпителия, предотвращая начало инфекционного процесса. Патогены, нейтрализованные секреторными IgА, удаляются за счет мукоцилиарного клиренса. При развитии инфекционного процесса неспецифическая местная защита снижается, нарушаются мукорегуляция и состав слизи, это приводит к застою, нарушению ее отделения и к скоплению в полостях околоносовых пазух и в среднем ухе. В настоящее время доказана причастность риновирусов к развитию некоторых воспалительных заболеваний ЛОР-органов. Регенерация слизистой оболочки заканчиваются к концу 2-й недели заболевания.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период длится от 1 до 3 сут (реже - до 6). Заболевание начинается остро с недомогания и легкого познабливания, температура тела нормальная или субфебрильная. С первых часов болезни появляются заложенность носа, многократное чихание и обильное серозное отделяемое, нарушаются обоняние и вкус, снижается слух. Возможны головная боль, чувство «тяжести в голове» и ломота во всем теле. Особенностью клинического течения риновирусной инфекции является преобладание местных симптомов над общеинфекционными. Общее состояние больного страдает мало. Через 2-3 дня ринит достигает максимальных проявлений. Также возможен небольшой сухой кашель (у одной трети больных признаки бронхита).
При осмотре в области крыльев и преддверия носа определяется мацерация кожи, гиперемия слизистой оболочки ротоглотки, преимущественно в области задней стенки глотки, инъекция сосудов склер и конъюнктив. Могут увеличиться поднижнечелюстные ЛУ.
Продолжительность заболевания редко превышает 7 сут, у части больных клинические симптомы сохраняются до 14 дней. При затяжном рините (более 2 нед) в результате присоединения бактериальной флоры выделения из носа приобретают слизисто-гнойный характер, что может свидетельствовать о начинающемся синусите. Наиболее характерными осложнениями являются евстахеит, отит, пневмония, обусловленные присоединением бактериальной флоры, чаще Staphylococcus aureus, Haemophilus influenzae, Streptococcus pneumoniae, Klebsiella sp., Moraxella sp., Neisseria sp.
ДИАГНОСТИКА
Диагностика риновирусной инфекции основывается на жалобах пациента: умеренно выраженные явления интоксикации, наличие катарального синдрома с преобладанием ринита. Учитываются данные эпидемиологического анамнеза, данные лабораторных методов исследования: для клинической диагностики наиболее эффективным является метод иммунофлюоресценции.
Показания к дополнительным методам диагностики и консультациям специалистов
При остром синусите рекомендованы рентгенография или МРТ придаточных пазух носа и консультация оториноларинголога. При развитии отита - консультация оториноларинголога.
ЛЕЧЕНИЕ
При неосложненных случаях риновирусной инфекции госпитализация не требуется. Больным в большинстве случаев достаточно симптоматической терапии. Срок изоляции больного - 5-6 дней. При среднетяжелом и тяжелом течении болезни показана дезинтоксикационная терапия. Целесообразно ингаляционное введение ИФН.
Патогенетическая терапия включает применение сосудосуживающих средств, в частности адреномиметиков, относящихся к группе имидазолов [допамин (Допамин♠, Дофамин♠)]. При их введении быстро уменьшаются отечность слизистой оболочки и патологически повышенная секреция, нормализуется проходимость носовых ходов, улучшается снабжение воздухом околоносовых пазух и барабанной полости, что устраняет насморк и предупреждает развитие синуситов, евстахиита и отита. Прогноз благоприятный. Диспансерное наблюдение не предусмотрено.
21.7. КОРОНАВИРУСНАЯ ИНФЕКЦИЯ
Коронавирусная инфекция - острое антропозоонозное вирусное заболевание с аэрозольным и фекально-оральным механизмом передачи возбудителя. Клинически характеризуется поражением респираторного тракта с возможным развитием пневмонии и ТОРС. Возможны клинические варианты с поражением ЖКТ.
ТОРС (атипичная пневмония) - тяжело протекающая форма коронавирусной инфекции, характеризующаяся циклическим течением, выраженной интоксикацией, преимущественным поражением альвеолярного эпителия и развитием ОДН.
Коронавирус ближневосточного респираторного синдрома (БВРС-КоВ) характеризуется выраженным синдромом интоксикации, поражением респираторного тракта с развитием тяжелой пневмонии.
КОД ПО МКБ-10
U04.9 Тяжелый острый респираторный синдром неуточненный. ЭТИОЛОГИЯ
Коронавирусы относятся к семейству Coronaviridae. Название семейства происходит от латинского Corona - корона, так как на электронномикроскопи-ческих фотографиях пепломеры создают вокруг оболочки вирионов зубчатое
обрамление. В семейство Coronaviridae входят два
подсемейства: Coronavirinae и Torovirinae. Первое подразделяется на 4 рода: Alphacoronavirus, Betacoronavirus, Gammacoronavirus, Deltacoronavirus.
Коронавирусы - крупные РНК-содержащие вирусы сферической формы диаметром 120-160 нм. Вирион имеет сложное строение, в центре расположена спиралевидная однонитевая молекула РНК, нуклеокапсид окружен белково-липидной оболочкой с отчетливо различимыми на электронномикроскопических снимках булавовидными пепломерами. В состав липидной оболочки входят 3 структурных белка (мембранный белок, трансмембранный белок и гемагглютинин). Репликация вируса происходит в цитоплазме пораженных клеток.
Коронавирусы обладают сложной антигенной структурой, их подразделяют на антигенные группы, которые имеют разные антигенные перекресты.
•Первая группа - человеческий коронавирус 229 Е и вирусы, поражающие свиней, собак, кошек и кроликов.
•Вторая группа - человеческий вирус ОС-43 и вирусы мышей, крыс, свиней, крупного рогатого скота и индюков.
•Третья группа - кишечные коронавирусы человека и вирусы кур и индюков. Этиологическими агентами коронавирусного заболевания ВДП являются HCoV
NL63, HCoV 229E, BetaCoV 1, HCoV HKU1 и HToV.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Вирусы родов Alphacoronavirus (HCoV NL63, HCoV 229E) и Torovirus (HToV) чаще клинически проявляются поражением ЖКТ.
Основными клетками-мишенями коронавирусов являются эпителиальные клетки и макрофаги, имеющие на своей поверхности рецепторы, с которыми взаимодействует поверхностный S-белок вируса.
Возбудитель ТОРС (SARS-CoV) - открытая в 2003 г. разновидность корона-вируса. Секвенирование вируса ТОРС показало, что он отличается по нуклеотид-ным последовательностям от известных ранее групп коронавирусов на 50-60%. Результаты секвенирования изолятов вируса, проведенные китайскими учеными, существенно отличаются от данных, полученных канадскими и американскими исследователями, что позволяет предположить способность вируса быстро мутировать. Коронавирусы неустойчивы в окружающей среде, мгновенно погибают при нагревании до 56 °C, под воздействием дезинфицирующих средств. Имеются данные о более высокой устойчивости вируса ТОРС. Так, на пластиковой поверхности вирус может сохраняться до 2 сут, в канализационных водах - до 4 сут. Однако в течение этих сроков количество вирусных частиц постоянно падает. Предполагают, что вирус ТОРС стал результатом мутаций известных ранее видов коронавируса.
Происхождение вируса БВРС-КоВ (описан в 2012 г.) в настоящее время до конца неизвестно, однако считается, что возник он среди летучих мышей.
ЭПИДЕМИОЛОГИЯ
Источник возбудителя больной и носитель коронавирусов. Путь передачи воздушнокапельный, восприимчивость к вирусу высокая. Болеют преимущественно дети, после перенесенной болезни формируется гуморальный иммунитет. У 80% взрослых есть антитела к коронавирусам. Коронавирусная инфекция, вызывающая заболевание ВДП, распространена повсеместно и регистрируется в течение всего года с пиками заболеваемости зимой и ранней весной, когда эпидемическая значимость ее в структуре ОРВИ колеблется от 6,8% до 28,6%. Коронавирусы, как правило, лидируют среди прочих респираторных вирусов в этиологии нозокоми-альных инфекций.
Первый случай ТОРС, этиологически связанный с SARS-CoV, был зарегистрирован в ноябре 2002 г. в провинции Гуандун (КНР), последний - 20 июня 2003 г.
За этот период зарегистрированы 8422 случая болезни в 30 странах, умерли 916 (10,9%) больных. До 60% от всех летальных исходов приходится на медицинских работников. Наибольшее количество заболевших зарегистрировано в Китае, Сингапуре, Канаде. Один завозной случай ТОРС был зарегистрирован и в Российской Федерации, в Благовещенске.
Природным резервуаром SARS-CoV являются летучие мыши (Chiroρtera: Microchiroρtera). От летучих мышей в природе заражаются виверровые (Viverridae - мелкие
дикие млекопитающие), которых жители Юго-Восточной Азии держат в качестве домашних животных и часто употребляют в пищу. Цепочка проникновения вируса в человеческую популяцию состоит из нескольких звеньев: летучие мыши → мелкие дикие млекопитающие, енотовидные собаки, бирманские хорьковые барсуки → непрожаренное мясо в ресторанах → человек.
Источником вируса ТОРС служат больные, считают, что вирус может выделяться уже в конце инкубационного периода и возможно реконвалесцентное носи-тельство. Основной путь передачи вируса ТОРС - также воздушно-капельный, именно он выступает движущей силой эпидемического процесса. Допустима контаминация вирусом предметов в окружении больного. Возможность распространения вируса от источника инфекции определяется многими факторами: выраженностью катаральных явлений (кашля, чихания, насморка), температурой, влажностью и скоростью движения воздуха. Сочетание этих факторов и
определяет конкретную эпидемиологическую ситуацию. Описаны вспышки в многоквартирных домах, где люди непосредственно не контактировали друг с другом и распространение вируса, скорее всего, происходило через вентиляционную систему. Вероятность заражения зависит от инфицирующей дозы вируса, его вирулентности и восприимчивости заразившегося. Инфицирующая доза вируса, в свою очередь, обусловлена количеством вируса, выделяемого источником инфекции, и расстоянием от него. Несмотря на высокую вирулентность, восприимчивость к вирусу ТОРС невысокая, что связано с наличием у большинства людей антител к коронавирусам. Об этом свидетельствует небольшое количество случаев заболевания, а также тот факт, что в большинстве ситуаций заражение произошло при близком контакте с больным в закрытом помещении. Болеют взрослые, случаев развития болезни у детей не зарегистрировано, что, вероятно, обусловлено более высоким уровнем иммунной защиты вследствие недавно перенесенной инфекции.
С 2012 г. в ВОЗ в соответствии с Международными медико-санитарными правилами поступает информация о спорадических случаях инфицирования новым коронавирусом. Данный штамм ранее не выявлялся у человека, а определение полной последовательности генома вируса показало, что он принадлежит к новому виду
коронавирусов Betacoronavirus, который отличается от других известных коронавирусов и вирусов, вызывающих ТОРС. По данным ВОЗ, в 2015 г. в мире зарегистрировано 1280 случаев заражения вирусом БВРС-КоВ/MERS, скончались 455 человек. Обитающие в России летучие мыши, подобно птицами, осуществляют сезонные миграции, зимуя в эндемичной по БВРС территории и могут, таким образом, заносить вирус в Россию.
Появление сначала ТОРС (англ. severe acute respiratory syndrome, SARS) в 2002 г., а затем ближневосточного респираторного синдрома (БВРС) (англ. Middle East respiratory syndrome, MERS) в 2012 г. заставило эпидемиологов существенно повысить уровень эпидемической опасности коронавирусов.
МЕРЫ ПРОФИЛАКТИКИ
Профилактика ТОРС и БВРС-КоВ/MERS предполагает изоляцию больных, проведение карантинных мероприятий на границах, дезинфекцию транспортных
средств. Индивидуальная профилактика предусматривает ношение марлевых масок и респираторов. Для химиопрофилактики рекомендуют назначение рибави-рина, а также препаратов ИФН и его индукторов.
ПАТОМОРФОЛОГИЯ И ПАТОГЕНЕЗ
Коронавирусы поражают эпителий ВДП и ЖКТ. Основными клетками-мишенями для вирусов ТОРС и БВРС-КоВ/MERS являются клетки альвеолярного эпителия, в цитоплазме которых происходит репликация вируса. После сборки вирионов они переходят в цитоплазматические вакуоли, которые мигрируют к мембране клетки и путем экзоцитоза выходят во внеклеточное пространство, причем до этого не происходит экспрессии антигенов вируса на поверхность клетки, поэтому антителообразование и синтез ИФН стимулируются относительно поздно. Сорбируясь на поверхности клеток, вирус способствует их слиянию и образованию синцития. Тем самым осуществляется быстрое распространение вируса в ткани. Действие вируса вызывает повышение проницаемости клеточных мембран и усиленный транспорт жидкости, богатой альбумином, в интерстици-альную ткань легкого и просвет альвеол. При этом разрушается сурфактант, что приводит к коллапсу альвеол, в результате чего резко нарушается газообмен. В тяжелых случаях развивается острый РДС, сопровождающийся тяжелой ДН. Вызванные вирусом повреждения «открывают дорогу» бактериальной и грибковой флоре, развивается вирусно-бактериальная пневмония. У ряда пациентов вскоре после выписки наступает ухудшение состояния, связанное с быстрым развитием фиброзных изменений в легочной ткани, что позволило предположить инициацию вирусом апоптоза. Возможно, коронавирус поражает макрофаги и лимфоциты, блокируя все
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
звенья иммунного ответа. Однако наблюдавшаяся в тяжелых случаях ТОРС лимфопения также может быть обусловлена и миграцией лимфоцитов из кровяного русла в очаг поражения. Таким образом, в настоящее время выделяют несколько звеньев патогенеза ТОРС и БВРС-КоВ/MERS:
◊первичное поражение вирусом альвеолярного эпителия;
◊повышение проницаемости клеточных мембран;
◊утолщение межальвеолярных перегородок и скопление жидкости в альвеолах;
◊присоединение вторичной бактериальной инфекции;
◊развитие тяжелой ДН, которая служит основной причиной смерти в острой фазе болезни.
Установлена корреляция между низкой концентрацией ИЛ-8 и TNF-α в периферической крови больных и тяжестью заболевания.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период коронавирусной инфекции, протекающей, как ОРВИ, составляет 2-3 сут. Заболевание начинается остро, протекает с умеренно выраженными явлениями интоксикации и симптомами поражения верхних отделов респираторного тракта. Температура тела, как правило, нормальная. Катаральный синдром в большинстве случаев проявляется ринитом с обильным серозным отделяемым. Иногда на фоне слабовыраженных явлений интоксикации больные отмечают першение в горле, сухой кашель. При осмотре отмечается гиперемия слизистой оболочки задней стенки глотки, гиперемия и отек слизистой оболочки носа. Продолжительность болезни от 5-7 сут. У детей раннего возраста коронавирусная инфекция может протекать тяжело с поражением НДП и развитием пневмонии.
Описаны нозокомиальные вспышки коронавирусной инфекции, проявляющиеся синдромом острого гастроэнтерита.
У ТОРС инкубационный период от 2 до 7 сут, в ряде случаев удлиняется до 10 дней. Начало болезни острое, первые симптомы - озноб, головная боль, боли в мышцах, общая слабость, головокружение, повышение температуры тела до 38 °C и выше. Помимо указанных выше симптомов, у части больных наблюдают кашель, насморк, боли в горле, при этом имеется гиперемия слизистой оболочки нёба и задней стенки глотки. Возможны также тошнота, одноили двукратная рвота, боли в животе, жидкий стул. Через 3-7 сут, а иногда и раньше болезнь переходит в респираторную фазу, которая характеризуется повторным повышением температуры тела, появлением упорного непродуктивного кашля, одышки, затрудненного дыхания. Наблюдаются бледность кожи, цианоз губ и ногтевых пластинок, тахикардия, приглушение тонов сердца, тенденция к артериальной гипотензии. При перкуссии грудной клетки определяют участки притупления перкуторного звука, выслушивают мелкопузырчатые хрипы. У 80-90% заболевших в течение недели состояние улучшается, симптомы ДН регрессируют и наступает выздоровление. У 10-20% больных состояние прогрессивно ухудшается и развивается картина, сходная с РДС.
Таким образом, ТОРС - циклически протекающая вирусная инфекция, в развитии которой можно выделить три фазы.
•Лихорадочная фаза. Если течение болезни завершается на этой фазе, констатируют легкое течение болезни.
•Респираторная фаза. Если характерная для этой фазы ДН быстро разрешается, констатируют среднетяжелое течение болезни.
•Фаза прогрессирующей ДН, которая требует проведения длительной ИВЛ, часто завершается летальным исходом. Такая динамика течения болезни свойственна тяжелому течению ТОРС.
У некоторых больных, помимо респираторного синдрома, наблюдаются признаки поражения ЖКТ: тошнота, повторная рвота, диарея, которые отмечаются до 30% случаев.
Клиническая картина БВРС характеризуется лихорадкой, кашлем, одышкой, затрудненным дыханием и в большинстве клинически подтвержденных случаев быстро переходит в тяжелую первичную вирусную пневмонию. У пациентов, страдающих хроническими заболеваниями органов дыхания и сердечно-сосудистой системы, метаболическим синдромом и иммунодефи-цитными состояниями различного генеза, на первом плане могут быть симптомы поражения ЖКТ. ВОЗ рекомендует рассматривать в качестве возможного БВРС, требующего соответствующего лабораторного подтверждения, санитарногигиенических мероприятий и госпитализации, все случаи острых респираторных вирусных заболеваний, осложненные ОРДС, при наличии эпидемиологических данных - пребывания на Ближнем Востоке в течение 14 сут до начала заболевания.
Описаны легкие и бессимптомные случаи заболевания, которые могут привести к скрытому распространению инфекции.
ДИАГНОСТИКА
Клинически коронавирусная инфекция с поражением ВДП не отличается от риновирусного заболевания. Диагностика ТОРС также представляет большие трудности, так как отсутствуют патогномоничные симптомы. Большое значение имеет эпидемиологический анамнез. В типичных тяжелых и среднетяжелых случаях имеется характерная динамика заболевания.
В связи с этим в качестве ориентира используют критерии, разработанные CDC (США), согласно которым к подозрительным на ТОРС относят респираторные заболевания неустановленной этиологии, протекающие:
◊с повышением температуры тела свыше 38 °C;
◊с наличием одного или нескольких признаков респираторного заболевания (кашель, учащенное или затрудненное дыхание, гипоксемия);
◊у лиц, выезжавших в течение 10 сут до заболевания в регионы мира, пораженные ТОРС, или общавшиеся в эти сроки с больными, подозрительными на
ТОРС.
С клинической позиции также важны отсутствие сыпи, полиаденопатии, гепато-лиенального синдрома, острого тонзиллита, поражения нервной системы, наличие лимфопении и лейкопении.
Специфическая и неспецифическая лабораторная диагностика
Картина периферической крови при ТОРС характеризуется умеренной тром-боцитопенией, лейко- и лимфопенией, анемией; часто наблюдают гипоаль-буминемию, реже - гипоглобулинемию, что связано с выходом белка во вне-сосудистое пространство вследствие повышенной сосудистой проницаемости. Возможно повышение активности АЛТ, АСТ и КФК, что указывает на вероятность органных поражений (печень, сердце) или развитие генерализованного цитолитического синдрома.
Иммунологические методы позволяют достоверно выявлять антитела к вирусу ТОРС и БВРС после 21 сут от начала болезни, ИФА через 10 сут от начала болезни, таким образом, они пригодны для ретроспективной диагностики или для популя-ционных исследований.
Вирусологические методы позволяют выявить вирус в образцах крови, фекалий, респираторных секретов на клеточных культурах, а затем идентифицировать его при помощи дополнительных тестов. Этот метод дорогостоящий, трудоемкий и используется в научных
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
целях. Наиболее эффективный метод ранней диагностики - ПЦР, которая позволяет обнаружить специфические фрагменты РНК вируса в биологических жидкостях (кровь, кал, моча) и секретах (смывах из носоглотки, бронхов, в мокроте) на самых ранних стадиях болезни. Установлено не менее 7 праймеров - нуклеотидных фрагментов, специфичных для вирусов ТОРС и БВРС.
Учитывая наличие у вирионов коронавирусов характерных морфологических черт, существенное значение в диагностике коронавирусных заболеваний может иметь электронная микроскопия.
Инструментальные методы
Рентгенологически выявляют интерстициальные инфильтраты, двустороннюю сливную пневмонию.
Дифференциальная диагностика
Дифференциальную диагностику ТОРС, БВРС-КоВ на 1-м этапе болезни следует проводить с гриппом, другими респираторными инфекциями и энтеро-вирусными инфекциями группы Коксаки-ЕСНО. В респираторной фазе прежде всего следует исключить орнитоз, микоплазмоз, респираторный хламидиоз и легионеллез.
Дифференциальная диагностика коронавирусной инфекции (ОРВИ) проводится с гриппом, респираторно-синцитиальной вирусной инфекцией, риновирусной инфекцией и энтеровирусными заболеваниями (табл. 21.17, 21.18).

Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/


•Микоплазменную пневмонию наблюдают преимущественно у детей старше 5 лет и взрослых до 30 лет. Болезнь развивается постепенно, начинаясь с катаральных явлений, субфебрилитета, реже остро. Характерен непродуктивный кашель с первых дней болезни, который через 10-12 сут становится продуктивным. Лихорадка умеренная, интоксикация выражена слабо, признаков ДН нет. Рентгенологически выявляют сегментарную, очаговую или интерсти-циальную пневмонию, возможен плевральный выпот, интерлобит. Регресс пневмонии медленный в сроки от 3-4 нед до 2-3 мес, нередки внелегочные поражения: артрит, менингит, гепатит.
•Легионеллезная пневмония характеризуется выраженной интоксикацией, высокой лихорадкой (39-40 °C) длительностью до 2 нед и плевральными болями. Наблюдают кашель со скудной мокротой, нередко с прожилками крови и внелегочные поражения (диарейный синдром, гепатит, почечную недостаточность, энцефалопатию). Физикальные данные (укорочение перкуторного звука, мелкопузырчатые хрипы) довольно четкие, рентгенологически выявляют плевропневмонию, обычно обширную одностороннюю, реже двустороннюю, при исследовании крови определяют нейтрофильный лейкоцитоз, значительное увеличение СОЭ. Возможно развитие тяжелой ДН, требующей применения ИВЛ.
Что касается РДС взрослых, то дифференциальную диагностику проводят на основании выявления перечисленных выше этиологических факторов синдрома. Во всех подозрительных случаях целесообразно использование лабораторных тестов для исключения перечисленных выше инфекций.
ЛЕЧЕНИЕ Режим. Диета
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Больных коронавирусной инфекцией лечат симптоматическими средствами амбулаторно, пациенты с подозрением на ТОРС, БВРС-КоВ подлежат госпитализации и изоляции в специально оборудованные стационары. Режим в остром периоде заболевания постельный, специфической диеты не требуется.
Медикаментозная терапия
Методов специфической терапии, эффективность которых подтверждена методами доказательной медицины, не существует.
Во время эпидемии применяли рибавирин в дозе 8-12 мг/кг каждые 8 ч в течение 7-10 сут, препарат назначали с учетом противопоказаний, также использовали ИФН-α2b, ИФН-α и его индукторы. Целесообразна оксигенотерапия путем ингаляций кислородно-воздушной смеси или ИВЛ в режиме вспомогательного дыхания, проведение дезинтоксикации по общим правилам. Необходимо, с учетом активизации аутофлоры, применение антибиотиков широкого спектра действия, таких как левофлоксацин, цефтриаксон и др. Перспективно применение ингаляций препаратами, содержащими сурфактант [порактант альфа (Куросурф♠), Сурфактант-БЛ♠], а также оксид азота.
Прогноз
Летальные исходы при коронавирусной инфекции (ОРВИ) крайне редки. При легком и среднетяжелом течении ТОРС (80-90% больных) прогноз благоприятный, в тяжелых случаях, требующих применения ИВЛ, летальность высокая. У пациентов, перенесших болезнь, возможны неблагоприятные последствия, обусловленные фиброзом легких.
Примерные сроки нетрудоспособности
Выписку больных осуществляют после полного регресса воспалительных изменений в легких, восстановления их функции и стойкой нормализации температуры тела в течение 7 сут.
21.8. ЭНТЕРОВИРУСНЫЕ ИНФЕКЦИИ
Энтеровирусные инфекции (Enterovirosis) - большая группа антропонозных инфекционных болезней с фекально-оральным механизмом передачи возбудителя, вызываемых энтеровирусами группы Коксаки и ECHO, которые характеризуются полиморфизмом клинической картины с поражением ЦНС, мышц, слизистых оболочек глаз, ВДП, пищеварительного тракта и кожи.
КОДЫ ПО МКБ-10
А85.0 (G05.1*) Энтеровирусный энцефалит, энтеровирусный энцефаломиелит. А87.0 (G02.0*) Энтеровирусный менингит; менингит, вызванный вирусом
Коксаки/менингит, вызванный ЕСНО-вирусом. А88.0 Энтеровирусная экзантематозная лихорадка (бостонская экзантема).
B08.4 Энтеровирусный везикулярный стоматит с экзантемой, вирусная пузырчатка полости рта и конечностей.
B08.5 Энтеровирусный везикулярный фарингит, герпетическая ангина.
В08.8 Другие уточненные инфекции, характеризующиеся поражением кожи и слизистых оболочек; энтеровирусный лимфонодулярный фарингит.
B30.3 (H13.1*) Острый эпидемический геморрагический конъюнктивит (энтеровирусный); конъюнктивит, вызванный: вирусом Коксаки типа 24, энтерови-русом типа 70; геморрагический конъюнктивит (острый) (эпидемический).
В34.1 Энтеровирусная инфекция неуточненная; инфекция, вызванная вирусом Коксаки, БДУ; инфекция, вызванная ЕСНО-вирусом, БДУ.
ЭТИОЛОГИЯ
Возбудители энтеровирусных инфекций - кишечные вирусы
рода Enterovirus семейства Picornaviridae (pico - маленький, RNA - РНК). Род энтеровирусов объединяет полиовирусы (3 серовара), которые являются возбудителями полиомиелита, вирусы Коксаки А (24 серовара), Коксаки В (6 сероваров) и ECHO (34 серовара), а также 5 энтеровирусов человека (неклассифицированные вирусы 68-72 типов). Энтеровирус 70 вызывает острый геморрагический конъюнктивит, а энтеровирус 72 - ВГA. Энтеровирусы генетически неоднородны. Они имеют маленькие размеры вириона - 15-35 нм, РНК расположена в центре вириона и окружена белковыми молекулами - капсомерами. Кишечные вирусы устойчивы в окружающей среде, резистентны к низким температурам, устойчивы к замораживанию и оттаиванию (в фекалиях при низкой температуре сохраняют жизнеспособность более полугода). Устойчивы к 70% раствору этанола, 5% раствору лизола. В сточных водах, мелких водоемах в зависимости от температуры могут сохраняться до 1,5-2 мес. Кишечные вирусы чувствительны к высушиванию, при комнатной температуре сохраняются до 15 сут. При температуре 33-35 °С погибают в течение 3 ч, при температуре 50-55 °С - в течение нескольких минут, при кипячении и автоклавировании - мгновенно. Быстро погибают под воздействием формальдегида, сулемы, гетероциклических красителей (метиленового синего и др.), окислителей [калия перманганата и водорода пероксида (Перекиси водорода♠)], а также ультрафиолетового облучения, ультразвука, ионизирующей радиации. Свободный остаточный хлор (0,3-0,5 мг/л) быстро инактивирует энтеровирусы в водных суспензиях, однако присутствие органических веществ, связывающих хлор, может снизить эффект инактивации.
ЭПИДЕМИОЛОГИЯ
Источник энтеровирусов - человек (больной или вирусоноситель). В распространении заболевания большую роль играют также реконвалесценты и лица, находившиеся в контакте с больными и реконвалесцентами.
Основной механизм передачи возбудителя - фекально-оральный, главные пути передачи - водный и алиментарный. Наиболее интенсивно вирус выделяется в первые дни болезни, однако в ряде случаев энтеровирусы могут выделяться в течение нескольких месяцев. Чаще всего факторами передачи становятся вода, овощи, реже молоко и другие пищевые продукты. Возможно заражение при купании в водоемах, контаминированных энтеровирусами. Вирус может передаваться через грязные руки, игрушки. Учитывая, что в остром периоде вирус выделяется из носоглоточной слизи, не исключен и воздушно-капельный путь передачи. Возможна
трансплацентарная передача энтеровирусов от больной матери плоду.
Восприимчивость высокая. Часто наблюдаются групповые заболевания в детских учреждениях, возможны семейные вспышки. Бессимптомное вирусоноси-тельство встречается в 17-46% случаев (чаще у детей младшего возраста). После перенесенной энтеровирусной инфекции вырабатывается стойкий типоспецифи-ческий иммунитет. Возможно развитие перекрестного иммунитета к некоторым типам энтеровирусов.
Энтеровирусные инфекции распространены повсеместно. Спорадические случаи болезни, вспышки и эпидемии энтеровирусных инфекций описаны во всех странах мира. Массовые миграции (как трудовые, так и в результате военных конфликтов), широкое распространение туризма приводят к распространению в коллективах новых штаммов энтеровирусов, к которым у людей нет иммунитета. С другой стороны, отмечено повышение вирулентности некоторых штаммов вируса в результате их естественной циркуляции. Энтеровирусные
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
инфекции наблюдаются в течение всего года, но для стран с умеренным климатом характерна летне-осенняя сезонность заболеваемости.
Энтеровирусные болезни регистрируют на территории РФ с 1956 г. В последние годы в Уральском, Сибирском и Дальневосточном федеральных округах отмечался рост числа вспышек энтеровирусной инфекции, причем заболевали преимущественно дети до 14 лет. В результате эпидемиологического расследования данных случаев установлено, что вспышки заболевания связаны в основном с употреблением необеззараженной воды и купанием в открытых водоемах. В то же время, по данным Роспотребнадзора, в 2015 г., по сравнению с 2014 г., снизилась заболеваемость энтеровирусными инфекциями на 16,3%. Всего было зарегистрировано 7849 случаев заболевания энтеровирусными инфекциями, из них энтеровирусным менингитом заболели 2994 человека (в 2014 г. - 9211 и 3212 соответственно, в 2013 г. - 16101 и 7176 соответственно). Показатель заболеваемости за 2015 г. составил 5,38 на 100 тыс. населения против 6,43 в 2014 г. и 12,0 в 2013 г.
МЕРЫ ПРОФИЛАКТИКИ Специфическая профилактика не разработана.
Вкачестве неспецифической профилактики детям до 3 лет, контактировавшим с больными, вводят человеческий иммуноглобулин из расчета 0,3-0,5 мл/кг, а также в течение 7 дней закапывают в нос лейкоцитарный ИФН по 5 капель 3 р/сут. В эпидемическом очаге проводят профилактические и противоэпидемические мероприятия. Больных изолируют на 14 дней; проводят влажную уборку помещений с использованием дезинфицирующих средств (0,1% раствор хлористоводородной кислоты, 0,3% раствор формальдегида).
Вдетских учреждениях устанавливают карантин на 14 дней. Работников родильных домов и детских учреждений, контактировавших с больными, переводят на другую работу на 14 дней.
ПАТОГЕНЕЗ И ПАТОМОРФОЛОГИЯ
Патогенез энтеровирусных инфекций изучен недостаточно, так как вирусы могут размножаться в эпителии кишечной стенки, не вызывая заболевания. Болезнь возникает при снижении резистентности организма.
Энтеровирусы проникают в организм через слизистую оболочку верхних отделов дыхательных путей и пищеварительного тракта, где и происходит их первичная репликация. При выходе вируса за пределы зоны первоначального накопления он попадает в регионарные ЛУ и лимфатические образования кишечника, где продолжается его репликация. На 3-й день от начала болезни в результате первичной
виремии поражаются другие органы. Многообразие клинических форм энтеро-вирусной инфекции объясняют как мутацией капсидных антигенов, гетерогенностью вирусной популяции, так и тропностью различных генотипов возбудителя к отдельным тканям (эпителиальным клеткам, нервной ткани и мышцам).
В 1-2% случаев одновременно с поражением других органов или несколько позже возможно вовлечение в процесс ЦНС. Проникнув в ЦНС, вирус воздействует на сосудистые сплетения желудочков головного мозга, вследствие чего вырабатывается избыточное количество СМЖ с развитием гипертензивно-гидроцефального синдрома, раздражением ядер блуждающего нерва и рвотного центра. В зависимости от уровня поражения ЦНС развиваются серозный менингит, менингоэнцефа-лит или полиомиелитподобное заболевание. К поражению ЦНС приводят генотипы энтеровирусов, обладающих повышенной тропностью к нервной ткани. Энтеровирусная инфекция может протекать бессимптомно с персистенцией вирусов в кишечнике, мышцах, паренхиматозных органах, ЦНС. Возможно и хроническое течение инфекции.
При патоморфологическом исследовании органов больных, умерших от Коксаки-вирусной инфекции (чаще всего детей раннего возраста), обнаруживают миокардит, инфильтрацию сердечной мышцы лимфоцитами, гистиоцитами, плазматическими и ретикулярными клетками, эозинофилами и полинуклеарными лейкоцитами. В ряде случаев выявляют интерстициальный отек, истончение и некроз мышечных волокон, рубцовые изменения и очаги обызвествления (в ряде наблюдений развитие трансмурального инфаркта миокарда связывали с перенесенным миокардитом).
При менингоэнцефалите в мягких мозговых оболочках головного и спинного мозга отмечают отек, гиперемию и периваскулярную лимфоцитарно-моноцитарную инфильтрацию. Выявляют диапедезные кровоизлияния в вещество мозга, периваскулярную инфильтрацию и очаговую пролиферацию глиальных клеток, очаговый некроз и полиморфноядерные инфильтраты в сосудистых сплетениях желудочков мозга.
При эпидемической миалгии обнаруживают признаки острого или хронического миозита в виде исчезновения поперечной исчерченности, набухания отдельных волокон и в ряде случаев - коагуляционного некроза. Изменения в поперечнополосатой мускулатуре типичны и патогномоничны для Коксаки-вирусной инфекции.
КЛИНИЧЕСКАЯ КАРТИНА Инкубационный период составляет от 2 до 10 сут, в среднем 3-4 сут. Классификация
По классификации энтеровирусных болезней (Чеснокова О.А., Фомин В.В.) различают: ◊ типичные формы:
-герпангина;
-эпидемическая миалгия;
-асептический серозный менингит;
-экзантема; ◊ атипичные формы:
-инаппарантная форма;
-малая болезнь («летний грипп»);
-катаральная (респираторная) форма;
-энцефалитическая форма;
-энцефаломиокардит новорожденных;
-полиомиелитподобная (спинальная) форма;
-эпидемический геморрагический конъюнктивит;
-увеит;
-нефрит;
-панкреатит.
Нередко встречаются сочетанные признаки различных клинических форм - смешанные формы энтеровирусных заболеваний.
Герпангину вызывают вирусы Коксаки А (серотипы 2, 3, 4,6,7и 10) и Коксаки В (серотип 3). Начало острое, с быстрого повышения температуры тела до 39,0-40,5 °С, при этом общее состояние больных может оставаться относительно удовлетворительным. Лихорадка длится
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
от 1 до 5 дней (обычно 2-3 дня). При осмотре ротоглотки выявляется гиперемия слизистой оболочки мягкого нёба, нёбных дужек, язычка, задней стенки глотки. В течение 24-48 ч на передней поверхности миндалин, нёбных дужек появляется от 5-6 до 20-30 мелких папул серовато-белого цвета диаметром 1-2 мм, которые могут встречаться группами или отдельно. Вскоре они превращаются в пузырьки, наполненные прозрачным содержимым. Через 12-24 ч (реже на 3-4-й день болезни), после их вскрытия, образуются эрозии диаметром до 2-3 мм, покрытые сероватым налетом, которые могут сливаться. Вокруг эрозий образуется венчик гиперемии. Боли в горле умеренные или отсутствуют, но могут усиливаться при образовании эрозий. Эрозии заживают в течение 4-6 дней без дефектов слизистой оболочки. Заболевание нередко рецидивирует. Иногда герпангина развивается на фоне серозного менингита.
Эпидемическую миалгию (плевродиния, болезнь Борнхольма) вызывают вирусы Коксаки В (типы 1-5), Коксаки А (серотип 9) и ECHO (серотипы 1, 6, 9).
Типично острое, внезапное начало с озноба и подъема температуры тела до 39-40 °С, появления общей слабости, тошноты, нередко рвоты, а также сильной головной боли, боли в грудных мышцах, эпигастральной и пупочной областях, спине, конечностях. Появление миалгий связано с развитием миозита. Боли усиливаются при движении, кашле, часто становятся мучительными и сопровождаются обильным потоотделением. Продолжительность болевых приступов составляет от 5-10 мин до нескольких часов (чаще 15-20 мин). В ряде случаев приступы сопровождаются рвотой и повторяются через 0,5-1 ч. Появление напряжения мышц брюшной стенки и их щажение при дыхании часто имитирует синдром острого живота, в связи с чем больных нередко направляют в хирургическое отделение. При болях в области грудной клетки в ряде случаев ошибочно диагностируют плеврит, пневмонию или приступ стенокардии. При возникновении болей отмечается двигательное беспокойство. В промежутках между приступами больные подавлены, апатичны, лежат спокойно и производят впечатление спящих. Лихорадка сохраняется 2-3 дня. Во время болевых приступов часто возникает тахикардия, но возможна и относительная брадикардия. Зев гиперемирован, на слизистой оболочке нёба нередко выявляют зернистость, характерен шейный лимфаденит.
У некоторых больных отмечают гепатоспленомегалию. Мышечные боли к 3-му дню болезни становятся менее интенсивными или исчезают, хотя иногда сохраняются и после нормализации температуры. Средняя продолжительность болезни составляет 3-7 дней. При волнообразном течении заболевания (2-3 обострения с интервалом в 2-4 дня) продолжительность болезни увеличивается до 1,5-2 нед.
Серозный менингит - одна из наиболее распространенных и тяжелых форм энтеровирусной инфекции. Вызывается нейротропными генотипами энтеровиру-сов: Коксаки А (серотипы 2, 4, 7, 9), Коксаки В (серотипы 1-5), ECHO (сероти-пы 4, 6, 9, 11, 16, 30). Регистрируется как в виде эпидемических вспышек, так и спорадических случаев. Редко наблюдается продромальный период длительностью 1-2 дня, при котором возникают слабость, раздражительность, сонливость.
Характерно острое начало болезни с симптомами общей интоксикации и повышением температуры тела до 38,0-39,0 °С, реже до более высоких цифр. Симптомы менингита возникают в первые дни болезни, иногда на 3-5-й день, сопровождаются повторным повышением температуры тела. Характерна общая гиперестезия (гиперакузия, фотофобия, гиперестезия кожи), интенсивная головная боль распирающего характера, рвота «фонтаном» без предшествующей тошноты, не приносящая облегчения. В более тяжелых случаях наблюдается психомоторное возбуждение и судороги. Глубокое расстройство сознания встречается крайне редко. Характерно наличие менингеальных симптомов, в ряде случаев - диссоциация менингеальных симптомов или неполный менингеальный синдром (например, наличие ригидности мышц затылка при отрицательном симптоме Кернига и наоборот). Лихорадка и менингеальные симптомы обычно сохраняются в течение 3-7 дней. В остром
периоде чаще отмечается относительная брадикардия, реже - тахикардия и абсолютная брадикардия. При развитии ОНГМ отмечают повышение АД. У больных отсутствует аппетит, язык обложен беловатым налетом и утолщен. Нередко возникает метеоризм, при пальпации живота обнаруживается урчание. Возможны катаральные явления. В периферической крови отмечают умеренный лейкоцитоз, нейтрофилез без сдвига влево, который впоследствии сменяется лим-фоцитозом. СМЖ бесцветная, прозрачная, при пункции вытекает с повышенным давлением (250-350 мм вод.ст.). Отмечается лимфоцитарный плеоцитоз (несколько десятков и сотен в 1 мм3). Однако в первые 1-2 дня болезни в СМЖ преобладают нейтрофилы (до 90%). В ряде случаев отмечается смешанный характер цитоза. Содержание белка в пределах нормы. Уровень глюкозы в пределах нормы или повышен. Возможно рецидивирующее течение менингита. При этом нарастание менингеальных симптомов сопровождается подъемом температуры тела.
Следует подчеркнуть, что в отдельных случаях, при наличии характерных менингеальных симптомов, СМЖ остается интактной, и наоборот, при отсутствии менингеальных симптомов в СМЖ выявляются воспалительные изменения. В обоих случаях диагноз ставится на основании обнаружения генетического материала энтеровирусов в СМЖ методом ПЦР.
Малую болезнь (Коксаки- и ЕСНО-лихорадку, трехдневную, или неопределенную, лихорадку; «летний грипп») могут вызывать все типы маловирулентных штаммов энтеровирусов. Клинически малая болезнь характеризуется кратковременной лихорадкой (не более 3 дней), слабостью, разбитостью, умеренной головной болью, рвотой, миалгией, болью в животе. Катаральные явления со стороны ВДП возникают менее чем у двух третей больных. Возможно двухволновое течение болезни.
Энтеровирусную экзантему (эпидемическую, или бостонскую, экзантему, а также кореподобную и краснухоподобную экзантемы) вызывают вирусы ECHO (типы 4, 5, 9, 12, 16, 18), реже - вирусы Коксаки (типы А-9, А-16, В-3). Относится к числу легких форм энтеровирусной инфекции. Регистрируют чаще в виде небольших вспышек, но описаны и крупные эпидемии. Болезнь развивается остро с подъемом температуры тела до 38-39 °С. Характерны общая слабость, выраженные головная и мышечные боли, боли в горле, шейный лимфаденит, экзантема на лице, туловище и конечностях. Сыпь краснухоподобная, реже макуло-папулезная, буллезная, петехиальная, сохраняется 2-4 дня. Отмечается пятнистая энантема на слизистой оболочке ротоглотки. В остром периоде нередко развивается фарингит, конъюнктивит. В ряде случаев болезнь сопровождается явлениями менингизма или сочетается с серозным менингитом. Лихорадка длится 1-8 дней
В ряде случаев энтеровирусная экзантема протекает только с поражением кистей, стоп, полости рта (в немецкой литературе - HFMK, сокращенно от
Hand-Fuss-Mundkrankheit). Заболевание вызывают вирусы Коксаки А (сероти-пы 5, 10, 16). При этой форме на фоне умеренной интоксикации и небольшого повышения температуры тела на пальцах кистей и стоп появляется везикулезная сыпь с элементами диаметром 2-3 мм, окруженными воспалительным венчиком. Одновременно на языке и слизистой оболочке щек, нёба обнаруживают единичные небольшие афты.
Катаральная (респираторная) форма - распространенная, малодифферен-цируемая форма энтеровирусной инфекции, которая вызывается многими типами энтеровирусов. Болеют как дети, так и взрослые. Развивается остро, в форме грип-поподобного заболевания с повышения температуры тела и симптомов интоксикации. Характерен ринит с серознослизистыми выделениями, сухой кашель, гиперемия и зернистость слизистой оболочки зева. Возможны проявления болезни в виде фарингита с регионарным лимфаденитом и кратковременной субфебрильной лихорадкой. У детей иногда развивается ложный круп, а течение заболевания в ряде случаев осложняется пневмонией и миокардитом. В
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
неосложненных случаях лихорадка сохраняется около 3 дней, катаральные явления - около недели.
Энтеровирусную диарею (вирусный гастроэнтерит, «рвотную болезнь») чаще вызывают вирусы ECHO. В основном болеют дети до 2 лет, реже - взрослые. Возможен короткий продромальный период, который проявляется общим недомоганием, слабостью, головной болью, отсутствием аппетита. Болезнь развивается остро с подъема температуры тела до 3839 °С, реже до субфебрильных цифр. Лихорадочный период продолжается в среднем около недели. Одновременно с повышением температуры тела отмечают жидкий стул без патологических примесей до 2-10 р/сут. Характерно вздутие живота, возможна болезненность при пальпации (более выраженная в илеоцекальной области). Аппетит отсутствует, язык обложен. В первые дни нередко отмечается многократная рвота, однако обезвоживания не наступает. Иногда отмечается гепатоспленомегалия. Часто наблюдаются признаки катарального воспаления ВДП.
Энцефаломиокардит новорожденных - наиболее тяжелый вариант энтеро-вирусной инфекции, вызываемый вирусами Коксаки В (типы 2-5) и возникающий в виде вспышек в родильных домах. Источником возбудителя инфекции могут быть роженицы (заражение реализуется через плаценту или в процессе родов) или медицинский персонал. На фоне подъема температуры отмечают нарушение аппетита, сонливость, рвоту, понос. Лихорадка имеет двухволновой характер (иногда отсутствует). Характерны цианоз или серый цвет кожи, тахикардия, одышка, расширение границ сердца, глухость тонов, нарушение сердечного ритма, появление шумов в сердце, увеличение размеров печени и селезенки, отеки, в редких случаях желтуха и геморрагическая сыпь. При поражении ЦНС возникают судороги, возможно развитие комы. При исследовании СМЖ выявляют лимфоцитарный плео-цитоз.
Паралитическую (спинальную, полиомиелитподобную) форму вызывают вирусы Коксаки А (типы 4, 7, 10, 14) и В (типы 1-6), а также вирусы ECHO (типы 2, 4, 6, 1, 9, 11, 16). Заболевание чаще регистрируют в теплое время года в виде спорадических случаев у детей 1-5 лет. Протекает преимущественно в виде легких паралитических форм. Тяжелые формы возникают редко. У трети больных отмечают препаралитический период, для которого характерны симптомы, свойственные другим формам энтеровирусной инфекции (малой болезни, респираторной, герпангине). Чаще парезы возникают остро, на фоне полного здоровья, при этом температура тела повышается незначительно или остается нормальной. Обычно поражаются нижние конечности и развивается так называемая утренняя хромота. Возникает нарушение походки в виде прихрамывания, при этом подгибается колено, свисает стопа, наблюдается ротация ноги кнаружи и снижение мышечного тонуса. Поверхностные и глубокие рефлексы не нарушаются; реже отмечают гипоили гиперрефлексию. При наличии лихорадки в СМЖ обнаруживают небольшое повышение
содержания белка, умеренный лимфоцитарный плеоцитоз. Парезы проходят относительно быстро, обычно с полным восстановлением двигательных функций, но в редких случаях в течение нескольких месяцев сохраняются гипотония и гипотрофия пораженных мышц. При тяжелом течении бульбарных, бульбо-спинальных форм инфекции описаны случаи смертельного исхода.
К редким формам энтеровирусных инфекций относят энцефалит, менингоэнце-фалит, миокардит, перикардит, эпидемический геморрагический конъюнктивит, увеит, нефрит, панкреатит, гепатит.
Энцефалиты и менингоэнцефалиты вызываются различными типами энте-ровирусов Коксаки и ECHO. Характерно острое начало, сильная головная боль, рвота и лихорадка, которая может иметь двухволновой характер. В тяжелых случаях отмечают нарушение сознания, возможны судороги, очаговая неврологическая симптоматика (нистагм, параличи черепных нервов и т.д.).
Перикардиты и миокардиты вызываются вирусами Коксаки В (типы 2-5), реже вирусами ECHO (типы 1, 6, 8, 9, 19). Чаще поражение сердца развивается у детей старшего возраста и взрослых после перенесенной респираторной формы энтеровирусной инфекции (через 1,5-2 нед), реже - изолированно. При этом на фоне умеренной лихорадки нарастает общая слабость, появляются боли в области сердца. При осмотре выявляют расширение границ сердца, глухость тонов, шум трения перикарда. Течение заболевания чаще доброкачественное, прогноз благоприятный, но возможны тяжелые миокардиты с нарушением биоэлектрической и сократительной функции миокарда, явлениями сердечной недостаточности и формированием дилатационной кардиомиопатии.
Эпидемический геморрагический конъюнктивит чаще вызывается энтеро-вирусом типа 70, реже другими энтеровирусами. Заболевание начинается остро с поражения одного глаза. В ряде случаев через 1-2 дня поражается и другой глаз. Характерны ощущение инородного тела, «песка» в глазах, слезотечение и фотофобия. При осмотре выявляются отек век, кровоизлияния в гиперемированную конъюнктиву и скудное слизисто-гнойное или серозное отделяемое. Болезнь чаще протекает доброкачественно, выздоровление наступает через 1,5-2 нед.
Осложнения
При эпидемической миалгии, серозном менингите, энцефалите и менингоэн-цефалите в ряде случаев развивается ОНГМ. При бульбарных нарушениях возможны тяжелые аспирационные пневмонии. В ряде случаев респираторная форма осложняется вторичной бактериальной пневмонией, крупом. В 8-10% случаев эпидемический геморрагический кератоконъюнктивит и увеит приводят к развитию катаракты и двусторонней слепоты.
ДИАГНОСТИКА
Диагноз энтеровирусной инфекции при возникновении эпидемической вспышки и типичных клинических проявлений обычно не вызывает затруднений, но требует лабораторного подтверждения. Нередко сложна диагностика атипичных и легких форм болезни.
Окончательно устанавливают диагноз при помощи серологических исследований и выделения вируса из носоглоточной слизи, цереброспинальной жидкости, фекалий, крови. Высокой эффективностью отличается метод ПЦР. Для серологического исследования в РН, РСК, РТГА и реакции преципитации в геле используют парные сыворотки, полученные с интервалом в 10-12 дней (первая - на 4-5-й день болезни, вторая - после 14-го дня болезни). Диагностический критерий - нарастание титра антител в 4 раза и более. Обнаружение вируса в испражнениях при отсутствии нарастания титра антител в динамике болезни не служит основани-
ем для постановки диагноза энтеровирусной инфекции, так как часто наблюдают бессимптомное носительство.
Дифференциальная диагностика
Дифференциальную диагностику необходимо проводить с большим количеством болезней ввиду многочисленности клинических форм энтеровирусных инфекций.
Серозный менингит и менингоэнцефалитическую форму энтеровирусной инфекции дифференцируют с серозными менингитами и менингоэнцефалитами другой этиологии. При этом учитывают как эпидемиологические, так и клинические особенности энтеровирусных менингитов: характерную летнюю сезонность, часто групповой характер заболевания, доброкачественность течения с быстрым регрессом менингеального синдрома. При паротитном менингите в большинстве случаев отмечают поражение железистых органов (воспаление слюнных, поджелудочной и половых желез), в сыворотке крови отмечают значительное повышение уровня амилазы и липазы. При нейтрофильном плеоцитозе
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
проводят дифференциальную диагностику с БГМ, для которых характерны резко выраженная интоксикация, менингеальный синдром, 4-5-значный плеоцитоз СМЖ, снижение в ней уровня глюкозы и повышение содержания лактата. Для туберкулезного менингита и менингоэнцефалита характерны постепенное развитие и прогрессирующая неврологическая симптоматика. В течение 1-2 нед нарастают слабость, депрессия, подъем температуры тела до 38-39 °С, головная боль, вегетативно-сосудистые расстройства (стойкий красный дермографизм, пятна Труссо). Проводят исследования для выявления туберкулезного процесса иной локализации. В СМЖ выявляют прогрессирующее снижение содержания глюкозы, уровня хлоридов в 1,5-2 раза, появление при отстаивании в пробирке фибриновой пленки.
В ряде случаев при эпидемической миалгии необходимо проводить дифференциальную диагностику с острыми хирургическими заболеваниями: острым аппендицитом, холециститом, кишечной непроходимостью, а также исключать развитие плеврита или приступа стенокардии.
Для полиомиелита (в отличие от полиомиелитподобной формы энтеровирус-ной инфекции) характерно острое начало с быстрым подъемом температуры, выраженными катаральными (ринит, тонзиллит, трахеит, бронхит) и диспепсическими явлениями, а также отсутствие полного регресса парезов и параличей.
Наличие экзантемы при энтеровирусной инфекции требует дифференциальной диагностики с такими заболеваниями, как скарлатина, корь, краснуха, парвовирус-ная инфекция. При этом надо обращать внимание на характерные для этих заболеваний продромальный период, этапность высыпаний, характер и локализацию экзантемы и другие клинические признаки, а также данные эпидемиологического анамнеза. Необходимо также исключить у пациента аллергическую сыпь.
Герпангину дифференцируют с афтозным стоматитом.
При энтеровирусной диарее дифференциальную диагностику проводят с другими острыми диарейными инфекциями, в частности с рото-, норо- и аденовирусной инфекциями. Во всех случаях необходима лабораторная верификация соответствующей инфекции.
Показания к дополнительным методам диагностики и консультациям специалистов При необходимости прибегают к инструментальным методам диагностики:
1)КТ и МРТ головного мозга;
2)эхокардиографии;
3)ЭНМГ;
4)рентгенографии органов грудной клетки;
5)ЭКГ.
Показания к консультации других специалистов определяет форма инфекции: ◊ при эпидемической миалгии - консультация хирурга;
◊при менингите и менингоэнцефалитической форме энтеровирусной инфекции - консультация невролога;
◊при эпидемическом геморрагическом конъюнктивите - консультация офтальмолога;
◊при перикардитах и миокардитах - консультация кардиолога.
ЛЕЧЕНИЕ
Госпитализация проводится по клиническим показаниям. Этиотропные средства отсутствуют. Проводят дезинтоксикационную терапию. При менингитах и
менингоэнцефалитах назначают дегидратационную терапию с использованием петлевых диуретиков (фуросемид, ацетазоламид), при тяжелом течении используют дексаметазон по 0,25 мг/кг/сут в течение 2-4 сут. Рекомендуют назначение человеческого лейкоцитарного ИФН, рибонуклеазы, однако данные об их эффективности, полученные методами доказательной медицины, отсутствуют.
С целью улучшения реологических свойств крови и сосудистого тонуса используют пентоксифиллин, Солкосерил♠, винпоцетин. Показаны десенсибилизирующие
препараты. При эпидемической миалгии для купирования болевого синдрома применяют НПВС. Лечение больных с полиомиелитподобными формами проводят так же как больных полиомиелитом, а больным энтеровирусным миокардитом назначают кардиопротекторы.
Πрогноз
У подавляющего большинства больных при поражениях кожи и слизистых оболочек прогноз благоприятный. Заболевание заканчивается полным выздоровлением. Тяжелое течение с летальным исходом возможно при энцефаломиокардите новорожденных, энцефалитах и менингоэнцефалитах, паралитической форме энтеровирусной инфекции. После перенесенного энцефалита в ряде случаев возникают гемиили монопарезы; после полиомиелитной формы болезни - снижение мышечного тонуса и гипотрофия конечности; при поражениях органа зрения - катаракта и двусторонняя слепота.
Примерные сроки нетрудоспособности
Сроки потери трудоспособности зависят от клинической формы инфекции. Стационарное лечение при серозных менингитах продолжается до 3 нед. Больных выписывают после полного клинического выздоровления и санации СМЖ.
Диспансерное наблюдение
Диспансерное наблюдение за лицами, перенесшими энтеровирусную инфекцию, не регламентировано. Сроки наблюдения за больными определяют индивидуально. При поражениях сердечно-сосудистой системы и ЦНС необходимо диспансерное наблюдение не менее 6 мес.
Πамятка для пациента
Рекомендации даются индивидуально, отражаются в выписке и обычно включают: сбалансированное питание, предотвращение переохлаждения, инсоляции и других стрессовых состояний, ограничение физической нагрузки. После перенесенного менингита, менингоэнцефалита - в течение года исключение полетов на самолете, пребывания в горной местности, подводного плавания (дайвинга), вакцинации (за исключением экстренной, как, например, против бешенства), инсоляции. Целесообразно на этот срок ограничить потребление соли.
Санаторно-курортное лечение
Через 3-6 мес после острого периода возможно санаторно-курортное лечение в санаториях, в зависимости от формы перенесенной инфекции, неврологического, кардиологического или общего профиля.
21.9. ПОЛИОМИЕЛИТ
21.9. ПОЛИОМИЕЛИТ Синонимы. Эпидемический детский паралич, болезнь Гейне-Медина.
Полиомиелит [от греч. polio (серый), myelos (мозг)] - острая вирусная антро-понозная инфекционная болезнь с фекально-оральным механизмом передачи возбудителя,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
характеризующаяся преимущественным поражением двигательных нейронов спинного и головного мозга с развитием параличей.
КОДЫ ПО МКБ-10
А80 Острый полиомиелит. А80.0 Острый паралитический полиомиелит, ассоциированный с вакциной. А80.1 Острый паралитический полиомиелит, вызванный диким завезенным вирусом.
А80.2 Острый паралитический полиомиелит, вызванный диким природным вирусом.
А80.3 Острый паралитический полиомиелит другой и неуточненный. А80.4 Острый непаралитический полиомиелит. А80.9 Острый полиомиелит неуточненный. ЭТИОЛОГИЯ
Возбудитель - РНК-содержащий полиовирус
семейства Picornaviridae рода Enterovirus размером 15-30 нм. Известно 3 серотипа вируса: I - Брунгильда (выделен от больной обезьяны с такой кличкой), II - Лансинг (выделен в местеч-
ке Лансинг) и III - Леон (выделен от больного мальчика МакЛеона). Все типы близки по своему строению и отличаются последовательностью нуклеотидов. Выделено два типоспецифических антигена полиовирусов: N (нативный), который находится в интактных вирионах, содержащих РНК, и H (гретый), который выделяется из капсидов, не содержащих РНК. Н-антиген инициирует у человека первичную реакцию антителообразования, сменяющуюся в дальнейшем реакцией на N-антиген. Репродукция вируса происходит в цитоплазме пораженных клеток.
Вирус устойчив в окружающей среде. Длительно сохраняется при низкой температуре (в замороженном состоянии - до нескольких лет); несколько месяцев - в фекалиях, сточных водах, молоке и на овощах. Устойчив к колебаниям рН, малочувствителен к спирту, хорошо сохраняется в 50% глицерине. Вирус полиомиелита быстро инактивируется хлорсодержащими веществами (3-5% хлорамином), 15% серной и 4% хлористоводородной кислотами, растворами йода, калия перманга-ната, медным купоросом, сулемой и под действием ультрафиолетовых лучей. При кипячении погибает мгновенно.
ЭПИДЕМИОЛОГИЯ
Источник и резервуар возбудителя - человек (больной или вирусоноситель). Вирус выделяется с носоглоточной слизью в течение инкубационного периода и до 5-го дня после начала болезни, с фекалиями - от нескольких недель до 3-4 мес. Больной наиболее заразен в остром периоде болезни.
Основной механизм передачи вируса - фекально-оральный, который реализуется водным, пищевым и контактно-бытовым путями. Воздушно-капельный путь заражения возможен в первые дни болезни и начальном периоде вирусоно-сительства. В тропических странах случаи заболевания регистрируются в течение всего года, в странах с умеренным климатом отмечается летне-осенняя сезонность. Наиболее подвержены заражению дети до 3 лет, но могут заболеть и взрослые. При инфицировании чаще всего развивается бессимптомная инфекция или абортивная форма болезни, и лишь в одном из 200 случаев - типичные паралитические формы полиомиелита, при этом от 5 до 10% погибают от ОДН вследствие паралича дыхательной мускулатуры.
После перенесенной инфекции вырабатывается стойкий типоспецифический иммунитет. Пассивный иммунитет, полученный от матери, сохраняется в течение первого полугодия жизни.
До начала вакцинации, в начале 50-х гг. ХХ в., полиомиелит регистрировался более чем в ста странах мира. Благодаря глобальной кампании по эрадикации полиомиелита с помощью
массовой вакцинации инактивированной вакциной Солка и живой вакциной Сэбина, которая проводится ВОЗ с 1988 г., появилась возможность полного избавления от этой болезни. Согласно статистике ВОЗ, с 1988 г. число случаев полиомиелита упало с 350 тыс. до нескольких сотен в год (так, в 2014 г. было зарегистрировано 359 случаев заболевания). За этот период список стран, в которых регистрировались случаи заболевания, сократился со 125 до 2 (Афганистан и Пакистан, в которых было зарегистрировано в 2015 г. 74 случая полиомиелита вызванного диким полиовирусом 1-го типа). Из 3 штаммов дикого полиовируса (тип 1, тип 2 и тип 3) один - дикий полиовирус 2-го типа был ликвидирован (последний дикий полиовирус типа 2 был зарегистрирован в Индии в 1999 г.). Резко сократилось и число заболеваний, вызванных полиовирусом третьего типа - с ноября 2012 г. в Нигерии, где он вызывал полиомиелит, не было зарегистрировано новых случаев заболевания. В России последние случаи заболевания полиомиелитом были зарегистрированы в 1996 г. в Чеченской Республике, что связано с отсутствием вакцинации населения в этом регионе с 1992 г. В 2002 г. ВОЗ объявила Россию территорией, свободной от полиомиелита. Однако в связи с использованием живой оральной вакцины наблюдается широкая циркуляция
вакцинных штаммов полиовируса, которые в неиммунном коллективе могут восстановить свою вирулентность и вызывать паралитический полиомиелит.
Внастоящее время более 80% населения планеты живет в сертифицированных на отсутствие полиомиелита регионах. Так, в 1994 г. ВОЗ сертифицировала Американский регион ВОЗ как свободный от полиомиелита, в 2000 г. - регион ВОЗ стран Западной части Тихого океана, в июне 2002 г. - Европейский регион ВОЗ, а в 2014 г. - регион стран Юго-Восточной Азии.
Вто же время стоит учитывать, что до тех пор, пока в мире остается хоть один инфицированный, риску заражения полиомиелитом подвергаются дети во всех странах. ВОЗ отмечает: сохранение полиомиелита в остающихся устойчивых очагах может привести к тому, что через 10 лет в мире при отсутствии специфической профилактики будет ежегодно происходить до 200 тыс. новых случаев заболевания.
Всвязи с этим в апреле 2013 г. на Глобальном саммите по вакцинам в Абу-Даби был представлен новый Стратегический план ликвидации полиомиелита и осуществления завершающего этапа в 2013-2018 гг. - план по одновременной ликвидации всех типов болезни, вызванных как диким полиовирусом, так и полиови-русами вакцинного происхождения.
МЕРЫ ПРОФИЛАКТИКИ
Специфическую профилактику проводят поливалентной (приготовленной из трех типов аттенуированного вируса) оральной живой вакциной (живой вакциной Сэбина) согласно календарю прививок с 3-месячного возраста троекратно с интервалом 45 дней. Ревакцинация - в 18, 20 мес и 14 лет. Оральная живая вакцина - одна из самых малореактогенных вакцин. Она проста в употреблении, формирует местный специфический иммунитет слизистой оболочки ЖКТ. Живая вакцина Сэбина противопоказана при лихорадочных состояниях и первичном иммунодефиците. Ввиду ликвидации дикого полиовируса 2-го типа разработана и используется двухвалентная оральная полиовакцина (впервые в Афганистане в 2009 г.). Она, по оценкам специалистов, даже несколько эффективнее старой трехвалентной оральной полиовакцины защищает от полиовирусов типов 1 и 3 и не содержит живой полиовирус типа 2, вызвавший большинство вспышек циркулирующего полиовируса вакцинного происхождения. С учетом рекомендаций ВОЗ в России был разработан и реализован «Национальный план по переходу с трехвалентной оральной полиомиелитной вакцины (тОПВ) на бивалентную оральную полиомиелитную вакцину (бОПВ) в связи с глобальным изъятием из обращения трехвалентной оральной полиомиелитной вакцины». Датой перехода на бОПВ стало 26.04.2016 г.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Лицам с иммунодефицитом целесообразно применять инактивированную вакцину для профилактики полиомиелита (Имовакс Полио♠) и в составе вакцины для профилактики дифтерии, коклюша, полиомиелиа, столбняка (Тетракок 05♠¤).
Обязательна ранняя изоляция больных полиомиелитом на 40 дней от начала заболевания. В очаге проводят заключительную дезинфекцию и расширенное эпидемиологическое обследование. За контактными лицами наблюдают 21 день.
В детских учреждениях на тот же срок вводится карантин. Обязательна немедленная вакцинация детей младше 7 лет, привитых с нарушением графика, и всех выявленных непривитых независимо от возраста.
ПАТОГЕНЕЗ И ПАТОМОРФОЛОГИЯ
Полиовирусы попадают в организм человека через слизистую оболочку ЖКТ и носоглотки, в которых происходит первичная репликация вируса. При отсутствии диссеминации возбудителя инфекционный процесс протекает по типу носитель-ства. Если происходит гематогенное и лимфогенное распространение возбуди-
теля, но вирус не проникает в ЦНС, развиваются абортивные формы болезни. При преодолении вирусом ГЭБ развивается менингеальная или паралитическая форма болезни. Полиовирусы обладают высокой тропностью к серому веществу головного и спинного мозга. Наиболее часто поражаются крупные двигательные нейроны передних рогов спинного мозга, реже - двигательные ядра черепных нервов, ствола мозга и др. Поражения сопровождаются воспалительной реакцией и дистрофическими изменениями, приводящими к гибели нейронов и развитию парезов и параличей по периферическому типу (атония, арефлексия, атрофия или гипотония, гипотрофия, гипорефлексия). Сохранение части нейронов и восстановление функции поврежденных нейронов определяет возможность последующего частичного или полного восстановления функций мышц. Смерть больных наступает в результате паралича дыхательных мышц или дыхательного центра головного мозга, бульбарных нарушений, а также присоединения вторичной аспи-рационной пневмонии. КЛИНИЧЕСКАЯ КАРТИНА
Инаппарантная форма, развивающаяся почти в 90% случаев, представляет собой здоровое вирусоносительство, при котором вирус не выходит за пределы лимфоглоточного кольца и кишечника. О перенесенной инфекции судят по результатам вирусологического и серологического исследований.
Различают следующие клинические формы полиомиелита: абортивную (без поражения ЦНС), менингеальную и паралитическую (наиболее типичную).
В зависимости от локализации процесса выделяют: спинальный, бульбарный, контактный, энцефалитический и смешанный (сочетанный) варианты паралитической формы.
Инкубационный период продолжается от 3 до 35 дней, чаще - 7-12 дней.
Для абортивной (катаральной) формы болезни (так называемая «малая болезнь») характерно острое начало: кратковременное повышение температуры тела, умеренная интоксикация, головная боль, легкое катаральное воспаление ВДП, боли в животе, иногда сопровождающиеся рвотой и жидким стулом без патологических примесей. Протекает доброкачественно и завершается выздоровлением через 3-7 дней. Диагноз ставят на основании эпидемиологических и лабораторных данных.
При менингеальной форме болезнь начинается остро с подъема температуры тела до 39-40 °С с выраженной головной боли, рвоты, боли в спине, шее, конечностях. Менингеальные симптомы выражены умеренно, но могут и отсутствовать, несмотря на воспалительные изменения СМЖ. Типичны наличие симптомов натяжения нервных стволов (Нери, Ласега,
Вассермана) и болезненность при пальпации по ходу нервных стволов. Часто выявляется горизонтальный нистагм. Возможно двухволновое течение болезни. Первая волна протекает как абортивная форма болезни, а затем после ремиссии, длящейся от одного до пяти дней, развивается картина серозного менингита. При люмбальной пункции прозрачная СМЖ вытекает под повышенным давлением. Иногда воспалительные изменения в СМЖ могут появляться на 2-3 дня позже возникновения менингеального синдрома. Течение болезни доброкачественное: к началу 2-й недели болезни нормализуется температура, регрессирует менингеальный синдром, а к 3-й неделе происходит нормализация состава СМЖ. Спинальная (паралитическая) форма болезни наблюдается менее чем у одного на 1000 инфицированных. Развитие паралитических форм болезни могут провоцировать иммунодефициты, недостаточное питание, беременность, тонзил-лэктомия, подкожные и внутривенные инъекции, высокая физическая активность в ранней стадии болезни. В клинической картине выделяют четыре периода: пре-
паралитический, паралитический, восстановительный, резидуальный (период остаточных явлений).
Препаралитический период длится 3-6 дней. Болезнь начинается остро, с общей интоксикации, лихорадки (иногда - двухволновой). В первые дни болезни отмечаются катаральные симптомы: ринит, трахеит, тонзиллит, бронхит. Возможна диарея, чаще встречающаяся у детей младшего возраста. На 2-3-й день присоединяются симптомы поражения ЦНС. При двухволновой температурной кривой неврологические симптомы появляются на второй волне после 1-2-дневной апи-рексии. Появляется головная боль, боли в конечностях и спине по ходу нервных стволов, рвота центрального генеза, гиперестезия, менингеальные симптомы, а также симптомы натяжения нервных стволов и корешков спинномозговых нервов. Больные вялы, сонливы, капризны. Изменения вегетативной нервной системы проявляются выраженной потливостью. Возможны фибрилляции мышц, задержка мочеиспускания. К концу первого периода общее состояние улучшается, уменьшается интоксикация, снижается температура, но усиливается болевой синдром, и болезнь переходит в паралитический период. Параличи возникают на 2-6-й день болезни, реже (при отсутствии препаралитического периода) - в первый день («утренний паралич»). Типично бурное развитие вялых асимметричных парезов и параличей мышц туловища и конечностей, нарушение функции тазовых органов в течение короткого времени - от нескольких часов до 1-3 дней. Характерны мышечный гипотонус, гипоили арефлексия, проксимальная локализация поражений и их мозаичность (в связи с гибелью части нервных клеток передних рогов спинного мозга при сохранности других). Клинические проявления зависят от локализации поражения нервной системы. Чаще поражается поясничный отдел спинного мозга с развитием парезов и параличей мышц тазового пояса и нижних конечностей. При грудной локализации процесса параличи, распространяясь на межреберные мышцы и диафрагму, вызывают дыхательные расстройства. Поражение шейного и грудного отделов спинного мозга проявляется параличами и парезами мышц шеи и рук. В зависимости от количества пораженных сегментов спинного мозга спинальная форма может быть ограниченной (монопарез) или распространенной. Изолированное поражение отдельных мышц при сохранении функций других приводит к нарушению взаимодействия между ними, развитию контрактур, деформаций суставов. Паралитический период длится от нескольких дней до 2 нед, после чего начинается восстановительный период. Наиболее заметное восстановление нарушенных функций происходит в первые 3-6 мес. В дальнейшем темп замедляется, но восстановление продолжается до года, иногда до двух лет. В первую очередь восстанавливаются движения в наименее пораженных мышцах, в основном за счет сохранившихся нейронов, в дальнейшем восстановление происходит в результате компенсаторной гипертрофии мышечных волокон, сохранивших иннервацию. При отсутствии положительной динамики в течение полугода оставшиеся параличи и парезы рассматриваются как резидуальные. Резидуальный период характеризуется атрофией мышц,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
развитием контрактур суставов, остеопорозом, деформацией костей, у детей - отставанием пораженных конечностей в росте, при поражении длинных мышц спины - искривлением позвоночника, при поражении мышц брюшного пресса - деформацией живота. Чаще остаточные явления наблюдаются в нижних конечностях.
Для бульбарной формы характерна высокая лихорадка, выраженная интоксикация, рвота, тяжелое состояние больных. Препаралитический период короткий или отсутствует. Эта форма болезни сопровождается поражением ядер двигательных черепных нервов с вовлечением в процесс жизненно важных центров, контролирующих дыхание, кровообращение, терморегуляцию. Поражение ядер IX и X пар черепных нервов приводит к гиперсекреции слизи, расстройствам глотания, фонации и, как следствие, - к обструкции дыхательных путей, нарушению вен-
тиляции легких, гипоксии, развитию аспирационной пневмонии. При поражении дыхательного и сосудодвигательного центров нарушается нормальный ритм дыхания (паузы и патологические ритмы), отмечается нарастающий цианоз, нарушение ритма сердечной деятельности (тахиили брадиаритмия), а также повышение и последующее падение АД. Наблюдается психомоторное возбуждение, спутанность сознания, а затем - сопор и кома. При стволовых формах с поражением ядер III, VI и VII пар черепных нервов выявляются глазодвигательные нарушения и асимметрия лица вследствие пареза мимических мышц. Нередко бульбарная форма заканчивается летальным исходом. Если смерть не наступает, то в ближайшие 2-3 дня происходит стабилизация процесса, а со 2-3-й недели болезни состояние больных улучшается и наступает полное восстановление утраченных функций.
При изолированном поражении ядра лицевого нерва, находящегося в области варолиева моста мозга, развивается менее тяжелая понтинная форма. Препаралитический период, лихорадка, общая интоксикация, менингеальные симптомы часто могут отсутствовать. При осмотре больного выявляют парез или паралич мимической мускулатуры половины лица, несмыкание глазной щели (лагофтальм), опущение угла рта. Течение доброкачественное, но возможно стойкое сохранение пареза лицевого нерва.
Ряд авторов описывают энцефалитическую форму болезни, при которой преобладает общемозговая симптоматика и рассеянные симптомы выпадения. При поражениях различных отделов мозга выделяют также смешанные (сочетанные) формы болезни - бульбоспинальную и понтоспинальную.
Осложнения
При тяжелом течении болезни с поражением диафрагмы, вспомогательных дыхательных мышц, дыхательного центра, IX, X, XII пар черепных нервов наблюдаются пневмонии, ателектазы и деструктивные поражения легких, часто приводящие к летальному исходу.
ДИАГНОСТИКА
Предварительный диагноз устанавливается на основании характерной клинической картины (острое начало болезни с лихорадкой, развитием менингорадику-лярного синдрома, периферических парезов, параличей с гипотонией, гипоили арефлексией, гипоили атрофией без нарушения чувствительности) и эпидемиологических данных: контакт с больными или недавно привитыми. Учитывается также связь с прививкой, отсутствие или неполная вакцинация. Подтверждают диагноз нарастанием титра вируснейтрализующих антител в 4 раза и более в РСК или РН в парных сыворотках, взятых с интервалом 14-21 день. Используют также вирусологические исследования. Вирус можно выделить из испражнений, реже - из носоглоточной слизи, СМЖ. Выделение вируса при отсутствии клинических проявлений заболевания не является основанием для постановки диагноза полиомиелита, особенно в районах, где постоянно проводится вакцинация. Для определения принадлежности выделенного вируса к вакцинному или «дикому» штамму применяют ПЦР.
При исследовании СМЖ обнаруживается лимфоцитарный плеоцитоз в несколько десятковсотен клеток в 1 мкл (в первые дни болезни он может быть нейтро-фильным). В острой стадии заболевания концентрации белка и глюкозы обычно находятся в пределах нормы. Для паралитической формы полиомиелита характерна смена клеточно-белковой диссоциации в начале болезни на белково-клеточную (снижение плеоцитоза, нарастание концентрации белка) через 1-2 нед.
Изменения в периферической крови не характерны. Иногда отмечается умеренный лейкоцитоз.
Дифференциальная диагностика
Дифференциальная диагностика полиомиелита определяется его клинической формой (табл. 21.19).
Абортивная форма болезни клинически неотличима от многих ОРВИ или диарей, вызываемых энтеровирусами группы Коксаки-ЕСНО, ротавирусами и другими вирусными агентами.
При менингеальной форме проводят дифференциальную диагностику с другими серозными менингитами (энтеровирусным, паротитным, туберкулезным), а в ранние сроки болезни при нейтрофильном плеоцитозе в СМЖ необходимо исключать и БГМ. Для менингеальной формы полиомиелита характерна выраженность болевого синдрома, наличие симптомов натяжения нервных стволов и корешков спинномозговых нервов, болезненности нервных стволов при пальпации, однако окончательный диагноз возможен только с использованием лабораторных методов.
Спинальная форма паралитического полиомиелита дифференцируется с болезнями опорнодвигательного аппарата, для которых характерна не паретическая, а щадящая походка, боль при пассивных движениях в суставах, сохранность мышечного тонуса, а также сохранение или повышение глубоких рефлексов. СМЖ при исследовании нормальная, а в крови отмечаются воспалительные изменения. Спинальную форму болезни необходимо также дифференцировать с миелитом, полиомиелитической формой клещевого энцефалита, дифтерийной полинейропа-тией, полирадикулоневритом, спинальной амиотрофией Верднига-Гоффманна.
Параличи при миелите имеют центральный характер: высокий мышечный тонус, оживленные рефлексы, наличие пирамидных знаков, нарушений чувствительности, функций тазовых органов, трофических расстройств с образованием пролежней.
При полиомиелитической форме клещевого энцефалита, в отличие от полиомиелита, патологический процесс локализуется преимущественно в шейных сегментах и проявляется вялыми парезами и параличами мышц шеи и плечевого пояса. Нет мозаичности поражения. В СМЖ - незначительный лимфоцитарный плеоцитоз (40-60 клеток) и повышенный уровень белка (до 0,66-1,0 г/л). При постановке диагноза учитывается эпидемиологический анамнез. Для дифтерийной полинейропатии характерна связь с перенесенной дифтерией за 1,5-2 мес до поражения ПНС, симметричность поражений, постепенное нарастание парезов в течение нескольких недель, выявление при ЭНМГ нарушений биоэлектрической активности преимущественно по демиелинизирующему либо аксонально-демиелинизирующему типу.
При полирадикулоневрите отмечается медленное (иногда волнообразное) развитие и нарастание симметричных парезов с преимущественным поражением дистальных отделов конечностей, расстройством чувствительности по полинев-ритическому и корешковому типам, повышением содержания белка в СМЖ при нормальном цитозе.
Спинальная амиотрофия Верднига-Гоффманна - наследственное заболевание, для которого характерно поражение мотонейронов спинного мозга. Первые симптомы болезни появляются
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
в возрасте до 1,5 лет. Параличи развиваются постепенно и симметрично: вначале ног, затем рук, мышц туловища, шеи. Глубокие рефлексы исчезают, болевой синдром отсутствует. При хорошо выраженном подкожном жировом слое часто трудно выявить мышечные атрофии.
СМЖ не изменена. Смерть наступает в возрасте 4-5 лет вследствие бульбарных нарушений и паралича дыхательной мускулатуры.
При понтинной форме болезни дифференциальную диагностику проводят с невритом лицевого нерва, для которого не характерна общая инфекционная симптоматика и наблюдается хотя бы один из следующих симптомов: слезотечение на
стороне поражения, снижение вкусовой чувствительности на сладкое и соленое на передних 2/3 языка с больной стороны, болезненность тригеминальных точек при пальпации, спонтанные боли и нарушение чувствительности на лице.
Бульбарную форму дифференцируют со стволовыми энцефалитами, при которых доминируют глубокие расстройства сознания и судорожный синдром.
В отличие от полиомиелита, поражение двигательных черепных нервов при полирадикулоневрите обычно носит двусторонний симметричный характер: диплегия лицевых мышц, двустороннее поражение глазодвигательного нерва.
Поражения нервной системы, клинически неотличимые от полиомиелита, могут вызывать энтеровирусы группы Коксаки-ЕСНО, реже другие вирусные агенты.
В этих случаях необходимо использовать весь комплекс вирусологических, серологических методов диагностики, а также ПЦР.

Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Показания к дополнительным методам диагностики и консультациям специалистов
При поражении нервной системы (менингеальная, паралитическая, бульбарная формы болезни) необходима консультация невролога и обследование методами клинической нейрофизиологии. Для выявления уровня и тяжести поражения двигательных нейронов используют ЭНМГ. В паралитическом периоде полиомиелита обнаруживается изменение биоэлектрической активности, характерное для переднерогового поражения: в парализованных мышцах при рано развившейся атрофии на электромиограмме определяется полное отсутствие биоэлектрической активности. При снятии электромиограммы с менее пораженных мышц отмечаются четкие редкие колебания потенциала («ритм частокола»).
ЛЕЧЕНИЕ
Больные полиомиелитом и с подозрением на него подлежат экстренной изоляции в специализированные отделения или боксы. Специфических противовирусных средств нет. В препаралитическом и паралитическом периодах обязателен абсолютный покой, так как любая физическая нагрузка ускоряет развитие и усиливает тяжесть параличей. Вводят ИФН-α2, нормальный человеческий иммуноглобулин, рибонуклеазу. Проводится дезинтоксикационная и дегидратаци-онная терапия. Назначаются витамины группы В и болеутоляющие средства, метамизол натрия. При параличах применяют горячие укутывания, припарки. В
течение 30 дней назначают бендазол (Дибазол♠) из расчета 1 мг/кг (оказывает положительное влияние на функцию спинного мозга) и аскорбиновую кислоту по 0,5-1,0 г/кг (приостанавливает развитие параличей). При дыхательных расстройствах проводят ИВЛ, санацию ротоглотки и дыхательных путей. При расстройствах глотания - зондовое кормление. В обязательном порядке проводится ортопедическая коррекция: необходим ортопедический режим, обеспечивающий физиологическое положение конечности (вплоть до использования гипсовых лонгет). Применяют антихолинэстеразные препараты [неостигмина метилсульфат (Прозерин♠), оксазиρ, галантамин] курсами по 10-20 дней, при необходимости чередуя курсы.
В восстановительном периоде назначают анаболические гормоны [нандролон (Ретаболил♠), метандиенон (Метандростенолон♠)], витамины группы В (B1, В6 и В12), никотиновую кислоту, кокарбоксилазу, ноотропные средства. Надо отметить, что эффективность рекомендуемой медикаментозной терапии не оценена методами доказательной терапии.
Для улучшения функции мышц используют препараты фосфора, калия и физиотерапевтические методы (ультравысокочастотная терапия, электрофорез кальция хлорида, калия йодида, брома, аппликации парафина, диатермия). Физиотерапевтическое лечение проводится курсами продолжительностью 1-1,5 мес. Назначение массажа и ЛФК возможно после нормализации температуры тела и исчезновения симптомов общей интоксикации и болей. Правильное применение адекватных физических упражнений в начале и в течение раннего восстановительного периода во многом определяет дальнейший эффект лечения и способствует предупреждению поздних осложнений (контрактур, атрофии, нарушений двигательного стереотипа и т.д.).
В резидуальном периоде для лечения остаточных явлений проводится ортопедическая и хирургическая коррекция.
Прогноз
Прогноз благоприятный при инаппарантной и абортивной формах полиомиелита. Тяжелое течение с летальными исходами при менингеальной форме возможно, но чрезвычайно редко; последующих осложнений, как правило, не бывает.
Исход паралитической формы полиомиелита зависит от тяжести и уровня поражения ЦНС. При своевременном и правильном лечении восстановление функций без последствий происходит в трети случаев. Приблизительно в 30% случаев полиомиелит заканчивается стойкими остаточными параличами с атрофией мышц, приводящими к инвалидизации, в 30% - более легкими парезами. Около 10% случаев (при поражении дыхательной системы) заканчиваются смертью больных. При тяжелом бульбарном параличе летальность достигает 60% (смерть может наступить уже через несколько дней от паралича дыхательного центра). Примерные сроки нетрудоспособности
Сроки потери трудоспособности зависят от клинической формы инфекции. Стационарное лечение при менингеальной форме продолжается до 3-4 нед, при паралитической - до нескольких месяцев. Выписка производится после полного клинического выздоровления и при отсутствии изменений в СМЖ. Рекомендовано реабилитационное лечение в специализированных санаториях неврологического профиля.
Диспансерное наблюдение
Диспансерное наблюдение за переболевшими не регламентировано. Сроки наблюдения за больными определяются индивидуально, но при менингеальной и паралитических формах составляют не менее года.
Памятка для пациента
Рекомендации даются индивидуально, отражаются в выписке и обычно включают: сбалансированное питание, ограничение физической нагрузки, рекомендации избегать переохлаждений и других стрессовых состояний. После перенесенной менингеальной и паралитической формы в течение года исключены полеты на самолете, походы в горы, спуски под воду (дайвинг), вакцинации, за исключением экстренной (например, против бешенства).
Санаторно-курортное лечение
Через 6 мес после острого периода показано санаторно-курортное лечение. Санаторнокурортное лечение больных с параличами и парезами проводится в санаториях неврологического профиля, на грязевых и бальнеологических курортах с сульфидными, радоновыми, хлоридными натриевыми, азотно-кремнистыми термальными водами (Евпатория, Саки, Пятигорск, Сочи-Мацеста и др.).
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
21.10. ДИАРЕИ ВИРУСНОЙ ЭТИОЛОГИИ
Диареи вирусной этиологии (гастроэнтерит вирусный) - группа острых антро-понозных вирусных инфекционных болезней с фекально-оральным механизмом передачи возбудителей. Для этой группы заболеваний характерны симптомы интоксикации, клиническая картина гастроэнтерита и, в некоторых случаях, катарально-респираторный синдром.
Диареи и гастроэнтериты могут быть вызваны различными вирусами. Это рота-
вирусы (Rotaviruses) и группа так называемых мелких круглых вирусов (small round viruses):
◊норовирусы (Norovirus), включающие вирус Норволк (Norwalk) и родственные ему вирусы (Hawaii, Snow, Mountain, Taunton, Mexico, Desert, Southampton, Lordsdale, Wilkinson);
◊калицивирусы (Caliciviruses);
◊астровирусы (Astroviruses);
◊прочие мелкие круглые вирусы (Wollan, Ditchling, Cockle).
Кроме того, возбудителями этой группы диарей могут быть аденовирусы (типы 40 и 41), коронавирусы, энтеровирусы Коксаки и ЕСНО.
Ведущие этиологические агенты вирусных гастроэнтеритов у человека: ротави-русы и норовирусы.
Ротавирусная инфекция
Ротавирусная инфекция (ротавирусный гастроэнтерит) - острая антропоноз-ная инфекционная болезнь с фекально-оральным механизмом передачи возбудителя, вызываемая ротавирусами, характеризующаяся симптомами общей интоксикации, развитием гастроэнтерита с обезвоживанием.
КОД ПО МКБ-10
A08.0 Ротавирусный энтерит. ЭТИОЛОГИЯ
Возбудитель - РНК-содержащий вирус семейства Reoviridae рода Rotavirus. Этот род включает большое количество сходных по морфологии и антигенной структуре вирусов, вызывающих заболевания у человека, животных (поросята, ягнята, жеребята, олени, собаки, кошки, кролики, мыши, обезьяны) и птиц. Свое название ротавирус получил из-за характерной кольцевой структуры (лат. rota - колесо, рис. 21.1).

Рис. 21.1. Ротавирус
Под электронным микроскопом вирусные частицы выглядят как колеса с широкой ступицей, короткими спицами и четко очерченным тонким ободом. Геном ротавируса состоит из 11 сегментов двухцепочечной РНК, каждый из которых кодирует структурные протеины вириона (VP) и неструктурные белки. Вирусная частица имеет трехслойный икосаэдрический капсид диаметром около 70 нм. В состав наружной оболочки вируса входят структурные белки VP4 и VP7, которые определяют выработку нейтрализующих антител. Внутренняя оболочка состоит преимущественно из структурного белка VP6, являющегося групповым и субгрупповым антигеном. Неструктурные протеины выполняют различные функции, в том числе отвечают за репликацию вируса, связывание РНК, эндотоксическую активность, сборку вируса. Особенности строения рота-вируса обусловливают высокую контагиозность и резистентность к стандартным дезинфицирующим средствам, что определяет повсеместную распространенность инфекции и высокие показатели заболеваемости.
Ротавирусы устойчивы к воздействию факторов окружающей среды: в питьевой воде, открытых водоемах и сточных водах они сохраняются до нескольких месяцев; на овощах - 25-30 дней; на хлопке и шерсти - до 15-45 дней; на поверхности мебели и на полу - до 7-15 дней. Ротавирусы не разрушаются при многократном замораживании. Погибают при кипячении, обработке фенольными соединениями, крезолом, формалином, растворами с рН более 9 либо менее 3. Эффективен для инактивации ротавирусов 95% этанол. Оптимальные условия сохранения вирусов: температура 4 °С и высокая (>90%) или низкая (<14%) влажность. Инфекционная активность возрастает при добавлении протеолитических ферментов (трипсина, панкреатина).
Ротавирусы классифицируются на серогруппы и серотипы. Известно не менее
7 серогрупп (A, B, С, D, E, F, G), выделение которых основывается на антигенных свойствах структурного белка внутреннего капсида VP6. Патогенными для человека являются серогруппы А, В и С. Серогруппа А наиболее часто обусловливает ротавирусный гастроэнтерит у человека, вызывая эндемические вспышки тяжелой диареи у детей младшего возраста как в развитых, так и в развивающихся странах. Серогруппа В более распространена в Азии, в частности в Китае; ротавирусы серогрупп
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

B и С чаще вызывают диарею у взрослых и детей старшего возраста. Серотипы описаны только для серогруппы А, их классификация основывается на наличии двух поверхностных антигенов VP4 и
VP7, к которым в организме человека образуются нейтрализующие антитела. По структуре VP7-антигена выделяют G-серотипы (glycoproteine), у человека описано 11 G-серотипов, им соответствует 11 генотипов. Однако повсеместно наиболее распространены всего 4 серотипа: G1-G4, а в последние годы растет частота выявления G9-серотипа. VP4-антиген обусловливает выделение Р-серотипов (protease sensitive), на сегодняшний день описано 11 патогенных для человека серотипов. Так же как и G-серотипы, они обозначаются числами, но соответствующие им Р-генотипы обычно указывают в квадратных скобках. Наиболее часто заболевание у человека вызывают P[4], P[6] и Р[8]. Если количества изученных G-серотипов и G-генотипов соответствуют друг другу, то количество Р-генотипов превышает количество Р-серотипов, поэтому обычно в номенклатуре указывается Р-серотип вируса, его Р-генотип и его G-серотип, например: Р1А[8]G1. У человека наиболее часто выявляются ротавирусы с серотипами G1, G3 и G4 в комбинации с Р1А[8] и G2 в комбинации с Р1В[4]. Серотип G9 обычно ассоциируется с Р1А[8] или Р2А[6].
Репликация ротавирусов в организме человека происходит в эпителиальных клетках тонкой кишки. Существуют данные о возможной корреляционной связи определенных серотипов с тяжестью диареи.
ЭПИДЕМИОЛОГИЯ Ротавирусная инфекция встречается повсеместно и выявляется во всех возрастных группах.
Вструктуре ОКИ доля ротавирусного гастроэнтерита колеблется от 9 до 73%, в зависимости от возраста, региона, уровня жизни, сезона и охвата детского населения вакцинацией от ротавирусов. Официальная регистрация ротавирусной инфекции в России проводится с 1990 г. Особенно часто болеют дети первых лет жизни (преимущественно от 6 мес до 2 лет). Ротавирусы - одна из причин диареи, сопровождающейся тяжелой дегидратацией у детей в возрасте до 3 лет, этой инфекцией обусловлено до 30-50% и более всех случаев диареи, требующих госпитализации или проведения интенсивной регидратации. По данным ВОЗ, от этого заболевания в мире ежегодно умирают от 1 до 3 млн детей. Ротавирусная инфекция является этиологическим фактором 25% случаев диареи путешественников.
ВРоссии частота ротавирусного гастроэнтерита в структуре других ОКИ колеблется от 7 до 35%, а среди детей до 3 лет - превышает 60%. Увеличение числа зарегистрированных случаев заболеваний ротавирусной инфекцией в период с 2007 по 2014 гг. более чем в 2 раза является в том числе следствием внедрения системы учета заболевания и совершенствования методов лабораторной диагностики (табл. 21.20).
Основной источник и резервуар ротавирусной инфекции - больной человек, выделяющий с фекалиями значительное количество вирусных частиц в конце инкубационного периода и в первые дни болезни (до 1010 в 1 г). После 4-5-го дня болезни количество вируса в испражнениях значительно снижается, однако общая продолжительность выделения возбудителя составляет до 2-3 нед. Длительновыделяют вирусные частицы больные с нарушенной иммунологической реактивностью, при хронической сопутствующей патологии ЖКТ, лактазной недостаточности. Источником возбудителя инфекции могут быть также
здоровые вирусоно-сители (дети из организованных коллективов и стационаров, взрослые: прежде всего медицинский персонал родильных домов, соматических и инфекционных отделений), в фекалиях которых ротавирус можно определять на протяжении нескольких месяцев.
Механизм передачи возбудителя - фекально-оральный. Пути передачи: контактно-бытовой (через грязные руки и предметы обихода), водный (при употреблении инфицированной вирусами воды, в том числе бутилированной), алиментарный (чаще всего при употреблении молока, молочных продуктов).
Не исключена возможность воздушно-капельного пути передачи ротавирус-ной инфекции, при этом для заражения человека достаточно всего 10 вирусных частиц.
Ротавирусная инфекция высококонтагиозна, о чем свидетельствует быстрое распространение заболевания в окружении больных. Во время вспышек заболевает до 70% неиммунного населения. При сероэпидемиологическом исследовании в крови 90% детей старших возрастных групп обнаруживают антитела к различным ротавирусам.
Ротавирусы - одна из наиболее частых причин внутрибольничной инфекции, особенно среди недоношенных новорожденных и детей раннего возраста. В структуре внутрибольничных ОКИ на долю ротавирусов приходится от 9 до 49%. Внутрибольничному инфицированию способствует длительное пребывание детей в стационаре. Существенную роль в передаче ротавирусов играет медицинский персонал: у 20% сотрудников даже при отсутствии кишечных расстройств в сыворотке крови обнаруживают антитела IgM к ротавирусу, а в копрофильтратах выявляют ротавирусный антиген.
На территориях с умеренным климатом ротавирусная инфекция носит сезонный характер, преобладая в холодные зимние месяцы, что связывают с лучшей выживаемостью вируса в окружающей среде при низких температурах и благоприятными условиями передачи в закрытых помещениях. В России около 60-70% случаев ротавирусного гастроэнтерита приходится на зимне-весенний период, около 20-30% регистрируются осенью и 10% - летом. В тропических странах заболевание встречается круглый год с некоторым повышением заболеваемости в прохладный дождливый сезон.
После перенесенной инфекции в большинстве случаев формируется непродолжительный типоспецифический иммунитет. Возможны повторные заболевания, особенно в старших возрастных группах. Решающую роль в образовании иммунитета к ротавирусам играют мукозальные (интестинальные) IgA-антитела и сывороточные IgG-антитела. Многочисленные исследования показывают, что иммунная защита возрастает с каждой перенесенной инфекцией, причем она эффективно предотвращает развитие тяжелой ротавирусной диареи в последующем, однако в меньшей степени защищает от легкого или бессимптомного течения болезни.
МЕРЫ ПРОФИЛАКТИКИ
Профилактика ротавирусной инфекции включает комплекс противоэпидемических мероприятий, принятых в отношении всей группы ОКИ с фекально-оральным механизмом инфицирования:
1)мероприятия, направленные на выявление и обезвреживание источника инфекции;
2)мероприятия, направленные на разрыв механизма передачи инфекции;
3)специфическая профилактика.
Мероприятия в эпидемическом огаге направлены на выявление больных, подозрительных на наличие ротавирусного гастроэнтерита. Проводятся врачами всех учреждений здравоохранения во время амбулаторных приемов, посещений на дому, медицинских
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
осмотров детей в детских учреждениях, стационарах и др. Больные изолируются из детских коллективов. Дети, посещающие детские учреждения, выписанные из больницы или закончившие лечение на дому, с отрицательными результатами лабораторного обследования допускаются в детские коллективы на основании справки врача-педиатра. Медицинское наблюдение за детьми, общавшимися с больными, осуществляется в течение 7 дней со дня изоляции последнего заболевшего. В образовательных учреждениях проводят ограничительные мероприятия в течение 7 дней с момента изоляции последнего больного:
◊дети, не контактировавшие с заболевшим, не принимаются в группу на период медицинского наблюдения;
◊отсутствующие контактные дети передаются на участок по месту жительства для медицинского наблюдения и принимаются в учреждение с результатами обследования на ротавирусную инфекцию;
◊перевод детей и персонала из группы, где выявлен случай ротавирусной инфекции, в другую группу запрещается.
С целью своевременного и полного выявления детей с ротавирусной инфекцией или подозрением на нее в детских дошкольных учреждениях необходимо проведение «утреннего фильтра» во всех группах на период проведения противоэпидемических мероприятий. Дети с подозрением на ротавирусный гастроэнтерит не допускаются в учреждение.
Лабораторное обследование на ротавирусы детей и взрослых, общавшихся с больными в организованных коллективах, проводится по указанию эпидемиолога и инфекциониста, при возникновении в семье или в детском коллективе повторных заболеваний с аналогичной клинической картиной, грубых нарушениях санитарно-гигиенического режима, наличии в очаге работников пищевых предприятий и лиц, к ним приравненных. Больные с положительными результатами вирусологического и молекулярно-генетического исследования (ПЦР) на ротавирусы подлежат тщательному клиническому осмотру инфекционистом. При отсутствии клинических проявлений заболевания дети и сотрудники из коллектива изолируются, направляются на консультацию к инфекционисту. Повторное комплексное лабораторное обследование лиц проводится с интервалом в 5-7 дней. Обеспечивается строгое соблюдение санитарных норм и дезинфекционного режима.
Сохраняющаяся высокая заболеваемость ротавирусной инфекцией в развивающихся и индустриально развитых государствах означает, по мнению экспертов ВОЗ, что превентивные меры (улучшение водоснабжения, санитарно-гигиенических условий и др.) без проведения масштабной вакцинации не смогут решить данной остро стоящей проблемы. По подсчетам экспертов ВОЗ, предотвратить около 170-210 тыс. смертей в год от ротавирусной инфекции может эффективная иммунопрофилактика. Выбор вакцины зависит от циркулирующих в регионе штаммов ротавирусов. Эксперты ВОЗ рекомендуют включить ротавирусную вакцину для детей младенческого возраста во все национальные программы иммунизации. Странам, где смертность от диарей составляет 10% или более от общих показателей смертности среди детей в возрасте младше 5 лет, применение вакцины настоятельно рекомендуется.
В настоящее время для профилактики ротавирусной инфекции во многих странах мира зарегистрированы и используются две вакцины: RotaRix (GSK Biologicals, Бельгия) и RotaTeq (Merck&Co., США).
Моновалентная аттенуированная оральная ротавирусная вакцина (RV1), RotaRix (GSK Biologicals, Бельгия) создана на основе ослабленного штамма рота-вируса Р1АG1, RIX 4414, который является самым распространенным в США и многих других странах. Курс вакцинации состоит из 2 прививок с соблюдением интервала между двумя прививками не менее 4 нед. Первая доза вводится детям, начиная с 6-недельного возраста. Вакцинация должна быть завершена к 24-й неделе жизни ребенка. Для создания полноценного

иммунитета необходимо получить 2 прививки. Вакцинный штамм реплицируется в тонкой кишке, так же как и естественный ротавирусный штамм. В 2006 г. вакцина RotaRix была зарегистрирована более чем в 70 странах Латинской Америки, Африки, Азии и Европейского союза. Клиническая эффективность вакцины RotaRix была доказана в многоцентровых исследованиях, а профилактические результаты вакцинации в отношении различных серотипов ротавирусов после применения 2 доз препарата представлены в табл. 21.21.
Живая оральная пятивалентная реассортантная ротавирусная вакцина (RV5), RotaTeq (Merck&Co., США) в России зарегистрирована в 2012 г. Она содержит 5 реассортантных (G1, G2, G3, G4, P1A[8]) вирусов, полученных на основе бычьего и человеческих родительских штаммов. Бычий штамм вируса, использованный при создании вакцины, является непатогенным для человека. Выбор серотипов для создания вакцины обусловлен тем, что более 80% тяжелых ротавирусных гастроэнтеритов во всем мире вызвано именно этими штаммами. Курс вакцинации состоит из 3 доз препарата вакцина для профилактики ротавирусной инфекции, пентавалентная, живая (РотаТек♠) с интервалом между введениями от 4 до 10 нед. Первую дозу препарата РотаТек♠ вводят детям в возрасте от 6 до 12 нед. Все 3 дозы рекомендуется ввести до достижения ребенком возраста 32 нед. Пятивалентная ротавирусная вакцина RotaTeq может использоваться одновременно с другими вакцинами (АКДС-вакциной, инактивированной полиовирусной вакциной, вакциной гемофильной тип b коньюгированной♠, вакциной для профилактики вирусного гепатита В, вакциной для профилактики пневмококковых инфекций). Эффективность RotaTeq показана в том числе при использовании у недоношенных детей, находящихся в стабильном состоянии. Вакцинация может проводиться у детей, в семьях которых есть больные с иммунодефицитными состояниями. Вакцинация показала высокую эффективность в отношении снижения числа госпитализаций по поводу ротавирусного гастроэнтерита, вызванного серотипа-ми G1 (95%), G3 (93%), G4 (89%) и G9 (100%). После вакцинации RotaTeq риск
госпитализации по поводу тяжелого ротавирусного гастроэнтерита в целом снижается на 96%, потребность в экстренной медицинской помощи - на 94%, потребность в обращении к врачу - на 86%.
Несмотря на регистрацию ротавирусных вакцин во многих государствах, в национальные календари профилактических прививок они включены далеко
не везде. На территории Евросоюза ротавирусные вакцины внедрили в национальные календари профилактических прививок Австрия, Бельгия, Финляндии и Люксембург. Наиболее длительный опыт применения вакцин имеют США и Австралия.
ПАТОГЕНЕЗ
Большое значение в развитии ротавирусного гастроэнтерита придают структурным (VP3, VP4, VP6, VP7) и неструктурным (NSP1, NSP2, NSP3, NSP4, NSP5) белкам вируса. В частности, NSP4-пептид - энтеротоксин, вызывающий секреторную диарею, подобно бактериальным токсинам; NSP3 влияет на репликацию вируса, а NSP1 может «запрещать»
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
выработку ИФН-регулирующего фактора 3. Уже через 30 мин после попадания в организм вирус внедряется в апикальные клетки ворсинок тонкой кишки, где происходит его репликация. Проникновение ротавируса в клетку - многоэтапный процесс. Для внедрения в клетку некоторые серотипы ротавируса нуждаются в специфических рецепторах, содержащих сиаловую кислоту. Установлена важная роль белков: α2β1-интегрина, интегринаαVβ3 и hsc70 на начальных этапах взаимодействия вируса и клетки, при этом весь процесс контролируется вирусным белком VP4. Проникнув внутрь клетки, ротавирусы вызывают гибель зрелых эпителиоцитов тонкой кишки и отторжение их от ворсинок. Клетки, замещающие ворсинчатый эпителий, функционально неполноценны и не способны адекватно абсорбировать углеводы и простые сахара. Возникновение дисахаридазной (главным образом лактазной) недостаточности ведет к накоплению в кишечнике нерасщепленных дисахари-дов с высокой осмотической активностью, что вызывает нарушение реабсорб-ции воды, электролитов и развитие водянистой диареи, нередко приводящей к дегидратации. Поступая в толстую кишку, эти вещества становятся субстратами для ферментации кишечной микрофлорой с образованием большого количества органических кислот, углекислого газа, метана и воды. Внутриклеточный метаболизм цАМФ и гуанозинмонофосфата в эпителиоцитах при данной инфекции практически не изменяется. Кроме этого, ротавирусы способны оказывать также стимулирующее действие на вегетативную нервную систему тонкого кишечника, с усилением секреции жидкости, электролитов в просвет кишки и интестинальной моторики, что может усугубить водянистую диарею, укорачивая время эвакуации кишечного содержимого из кишечника.
Факторами саногенеза являются: замещение энтероцитов молодыми клетками, не имеющими рецепторов к РВ, появление в конце первой недели болезни IgM-антител и IgG-антител на 3- 4-й неделе.
Таким образом, в настоящее время в развитии диарейного синдрома выделяют два основных компонента: осмотический и секреторный.
КЛИНИЧЕСКАЯ КАРТИНА Инкубационный период составляет от 14-16 ч до 7 дней (чаще - 1-4 дня).
Различают типичную (легкую, средней тяжести, тяжелую) и атипичную ротави-русную инфекцию. К атипичным относят стертую (клинические проявления выражены слабо и кратковременны) и бессимптомную формы (полное отсутствие клинических проявлений, но лабораторно обнаруживают ротавирус и специфический иммунный ответ). Диагноз вирусоносительства устанавливают при обнаружении ротавируса у здорового человека, не имевшего при обследовании изменений специфического иммунитета в динамике.
Заболевание чаще всего начинается остро, с повышения температуры тела, появления симптомов интоксикации, диареи и повторной рвоты, что позволило зарубежным исследователям охарактеризовать ротавирусную инфекцию как
DFV-синдром (диарея, лихорадка, рвота). Указанные симптомы отмечают у 90% пациентов; они возникают почти одновременно в 1-й день болезни, достигая максимальной выраженности в течение 12-24 ч. В 10% случаев рвота и диарея появляются на 2-3-й день болезни. Возможно также постепенное начало заболевания, с медленным нарастанием тяжести процесса и развитием обезвоживания, что нередко обусловливает позднюю госпитализацию. Рвота - не только один из первых, но нередко и ведущий признак ротавирусной инфекции. Обычно она предшествует диарее или появляется одновременно с ней, может быть повторной (2-6 раз) или многократной (до 10-12 р/сут и более), продолжается в течение 1-3 дней. Кишечная дисфункция протекает преимущественно по типу гастроэнтерита или энтерита, характеризуясь жидким, водянистым, пенистым стулом желтого или желто-зеленого цвета без патологических примесей с резким кислым запахом.
Кратность дефекаций чаще соответствует тяжести болезни. При обильном жидком стуле может развиться обезвоживание, обычно I-II степени. Лишь в отдельных случаях наблюдают тяжелую дегидратацию III степени с развитием дегидратационного шока. С самого начала заболевания могут наблюдаться боли в животе. Чаще они умеренные, постоянные, локализованы в верхней половине живота; в отдельных случаях - схваткообразные, сильные. При пальпации живота отмечают болезненность в эпигастральной и пупочной областях, грубое урчание в правой подвздошной области. Печень и селезенка не увеличены. Признаки поражения органов пищеварения сохраняются в течение 3-6 дней. Повышение температуры тела умеренное: от субфебриль-ных до фебрильных значений. Длительность лихорадки колеблется в пределах 2-4 дней, нередко лихорадка сопровождается симптомами интоксикации (вялость, слабость, снижение аппетита, вплоть до анорексии). У части больных, преимущественно у детей младшего возраста, развиваются катаральные явления: покашливание, насморк или заложенность носа, редко - конъюнктивит, катаральный отит. При осмотре обращают на себя внимание гиперемия и зернистость мягкого нёба, нёбных дужек, язычка.
Количество мочи в острый период болезни уменьшено, у отдельных пациентов наблюдаются незначительные протеинурия, лейкоцитурия, эритроцитурия, а также повышение содержания креатинина и мочевины в сыворотке крови. В начале болезни может быть лейкоцитоз с нейтрофилезом без сдвига влево, в период разгара сменяющийся лейкопенией с лимфоцитозом; СОЭ не изменена. Для копроцитограммы характерно отсутствие признаков выраженного воспалительного процесса, в то же время обнаруживаются зерна крахмала, непереваренная клетчатка, нейтральный жир. У большинства больных ротавирусной инфекцией отмечают нарушение состава микрофлоры фекалий, в первую очередь, снижение содержания бифидобактерий, а также рост числа условно-патогенных микробных ассоциаций. Выявляют признаки лактазной недостаточности, в том числе кислые значения pH кала.
Симптомы, характерные для легкой формы ротавирусной инфекции: субфе-брильная температура тела, умеренная интоксикация в течение 1-2 дней, нечастая рвота, стул жидкой кашицей до 5-10 р/сут.
При среднетяжелой форме отмечаются: фебрильная лихорадка, выраженная интоксикация (слабость, вялость, головная боль, бледность кожных покровов), повторная рвота в течение 1,5-2 дней, обильный водянистый стул от 10 до 20 р/сут, обезвоживание I-II степени.
Тяжелая форма характеризуется бурным началом с нарастанием тяжести состояния ко 2-4-му дню болезни в связи со значительными потерями жидкости
(обезвоживание II-III степени), многократной рвотой и бессчетным водянистым стулом (более 20 р/сут). Возможны гемодинамические нарушения.
Осложнения ротавирусной инфекции: дегидратационный шок, острая сердечнососудистая недостаточность, острая экстраренальная почечная недостаточность, вторичная дисахаридазная недостаточность, дисбактериоз кишечника (синдром избыточного бактериального роста).
Возможна вторичная бактериальная инфекция, что приводит к изменениям клинической картины болезни и требует коррекции терапевтического подхода. В связи с возможностью развития осложнений при ротавирусном гастроэнтерите выделяют группы больных повышенного риска, куда включают новорожденных, детей младшего возраста, пожилых лиц, а также больных с тяжелыми сопутствующими заболеваниями. Недостаточно изучены особенности течения ротавирусной инфекции у лиц с иммунодефицитами (например ВИЧинфицированных), у которых может наблюдаться некротический энтероколит и геморрагический гастроэнтерит.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Летальные исходы чаще встречаются у детей раннего возраста, имеющих выраженный иммунологический дефицит и гипотрофию, а также среди пожилых пациентов с тяжелой сопутствующей патологией (такой как атеросклероз, хронический гепатит), в некоторых случаях - со смешанной инфекцией.
ДИАГНОСТИКА
Основные клинико-диагностические признаки ротавирусной инфекции: характерный эпидемиологический анамнез - групповой характер заболевания в зимнее время года, острое начало болезни, повышение температуры тела и синдром интоксикации, рвота как ведущий симптом, водянистая диарея, умеренно выраженные боли в животе, метеоризм.
Для лабораторного подтверждения ротавирусной инфекции используют три группы методов:
◊методы, основанные на обнаружении ротавируса и его антигенов в фекалиях: электронная и иммуноэлектронная микроскопия (признана «золотым стандартом» в диагностике вирусной инфекции, но метод достаточно дорогой для рутинного использования); РЛА (преимущества: не требует специального оборудования, быстрое получение ответа при относительно низкой стоимости метода, высокая специфичность; недостатки: только серогруппа А, ложно-положительные результаты в 3-5% случаев, чувствительность меньше, чем у ИФА); ИФА (преимущества: чувствительность сравнима с электронной микроскопией, высокая специфичность; недостатки: только серогруппа А, ложноположительные результаты в 3-5% случаев); иммунохроматография (преимущества: высокая чувствительность и специфичность метода, быстрое получение ответа при относительно низкой стоимости метода; недостатки: только серогруппа А);
◊методы обнаружения вирусной РНК в копрофильтратах: метод молекулярных зондов -
ПЦР и гибридизации; электрофорез РНК в полиакриламидном геле или агарозе;
◊ методы обнаружения специфических антител (Ig различных классов и/или нарастания титра антител) к ротавирусам в сыворотке крови (ИФА, РСК,
РТГА, РНГА).
На практике диагностика ротавирусной инфекции чаще всего основана на обнаружении вирусного антигена в копрофильтратах с помощью РЛА, ИФА в 1-4-е сутки болезни, ПЦР.

Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Показания к консультации других специалистов
Консультации других специалистов рекомендуют при тяжелой сопутствующей патологии, развитии осложнений.
Пример формулировки диагноза
A08.0 Ротавирусная инфекция, синдром гастроэнтерита, среднетяжелая форма, дегидратация I степени.
ЛЕЧЕНИЕ
Госпитализации подлежат больные со среднетяжелой и тяжелой формами ротавирусной инфекции, а также пациенты закрытых коллективов, представляющие высокую эпидемиологическую опасность, декретированные континген-ты. Комплексное лечение ротавирусной инфекции включает лечебное питание, патогенетическую и симптоматическую терапию. Из диеты исключают молоко и молочные продукты, ограничивают употребление углеводов (овощи, фрукты и соки, бобовые). Пища должна быть физиологически
полноценной, механически и химически щадящей, с достаточным содержанием белка, жира, минеральных солей и витаминов. Необходимо увеличение кратности приемов пищи. Препараты с противовирусной активностью в отношении ротавирусов не разработаны. Антибактериальные средства противопоказаны (дисбактериоз).
Патогенетическое лечение, направленное на борьбу с дегидратацией и интоксикацией, осуществляют путем введения полиионных кристаллоидных растворов, внутривенно или внутрь, с учетом степени обезвоживания и массы тела больного. Оральную регидратацию проводят подогретыми до 37-40 °С растворами: глюкосолаρ, декстроза + калия хлорид + натрия хлорид + натрия цитрат (Цитраглюкосолан¤), декстроза + калия хлорид + натрия хлорид + натрия цитрат (Регидрон♠), оралиρ. Для инфузионной терапии используют раствор, рекомендованный ВОЗ [3-5 г NaCl, 1,5 г KCl, 20 г декстрозы (Глюкозы♠) на 1 л воды; калия хлорид + натрия гидрокарбонат + натрия хлорид (Трисоль♠); квартасолρ; калия хлорид + натрия ацетат + натрия хлорид (Ацесоль♠)]. Противорвотные препараты назначают с учетом возраста и выраженности симптома. Эффективный метод лечения диареи ротавирусной этиологии - применение энтеросорбентов [производные диосмектита, лигнин гидролизный (Полифепан♠), полиметилсилоксана полигидрат (Энтеросгель♠) и др.]. Учитывая ферментативную недостаточность, показано применение ферментов (панкреатин и др.). Кроме того, при лечении ротавирусной инфекции целесообразно включение пробиотиков и пребиотиков с учетом возрастных показаний и противопоказаний.
Прогноз
Прогноз обычно хороший, отдаленных неблагоприятных значимых последствий не описано. Переболевших выписывают при полном клиническом выздоровлении, наступающем в большинстве случаев к 5-7-му дню от начала болезни.
После перенесенного заболевания пациенту рекомендуют в течение 2-3 нед соблюдать диету с ограничением молока и молочных продуктов, углеводов.
Норовирусная инфекция
Норовирусная инфекция - острая антропонозная инфекционная болезнь с преимущественно фекально-оральным механизмом передачи возбудителя, характеризующаяся умеренной интоксикацией и картиной острого гастроэнтерита с доброкачественным течением.
КОД ПО МКБ-10
A08.1 Острая гастроэнтеропатия, вызванная возбудителем Норволк. ЭТИОЛОГИЯ
Возбудитель норовирусной (Nv) инфекции является представителем 4-й группы однонитевых (ssRNA) РНК-содержащих вирусов семейства Caliciviridae. Имеет белковую структуру, округлую форму и размеры около 27-32 нм. Отличается генетическим разнообразием. Из 7 известных геногрупп (NvGI-NvGVII) только NvGI и NvGII (реже - NvGIV) представляют значение для патологии человека и склонны к глобальному распространению. Геногруппа GI подразделяется на 9 генотипов,
GII - на 22 генотипа. Наиболее часто вспышки Nv-инфекции в мире связаны с NvGII. Он в 80-90% случаев также служит причиной заболевания у детей в возрасте до 5 лет. Вирусы NvGI вызывают, как правило, спорадические случаи болезни и выявляются у 0,6-17% детей с острым гастроэнтеритом. Значимость в развитии Nv-гастроэнтерита NvGII, в частности штама NvGII.4 связана с тем, что GII.4 вирусы могут захватывать больший диапазон антигенов гистокровяной группы (HBGAs), служащих факторами прикрепления к клеткам для Nv, по сравнению с другими генотипами. Таким образом, NvGII.4 имеют расширенный пул населения, восприимчивый к инфекции.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Nv сохраняют жизнеспособность в окружающей среде длительное время (до месяца), в том числе в хлорированной питьевой воде; устойчивы к нагреванию и замораживанию, ультрафиолетовому излучению и действию ряда дезинфицирующих средств (этанол, эфир, жирорастворители). Инактивируются в кислой среде (рН 3,0-5,0), при воздействии температуры выше 60 °C и 0,1-0,5% раствора хлорамина.
ЭПИДЕМИОЛОГИЯ
Источник возбудителя инфекции - больной человек, выделяющий вирус в течение 3-7 нед после заражения. У иммунокомпрометированных пациентов описана длительная (до 119-182 дней) персистенция Nv без клинических симптомов болезни. Количество вируса в кале больного колеблется от 103 до 106 в разные периоды, при чрезвычайно малой инфицирующей дозе, составляющей 10 вирусных частиц, что, наряду с высокой устойчивостью возбудителя, лежит в основе быстрого распространения Nv-инфекции и развития вспышек.
Основной механизм передачи возбудителя - фекально-оральный, реализующийся контактнобытовым (88% случаев), пищевым (зеленый лук, салат, устрицы, моллюски, клубника, мороженое и т.д.) - 10% случаев и водным (2% случаев) путем. Определенное значение имеет и воздушно-капельный путь передачи Nv, содержащегося в аэрозолях, образующихся при рвоте и диарее и загрязняющих окружающие предметы, что также способствует быстрому вовлечению в эпидемический процесс большого количества людей в местах их скопления (больницы, детские сады, детдома, школы, санатории для пожилых людей, места общественного питания, гостиницы, круизные суда, войсковые части и др.).
Заболеваемость при Nv-инфекции может иметь спорадический, групповой и вспышечный характер. Контактно-бытовые вспышки чаще вызываются NvGII.4, пищевые и водные - NvGI и вирусами других генотипов. Для вспышек Nv-гастроэнтерита характерно затяжное и волнообразное течение с поражением в основном детей школьного возраста, молодых (средний возраст - 28 лет) и пожилых людей. Спорадические случаи чаще наблюдаются у детей и пожилых.
Сезонность Nv-инфекции в разные периоды наблюдения на отдельных территориях имеет свои особенности, что связано со сменой эпидемических штаммов Nv и фазами их активности. В России подъем спорадической заболеваемости регистрируется в январефеврале. Появление нового эпидемического штамма может быть причиной роста заболеваемости весной и летом.
Заболевание широко распространено. У 50-70% взрослых, проживающих как в развитых, так и в развивающихся странах, определяются антитела к Nv, появляющиеся еще в детском возрасте. С середины 90-х годов прошлого века отмечен рост циркуляции Nv. В 2006 г. ВОЗ сообщила о пандемии Nv-инфекции. В ряде стран созданы системы надзора за вспышками Nv-инфекции. В целом имеющиеся неполные данные по этиологии ОКИ позволяют говорить о том, что если спорадические случаи вирусного гастроэнтерита у взрослых и в большей степени у детей связаны в основном с ротавирусами, то причиной вспышек, в том числе внутрибольнич-ных, является чаще всего Nv. Однако в индустриальных странах, где проводится
эффективная вакцинация против ротавирусной инфекции, Nv-диареи в детской популяции быстро выходят на лидирующие позиции и среди спорадических случаев вирусных гастроэнтеритов. В настоящее время в мире ежегодно по различным данным около 200 тыс. детей в возрасте до 5 лет погибают от Nv-инфекции.
Официальная регистрация норовирусной инфекции в РФ введена с 2009 г., а показатели
заболеваемости колебались от 0,90/0000 в 2009 г. до 8,910/0000 в 2014 г. (табл. 21.23), что связано, в том числе, с активным внедрением обследования на возбудитель в практику учреждений

здравоохранения. До 80% от всех случаев норовирусной инфекции в РФ приходится на детей.
ПРОФИЛАКТИКА
Противоэпидемические мероприятия такие же, как и при других кишечных инфекциях. Однако высокая устойчивость во внешней среде, низкая чувствительность к хлорированию и замораживанию, очень малая заражающая доза дают основание предполагать рост удельного веса Nv-инфекции в структуре ОКИ, особенно в развитых странах.
Специфической профилактики не разработано. Активно ведутся исследования, направленные на создание профилактической вакцины, результаты которых свидетельствуют о перспективности данного направления.
ПАТОГЕНЕЗ
В результате проникновения в организм человека Nv происходит нарушение моторной функции желудка, при этом, как правило, гистологические изменения слизистой незначительны, а секреторная активность (выработка пепсина и соляной кислоты) не страдает. Основной патологический процесс локализуется в тонкой кишке, где вирус нарушает структуру клеток тонкой кишки, при этом укорачиваются ворсинки клеток, развивается гиперплазия крипт, собственная пластинка слизистой оболочки кишечника инфильтрируется полиморфно-ядерными и моноядерными клетками. Все это обусловливает умеренную стеаторею, нарушение всасывания углеводов (вторичная дисахаридазная недостаточность) и снижение активности некоторых ферментов, располагающихся в пограничном клеточном слое. Аденилатциклазная активность клеток не изменяется. В слизистой оболочке толстой кишки значительных изменений обычно не наблюдается.
Реакция организма на внедрение Nv включает активацию факторов неспецифической резистентности с последующим клоноспецифическим распознаванием антигенов, активацией и клональной экспансией эффекторных клеток (Т- и В-лимфоцитов), в результате чего формируется специфический иммунный ответ и иммунологическая память. От состояния защитных механизмов может зависеть тяжесть Nv-инфекции и ее прогноз. Подавляющее большинство пациентов выздоравливают, летальные исходы крайне редки. К группе риска относятся дети раннего возраста, пожилые, больные с тяжелыми сопутствующими заболеваниями и иммунокомпрометированные лица.
После перенесенного заболевания стойкий иммунитет не формируется, что связано с выраженной изменчивостью Nv. Иммунитет развивается в основном к
гомологичной геногруппе или генотипу. Повторное заражение возможно спустя 27-42 мес.
Восприимчивость к Nv-инфекции высокая. В человеческой популяции существуют генетически обусловленные варианты повышенной и пониженной чувствительности, а также штаммоспецифической невосприимчивости к Nv-инфекции.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период - от 10 ч до 2-3 сут. Начало заболевания острое, у некоторых больных - короткий субфебрилитет, сильная слабость, адинамия. Самые частые симптомы:
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
тошнота и нечастая кратковременная рвота; боли в эпи-гастрии и средней части живота (несильные, ноющие или схваткообразные); жидкий стул без патологических примесей не более 5-7 р/сут в течение 1-2 сут.
У большинства пациентов наблюдается головная боль, миалгии. При осмотре живот немного вздут, при пальпации ощущается громкое урчание. Печень и селезенка не увеличиваются. В гемограмме чаще встречается нормоцитоз в сочетании с лимфопенией, изредка обнаруживают лейкоцитоз с относительной лимфопенией.
Заболевание обычно протекает в легкой форме, выздоровление наступает через 12-72 ч. В большинстве случаев Nv-инфекция приобретает форму гастроэнтерита, реже - гастроэнтероколита. Почти у трети пациентов выявляется катаральный синдром (насморк, кашель, гиперемия зева). У больных пожилого возраста возможно развитие выраженного обезвоживания, при этом продолжительность желудочно-кишечной дисфункции в среднем составляет 5 дней. У детей на фоне Nv-инфекции в 30% случаев регистрируются судороги, нередко отмечаются и бронхиолиты. Внутрибольничные вспышки Nv-инфекции могут характеризоваться атипичным течением. Так, в РФ в клинической картине отмечено отсутствие температурной реакции у половины больных, ее кратковременный характер (около 40% больных), слабо выраженный интоксикационный синдром и более редкая в сравнении со спорадическими случаями встречаемость рвоты (45-56%). Осложнения при Nvинфекции чаще наблюдаются у младенцев и пожилых людей. Описаны шок смешанного генеза, регионарное нарушение кровообращения, некротизирующий энтероколит у новорожденных, обострение хронического воспалительного заболевания кишечника (язвенный колит, болезнь Крона) и др.
ДИАГНОСТИКА
Диагноз ставят на основании клинических и эпидемиологических данных, подтверждают лабораторно. Среди используемых методов - морфологические (электронная микроскопия), иммунологические (ИФА с гипериммунной сывороткой животных, ИФА с моноклональными антителами, ИФА с вирусоподобными частицами) и генетические (ПЦР). Для экспрессдиагностики Nv-инфекции применяют иммунохимические тесты, выявляющие антигены вируса. Чувствительность составляет 75-90%, специфичность близка к 100%. Время проведения анализа не превышает 15 мин.
В настоящее время диагностические подходы для обнаружения Nv не стандартизированы. Наибольшей чувствительностью обладает ПЦР, а наивысшей специфичностью - электронная микроскопия, ИФА по обоим показателям занимает промежуточное положение.
Дифференциальная диагностика См. «Ротавирусная инфекция». ЛЕЧЕНИЕ
Госпитализацию осуществляют в основном по эпидемиологическим показаниям. Решение о госпитализации по клиническим показаниям основывается на оценке риска развития осложнений.
Назначают полноценную диету, включающую механически и химически щадящую пищу. В остром периоде из рациона исключают цельное молоко и тугоплавкие жиры, ограничивают употребление углеводов.
Медикаментозное лечение
В качестве медикаментозного лечения применяют оральную регидратацию, энтеросорбенты, ферменты, биопрепараты. Антибактериальные средства не показаны. Специфические противовирусные препараты отсутствуют.
Прогноз
Прогноз благоприятный. На исход заболевания могут оказывать влияние возраст и преморбидный фон пациента, тяжесть развившихся осложнений, выраженность изменений показателей мукозального иммунитета (резкое снижение муцина и общего белка в копрофильтрате), а также наличие первичного и вторичного иммунодефицита.
Выписка при полном клиническом выздоровлении. Диспансеризация Диспансерного наблюдения не проводят. Астровирусная инфекция
Астровирусная инфекция - острая антропонозная инфекционная болезнь с фекальнооральным механизмом передачи, вызываемая астровирусами, характеризующаяся чаще легкой или субклинической формой с картиной острого гастроэнтерита и доброкачественным течением.
КОД ПО МКБ-10
A08.3 Другие вирусные энтериты. ЭТИОЛОГИЯ
Астровирусы (Astrovirus), патогенные для человека (HAstVs), принадлежат к семейству Astroviridae, которое подразделяется на две
генерации: Mamastrovirus и Avastrovirus. Астровирусы - одноцепочечные РНК-содержащие вирусы, среди HAstVs выделяют 8 серотипов, из которых тип 1 является превалирующим в мире. По результатам генетического секвенирования определена высокая корреляция генотипической и серотипической классификаций астровирусов.
ЭПИДЕМИОЛОГИЯ
Астровирусы были впервые обнаружены в 1975 г. с помощью метода электронной микроскопии в кале детей с диареями. С астровирусами связано до 8-10% гастроэнтеритов у детей. При изучении сероэпидемиологической ситуации астровирусной инфекции среди детей установлено, что до 70% детей в возрасте от 3 до 4 лет имеют антитела к астровирусам, хотя в анамнезе у них признаки заболевания отсутствовали. Астровирусы обладают низкой патогенностью: клинические признаки заболевания регистрируют гораздо реже, чем позитивные серологические реакции. Астровирусной инфекцией болеют преимущественно дети до 7 лет, причем наиболее часто заболевание регистрируют у детей до года. Возможна как вспышечная, так и спорадическая заболеваемость. Сезонность не характерна. Основные механизмы передачи возбудителя - фекально-оральный, контактно-бытовой.
ПРОФИЛАКТИКА Мер специфической профилактики не разработано. Противоэпидемические мероприятия
осуществляются как и при других кишечных инфекциях. КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период при астровирусных гастроэнтеритах составляет 1-2 дня. Часто встречаются бессимптомные формы инфекции. Клинические формы протекают легко с преобладанием водянистой диареи.
В последние годы отмечается возрастающее значение астровирусов в развитии диареи у лиц с иммунодефицитами, включая ВИЧ-инфекцию, а также при нозоко-миальных инфекциях.
ДИАГНОСТИКА
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
При постановке диагноза учитываются клинико-эпидемиологические данные, а также результаты лабораторных исследований (электронная микроскопия, ИФА,
ПЦР).
Дифференциальная диагностика ЛЕЧЕНИЕ Прогноз Диспансеризация
См. «Ротавирусная инфекция».
21.11. ГЕРПЕСВИРУСНЫЕ ИНФЕКЦИИ
Герпесвирусные инфекции - группа широко распространенных антропонозных инфекционных болезней, вызываемых вирусами семейства Herpesviridae, которые характеризуются пожизненным персистированием возбудителя в организме.
КОДЫ ПО МКБ-10
B00 Инфекция, вызванная вирусом герпеса Herpes simplex (герпетическая инфекция). B01 Ветряная оспа (Varicella-zoster).
B02 Опоясывающий лишай (Herpes zoster). B08.2 Экзантема внезапная (шестая болезнь). В25 Цитомегаловирусная болезнь.
В27 Инфекционный мононуклеоз. ЭТИОЛОГИЯ
Герпесвирусы объединены в обширное семейство Herpesviridae, которое включает в себя более 100 представителей, из которых для человека патогенны 8 гер-песвирусов - HHV. Герпесвирусы - филогенетически древнее семейство крупных ДНК-вирусов; их подразделяют на три подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярнобиологических и иммунологических особенностей: α, β и γ (табл. 21.24).

α-Герпесвирусы, включающие HHV-1, HHV-2 и вирус ветряной оспы (Varicellazoster virus), характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпесвирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в нервных ганглиях.
β-Герпесвирусы, к этой группе относят ЦМВ, HHV-6, HHV-7, видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму; в культуре клеток легко возникает персистентная инфекция.
γ-Герпесвирусы характеризуются тропностью к лимфоидным клеткам (Т- и В-лимфоцитам), в которых они длительно персистируют и могут трансформировать, вызывая лимфомы, саркомы. В эту группу входят ЭБВ и HHV-8-герпесвирус.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Все герпесвирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду (его сборка происходит в ядре инфицированной клетки), оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
Вирионы герпесвирусов чрезвычайно термолабильны - инактивируются при температуре 5052 °С в течение 30 мин, при температуре 37,5 °С - в течение 20 ч, устойчивы при температуре -70 °С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50% растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпесвирусы выживают в течение 2 ч, на пластике и дереве - до 3 ч, во влажных медицинских вате и марле - в течение всего времени их высыхания при комнатной температуре (до 6 ч). Уникальные биологические свойства всех герпесвирусов человека - это тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека, способность интегрироваться в геном клетки-хозяина, системности воздействия на макроорганизм. Персистенция представляет собой способность
герпесвирусов непрерывно или циклично реплицироваться в инфицированных клетках, что создает постоянную угрозу реактивации инфекционного процесса. Латенция герпесвирусов - это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпесвируса) ганглиев чувствительных нервов. Штаммы герпесвирусов обладают неодинаковой способностью к персистенции и латенции, и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпесвируса выделяют свой темп персистенции и латенции. Среди изученных наиболее активны в этом отношении ВПГ, наименее - ЭБВ.
ЭПИДЕМИОЛОГИЯ
Источник герпесвирусов - больные острыми формами болезней (стоматит, генитальный герпес, ветряная оспа и др.) и здоровые лица, инфицированные соответствующим вирусом, которые периодически выделяют его в окружающую среду со слюной, назофарингеальным секретом, секретом слизистых оболочек половых органов. Установлено, что к 18 годам более 90% жителей городов инфицированы одним или несколькими из 8 клинически значимых герпесвирусов (ВПГ типа 1 и 2, вирус ветряной оспы, ЦМВ, ЭБВ, HHV-6 и -8). В большинстве случаев инфицирование происходит при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т.п.), воздушно-капельным путем. Доказаны также половой, вертикальный и трансфузионный пути передачи инфекции.
ПАТОГЕНЕЗ
Инфицирование человека герпесвирусами сопровождается клиническими симптомами соответствующей острой инфекции, в среднем не более чем у 50% людей, в основном у детей: внезапная экзантема (HHV-6), афтозный стоматит (ВПГ типа 1 или 2), ветряная оспа (вирус ветряной оспы Varicella-zoster virus), ИМ (ЭБВ), мононуклеозоподобный синдром (ЦМВ). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпесвируса, влияние на течение острых и рецидивирующих герпесвирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онтогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
При снижении иммунореактивности организма герпесвирусы выступают в качестве вирусовоппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями течению основного заболевания. Вызываемые ВПГ, ЦМВ, ЭБВ заболевания рассматривают как СПИД-индикаторные в связи с их частым обнаружением и активной репликацией. Доказана роль некоторых герпесвирусов (HHV-8, ЦМВ, ЭБВ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфо-мы Беркитта, В-
клеточной лимфомы, лимфогранулематоза, лимфоэпителиомы слюнных желез, лимфопролиферативных посттрансплантационных лимфом, рака грудной железы, аденокарциномы кишечника и простаты, карциномы цервикаль-ного канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации - 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
Все известные герпесвирусные инфекции могут рецидивировать, однако порог и причины трансформации острой формы в рецидивирующую для каждого типа герпесвируса индивидуальны. Например, рецидивирование инфекций, вызванных ВПГ, нередко возникает на фоне стрессов, неспецифических эндокринных
нарушений, изменения географической зоны проживания, гиперинсоляции и др. У пожилых людей, перенесших в детском возрасте ветряную оспу, рецидив инфекции, вызванной вирусом ветряной оспы (Varicella-zoster virus), протекает в форме опоясывающего герпеса. Субклинические рецидивы ЦМВИ чаще всего наблюдают у беременных и больных, получающих иммуносупрессивную терапию. В то же время инфекция, вызванная ЭБВ, рецидивирует крайне редко и только у больных с врожденным или приобретенным иммунодефицитом.
Клонирование герпесвирусов происходит по следующей схеме: спонтанная случайная адсорбция исходного «материнского» вируса на поверхности клетки-мишени, «раздевание вириона» - расщепление оболочки и капсида, инфильтрация вирусной ДНК в ядро клеткимишени, формирование и созревание «дочерних» вирионов путем почкования на ядерной мембране. Все эти превращения идут под управлением ферментных систем вируса. В процессе созревания «дочерних» вирионов их оболочки, капсиды и ДНК формируются из имеющихся внутри инфицированной клетки аминокислот, белков, липопротеидов и нуклеозидов. Эти молекулы поступают в инфицированную клетку из межклеточного пространства по мере истощения внутриклеточных резервов. Первая генерация «дочерних» герпесвирусов начинает поступать в межклеточные пространства, кровь, лимфу и другие биологические среды примерно через 18 ч. В свободном состоянии герпесвирусы находятся в течение весьма непродолжительного периода (от 1 до 4 ч) - именно такова типичная продолжительность периода острой интоксикации при герпесвирусных инфекциях. Срок жизни каждой генерации образовавшихся и адсорбированных герпесвирусов в среднем составляет 3 сут.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина инфекции, вызванной ВПГ, вирусом ветряной оспы (Varicella-zoster virus), ЭБВ и ЦМВ, вирусом герпеса человека 6, 7, 8 типа изложена в соответствующих главах руководства.
ДИАГНОСТИКА
Для диагностики герпетических инфекций на практике применяют методы ИФА, метод иммунофлюоресцирующих антител, ИБ, ПЦР, электронную микроскопию.
ЛЕЧЕНИЕ
Лечение герпетических инфекций остается сложной задачей. Длительный хронический процесс приводит к негативной иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакций клеточного иммунитета, снижению неспецифической защиты организма, выражающейся в снижении способности лейкоцитов продуцировать α- и γ-ИФН, гипоиммуногло-булинемии, сенсибилизации к антигенам вируса. Учитывая этиологию, патогенез, клиническую симптоматику, для терапии герпетических
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
заболеваний были предложены многочисленные препараты этиотропного и иммунокорригирующего действия, которые подразделяют на три группы по механизму действия (см. главу «Противовирусные препараты»).
21.11.1. Герпетическая инфекция
ГИ (простой герпес, herpes simplex) - широко распространенная антропонозная вирусная болезнь c преимущественно контактным механизмом передачи возбудителя, характеризующаяся поражением кожи, слизистых, глаз, нервной системы и хроническим рецидивирующим течением.
КОДЫ ПО МКБ-10
B00.0 Герпетическая экзема.
B00.1 Герпетический везикулярный дерматит.
B00.2 Герпетический вирусный гингивостоматит и фарингостоматит.
B00.3 Герпетический вирусный менингит (G02.0*).
B00.4 Герпетический вирусный энцефалит (G05.1*).
B00.5 Герпетическая вирусная болезнь глаз.
B00.7 Диссеминированная герпетическая вирусная болезнь.
B00.8 Другие формы герпетической вирусной инфекции.
B00.9 Герпетическая вирусная инфекция неуточненная. ЭТИОЛОГИЯ
Возбудитель - ВПГ типа 1 и 2 (вирус герпеса человека типа 1 и 2),
семейства Herρesviridae, подсемейства Alρhaherρesviruses, рода Simplexvirus. Согласно таксономии, ВПГ имеет криптограмму: D/2:92-102/8,5:Se/S:V/O. Размер вируса 120-150 нм. Геном ВПГ представлен двуспиральной линейной ДНК, молекулярная масса около 100 Да. Капсид имеет икосадельтаэдрическую форму и состоит из 162 капсомеров. Репликация вируса и сборка нуклеокапсидов происходят в ядре инфицированной клетки. Вирус обладает выраженным цитопатическим действием, вызывая гибель пораженных клеток, однако проникновение ВПГ в некоторые клетки (в частности нейроны) не сопровождается репликацией вируса и гибелью клетки. Клетка оказывает на вирусный геном угнетающее влияние, приводя его в латентное состояние, когда существование вируса совместимо с ее нормальной активностью. Через какое-то время может произойти активация вирусного генома с последующей репликацией вируса, в некоторых случаях вновь могут появляться герпетические высыпания, что свидетельствует о реактивации и переходе латентной формы инфекции в манифестную. Геномы ВПГ-1 и ВПГ-2 на 50% гомологичны. Оба вируса могут вызывать поражения кожи, внутренних органов, нервной системы, гениталий. Однако ВПГ-2 вызывает поражения гениталий значительно чаще. Есть данные, свидетельствующие о возможности мутации ВПГ с приобретением новых антигенных свойств. ВПГ устойчив к высушиванию, замораживанию, при температуре 50-52 °С инак-тивируется в течение 30 мин. Липопротеидная оболочка вируса растворяется под действием спиртов и кислот. Обычные дезинфицирующие средства существенного влияния на ВПГ не оказывают. Ультрафиолетовое облучение быстро инактивирует вирус.
ЭПИДЕМИОЛОГИЯ
ГИ распространена повсеместно. Антитела к ВПГ обнаруживают более чем у 90% населения в возрасте старше 40 лет. Эпидемиология ГИ, вызванной вирусами ВПГ-1 и ВПГ-2, различна. Первичное инфицирование ВПГ-1 происходит в первые годы жизни (от 6 мес до 3 лет), чаще всего проявляется везикулезным стоматитом.
Антитела к ВПГ-2 обнаруживают, как правило, у лиц, достигших половой зрелости. Наличие антител и их титр коррелируют с половой активностью. У 30% лиц, имеющих антитела к ВПГ-2, в анамнезе есть указания на перенесенную или текущую инфекцию половых органов, сопровождаемую высыпаниями.
По данным ВОЗ, в мире вирусом ВПГ-1 инфицированы около 3,7 млрд человек в возрасте до 50 лет (67% населения), вирусом ВПГ-2 - около 417 млн человек в возрасте от 15 до 49 лет (11%). Заражение ВПГ-2 увеличивает риск заражения и передачи ВИЧ. Распространенность инфекции наивысшая в Африке (87%) и самая низкая в странах Америки (40-50%).
Заболеваемость ГИ в России с 2001 по 2011 гг. увеличилась практически в 2 раза (на 84,96%):
с11,3 случаев до 20,9 случаев на 100 тыс. населения. В России 18-20 млн больных ГИ. Рецидивирующими формами герпеса страдают от 10 до 20% населения, а ежегодный прирост равен 15-17%. Тяжелый генитальный герпес у 5% больных обусловлен ВПГ-1. Инфицирование ВПГ-1 на поздних стадиях беременности более опасно, чем ВПГ-2. Оставаясь на 6-м месте в общей структуре инфекций, передаваемых половым путем, доля генитального сепсиса увеличилась
с1,46% в 2001 г. до 5,43% в 2011 г., т.е. в 3,72 раза.
Источник ВПГ-1 - человек в период реактивации ГИ с выделением вируса в окружающую среду. Бессимптомное выделение со слюной ВПГ-1 отмечено у 2-9% взрослых и у 5-8% детей. Источник ВПГ-2 - больные генитальным герпесом и здоровые лица, в секрете слизистой оболочки половых органов которых содержится ВПГ-2.
Различны и механизмы передачи ВПГ-1 и ВПГ-2. Ряд авторов относят ВПГ-1 к инфекции с аспирационным механизмом передачи возбудителя. Однако, хотя инфицирование ВПГ-1 происходит в детском возрасте, в отличие от других детских капельных инфекций для инфекции ВПГ-1 очаговость (например, в детских учреждениях) и сезонность не характерны. Основные субстраты вируса - слюна, секрет слизистой оболочки ротоглотки, содержимое герпетических пузырьков, то есть передача вируса происходит путем прямого или непрямого (игрушки, посуда, другие ослюненные предметы) контакта. Поражение респираторного тракта, наличие катаральных явлений, обеспечивающих воздушно-капельный путь передачи возбудителя, мало значимы.
Основной механизм передачи ВПГ-2 - также контактный, но реализуется он преимущественно половым путем. Поскольку и передача ВПГ-1 также возможна половым путем (орально-генитальные контакты), ГИ относят к заболеваниям, передаваемым половым путем. ВПГ можно обнаружить в слюне и половых путях у клинически здоровых лиц. Однако при наличии активных проявлений инфекции частота выделения вируса возрастает в несколько раз, а титр вируса в пораженных тканях - в 10-1000 раз и более. Возможна трансплацентарная передача вируса при наличии у беременной рецидива ГИ, сопровождаемого вирусемией. Однако чаще инфицирование плода происходит при прохождении через родовые пути.
Передача вируса возможна при гемотрансфузии и трансплантации органов. Восприимчивость высокая. В результате перенесенной ГИ формируется нестерильный иммунитет, который в силу многообразных эндо- и экзогенных причин может нарушаться.
ПРОФИЛАКТИКА
Лицам с симптомами орального герпеса следует избегать орального контакта с другими людьми и совместного пользования предметами, которые были в контакте со слюной. Им следует также воздерживаться от оральных половых сношений, чтобы не допустить передачу ВПГ-1 половому партнеру. Лицам с симптомами генитального герпеса следует воздерживаться от половых сношений, пока у них наблюдаются проявления генитального герпеса.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Лица, инфицированные ВПГ-1, не могут заразиться повторно, однако могут заразиться ВПГ- 2. Систематическое и правильное пользование презервативами предупреждает распространение генитального герпеса. Однако презервативы обеспечивают лишь частичную защиту, поскольку ВПГ может находиться на участках кожи, не защищенных презервативом.
Предотвращение первичного инфицирования вирусом генитального герпеса особенно важно в поздние сроки беременности, поскольку именно в этот период существует максимальный риск развития неонатального герпеса.
Специфическая профилактика направлена на предупреждение рецидивов ГИ путем комплексного применения противовирусных препаратов, противогерпети-ческой вакцины и иммуномодуляторов (см. раздел «Лечение»).
ПАТОМОРФОЛОГИЯ
Вследствие экссудативного воспаления в эпидермисе образуются пузырьки - баллонирующая дегенерация эпителия. Первоначально возникают очаговые изменения в клетках шиповидного слоя, одновременно образуются многоядерные клетки, затем накапливается серозный экссудат, который разъединяет пораженные клетки. Формируется полость пузырька, лежащего на инфильтрированном и отечном слое дермы. При генерализованных формах образуются мелкие очаги коагу-ляционного некроза во многих органах и системах. В ЦНС изменения встречаются преимущественно в сером, редко белом веществе и подкорковых центрах. Типичны диффузный васкулит, пролиферация глии, некроз нервных клеток.
ПАТОГЕНЕЗ
Вирус проникает в организм человека через слизистые оболочки, поврежденную кожу (в клетках ороговевающего эпителия кожи рецепторы к вирусу отсутствуют). Размножение вируса в эпителиальных клетках приводит к их гибели с образованием очагов некроза и везикул. Из первичного очага ВПГ путем ретроградного аксонального транспорта мигрирует в сенсорные ганглии: ВПГ-1 преимущественно в ганглий тройничного нерва, ВПГ-2 - в поясничные ганглии. В клетках сенсорных ганглиев репликация вируса подавляется, и он персистирует в них пожизненно. Первичная инфекция сопровождается формированием гуморального иммунитета, напряженность которого поддерживается периодической активацией вируса и проникновением его в слизистые оболочки ротоглотки (ВПГ-1) и половых органов (ВПГ-2). В некоторых случаях реактивация вируса сопровождается клиническими проявлениями в виде пузырьковых высыпаний (рецидив ГИ). Возможно и гематогенное распространение вируса, о чем свидетельствует появление генерализованных высыпаний, поражение ЦНС и внутренних органов, а также обнаружение вируса в крови методом ПЦР. Рецидивы ГИ связывают со снижением уровня специфического иммунитета под воздействием неспецифических факторов (избыточная инсоляция, переохлаждение, инфекционные болезни, стрессы). Как правило, от одного больного выделяют один штамм ВПГ, но у больных с иммунодефицитом можно выделить несколько штаммов одного и того же подтипа вируса. Иммунный статус организма во многом определяет вероятность развития заболевания, тяжесть течения, риск развития латентной инфекции и персистенции вируса, частоту последующих рецидивов. Имеет значение состояние как гуморального, так и клеточного иммунитета. Заболевание у лиц с нарушениями клеточного иммунитета протекает значительно тяжелее. У людей с иммунодефицитными состояниями инфекция может приобрести генерализованный характер с органными поражениями. Иммунная система при ГИ реагирует только на свободные вирусные частицы. На латентные вирусы, находящиеся в сенсорных ганглиях нервной системы и фагоцитах, иммунная система не отвечает.
КЛИНИЧЕСКАЯ КАРТИНА
Классификация
Общепринятая клиническая классификация отсутствует. Классификация по МКБ-10 не подразделяет врожденную и приобретенную первичную и рецидиви-
рующую ГИ. В зависимости от локализации патологического процесса выделяют герпетические поражения слизистых оболочек, кожи, глаз, нервной системы, внутренних органов, гениталий, генерализованный герпес.
Основные симптомы и динамика их развития
Клинические проявления и течение заболевания зависят от локализации процесса, возраста больного, иммунного статуса и антигенного варианта вируса. Первичная инфекция часто сопровождается системными признаками. При этом поражаются как слизистые оболочки, так и другие ткани. При первичном инфицировании продолжительность клинических проявлений и период выделения вируса больше, чем при рецидивах. Вирусы обоих подтипов могут вызывать поражение половых путей, слизистой ротовой полости, кожи, нервной системы. Клинически инфекция, вызванная ВПГ-1 или ВПГ-2, неразличима. Реактивация инфекции половых путей, вызванной ВПГ-2, происходит в 2 раза чаще, чем при поражении половых путей ВПГ-1. И наоборот, рецидивы поражений ротовой полости и кожи при инфекции ВПГ-1 происходят чаще, чем при инфекции ВПГ-2.
Врожденную ГИ наблюдают при наличии у беременных активных клинических проявлений болезни, сопровождаемых вирусемией. В зависимости от сроков инфицирования возможно формирование различных пороков развития плода (микроцефалия, микрофтальмия, хориоретинит, внутриутробная смерть) или гибель новорожденного при клинических проявлениях генерализованной ГИ.
Приобретенная ГИ возможна у новорожденных при инфицировании во время прохождения через родовые пути, а затем в различные периоды жизни, чаще в детском возрасте. Чем раньше происходит заражение, тем тяжелее протекает заболевание, но возможна и бессимптомная инфекция (антитела к ВПГ-1 определяют в сыворотке крови 60% детей в возрасте до 6 лет).
Инкубационный период при первичной ГИ составляет 5-10 дней (возможны колебания от 1 до 30 дней).
Поражение слизистых оболочек и кожи
Вирусный фарингит и стоматит наблюдают чаще у детей и лиц молодого возраста. Заболевание сопровождается лихорадкой, ознобом, недомоганием, раздражительностью, миалгией, затруднением при приеме пищи, гиперсаливацией. Увеличиваются и становятся болезненными поднижнечелюстные и шейные ЛУ. На слизистой оболочке щек, десен, внутренней поверхности губ, реже языка, мягкого и твердого нёба, нёбных дужек и миндалин появляются сгруппированные везикулы, после вскрытия которых образуются болезненные эрозии. Длительность заболевания - от нескольких дней до двух недель.
Герпетическое поражение глотки обычно приводит к экссудативному или язвенному изменению ее задней стенки и/или миндалин. В 30% случаев одновременно могут поражаться язык, слизистая оболочка щек и десен. Продолжительность лихорадки и шейной ЛАП составляет от 2 до 7 дней. У лиц с недостаточностью иммунитета вирус может распространиться вглубь слизистой оболочки и в подлежащие ткани, приводя к их разрыхлению, некрозу, кровоточивости, образованию язв, что сопровождается сильными болями, особенно при жевании.
При герпетическом поражении кожи возникают локальное жжение, зуд кожи, затем появляются отечность и гиперемия, на фоне которых образуются округлые сгруппированные папулы, которые в течение суток трансформируются в пузырьки с прозрачным содержимым,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
которое затем мутнеет. Пузырьки могут вскрываться с образованием эрозий, покрывающихся коркой, после отпадения которой обнаруживают эпителизированную поверхность. Длительность болезни 7-14 дней. Излюбленная локализация - губы, нос, щеки. Возможны диссеминированные формы с локализацией высыпаний на отдаленных участках кожи. Острые респираторные заболевания
ВПГ может вызвать заболевания, напоминающие ОРВИ, - так называемую герпетическую лихорадку, для которой характерно острое начало, выраженная температурная реакция, озноб и другие симптомы интоксикации. Катаральные явления в носоглотке выражены слабо. Возможно покашливание из-за сухости слизистых, умеренная гиперемия дужек и мягкого нёба. Такая симптоматика сохраняется в течение нескольких дней. Типичные для ГИ высыпания не всегда наблюдаются в первые дни болезни, а могут присоединиться на 3-5-й день от начала лихорадочного периода или отсутствовать.
Герпетическое поражение глаз
Герпетическое поражение глаз может быть первичным и рецидивирующим. Чаще развивается у мужчин в возрасте до 40 лет. Это одна из наиболее частых причин роговичной слепоты. Клинически различают поверхностные и глубокие поражения. К поверхностным относятся герпетический кератоконъюнктивит, древовидный кератит, герпетическая краевая язва роговицы; к глубоким - диско-видный кератит, глубокий кератоирит, паренхиматозный увеит, паренхиматозный кератит.
Поражение нервной системы
В этиологической структуре вирусных энцефалитов (менингоэнцефалитов) около 20% приходится на долю ГИ. Болеют преимущественно лица в возрасте 5-30 лет и старше 50 лет. Заболеваемость составляет 2-3 на 1 млн (данные США), в течение года заболеваемость равномерная. Герпетический менингоэн-цефалит в 95% случаев вызван ВПГ-1. Патогенез герпетического энцефалита различен. У детей и лиц молодого возраста первичное инфицирование может манифестировать энцефаломиелитом. Предполагают, что экзогенно попавший вирус проникает в ЦНС, распространяясь от периферии через обонятельную луковицу. У большей части взрослых сначала появляются клинические признаки генерализованной инфекции, иногда поражение слизистых оболочек и кожи, а затем поражение ЦНС, т.е. в ЦНС вирус может проникать гематогенно. Начало болезни всегда острое, с повышением температуры тела до высоких цифр. Больные жалуются на недомогание, упорную головную боль. У трети пациентов в первые дни болезни возможен умеренно выраженный респираторно-катаральный синдром. Герпетическая экзантема, стоматит возникают редко. Через 2-3 дня, иногда в более поздние сроки состояние больных резко и прогрессивно ухудшается за счет развития неврологических симптомов. Угнетается сознание, развивается менингеальный синдром, появляются генерализованные или фокальные тонико-клонические судороги, многократно повторяющиеся в течение дня. Общемозговая симптоматика сочетается с очаговыми проявлениями (нарушение корковых функций, поражение черепных нервов, гемипарезы, параличи). Дальнейшее течение болезни неблагоприятное, через несколько дней развивается кома. В течение всего заболевания температура тела остается высокой, лихорадка носит неправильный характер. При отсутствии противовирусной терапии летальность достигает 50-80%.
Характерная черта герпетического энцефалита - поражение височной доли с одной или с обеих сторон, что проявляется изменениями личности со снижением интеллектуальных функций и психическими расстройствами. Исследование СМЖ выявляет лимфоцитарный или смешанный плеоцитоз, повышение уровня белка, ксантохромию и появление примеси эритроцитов. Возможны изменения на ЭЭГ. При МРТ головного мозга через 5-7 дней обнаруживают очаги поражения с преобладанием изменений в передних отделах височных долей с преимущественным
вовлечением коры. Возможны атипичные проявления герпетического энцефалита с поражением ствола мозга и подкорковых структур, абортивное течение болезни, хроническое, рецидивирующее прогредиентное течение герпетического энцефалита по типу медленной инфекции ЦНС.
Серозный менингит. Серозный менингит чаще всего вызывает ВПГ-2, обычно заболевание развивается у лиц, страдающих генитальным герпесом. Доля инфекции ВПГ среди вирусных менингитов не превышает 3%. Клинически менингит характеризуется острым началом, головной болью, повышением температуры тела, светобоязнью, наличием менингеальных симптомов. При исследовании СМЖ наблюдают плеоцитоз от 10 до 1000 клеток в мкл (в среднем 300-400) лим-фоцитарного или смешанного характера. Клинические симптомы сохраняются около недели, затем самостоятельно исчезают без неврологических осложнений. Возможны рецидивы.
Другая частая форма поражения нервной системы ВПГ-2 - синдром радику-ломиелопатии. Клинически он проявляется онемением, парестезиями, болями в области ягодиц, промежности или нижних конечностей, тазовыми нарушениями. Возможно появление плеоцитоза, повышения концентрации белка в СМЖ. Есть данные о выделении ВПГ-1 из СМЖ больных шейным и поясничным радикулитом. Подтвердилось предположение о связи ВПГ-1 с поражением лицевого нерва (паралич Белла).
Герпетическое поражение внутренних органов
Герпетические поражения внутренних органов - результат вирусемии. В процесс вовлекается несколько органов, реже развивается изолированное поражение печени, легких, пищевода. Герпетический эзофагит может быть результатом непосредственного распространения инфекции из ротоглотки в пищевод или возникает вследствие реактивации вируса. В этом случае вирус достигает слизистой оболочки по блуждающему нерву. Доминирующие симптомы эзофагита: дисфагия, загрудинные боли и снижение массы тела. При эзофагоскопии обнаруживают множественные овальные язвы на эритематозном основании. Чаще поражается дистальный отдел, но по мере распространения процесса происходит диффузное разрыхление слизистой оболочки всего пищевода.
У лиц, перенесших пересадку костного мозга, в 6-8% случаев возможно развитие интерстициальной пневмонии, что доказано результатами биопсии и аутопсии. Смертность от герпетической пневмонии у больных с иммуносупрессией составляет до 80%.
Герпетический гепатит чаще развивается у лиц с иммунодефицитом, при этом повышается температура тела, появляется желтуха, увеличивается концентрация билирубина и активность аминотрансфераз в сыворотке крови. Иногда признаки гепатита сочетаются с проявлениями тромбогеморрагического синдрома.
Герпетическое поражение гениталий
Генитальный герпес чаще вызван ВПГ-2. Может быть первичным или рецидивирующим. Типичные высыпания локализованы у мужчин на коже и слизистой оболочке полового члена, у женщин - в уретре, на клиторе, во влагалище. Возможны высыпания на коже промежности, внутренней поверхности бедер. Образуются везикулы, эрозии, язвы. Отмечается гиперемия, отечность мягких тканей, локальная болезненность, дизурия. Могут беспокоить боли в пояснице, в области крестца, внизу живота, в промежности. У части больных, особенно при первичной ГИ, наблюдается паховый или бедренный лимфаденит. Существует связь между частотой генитального герпеса и раком шейки матки у женщин, раком предстательной железы у мужчин. У женщин рецидивы часто возникают перед началом менструации. Генерализованная герпетическая инфекция
Генерализованная ГИ развивается у новорожденных и у лиц с выраженной иммунной недостаточностью (при гематологических заболеваниях, длительном применении
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

глюкокортикоидов, цитостатиков, иммунодепрессантов, при ВИЧ-инфекции). Болезнь начинается остро, протекает тяжело с поражением многих органов и систем. Характерны высокая лихорадка, распространенные поражения кожи и слизистых оболочек, диарейный синдром, поражение ЦНС, гепатит, пневмония. Без применения современных противовирусных препаратов болезнь в большинстве случаев заканчивается летально.
Герпетическая инфекция у ВИЧ-инфицированных
ГИ у ВИЧ-инфицированных развивается обычно в результате активации латентной инфекции, при этом заболевание быстро приобретает генерализованный характер. Признаки генерализации - распространение вируса со слизистой оболочки полости рта на слизистую оболочку пищевода, появление язв. Часто герпетические поражения сочетаются с кандидозными. Поражения кожи у ВИЧ-инфицированных более обширные и глубокие с образованием не только эрозий, но и язв. Репаративные процессы происходят крайне вяло, характерно длительное незаживление язв и эрозий. Значительно возрастает число рецидивов.
Осложнения Осложнения обычно обусловлены присоединением вторичной микрофлоры. ДИАГНОСТИКА
Диагноз при поражении кожи и слизистых оболочек устанавливают на основании клинических данных (характерная герпетическая сыпь). При поражении ЦНС, висцеральных и генерализованных формах необходима лабораторная диагностика. Используют иммунологические методы, молекулярно-биологические и серологические методы. Вирусологический метод в клинической практике не используется, так как является очень трудоемким и дорогостоящим. Серологические методы диагностики по своей информативности уступают иммунологическим методам диагностики (РИФ и ИФА). Поражение ЦНС диагностируют с помощью ПЦР. Для исследования используют СМЖ. Кроме того, определяют уровень антител в СМЖ и сыворотке крови (не ранее 10-го дня болезни). На высоком уровне антитела сохраняются в течение 1,5-2 мес и более. Для обнаружения специфического антигена в СМЖ применяют РИФ. Важное значение имеет обнаружение при МРТ характерных энцефалитиче-ских очагов.
Дифференциальная диагностика
Дифференциальную диагностику проводят, в зависимости от локализации процесса и формы болезни, с герпангиной, опоясывающим герпесом, ветряной оспой, пиодермией (табл. 21.25).

Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Приказом Минздрава России от 9 ноября 2012 г. № 764н утвержден стандарт оказания специализированной медицинской помощи детям при инфекции, вызванной ВПГ, средней степени тяжести, и приказом Минздрава России № 876н - стандарт оказания специализированной медицинской помощи детям при хронических герпесвирусных инфекциях.
Показания к консультации других специалистов
Консультация невролога показана при поражении ЦНС, стоматолога - при стоматите, гинеколога - при генитальном герпесе, офтальмолога - при офтальмо-герпесе.
ЛЕЧЕНИЕ
Локализованные формы простого герпеса лечатся амбулаторно. Госпитализируются в инфекционный стационар лица с осложненными и генерализованными формами ГИ. Режим и питание определяются тяжестью течения болезни. Лечение назначают с учетом клинической формы болезни.
Этиотропное лечение ГИ предусматривает назначение противовирусных препаратов. Наиболее эффективен ацикловир (Зовиракс♠, Виролекс♠) назначается по 200 мг 5 раз в день, перорально, местно на пораженные участки кожи и слизистых накладывается 5% крем ацикловира 5 раз в день В связи с появлением штаммов ВПГ, резистентных к ацикловиру, используются также валацикловир (Валтрекс♠) 500 мг 2 р/сут и фамцикловир (фамвир) 250 мг 3 раза в день. Продолжительность лечения составляет 5-7 дней. Перспективен новый противовирусный препарат - лобукавирρ При генерализованных формах ГИ и герпетическом менингоэнце-фалите назначается ацикловир внутривенно в дозе 10 мг/кг массы тела каждые 8 ч в течение 10-14 дней. При герпетических кератитах применяется 3% глазная мазь ацикловира. Кроме того, могут быть использованы препараты с другим механизмом противовирусного действия. Аллокин-альфа♠ назначают в дозе 10,0, 1,0 и 0,1 мг в виде 3 п/к инъекций с интервалом через день. Местно на пораженные участки кожи и слизистых можно применять мазь тетрагидроксиглюкопирано-зилксантен (Алпизарин♠) - 2% для кожи, 5% для слизистых; госсипоρ - 2% мазь, мегосиновая мазь - 5%, смазывать слизистую рта 3-4 раза в день после еды. Десмодиума канадского травы экстракт (Хелепин-Д♠) при поражении слизистых оболочек - 1% мазь, при поражении кожи - 5% мазь, в тяжелых случаях внутрь 0,2 г 3 раза в день в течение 10-15 дней. Флореналевая 0,5% мазь применяется при кератитах и кератоконъюнктивитах до 2 раз в день, продолжительность лечения при поверхностных поражениях 10-14 дней, при глубоких до 1-1,5 мес.
Патогенетическая терапия включает в себя применение НПВС, особенно у больных с выраженными отеками, антигистаминные препараты, препараты, стимулирующие регенеративные и репаративные процессы (Солкосерил♠, шиповника семян масло, облепихи масло).
Интенсивную терапию проводят больным с висцеральными и осложненными формами. Кроме этиотропной противовирусной, назначают антибактериальную терапию. В случаях развития ОНГМ назначают антигипоксическую, противосудо-рожную, дегидратационную и противовоспалительную терапию.
В комплексной терапии ГИ применяют иммунологические средства, которые способствуют нормализации клеточного и гуморального иммунитета, активации системы ИФН. Часто используются средства иммунозаместительной терапии. Специфические иммуноглобулины применяются при тяжелых и генерализованных формах ГИ. Они назначаются внутривенно по 1,5-3 мл (0,05 мл/кг) через день или каждый день в течение 5-10 сут. Интерферон альфа-2а внутримышечно 1 млн МЕ 2 раза в день в течение 10 дней. Интерферон альфа-2b (Виферон♠) 1 млн МЕ по 2 свечи ежедневно с 12-часовым интервалом в течение 10 дней. При лечении гени-тального герпеса применяются индукторы ИФН [оксодигидроакридинилацетат натрия (Неовир♠), меглюмина акридонацетат (Циклоферон♠)]. В клинической практике чаще используется сочетанное применение противовирусных препаратов и средств с иммуномодулирующей активностью.
Профилактику рецидивов ГИ проводят с учетом локализации процесса (лабиальный, генитальный герпес), частоты рецидивов, иммунного и интер-феронового статуса организма, которые исследуют в межрецидивный период. Показаны природные адаптогены (элеутерококк, эхинацея). На фоне неспецифической профилактики вводят вакцину для профилактики герпетических инфекций (Витагерпавак♠): 0,2 мл внутрикожно 1 р/нед, 5 инъекций.
Примерные сроки нетрудоспособности
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Сроки нетрудоспособности зависят от формы и тяжести течения болезни.
В большинстве случаев герпетических поражений кожи и слизистых оболочек трудоспособность не нарушается или нарушается кратковременно (до 5 сут). При поражении ЦНС, глаз, генерализованных формах болезни сроки нетрудоспособности определяют индивидуально.
Диспансеризация
Диспансеризация не регламентирована. В диспансерном наблюдении нуждаются пациенты, перенесшие герпетическое поражение ЦНС, и лица с часто рецидивирующим герпесом для проведения противорецидивного лечения.
8. Хрянин А.А. Распространенность вируса простого герпеса 1-го и 2-го типов в Сибири: популяционное исследование // Российский журнал кожных и венерических болезней. - 2008, - № S1. - С. 9-13.
21.11.2. Ветряная оспа
Ветряная оспа (Varicella) - острая вирусная антропонозная инфекционная болезнь с аэрозольным механизмом передачи возбудителя, характеризуется лихорадкой, полиморфной макуло-папулезно-везикулезной сыпью, возможностью пожизненной персистенции возбудителя в организме.
КОДЫ ПО МКБ-10
В01 Ветряная оспа. В01.0. Ветряная оспа с менингитом (G02.0). B01.1 Ветряная оспа с энцефалитом (G05.1).
B01.2 Ветряная оспа с пневмонией (J17.1).
B01.8 Ветряная оспа с другими осложнениями.
B01.9 Ветряная оспа неосложненная. ЭТИОЛОГИЯ
Возбудитель - вирус ветряной оспы Varicella-zoster virus семейства Herρesviridae (герпесвирус 3 типа). Размер вируса от 150 до 200 нм, он находится в ветряноч-ных пузырьках в первые 3-4 дня болезни; после 7-го дня обнаружить вирус не удается. Геном имеет двуспиральную линейную молекулу ДНК, липидную оболочку. Репродуцируется только в ядре инфицированных клеток человека. Установлена идентичность вируса, вызывающего опоясывающий герпес, и вируса ветряной оспы. В окружающей среде вирус неустойчив и быстро погибает. В капельках слизи, слюны вирус сохраняется не более 10-15 мин. Нагревание, солнечные лучи, ультрафиолетовое излучение быстро инактивируют его.
ЭПИДЕМИОЛОГИЯ
Источник вируса - больной ветряной оспой и опоясывающим герпесом от последнего дня инкубационного периода до 5-го дня после появления последних высыпаний. Основной путь передачи - воздушно-капельный. Вирус способен распространяться на расстояния до 20 м (через коридоры в соседние комнаты квартиры и даже с одного этажа на другой). Возможен вертикальный механизм передачи вируса через плаценту. Восприимчивость к ветряной оспе очень высокая (более 90%), за исключением детей первых 3 мес жизни, у которых сохраняется пассивный иммунитет. Заболеваемость характеризуется выраженной сезонностью, достигая максимума в осенне-зимние месяцы. Болеют преимущественно дети. Постинфекционный иммунитет напряженный, поддерживается персистенцией вируса в организме. При снижении его напряженности возникает опоясывающий герпес.
Показатели заболеваемости этой инфекцией в России составляют от 320 до 780 на 100 тыс. населения (1980-2015 гг.). Абсолютное число заболевших - от 500 тыс. до 1150 тыс. случаев в год. Наиболее высокая заболеваемость среди детей в возрасте 3-6 лет, показатель заболеваемости которых более 7000 на 100 тыс. детей данного возраста.
Значимость ветряной оспы определяется также наличием хронической рецидивирующей формы инфекции - опоясывающего лишая, частота которого составляет около 70 на 100 тыс. переболевших ветряной оспой. Современный эпидемический процесс ветряной оспы характеризуется тенденцией к «повзрослению» инфекции. Риск осложнений и летальных исходов ветряной оспы у взрослых в 1020 раз выше, чем у детей. Увеличивается вероятность заболевания беременных и, следовательно, риск внутриутробного заражения новорожденных.
МЕРЫ ПРОФИЛАКТИКИ
Больных изолируют дома до 5-го дня со времени появления последнего свежего элемента сыпи, обычно не госпитализируют. Дети до 3 лет, ранее не болевшие, подлежат разобщению и наблюдению с 11 до 21-го дня с момента контакта. Контактным детям с отягощенным фоном рекомендовано введение иммуноглобулина человеческого нормального. Вирус нестойкий, поэтому дезинфекцию не проводят. Изоляции подлежат больные опоясывающим герпесом.
В настоящее время в категорию инфекций, управляемых вакцинопрофилакти-кой, переходят заболевания, вызванные вирусом Varicella-zoster, - ветряная оспа и опоясывающий лишай. В Национальный календарь прививок с 2014 г. включена вакцинация детей против ветряной оспы, зарегистрированы и разрешены к использованию в России две живые аттенуированные вакцины зарубежного производства.
ПАТОГЕНЕЗ
Входные ворота вируса ветряной оспы - слизистые оболочки ВДП, где происходит репликация вируса, далее по лимфатическим путям возбудитель проникает в кровь. В конце инкубационного периода развивается виремия. Вирус фиксируется в
клетках эктодермального происхождения, преимущественно в эпителиальных клетках кожи и слизистых оболочек дыхательных путей, ротоглотки. Возможно поражение межпозвоночных ганглиев, коры мозжечка и больших полушарий, подкорковых ганглиев. В редких случаях при генерализованной форме поражается печень, легкие, ЖКТ. В коже вирус вызывает формирование пузырьков, заполненных серозным содержимым, в котором вирус находится в высокой концентрации. При тяжелых генерализованных формах болезни везикулы и поверхностные эрозии обнаруживают на слизистых оболочках ЖКТ, трахеи, мочевого пузыря и почечных лоханок, уретры, конъюнктивы глаз. В печени, почках, легких и ЦНС выявляют мелкие очаги некроза с кровоизлияниями по периферии.
В патогенезе значительную роль отводят клеточному иммунитету, в основном системе Т- лимфоцитов, при угнетении которой наблюдают более тяжелое течение болезни. После стихания острых проявлений первичной инфекции вирус пожизненно персистирует в спинальных нервных ганглиях.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период длится от 10 до 21 дня, при введении иммуноглобулина человеканормальногоможет удлиняться до 28 дней.
Классификация Различают следующие клинические формы ветряной оспы.
• По течению: ◊ типичные; ◊ атипичные:
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
-рудиментарная; - геморрагическая; - гангренозная; - генерализованная.
• По тяжести: ◊ легкие; ◊ среднетяжелые; ◊ тяжелые:
-с выраженной общей интоксикацией;
-с выраженными изменениями на коже. Продромальные явления чаще отсутствуют, редко отмечают кратковременный субфебрилитет на фоне ухудшения общего самочувствия. Везикулы появляются обычно одновременно с повышением температуры или на несколько часов позднее. При обильной экзантеме температура может повышаться до 39 °С и выше. Высыпания появляются волнами на протяжении 2-4 дней и сопровождаются подъемом температуры. Сыпь локализована на лице, волосистой части головы, туловище и конечностях. На ладонях и подошвах она встречается только при обильных высыпаниях. Элементы сыпи вначале имеют вид мелких макуло-папул, которые в течение нескольких часов превращаются в везикулы круглой или овальной формы размером 2-5 мм. Они располагаются поверхностно, на неинфильтри-рованном основании, стенка их напряжена, блестящая, содержимое прозрачное, но в некоторых везикулах мутнеет. Везикулы однокамерные, при прокалывании иглой они полностью спадаются. Большинство везикул окружено узкой каймой гиперемии. Везикулы подсыхают через 2-3 дня, на их месте образуются корочки, которые отпадают через 2-3 нед. После отпадения корочек рубцы остаются только при расчесывании элементов сыпи. Высыпания наблюдаются и на конъюнктиве глаз, слизистых оболочках ротоглотки, иногда гортани, половых органов. Пузырьки на слизистых быстро превращаются в эрозии с желтовато-серым дном, которые через несколько дней эпителизируются. Высыпания на слизистой оболочке гортани и трахеи, сопровождаемые отеком слизистой оболочки, могут вызывать грубый кашель, охриплость голоса, в редких случаях - явления крупа. Высыпания на слизистой оболочке половых губ представляют угрозу развития вульвовагини-та. Высыпания часто сопровождаются увеличением ЛУ.
К концу 1-й недели болезни одновременно с подсыханием везикул нормализуется температура, улучшается самочувствие больного. В это время многих больных беспокоит кожный зуд.
В гемограмме в период высыпания наблюдают небольшую лейкопению и относительный лимфоцитоз, СОЭ обычно не увеличена.
Принято выделять типичную и атипичную ветряную оспу. К типичной относят случаи с характерной сыпью. Чаще всего типичная ветряная оспа протекает в легкой и среднетяжелой форме. Тяжелая форма болезни возникает редко, чаще у ослабленных детей и взрослых, для нее характерна ремиттирующая лихорадка до 6-8 сут. Отмечают головную боль, возможна рвота, менингеальный синдром, нарушение сознания, артериальная гипотензия, судороги. Сыпь обильная, крупная, метаморфоз ее замедлен, возможны элементы с пупковидным вдавлением в центре, напоминающие элементы сыпи при натуральной оспе.
К атипичным формам относят рудиментарную, буллезную, геморрагическую, гангренозную и генерализованную ветряные оспы.
Рудиментарную форму чаще наблюдают у детей, получавших иммуноглобулины, плазму в период инкубации. Сыпь необильная, розеолезно-папулезная с единичными очень мелкими везикулами. Общее состояние не нарушается.
Геморрагическая форма ветряной оспы встречается очень редко у резко ослабленных детей, страдающих гемобластозом или геморрагическими диатезами, на фоне приема глюкокортикоидов и цитостатиков. На 2-3-й день высыпания содержимое пузырьков приобретает геморрагический характер. Появляются кровоизлияния в кожу и слизистые
оболочки, носовые кровотечения и другие проявления геморрагического синдрома. Возможен летальный исход.
Очень редко встречается гангренозная форма ветряной оспы. Она развивается у истощенных больных, при плохом уходе, создающем возможность присоединения вторичной инфекции. Вначале отдельные пузырьки принимают геморрагический характер, затем в их окружении возникает значительная воспалительная реакция. В последующем образуется геморрагический струп, после отпадения которого обнажаются глубокие язвы с грязным дном и крутыми или подрытыми краями. Язвы, вследствие прогрессирующего гангренозного распада ткани, увеличиваются, сливаются, принимая значительные размеры. Нередко возникают осложнения гнойно-септического характера. Общее состояние больного тяжелое, течение болезни длительное.
Генерализованная (висцеральная) форма. Встречается главным образом у новорожденных, иногда у взрослых с иммунодефицитом. Характерна гипертермия, интоксикация, поражение внутренних органов. Летальность высокая. На вскрытии обнаруживают мелкие очаги некроза в печени, легких, поджелудочной железе, надпочечниках, тимусе, селезенке, костном мозге.
Ветряная оспа представляет опасность для плода и новорожденного. Если заболевание у женщины возникло в конце беременности, возможны преждевременные роды и мертворождения. При заболевании ветряной оспой в ранние сроки беременности может произойти внутриутробное заражение плода с развитием у него различных пороков развития. Вероятность заболевания новорожденных составляет 17%, их гибели - 30%. Врожденная ветряная оспа протекает тяжело, сопровождаясь тяжелыми висцеральными поражениями.
Осложнения
Ветряная оспа считается доброкачественным заболеванием, однако в ряде случаев могут развиться осложнения (примерно у 5% больных), иногда очень тяжелые.
Среди осложнений ветряной оспы наиболее часты различные гнойные поражения кожи - абсцессы, фурункулы, флегмоны. В основе гнойных осложнений кожи лежит суперинфекция стафилококками или стрептококками. Одной из частых причин инфицирования является расчесывание больным зудящих элементов сыпи. В большинстве случаев входными воротами гнойной инфекции становится поврежденный ветряночный пузырек.
Менее распространенные осложнения: поражение ЦНС, миокардит, пневмония, кератит, нефрит, артрит, гепатит.
Клинически выраженная картина ветряночной пневмонии - одна из особенностей ветряной оспы взрослых. При этом непосредственно перед высыпанием, чаще одновременно с массовым высыпанием и повышением температуры, у больного появляются одышка, цианоз, кашель с кровянистой мокротой, боли в груди. Физикальные изменения часто отсутствуют или очень незначительны. На рентгенограмме видны обильные мелкие очажки на всем протяжении легких. Клинические проявления пневмонии наблюдаются в течение 7-10 дней, рентгенологические изменения - до 1-2 мес.
Поражение ЦНС чаще наблюдается у подростков и взрослых с 5-10 до 21 дня болезни и имеет различную локализацию. Поражаются нейроциты головного и спинного мозга, оболочки мозга, иногда периферические нервы. Для ветряночных энцефалитов характерны независимость от обилия высыпания и тяжести течения болезни. Одновременно с кратковременными подъемами температуры у больных появляются вялость, головная боль, рвота, а через несколько дней - симптомы поражения вещества головного мозга: расстройства сознания, нарушения психики, судороги, атаксия, при миелитах и энцефаломиелитах - вялые параличи. Возможно изолированное поражение периферических нервов. Описаны поздние ветряночные энцефалиты с парезом конечностей и полной временной потерей зрения. Среди
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
энцефалитов, дающих менее благоприятный прогноз, можно упомянуть формы с поражениями подкорковых узлов. Для ветряночного энцефалита и других неврологических осложнений ветряной оспы характерна обратимость процесса, обычно благоприятный исход. К исключительно редким последствиям ветряночных менингоэнцефалитов относится нарушение психики с последующим снижением интеллекта. При исследовании СМЖ обнаруживают повышенное содержание белка, 1-3-значный лимфоцитарный или смешанный плеоцитоз, нормальное или повышенное содержание глюкозы.
Поражение почек - редкое осложнение. Нефрит при ветряной оспе чаще появляется на 2-й неделе к концу высыпания. Он начинается остро: с подъема температуры до высоких показателей, рвоты, головной боли и болей в животе. Изменения в моче бывают умеренными и выражаются в появлении высокой протеинурии, микрогематурии, единичных цилиндров. Это осложнение протекает легко и к 12-15-му дню болезни регрессирует.
ДИАГНОСТИКА
Диагностика ветряной оспы в типичных случаях не представляет затруднений. Диагноз устанавливают главным образом на основании клинических данных, при этом учитывают эпидемиологический анамнез.
В РФ лабораторная диагностика инфекций, вызванных вирусом Varicella-zoster, недостаточно широко применяется.
Общеприняты следующие лабораторные критерии диагностики инфекции, вызванной вирусом Varicella-zoster.
1.Вирусологические методы диагностики инфекций, вызванных вирусом Varicellazoster. Выделение культуры вируса из клинического образца (куль-туральный метод) -
«золотой стандарт» в диагностике ветряной оспы. Однако метод является очень трудоемким, так как для выявления цитопати-ческого эффекта требуется более недели. Исследование везикулярной жидкости дает положительный результат только в первые дни после появления сыпи.
2.РИФ - эффективный метод, основанный на прямом обнаружении антигена вируса. Преимуществами метода являеются доступность результата через несколько часов и возможность проведения дифференциальной диагностики между ВПГ, вирусом Varicellazoster и поксвирусами. Доступны коммерческие наборы на основе моноклональных антител к гликопротеину Е, конъюгиро-ванные с флюоресцеином.
3.ПЦР - самый чувствительный и эффективный метод. Исследуются образцы содержимого элементов сыпи, кровь, носоглоточная слизь, СМЖ (при поражении ЦНС). ПЦРисследование носоглоточных смывов иногда может помочь в диагностике на поздних стадиях болезни после исчезновения сыпи. Метод может быть использован для проведения диагностики на стадии образования корочек, когда культуральный метод уже неэффективен. В специализированных лабораториях ПЦР может использоваться для дифференциации между диким типом и вакцинальным штаммом вируса.
Дифференциальная диагностика
Дифференцировать ветряную оспу необходимо от герпетической сыпи при простом герпесе, опоясывающего герпеса, везикулезного риккетсиоза, импетиго и натуральной оспы (табл. 21.26). Необходимо исключать герпетическую экзему Капоши, а также инфекции, вызванные вирусами Коксаки и ЕСНО.

Показания к консультации других специалистов
При развитии осложнений, связанных с поражением нервной системы, показана консультация невролога.
Консультация хирурга при глубоком поражении кожи и подкожной клетчатки. Пример формулировки диагноза В.02 Ветряная оспа средней тяжести, неосложненная.
Показания к госпитализации
Госпитализируют больных при тяжелом, осложненном течении болезни и по эпидемиологическим показаниям.
ЛЕЧЕНИЕ Медикаментозная терапия
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
У больных с нормальным иммунитетом ветряная оспа требует только профилактики осложнений. Тщательный уход за кожей помогает избежать бактериальной суперинфекции. В качестве этиотропной терапии с первых суток заболевания назначают ацикловир (800 мг внутрь 5 р/сут в течение 5-7 дней) - подросткам и взрослым, у детей младше 12 лет - 20 мг/кг внутрь 4 р/сут. Больным с ослабленным иммунитетом при ветряной оспе ацикловир вводят внутривенно в дозе 10-12,5 мг/кг каждые 8 ч в течение 7 дней.
При развитии ветряночной пневмонии показаны ингаляции ИФН лейкоцитарного человеческого [ИФН-α (Лейкинферон¤)].
Местно используют 5-10% раствор калия перманганата или 1% спиртовой раствор бриллиантового зеленого с целью предотвращения присоединения вторичной инфекции и более быстрого подсыхания пузырьков. Для уменьшения зуда кожу обрабатывают глицеролом или обтирают водой с уксусом или спиртом. Назначают антигистаминные препараты (клемастин, дифенгидрамин, цетиризин, акривастин). При геморрагических формах показаны менадиона натрия бисульфита (Викасол♠), рутинρкальция хлорид.
Из физиотерапевтических процедур используют ультрафиолетовое облучение в течение 2-3 дней для ускорения отпадения корочек.
Примерные сроки нетрудоспособности 10 дней.
Диспансеризация Диспансерное наблюдение в течение месяца. ПАМЯТКА ДЛЯ ПАЦИЕНТОВ
Следует ограничивать физическую нагрузку, избегать переохлаждений, питаться сбалансированно. Для профилактики ветряной оспы показана вакцинация, предупреждающая заболевание, а при его развитии избежать осложнений со стороны нервной системы.
21.11.3. Опоясывающий лишай
Опоясывающий лишай (Herpes zoster, shingles, zona) - острая, циклически протекающая инфекционная болезнь, возникающая в результате реактивации латентного вируса Varicellazoster virus (вирус ветряной оспы), характеризующаяся лихорадкой, интоксикацией, появлением болей и везикулезных высыпаний в зоне иннервации отдельных чувствительных нервов, поражением ПНС и ЦНС.
КОДЫ ПО МКБ-10
В.02 Опоясывающий лишай. B.02.0 Опоясывающий лишай с энцефалитом (G05.1*). B.02.1 Опоясывающий лишай с менингитом (G02.0*).
B.02.2 Опоясывающий лишай с другими осложнениями со стороны нервной системы.
B.02.3 Опоясывающий лишай с глазными осложнениями. B.02.7 Диссеминированный опоясывающий лишай. B.02.8 Опоясывающий лишай с другими осложнениями. B.02.9 Опоясывающий лишай без осложнений.
ЭТИОЛОГИЯ
Возбудитель - вирус семейства Herpesviridae, вызывающий опоясывающий лишай и ветряную оспу (см. раздел «Ветряная оспа»).
ЭПИДЕМИОЛОГИЯ
Болеют лица, ранее перенесшие ветряную оспу. Опоясывающий лишай - вторичная эндогенная инфекция по отношению к ветряной оспе.
Заболевание наблюдают у лиц всех возрастных групп - от детей первых месяцев жизни до людей пожилого и старческого возраста, ранее перенесших ветряную оспу. 75% случаев приходится на людей старше 45 лет, в то время как на долю детей и подростков - менее 10%. Заболеваемость составляет 12-15 на 100 тыс. населения. Больные опоясывающим лишаем являются источниками инфекции для лиц, не болевших ветряной оспой. Индекс контагиозности - не выше 10%, так как, в отличие от ветряной оспы, вирус на поверхности слизистой оболочки дыхательных путей обнаруживают непостоянно.
Случаи опоясывающего лишая регистрируют в течение всего года, выраженной сезонности болезнь не имеет.
МЕРЫ ПРОФИЛАКТИКИ
Меры в очаге такие же, как при ветряной оспе. В рамках вопроса о взаимосвязи опоясывающего лишая и ветряной оспы следует рассматривать и все другие профилактические мероприятия.
ПАТОГЕНЕЗ
Опоясывающий лишай развивается как вторичная эндогенная инфекция у лиц, перенесших ветряную оспу в клинически выраженной, стертой или латентной форме, вследствие реактивации вируса ветряной оспы (Varicella-zoster virus), интегрированного в геном клеток в черепных и спинномозговых сенсорных ганглиях. Интервал между первичным инфицированием и клиническими проявлениями опоясывающего лишая исчисляется десятками лет, но может быть коротким и составлять несколько месяцев. Механизм реактивации вируса ветряной оспы недостаточно изучен. К факторам риска относят пожилой и старческий возраст, заболевания, сопровождающиеся иммуносупрессией или иммунодефицитом, прежде всего онкологические, гематологические, ВИЧ-инфекцию, наркоманию; применение глюкокортикоидов, цитостатиков, лучевую терапию. В группу риска входят реципиенты трансплантируемых органов. Реактивация вируса может быть спровоцирована стрессовыми состояниями, физическими травмами, переохлаждением, инфекционными заболеваниями, алкоголизмом.
В результате активизации вируса ветряной оспы (Varicella-zoster virus) развивается ганглионеврит с поражением межпозвоночных ганглиев, ганглиев черепных нервов и задних корешков спинного мозга. В процесс могут вовлекаться вегетативные ганглии, вещество и оболочки головного и спинного мозга. Могут быть поражены внутренние органы. Распространяясь центробежно по нервным стволам, вирус попадает в клетки эпидермиса и вызывает в них воспалительно-дегенеративные изменения, что проявляется высыпаниями в пределах зоны иннервации соответствующего нерва, т.е. дерматома. Возможно и гематогенное распространение вируса, о чем свидетельствует генерализованная форма болезни, полиорганность поражений.
Патологоанатомическая картина заболевания обусловлена воспалительными изменениями в спинальных ганглиях и связанных с ними участках кожного покрова, а также в задних и передних рогах серого вещества, задних и передних корешках спинного мозга и мягких мозговых оболочках. Морфология везикул идентична таковым при ветряной оспе.
КЛИНИЧЕСКАЯ КАРТИНА Течение болезни разделяют на 4 периода:
◊продромальный (прегерпетическая невралгия);
◊стадия герпетических высыпаний;
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
◊реконвалесценции (после исчезновения экзантемы);
◊остаточных явлений.
У взрослых наиболее ранний признак болезни - появление корешковых болей. Боль может быть интенсивной, носит приступообразный характер, часто ее сопро-
вождает местная гиперестезия кожи. У детей болевой синдром менее выражен и встречается в 2-3 раза реже. В продромальном периоде появлению высыпаний предшествуют слабость, недомогание, повышение температуры тела, познабливание, боль в мышцах и суставах, головная боль. В области пораженного дерматома возможно чувство онемения, покалывания или жжения. Продолжительность продромального периода варьирует от 1 до 7 сут.
Период клинических проявлений характеризуется поражением кожи и/или слизистых оболочек, проявлениями интоксикации и неврологическими симптомами.
Везикулы являются основным элементом локальных и генерализованных кожных высыпаний при опоясывающем лишае, они развиваются в ростковом слое эпидермиса.
Сначала экзантема имеет вид розово-красного пятна, которое быстро превращается в тесно сгруппированные везикулы («гроздья винограда») с прозрачным серозным содержимым, располагающиеся на гиперемированном и отечном основании. Размер их не превышает нескольких миллиметров. Содержимое пузырьков быстро мутнеет, затем состояние больных улучшается, нормализуется температура, везикулы подсыхают и покрываются корочкой, после которой не остается рубца. Полное заживление происходит в течение 2-4 нед. При опоясывающем лишае сыпь имеет сегментарный, односторонний характер, захватывая обычно 2-3 дер-матома. Преимущественная локализация поражений кожи при опоясывающем лишае отмечена в зоне иннервации ветвей тройничного нерва, далее в убывающей последовательности - в области грудных, шейных, пояснично-крестцовых, шейно-грудных сегментов.
У 10% больных наблюдают распространение экзантемы за границы пораженных дерматомов. Диссеминацию может сопровождать появление множественных или единичных элементов сыпи, с более коротким периодом обратного развития. Генерализацию экзантемы отмечают через 2-7 дней от момента появления высыпаний в области дерматома, ей может сопутствовать ухудшение общего состояния. Кроме типичных везикулезных высыпаний, у ослабленных больных экзантема может трансформироваться в буллезную форму, приобретать геморрагический характер и сопровождаться некрозом. Некротические высыпания наблюдаются у лиц с иммунодефицитом (ВИЧ-инфекция, онкологические болезни). В этих случаях на месте высыпаний остаются рубцы. В зоне высыпаний определяют распространенную гиперемию кожи, выраженный отек подлежащих тканей. При локализации высыпаний в зоне первой ветви тройничного нерва часто наблюдают выраженный отек. Экзантему сопровождают увеличение и умеренная болезненность регионарных ЛУ. У детей могут быть признаки катарально-респираторного синдрома. Повышенная температура тела держится несколько дней, сопровождается умеренно выраженными симптомами интоксикации. В этом периоде болезни возможны общемозговые и менингеальные симптомы в виде адинамии, сонливости, диффузной головной боли, головокружения, рвоты. Длительность клинических проявлений опоясывающего лишая в среднем 2-3 нед.
Постгерпетическая невралгия (ПГН) развивается непосредственно через 2-3 нед после болезни. Боль, как правило, носит приступообразный характер и усиливается в ночные часы, становясь нестерпимой. Продолжительность ПГН составляет от 2-3 мес до года и более. Боль обусловлена различными механизмами. На ранних стадиях течения болезни формируются анатомические и функциональные изменения, приводящие к развитию ПГН, что объясняет связь тяжести первичной боли с последующим развитием ПГН, а также причины неудач
противовирусной терапии в профилактике ПГН. К предрасполагающим факторам к развитию ПГН относят: возраст более 50 лет, женский пол, наличие продромы, массивные кожные высыпания, локализацию высыпаний в области иннервации тройничного нерва или плечевого сплетения, наличие иммунодефицита. При ПГН можно выделить три типа боли: постоянная, глубокая, тупая, давящая или жгучая боль; спонтанная,
периодическая, колющая, стреляющая, похожая на удар током; алло-диния. Болевой синдром, как правило, сопровождается нарушениями сна, потерей аппетита и снижением веса, хронической усталостью, депрессией, что приводит к социальной дезадаптации пациентов.
Опоясывающий лишай может протекать только с симптомами радикулярных болей, с одиночными везикулами или вообще без высыпаний. Диагноз в таких случаях устанавливают на основании нарастания титров антител к вирусу ветряной оспы (Varicella-zoster virus).
Заболевание может протекать в легкой, среднетяжелой и тяжелой форме. Возможно абортивное или затяжное течение. Критериями тяжести считают выраженность интоксикации, признаков поражения ЦНС, характер местных проявлений (вид экзантемы, интенсивность болевого синдрома).
Повторные случаи опоясывающего лишая характерны для больных ВИЧ-инфекцией или онкологическими заболеваниями (лейкоз, рак легкого). При этом локализация высыпаний может соответствовать локализации опухоли, поэтому повторный опоясывающий лишай считают сигналом для углубленного обследования больного. В патологии опоясывающего лишая значительное место занимает поражение глаз (кератит), которое определяет тяжесть болезни и служит причиной снижения остроты зрения.
В структуре клинических проявлений опоясывающего лишая значительное место занимает поражение нервной системы.
Сенсорные нарушения в зоне высыпаний: корешковые боли, парестезии, сегментарные расстройства поверхностной чувствительности наблюдают постоянно. Основной признак - локальные боли, интенсивность которых колеблется в широких пределах. Боль имеет ярко выраженную вегетативную окраску (жгучая, приступообразная, усиливающаяся в ночные часы). Нередко она сопровождается эмоционально-аффективными реакциями. Корешковые парезы топически приурочены только к определенным зонам высыпаний: поражения глазодвигательных нервов, лицевого нерва (варианты синдрома Ханта), парезы верхних конечностей, мышц брюшной стенки, нижних конечностей, сфинктера мочевого пузыря. Развиваются, как правило, на 6-15-й день болезни.
Πолирадикулоневропатия - очень редкий синдром у больных опоясывающим лишаем; описано всего несколько десятков наблюдений.
Серозный менингит - один из основных синдромов в картине опоясывающего лишая. При исследовании СМЖ в ранние сроки обнаруживают двухили трехзначный лимфоцитарный или смешанный плеоцитоз, в том числе при отсутствии общемозговых и менингеальных явлений (клинически «асимптомный» менингит). Энцефалит и менингоэнцефалит наблюдают в остром периоде. Признаки
поражения ЦНС возникают на 2-8-й день высыпаний в дерматоме. КТ позволяет выявить очаги деструкции мозговой ткани уже с 5-го дня энцефалита.
Опоясывающий лишай у детей. Имеются единичные сообщения о заболевании детей ОГ. К факторам риска возникновения ОГ у детей относятся: ветряная оспа у матери во время беременности или первичная инфекция VZV в 1-й год жизни. Риск заболевания ОГ повышен у детей, которые переболели ветряной оспой в возрасте до 1 года. Опоясывающий герпес у детей протекает не так тяжело, как у пожилых пациентов, с меньшей выраженностью болевого синдрома; ПГН также встречаются редко.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Опоясывающий герпес у больных ВИЧ-инфекцией. Риск развития ОГ у больных ВИЧинфекцией более высок, и у них чаще развиваются рецидивы заболевания. Возможно появление дополнительных симптомов за счет вовлечения двигательных нервов (в 5-15% случаев). Течение ОГ более длительное, нередко развиваются гангренозные и диссеминированные формы (25-50%), при этом у 10% больных
выявляются тяжелые поражения внутренних органов (легких, печени, головного мозга). При ВИЧ-инфекции отмечаются частые рецидивы ОГ как в пределах одного, так и нескольких смежных дерматомов.
Опоясывающий лишай у беременных. Первичная инфекция проявляется, как правило, ветряной оспой, что, по данным статистики, составляет 7:10 тыс. беременных. Заболевание может осложняться развитием пневмонии, энцефалита. Герпетическое инфицирование в I триместре беременности приводит к первичной плацентарной недостаточности и, как правило, сопровождается прерыванием беременности. Наличие инфекции должно служить основанием для проведения интенсивной профилактики последствий нарушения гемодинамики (плацентарной недостаточности, внутриутробной гипоксии, задержки внутриутробного развития плода).
ДИАГНОСТИКА
Для лабораторного подтверждения диагноза используют обнаружение антигена вируса при микроскопии или с помощью иммунофлюоресцентного метода, серологические методы. Перспективна ПЦР.
Дифференциальная диагностика
Диагностика опоясывающего лишая в подавляющем большинстве случаев не вызывает затруднений. Ведущее положение сохраняют клинические критерии, главным из которых считают наличие характерной экзантемы со своеобразной сегментарной топографией, почти всегда односторонней. В отдельных случаях необходимо дифференцировать опоясывающий лишай от зостериформного простого герпеса, клинически мало отличимого. Буллезную форму опоясывающего лишая дифференцируют с рожей, поражениями кожи при онкологических, гематологических заболеваниях, сахарном диабете и ВИЧ-инфекции. При невралгии, предшествующей высыпаниям, дифференциальную диагностику проводят с невралгиями другой этиологии и заболеваниями органов, расположенных в зоне предстоящих высыпаний (кератит, глаукома, синусит, пульпит, плеврит, стенокардия и т.д.).
Показания к консультации других специалистов
При развитии осложнений, связанных с поражением нервной системы, необходима консультация невролога, консультация офтальмолога - при поражении глаз.
Пример формулировки диагноза В.02.1 Опоясывающий лишай. Осложнение: серозный менингит. Показания к госпитализации
Госпитализируют больных при тяжелом течении опоясывающего лишая и выраженном болевом синдроме.
В обязательной госпитализации нуждаются больные с генерализованной формой инфекционного процесса, поражением первой ветви тройничного нерва и ЦНС.
ЛЕЧЕНИЕ Медикаментозная терапия
Схема лечения состоит из назначения противовирусных препаратов, патогенетической терапии и симптоматических средств. Препараты выбора этиотропной терапии:
◊ацикловир - 800 мг 5 р/сут, в течение 7-10 дней. При тяжелых формах ацикловир вводят внутривенно по 10 мг/кг каждые 8 ч, продолжительность лечения 7 дней; ◊ пенцикловир - 250 мг 3 р/сут, 7 дней;
◊валацикловир - 1000 мг 3 р/сут, 7 дней. Возможно сочетанное использование противовирусной терапии и глюкокорти-коидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных
аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, т.е. она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН, т.е. данная комбинация может быть использована в старших возрастных
группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона.
Патогенетическая терапия предполагает назначение дипиридамола в качестве дезагреганта по 50 мг 3 р/сут, 5-7 дней. Показана дегидратационная терапия (аце-тазоламид, фуросемид). Целесообразно назначение иммуномодуляторов [проди-гиозанρ, аргинил-альфа-аспартил- лизил-валил-тирозил-аргинин (Имунофан♠), азоксимера бромид и др.].
При ПГН используют НПВС (индометацин, диклофенак и др.) в сочетании с анальгетиками, седативными средствами и физиотерапией. Возможна витаминотерапия (В1, В6, В12), ее предпочтительнее проводить липофильной модификацией витаминов - мильгаммой «N», обладающей более высокой биодоступностью.
Втяжелых случаях при выраженной интоксикации проводят дезинтокси-кационную терапию с внутривенным введением декстрана [ср. мол. масса 35 00045 000] (Реополиглюкин♠), гидроксиэтилкрахмала (Инфукол ГЭК♠), усиливают дегидратацию, в небольших дозах применяют антикоагулянты, глюкокортикоиды. Местно - 1% раствор бриллиантового зеленого, 5-10% раствор калия перман-ганата, в фазе корочек - 5% мазь висмута субгаллата; при вялотекущих процессах - мазь диоксометилтетрагидропиримидин (Метилурацил♠), Солкосерил♠. Антибиотики назначают только больным опоясывающим лишаем с признаками активации бактериальной флоры.
Вцелом терапевтическую стратегию определяют стадией и выраженностью процесса, особенностями клинического течения опоясывающего лишая, общим состоянием и возрастом больного.
Лечение ПГН и офтальмогерпеса проводится соответственно врачами неврологами и офтальмологами.
Герпферон®, мазь - оригинальная лекарственная форма рекомбинантного интерферона, ацикловира и лидокаина для лечения герпетической инфекции кожи и слизистых оболочек.
Герпферон® эффективен против вируса простого герпеса (ВПГ-1 и ВПГ-2) и вируса Varicellazoster. Уникальный состав препарата обуславливает его комплексное противовирусное и иммуномодулирующее действие. Благодаря введению лидокаина достигается выраженный обезболивающий эффект, что значительно улучшает качество жизни пациентов.
Препарат не имеет мировых аналогов и защищен патентом.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Проведенные клинические исследования убедительно доказали безопасность и хорошую переносимость препарата, подтвердили его высокую терапевтическую эффективность, особенно при рецидивирующем течении заболевания.
Мазь Герпферон® наносится на пораженные участки кожи и слизистых оболочек 5 раз в день с интервалом 4 ч. Продолжительность курса лечения - 5-10 дней.
Полная информация о препарате представлена в инструкции по медицинскому применению.
На правах рекламы
Примерные сроки нетрудоспособности 7-10 дней при неосложненном течении болезни. Диспансеризация
Диспансерное наблюдение при тяжелом течении болезни и наличии осложнений в течение 3- 6 мес, при невралгии - до 1 года и более.
ПАМЯТКА ДЛЯ ПАЦИЕНТА
Следует избегать переохлаждения и других стрессовых состояний, ограничивать физическую нагрузку, питаться сбалансированно. Необходимо также проверить состояние иммунной системы.
21.11.4. Инфекционный мононуклеоз
Синонимы: Эпштейна-Барр ИМ, болезнь Филатова, железистая лихорадка, моноцитарная ангина, болезнь Пфейффера; англ. infectious mononucleosis; нем. infectiose mononukleos.
Антропонозная инфекционная болезнь, вызываемая ЭБВ, преимущественно с аэрозольным механизмом передачи возбудителя. Характеризуется циклическим течением, лихорадкой, острым тонзиллитом, фарингитом, выраженным поражением лимфоидной ткани, гепатоспленомегалией, лимфомоноцитозом, появлением в крови атипичных мононуклеаров.
КОД ПО МКБ-10
B27.0 Мононуклеоз, вызванный гамма-герпетическим вирусом. ЭТИОЛОГИЯ
Возбудитель - ЭБВ относят к семейству вирусов герпеса
(семейство Herpesviridae, подсемейство Gammaherpesvirinae род Lymρhocryρtovirus), HHV-4. Содержит ДНК, имеющую форму двойной спирали, в которой закодировано более 30 полипептидов. Вирион состоит из капсида диаметром 120-150 нм, окруженного оболочкой, содержащей липиды. Капсид вириона имеет форму икосаэдра. ЭБВ обладает
тропизмом к В-лимфоцитам из-за наличия на их поверхности рецепторов для этого вируса. Вирус может длительное время персистировать в клетках хозяина в латентной форме. Имеет антигенные компоненты, общие с другими вирусами семейства герпес-вирусов. Антигенно однороден, содержит следующие специфические антигены: вирусный капсидный антиген, ядерный антиген, ранний антиген и мембранный антиген. Антигены вируса индуцируют продукцию антител - маркеров ЭБВ-инфекции. Устойчивость в окружающей среде низкая. Вирус быстро погибает при высыхании, под действием высоких температур (кипячение, авто-клавирование), при обработке всеми дезинфицирующими средствами.
В отличие от других герпетических вирусов ЭБВ вызывает не гибель, а пролиферацию пораженных клеток, потому его относят к онкогенным вирусам, в частности, он является этиологическим фактором саркомы Беркитта, назофарингеаль-ной карциномы, В-клеточных лимфом, некоторых иммунодефицитов, волосистой лейкоплакии языка при ВИЧ-инфекции. ЭБВ после первичного инфицирования персистирует в организме пожизненно, интегрируясь
в геном пораженных клеток. При нарушениях в иммунной системе и воздействии других факторов возможна реактивация вируса.
ЭПИДЕМИОЛОГИЯ
Антропоноз; источник возбудителя инфекции - больной человек, в том числе со стертой формой болезни и вирусоноситель. Эпидемический процесс в популяции поддерживается за счет вирусоносителей, лиц, инфицированных ЭБВ, которые периодически выделяют вирус в окружающую среду со слюной. В смывах из ротоглотки у серопозитивных здоровых лиц в 15-25% случаев обнаруживают вирус. При заражении добровольцев смывами из зева больных ИМ возникали отчетливые лабораторные изменения, характерные для ЭБВ-ИМ (умеренный лейкоцитоз, увеличение числа одноядерных лейкоцитов, повышение активности аминотрансфераз, гетерогемагглютининов), однако развернутой клинической картины мононуклеоза не было ни в одном случае. Частота выделения вируса резко возрастает при нарушениях в иммунной системе. Основной путь передачи - воздушно-капельный. Заражение также возможно путем прямого (при поцелуях, половым путем) и непрямого контакта через предметы обихода, игрушки, контаминированные слюной, содержащей вирус. Латентная инфекция в В-лимфоцитах периферической крови доноров создает опасность заражения при гемотрансфузиях.
Человек высоковосприимчив к ЭБВ. Сроки первичного инфицирования зависят от социально-бытовых условий. В развивающихся странах и социально неблагополучных семьях большинство детей инфицируются в возрасте от 6 мес до 3 лет, причем, как правило, болезнь протекает бессимптомно или с клинической картиной ОРЗ. Все население инфицируется к 18 годам. В развитых странах и социально благополучных семьях инфицирование происходит в более старшем возрасте, чаще в подростковом или юношеском. К 35 годам инфицируется основная масса населения. При инфицировании в возрасте старше 3 лет у 45% развивается типичная картина ИМ. Иммунитет у перенесших ИМ пожизненный, нестерильный, повторные заболевания не наблюдаются, но возможны различные проявления ЭБВ-инфекции, обусловленные реактивацией вируса. Чаще болеют лица мужского пола. Очень редко болеют лица старше 40 лет. Однако у ВИЧ-инфицированных реактивация ЭБВ может наступать в любом возрасте.
ПАТОГЕНЕЗ
При попадании ЭБВ со слюной воротами инфекции и местом его репликации служит ротоглотка. Инфекцию поддерживают В-лимфоциты, являющиеся основной мишенью вируса. Репликация вируса происходит также в эпителии слизистой оболочки ротоглотки и носоглотки, протоков слюнных желез. Во время острой
фазы болезни специфические вирусные антигены обнаруживают в ядрах более 20% циркулирующих В-лимфоцитов. После стихания инфекционного процесса вирусы можно обнаружить лишь в единичных В-лимфоцитах и эпителиальных клетках носоглотки.
Инфицированные вирусом В-лимфоциты под влиянием мутагенов вируса начинают интенсивно пролиферировать, трансформируясь в плазматические клетки. В результате поликлональной стимуляции В-системы в крови возрастает уровень Ig, в частности, появляются гетерогемагглютинины, способные агглютинировать чужеродные эритроциты (барана, лошади), что используют для диагностики. Пролиферация В-лимфоцитов также приводит к активации Т-супрессоров и естественных киллеров. Т-супрессоры подавляют пролиферацию В-лимфоцитов. В крови появляются их молодые формы, которые морфологически характеризуют как атипичные мононуклеары (клетки с крупным, как у лимфоцита, ядром и широкой базофильной цитоплазмой). Т-киллеры разрушают инфицированные В-лимфоциты путем антителозависимого цитолиза. Активация Т- супрессоров приводит к снижению иммунорегуляторного индекса ниже 1,0, что способствует присоединению бактериальной инфекции. Активация лимфатической системы проявляется увеличением ЛУ, миндалин, других лимфоидных образований глотки, селезенки и печени.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Гистологически выявляют пролиферацию лимфоидных и ретикулярных элементов, в печени - перипортальную лимфоидную инфильтрацию. В тяжелых случаях возможны некрозы в лимфоидных органах, появление лимфоидных инфильтратов в легких, почках, ЦНС и других органах.
КЛИНИЧЕСКАЯ КАРТИНА
ИМ имеет цикличное течение. Инкубационный период, по различным данным, варьирует от 4 до 50 дней.
Классификация
Выделяют типичные и атипичные формы болезни, по тяжести - легкие, средней тяжести и тяжелые формы болезни. В настоящее время описана хроническая форма ИМ.
Основные симптомы и динамика их развития
Периоды болезни: начальный, разгара и реконвалесценции. В большинстве случаев болезнь начинается остро, с повышения температуры тела, появления болей в горле и увеличения ЛУ. При постепенном начале болезненность и увеличение ЛУ предшествуют повышению температуры на несколько дней, затем появляются боли в горле и лихорадка. В любом случае к концу недели начальный период болезни завершается и выявляют весь симптомокомплекс болезни.
Для периода разгара болезни характерны: лихорадка, полиаденопатия, поражение рото- и носоглотки, гепатолиенальный синдром, гематологический синдром.
Лихорадочная реакция многообразна как по уровню, так и по продолжительности лихорадки. В начале болезни температура чаще субфебрильная, в разгаре может достигать 38,5-40,0 °С в течение нескольких дней, затем снижается до субфебрильного уровня. В некоторых случаях субфебрилитет отмечают на протяжении всей болезни, в редких случаях лихорадка отсутствует. Длительность лихорадки от 3-4 сут до 3-4 нед, иногда больше. При длительной лихорадке выявляют ее волнообразность. Особенность ИМ - относительно слабая выраженность и своеобразие интоксикационного синдрома. Больные обычно сохраняют подвижность, аппетит снижен, доминируют миастения, утомляемость, в тяжелых случаях больные из-за миастении не могут стоять, с трудом сидят. Интоксикация сохраняется несколько дней.
Полиаденопатия - постоянный симптом. Чаще всего увеличиваются латеральные шейные ЛУ, часто они видны на глаз, размеры их варьируют от фасолины до куриного яйца. В некоторых случаях появляется отек клетчатки вокруг увеличенных ЛУ,
изменяются контуры шеи (симптом «бычьей шеи»). Кожа над ЛУ не изменена, при пальпации они чувствительные, плотноэластической консистенции, не спаяны между собой и с окружающими тканями. Увеличиваются также и другие группы узлов: затылочные, подчелюстные, кубитальные. В некоторых случаях, по-видимому, при половом пути заражения доминирует увеличение ЛУ пахово-бедренной группы. При этом отмечают боли в крестце, пояснице, резкую слабость, изменения в ротоглотке выражены слабо. Полиаденопатия регрессирует медленно и, в зависимости от тяжести течения болезни, сохраняется от 3-4 нед до 2-3 мес или принимает персистирующий характер.
Также постоянным симптомом считают увеличение и отечность нёбных миндалин, которые иногда смыкаются между собой, затрудняя ротовое дыхание. Одновременное увеличение носоглоточной миндалины и отечность слизистой оболочки нижней носовой раковины затрудняют носовое дыхание. При этом появляется пастозность лица, гнусавость голоса. Больной дышит открытым ртом. Возможна асфиксия. Задняя стенка глотки также отечна, гиперемирована, с гиперплазией боковых столбов и лимфоидных фолликулов задней стенки глотки (гра-нулематозный фарингит). Часто на нёбных и носоглоточных миндалинах
появляются грязно-серые или желтовато-белые наложения в виде островков, полосок, иногда они сплошь покрывают всю поверхность миндалин. Наложения рыхлые, легко снимаются шпателем, растворяются в воде. Редко отмечают фибринозные налеты или поверхностный некроз ткани миндалин. Налеты могут появиться с первых дней болезни, но чаще на 3-7-й день. При этом появление налетов сопровождается болью в горле и значительным повышением температуры тела.
Увеличение печени и селезенки - почти постоянный симптом, особенно у детей. Печень увеличивается с первых дней болезни, максимально в ее разгаре. Она чувствительна при пальпации, плотноватая спленомегалия сохраняется до 1 мес. Часто выявляют умеренное повышение активности АЛТ и АСТ, реже - потемнение мочи, легкую желтуху и гипербилирубинемию. В этих случаях отмечают тошноту, снижение аппетита. Длительность желтухи не превышает 3-7 сут, течение гепатита доброкачественное. Селезенка увеличивается на 3-5-е сутки, максимально - ко 2-й неделе и перестает быть доступной для пальпации к концу 3-й недели болезни. Она становится малочувствительной при пальпации. В отдельных случаях спленомегалия резко выражена (край определяется на уровне пупка). В этом случае есть угроза ее разрыва.
Картина крови имеет решающее диагностическое значение. Характерен умеренный лейкоцитоз (12-25 × 109/л), лимфомоноцитоз до 80-90%, относительная нейтропения со сдвигом влево. Часто обнаруживают плазматические клетки. СОЭ увеличивается до 20-30 мм/ч. Особенно характерно появление атипичных моно-нуклеаров с первых дней болезни или в ее разгаре. Количество их варьирует от 10 до 50%, как правило, они обнаруживаются в течение 10-20 сут, т.е. могут быть выявлены в двух анализах, взятых с интервалом 5-7 сут.
Из других симптомов болезни следует отметить сыпь, обычно папулезную. Она наблюдается у 10% больных, а при лечении ампициллином - у 80%. Возможна умеренная тахикардия.
Из атипичных форм описывают стертую форму, при которой отсутствует часть основных симптомов и для подтверждения диагноза необходимы серологические тесты.
В редких случаях наблюдают висцеральную форму болезни с тяжелыми полиорганными поражениями и неблагоприятным прогнозом.
Описана хроническая форма болезни, которая развивается после перенесенного острого ИМ. Она характеризуется слабостью, утомляемостью, плохим сном,
головными болями, миалгией, субфебрилитетом, фарингитом, полиаденопатией, иногда экзантемой. Постановка диагноза возможна только при использовании лабораторных тестов.
Осложнения
При инфекционном мононуклеозе осложнения возникают редко, но могут быть очень тяжелыми. К гематологическим осложнениям относят аутоиммунную гемолитическую анемию, тромбоцитопению и гранулоцитопению. Неврологические осложнения:
менингоэнцефалит, энцефалит, параличи черепных нервов, в том числе паралич Белла или прозоплегия (паралич мимической мускулатуры, обусловленный поражением лицевого нерва), синдром Гийена-Барре, полиневрит, поперечный миелит, психоз. Возможны кардиологические осложнения (перикардит, миокардит). Со стороны органов дыхания иногда отмечают интерстициальную пневмонию.
В редких случаях на 2-3-й неделе заболевания происходит разрыв селезенки, сопровождаемый резкими, внезапно возникающими болями в животе. Единственный метод лечения в данном случае - спленэктомия.
Летальность и причины смерти
Причинами смерти при мононуклеозе могут быть энцефалит, обструкция дыхательных путей и разрыв селезенки.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

ДИАГНОСТИКА
Диагностика основывается на комплексе ведущих клинических симптомов (лихорадка, ЛАП, увеличение печени и селезенки, изменения периферической крови).
Помимо исследования картины крови, диагностика основывается на обнаружении гетерофильных антител и специфических антител к ЭБВ (табл. 21.27).
Гетерогенные антитела. Используют модифицированные реакции гетерогемаг-глютинации: реакция Пауля-Буннелля (РА бараньих эритроцитов) в настоящее время в связи с низкой специфичностью не рекомендуется. Реакция Гоффа-Бауэра - агглютинация сывороткой крови больного формалинизированных лошадиных эритроцитов (4% взвесь), реакция на стекле, результаты учитывают через 2 мин; возможно применение для экспресс-диагностики. Титры гетерофильных антител достигают максимума на 4-5-й неделе от начала болезни, затем снижаются и могут сохраняться 6-12 мес. Однако эта реакция также может давать ложноположительные и ложноотрицательные результаты.
Наиболее специфичны и чувствительны методы, основанные на определении антительных маркеров антигенов ЭБВ (РНИФ, ИФА), которые позволяют определить форму инфекции.
Антитела (IgM) к капсидному антигену при инфекционном мононуклеозе обнаруживаются с конца инкубационного периода, они определяются не более 2-3 мес. IgG к капсидному антигену появляются в остром периоде инфекции и сохраняются пожизненно. Антитела к ранним антигенам (IgM) появляются в разгаре болезни у 70-80% больных и быстро исчезают, а антитела к IgG сохраняются длительно. Повышение титра антител к ранним антигенам характерно для реактивации ЭБВ-инфекции и для опухолей, обусловленных этим вирусом. Антитела против ядерного антигена появляются через 6 мес после инфицирования и сохраняются в невысоких титрах пожизненно.
В настоящее время широко используется ПЦР для выявления в крови с первых дней болезни специфических фрагментов генома ЭБВ в крови, при поражении ЦНС - в СМЖ.
Его применение эффективно для обнаружения ЭБВ-инфекции у новорожденных, когда определение серологических маркеров малоэффективно вследствие несформировавшейся иммунной системы, а также в сложных и сомнительных случаях при диагностике ЭБВ у взрослых.
Дифференциальная диагностика
Необходимо дифференцировать с лихорадочными заболеваниями, протекающими с ЛАП и гепатолиенальным синдромом, с синдромом острого тонзиллита и с наличием атипичных мононуклеаров в крови (табл. 21.28).
Показания к консультации других специалистов
Всех больных с диагнозом ИМ и при подозрении на него необходимо обследовать на ВИЧинфекцию в остром периоде болезни, через 1, 3 и 6 мес в периоде реконвалесценции.
При сохранении гематологических сдвигов показаны консультация и обследование у гематолога, при появлении болей в животе - консультация хирурга и УЗИ органов брюшной полости.
При появлении неврологической симптоматики - консультация невропатолога. Пример формулировки диагноза
В27.0 Инфекционный мононуклеоз. Среднетяжелое течение. Осложнение: сыпь после приема ампициллина.
Показания к госпитализации
Больных госпитализируют по клиническим показаниям: длительная высокая лихорадка, желтуха, осложнения, диагностические трудности.
ЛЕЧЕНИЕ Режим. Диета
Режим полупостельный. Стол № 5. Лечение ИМ чаще всего проводят в амбулаторных условиях. Рекомендуют обильное питье, полоскание ротоглотки растворами антисептиков, НПВС, симптоматическую терапию.
Медикаментозная терапия
In vitro ацикловир и ИФН-α подавляют репликацию ЭБВ, однако их клиническая эффективность не доказана. При выраженных некротических изменениях на миндалинах назначают антибактериальные препараты (фторхинолоны, макролиды). Ампициллин противопоказан из-за возникновения у 80% больных сыпи.
Глюкокортикоиды могут существенно сократить длительность лихорадки и воспалительных изменений в ротоглотке, однако их рекомендуют назначать лишь при тяжелых формах, при обтурации дыхательных путей, при гемолитической анемии и неврологических осложнениях.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/


При разрыве селезенки необходимо немедленное хирургическое вмешательство. При значительном увеличении селезенки ограничивают двигательный режим, заниматься спортом можно не ранее 6-8 мес после выписки из стационара. При выявлении гепатита - соблюдение диеты № 5 в течение 6 мес после перенесенного ЭБВ-ИМ. Ограничение физической нагрузки на 3 мес.
Прогноз
Благоприятный. Летальные исходы казуистически редки (разрыв селезенки, обструкция дыхательных путей, энцефалит).
Примерные сроки нетрудоспособности 15-30 сут.
Диспансеризация
Не регламентирована. Рекомендуют наблюдение терапевта (педиатра) при пер-систирующей полиаденопатии.
ПАМЯТКА ДЛЯ ПАЦИЕНТА
Соблюдение полупостельного режима в течение всего лихорадочного периода. Ограничение физической активности. Обильное питье, диета № 5.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Своевременное применение лекарственных препаратов. Исследование периферической крови.
Диспансерное наблюдение у врача-инфекциониста, терапевта. 21.11.5. Цитомегаловирусная инфекция
ЦМВИ - хроническая антропонозная болезнь вирусной этиологии, характеризующаяся многообразием форм патологического процесса от латентной инфекции до клинически выраженного генерализованного заболевания.
КОДЫ ПО МКБ-10
В25 (Цитомегаловирусная болезнь). В25.0+ Цитомегаловирусный пневмонит (J7.1*). В25.1+ Цитомегаловирусный гепатит (К77.0*). В25.2+ Цитомегаловирусный панкреатит (К87.1*). B25.8 Другие цитомегаловирусные болезни.
B25.9 Цитомегаловирусная болезнь неуточненная. В27.1 Цитомегаловирусный мононуклеоз. Р35.1 Врожденная цитомегаловирусная инфекция.
В20.1 Болезнь, вызванная ВИЧ, с проявлениями ЦМВ заболевания. ЭТИОЛОГИЯ
Возбудитель - цитомегаловирус вида - Cytomegalovirus
hominis семейства Herpesviridae подсемейства Betaherρesvirinae рода Cytomegalovirus. ЦМВ - крупный ДНК-содержащий вирус с невысокой цитопатогенностью в культуре клеток, медленной репликацией, низкой вирулентностью. Инактивируется при температуре 56 °С, длительно сохраняется при комнатной температуре, быстро теряет инфекционность при замораживании до -20 °С. ЦМВ обладает относительной нечувствительностью к действию ИФН, менее чувствителен по сравнению с ВПГ и вирусом Varicella-zoster к противогерпетическим препаратам (ацикловиру и его аналогам). В международных каталогах зарегистрировано 3 штамма ЦМВ - AD 169, Davis и Kerr. Этиологическое значение для человека имеют все 3 штамма ЦМВ. От одного человека может быть выделено несколько штаммов вируса.
ЭПИДЕМИОЛОГИЯ
Цитомегалия - широко распространенная инфекция. Серопозитивные лица среди взрослого населения нашей страны составляют 73-98%. В Москве заболеваемость ЦМВИ в 2006 г. у детей в возрасте до 14 лет составляла 3,24 на 100 тыс. населения, а среди взрослого населения - 0,24 на 100 тыс. По данным Роспотребнадзора (2011 г.), в РФ в 2010 г. по сравнению с 2009 г. заболеваемость ЦМВИ возросла на 30,5%. В документах 2014-2015 гг. сведения о заболеваемости не приведены.
Источником ЦМВИ является человек. ЦМВИ характеризуется состоянием длительного латентного носительства вируса с его периодическим выделением в окружающую среду. Возбудитель может находиться в любой биологической жидкости, а также в органах и тканях, используемых для трансплантации. Наличие в крови специфических антител в абсолютном большинстве случаев означает присутствие в организме самого вируса. У 20-30% здоровых беременных ЦМВ присутствует в слюне, 3-10% - в моче, 2-20% - в цервикальном канале или вагинальном секрете. Вирус обнаруживают в грудном молоке 20-60% серопозитивных матерей. Установлена значительная частота выявления (до 35%) и длительность присутствия (в среднем до 22 мес) ЦМВ в сперме. Кровь около 1% доноров содержит ЦМВ. Заражение вирусом возможно половым, парентеральным, вертикальным путями, а также контактнобытовым путем, через слюну при близких контактах.
ЦМВИ - классическая врожденная инфекция, частота ее составляет 0,2-2,5% среди новорожденных. В США с населением 315 млн человек ежегодно рождаются 20-40 тыс. ЦМВ-инфицированных детей. Источником внутриутробного инфицирования является мать, у которой развивается активная ЦМВИ вследствие первичного или повторного заражения вирусом, его реактивации на фоне иммунологической дисфункции, гормональных изменений. Характерен трансплацентарный гематогенный путь заражения плода.
Наибольший риск для плода представляет первичная инфекция на ранних сроках беременности. У 0,7-4% женщин во время беременности происходит первичное инфицирование, при этом в 24-75% случаев инфекция передается плоду. Риск передачи ЦМВ от матери к плоду составляет 17% в случае заражения ЦМВ от 1 до 10 нед до наступления беременности, 35% - в случае заражения от 1 до 5 нед беременности и 30%, 38% и 72% при развитии острой ЦМВИ в I, II и III триместрах беременности соответственно. При реинфекции (повторном заражении ЦМВ) или реактивации вируса частота его передачи плоду существенно меньше: от 0,2% до 20% случаев.
Наличие ЦМВ в генитальном тракте у беременных женщин - причина заражения ребенка во время родов. Частота обнаружения ЦМВ в цервикальном канале, вагинальном секрете здоровых беременных женщин составляет от 2-8% до 18-20%. С увеличением срока беременности вероятность обнаружения ЦМВ в вагинальном содержимом возрастает, у ВИЧинфицированных беременных ДНК ЦМВ в соскобах из цервикального канала была выявлена в 33,3% случаев. Риск интранатального инфицирования ребенка при наличии вируса в генитальном тракте матери составляет 50-57%.
Основной путь заражения в возрасте до года - передача вируса через грудное молоко. ДНК ЦМВ обнаруживают в молоке до 60% серопозитивных матерей. ЦМВ выделяется с грудным молоком в первые 2-12 нед лактации. Дети серопози-тивных матерей, находящиеся на грудном вскармливании более 1 мес, инфицируются в 40-76% случаях. Суммарно до 2-3% новорожденных заражаются ЦМВ в период внутриутробного развития, 4-5% - интранатально; к первому году жизни количество инфицированных детей составляет от 10 до 60%.
Контактно-бытовой путь передачи вируса у детей младшего возраста играет существенную роль. Инфицированность ЦМВ детей, посещающих детские дошкольные учреждения, выше (80%), чем «домашних» детей того же возраста (20%). Количество серопозитивных лиц увеличивается с возрастом. Около 40-80% подростков и 60-100% взрослого населения имеют антитела класса IgG к ЦМВ. Заражение взрослого человека наиболее вероятно половым путем в связи с присутствием вируса в сперме, реже - в вагинальном секрете. Гемотрансфузии и парентеральные манипуляции также могут приводить к заражению ЦМВ. Переливание цельной крови и ее компонентов, содержащих лейкоциты, ведет к передаче вируса с частотой 0,14-10 на 100 доз. Крайне опасно заражение новорожденного ЦМВ при переливании не прошедшей соответствующую обработку крови серопозитивного донора.
Клинически выраженная ЦМВИ - одно из самых значимых инфекционных осложнений при трансплантации органов. Около 75% реципиентов имеют лабораторные признаки активной ЦМВИ в первые 3 мес после трансплантации. У 5-25% больных, перенесших пересадку почек или печени, 20-50% больных после аллогенной трансплантации костного мозга, 5575% реципиентов легких и/или сердца развивается ЦМВИ. ЦМВИ обостряет процессы, приводящие к реакции отторжения трансплантата, значительно повышая риск его гибели, а также увеличивает вероятность развития бактериальных, грибковых, вирусных осложнений у реципиентов органов.
Проблема клинически выраженной ЦМВИ актуальна и для лиц, имеющих иммуносупрессию иной природы. Описана тяжело протекающая манифестная ЦМВИ у онкогематологических больных, больных лучевой болезнью, длительно принимающих глюкокортикоиды, цитостатическую терапию, перенесших ожоговую травму. Цитомегаловирус может быть
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
причиной посттрансфузионных гепатитов, разнообразной гинекологической патологии. Предполагается роль ЦМВ, как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности фиброзирующего альвеоли-та), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма. Возможно тяжелое течение манифестной острой ЦМВИ у беременных, взрослых лиц без выраженного иммунодефицита.
Частота вторичных иммунодефицитов существенно повысилась благодаря появлению и распространению ВИЧ-инфекции. Клинически выраженная генерализованная ЦМВИ занимает одно из первых мест в структуре оппортунистических заболеваний у ВИЧинфицированных. Активная репликация ЦМВ у ВИЧ-инфицированных детей ассоциируется с более быстрой прогрессией ВИЧ-инфекции и более высокой вероятностью летального исхода. ЦМВИ имеется у 20-40% больных СПИДом, не получающих АРВТ, и в 3-7% случаев при ее назначении. Факторами риска для развития ЦМВИ у больных ВИЧ-инфекцией является количество CD4-лимфоцитов в крови меньше 100 кл/мкл.
Сезонность, вспышки, эпидемии для ЦМВИ не характерны. МЕРЫ ПРОФИЛАКТИКИ
Профилактические мероприятия в отношении ЦМВИ должны быть дифференцированы в зависимости от группы риска. Необходимы консультирование и информирование серонегативных по ЦМВ женщин, планирующих беременность или беременных, об источниках и путях инфицирования (половые контакты с серопозитивным партнером, физический контакт при ежедневном уходе за ребенком дома или профессиональный контакт с детьми младшего возраста в стационарах, домах ребенка, детских дошкольных учреждениях). Для снижения
риска первичного заражения ЦМВ беременным, не имеющим специфических антител IgG, даются рекомендации по использованию барьерных контрацептивов при половых контактах, соблюдению правил личной гигиены после смены пеленок или после контакта с игрушками, испачканным слюной или мочой детей, избеганию пользования одной посудой с ребенком, поцелуев в губы детей грудного возраста, которые могут выделять вирус со слюной. Рекомендован временный перевод серонегативных беременных - сотрудников домов ребенка, детских стационарных отделений, учреждений ясельного типа - на работу, не связанную с опасностью их заражения вирусом. Подобные меры профилактики актуальны и для серопозитивных беременных для предотвращения повторного заражения ЦМВ.
В случае активной ЦМВИ у серопозитивной лактирующей женщины, несмотря на риск передачи вируса ребенку, грудное кормление не прерывают. Если ребенок недоношен, с низкой массой тела при рождении и/или имеет врожденную ЦМВИ и концентрация ДНК вируса в грудном молоке высокая, рекомендованы пастеризация или замораживание молока на 24 ч.
Важно осуществление проверки крови и ее компонентов на наличие ДНК ЦМВ при гемотрансфузии недоношенному ребенку или взрослому человеку с ослабленной иммунной системой.
Учитывая, что частота развития манифестной ЦМВИ при пересадке сероне-гативному реципиенту органа от серопозитивного донора составляет 50-65%, важной мерой профилактики ЦМВ-заболевания в трансплантологии является подбор серонегативного донора, если серонегативен реципиент. Значение пассивной профилактики путем введения
иммуноглобулина с повышенным содержанием нейтрализующих антител серонегативным лицам (реципиентам перед трансплантацией, беременным) на сегодняшний день не оценено.
Оптимальный способ предотвращения первичной ЦМВИ - активная вакцинация лиц из групп риска. Для этого созданы или разрабатываются различные виды вакцин, но до сих пор лицензированной антицитомегаловирусной вакцины не существует.
ПАТОГЕНЕЗ
Решающим условием для развития антенатальной ЦМВИ является виремия у матери вследствие инфцирования вирусом или его реактивации. Наличие вируса в крови ведет к инфицированию плаценты, ее поражению и заражению плода с возможными последствиями в виде пороков и задержки внутриутробного развития, патологического процесса с поражением внутренних органов, в первую очередь ЦНС. При наличии вируса в канале шейки матки беременной женщины возможен восходящий (трансцервикальный) путь заражения плода без выхода возбудителя в кровь. Реактивация ЦМВ в эндометрии является одним из факторов ранних абортов.
При постнатальной ЦМВИ входными воротами возбудителя служат слизистые оболочки ротоглотки, дыхательной системы, пищеварительного и генитального трактов. После преодоления вирусом входных ворот и его локального размножения наступает кратковременная виремия, моноциты и лимфоциты переносят вирус в различные органы. При острой ЦМВИ вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Поражение эпителиальных клеток облегчает вирусную трансмиссию подлежащим тканям и инфицирование фибробластов. ЦМВ может инфицировать нервные клетки, клетки гладкой мускулатуры, клетки стромы костного мозга. Несмотря на иммунный ответ, ЦМВ индуцирует хроническую латентную инфекцию. Резервуаром вирусных частиц служат моноциты, лимфоциты, эндотелиальные и эпителиальные клетки. Зараженные эндотелиаль-
ные клетки крупных сосудов являются резервуарами ЦМВ и способствуют развитию виремии, передавая вирус циркулирующим моноцитам. Вирусная инфекция в микрососудах приводит к разрушению зараженных эндотелиальных клеток, их слущиванию, образованию микротромбов. ЦМВИ в микрососудах вызывает постепенное продуктивное поражение всех слоев сосудистой стенки, приводящее к склеротическим изменениям, стенозу и облитерации сосудов.
При незначительной иммуносупрессии возможны периоды локальной активизации ЦМВ с выделением вируса из носоглотки или урогенитального тракта. В случае выраженных иммунологических нарушений происходит возобновление репликации вируса, развивается виремия с клинически выраженной картиной заболевания. Активность вирусной репликации, риск манифестации ЦМВИ, тяжесть ее течения во многом определяются степенью снижения количества СD4-лимфоцитов.
С ЦМВИ связан широкий спектр органных поражений: легких, пищеварительного тракта, надпочечников, почек, головного и спинного мозга, сетчатки глаза. У умерших от ЦМВИ выявляют фиброателектаз легких, иногда с кистами и инкапсулированными абсцессами; эрозивно-язвенное с выраженным фиброзом подслизистого слоя поражение пищевода, толстой кишки, реже желудка и тонкой кишки; массивный, часто двусторонний некроз надпочечников; энцефаловентри-кулит, некротическое поражение спинного мозга, сетчатки глаза. Специфичность поражений подтверждает наличие крупных цитомегалоклеток, лимфогистиоци-тарных инфильтратов, а также продуктивно-инфильтративных панваскулитов с цитомегалическим превращением клеток всех оболочек мелких артерий и вен с исходом в склерозирование. Подобное поражение сосудов служит основой для тромбообразования, приводит к хронической ишемии, на фоне которой развиваются деструктивные изменения, сегментарные некрозы и язвы, выраженный фиброз. Распространенный фиброз - характерная особенность ЦМВ-поражения органа. У
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
большинства больных патологический процесс, связанный с ЦМВ, носит генерализованный характер.
КЛИНИЧЕСКАЯ КАРТИНА
Продолжительность инкубационного периода составляет 2-12 нед. Клиническая картина ЦМВИ зависит от сроков и механизмов заражения (врожденная и приобретенная инфекция, антенатальная, интранатальная и постнатальная ЦМВИ), формы инфекции (первичное заражение, реинфекция, реактивация латентного вируса), путей и механизмов заражения (аспирация слюны, гемотрансфузия, половой путь, трансплантация органа), состояния иммунной системы.
Клиническая классификация цитомегаловирусной инфекции I. Врожденная ЦМВИ:
а) бессимптомная форма; б) ЦМВ-болезнь (манифестная ЦМВИ).
II. Приобретенная ЦМВИ. 1. Острая ЦМВИ:
а) бессимптомная форма; б) мононуклеозоподобный синдром;
в) ЦМВ-болезнь (манифестная ЦМВИ).
2.Латентная ЦМВИ.
3.Активная ЦМВИ (реинфекция или реактивация вируса): а) бессимптомная форма; б) ЦМВ-ассоциированный синдром.
4.ЦМВ-болезнь (манифестная ЦМВИ).
Основные симптомы и динамика их развития
При врожденной ЦМВИ характер поражения плода зависит от срока заражения. Особенно опасно инфицирование ЦМВ матери в первые 20 нед беременности, которое может привести к самопроизвольному выкидышу, внутриутробной гибели плода, мертворождению, грубым врожденным порокам развития (анэнцефалия, микроцефалия, гидроцефалия, порэнцефалия, микрофтальмия, дефект строения внутренней глазной камеры, гипопластическая дисплазия тимуса, гипоплазия легких, нарушение строения бронхиального дерева и легочных сосудов, гипоплазия внутрипеченочных желчных протоков, атрезия пищевода, аномалии строения почек, рубцовые стенозы МВП, дефекты межпредсердной и межжелудочковой перегородок, фиброэластоз миокарда, стеноз аорты). Врожденные пороки развития в большинстве случаев несовместимы с жизнью. При заражении ЦМВ в поздние сроки беременности прогноз для жизни и развития ребенка более благоприятен.
При антенатальном инфицировании возникает клинически выраженная патология в период от момента рождения до нескольких недель жизни ребенка. Манифестная форма болезни развивается у 5-30% инфицированных новорожденных. Новорожденные, инфицированные внутриутробно, часто рождаются недоношенными, с синдромом задержки роста плода (низкая и экстремально низкая масса тела), гестационным возрастом менее 32 нед, признаками внутриутробной гипоксии, низкой оценкой состояния по шкале Апгар. Характерна обильная петехиальная или более крупная геморрагическая сыпь, обусловленная выраженной тромбоцитопенией и повреждением сосудов кожи. ЦМВИ - одна из причин
конъюгированной гипербилирубинемии. При лабораторных исследованиях отмечают повышение активности АЛТ (>80 ед/л), выраженную тромбоцито-пению (<100 кл/мкл) (1520% случаев) или тромбоцитоз, повышение концентрации связанного билирубина в крови (>25,7-34,2 мкмоль/л), повышенный гемолиз эритроцитов, возможны лейкопения, нейтропения. В 70-80% случаев врожденной ЦМВИ дети имеют более одного из трех симптомов: низкая масса тела при рождении, желтуха, тромбоцитопения.
Только для антенатального инфицирования ЦМВ характерно поражение ЦНС в виде микроцефалии, реже - гидроцефалии, сонливости или мышечной гипотонии, слабого сосательного рефлекса, судорожного синдрома. Патология ЦНС у новорожденного имеется в 30% случаев при первичном заражении матери в I триместре беременности. При микроцефалии частота инвалидности составляет более 50%. Исследование СМЖ выявляет повышение содержания белка. Неблагоприятными прогностическими факторами развития ребенка являются наличие патологии по данным МРТ головного мозга плода и микроцефалия. ЦМВИ - основная причина сенсоневральной потери слуха. Нарушения слуха наблюдают у 22-70% детей с врожденной манифестной ЦМВИ и 5-23% - при бессимптомном течении антенатальной инфекции. Нарушения зрения и страбизм являются частыми клиническими проявлениями ЦМВИ. Частые нарушения зрения возникают вследствие развития хориоретинита, пигментного ретинита, рубцов сетчатки глаза, атрофии зрительного нерва, потери центрального зрения, врожденной катаракты. Прогноз врожденной ЦМВИ с поражением ЦНС неблагоприятный.
Интерстициальную пневмонию относят к редким прогностически неблагоприятным проявлениям врожденной ЦМВИ. ЦМВ-поражение органов дыхания более вероятно у детей старше 1 мес, инфицированных ЦМВ во время родов или в раннем постнатальном периоде. У ребенка с врожденной ЦМВИ возможен некротический энтероколит, фиброз и поликистоз поджелудочной железы, очаговый интерстициальный нефрит, хронический сиалоаденит. Возможно развитие сахарного диабета, диффузного тиреотоксического зоба. Инфицирование ЦМВ в период
внутриутробного развития может быть причиной гепато- и спленомегалии, лим-фопении, нейтропении, тромбоцитопении, повышения активности аминотранс-фераз, генерализованного поражения органов с развитием шока, ДВС-синдрома и смерти ребенка. Летальность при клинически выраженной врожденной ЦМВИ - около 20-30%.
У 40-90% выживших новорожденных с манифестной ЦМВИ наблюдаются задержка психомоторного развития, сенсоневральная тугоухость, нарушения восприятия речи при сохранении слуха, один или более из следующих признаков (микроцефалия, судороги, парезы/параличи, хориоретинит). В части случаев в более старшем возрасте наблюдаются: когнитивные нарушения, низкая обучаемость в школе, неспособность к чтению, гиперактивность в сочетании с невозможностью сосредоточиться, поведенческие проблемы.
Инфицирование ЦМВ плода во второй половине беременности может не приводить к клинически выраженной патологии при рождении, но быть причиной развития заболевания в первые недели и месяцы жизни ребенка. Наличие виремии в период от момента рождения до 3 мес жизни является фактором риска развития неврологической патологии (прогрессирующей тугоухости, хориоретинита, очаговых двигательных нарушений, гипотонии, судорожного синдрома).
В 5-15% случаев бессимптомная антенатальная ЦМВИ также приводит к значительному ухудшению слуха, снижению зрения, судорожному синдрому, задержке физического и умственного развития, нейросенсорным нарушениям, сложностям при обучении.
При интранатальном или раннем постнатальном инфицировании клинические признаки болезни чаще возникают через 1-3 мес после родов. Наиболее часто ЦМВИ проявляется
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
поражением легких, протекающим благоприятно. У недоношенных ослабленных детей с низким весом при рождении, зараженных ЦМВ во время родов или в первые дни жизни путем гемотрансфузий, уже к 3-5-й неделе жизни может развиться тяжелое генерализованное заболевание, проявлениями которого служат пневмония, гепатит с затяжной желтухой и холестазом, гепато-спленомегалия, нефропатия, поражение пищеварительного тракта, анемия, тром-боцитопения. Заболевание может носить длительный рецидивирующий характер.
Максимальная летальность при ЦМВИ приходится на возраст 2-4 мес. ЦМВИ диагностируют у 10% умерших детей в возрасте до года.
Острая цитомегаловирусная инфекция. Мононуклеозоподобный синдром
Первичное инфицирование ЦМВ иммунокомпетентных лиц обычно протекает бессимптомно или с не резко выраженным мононуклеозоподобным синдромом. Лишь у 5% взрослых острая ЦМВИ проявляется яркой клинической симптоматикой. Около 15% больных с диагнозом ИМ имеют лабораторные маркеры острой ЦМВИ. Характерны высокая лихорадка неправильного типа длительностью более 2 нед, слабость, выраженная утомляемость, потеря аппетита, ЛАП. Возможны головная боль, миалгии, артралгии, гепатоспленомегалия, характерно повышение активности аминотрансфераз и щелочной фосфатазы. Ангину и увеличение задне-шейных и затылочных ЛУ наблюдают редко. Описаны гепатит, холангит, эзофагит и пневмония как проявления первичного заражения вирусом. Ряд заболевших отмечают выраженную сухость во рту, нарушение выработки слюны. Выявляют лейкоцитоз, относительный лимфоцитоз, причем более 10% лимфоцитов - атипичные (с широкой базофильной цитоплазмой). Прогноз благоприятный.
Острая ЦМВИ у беременных протекает с умеренно выраженным фарингитом, субфебрилитетом, наличием слабости, артралгий или миалгий, повышением активности печеночных ферментов, лимфоцитозом. У трети пациенток инфекция протекает бессимптомно. В редких случаях острая ЦМВИ протекает с развитием интерстициальной пневмонии, неправильного типа лихорадкой, сильным сухим
кашлем, астенией. Необходимо обращать внимание на любые признаки острой инфекционной патологии у беременных, при наличии которых следует провести внеплановые лабораторные исследования для исключения первичной ЦМВИ.
Заражение вирусом при гемотрансфузии или трансплантации органа серонега-тивному реципиенту может привести к развитию острого заболевания, возникающего через 2-8 нед после переливания инфицированной крови или через 8-12 нед после пересадки зараженного органа и характеризующегося высокой лихорадкой, выраженной астенией, болями в горле, ЛАП, миалгией и артралгией. В крови выявляют нейтропению и тромбоцитопению. Возможны пневмония, плеврит, гепатит, нефрит, миокардит, артрит. Заражение ЦМВ серонегативного реципиента органа в 70-80% случаев вызывает развитие манифестной ЦМВИ, которая при отсутствии лечения может закончиться летальным исходом. Отсутствие иммунологических нарушений обусловливает переход острой ЦМВИ в латентную, при которой клинических проявлений инфекции не наблюдается.
Развитие иммуносупрессии ведет к возобновлению репликации ЦМВ, виру-семии и возможной манифестации заболевания. Повторное попадание вируса в организм человека на фоне иммунодефицитного состояния также может быть причиной клинически выраженной ЦМВИ. При реинфекции манифестация ЦМВИ происходит чаще и протекает более тяжело, чем при реактивации вируса.
Для ЦМВИ у иммуносупрессивных лиц характерно постепенное, в течение нескольких недель, развитие заболевания, появление симптомов-предвестников в виде быстрой утомляемости, слабости, потери аппетита, значительного снижения веса, длительной
волнообразной лихорадки неправильного типа с подъемами температуры тела выше 38,5 °С, реже - потливости по ночам, артралгии, миал-гии. Данный комплекс симптомов носит название «ЦМВ-ассоциированный синдром». Через 1-3 мес при сохранении выраженной иммуносупрессии развивается тяжелая органная патология с тенденцией к генерализации процесса. С ЦМВИ связан широкий спектр органных поражений. Частота поражения легких у ВИЧ-инфицированных больных ЦМВИ составляет 70%, сетчатки - 45%, надпочечников - 60%, ЖКТ - 39%, пищевода - 13%, печени - 13%, головного мозга - 16%, спинного мозга - 8%, корешков спинных нервов - 20%. Летальность стационарных больных ВИЧ-инфекцией, страдающих ЦМВИ, составляет 25-27%.
Для поражения легких характерны: постепенно усиливающийся сухой или малопродуктивный кашель, умеренная одышка, нарастание симптомов интоксикации. Рентгенологические признаки могут отсутствовать или ограничиваться незначительным усилением легочного рисунка, снижением прозрачности легочных полей, характерны выраженная сетчатость, ячеистость легочного рисунка, наличие на фоне деформированного легочного рисунка двусторонних мелкоочаговых инфильтративных теней, преимущественно в средних и нижних отделах легких. КТ у больных ЦМВ-пневмонией выявляет изменения легочной ткани по типу «матового стекла», уплотнение легочной ткани, утолщение стенок бронхиол или бронхоэктазы, интерстициальную сетчатость без эмфиземы, наличие очаговых и мелкофокусных изменений. При несвоевременной диагностике возможно развитие ДН, РДС, наступление летального исхода. Степень поражения легких у больных ЦМВИ может варьировать от минимально выраженного интерстициального пневмонита до распространенного фиброзирующего бронхиолита и альвеолита с формированием двустороннего полисегментарного фиброза легких.
ЦМВ - основной этиологический фактор язвенных дефектов пищеварительного тракта у больных ВИЧ-инфекцией. Патологический процесс локализуется в пищеводе, толстой кишке, реже - в терминальном отделе тонкой кишки и желудке, описаны случаи поражения глотки, слизистой ротовой полости, языка. Типичными признаками ЦМВ-эзофагита служат лихорадка, затруднение при глотании, загрудинная боль при прохождении пищевого комка, отсутствие эффекта
противогрибковой терапии, наличие неглубоких округлых язв и/или эрозий в дистальном отделе пищевода. Поражение желудка ЦМВ-этиологии характеризуется сочетанием симптомов интоксикации и наличием острых или подострых язв в центре полиповидных образований в различных отделах желудка. Клиническая картина ЦМВ-колита или энтероколита характеризуется значительным снижением массы тела, лихорадкой, диареей, постоянными болями в животе, болезненностью толстой кишки при пальпации. Колоноскопия выявляет эрозии и изъязвления слизистой оболочки толстой кишки.
Гепатит - одно из основных клинических проявлений ЦМВИ при трансплацентарном заражении ребенка, у реципиентов после пересадки печени, инфицированных ЦМВ во время гемотрансфузий. Клинической особенностью ЦМВ-гепатита является частое сочетание с патологией желчевыводящих путей. Холангиопатии ЦМВ-этиологии включают в себя склерозирующий холангит, папиллярный стеноз, стриктуру общего желчного потока и некалькулезный холецистит. ЦМВ-гепатит характеризуется мягким клиническим течением, но при развитии склерозирующе-го холангита наблюдаются боли в верхней части живота, тошнота, диарея, болезненность печени, повышение активности ЩФ и ГГТ. Может развиться надпече-ночная желтуха. Поражение печени носит характер гранулематозного гепатита, в редких случаях наблюдают выраженный фиброз и даже исход в цирроз печени.
Патология поджелудочной железы у больных генерализованной ЦМВИ обычно протекает бессимптомно или со стертой клинической картиной и проявляется повышением активности панкреатических ферментов в крови и в моче.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Высокой чувствительностью к ЦМВ обладают клетки эпителия мелких протоков слюнных желез, преимущественно околоушных. Специфические изменения в слюнных железах при ЦМВИ у детей встречаются в подавляющем большинстве случаев. У взрослых больных ЦМВИ сиалоаденит возможен при первичном заражении.
Цитомегаловирусный интерстициальный нефрит, как правило, протекает без клинических проявлений. Отмечают микропротеинурию, микрогематурию, лей-коцитурию, редко - нефротический синдром и почечную недостаточность.
ЦМВ - одна из причин патологии надпочечников (часто у больных ВИЧ-инфекцией) с развитием надпочечниковой недостаточности, проявляющейся стойкой артериальной гипотензией, слабостью, похуданием, анорексией, нарушением работы кишечника, рядом психических отклонений, реже - гиперпигментацией кожи и слизистых.
Манифестная ЦМВИ у новорожденных, детей первых месяцев и лет жизни, ВИЧинфицированных лиц нередко протекает с поражением нервной системы в виде энцефаловентрикулита, миелита, полирадикулопатии, полинейропатии нижних конечностей. Для ЦМВ-энцефалита у больных ВИЧ-инфекцией характерны повышение температуры тела, скудная неврологическая симптоматика (непостоянные головные боли, головокружение, горизонтальный нистагм, у части пациентов в поздние сроки болезни - парез глазодвигательного нерва и лицевого нерва), развитие в большинстве случаев выраженных изменений психического статуса в виде личностных изменений, грубых нарушений памяти, снижения интеллектуальной деятельности, резкого ослабления психической и двигательной активности, нарушения ориентировки в месте и времени, анозогнозии, снижения контроля за функцией тазовых органов. Цитомегаловирусное поражение головного мозга - основная причина выраженных нейрокогнитивных расстройств (синдрома «СПИД-деменции»). У детей, перенесших ЦМВ-энцефалит, также выявляется замедление психического и умственного развития. Исследования СМЖ выявляют повышенное содержание белка при отсутствии плеоцитоза или мононуклеарный плеоцитоз, нормальное содержание глюкозы. Клиническая картина полинейро-патии и полирадикулопатии характеризуется болевым синдромом в дистальных отделах нижних конечностей, реже - в поясничной области в сочетании с чувством онемения,
парестезией, гиперестезией, каузалгией, гиперпатией. При поли-радикулопатии развивается вялый парез нижних конечностей, сопровождающийся снижением болевой и тактильной чувствительности в дистальных отделах ног, ослаблением тонуса мышц, мышечной гипотрофией, тазовыми расстройствами. В СМЖ больных полирадикулопатией выявляют повышение содержания белка, 2-3-значный лимфоцитарный плеоцитоз. В основе полинейропатии и полира-дикулопатии лежит демиелинизация нервных стволов, что ведет к нарушению проведения нервного импульса. ЦМВ принадлежит ведущая роль в развитии миелита у больных ВИЧ-инфекцией. Поражение спинного мозга носит диффузный характер и является поздним проявлением ЦМВИ. В дебюте заболевание имеет клиническую картину полинейропатии или полирадикулопатии, в дальнейшем, в соответствии с уровнем поражения спинного мозга, развиваются тетрапарез или нижний парапарез, появляются пирамидные знаки, значительное снижение всех видов чувствительности. Все больные страдают грубыми расстройствами функции тазовых органов. В СМЖ умеренно повышается содержание белка, 2-3-значный лимфоцитарный плеоцитоз.
У больных ВИЧ-инфекцией самой частой причиной потери зрения является ЦМВ-ретинит, который описан также у реципиентов органов, детей с врожденной ЦМВИ, в единичных случаях - у беременных женщин. Больные предъявляют жалобы на плавающие точки, пятна, пелену перед глазами, снижение остроты зрения. При офтальмоскопии на сетчатке по периферии глазного дна выявляют очаги белого цвета с геморрагиями по ходу ретинальных сосудов. Прогрессирование процесса ведет к формированию диффузного обширного инфильтрата с зонами ретинальной атрофии и очагами кровоизлияний по поверхности
поражения. Вначале процесс односторонний, через 2-4 мес поражается второй глаз и без этио-тропной терапии приводит в большинстве случаев к потере зрения. У больных ВИЧинфекцией, перенесших ЦМВ-ретинит, через 4-12 нед от начала АРВТ при повышении количества СD4-лифоцитов в крови >100-150 кл/мкл может развиться увеит, характерный для поражения ЦМВ органов зрения у иммунокомпетент-ных лиц, он является опасным проявлением воспалительного синдрома восстановления иммунной системы у больных ВИЧинфекцией на фоне АРВТ.
Сенсоневральная глухота отмечается у 60% детей с клинически выраженной врожденной ЦМВИ. Снижение слуха возможно и у взрослых ВИЧ-инфицированных больных с манифестной ЦМВИ. В основе связанных с ЦМВ дефектов слуха лежит воспалительное и ишемическое повреждение улитки и слухового нерва.
ЦМВ может быть причиной «идиопатических» миокардитов и миоперикар-дитов у пациентов без иммуносупрессии. При иммунодефицитных состояниях у больных манифестной ЦМВИ нередко наблюдают развитие дилатационной кар-диопатии.
Возможно ЦМВ-поражение селезенки, ЛУ, костного мозга с развитием панцито-пении. Частыми проявлениями ЦМВ-болезни являются тромбоцитопения со снижением способности клеток к агрегации и экзоцитозу, а также умеренные анемия, лейкопения, лимфопения и моноцитоз. Снижение концентрации гемоглобина, количества эритроцитов и тромбоцитов у больных ВИЧ-инфекцией коррелирует с увеличением концентрации ДНК ЦМВ в крови. В абсолютном большинстве случаев патологический процесс, связанный с ЦМВ, носит генерализованный характер. Выделение локализованной формы ЦМВИ неоправданно.
ДИАГНОСТИКА
Клинический диагноз ЦМВ-заболевания требует обязательного лабораторного подтверждения. ЦМВ в организме человека может находиться в латентном состоянии, в стадии активной репликации без развития органных поражений
и быть причиной тяжелой клинически выраженной патологии. Следовательно, цель лабораторного обследования больного при подозрении на манифестную ЦМВИ заключается не в установлении факта присутствия вируса в организме (за исключением новорожденных), а в доказательстве этиологической роли ЦМВ в имеющейся органной патологии. Используемые в настоящее время практическим здравоохранением серологические, вирусологические, молекулярные, гистологические методы выявления маркеров активной ЦМВИ имеют различную диагностическую ценность.
Определение серологических маркеров (антител класса IgМ, IgА, IgG и их авид-ности). При первичном заражении на 5-7-й день вырабатываются анти-ЦМВ IgM, через 10-14 дней - низкоавидные анти-IgG, затем постепенно авидность антител увеличивается, они становятся высокоавидными. Анти-IgM в большинстве случаев исчезают через 1-2 мес, низкоавидные анти-IgG - через 1-3 мес, высокоавидные антитела класса IgG циркулируют в крови носителя пожизненно. При использовании различных тест-систем для выявления анти-ЦМВ IgM с целью диагностики острой ЦМВИ специфичность и чувствительность тестов методом ИФА составляют 56-75% и 30-88% соответственно, поэтому выявления в крови анти-ЦМВ IgM недостаточно для установления диагноза острой ЦМВИ, необходимо повторное исследование крови через 2 нед для установления факта появления IgG (сероконверсии) при их отсутствии ранее, а при наличии анти-ЦМВ IgG антител необходимо определение их авидности. Чувствительность и специфичность низкой авидности антител как фактора риска недавнего заражения ЦМВ высоки.
При латентной инфекции в крови присутствуют только высокоавидные IgG-антитела, у части пациентов - ДНК ЦМВ в слюне. Количественное содержание IgG не отражает степени
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
репликативной активности вируса и не может служить основанием для постановки диагноза активной ЦМВИ.
Твердофазный хемилюминесцентный иммуноферментный анализ обладает существенно более высокими чувствительностью и специфичностью, что делает его методом выбора для определения серологических маркеров. Метод иммуноблота, позволяющий детектировать анти-IgМ и анти-IgG к отдельным структурным и неструктурным белкам ЦМВ, является золотым стандартом для выявления антител класса IgМ (аналитические чувствительность и специфичность 100%), но данный метод высокозатратен и редко используется в практическом здравоохранении. У взрослых больных с иммуносупрессией использование серологических методов (выявление специфических антител, их авидности) для диагностики активной или манифестной ЦМВИ неэффективно.
У новорожденного ребенка IgG-антитела в крови являются в большинстве случаев материнскими и не служат доказательством заражения ЦМВ. Выявление анти-ЦМВ IgМ у детей первых недель жизни является важным критерием внутриутробного заражения вирусом, но недостатками этого метода является их отсутствие у 30% больных и нередкие ложноположительные результаты. Наличие специфических антител класса IgА также является критерием острой ЦМВИ. Серологические маркеры антенатального заражения ребенка должны подтверждаться выявлением ДНК вируса.
Решающее значение для установления наличия активного инфекционного процесса (активной репликации вируса) и подтверждения ЦМВ-природы поражения органов принадлежит прямым методам выявления вируса, его антигенам и ДНК. Вирусологический метод, основанный на выделении ЦМВ из биологических жидкостей на культуре клеток, является специфическим, но в практическом здравоохранении не используется.
Наиболее специфичным и чувствительным методом диагностики ЦМВИ является ПЦР, которая позволяет определить наличие ДНК ЦМВ в биологических жидкостях и тканях в кратчайшие сроки. ПЦР в режиме реального времени
используют для выявления и определения концентрации ДНК (вирусной нагрузки) ЦМВ в различных биологических жидкостях (кровь, СМЖ, бронхоальвео-лярная лаважная жидкость (БАЛЖ), моча, цервикальный секрет, амниотическая жидкость) и тканях (биоптаты, операционный материал, аутоптаты). Результаты количественной ПЦР предназначены для определения степени репликативной активности ЦМВ и обоснования наличия манифестной инфекции.
Клиническое и прогностическое значение определения ДНК ЦМВ в различных биологических жидкостях неоднозначно. Присутствие возбудителя в слюне и в моче является маркером инфицированности и не свидетельствует об активном инфекционном процессе. Так, прогностическая ценность обнаружения вируса в моче беременной для антенатальной ЦМВИ составляет не более 20-30%. Вероятность антенатального заражения плода возрастает при сочетании наличия ДНК ЦМВ в моче и анти-ЦМВ IgМ в крови.
Наиболее важное диагностическое значение имеет обнаружение ДНК в крови, свидетельствующее о высокоактивной репликации вируса и его роли в имеющейся патологии. Наличие ДНК ЦМВ в лейкоцитах крови беременной женщины является достоверным признаком активной репликации ЦМВ и служит важным маркером высокого риска антенатального и интранатального заражения вирусом ребенка. Целесообразно плановое обследование беременных с высокоавидными анти-ЦМВ IgG на наличие ДНК ЦМВ в крови и моче при постановке на диспансерный учет и на сроке беременности 32-34 нед. Наличие ДНК ЦМВ в цервикальном канале у женщин при сроке беременности 32-34 нед имеет значение как фактор риска интранатального заражения ребенка и является показателем для его обследования на 4-6-й неделе жизни.
Прямым доказательством заражения плода является обнаружение ДНК ЦМВ в амниотической жидкости и пуповинной крови.
Доказательством наличия врожденной ЦМВИ является обнаружение ДНК ЦМВ в любой биологической жидкости (крови, моче, соскобе с ротовой полости) в первые 14 дней жизни ребенка. Обнаружение ДНК вируса через 4-6 нед жизни ребенка при отсутствии вируса в биологических материалах в первые 2 нед от момента родов свидетельствует об интранатальном или раннем постнатальном заражении ЦМВ. При выявлении у матери маркеров острой ЦМВИ обследование детей в первые дни и недели жизни обязательно.
У иммуносупрессивных лиц (больных ВИЧ-инфекцией, реципиентов органов) для подтверждения диагноза манифестной ЦМВИ необходимо устанавливать количество ДНК вируса в крови. Диагностическое значение имеет вирусная нагрузка 105 и выше в лейкоцитах и 104 в плазме крови. Высокая вирусная нагрузка является даже при отсутствии клинических проявлений поводом для превентивной антицитомегаловирусной терапии.
Важным подтверждением ЦМВ-природы имеющихся у больного клинических проявлений заболевания и патологических изменений в органах является обнаружение при гистологических исследованиях биопсийных материалов цитомега-локлеток.
Стандарт лабораторного обследования при цитомегаловирусной инфекции
Обследование беременных женщин для установления наличия активной ЦМВИ и степени риска вертикальной передачи вируса плоду:
◊исследование крови на наличие антител классов IgМ и IgG к ЦМВ;
◊повторный анализ крови на анти-ЦМВ IgG через 14 дней при их отсутствии в
первом исследовании, но наличии анти-ЦМВ IgМ; ◊ определение авидности антител класса IgG к ЦМВ при их одновременном
обнаружении с анти-ЦМВ IgМ в первом исследовании крови или при наличии признаков острой инфекционной патологии;
◊повторное исследование крови на антитела классов IgМ и IgG к ЦМВ при их первоначальном отсутствии в каждом триместре беременности или по клиническим показаниям;
◊исследование крови на наличие ДНК ЦМВ в клетках крови;
◊исследование мочи на наличие ДНК ЦМВ;
◊исследование амниотической жидкости или пуповинной крови на наличие ДНК ЦМВ (по показаниям).
Исследования крови и мочи на ДНК ЦМВ проводят планово не менее двух раз за время беременности или по клиническим показаниям.
Обследование новорожденных для подтверждения антенатального заражения ЦМВ (врожденной ЦМВИ):
◊исследование мочи на наличие ДНК ЦМВ;
◊исследование соскоба со слизистой ротовой полости на наличие ДНК ЦМВ; ◊ исследование крови на количественное определение ДНК ЦМВ в клетках крови;
◊исследование крови на количественное определение ДНК ЦМВ в плазме;
◊исследование крови на наличие антител классов IgМ и IgG к ЦМВ;
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
◊ определение авидности анти-ЦМВ IgG.
Исследования проводят в первые 14 дней жизни ребенка.
Для подтверждения интранатального заражения ЦМВ ребенка (при отсутствии вируса в крови, моче или слюне, анти-ЦМВ IgМ в течение первых 14 дней жизни) перечисленные выше исследования повторяют через 4 нед его жизни.
Обследование больных при подозрении на активную ЦМВИ и манифестную форму заболевания (ЦМВ-болезнь):
◊исследование крови на количественное определение ДНК ЦМВ в клетках крови;
◊исследование крови на количественное определение ДНК ЦМВ в плазме (для новорожденных);
◊анализ ликвора, БАЛЖ, плевральной жидкости, биоптатов бронхов, биопта-тов органов на ДНК ЦМВ с определением количества при наличии соответствующей органной патологии;
◊гистологическое исследование биопсийных и аутопсийных материалов на присутствие цитомегалоклеток (окраска гематоксилином и эозином).
Дифференциальная диагностика
Врожденную ЦМВИ следует дифференцировать с краснухой, токсоплазмозом, неонатальным герпесом, сифилисом, бактериальными инфекциями, гемолитической болезнью новорожденных, родовой травмой, наследственными синдромами. Решающее значение имеет специфическая лабораторная диагностика заболевания в первые недели жизни ребенка, гистологическое исследование плаценты с привлечением молекулярных методов диагностики. При мононуклеозо-подобном заболевании исключают инфекции, вызываемые ЭБВ, герпесвирусами 6-го и 7-го типов, острую ВИЧ-инфекцию, а также стрептококковый тонзиллит и дебют острого лейкоза. В случае развития ЦМВ-заболевания органов дыхания у детей раннего возраста дифференциальную диагностику следует проводить с коклюшем, бактериальным трахеитом или трахеобронхитом, РС-вирусной инфекцией, герпетическим трахеобронхитом. У больных с иммунодефицитом ЦМВ-пневмонию следует дифференцировать с пневмоцистной пневмонией, туберкулезом, микоплазменной пневмонией, грибковым поражением легких, бактериальным сепсисом; ЦМВэнцефаловентрикулит - с ВИЧ-энцефалитом, прогрессирующей многоочаговой лейкоэнцефалопатией, нейросифилисом. Полинейропатия и полирадикулопатия ЦМВэтиологии требуют дифференцировки с полирадикулопатией, вызванной герпесвирусами 2-го и 6-го типов, синдромом
Гийена-Барре, токсической полинейропатией, связанной с приемом ЛС, алкоголя, психотропных препаратов.
Показания к консультации других специалистов
Показаниями к консультации специалистов служат тяжелое поражение легких (пульмонолог, фтизиатр), ЦНС (невролог, психиатр), зрения (офтальмолог), органов слуха (оториноларинголог), костного мозга (онкогематолог).
Примеры формулировки диагноза с учетом МКБ-10
Диагноз манифестной ЦМВИ формулируют следующим образом: «Острая цитомегаловирусная инфекция, цитомегаловирусный мононуклеоз»; «врожденная цитомегаловирусная инфекция, манифестная форма»; «ВИЧ-инфекция, стадия вторичных заболеваний 4В (СПИД): манифестная цитомегаловирусная инфекция (пневмония, колит)».
Показание к госпитализации При развитии клинически выраженной ЦМВ-болезни показана госпитализация.
ЛЕЧЕНИЕ Режим. Диета
Особого режима и диеты не требуется. Они устанавливаются, исходя из состояния больного и локализации поражения.
Грудное вскармливание при наличии ЦМВИ у матери не противопоказано. Если ребенок недоношенный, с низкой массой тела при рождении имеет врожденную ЦМВИ, и концентрация ДНК ЦМВ в грудном молоке высокая, рекомендована пастеризация или замораживание молока на 24 ч.
Медикаментозная терапия
ЛС, эффективность которых для лечения и профилактики ЦМВ-заболевания доказана контролируемыми исследованиями, - противовирусные препараты ганцикловир (Цимевен♠), валганцикловир (Вальцит♠), фоскарнет натрия (фоска-
вирρ) и цидофовирρ. Препараты интерферонового ряда и иммуномодуляторы неэффективны у больных ЦМВИ. При острой ЦМВИ или активной ЦМВИ (наличие ДНК ЦМВ в крови или наличие ДНК ЦМВ в моче в сочетании с анти-ЦМВ IgM) вследствие реинфекции или реактивации вируса у беременных препаратом выбора является Неоцитотект♠ - иммуноглобулин человека антицитомегалови-русный для внутривенного введения. Препарат назначают с целью профилактики антенатального и интранатального заражения ребенка, а также новорожденным и детям первых месяцев с антенатальной (врожденной) ЦМВИ с целью предупреждения манифестации заболевания или развития отдаленных последствий. Ганцикловир и валганцикловир - препараты выбора для лечения, вторичной профилактики и предупреждения ЦМВ-болезни. Лечение манифестной ЦМВИ ганцикловиром (Цимевен♠) проводится в течение 2-6 нед в зависимости от клинической формы заболевания. Валганцикловир (Вальцит♠) применяется перорально (одна таблетка
Вальцита♠ содержит 450 мг валганцикловира) для лечения ЦМВ-ретинита. Критериями эффективности терапии служат нормализация состояния пациента, отчетливая положительная динамика по результатам инструментальных исследований, исчезновение ДНК ЦМВ из крови. Положительные результаты лечения ганцикловиром наблюдают у 7095% больных.
При сохранении иммунодефицита рецидивы ЦМВ-болезни неизбежны. Больным ВИЧинфекцией, прошедшим курс лечения манифестной ЦМВИ, для
профилактики рецидива назначается поддерживающая терапия валганцикловиром (Вальцит♠) или ганцикловиром (Цимевен♠). Поддерживающее лечение у больных ВИЧ-инфекцией, перенесших ЦМВ-ретинит, проводится на фоне АРВТ до момента повышения количества СD4-лифоцитов более 100 кл/мкл, сохраняющегося не менее 3 мес. Длительность поддерживающего курса при других клинических формах ЦМВИ - не менее одного месяца. Главным фактором, способствующим снижению риска рецидива ЦМВИ у больных ВИЧинфекцией, является уменьшение иммуносупрессии вследствие АРВТ. При рецидиве заболевания назначается повторный терапевтический курс.
Нежелательные явления, связанные с терапией ганцикловиром или валганци-кловиром, включают нейтропению, тромбоцитопению, анемию, повышение уровня креатинина в крови, кожную сыпь, зуд, диспепсические явления, реактивный панкреатит. Резистентность к ганцикловиру через 3 мес от начала приема препарата возникает менее чем у 10% пациентов, но через 9 мес терапии - в 25-30% случаев.
Стандарт лечения
Лечебный курс: ганцикловир 5 мг/кг в/в 2 р/сут с 12-часовым интервалом или валганцикловир 900 мг 2 р/сут (ретинит).
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Длительность терапии: 21 день у больных ретинитом, 4 нед - при поражении легких или пищеварительного тракта, 6 нед и более - при патологии ЦНС.
Лечение проводят до исчезновения симптомов заболевания и ДНК ЦМВ из крови.
Поддерживающая терапия: валганцикловир 900 мг/сут. Длительность терапии: не менее одного месяца. При рецидиве заболевания - повторный лечебный курс. Превентивная терапия активной ЦМВИ у иммуносупрессивных больных: валганцикловир 900 мг/сут в течение не менее 1 мес.
Критерии прекращения терапии: отсутствие ДНК ЦМВ в крови.
Превентивная терапия при острой или активной ЦМВИ во время беременности: иммуноглобулин человека антицитомегаловирусный (НеоЦитотект♠)
1 мл/кг в сутки в/в 3 введения с интервалом в 2 нед.
Превентивная терапия активной ЦМВИ у новорожденных, детей младшего возраста: иммуноглобулин человека антицитомегаловирусный (НеоЦитотект♠)
2 мл/кг в сутки в/в 6 введений с интервалом 48 ч.
Лечебный курс при манифестной врожденной ЦМВИ: ганцикловир 6 мг/кг каждые 12 ч не менее 42 дней в дальнейшем с переходом на пероральную форму вал-ганцикловира в форме суспензии в дозе 16-20 мг/кг каждые 12 ч в течение 6 мес.
Прогноз
При ранней постановке диагноза ЦМВ-пневмонии, эзофагита, колита, ретинита, полинейропатии и своевременном начале этиотропной терапии прогноз для жизни и сохранения трудоспособности благоприятный. Поздняя диагностика поражения сетчатки ведет к стойкому снижению зрения или к его полной потере. ЦМВ-поражение легких, кишечника, надпочечников, головного и спинного мозга могут стать причиной инвалидности или привести к летальному исходу.
Примерные сроки нетрудоспособности Трудоспособность больных с ЦМВИ нарушается на срок не менее 30 дней. Диспансеризация
Женщины во время беременности проходят лабораторное обследование для исключения активной ЦМВИ. Дети младшего возраста, инфицированные ЦМВИ антенатально, наблюдаются невропатологом, отоларингологом, окулистом. Дети, перенесшие клинически выраженную врожденную ЦМВИ, находятся на диспан-
серном учете у невропатолога. Больные после пересадки костного мозга, других органов в первый год после трансплантации должны не реже одного раза в месяц проходить обследование на наличие ДНК ЦМВ в крови. Больные ВИЧ-инфекцией, имеющие количество СD4-лимфоцитов <100 кл./мкл, должны осматриваться офтальмологом и проходить обследование на количественное содержание ДНК ЦМВ в клетках крови не реже одного раза в 3 мес. Выполнение подобных рекомендаций, использование современных методов диагностики, применение эффективных терапевтических средств позволяют предотвратить развитие манифестной ЦМВИ или свести к минимуму ее последствия.
21.11.6. Инфекция, вызванная вирусом герпеса человека 6-го типа
Герпесвирус 6-го типа (HHV-6) считают наиболее вероятным этиологическим агентом рассеянного склероза, лихорадки новорожденных с судорожным синдромом и ИМ,
негативных по ЭБВ и ЦМВ, а также ассоциированного с HHV-6 энцефалита. HHV-6 является кофактором СПИДа, некоторых форм карцином шейки матки и назофарингеальных карцином.
ЭТИОЛОГИЯ
HHV-6 сходен с остальными герпесвирусами, но отличается от них по биологическим, иммунологическим свойствам, спектру чувствительных клеток, антигенной структуре, составу генома, количеству и молекулярной массе структурных вирусных белков. HHV-6 относят к подсемейству Betaherpesvirinae роду Roseolovirus.
Диаметр вириона 160-200 нм, тип симметрии икосаэдрический, вирус содержит 162 капсомера, обладает суперкапсидной липидсодержащей оболочкой. Геном представлен двунитевой ДНК. Сравнение первичной структуры геномов показывает, что HHV-6 более схож с ЦМВ, чем с другими герпесвирусами.
Исследования изолятов HHV-6 от людей с различной патологией показали, что вирусы принадлежат к вариантам А или В (HHV-6A и HHV-бВ), отличающимся по 9 генам. ННV-6A вызывает лимфогранулематоз, лимфоретикулез, гемоцито-бластоз, рассеянный склероз, ННV-6В - внезапную экзантему новорожденных (Exanthema subitum). ННV-6 вызывает мононуклеоз, негативный по ЭБВ и ЦМВ, с длительной ЛАП. ННV-6 индуцирует у детей лимфопролиферативное заболевание с моноклональной пролиферацией В-клеток (дети от 3 мес до 3 лет). Считается, что ННV-6 может быть индуктором фульминантного гепатита.
Вирус HHV-6 селективно тропен к CD4+-Т-клеткам, но также способен поражать Т-клетки с детерминантами CD3+, CD5+, CD7+, CD8-. Вирус реплицируется во многих клеточных первичных и перевиваемых культурах различного происхождения: лимфоцитах Т-ряда, моноцитарно-макрофагальных, мегакариоцитах, глиальных клетках, клетках тимуса, в свежевыделенных лимфоцитах человека. Ростовой цикл вируса длится 4-5 дней.
ЭПИДЕМИОЛОГИЯ
HHV-6, подобно другим герпесвирусам, распространен повсеместно. При рождении большинство детей серопозитивны за счет материнских антител, титр которых снижается к 5 мес. От 1 года до 7 лет наблюдается уменьшение количества серопозитивных детей, в возрастной группе от 3 до 7 лет оно составляет 55%. От 7 до 15 лет отмечается стабилизация частоты инфицированности. Начиная с 15 лет, отмечается резкое увеличение количества инфицированных HHV-6, эта тенденция сохраняется, включая лиц 60 лет и старше. Исследования в различных регионах мира свидетельствуют о широком распространении HHV-6 (85%) в человеческой популяции.
После снижения титра материнских антител заболевание может проявиться молниеносной экзантемой. Вирус находится в организме человека в слюне и носоглоточной слизи, в латентной фазе сохраняется в моноцитах/макрофагах. В естественных условиях основной путь передачи вируса - воздушно-капельный. Возможны также половой путь передачи вируса и перинатальная инфекция. Однако в большинстве случаев инфицирование происходит постнатально, что подтверждает контактный путь передачи в раннем периоде жизни.
Возможно заражение при гемотрансфузиях, трансплантации органов, использовании медицинских инструментов, контаминированных вирусом.
КЛИНИЧЕСКАЯ КАРТИНА
Спектр заболеваний, связанных с HHV-6, довольно широк (табл. 21.29). HHV-6 связывают с различными лимфопролиферативными и иммуносупрессивными заболеваниями, с внезапной экзантемой новорожденных, злокачественными новообразованиями, аутоиммунной патологией, некоторыми заболеваниями ЦНС и др.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Доказана этиологическая роль HHV-6 в развитии внезапной экзантемы (синонимы: розовая сыпь новорожденных, exanthema subitum, roseola infantum, «шестая болезнь», МКБ-10: В08.2) - широко распространенного заболевания детей в возрасте от 3 мес до 3 лет. Инкубационный период заболевания длится 5-15 дней. Exanthema subitum характеризуется острым началом, высокой лихорадкой (38,5-40 °С) и умеренно выраженной интоксикацией. На 4-й день болезни температура снижается, и одновременно или через несколько часов появляется макулезная сыпь. Обычно высыпания локализуются на спине, животе, груди, разгибательных поверхностях конечностей. На лице сыпь встречается редко. Через 2-3 дня сыпь исчезает, не оставляя следов. Обычно заболевание заканчивается без осложнений, но описаны клинические случаи манифестной инфекции с различными симптомами: лихорадка выше 40 °С, острый тимпонит, респираторные и гастроинтестинальные симптомы, неврологические осложнения. Неврологическим осложнением HHV-6, кроме фебрильных судорог, является энцефалит, который протекает более доброкачественно, чем вызванный ВПГ-1, -2 с формированием воспалительных инфильтратов в различных отделах мозга. В редких случаях возможны менингит, развитие эпилепсии, однако данная тема является до конца не изученной. Причинами фебрильных судорог может быть как прямое повреждающее действие на ЦНС, так и опосредованное за счет активации ИЛ-8 в СМЖ. В редких случаях первичная HHV-6-инфекция протекает с гепатоспленомегалией, фатальным фульминантным гепатитом.
Доказана роль HHV-6 развитии ИМ у детей как моноинфекции и в ряде случаев в виде микст-инфекции в сочетании с вирусами ЭБВ и ЦМВ.
Критериями диагностики моноинфекции ИМ, вызванного HHV-6, являются маркеры активной репликации HHV-6 (обнаружение ДНК вируса в лейкоцитах крови, наличие специфических антител класса IgМ в сыворотке крови и/или повышение уровня антител класса IgG к HHV-6 в сыворотке крови в 2-4 раза выше диагностических значений; отрицательная реакция на наличие гетерофильных антител); при отсутствии маркеров активной репликации ЭБВ
и ЦМВ.
Клинико-лабораторными проявлениями HHV-6 мононуклеоза у детей являются: острое начало с развитием основных симптомов уже на 1-й неделе заболевания (лихорадка, ЛАП, гепатомегалия с повышением активности трансфераз, ангина, спленомегалия); в гемограмме отмечаются умеренный лейкоцитоз, лимфоцитоз, тромбоцитоз, значительное (более 20 мм/ч) повышение СОЭ, атипичные моно-нуклеары (до 55%). Проба на гетерофильные антитела всегда отрицательная. При HHV-6-мононуклеозе менее выражены такие симптомы, как ангина, ЛАП (более 2 см), спленомегалия.
Первичную инфекцию среди взрослых выявляют довольно редко, она проявляется в форме длительной ЛАП, мононуклеозоподобного синдрома, гепатита и др.
В крови наблюдают лейкопению, нейтропению, относительный лимфоцитоз и моноцитоз.
Роль HHV-6 как кофактора СПИДа обеспечивается его способностью инфицировать, реплицироваться и разрушать CD4+-клетки. Отмечают усиление цитопа-тического эффекта при двойном инфицировании по сравнению с моноинфекцией ВИЧ-1, при этом HHV-6 может как ингибировать, так и стимулировать репликацию ВИЧ-1. HHV-6 активирует онкопротеины Е6 и Е7 вируса папилломы человека при цервикальной карциноме.
ДНК HHV-6 была идентифицирована в тканях и клетках биопсийных образцов ходжкинских, смешанных В- и Т-клеточных неходжкинских лимфом, при ангиоиммунобластоидной ЛАП, африканской лимфоме Беркитта, Т-клеточной
острой лимфобластной лейкемии и ряде других лимфопролиферативных заболеваний.
В литературе обсуждается роль HHV-6 в этиологии развития болезни Шегрена. Данные приводятся противоречивые, но было показано частое выявление маркеров активной HHV-6- инфекции.
Роль HHV-6 в развитии синдрома хронической усталости обсуждается. В связи с этим были проведены исследования, в которых обследовалась группа взрослых с различными формами депрессий и группа детей с задержкой психомоторного развития. Было отмечено, что у взрослых с депрессиями и детей с задержкой психомоторного развития активную форму HHV-6-инфекции диагностировали у 48,4% и 45,2% соответственно.
ДИАГНОСТИКА
Для диагностики HHV-6-инфекции используют иммунологические методы (РНИФ, ИБ, ИФА), метод электронной микроскопии и ПЦР.
ЛЕЧЕНИЕ
Разработаны Стандарт оказания специализированной медицинской помощи детям при инфекционном мононуклеозе, в том числе неуточненном, средней и тяжелой степени тяжести (приказы Минздрава России от 9 ноября 2012 г. № 801н и № 802н) и Стандарт оказания специализированной медицинской помощи детям при хронических герпесвирусных инфекциях (приказ Минздрава России от 9 ноября 2012 г. № 876н).
Перечень лекарственных препаратов для медицинского применения: нуклео-зиды и нуклеотиды, кроме ингибиторов обратной транскриптазы (ацикловир, валацикловир), прочие противовирусные препараты (инозин пранобекс), иммуностимуляторы (глюкозаминилмурамилдипептид), ИФН-α, ИЛ (интерлейкин-2), другие иммуностимуляторы (меглюмина акридонацетат, пидотимод, тилорон), симпатомиметики в комбинации с другими средствами, кроме глюкокорти-коидов (ацетилцистеин + туаминогептан), антисептики (лизоцим + пиридоксин, Гексализ♠), муколитические препараты (амброксол), производные пиперазина (цетиризин). Средняя продолжительность 14 дней.
Сложность лечения заболеваний, вызванных HHV-6, связана с генотипиче-скими особенностями возбудителя, а также различной чувствительностью к препаратам. Этот вирус малочувствителен к аналогам нуклеозидов. С определенным успехом в лечении были использованы ганцикловир, валганцикловир и фоскарнет. Однако эти препараты обладают выраженной токсичностью, что ограничивает их применение.
21.11.7. Инфекция, вызванная вирусом герпеса человека 7-го типа ЭТИОЛОГИЯ
HHV-7 относится к роду Roseolovirus подсемейству Betaherpesvirus. При электронномикроскопическом исследовании выявлены типичные для герпес-вирусов вирионы диаметром до 170 нм. Вирион содержит электронно-плотное цилиндрическое ядро, капсид, тегумент и внешнюю оболочку и имеет значительное морфологическое сходство с HHV-6. Гибридизационный анализ показал, что ДНК HHV-7 отличается от ДНК ВПГ, ЭБВ, вируса
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
ветряной оспы (Varicella-zoster virus) и ЦМВ. Степень гомологии между ДНК HHV-7 и ДНК HHV-6 находится на уровне 57,5-58,8%, а с ДНК ЦМВ - на уровне 36%. HHV-7 является лимфо-тропным вирусом, осуществляющим репликацию в Т-лимфоцитах и моноцитах. Рецептором для попадания в клетку HHV-7 являются CD4+, но также HHV-7 способен инфицировать клетки и с другими рецепторами.
ЭПИДЕМИОЛОГИЯ
HHV-7 широко распространен среди населения. У серопозитивных взрослых вирус можно обнаружить в периферических мононуклеарах крови, слюне. Частота выделения HHV-7 у детей в возрасте 12-23 мес - 50%, 24-35 мес - 75%, старше 36 мес - 100%. Основной путь передачи HHV-7 - через слюну. Характерна внутрисемейная передача вируса. Кроме того, вирус обнаруживается в грудном молоке, поэтому возможна его передача и при грудном вскармливании. В отличие от HHV-6, HHV-7 не вызывает внутриутробной инфекции. Инкубационный период предположительно составляет от 7 до 15 дней.
ПАТОГЕНЕЗ
Как и все герпесвирусы человека, HHV-7 персистирует в организме после перенесенной первичной инфекции в течение всей жизни, но может реактивироваться при выраженной иммуносупрессии. Такая ситуация наиболее характерна для реципиентов после трансплантации костного мозга и органов. Реактивация HHV-7 на фоне иммунодефицита может сопровождаться лихорадкой, пневмонией, развитием энцефалита, реакцией «трансплантат против хозяина» и отторжением пересаженного органа. HHV-7 может выступать кофактором в развитии манифестной ЦМВИ у пациентов после пересадки почек. Установлено, что рецептор HHV-7 - гликопротеин CD4+. Во время заражения HHV-7 у CD4+- Т-клеток отмечают избирательное и прогрессирующее уменьшение количества гликопротеина CD4+, что объясняет взаимную интерференцию между HHV-7 и ВИЧ-1.
КЛИНИЧЕСКАЯ КАРТИНА
Основным клиническим проявлением первичной HHV-7-инфекции у детей является внезапная экзантема. Считается, что в основном это заболевание вызывается HHV-6 и только в 10% - HHV-7. Проявляется болезнь высокой лихорадкой в течение 3 дней с последующим появлением пятнисто-папулезной сыпи на голове и туловище, самостоятельно исчезающей в течение 2 дней. При осмотре выявляются также гиперемия ротоглотки и увеличение затылочных ЛУ. Частым неврологическим осложнением первичной HHV-7-инфекции являются фебрильные судороги, которые встречаются чаще, чем при HHV-6-инфекции. Среди других проявлений HHV-7-инфекции выделяют мононуклеозоподобный синдром. Описаны случаи гепатита, менингоэнцефалита.
ДИАГНОСТИКА
Для диагностики HHV-7-инфекции используют иммунологические методы (РНИФ, ИФА), электронную микроскопию, ПЦР.
ЛЕЧЕНИЕ
Стандарты диагностики и лечения при данной инфекции не разработаны. Показания и схемы противовирусного лечения также не разработаны. Не существует клинических исследований, показывающих необходимость лечения HHV-7. In vitro репликация HHV-7 подавляется фоскарнетом, ганцикловиром, ацикловиром, циклотриадисульфонамидомρ . Показано, что для подавления HHV-7 обычной терапевтической дозы ганцикловира недостаточно. В отечественной научной литературе имеются только единичные работы, посвященные HHV-7 и вызванным им заболеваниям, что обусловливает актуальность дальнейших исследований.
21.11.8. Инфекция, вызванная вирусом герпеса человека 8-го типа
ЭТИОЛОГИЯ
HHV-8 - герпесвирус, ассоциированный с саркомой Капоши, идентифицирован молекулярным клонированием с использованием тканей саркомы Капоши. HHV-8 инфицирует в первую очередь лимфоциты, ассоциирован с клеточной трансформацией и иммортализацией. С HHV-8 связано развитие некоторых В-клеточных лимфом, ангиоиммунобластоидной ЛАП, болезни Кастлемана, первичной выпот-ной лимфомы и ряда других лимфопролиферативных заболеваний. HHV-8 по морфологии, структуре и функциям относят к подсемейству γ-герпесвирусов рода радиновирусов. Установлено, что HHV-8 связан со всеми типами саркомы Капоши, включая эндемическую - у африканцев, классическую - у пожилых людей, эпидемическую и иммуносупрессивную. Выделяют 5 субтипов генотипа А, В, С, D, E гена Кl, локализованного в левом конце генома вируса, ассоциированных с географическим происхождением больных. Субтипы А и С характерны для Европы и Америки, субтип В доминирует в Африке, субтип D встречается редко, распространен среди населения островов Тихого океана. В России получены изоляты субтипов А и С.
ЭПИДЕМИОЛОГИЯ
Вирус широко распространен в популяции; более 25% взрослого населения и 90% ВИЧинфицированных имеют антитела к HHV-8. Выявлены высокие уровни заболеваемости классической саркомой Капоши в странах Африки, особенно Центральной; низкие - в США, Японии и в некоторых северных европейских странах, средние - в большинстве средиземноморских стран. Установлено, что за 3-10 лет развитию саркомы Капоши предшествует инфекция, вызванная HHV-8.
Вирус передается половым путем. Кроме того, вирус может передаваться вертикально от матери к плоду. Чаще всего HHV-8 передается во время родов или после родов. Наибольшую концентрацию вируса отмечают в слюне.
ПАТОГЕНЕЗ И ПАТОМОРФОЛОГИЯ
Происхождение веретенообразных клеток - важного компонента бляшек и опухолей при саркоме Капоши подтверждено результатами ультраструктурных и иммуногистохимических исследований с маркерами CD31 и С34, в которых выяснено, что они являются трансформированными эндотелиальными клетками. Существует мнение о более вероятном происхождении саркомы Капоши из эндотелия лимфатических, а не кровеносных капилляров. При экспериментальном изучении характерного для саркомы Капоши неоангиогенеза в культуре клеток опухоли были выделены цитокины, стимулирующие рост клеточных культур данной опухоли, такие как ИЛ-6, фактор роста фибробластов (3FGF), трансформирующий фактор роста p (TGFp). Большое значение в развитии саркомы Капоши при СПИДе отводится онкостатину М - цитокину, вырабатываемому макрофагами и активированными Т-лимфоцитами. Он первично образуется в веретенообразных клетках саркомы Капоши и является аутокринным фактором роста для СПИД-ассоциированной саркомы Капоши.
Гистологическая структура опухоли характеризуется множеством хаотично расположенных тонкостенных новообразованных сосудов и пучков веретенообразных клеток. Характерна инфильтрация опухоли лимфоцитами и макрофагами. Сосудистый характер опухоли резко увеличивает риск кровотечений.
КЛИНИЧЕСКАЯ КАРТИНА
Первичная инфекция HHV-8 протекает бессимптомно. Манифестация саркомы Капоши на фоне иммуносупрессии проявляется характерными узелками багрово-синюшного, иногда бурого цвета, которые могут появиться на коже или на слизистой оболочке рта. Болезнь поражает легкие, желчевыводящую систему, другие органы.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Классическая форма характеризуется появлением локализованных узлов преимущественно на коже нижних конечностей. Встречается у лиц пожилого возраста, чаще у мужчин, в Центральной Европе и странах Средиземноморья, а также и в России. Заболевание протекает медленно, внутренние органы вовлекаются в процесс редко.
Эндемическая форма распространена в Центральной Африке. Болеют преимущественно дети. В процесс вовлекаются кожа, кости, внутренние органы, ЛУ, подкожная клетчатка, часто развивается лимфедема. Прогноз неблагоприятный, летальный исход наступает через 2-3 мес.
Иммуносупрессивная саркома Капоши возникает у лиц, длительно получающих иммуносупрессивную терапию, после трансплантации органов, при системных заболеваниях. Отличается более агрессивным течением. Начинается внезапно, характерно появление множественных элементов, которые быстро трансформируются в опухолевые узлы. Часто поражаются внутренние органы. Однако после прекращения иммуносупрессивной терапии саркома Капоши может спонтанно регрессировать.
Эпидемическая (СПИД-ассоциированная) саркома Капоши отличается агрессивным течением, распространением элементов сверху вниз, разнообразие морфологических элементов, с преобладанием бляшечных. Типичной локализации для данной формы саркомы Капоши нет. Элементы саркомы Капоши могут появляться на лице, часто на кончике носа, ушах, в слуховом проходе, на слизистых оболочках глаз и около глазницы, во рту, на половых органах, нижних конечностях. Часто в процесс вовлекаются внутренние органы.
Первичная лимфома серозных оболочек встречается у ВИЧ-инфицированных. Это редкий тип лимфом. Выявляется серозный экссудат, без объемных образований. В серозном экссудате обнаруживают большое количество лимфоцитов с признаками высокой степени злокачественности и герпесвирус человека 8-го типа. Не распространяется за пределы серозных полостей. Прогноз неблагоприятный. Продолжительность жизни от 2-6 мес. Многоочаговая болезнь Кастлемана - злокачественное лимфопролифератив-ное заболевание у ВИЧ-инфицированных. Больных беспокоят сильная слабость и недомогание. Отмечается значительное увеличение ЛУ. Наблюдается выраженная лихорадка, ночные поты, потеря веса. Выявляется выраженная спленомегалия, часто гепатомегалия, катаральные явления, отеки с гипоальбуминемией. Прогноз неблагоприятный. Для диагностики проводят биопсию ЛУ с последующим гистологическим и иммуногистохимическим исследованием. Средняя продолжительность жизни после постановки диагноза составляет 14 мес. Отмечается частая трансформация в высокозлокачественную лимфому.
ДИАГНОСТИКА
Для диагностики HHV-8 преимущественно используют серологические исследования (ИФА, иммуноблоттинг) и ПЦР.
Дифференциальная диагностика
Саркому Капоши дифференцируют в первую очередь с гетерогенной группой сосудистых пролифераций [псевдоангиосаркома Массона, псевдосаркома Капоши типа Мали (акроангиодерматит), мишенеподобная гемосидеротическая гемангио-ма и др.].
ЛЕЧЕНИЕ
Местная терапия: инъекции винбластина по 0,1 мл/см2 в ткань опухоли с интервалом 3-4 нед. При поверхностной и бляшечной форме - облучение мягкими Rö-лучами 4-5 гр/день 3 р/нед. Лучевая терапия при обширном распространении опухоли 400 рад/нед в течение 6 нед.
Хирургическое лечение с осторожностью. Химиотерапия: проспидия хлорид (Проспидин♠) 100 мг в/м ежедневно на курс 3-6 г; липосомальные антрациклины: доксорубицин (Келикс♠) 20 мг/м2 в/в каждые 2-3 нед, курс 6-8 введений; даунорубицин (дауноксρ) 40 мг/м2 в/в каждые
2 нед. Интерферонотерапия: рекомбинантный ИФН-α2b 3-6 млн МЕ/м2 п/к в день 3-5 р/нед. ПЭГ-ИФН 50 мкг/нед п/к.
ПРОФИЛАКТИКА
Первичная профилактика саркомы Капоши заключается в активном выявлении больных и групп повышенного риска по развитию этого заболевания.
Особое внимание должно уделяться пациентам, получающим иммуносупрессив-ную терапию. В этих группах важно обнаружение лиц, инфицированных HHV-8.
Вторичная профилактика включает диспансерное наблюдение за больными в целях предотвращения рецидива (возврата) заболевания, осложнений после лечения и реабилитацию больных.
21.12. КОРЬ
Корь - острая высококонтагиозная антропонозная вирусная болезнь с аэрозольным механизмом передачи возбудителя, характеризующаяся циклическим течением, общей интоксикацией, макулопапулезной сыпью, патогномоничными высыпаниями на слизистой оболочке рта, катарально-респираторным синдромом и конъюнктивитом.
КОДЫ ПО МКБ-10 В05 Корь.
B05.0 Корь, осложненная энцефалитом.
B05.1 Корь, осложненная менингитом.
B05.2 Корь, осложненная пневмонией.
B05.3 Корь, осложненная отитом.
B05.4 Корь с кишечными осложнениями.
B05.8 Корь с другими осложнениями (кератит).
B05.9 Корь без осложнений. ЭТИОЛОГИЯ
Возбудитель кори - РНК-содержащий вирус, семейства парамиксовирусов, рода коревых вирусов, включающего вирус кори человека, вирус кори рогатого скота, вирус чумы собак и вирус подострого склерозирующего панэнцефалита. Вирусная частица плейоморфна, имеет округлую форму, мембранную оболочку и спиральный нуклеокапсид, образованный тремя белками вируса и РНК. Имеется липопротеидная мембрана, обеспечивающая адгезию, проникновение и размножение вируса в чувствительных клетках хозяина, и гликопротеидная мембрана, представленная гемагглютинином (белок Н) и гемолизином (F), которые индуцируют образование специфических антител - основу гуморального иммунитета. При размножении вирус кори вызывает образование многоядерных гигантских клеток-симпластов и эозинофильных включений. Многоядерные клетки образуются путем слияния мембран близлежащих клеток. Формирование дочернего вируса кори происходит путем «почкования» на поверхности зараженных клеток. Вирус кори высококонтагиозен, но неустойчив в окружающей среде, он быстро погибает под воздействием солнечного света, ультрафиолетового излучения, при высыхании. В высушенном состоянии при температуре -20 °С вирус не теряет активности в течение года. При температуре 37 °С инактивация 50% популяции вируса наступает через 2 ч, при 56 °С вирус гибнет через 30 мин, при 60 °С - мгновенно. Он инактивируется 0,00025% раствором формалина, чувствителен к эфиру, кислой среде (рН <4,5).
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
ЭПИДЕМИОЛОГИЯ И ПРОФИЛАКТИКА
Успехи иммунизации позволили отнести корь к «уходящим» инфекциям, включенным в Национальную программу элиминации кори, цель которой - возможность ликвидации данного заболевания в нашей стране к 2010 г. Программа была рассчитана на несколько этапов: на 1-м этапе (2002-2004 гг.) планировалось достижение повсеместной стабилизации показателей заболеваемости корью на спорадическом уровне во всех регионах страны, на 2-м (2005-2007 гг.) - создание условий для предупреждения возникновения случаев кори и полного искоренения коревой
инфекции в России, на 3-м (2008-2010 гг.) - сертификация свободных от кори территорий. Однако в 2011 г. ситуация резко изменилась. Заболеваемость корью в 2012 г. по сравнению с 2011 г. выросла в 3,38 раза и составила 1,49 на 100 тыс. населения против 0,44 в 2011 г., а по сравнению с 2010 г. увеличилась в 16,5 раза. Особенностью 2012 г. явилось увеличение числа внутрибольничных вспышек кори с вовлечением непривитых детей, находящихся на лечении, и медицинского персонала. В 2013 г. заболеваемость корью увеличилась на 9,4% и составила 1,63 на 100 тыс. населения. В 2014 г. продолжился эпидемический подъем кори, заболеваемость выросла в 2 раза и составила 3,23 на 100 тыс. населения. В 2015 г. отмечалось снижение заболеваемости корью в 5,7 раза, показатель составил 0,58 на 100 тыс. населения.
Источник возбудителя - больной человек. Индекс контагиозности составляет 95-96%. Больные заразны в течение 1-2 сут до появления симптомов и до конца 4-х суток с момента появления сыпи. При развитии пневмонии сроки выделения вируса увеличиваются. Путь передачи - воздушно-капельный, заражение возможно даже при кратковременном контакте. От источника вирус потоками воздуха по вентиляционным ходам может распространяться в другие помещения. Лица, не болевшие корью и не привитые против нее, остаются высоко восприимчивыми к возбудителю в течение всей жизни и могут заболеть в любом возрасте.
Корь распространена повсеместно; в естественных условиях болеют только люди, в эксперименте возможно заражение приматов. До введения вакцинации подъемы заболеваемости корью регистрировались каждые 2 года. После введения массовой вакцинации и ревакцинации периоды эпидемиологического благополучия стали более продолжительными (8-9 лет). Для кори характерна зимне-весенняя сезонность заболеваемости, меньше всего болеют корью осенью.
После перенесенной естественной коревой инфекции остается стойкий иммунитет.
Повторные заболевания корью встречаются редко. Иммунитет после прививок более кратковременный.
Основной метод профилактики - специфическая профилактика противо-коревой вакциной. Современные вакцины обладают профилактической эффективностью 95-98%. За период с 2000 по 2014 г. противокоревая вакцинация привела к снижению глобальной смертности от кори на 79%. По данным ВОЗ, в 2000-2014 гг. вакцинация от кори предотвратила 17,1 млн случаев смерти, сделав вакцину от кори одним из наиболее эффективных достижений общественного здравоохранения.
Современные вакцины национального календаря прививок:
◊вакцина живая коревая культуральная сухая ЖКВ (Россия);
◊вакцина паротитно-коревая культуральная живая сухая АПКВ (Россия);
◊Рувакс♠ живая вакцина против кори (Франция);
◊M-M-R-II живая вакцина против кори, эпидемического паротита и краснухи (Нидерланды);
◊Приорикс♠ живая вакцина против кори, эпидемического паротита и краснухи (Бельгия);
◊ вакцина против кори, паротита и краснухи КПК (Индия).
Коревая вакцина предназначена для плановой и экстренной профилактики кори. Плановые прививки проводятся в 12 мес и 6 лет детям, не болевшим корью. Восприимчивых к кори взрослых тоже надо иммунизировать. Невосприимчивые люди - переболевшие корью, получившие 2 дозы вакцины или имеющие защитный титр противокоревых антител. Вакцинация против кори противопоказана при клеточном иммунодефиците, во время беременности и при аллергических ГНТ на яичный белок или неомицин в анамнезе.
Восприимчивым к кори детям и взрослым в случае контакта с больным при отсутствии противопоказаний проводят иммунизацию живой коревой вакциной, но не позднее 72 ч после предполагаемого контакта. Детям, не привитым против кори (не достигшим прививочного возраста или не получившим прививки в связи с медицинскими противопоказаниями или отказом от прививок) не позднее 5-го дня с момента контакта с больным вводится иммуноглобулин человека нормальный (далее - иммуноглобулин) в соответствии с инструкцией по его применению.
Метод неспецифической профилактики - ранняя изоляция больного с целью предупреждения дальнейшего распространения заболевания. Больные подлежат изоляции в течение 7 дней, при развитии осложнений - 17 дней от начала заболевания.
Детей, не привитых и не болевших, контактировавших с больными корью, не допускают в детские учреждения в течение 17 дней с момента контакта. Первые 7 дней от начала контакта дети разобщению не подлежат.
Противоэпидемические мероприятия в очаге
Если очаг инфекции зарегистрирован в детском дошкольном учреждении или школе, то на срок с момента выявления первого больного до 21 дня с момента выявления последнего больного в коллектив не принимаются дети, не болевшие корью и не привитые против нее. Больных корью госпитализируют при наличии показаний на срок до исчезновения клинических симптомов, но не менее 5 дней с момента появления сыпи с обязательным лабораторным обследованием. Реконвалесцентов можно допускать в коллектив после клинического выздоровления даже при наличии вторичных случаев инфекции в очаге. Контактные лица в очагах кори ежедневно осматриваются врачом или медсестрой. При наличии среди контактных лиц не привитых (или привитых однократно) и не болевших корью за ними устанавливается медицинское наблюдение в течение 21 дня с момента выявления первого случая заболевания в очаге, проводится их лабораторное обследование в те же сроки, что и больным.
С целью предупреждения распространения инфекции в очагах не позднее 72 ч с момента выявления первого больного проводится вакцинация (ревакцинация) против кори следующим категориям контактных лиц в возрасте до 35 лет: не болевшим и не привитым ранее; не болевшим и привитым однократно, если с момента прививки прошло не менее 6 мес; при неизвестном инфекционном и прививочном анамнезе; серонегативным или имеющим титр антител ниже защитного уровня. При наличии противопоказаний к вакцинации, а также детям, не достигшим прививочного возраста, из числа контактных вводится иммуноглобулин человека нормальный в соответствии с инструкцией, не позднее 5-го дня с момента первого контакта с больным корью. Неиммунные дети, контактные по кори, подлежат разобщению с 9-го по 17-й день. На вакцинированных против кори детей карантин не накладывается, если контакт произошел не ранее 21 дня после иммунизации.
ПАТОГЕНЕЗ
Вирус кори обладает эпителиотропными, лимфотропными и нейротропными свойствами. Входными воротами для вируса является слизистая оболочка дыхательных путей и, возможно, конъюнктива глаз, где осуществляется адгезия вируса и откуда он попадает в
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
регионарные ЛУ, в которых начинается его репликация. С 3-4-го дня инкубационного периода вирус проникает в кровь (первичная виру-семия, во время которой его можно частично нейтрализовать парентеральным введением иммуноглобулина) и оседает в ЛУ, печени, селезенке. Начинается новый этап интенсивного размножения вируса в этих органах, в результате которого образуются гигантские многоядерные клетки, несущие коревой антиген. Размножившийся вирус снова проникает в кровь (вторичная вирусемия), что соот-
ветствует началу заболевания. В капиллярах слизистых оболочек и кожи происходит контакт сенсибилизированных Т-клеток и клеток, несущих коревой антиген, и реакция ГЗТ, клинически проявляющаяся характерной сыпью на коже и пятнами Филатова-Бельского- Коплика на слизистой оболочке полости рта. При электронной микроскопии материала, взятого из пятен Филатова-Бельского-Коплика и кожных высыпаний, обнаруживаются скопления вируса. С последних дней инкубации в течение 1-2 дней после появления сыпи вирус можно выделить из крови.
Эпителиотропные свойства вируса реализуются клинически воспалительной реакцией в дыхательных путях (коревой бронхит, пневмония) и пищеварительном тракте (абдоминальный синдром, диарея). Нейротропные свойства коревого вируса клинически ассоциируются с развитием инфекционного токсикоза с возможным возникновением энцефалической реакции у детей младшего возраста или коревого менингоэнцефалита у детей старшего возраста и взрослых.
Лимфотропные свойства вируса проявляются увеличением ЛУ (преимущественно шейных), печени, селезенки и особенно повреждением иммунокомпетентных клеток с развитием иммуносупрессии, предрасполагающим к возникновению бактериальных осложнений. В гиперплазированных лимфоидных тканях, в частности в ЛУ, миндалинах, селезенке, вилочковой железе, можно обнаружить гигантские ретикулоэндотелиоциты (клетки УортинаФинкельдея). Во многих лейкоцитах выявляют разрушенные хромосомы.
С 3-го дня высыпания вирусемия резко снижается, а с 4-го дня вирус в крови обычно не обнаруживается, с этого времени в крови появляются вируснейтрали-зующие антитела. При кори развивается специфическая аллергическая перестройка организма, сохраняющаяся длительное время. У привитых со временем резко снижаются титры антител к вирусу кори, тогда как аллергизация сохраняется длительно, что обусловливает атипичное течение болезни спустя 5-7 лет после прививки.
Самые значительные изменения происходят в органах дыхания. С первого дня болезни наблюдается воспаление слизистой оболочки носа, гортани, трахеи, бронхов, бронхиол и альвеол. Воспалительный процесс углубляется, захватывает не только слизистую бронха, но и мышечную, перибронхиальную ткань, вызывая панбронхит. Иногда интерстициальный коревой пневмонит переходит в характерную для этой болезни гигантоклеточную пневмонию, при которой в альвеолах обнаруживают типичные для кори гигантские клетки.
Со стороны органов ЖКТ отмечается катаральный или язвенный стоматит, катаральный колит с наличием в лимфоидных фолликулах и групповых лимфатических фолликулах (пейеровых бляшках) специфических клеток (ретикулоэндоте-лиоцитов). Поздние поражения пищеварительного канала являются, как правило, следствиемприсоединения вторичной инфекции.
КЛАССИФИКАЦИЯ КОРИ По тяжести: легкая, среднетяжелая, тяжелая.
По течению: типичная, атипичная, с вариантами течения: абортивное, митиги-рованное, стертое, бессимптомная инфекция.
КЛИНИЧЕСКАЯ КАРТИНА
ВОЗ предложено стандартное определение заболевшего корью: «любой человек с температурой 38 °С и выше, пятнисто-папулезной (не везикулярной) сыпью и хотя бы одним из следующих симптомов: кашель, насморк, конъюнктивит; или любой другой человек, у которого медицинские работники подозревают корь».
Периоды заболевания: инкубационный, продромальный (катаральный), период экзантемы (высыпания), период пигментации.
Инкубационный период - 9-17 дней, при введении иммуноглобулина может удлиниться до 21 дня, реже - дольше.
Клиническая картина современной кори у неиммунных лиц не изменилась. Корь сохранила характерные клинические симптомы, стадийность инфекционного процесса.
В продромальном периоде (продолжительность 2-4 сут у детей и до 5-8 сут у взрослых) характерны симптомы респираторной инфекции: кашель, насморк с обильными выделениями из носа, конъюнктивит со слезотечением, лихорадка (до 40 °С), связанная со второй волной вирусемии. Незадолго до сыпи появляются пятна Филатова-Бельского-Коплика (голубоватобелые, диаметром 1-2 мм, с ярко-красной каймой), иногда обильные, сливающиеся между собой, располагающиеся на слизистой оболочке щек напротив вторых моляров. С появлением сыпи пятна вскоре исчезают. Слизистая щек и поверхности губ отечна, гиперемирова-на, губы иногда краснеют. У части больных на лице, туловище и конечностях на 2-3-й день появляется продромальная мелкопятнистая зудящая сыпь.
Период высыпания характеризуется усилением интоксикации, катаральных явлений, нарастанием лихорадки, на 4-8-й день появляется сыпь на голове вдоль линии роста волос и за ушами, распространяется на лицо, туловище и конечности, в том числе на ладони и стопы, часто становясь сливной: в 1-е сутки элементы сыпи появляются на лице, шее; на 2-е сутки - на туловище, руках и бедрах; на 3-и сутки сыпь захватывает голени и стопы, а на лице начинает бледнеть. Наиболее густо элементы сыпи расположены на лице, шее и верхней части туловища. Элементами сыпи являются мелкие папулы (около 2 мм), сливающиеся между собой и окруженные неправильной формы пятном диаметром более 10 мм. Даже при самой обильной сыпи можно обнаружить участки кожи нормальной окраски. В некоторых случаях на фоне коревой экзантемы можно заметить кровоизлияния (петехии).
В период высыпания состояние больных наиболее тяжелое. На 4-е сутки сыпь начинает бледнеть в том же порядке, в каком она появилась. Пигментация сохраняется 1-2 нед, отрубевидное шелушение на лице и туловище - 5-7 дней. Температура нормализуется на 4-5-е сутки от начала высыпания. Более длительная лихорадка указывает на развитие осложнений.
Стертая форма кори характеризуется тем, что все основные симптомы заболевания выражены слабо, а иногда отсутствуют.
Митигированная корь развивается у детей после введения в инкубационном периоде иммуноглобулина или других препаратов, содержащих антитела, а также у грудных детей, не утративших полностью врожденного иммунитета. Заболевание протекает при слабо выраженных симптомах интоксикации; укорачивается и нарушается этапность высыпаний.
Корь может иметь неосложненное и осложненное течение. По срокам развития различают ранние осложнения, обусловленные вирусом кори, возникающие в остром катаральном периоде и периоде высыпаний, и поздние, вызванные вторичной инфекцией в периоды пигментации и реконвалесценции.
В настоящее время наиболее частыми осложнениями кори являются коревой круп, ларинготрахеит, отит, бронхит, пневмония, синусит, стоматит, колит и энтероколит, импетиго, фурункулез. Развитие пневмонии возможно в любом периоде болезни. По своему характеру ранние пневмонии протекают как бронхопневмонии или интерстициальные пневмонии, отличаются тяжелым течением, выраженными симптомами интоксикации, дыхательной и
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
сердечной недостаточности. Поздние пневмонии характеризуются ухудшением состояния ребенка после 5-го дня высыпаний, повышением температуры тела, развитием ДН, появлением физикальных изменений в легких в виде мелко- и среднепузырчатых хрипов с рентгенологическими признаками очаговой пневмонии. Наиболее тяжело протекают пневмонии у детей раннего возраста.
К осложнениям со стороны ЦНС относятся серозный менингит, энцефалит, менингоэнцефалит, встречающиеся с частотой 1:1000 случаев кори и отличающиеся тяжелым течением с возможным летальным исходом. При коревом энцефалите различают наиболее типичные синдромы: коматозный, судорожный, гемиплеги-ческий, акинетико-ригидный, психоорганический и др. Острый коревой энцефалит развивается чаще у детей старшего возраста и взрослых как при тяжелой, так и при легкой форме кори на 3-5-й день после появления сыпи. На фоне повышения температуры тела до высоких цифр появляются головная боль, сонливость, переходящая в некоторых случаях в сопор или кому. На фоне нарушения сознания возникают судороги генерализованные или фокальные, параличи и парезы, гемипарезы, реже монопарезы. Возможны очаговые симптомы: гиперкинезы разного характера, мозжечковая атаксия, нистагм, диэнцефальные нарушения, парезы черепных нервов, чаще всего лицевого и зрительного, носящие обратимый характер. Поражение спинного мозга в виде миелита и полирадикулоневрита проявляется нарушением функции тазовых органов, развитием нижней параплегии, проводниковыми расстройствами чувствительности, трофическими расстройствами. Серозный менингит характеризуется появлением на фоне кори головной боли, менингеальных симптомов, рвоты, общетоксического синдрома. В СМЖ - умеренный плеоцитоз лимфоцитарного или смешанного характера, содержание белка может быть повышено.
Подострый склерозирующий панэнцефалит - медленная коревая нейроинфек-ция с длительным инкубационным периодом (до 8-10 лет после перенесенной кори). Заболевание развивается латентно, проявляется хроническим нейроасте-ническим синдромом, головной болью, вялостью, слабостью, быстрой утомляемостью. Наблюдаются изменения в психоэмоциональной сфере: нарушение памяти, реже снижение способности к обучению, расторможенность. Постепенно присоединяются пирамидные и экстрапирамидные симптомы, появляются эпилептические припадки, гиперкинезы. Характерно снижение интеллекта, панагнозия.
Особенности течения кори у детей 1-го года жизни: в периоде продромы катаральные явления слабо выражены, заболевание может начинаться с появления сыпи, сохраняются этапность высыпания и пятнисто-папулезный характер сыпи с последующей пигментацией. Симптом Филатова-Коплика может отсутствовать. Для детей раннего возраста характерно появление дисфункции кишечника (частый жидкий стул). Течение кори у детей первого года жизни более тяжелое, отличается более частым развитием ранних и поздних осложнений.
ДИАГНОСТИКА
В условиях некоторого снижения уровня заболеваемости в 2015 г. диагностика кори носит комплексный характер и предусматривает оценку эпидемической ситуации в окружении больного, клиническое наблюдение в динамике и серологическое обследование. Типичную корь с пятнами Филатова-Бельского-Коплика, кашлем, ринитом, конъюнктивитом и сыпью легко диагностировать на основе клинической картины.
Выявление в сыворотке крови больного (лиц с подозрением на заболевание) специфических антител, относящихся к IgМ, методом ИФА является основанием для установления (подтверждения) диагноза. При выявлении IgM к вирусу кори у лиц с лихорадкой и пятнистопапулезной сыпью, обследуемых в рамках активного эпидемиологического надзора за корью, дополнительно проводится одновременное исследование парных сывороток крови на IgG. Взятие крови для исследований осуществляется на 4-5-й день с момента появления сыпи (1-я сыворотка) и не ранее чем через 10-14 дней от даты взятия первой пробы (2-я сыворотка).
Нарастание титра специфических IgG антител в 4 и более раз является основанием для подтверждение диагноза «корь».
ПЦР позволяет диагностировать корь в ранние сроки при наличии вирусемии вне зависимости от клинической картины. В более поздние сроки исследуют мочу, носоглоточные смывы, СМЖ.
Инструментальные методы исследования (рентгенография органов грудной клетки, МРТ головного мозга и др.) применяют при подозрении на развитие осложнений.
Дифференциальная диагностика при кори проводится с краснухой, скарлатиной, ИМ, аллергическими сыпями (табл. 21.30), энтеровирусной инфекцией, инфекционной эритемой, внезапной экзантемой.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Энтеровирусная экзантема обычно сочетается с другими проявлениями энте-ровирусной инфекции (лихорадка, миалгия, поражение ЖКТ и пр.) и напоминает таковую при кори, краснухе или скарлатине, захватывая лицо, туловище, конечности. Характерной для вируса Коксаки А (серотипы 5, 10, 16) является локализация сыпи на кистях, стопах и в полости рта в виде везикул до 3 мм в диаметре с венчиком гиперемии.
Инфекционная эритема, обусловленная парвовирусом В19, отличается появлением сыпи, преимущественно на лице, напоминающей следы от пощечин. Иногда эритема может распространяться на туловище и конечности. Кроме того, могут отмечаться поражения суставов и апластические кризы с угнетением эритроидного ростка.
Внезапная экзантема, этиологическим фактором которой является вирус герпеса 6-го типа, характеризуется высокой лихорадкой в течение 4 дней с литической нормализацией температуры тела на 5-е сутки, что сопровождается одномоментным появлением розеолезной (реже пятнисто-папулезной) сыпи на туловище и конечностях, в меньшей степени на лице. Элементы исчезают через несколько дней бесследно, без пигментации, иногда на лице возможно мелкое отрубевидное шелушение.
Показания к консультации других специалистов
При развитии отита, ларингита и ларинготрахеита показана консультация оториноларинголога с последующей коррекцией терапии, а также врача-физиотерапевта. При длительном течении конъюнктивита, развитии кератоконъюнктивита необходима консультация офтальмолога, а при подозрении на энцефалит или менингоэнцефалит - невропатолога.
ЛЕЧЕНИЕ Показания для госпитализации
Госпитализируют детей из приютов, детских домов, общежитий, социальнонеблагополучных семей, а также больных с тяжелыми и осложненными формами заболевания.
Режим. Диета
Режим постельный на все время лихорадочного периода. Кровать пациента должна находиться головным концом к окну, чтобы свет не раздражал глаза, искусственное освещение в комнате или палате должно быть приглушенным.
В рацион больного необходимо включить фруктовые соки, морсы, пища должна быть полноценной, богатой витаминами, легко усваиваться.
Медикаментозная терапия
Минздравом России разработаны стандарты специализированной медицинской помощи детям при легкой, среднетяжелой и тяжелой формах кори (приказы Минздрава России от 9 ноября 2012 г. № 765н, 766н, 811н).
Симптоматическая терапия включает жаропонижающие средства при лихорадке 38,5 °С и выше (парацетамол), адреномиметики (ксилометазолин), муко-литические препараты (ацетилцистеин). Обосновано применение ИФН-α в катаральном периоде и периоде высыпания. При коревом крупе показана ингаляционная терапия (глюкокортикоиды), при тяжелом крупе - при неэффективности ингаляционного введения - внутривенно или внутримышечно. Антибактериальная терапия назначается при тяжелых формах кори (независимо от возраста заболевших), при среднетяжелых формах у детей до первого года жизни и при бактериальных осложнениях. Рекомендуются защищенные пени-циллины, макролиды и ЦС II-III поколения парентерально в возрастных дозах. При коревом энцефалите рекомендуются применение рекомбинантных ИФН, глюкокортикоиды, нейропротекторов, препаратов, улучшающих микроциркуляцию и тканевый метаболизм, дегидратация петлевыми диуретиками.
Дополнительные методы лечения
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Физиотерапевтические методы лечения кори - массаж органов грудной клетки и дыхательная гимнастика (назначается и контролируется врачом ЛФК). При развитии крупа, ярко выраженных симптомов ларинготрахеита проводят ингаляции с щелочными растворами, бронхолитиками, муколитиками. При сухом кашле и сухих хрипах в легких показано воздействие коротким ультрафиолетовым излучением, электрическим полем ультравысокой частоты.
Прогноз
При неосложненном течении заболевания прогноз благоприятный. При развитии пневмонии, энцефалита, неадекватном несвоевременном лечении возможен летальный исход.
Диспансеризация
Диспансерное наблюдение в неосложненных случаях не требуется. Дети, перенесшие коревой энцефалит, подлежат наблюдению неврологом, офтальмологом, инфекционистом в течение 2 лет с проведением курсов восстановительного лечения.
21.13. КРАСНУХА
ОПРЕДЕЛЕНИЕ БОЛЕЗНИ
Краснуха (Rubeola) - острая антропонозная инфекционная болезнь, передающаяся воздушнокапельным путем, проявляющаяся умеренной интоксикацией, лихорадкой, мелкопятнистой сыпью, полиаденопатией и высоким риском поражения плода при развитии заболевания у беременных.
КОДЫ ПО МКБ-10 В06 Краснуха [немецкая корь]. В06.0 Краснуха с неврологическими осложнениями.
B06.8 Краснуха с другими осложнениями.
B06.9 Краснуха без осложнений. ЭТИОЛОГИЯ
Возбудитель краснухи - Rubella virus - относится к
семейству Togaviridae, роду Rubivirus. Вирион краснухи сферической формы, 40-80 нм в диаметре, состоит из наружной оболочки с характерными выступами, представленными гемагглютинином, и нуклеокапсида. Геном образован несегментированной одно-цепочечной молекулой +РНК. Вирион состоит из трех белков, два из которых являются поверхностными гликопротеинами (E1 и E2), а один - внутренним негликозилированным капсидным белком (С), участвующим в структурной организации РНК. Гемагглютинация и нейтрализация вируса обеспечиваются за счет поверхностного белка E1. Генетическое разнообразие Rubella virus обусловлено наличием различий в структуре белка E2. Вирус чувствителен к действию химических агентов. Инактивируется под действием эфира, хлороформа, формалина. При температуре 56 °С погибает через 30 мин, при 100 °С - через 2 мин, при воздействии ультрафиолетового облучения - через 30 с. При наличии в среде белка устойчивость вируса повышается. Вирус хорошо сохраняет биологическую активность при низких температурах. Оптимальная для вируса рН - 6,8-8,1. Вирус может размножаться во многих видах первичных и перевиваемых культур ткани человека, обезьяны, кролика, быка, птицы. Вирионы формируются в цитоплазме чувствительной клетки. Вирус оказывает слабое цитопатогенное действие, имеет способность к длительной персистенции. Репродукция вируса краснухи в культурах тканей сопровождается образованием ИФН. В 2005 г. Российская Федерация была определена экспертами ВОЗ как единственная территория с эндемичной циркуляцией штаммов вируса краснухи генотипа 2С. Однако, начиная с 2004 г., на территории РФ отмечено появление новых геновариантов вируса краснухи, принадлежащих к 1-й
генетической линии. В период 2004-2009 гг. на территориях РФ и СНГ циркулировали генотипы 1H, 1G, 1E, с преобладанием изолятов вируса краснухи 1Е генотипа. ЭПИДЕМИОЛОГИЯ
В РФ выполнение Национального проекта «Здоровье» позволило существенно снизить значимость краснушной инфекции в структуре инфекций, передающихся воздушнокапельным путем (без гриппа и ОРВИ), с 40% в 2001 г. до 0,17%. В 2014 г. показатель заболеваемости краснухой в РФ составил 0,04 на 100 тыс. населения. В 2014 г. зарегистрировано 54 случая заболевания краснухой, в том числе 14 слу-
чаев у детей до 17 лет и 12 случаев у детей до 14 лет (в 2013 г. 172, 21 и 13 соответственно). Случаи заболевания краснухой зарегистрированы в Астраханской, Амурской, Сахалинской, Московской, Воронежской, Ростовской областях, Москве и Санкт-Петербурге, Ставропольском, Забайкальском, Краснодарском краях, Удмуртской Республике, Республике Марий Эл, Республике Дагестан, Чеченской Республике. Массовая вакцинация детей в ходе реализации программы «Здоровье» привела к смещению заболеваемости в старшие возрастные группы. В 2010 г. 69% заболевших краснухой составили лица в возрасте 15 лет и старше. Увеличение доли взрослых в структуре заболевших создает возможность вовлечения в эпидемический процесс женщин репродуктивного возраста и сохраняет потенциальную опасность рождения детей с синдромом врожденной краснухи (СВК). В мире ежегодно рождаются более 100 тыс. детей с СВК. Самые высокие показатели СВК наблюдаются в Африканском регионе и в Юго-Восточной Азии, где отмечается самый низкий уровень охвата вакцинацией.
Источник возбудителя инфекции - больные, в том числе со стертым и атипичным течением болезни, лица с бессимптомной инфекцией и вирусоносители. Человек является единственным известным носителем вируса краснухи. Вирус выделяется из слизи ВДП за 1-2 нед до появления сыпи и в течение 3 нед после высыпания. У детей с врожденной краснухой возбудитель может выделяться с мочой, мокротой, калом до 2 лет после рождения. Основной путь передачи возбудителя - воздушно-капельный. Вирусемия, развивающаяся при краснухе, обусловливает внутриутробный путь передачи возбудителя от матери плоду, а также вероятность парентеральной передачи. Передача возбудителя через предметы обихода не имеет практического значения. Восприимчивость к краснухе высокая. Невосприимчивы к инфекции дети первого полугодия жизни, если у матери есть иммунитет к этой инфекции. Наиболее восприимчивы дети в возрасте от 1 до 9 лет, большинство которых не имеют противокраснушного иммунитета. Постинфекционный иммунитет в большинстве случаев пожизненный, повторные случаи заболевания крайне редки. Анализ состояния специфического иммунитета населения Российской Федерации к вирусам краснухи в 2014 г. показал отсутствие тенденции к накоплению лиц, не имеющих защитных антител. В целом по Российской Федерации доля незащищенных лиц составила 4,5%. При краснухе наблюдают разные формы эпидемического процесса. Для крупных городов характерна постоянная заболеваемость с сезонными зимне-весенними подъемами. Могут быть эпидемические вспышки, возникающие обычно с интервалом 7 лет. Заболеваемость краснухой характеризуется выраженной очаговостью в детских коллективах. Болезнь распространяется там, где люди находятся в длительном и тесном контакте (семья, школа, детский сад, больница).
МЕРЫ ПРОФИЛАКТИКИ
Больных изолируют на дому в течение 5 сут с момента высыпания. Дезинфекцию и разобщение контактных детей не проводят. Основу профилактики составляет вакцинация, проводимая в России с 1997 г. Вакцинацию проводят в возрасте 12 мес и 6 лет. Однократное введение вакцины приводит к формированию иммунитета у 95% вакцинированных. Вакцинации подлежат также девочки 13 лет, не болевшие краснухой, при отсутствии данных о вакцинации. Рекомендуют вакцинировать и женщин фертильного возраста, не
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
вакцинированных в детстве, не болевших краснухой и имеющих концентрации антител против краснухи ниже защитного уровня. Прививка противопоказана беременным, после вакцинации женщинам необходимо предохраняться от беременности в течение 3 мес. Вакцинацию проводят живыми аттенуированными моновакцинами либо, чаще всего, комбиниро-
ванными вакцинами. В России сертифицированы следующие вакцины для профилактики краснухи:
◊вакцина для профилактики краснухи (Рудивакс♠¤) (Франция);
◊вакцина для профилактики краснухи (Вакцина против краснухи живая атте-нуированная♠) (Индия);
◊вакцина для профилактики краснухи (Вакцина против краснухи живая атте-нуированная♠) (Хорватия);
◊вакцина для профилактики краснухи (Вакцина против краснухи культуральная живая аттенуированная♠) (Россия);
◊вакцина для профилактики кори, краснухи и паротита (М-М-Р II♠) (Нидерланды);
◊вакцина для профилактики кори, краснухи и паротита (Приорикс♠) (Бельгия);
◊вакцина против кори, эпидемического паротита и краснухи живая аттенуиро-ванная лиофилизированная (Индия).
Побочные реакции на вакцинацию обычно бывают легкими. Они могут включать боль и покраснение в месте инъекции, незначительное повышение температуры, сыпь и мышечные боли. Для профилактики врожденной краснухи женщинам, заболевшим краснухой или имевшим контакт с больными краснухой (при отсутствии вакцинации и краснухи в анамнезе), рекомендуют прерывание беременности.
В апреле 2012 г. «Инициатива по борьбе с корью и краснухой» объявила о новом глобальном стратегическом плане борьбы с корью и краснухой, охватывающем период 2012-2020 гг. План включает новые глобальные цели на 2015 и
2020 гг.
Цели на конец 2015 г.:
◊ снизить глобальную смертность от кори по меньшей мере на 95% по сравнению с уровнями 2000 г.; ◊ достигнуть региональных целей в области ликвидации кори и краснухи/
СВК.
Цели на конец 2020 г.:
◊завершить ликвидацию кори и краснухи по меньшей мере в 5 регионах ВОЗ. Стратегия направлена на осуществление 5 основных компонентов:
◊обеспечить и поддерживать высокий уровень охвата вакцинацией 2 дозами вакцин, содержащих компоненты против кори и краснухи;
◊проводить мониторинг за болезнью, используя эффективный эпиднадзор, и оценивать программные усилия по обеспечению прогресса и позитивного воздействия мероприятий по вакцинации;
◊обеспечить и поддерживать готовность к вспышкам болезни, быстрые ответные меры на такие вспышки и эффективное лечение пациентов;
◊передавать информацию и проводить работу для формирования общественного доверия и спроса на иммунизацию;
◊проводить научные исследования и разработки, необходимые для поддержки эффективных по стоимости действий и для улучшения вакцинации и диагностических методик.
Преодолению негативных тенденций в развитии эпидемиологической ситуации должна способствовать реализация комплекса мероприятий в рамках программы «Профилактика кори и краснухи в период верификации их элиминации в Российской Федерации (20132015)», основными из которых являются повышение качества противоэпидемических мероприятий, включая иммунизацию мигрантов, цыганского населения и других групп риска.
ПАТОМОРФОЛОГИЯ И ПАТОГЕНЕЗ Вирус проникает в организм через слизистые оболочки ВДП. Наиболее вероятными местами
первичной репликации вируса являются носоглотка и регионарные
ЛУ. Через 5-7 дней после инфицирования развивается вирусемия, и вирус выделяется в окружающую среду с выдыхаемым воздухом, мочой и испражнениями. В дальнейшем вирус размножается в ЛУ (этот процесс сопровождается полиаде-нопатией), а также в эпителии кожи, приводя к появлению сыпи. Вирус проникает через ГЭБ и плаценту. В результате активации продукции ИФН, формирования клеточного и гуморального иммунитета циркуляция вируса прекращается, и наступает выздоровление. Однако у беременных и детей с врожденной краснухой вирус может персистировать в организме длительное время. При врожденной краснухе вирус попадает в плод через плаценту, инфицирует эпителий ворсинок хориона и эндотелий кровеносных сосудов плаценты, затем попадает в кровоток плода. При этом поражаются органы и ткани, находящиеся в процессе формирования, т.е. в так называемом критическом периоде внутриутробного развития (для мозга это 3-11-я неделя беременности, для глаз и сердца - 4-7-я, для органа слуха -7-12-я). Психомоторные нарушения плода развиваются при заболевании матери краснухой на 3-4-м месяце беременности. Сформировавшийся плод относительно устойчив к действию вируса. Частота поражения плода зависит от срока беременности. Заражение краснухой на 1-4-й неделе беременности приводит к поражению плода в 60% случаев, на 9-12-й неделе - в 15% случаев, на 13-16-й неделе - в 7% случаев. Чем раньше произошло инфицирование плода, тем тяжелее и многообразнее его поражения. В основе развития пороков и аномалий плода лежит способность вируса подавлять митотическую активность клеток и, в меньшей степени, его прямое цитопатическое действие.
КЛИНИЧЕСКАЯ КАРТИНА
Общепринятой классификации краснухи нет. Принято выделять приобретенную и врожденную краснуху. Приобретенную краснуху подразделяют на типичную, атипичную (без сыпи) и субклиническую (инаппарантную). Врожденную краснуху классифицируют в зависимости от преобладающего поражения (ЦНС, сердечно-сосудистая система, орган слуха, орган зрения). Типичные формы краснухи характеризуются цикличностью течения инфекции со сменой периодов: инкубационного, продромального, высыпания (экзантема) и реконвалесценции. Инкубационный период продолжается от 10 до 25 дней, в среднем - 16-20 дней. Продромальный (или катаральный) период - 1-3 дня. Период высыпания - 2-4 дня. Период реконвалесценции протекает, как правило, гладко, без осложнений. У детей болезнь протекает в большинстве случаев легко, с симптомами, включающими сыпь, умеренную лихорадку (<39 °С), ЛАП, рвоту и легкий конъюнктивит. Чаще всего увеличиваются затылочные, заднешейные и заушные ЛУ. Они слегка болезненны, могут оставаться увеличенными несколько недель. Часто увеличивается селезенка. Сыпь появляется сначала на лице, затем в течение суток распространяется на шею, туловище, руки и ноги. Сыпь мелко-пятнистая, более обильная на спине, разгибательных поверхностях конечностей. Элементы сыпи расположены на неизмененной коже, иногда сопровождаются зудом,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
исчезают через 1-3 сут, не оставляя пигментации и шелушения. У подростков и взрослых также могут наблюдаться тонзиллит, ринит, конъюнктивит.
Осложнения наблюдают редко. Возможен доброкачественно протекающий полиартрит с поражением мелких и средних суставов, который длится до 2 нед, тромбоцитопеническая пурпура. Наиболее тяжелое осложнение - энцефалит (менингоэнцефалит, энцефаломиелит), чаще развивающийся у подростков и взрослых. Энцефалит может сочетаться с тромбоцитопенической пурпурой. Симптомы энцефалита появляются через 2-4 сут после появления сыпи. Внезапно повышается температура тела, появляются генерализованные судороги, расстройства сознания вплоть до развития комы. Возможны менингеальные симптомы, делириозный синдром, парезы черепных нервов, конечностей, гиперкинезы, мозжечковая, диэнцефальная и бульбарная симптоматика, расстройства функций тазовых органов. В СМЖ обнаруживают повышение уровня белка и глюкозы при нормальном содержании лактата, у части больных - двузначный смешанный или лимфоцитарный плеоцитоз. Редкими осложнениями краснухи являются пневмония, первичная вирусная пневмония или вторичная бактериальная. В большинстве случаев краснуха протекает доброкачественно. Причиной летального исхода может стать энцефалит, в редких случаях при тромбоцитопенической пурпуре - кровоизлияние в мозг.
Врожденная краснуха
Наиболее часто встречающиеся аномалии плода - катаракта, пороки сердца и глухота были объединены под названием «классический СВК». В случае если инфицирование женщины вирусом краснухи происходит в начале ее беременности, вероятность того, что она передаст вирус плоду, составляет 60%. Это может приводить к выкидышу, мертворождению или тяжелым врожденным порокам развития, известным как СВК. Дети с СВК могут выделять вирус в течение года или более после рождения. Частота врожденных аномалий, связанных с заболеванием беременных женщин краснухой, варьирует от 8,1 до 38%. К СВК относят:
◊ пороки сердца:
-незаращение артериального протока;
-стеноз легочного ствола;
-дефекты межжелудочковой и межпредсердной перегородки; ◊ поражения глаз:
-жемчужную ядерную катаракту;
-микрофтальмию;
-врожденную глаукому;
-ретинопатию; ◊ поражения ЦНС:
-микроцефалию;
-задержку умственного развития;
-умственную отсталость;
-параплегию;
-аутизм; ◊ глухоту.
Дети часто рождаются с низкой массой тела, геморрагической синью, гепатоспленомегалией, гемолитической анемией, менингитом, поражением костей, однако все эти поражения обратимы. На втором десятилетии жизни возможно развитие медленной инфекции ЦНС - прогрессирующего краснушного панэнцефалита, проявляющегося снижением интеллекта, миоклонией, атаксией, эпилептическим синдромом и приводящего к

смерти. Врожденная краснуха повышает риск развития инсулинозависимого сахарного диабета. При фетальном синдроме краснухи летальность составляет около 10%. ДИАГНОСТИКА
Диагноз устанавливают на основании клинико-эпидемиологических данных и картины крови. Для специфической диагностики используют РСК, РТГА, ИФА и РИФ в парных сыворотках. Определение специфических антител, относящихся к классу IgM, проводят не позднее 12-го дня после контакта с источником инфекции. У подавляющего большинства больных удается выявить антитела в высоких титрах после 7-10-го дня болезни. Наличие краснухи доказывает нарастание титра антител во 2-й сыворотке по сравнению с 1-й в 4 раза и более. В последние годы широко применяют метод ПЦР, особенно для диагностики врожденной краснухи.
Дифференциальная диагностика
Дифференциальную диагностику при подозрении на краснуху в первую очередь необходимо проводить с такими заболеваниями, как корь, псевдотуберкулез, ИМ, энтеровирусная экзантема, внезапная экзантема и токсикоаллергический дерматит (табл. 21.31).
Таблица 21.31. Дифференциальная диагностика краснухи
Показания к консультации других специалистов При поражении ЦНС необходима консультация невролога. Пример формулировки диагноза
B06.0 Краснуха, краснушный энцефалит, судорожный синдром.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
ЛЕЧЕНИЕ
Лечение типичной краснухи не требует назначения ЛС. При полиартрите показаны НПВС. При энцефалите рекомендуют лечение в ОРИТ. Дексаметазон в дозе 1,0 мг/кг, противосудорожные средства [диазепам, натрия оксибутират (Натрия оксибат♠), тиопентал натрия], ноотропы, петлевые диуретики, оксигенотерапия, коррекция гомеостаза, меглюмина акридонацетат (Циклоферон♠, эффективность
последнего не подтверждена). В Российской Федерации действуют стандарты специализированной медицинской помощи детям при краснухе легкой, средней и тяжелой степени тяжести от 2013 г.
21.14. ПАРОТИТНАЯ ИНФЕКЦИЯ
Синонимы - эпидемический паротит, parotitis epidemica, «свинка», «заушница», «окопная» болезнь, «солдатская» болезнь - острая антропонозная воздушно-капельная инфекционная болезнь, характеризующаяся преимущественным поражением слюнных желез и других железистых органов (поджелудочной железы, половых желез и др.), а также ЦНС.
КОДЫ ПО МКБ-10
В26 Эпидемический паротит. В26.0 Паротитный орхит. B26.1 Паротитный менингит. B26.2 Паротитный энцефалит. B26.3 Паротитный панкреатит.
B26.8 Эпидемический паротит с другими осложнениями. B26.9 Эпидемический паротит неосложненный.
ЭТИОЛОГИЯ
Возбудитель паротитной инфекции - вирус Pneumophila
parotiditis семейства Paramyxoviridae рода Paramyxovirus, патогенный для человека и обезьян, антигенно близок к вирусу парагриппа. Геном представлен одноцепочечной спиралевидной РНК, окруженной нуклеокапсидом. Для вируса характерен выраженный полиморфизм: по форме он представляет округлые, сферические или неправильные элементы, а размеры могут варьировать от 100 до 600 нм. Обладает гемолитической, нейраминидазной и гемагглютинирующей активностью, связанной с глико-протеинами HN и F. Вирус культивируется на куриных эмбрионах, культуре почки
морской свинки, обезьян, сирийского хомячка, а также клетках амниона человека, малоустойчив в окружающей среде, инактивируется при воздействии высокой температуры, при ультрафиолетовом облучении, высушивании, быстро разрушается в дезинфицирующих растворах [50% этанола (Этиловый спирт♠), 0,1% раствора формалина и др.]. При низкой температуре (-20 °С) он может сохраняться до нескольких недель. Антигенная структура вируса стабильна. Известен только один серотип вируса, имеющий два антигена: V (вирусный) и S (растворимый). Оптимальная рН среды для вируса - 6,5-7,0. Из лабораторных животных наиболее чувствительны к вирусу эпидемического паротита обезьяны, у которых удается воспроизвести заболевание путем введения вирусосодержащего материала в проток слюнной железы.
ЭПИДЕМИОЛОГИЯ
Паротитную инфекцию традиционно относят к числу детских инфекций. При этом заболевание у грудных детей и в возрасте до 2 лет встречается редко. Наиболее высока заболеваемость с 2 до 25 лет, резко снижается после 40 лет. В последние годы эпидемический паротит у взрослых встречается чаще в связи с проведением массовой вакцинации детей. У большей части вакцинированных уже через 5-7 лет концентрация защитных антител значительно снижается. Это способствует увеличению восприимчивости к заболеванию подростков и взрослых. По официальной статистике Роспотребнадзора, в 2006 г. она
составила 1,62 на 100 тыс. населения (2327 случаев), в 2009 г. - 0,65 случаев на 100 тыс. населения (929 случаев), в 2011 г. - 0,32 на 100 тыс. населения, а за 6 мес 2015 г. заболеваемость снизилась на 11% по сравнению с 2014 г. В настоящее время регистрируются единичные спорадические случаи.
Источник возбудителя заболевания - больной паротитной инфекцией человек, который начинает выделять вирус за 1-2 дня до появления первых клинических симптомов и до 9-го дня болезни. При этом наиболее активное выделение вируса в окружающую среду происходит в первые 3-5 дней заболевания. Вирус выделяется со слюной и мочой. Вирус можно обнаружить в крови, грудном молоке, СМЖ и в пораженной железистой ткани. Вирус передается воздушно-капельным путем. Интенсивность выделения вируса в окружающую среду небольшая из-за отсутствия катаральных явлений. Один из факторов, ускоряющих распространение вируса эпидемического паротита, - наличие сопутствующих ОРЗ, при которых в связи с кашлем и чиханием повышается выделение возбудителя в окружающую среду. Не исключена возможность заражения через предметы обихода (игрушки, полотенца), инфицированные слюной больного. Описан вертикальный путь передачи эпидемического паротита от больной беременной плоду. После исчезновения симптомов заболевания пациент не заразен. Восприимчивость к инфекции высокая (до 100%). «Вялый» механизм передачи возбудителя, длительная инкубация, большое количество больных стертыми формами болезни, затрудняющее их выявление и изоляцию, приводит к тому, что вспышки эпидемического паротита в детских и подростковых коллективах протекают длительно, волнообразно на протяжении нескольких месяцев. Лица мужского пола болеют в 1,5 раза чаще, чем женского. Максимум заболеваемости приходится на март-апрель, минимум - на август-сентябрь. Среди взрослого населения эпидемические вспышки регистрируют чаще в закрытых и полузакрытых коллективах - казармах, общежитиях, корабельных командах. Подъемы заболеваемости отмечают с периодичностью 7-8 лет. Паротитная инфекция относится к управляемым. После введения в практику иммунизации заболеваемость значительно снизилась, но только в 42% стран мира вакцинация против эпидемического паротита включена в национальные прививочные календари. Из-за постоянной циркуляции вируса у 80-90% людейстарше 15 лет обнаруживают противопаротитные антитела. Это свидетельствует о широком распространении инфекции. По оценкам в 25% случаях паротитная инфекция протекает инаппарантно. После перенесенного заболевания формируется стойкий пожизненный иммунитет, повторные заболевания встречаются крайне редко. Однако в последние годы мы наблюдаем увеличение случаев эпидемического паротита как у вакцинированных, так и после перенесенного заболевания, что может быть обусловлено снижением общего иммунитета в популяции.
ПРОФИЛАКТИКА
Больных паротитной инфекцией не допускают в детские коллективы на 9 дней. Контактные лица (дети до 10 лет, не болевшие паротитной инфекцией и невак-цинированные) подлежат разобщению сроком на 21 день, а в случаях точного установления даты контакта - с 11-го по 21-й день. Проводят влажную уборку с использованием дезинфицирующих средств и проветривание помещения. За детьми, имевшими контакт с больным, на период изоляции устанавливают врачебное наблюдение. Основу профилактики составляет вакцинопрофилактика в рамках национального календаря профилактических прививок России. В 1981 г. в России начали проводить массовую, а затем плановую вакцинацию детей. К 1992 г. заболеваемость уменьшилась в 20,5 раза и составила 23,3 на 100 тыс. населения. С 1992 г. начался рост заболеваемости с пиком в 1998 г. - 98,9 случаев на 100 тыс. населения, со сдвигом среднего возраста заболевших в сторону повзросления. Иммунологи и эпидемиологи, изучив ситуацию, пришли к выводу, что для формирования полноценного иммунитета против вируса паротита недостаточно одной прививки. С 1999 г. в календарь прививок включена ревакцинация детей от эпидемического паротита в 6-7 лет, и заболеваемость начала снижаться. Вакцинацию проводят паротитной культуральной живой
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
сухой вакциной отечественного производства с учетом противопоказаний в 12 мес и ревакцинацией в 6 лет. Вакцину вводят подкожно в объеме 0,5 мл под лопатку или в наружную поверхность плеча. После введения вакцины возможны непродолжительная лихорадка, катаральные явления на 4-12 сут, очень редко - увеличение слюнных желез и серозный менингит. Для экстренной профилактики невакцинированным и неболевшим вакцину вводят не позже 72 ч после контакта с больным. Сертифицированы также паротитно-коревая культуральная живая сухая вакцина (Россия) и вакцина против кори, эпидемического паротита и краснухи живая аттенуированная лиофили-зированная (Индия). ПАТОГЕНЕЗ
Вирус эпидемического паротита попадает в организм через слизистую оболочку ВДП, рта, конъюнктиву глаз. Репликация вируса начинается в клетках эпителия респираторного тракта, затем вирус проникает в подслизистую оболочку, затем в кровь. Развивается первичная вирусемия, и вирус заносится в слюнные железы и другие железистые органы. Период первичной вирусемии соответствует концу инкубационного периода и длится до 3-5-го дня болезни. Из всех органов, пораженных вирусом, наиболее интенсивно его репликация происходит в слюнных железах, особенно околоушной, сопровождаясь ответной воспалительной реакцией и развитием более интенсивной вторичной вирусемии, во время которой вирус поражает ЦНС, а также оболочки глаза, печень, почки, сердце, мышцы, суставы, слуховой аппарат. Из железистых органов чаще всего поражаются поджелудочная, половые железы, реже - вилочковая, щитовидная и грудные железы. Поражение ЦНС и железистых органов может наступать не только после, но и одновременно, раньше, в редких случаях без клинически выраженного поражения слюнных желез. Характер морфологических изменений в пораженных органах изучен
недостаточно. Преобладает поражение соединительной ткани, а не железистых клеток. При этом для острого периода типично развитие отека и лимфоцитарной инфильтрации интерстициального пространства железистой ткани, однако вирус эпидемического паротита одновременно может поражать и саму железистую ткань. В ряде исследований показано, что при орхите, помимо отека, поражается и паренхима яичек. Это обусловливает уменьшение выработки андрогенов, нарушение сперматогенеза и вторичное бесплодие или снижение репродуктивной функции. Значительно реже наблюдается поражение яичников. Сходный характер поражения описан и для поражения поджелудочной железы, результатом чего может быть атрофия островкового аппарата с развитием сахарного диабета. После 10-15-го дня болезни органные поражение развиваются редко. Со 2-й недели болезни начинается активное формирование иммунитета и освобождение организма от вируса.
КЛИНИЧЕСКАЯ КАРТИНА
Общепринятая классификация эпидемического паротита отсутствует. Это объясняют различной трактовкой специалистами проявлений болезни.
Патогенетически обоснована позиция, согласно которой поражения не только слюнных желез, но и другой локализации, вызванные вирусом эпидемического паротита, следует рассматривать именно как проявления, а не осложнения болезни. Тем более что они могут манифестировать изолированно без поражения слюнных желез. В то же время поражения различных органов как изолированные проявления паротитной инфекции наблюдают редко (атипичная форма болезни). С другой стороны, стертую форму болезни, которую диагностировали до начала плановой вакцинации практически во время каждой вспышки болезни в детском и подростковом коллективе и при плановых осмотрах, нельзя признать атипичной. Бессимптомную инфекцию не рассматривают как болезнь. В классификации следует отразить и нередкие неблагоприятные отдаленные последствия эпидемического паротита. Критерии тяжести в эту классификацию не включены, так как они совершенно различны при разных формах болезни и не имеют нозологической специфики. Осложнения редки и не имеют характерных особенностей, поэтому их в классификации не
рассматривают. Клиническая классификация эпидемического паротита включает следующие клинические формы.
• Типичная.
◊ С изолированным поражением слюнных желез: ◊ клинически выраженная; ◊ стертая. ◊ Комбинированная:
-с поражением слюнных желез и других железистых органов;
-с поражением слюнных желез и нервной системы.
• Атипичная (без поражения слюнных желез).
◊ С поражением железистых органов. ◊ С поражением нервной системы. По тяжести:
1)легкая форма;
2)среднетяжелая форма;
3)тяжелая форма.
Критерии тяжести: выраженность лихорадки, интоксикации, выраженность органных поражений. Исходы болезни.
•Полное выздоровление.
•Выздоровление с резидуальной патологией: ◊ сахарный диабет; ◊ бесплодие; ◊ поражение ЦНС.
Инкубационный период составляет от 11 до 23 дней (чаще 15-19).
У некоторых больных (чаще у взрослых) за 1-2 дня до развития типичной картины наблюдают продромальные явления в виде разбитости, недомогания, гиперемии ротоглотки, боли в мышцах, головной боли, нарушения сна и аппетита. Типично острое начало, озноб и повышение температуры до 39-40 °С. Один из ранних признаков заболевания - болезненность за мочкой уха (симптом Филатова). Односторонняя припухлость околоушной железы чаще появляется к концу суток или на второй день болезни, а через 1-2 дня у 80-90% больных поражается вторая железа. При этом обычно отмечают шум в ушах, боли в области уха, усиливающиеся при жевании и разговоре, возможен тризм. Увеличение околоушной железы хорошо заметно. Железа заполняет ямку между сосцевидным отростком и нижней челюстью. При значительном увеличении околоушной железы ушная раковина оттопыривается и мочка уха поднимается кверху (отсюда народное название «свинка»). Отек распространяется в трех направлениях: кпереди - на щеку, вниз и кзади - на шею и вверх - на область сосцевидного отростка. Отечность особенно заметна при осмотре больного со стороны затылка. Кожа над пораженной железой напряжена, обычной окраски, при пальпации железа имеет тестовую консистенцию, умеренно болезненна. Максимальной степени отечность достигает на 3-5-й день заболевания, затем постепенно уменьшается и исчезает, как правило, на 6-9-й день (у взрослых на 10-16-й день). В этот период саливация снижена, слизистая оболочка полости рта сухая, больные жалуются на жажду. Устье Стенонова протока видно на слизистой оболочке щеки в виде гипе-ремированного отечного колечка (симптом Мурсу). Реже в процесс вовлекаются поднижнечелюстные слюнные железы, которые определяют в виде слабоболезненных веретенообразных припухлостей тестовой консистенции, при поражении подъязычной железы припухлость отмечают в подбородочной области и под языком. Поражение только подчелюстных (субмаксиллит) или подъязычных желез наблюдают крайне редко. Внутренние органы при изолированном паротите, как правило, не изменены. В ряде случаев у больных отмечают тахикардию, шум на верхушке и приглушение тонов сердца, гипотонию. Поражение ЦНС проявляется
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
головной болью, бессонницей, адинамией. Общая продолжительность лихорадочного периода составляет чаще 3-4 дня, в тяжелых случаях - до 6-9 дней.
Частый симптом эпидемического паротита у подростков и взрослых - поражение яичек (орхит). Частота паротитного орхита напрямую зависит от тяжести заболевания. При тяжелых и среднетяжелых формах он возникает приблизительно в 50% случаях. Возможен орхит без поражения слюнных желез. Признаки орхита отмечают на 5-8-й день болезни на фоне снижения и нормализации температуры. При этом состояние больных вновь ухудшается: температура тела повышается до 38-39 °С, появляется озноб, головная боль, возможны тошнота и рвота. Отмечают сильные боли в области мошонки и яичка, иногда иррадиирующие в нижние отделы живота. Яичко увеличивается в 2-3 раза (до размера гусиного яйца), становится болезненным и плотным, кожа мошонки гиперемирована, часто - с синюшным оттенком. Чаще поражается одно яичко. Выраженные клинические проявления орхита сохраняются 5-7 дней. Затем боли исчезают, яичко постепенно уменьшается в размерах. В дальнейшем можно отметить признаки его атрофии. Почти у 20% больных орхит сочетается с эпидидимитом. Придаток яичка пальпируется как продолговатая болезненная припухлость. Это осложнение приводит к нарушению сперматогенеза. Получены данные о стертой форме орхита, которая
также может быть причиной мужского бесплодия. При паротитном орхите описан инфаркт легкого вследствие тромбоза вен простаты и тазовых органов. Еще более редкое осложнение паротитного орхита - приапизм. У женщин может развиться оофорит, бартолинит, мастит. Нечасто встречается у пациентов женского пола в постпубертатный период оофорит, в редких случаях приводящий к бесплодию. Следует заметить, что мастит может развиться и у мужчин.
Частое проявление эпидемического паротита - острый панкреатит, часто протекающий бессимптомно и диагностируемый только на основании резкого повышения активности панкреатических ферментов в крови и моче. Частота развития панкреатита варьирует в широких пределах - от 2 до 50%. Чаще он развивается у детей и подростков. Такой разброс данных связан с использованием различных критериев диагностики панкреатита. Панкреатит развивается обычно на 4-7-й день болезни. Наблюдают тошноту, многократную рвоту, диарею, боли опоясывающего характера в средней части живота. При выраженном болевом синдроме иногда отмечают напряжение мышц живота и симптомы раздражения брюшины. Повышение активности ферментов поджелудочной железы сохраняется до месяца, тогда как другие симптомы заболевания исчезают уже через 5-10 дней. Поражение поджелудочной железы может приводить к атрофии островкового аппарата и развитию диабета.
В редких случаях возможно поражение и других железистых органов, обычно в сочетании со слюнными железами. Описаны тиреоидит, паратиреоидит, дакриоадениты, тимоидит.
Поражение нервной системы - одно из частых и существенных проявлений паротитной инфекции. Чаще всего наблюдают серозный менингит. Возможны также менингоэнцефалит, невриты черепных нервов, полирадикулоневрит. Клиническая картина паротитного менингита полиморфна, поэтому критерием диагностики может быть только выявление воспалительных изменений СМЖ. Возможны случаи эпидемического паротита, протекающие с синдромом менин-гизма, при интактности СМЖ. Напротив, часто без наличия менингеальных симптомов отмечают воспалительные изменения СМЖ. Между тем своевременная диагностика и лечение менингита и других поражений ЦНС существенно влияют на отдаленные последствия болезни.
Менингит чаще наблюдают у детей в возрасте 3-10 лет. В большинстве случаев он развивается на 4-9-й день болезни, т.е. в разгаре поражения слюнных желез или на фоне стихания болезни. Однако возможно и появление симптомов менингита одновременно с поражением слюнных желез и даже раньше. Возможны случаи менингита без поражения слюнных желез, в редких случаях - в сочетании с панкреатитом. Начало менингита
характеризуется быстрым повышением температуры тела до 38-39,5 °С, сопровождающимся интенсивной головной болью диффузного характера, тошнотой и частой рвотой, гиперестезией кожи. Дети становятся вялыми, адинамичными. Уже в первые сутки заболевания отмечают менингеальные симптомы, которые выражены умеренно, часто не в полном объеме, например, только симптом посадки («треножника»). У детей младшего возраста возможны судороги, потеря сознания, у старших детей - психомоторное возбуждение, бред, галлюцинации. Общемозговая симптоматика обычно регрессирует в течение 1-2 сут. Сохранение в течение более длительного времени свидетельствует о развитии энцефалита. Существенную роль в развитии менингеальной и общемозговой симптоматики играет внутричерепная гипертензия с повышением ЛД до 300-600 мм вод.ст. В то же время развитие ОНГМ с дислокацией ствола не описано. Осторожная по каплям эвакуация СМЖ во время люмбальной пункции до нормального уровня ЛД (200 мм вод.ст.) сопровождается выраженным улучшением состояния больного (прекращение рвоты, прояснение сознания, уменьшение интенсивности головной боли).
СМЖ при паротитном менингите прозрачная или опалесцирующая, плеоцитоз составляет 200-400 в 1 мкл. Содержание белка повышено до 0,3-0,6/л, иногда до 1,0-1,5/л, редко наблюдают сниженный или нормальный уровень белка. Цитоз, как правило, лимфоцитарный (90% и выше), в 1-2-й дни болезни может быть смешанным или нейтрофильным. Концентрация глюкозы в СМЖ - в пределах нормальных значений или повышена. Санация ликвора происходит позже регресса менингеального синдрома, к 3-й нед болезни, но может затягиваться, особенно у детей старшего возраста, до 1-1,5 мес.
При менингоэнцефалите через 2-4 дня после развития картины менингита на фоне ослабления менингеальных симптомов нарастает общемозговая симптоматика, появляются очаговые симптомы: сглаженность носогубной складки, девиация языка, оживление сухожильных рефлексов, анизорефлексия, мышечный гипертонус, пирамидные знаки, симптомы орального автоматизма, клонусы стоп, атаксия, интенционный тремор, нистагм, преходящий гемипарез. У детей младшего возраста возможны мозжечковые расстройства. Паротитный менингит и менингоэнцефалит протекают доброкачественно. Как правило, наступает полное восстановление функций ЦНС, однако после менингоэнцефалита может сохраняться внутричерепная гипертензия, астенизация, снижение памяти, внимания, слуха, задержка развития.
На фоне менингита, менингоэнцефалита, иногда изолированно, возможно развитие невритов черепных нервов, чаще всего VIII пары. При этом отмечают головокружение, рвоту, усиливающиеся при перемене положения тела, нистагм. Больные стараются лежать неподвижно с закрытыми глазами. Эти симптомы связаны с поражением вестибулярного аппарата, но возможен и кохлеарный неврит, для которого характерно появление шума в ухе, снижение слуха, преимущественно в зоне высоких частот. Процесс обычно односторонний, но часто полного восстановления слуха не происходит. Следует иметь в виду, что при резко выраженном паротите кратковременное снижение слуха возможно за счет отека наружного слухового прохода.
Полирадикулоневрит развивается на фоне менингита или менингоэнцефалита, ему всегда предшествует поражение слюнных желез. При этом характерно появление корешковых болей и симметричных парезов, преимущественно дистальных отделов конечностей, процесс обычно обратим, возможно и поражение дыхательной мускулатуры.
Иногда, обычно на 10-14-й день заболевания, чаще у мужчин, развивается серозный полиартрит. В основном поражаются крупные суставы (плечевые, коленные). Процесс, как правило, обратим, заканчивается полным выздоровлением в течение 1-2 нед.
Осложнения (ангина, отит, ларингит, нефрит, миокардит) встречаются крайне редко. Изменения крови при эпидемическом паротите незначительны и характеризуются
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

лейкопенией, относительным лимфоцитозом, моноцитозом, увеличением СОЭ, у взрослых иногда отмечают лейкоцитоз.
ДИАГНОСТИКА
Диагностика основана, главным образом, на характерной клинической картине и эпидемиологическом анамнезе, и в типичных случаях трудностей не вызывает (рис. 21.2). Из лабораторных методов подтверждения диагноза наиболее доказательно выделение вируса эпидемического паротита из крови, секрета околоушной железы, мочи, СМЖ и глоточных смывов, однако на практике это не используют.
В последние годы чаще стали применять серологические методы диагностики, наиболее часто используют ИФА, РСК и РТГА. Высокий титр IgM и низкий - IgG в острый период инфекции может служить признаком паротитной инфекции. Окончательно подтвердить диагноз можно через 3-4 нед при повторном исследо-
вании титра антител, при этом увеличение титра IgG в 4 раза и более имеет диагностическое значение. При использовании РСК и РТГА возможны перекрестные реакции с вирусом парагриппа. В последние годы все чаще применяется ПЦР, эффективная при наличии вирусемии. Для диагностики часто определяют активность амилазы и липазы в крови и моче, содержание которых повышается у большинства больных. Это особенно важно не только для диагностики панкреатита, но и косвенного подтверждения паротитной этиологии серозных менингитов.
Рис. 21.2. Алгоритм диагностики паротитной инфекции у взрослых

Дифференциальная диагностика
Дифференциальную диагностику эпидемического паротита в первую очередь следует проводить с бактериальными паротитами, слюнно-каменной болезнью (табл. 21.32). Увеличение слюнных желез также отмечается при саркоидозе и новообразованиях. Паротитный менингит дифференцируют с серозными менингитами энтеровирусной этиологии, лимфоцитарным хориоменингитом, иногда туберкулезным менингитом. При этом особое значение имеет повышение активности панкреатических ферментов в крови и моче при паротитном менингите. Наибольшую опасность представляют случаи, когда отек подкожной клетчатки шеи и лимфаденит, встречающийся при токсических формах дифтерии ротоглотки (иногда при инфекционном мононуклеозе и герпесвирусных инфекциях), врач принимает за паротит. Острый панкреатит следует дифференцировать с острыми хирургическими заболеваниями брюшной полости (бактериальным панкреатитом, аппендицитом, острым холециститом).
Паротитный орхит дифференцируют с туберкулезным, гонорейным, травматическим и бруцеллезным орхитом.
Показания к консультации других специалистов
При наличии неврологической симптоматики - консультация невролога, при панкреатите - хирурга, при орхите - уролога.
Пример формулировки диагноза В26, В26.3 Эпидемический паротит, панкреатит, среднетяжелое течение болезни. ЛЕЧЕНИЕ
Госпитализируют больных по эпидемиологическим показаниям из закрытых детских коллективов (детские дома, интернаты, воинские части). Как правило, больных лечат на дому. Госпитализация показана при тяжелом течении болезни (гипертермия свыше 39,5 °С, признаки поражения ЦНС, панкреатита, орхита). В целях уменьшения риска развития осложнений вне зависимости от тяжести течения заболевания весь период лихорадки
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
пациенты должны соблюдать постельный режим. У мужчин, не соблюдавших постельный режим в первые 10 дней болезни, орхиты развивались в 3 раза чаще. В острый период заболевания (до 3-4-го дня болезни) больные должны получать только жидкую и полужидкую пищу. Учитывая нарушения саливации, большое внимание следует уделять уходу за слизистой оболочкой полости рта, а в период реконвалесценции проводить стимуляцию секреции слюны, используя, в частности, лимонный сок. Для профилактики панкреатитов целесообразна молочно-растительная диета (стол № 5). Показано обильное питье (морсы, соки, чай, минеральная вода). Целесообразно назначать десенсибилизирующие препараты. Для уменьшения местных проявлений болезни на область слюнных желез назначают светотеплолечение (лампа-соллюкс). При орхите применяют преднизолон в течение 3-4 дней в дозе 2-3 мг/кг/сут
с последующим уменьшением дозы на 5 мг ежедневно. Обязательно ношение суспензория в течение 2-3 нед для обеспечения приподнятого положения яичек. При остром панкреатите назначают щадящую диету (в первые сутки - голодную диету). Показан холод на живот. Для уменьшения болевого синдрома вводят анальгетики, применяют апротинин. При подозрении на менингит показана люмбальная пункция, которая имеет не только диагностическое, но и лечебное значение. При этом также назначают анальгетики, дегидратационную терапию с использованием фуросемида (Лазикса♠) в дозе 1 мг/кг/сут. При выраженном общемозговом синдроме назначают дексаметазон по 0,25-0,5 мг/кг/сут в течение 3-4 дней, при менингоэнцефалите - ноотропные средства курсами по 2-3 нед. Изучалась эффективность использования иммуноглобулина человека, содержащего специфические противопаротитные антитела класса IgG. Применение этого препарата приводило к уменьшению длительности орхита и панкреатита, а раннее введение снижало риск развития паротитного менингита и орхита. Рекомендуется Виферон-3♠ (1 млн МЕ) ректально (в свечах) 2 р/сут, курс 7-10 дней.
Прогноз
Благоприятный, летальные исходы редки (1 на 100 тыс. заболевших эпидемическим паротитом). У некоторых больных возможно развитие эпилепсии, глухоты, сахарного диабета, снижение потенции, атрофии яичек.
Примерные сроки нетрудоспособности
Сроки нетрудоспособности определяют в зависимости от клинического течения эпидемического паротита, наличия менингита и менингоэнцефалита, панкреатита, орхита и других специфических поражений.
Диспансеризация
Не регламентирована. Ее проводит врач-инфекционист в зависимости от клинической картины и наличия осложнений. При необходимости привлекают специалистов других специальностей (эндокринологов, неврологов и т.д.).
21.15. НАТУРАЛЬНАЯ ОСПА* 21.16. ОСПА ЖИВОТНЫХ
Оспа животных - группа острых зоонозных инфекционных болезней с преимущественно контактным механизмом передачи возбудителя, характеризующихся лихорадкой и папулезнопустулезной сыпью. Вспышки оспы отмечают в ряде стран всех материков мира.
Возбудители оспы животных и человека - большая группа оспенных вирусов семейства Poxviridae (более 100 вирусов).
* Материалы размещены в электронном виде на сайте.
Человек восприимчив к вирусам: оспы обезьян, коров, вакцины и его подвиду - вирусу оспы буйволов, а также псевдокоровьей оспы (паравакцина) и оспы Таны. Возбудителя
псевдокоровьей оспы относят к роду Paraρoxvirus, оспы Таны - к роду Yataρoxvirus, остальных - к роду Orthopoxvirus.
Возбудители оспы различных видов животных морфологически сходны. Это ДНКсодержащие вирусы, характеризующиеся относительно большими размерами (170-350 нм), эпителиотропностью и способностью образовывать в клетках элементарные округлые включения (тельца Пашена, Гварниели, Боллингера), видимые в световом микроскопе при окраске по Морозову. Хотя и имеется филогенетическое родство между возбудителями оспы различных видов животных, спектр патогенности неодинаков, и иммуногенные связи сохранились не во всех случаях. Вирусы оспы овец, коз, свиней и птиц патогенны только для соответствующего вида, и в естественных условиях каждый из них вызывает самостоятельную (оригинальную) оспу. Вирусы натуральной оспы коров и осповакцины имеют широкий спектр патогенности, включая крупный рогатый скот, буйволов, лошадей, ослов, мулов, верблюдов, кроликов, обезьян и человека.
Близкие иммунологические связи сохранились только между двумя видами вирусов - осповакцины и коровьей оспы, тогда как остальные возбудители различны в антигенном и иммуногенном отношении.
Каждый вид возбудителя оспы характеризуется определенной инфекционно-стью в отношении культуры клеток и куриных эмбрионов. Репродукция оспенных вирусов приводит к появлению характерных патологических изменений в хориоаллантоисной оболочке эмбриона, а в культуре клеток - к выраженному цитоплазматическому действию.
Устойчивость оспенных вирусов в окружающей среде сравнительно высокая. Они могут сохранять жизнеспособность в сухих корочках оспин до 1-2 лет. Замораживание консервирует вирусы. В овчарнях вирус оспы овец сохраняется более 6 мес, на пастбищах и в шерсти переболевших животных - свыше 2 мес. Вирусы оспы быстро погибают при гниении субстрата. Они чувствительны к высокой температуре, солнечным лучам и кислотам; кипячение убивает их моментально, 70 °С - за 5 мин, кислая среда (рН 3,0-3,6) - в течение часа. Растворы серной, соляной и карболовой кислот (2-5%), формальдегида и хлорамина (1%), едкого натра (3%) инактивируют возбудителя в течение 1 ч. Биотермическое обеззараживание инфицированного помета наступает через 28 дней.
Особенность инфекционного процесса при оспе обусловливается эпителио-тропностью возбудителей и их способностью вызвать на коже своеобразную оспенную экзантему. Патологический процесс состоит из ряда последовательных стадий: а) розеолы - появление красных пятен в течение 1-2 дней; б) папулы - превращение пятен в узелки в течение 1-3 дней; в) везикулы - папулы в течение 5-6 дней превращаются в пузырьки, наполненные серожелтоватой жидкостью, в этот период лихорадочные явления угасают; г) пустулы - содержимое везикул в течение трех дней мутнеет и становится гнойным; д) крусты (струпы) - на месте высохших пустул образуется бурый струп, эпителий восстанавливается, а при глубоком поражении возникает соединительнотканный рубец; струп отпадает через 5-6 дней. Аналогично патологический процесс протекает и у людей.
Оспа обезьян
Оспа обезьян (англ. monkeypox, лат. variola vimus) - острая зоонозная природно-очаговая вирусная инфекционная болезнь, распространенная в тропических лесах и саванне экваториальной зоны Центральной и Западной Африки и характеризующаяся интоксикацией, лихорадкой и везикулезно-пустулезной сыпью.
КОДЫ ПО МКБ-10 В04 Инфекции, вызванные вирусом обезьяньей оспы.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Вирус был впервые выявлен в Государственном институте сывороток (Копенгаген, Дания) в 1958 г. во время изучения сходной с оспой болезни среди обезьян. Ряд аналогичных вспышек имел место в течение последующих лет, но ни одна из них не была официально зарегистрирована до 1968 г. Вирус, который был выделен во время вспышек в Копенгагене и при четырех других вспышках, оказался представителем нового вида ортооспенных вирусов c соответствующими биологическими свойствами и структурой генома. Он был назван «вирусом обезьяньей оспы». В последующем отмечали вспышки в 78 лабораториях разных стран, работающих с обезьянами. В конце августа 1970 г. в Экваториальной провинции бывшей республики Заир (Демократическая Республика Конго) был зафиксирован первый случай оспы обезьян у 9-месячного мальчика. В 1970-2003 гг. было зарегистрировано около 950 случаев оспы обезьян у людей в Демократической Республике Конго, ЦентральноАфриканской Республике, Габоне, Камеруне, Нигерии, Кот-Д?Ивуаре, Либерии, СьерраЛеоне. В 2003 г. в США она была обнаружена у 37 человек. Более 95% всех случаев заболевания выявлены в Демократической Республике Конго. При этом в 73% случаев была доказана передача инфекции от человека к человеку.
В2010 г. в отчете об исследовании группы специалистов из Университета Калифорнии в ЛосАнджелесе проанализированы данные о заболеваемости обезьяньей оспой в девяти регионах Демократической Республики Конго с 1981 по 2007 г. По результатам исследования было установлено, что заболеваемость оспой в стране в 2005-2007 гг. составила около 5,53 случая на 10 тыс. населения, тогда как с 1981 по 1986 г. - лишь 0,72 случая на 10 тыс. жителей.
При этом максимальный уровень заболеваемости в 2005-2007 гг. составил 14,42 случая на 10 тыс. жителей Демократической Республики Конго. Таким образом, с 1981 г. этот показатель увеличился в 7,7-20 раз, что связано с прекращением вакцинации против натуральной оспы в конце 1970-х гг., причем вакцинированные конголезцы заражались обезьяньей оспой в 5,2 раза реже, чем непривитые.
В2003 г. почти 100 американцев заразились оспой обезьян от луговых собачек, приобретенных в качестве домашних животных. По мнению Э. Римойн, это свидетельствует о том, что вызывающий заболевание вирус способен образовывать природные резервуары за пределами Африки.
Оспа обезьян y человека является редким зоонозом, который стали распознавать лишь после ликвидации натуральной оспы. Можно ожидать роста заболеваемости в связи с прекращением вакцинации против оспы.
ЭТИОЛОГИЯ
Возбудитель - вирус рода Orthopoxvirus семейства Poxviridae. По морфологическим и антигенным свойствам близок к вирусу натуральной оспы, но отличается от него по биологическим свойствам: на хорион-аллантоисной оболочке куриных эмбрионов при температуре 34,5-35,0 °С вирус размножается с образованием мелких оспин с центральной геморрагией и единичных крупных белых оспин; предельная температура развития - 39,0 °С; обладает выраженной гемагглютинирующей активностью; не оказывает цитопатического действия и не вызывает феномена гемадсорбции в клетках перевиваемой линии почек эмбриона свиньи.
Устойчивость к воздействию факторов окружающей среды - такая же, как у возбудителя натуральной оспы.
ЭПИДЕМИОЛОГИЯ
Источник и резервуар возбудителя - больные приматы 12 видов (церкопитеки, колобусы, гиббоны, гориллы, шимпанзе, орангутанги и др.), тропические белки и гамбийские крысы. Длительность периода выделения вируса неизвестна. Человек заражается от больных
животных контактным (через конъюнктиву и поврежденную кожу) путем, а также в результате прямых контактов с кровью, жидкостями организма или сыпью инфицированных животных. Возможен воздушно-капельный или воздушно-пылевой путь (аэрозольный механизм заражения).
Естественная восприимчивость людей неизвестна. Вторичная передача происходит от человека человеку в результате тесного контакта с выделениями из дыхательных путей, повреждениями кожи инфицированного человека или с недавно зараженными предметами.
Возможно трансплацентарное заражение плода при заболевании беременной. Наиболее поражаемый контингент - дети в возрасте 4-10 лет. Сезонность летняя.
МЕРЫ ПРОФИЛАКТИКИ: СПЕЦИФИЧЕСКИЕ, НЕСПЕЦИФИЧЕСКИЕ. МЕРОПРИЯТИЯ В ОЧАГЕ
1.При выявлении больных оспой обезьян или подозрительных на это заболевание проводят такие же противоэпидемические и профилактические мероприятия, как при натуральной оспе, включая вакцинацию проти-вооспенной вакциной. В тропических районах Центральной и Западной Африки, эндемичных по оспе обезьян, рекомендована плановая вакцинация населения.
2.Предотвращение дальнейшего распространения оспы обезьян в результате торговли животными. Ограничение или запрещение перемещения небольших африканских млекопитающих животных или обезьян может быть эффективным в замедлении распространения вируса за пределы Африки.
3.Содержащихся в неволе животных не следует прививать против натуральной оспы. Однако инфицированных животных необходимо изолировать от других животных и немедленно помещать в карантин. Любые животные, которые могли иметь контакты с инфицированным животным, должны быть помещены в карантин и находиться под наблюдением на предмет появления симптомов оспы обезьян в течение 30 дней.
4.Снижение риска инфекции у людей. Во время вспышек оспы обезьян тесный контакт с другими пациентами является самым значительным фактором риска инфицирования вирусом оспы обезьян. При отсутствии специального лечения и вакцины единственным способом уменьшения числа заболеваний среди людей является информация населения в отношении факторов риска и в отношении мер по ограничению возможного контакта с вирусом.
• Снижение риска передачи возбудителя от человека человеку. Необходимо избегать тесных физических контактов с людьми, инфицированными оспой обезьян. При уходе за больными необходимо надевать перчатки и использовать средства защиты. После ухода за больными или после посещений таких людей необходимо регулярно мыть руки.
• Снижение риска передачи инфекции от животного человеку. Усилия по предотвращению передачи инфекции в эндемичных районах должны быть направлены на тщательную тепловую обработку всех употребляемых в пищу продуктов животного происхождения (таких как кровь, мясо). При обращении с больными животными или их инфицированными тканями, а также во время забоя животных необходимо надевать перчатки и другую соответствующую защитную одежду.
В медицинских учреждениях
Медицинские работники, осуществляющие уход за пациентами с предполагаемой или подтвержденной инфекцией вирусом оспы обезьян или обращающиеся с образцами, взятыми у таких пациентов, должны принимать стандартные меры предосторожности в области инфекционного контроля, им необходимо проведение иммунизации против натуральной оспы. Иммунологически компрометированным лицам с ослабленной иммунной системой вакцинация противопоказана.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Работа с образцами, взятыми у людей и животных с предполагаемой инфекцией вирусом оспы обезьян, должна осуществляться специально подготовленными сотрудниками в надлежащем образом оборудованных лабораториях.
ПАТОГЕНЕЗ
Фазы патогенеза - такие же, как при натуральной оспе, в то же время вирус имеет тропизм к ЛУ, вызывая в них выраженные воспалительные изменения.
КЛИНИЧЕСКАЯ КАРТИНА Инкубационный период длится от 6 до 16 дней.
Основной особенностью, отличающей оспу обезьян от натуральной оспы, является развитие лимфаденита у 86% больных, одновременно с ознобом, повышением температуры до 38,0- 39,5 °С и проявлениями интоксикации (головной болью, миалгией и артралгией). Лимфаденит может быть двусторонним или односторонним и, в зависимости от входных ворот инфекции, развивается в подчелюстных, шейных, подмышечных или паховых ЛУ. Ко времени появления экзантемы у 64% больных развивается генерализованная ЛАП. При аэрозольном механизме заражения больные отмечают боль в горле и кашель. Периоды высыпания, нагноения и реконвалесценции по клиническим проявлениям практически не отличаются от натуральной оспы, но протекают обычно легче и быстрее (за 2-4 нед). По классификации Rao оспа обезьян у людей проходит по дискретному варианту в 58% случаев заболевания, по полусливному и сливному - в 32% и 10% случаев соответственно. Возможно развитие оспенной пурпуры (один случай у ребенка), вариолоида, оспы без сыпи, оспы без температуры и инаппарантной инфекции.
Течение болезни можно разделить на два периода:
1 - период инвазии (0-5 дней), для которого характерны лихорадочное состояние, сильная головная боль, ЛАП, боль в спине, миалгия и выраженная астения;
2 - период высыпаний, когда элементы сыпи появляются на лице (в 95% случаев), на ладонях и ступнях (75%) и на теле почти одновременно, поэтому характерен мономорфизм сыпи, т.е. все элементы находятся в одной стадии развития: розеола-папула-везикула-пустула.
Нагноение (пустулизация) сыпи сопровождается лихорадкой и развитием бактериальных осложнений: бронхопневмонии, кератитов, диареи, флегмон, абсцессов и др.
Летальность при оспе обезьян в среднем составляет 3,3-9,8% (в зависимости от возраста заболевших). Большинство случаев смерти происходит среди детей раннего возраста. Дети более чувствительны к вирусу оспы обезьян из-за прекращения регулярной вакцинации против натуральной оспы, последовавшей за всемирной ликвидацией этой болезни в 1980 г.
В возрастной группе старше 10 лет летальные исходы не зарегистрированы. ДИАГНОСТИКА Основные диагностические мероприятия соответствуют таковым при натуральной оспе.
Дифференциальную диагностику обычно проводят с натуральной оспой, ветряной оспой, корью, пиодермией, медикаментозной аллергией (табл. 21.36).

Окончательный диагноз устанавливается с помощью иммуносорбентного анализа с применением фиксированных ферментов (ELISA), теста на выявление антигенов, ПЦР, изоляции вируса в культурах клетках.
ЛЕЧЕНИЕ
Больные изолируются в боксы. Специфических методов лечения нет. Режим постельный (до нормализации температуры). Диета - механически и химически щадящая (стол № 4). Принципы лечения такие же, как при натуральной оспе.
Прогноз
У детей раннего возраста - серьезный. Зависит от клинической формы болезни и осложнений.
Диспансеризация Не проводится. Коровья оспа
Коровья оспа (Cowpox) - зоонозная инфекционная болезнь с контактным механизмом передачи возбудителя, протекающая в части случаев с развитием лихорадочноинтоксикационного синдрома, единичными пустулезными высыпаниями на коже.
КОДЫ ПО МКБ-10
В08.0 Другие инфекции, вызванные ортопоксвирусом. Коровья оспа. Болезнь, вызванная вирусом Орф.
ЭТИОЛОГИЯ
Возбудитель - Cowpox virus, относится к роду Othopoxvirus, семейству Poxviridae. Геном вируса представлен односпиральной ДНК, известны генетические варианты вируса. Вирус хорошо культивируется на хорион-аллантоисной оболочке куриных эмбрионов и ряде клеточных культур, с развитием в них цитопластического эффекта.
ЭПИДЕМИОЛОГИЯ
Коровья оспа - природно-очаговая инфекция. Основным резервуаром возбудителя являются лесные мыши и мыши-полевки, которые инфицируют домашних кошек и крупный рогатый скот, которые и служат основным источником возбудителей для человека. Человек является случайным и конечным хозяином вируса, передача возбудителя от человека не установлена.
Заражение людей от инфицированных кошек и других животных происходит контактным путем через поврежденную кожу при ручном доении коров.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Чаще болеют дети и подростки, имевшие контакт с зараженными кошками; среди взрослых - лица, ухаживающие за скотом, доярки.
Заболевание регистрируется повсеместно в Европе в виде спорадических случаев и локальных вспышек преимущественно летом и осенью (июль-октябрь).
МЕРЫ ПРОФИЛАКТИКИ: СПЕЦИФИЧЕСКИЕ, НЕСПЕЦИФИЧЕСКИЕ. МЕРОПРИЯТИЯ В ОЧАГЕ
Меры профилактики заключаются в строгом выполнении ветеринарно-сани-тарных мероприятий, тщательном соблюдении санитарных мер при уходе за больными животными, обеспечении работы предприятий в режиме закрытого типа.
ПАТОГЕНЕЗ
Механизмы развития болезни изучены недостаточно. В месте инокуляции вируса возникает очаговая воспалительная реакция с пролиферацией клеток базального слоя эпидермиса и массивной лейкоцитарной инфильтрацией, формируется крупная везикула. В пораженных клетках при световой микроскопии обнаруживаются характерные внутриклеточные включения типа А, представленные скоплениями зрелых вирионов. Патологический процесс в коже заканчивается рубцеванием. Возможно развитие транзиторной вирусемии.
КЛИНИЧЕСКАЯ КАРТИНА Продолжительность инкубационного периода не установлена.
В большинстве случаев заболевания на руках и лице пациента появляется один или несколько элементов сыпи, сходных с элементами сыпи при натуральной оспе, и проходят те же фазы развития (папула-везикула-пустула-корка). Везикулы имеют в центре пупковидное вдавление, расположены на инфильтрированном основании, многокамерные. После отпадения корки (6-12 нед) остается рубец. Возможны, в результате инокуляции, вторичные элементы на различных участках кожи. Часто лимфаденит.
У пациентов, не вакцинированных против натуральной оспы, возможна лихорадка и интоксикация, длящиеся до 5-7 дней.
ДИАГНОСТИКА
Постановка диагноза достигается путем обнаружения Cowpox virus при электронной микроскопии содержимого везикул, или изоляции вируса при заражении патологическим материалом хорион-аллантоисной оболочки куриного эмбриона, на которой образуются геморрагические оспины, или выделения клеточной культуры, в которой возникает цитопатический эффект. Вирус может быть обнаружен в виде внутриклеточных включений типа А при гистологическом исследовании материала из очага поражения.
Дифференциальную диагностику проводят с сибирской язвой, паравакциной, герпетическими высыпаниями при простом герпесе.
ЛЕЧЕНИЕ
Противовирусная терапия не разработана. Больным проводят патогенетическое лечение, местно применяются антисептики, для профилактики вторичной инфекции назначают антибиотики. Противопоказано использование глюкокор-тикоидов.
Прогноз
Болезнь протекает доброкачественно, у иммунокомпрометированных пациентов описаны генерализованные заболевания с летальным исходом.
21.17. ГЕМОРРАГИЧЕСКИЕ ЛИХОРАДКИ
Геморрагические лихорадки (ГЛ) - полиэтиологичная группа острых вирусных зоонозных инфекций, объединенных по признаку регулярного развития геморрагического синдрома на фоне острого лихорадочного состояния и характеризующихся интоксикацией и генерализованным поражением сосудов микроциркуля-торного русла с развитием тромбогеморрагического синдрома.
ГЛ - опасные или особо опасные болезни с высокой летальностью. В эту группу входят как минимум 15 самостоятельных нозологических форм (табл. 21.37). Венесуэльская и бразильская ГЛ - варианты аргентинской ГЛ.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/


ЭТИОЛОГИЯ
Возбудители ГЛ отнесены к четырем семействам вирусов: Arenaviridae, Bunyaviridae, Filoviridae, Flaviviridae. Их геном представлен однонитевой РНК.
Репликация генома этих вирусов происходит с низкой точностью, что обусловливает высокую частоту мутаций РНК и возникновение новых вариантов вируса с измененной антигенной структурой и вирулентностью.
Большинство ГЛ - природно-очаговые инфекции.
Резервуар возбудителей - различные виды животных. В некоторых случаях источником вируса становится больной человек и инфекция принимает антропо-нозный характер.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Заражение человека арбовирусными ГЛ происходит трансмиссивным путем через укус инфицированных кровососущих членистоногих (клещи, комары).
ГЛ, вызываемые арена-, филовирусами и некоторыми буньявирусами, распространяются контактно-бытовым, аэрогенным, парентеральным путями.
Восприимчивость человека к ГЛ варьирует в широких пределах и зависит от изменчивости вируса.
ОБЩАЯ ХАРАКТЕРИСТИКА
Репликация вирусов - возбудителей ГЛ происходит преимущественно в клетках эндотелия сосудов микроциркуляторного русла, что сопровождается расстройствами микроциркуляции и развитием геморрагического синдрома и ИТШ. Именно эти особенности позволяют рассматривать ГЛ в одной группе болезней. Клинически общность ГЛ определяется наличием лихорадочно-интоксикационного и геморрагического синдромов. Диагностику ГЛ осуществляют вирусологическими и иммунологическими методами. Основу лечения составляет патогенетическая терапия, методы специфической профилактики не разработаны. В связи с тяжестью течения, высокой летальностью, эпидемиологической неуправляемостью ГЛ относят к особо опасным и опасным инфекционным болезням.
21.17.1. Геморрагическая лихорадка с почечным синдромом
ГЛПС (геморрагический нефрозонефрит, тульская лихорадка, скандинавская эпидемическая нефропатия, эпидемический нефрозонефрит, дальневосточная, корейская, маньчжурская, ярославская, уральская, закарпатская, югославская лихорадка) - острая вирусная зоонозная природно-очаговая болезнь с многообразными механизмами передачи возбудителя, характеризующаяся системным поражением мелких кровеносных сосудов, геморрагическим диатезом, гемодина-мическими расстройствами и поражением почек с развитием ОПН. КОД ПО МКБ-10
А98.5 Геморрагическая лихорадка с почечным синдромом. ЭТИОЛОГИЯ
Возбудитель - арбовирус семейства Bunyaviridae, рода Hantavirus, включающий около 30 серотипов, 4 из которых (Hantaan, Puumala, Seul и Dobrava/Belgrad) вызывают ГЛПС. Вирус ГЛПС имеет сферическую форму диаметром 85-120 нм, содержит четыре полипептида: нуклеокапсид (N), РНК-полимеразу и гликопро-теины мембраны - G1 и G2. Геном вируса включает три сегмента (L-, M-, S-) одно-цепочечной «минус»-РНК; реплицируется в цитоплазме инфицированных клеток (моноцитах, клетках легких, почек, печени, слюнных желез). Антигенные свойства обусловлены наличием антигенов нуклеокапсида и поверхностных гликопротеи-нов. Поверхностные гликопротеины стимулируют образование вируснейтрали-зующих антител, в то время как антитела к нуклеокапсидному белку не способны нейтрализовать вирус. Возбудитель ГЛПС способен размножаться в куриных эмбрионах, пассируется на лабораторных животных. Вирус чувствителен к хлороформу, ацетону, эфиру, бензолу, ультрафиолетовому облучению; инактивируется при 50 °С в течение 30 мин, кислотолабилен (полностью инактивируется при pH ниже 5,0). Относительно устойчив в окружающей среде при 4-20 °С, хорошо сохраняется при температуре ниже -20 °С. В сыворотке крови, взятой у больных, сохраняется до 4 сут при 4 °С.
ЭПИДЕМИОЛОГИЯ
Основной источник и резервуар возбудителя ГЛПС - мышевидные грызуны (рыжая полевка, лесная мышь, красно-серая полевка, азиатская лесная мышь, домовые мыши и крысы), которые переносят бессимптомную инфекцию и выделяют вирус с мочой и фекалиями.
Заражение людей происходит преимущественно воздушно-пылевым путем (при аспирации вируса из высохших
испражнений инфицированных грызунов), а также контактным (через поврежденные кожные и слизистые покровы, при соприкосновении с грызунами или инфицированными объектами окружающей среды - сено, солома, хворост), а также алиментарным (при употреблении продуктов, загрязненных выделениями инфицированных грызунов и не прошедших термическую обработку). Больной человек не заразен. Естественная восприимчивость людей высокая, болезни подвержены все возрастные группы. Чаще заболевают мужчины (70-90% больных) от 16 до 50 лет, преимущественно работники сельского хозяйства, трактористы, водители. Реже ГЛПС регистрируют у детей, женщин и лиц пожилого возраста. Перенесенная инфекция оставляет стойкий пожизненный типоспецифический иммунитет. Природные очаги ГЛПС распространены по всему миру: в скандинавских странах (Швеции, Норвегии, Финляндии), Болгарии, Чехии, Словакии, Югославии, Бельгии, Франции, Австрии, Польше, Сербии, Словении, Хорватии, Боснии, Албании, Венгрии, Германии, Греции, Дальнем Востоке (КНР, КНДР, Южная Корея). В России ГЛПС регистрируют во всех регионах. Наиболее активные очаги существуют между Волгой и Уралом (Республики Башкортостан, Татарстан, Марий Эл, Самарская и Ульяновская области) и на Дальнем Востоке. Четко выражена сезонность заболеваемости: с мая по декабрь. В последние годы наблюдается смещение сезонного пика из летне-осеннего в осенне-зимний период. Наиболее высокая заболеваемость в Республике Башкортостан. Так, с 2008 по 2014 гг. заболеваемость в РФ находилась в пределах 3,0-7,96 на 100 тыс. населения, в Республике Башкортостан - от 15,0 до 81,5 на 100 тыс. населения, т.е. в 5-10 раз выше.
МЕРЫ ПРОФИЛАКТИКИ
Специфическая не проводится. Корейская вакцина, изготовленная на основе штамма Hantaan, в России не сертифицирована.
Неспецифическая профилактика включает уничтожение грызунов в очагах, использование респираторов при работе в запыленных помещениях, хранение продуктов на складах, защищенных от грызунов.
ПАТОГЕНЕЗ
Изучен недостаточно. Патологический процесс протекает стадийно; выделяют несколько стадий.
Заражение. Вирус внедряется через слизистые дыхательных, пищеварительных путей, поврежденный кожный покров и репродуцируется в ЛУ и мононуклеарно-фагоцитарной системе.
Вирусемия и генерализация инфекции. Происходит диссеминация вируса и его инфекционно-токсическое воздействие на рецепторы сосудов и нервной системы, что клинически соответствует инкубационному периоду болезни.
Токсико-аллергические и иммунологические реакции (соответствуют лихорадочному периоду заболевания). Циркулирующий в крови вирус захватывают клетки мононуклеарнофагоцитарной системы и при нормальной иммунореак-тивности удаляют из организма. Однако при нарушении регуляторных механизмов комплексы антиген-антитело повреждают стенки артериол, повышая активность гиалуронидазы, калликреин-кининовой системы, в результате чего повышается проницаемость сосудов и развивается геморрагический диатез с плазмореей в ткани. Ведущее место в патогенезе также принадлежит клеточным факторам иммунитета: цитотоксическим лимфоцитам, NK-клеткам и провоспалительным цитокинам (ИЛ-1, ФНО-α, ИЛ-6), которые оказывают повреждающее действие на инфицированные вирусом клетки.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Висцеральные поражения и обменные нарушения (клинически соответствуют олигурическому периоду болезни). Результатом развившихся под действием вируса нарушений становятся геморрагические, дистрофические и некробиоти-ческие изменения в гипофизе, надпочечниках, почках и других паренхиматозных органах (манифестация ДВСсиндрома). Наибольшие изменения отмечают в почках - снижение клубочковой фильтрации и нарушение канальцевой реабсорбции, что приводит к олигурии, азотемии, протеинурии, кислотно-основному и водно-электролитному дисбалансу, в результате чего развивается ОПН.
Анатомическая репарация, формирование стойкого иммунитета, восстановление нарушенных функций почек.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период - от 4 до 49 (в среднем 14-21) дней. Для заболевания характерна четкая цикличность течения и многообразие клинических вариантов, от абортивных лихорадочных форм до тяжелых, с массивным геморрагическим синдромом и стойкой почечной недостаточностью. Выделяют следующие периоды: начальный (лихорадочный), олигурический, полиурический, реконвалесцент-ный (ранний - до 2 мес и поздний - до 2-3 лет). Продромальные явления в виде недомогания, познабливания, утомляемости, субфебрилитета, длящиеся 1-3 дня, наблюдают не более чем у 10% больных.
Начальный период (1-3-й дни болезни) длительностью от 3 до 10 сут характеризуется острым началом, повышением температуры тела до 38-40 °С и более, сильной головной болью, сухостью во рту, тошнотой, снижением аппетита, слабостью, миалгиями. Отмечают запоры, хотя возможна и диарея до 3-5 р/сут. Характерны жалобы на снижение остроты зрения («мушки» перед глазами), боли в глазных яблоках, которые исчезают в течение 1-5 дней. Отмечают гиперемию лица, шеи, верхней части груди, инъекцию склер и конъюнктивы, гиперемию зева, геморрагическую энантему на слизистой оболочке мягкого нёба, умеренную брадикардию. Возможны кровянистые выделения из носа, рвота, боли в пояснице, животе; с 3-5-го дня появляется петехиальная сыпь в области ключиц, подмышечных впадин, груди. При тяжелых формах отмечают симптомы менингизма. На 4-6-й день болезни возрастает риск развития ИТШ, особенно при нарушении лечебно-охранительного режима (физический труд, посещение бани, употребление алкоголя). Олигурический период (с 3-6-го по 8-14-й день болезни) - при нормализации температуры тела состояние больного не улучшается, чаще ухудшается; усугубляются симптомы интоксикации (усиливается головная боль, появляется рвота, не связанная с приемом пищи, икота, сухость во рту, анорексия), суточный диурез снижается, степень выраженности олигурии коррелирует с тяжестью заболевания. Характерна выраженная адинамия, боли в поясничной области различной интенсивности, геморрагический синдром (кровоизлияния в склеры, в местах инъекций; носовые, желудочно-кишечные, маточные кровотечения). Кровоизлияния в жизненно важные органы (ЦНС, надпочечники, гипофиз) могут стать причиной летального исхода. У больных отмечают бледность лица, пастозность век, одутловатость лица; брадикардию, гипотензию, сменяемую к концу периода гипертензией; проявляются симптомы бронхита (у курильщиков). При пальпации живота определяется болезненность в проекции почек, гепатомегалия, положительный симптом поколачивания по поясничной области. При выявлении последнего симптома следует проявлять особую осторожность из-за возможности разрыва капсулы почки.
Πолиурический период (с 9-13-го дня болезни) отличается развитием полиу-рии (до 5 л/сут и более), никтурии с гипоизостенурией, прекращением рвоты,
исчезновением болей в пояснице, восстановлением сна и аппетита. В то же время сохраняются слабость, сухость во рту, усиливается жажда. Иногда в первые дни полиурии еще нарастает азотемия, возможно развитие дегидратации, гипонатрие-мии, гипокалиемии.
В период реконвалесценции восстанавливается суточный диурез, приходят к норме показатели мочевины и креатинина, улучшается общее состояние больного. Длительность выздоровления зависит от скорости восстановления почечных функций и продолжается от 3 нед до 2-3 лет. Оценка тяжести заболевания соответствует степени выраженности основных клинических синдромов, прежде всего ОПН, и развитию осложнений.
Критерии тяжести
•Легкое течение: лихорадка (до 38,0 °С), диурез (до 900 мл/сут), микропротеи-нурия, микрогематурия, концентрация мочевины сыворотки крови в норме, повышение уровня креатинина до 130 мкмоль/л.
•Среднетяжелое течение: лихорадка (до 39,5 °С), головная боль, частая рвота, интенсивная боль в области поясницы, боли в животе, геморрагическая сыпь, диурез (300-900 мл/сут), умеренная азотемия (мочевина в плазме крови до 18 ммоль/л, креатинин до 300 мкмоль/л).
•Тяжелое течение: осложнения в виде ИТШ и острой сосудистой недостаточности, геморрагический синдром, олигурия (менее 300 мл/сут) или анурия, уремия (концентрация мочевины выше 18,5 ммоль/л, креатинина - выше 300 мкмоль/л).
•Предвестники развития тяжелой формы (на 2-4-й день болезни): сильная боль в пояснице и животе, резкое снижение остроты зрения на фоне сильной головной боли, сухости во рту и жажды, многократная рвота, не связанная с приемом пищи, выраженный геморрагический синдром, диурез (менее 500 мл/сут), лейкоцитоз крови, массивная протеинурия (более 3,0 г/л), резкий подъем концентрации мочевины и креатинина с 3-го дня болезни.
Осложнения
Осложнения делят на специфические и неспецифические.
•Специфические: ИТШ, ДВС-синдром, азотемическая уремия, отек легких и головного мозга, кровоизлияния в гипофиз, надпочечники, миокард, головной мозг, эклампсия, острая сердечно-сосудистая недостаточность, про-фузные кровотечения, надрыв или разрыв капсулы почки, инфекционный миокардит, геморрагический менингоэнцефалит, парез кишечника, вирусная пневмония и др.
•Неспецифические: пиелонефрит, гнойный отит, абсцессы, флегмоны, пневмонии, паротит, сепсис и др.
Летальность и причины смерти
Летальность составляет 0,7-3,5% и наступает от развития ИТШ, ОПН, кровоизлияний в жизненно важные органы, разрыва почек.
ДИАГНОСТИКА Клиническая
Характерно сочетание острого начала болезни с появлением лихорадки и симптомов интоксикации, поражения почек с развитием ОПН и геморрагическим синдромом; пребывание в эндемичном очаге, характер профессиональной деятельности; сезонность (майдекабрь). Цикличность течения с закономерной сменой инфекционно-токсических симптомов начального периода (лихорадка, головная
боль, слабость, гиперемия лица, шеи, верхней трети груди, слизистых оболочек, инъекция сосудов склер), признаками нарастающей почечной недостаточности олигурического периода (боли в пояснице, животе, рвота, не связанная с приемом пищи, снижение остроты зрения на фоне сильной головной боли, сухости во рту, жажды, выраженный геморрагический синдром, снижение диуреза до менее 500 мл/сут).
Неспецифическая лабораторная диагностика
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Информативность лабораторных неспецифических (общеклинических, биохимических, коагулопатических, электролитных, иммунологических) и инструментальных (ЭГДс, УЗИ, КТ, ЭКГ, рентгенографии, ОГК и др.) показателей относительна, так как они отражают выраженность неспецифических патофизиологических синдромов - ОПН, ДВС и других, их следует оценивать с учетом периода болезни. Клинический анализ крови: в начальном периоде - лейкопения, увеличение числа эритроцитов, гемоглобина, снижение СОЭ, тромбоцитопения; в разгар болезни - лейкоцитоз со сдвигом формулы влево, увеличение СОЭ до 40 мм/ч. Общий анализ мочи: протеинурия (от 0,3 до 30,0 г/л и выше), микро- и макрогематурия, цилиндрурия, клетки Дунаевского. Проба Зимницкого: гипоизостенурия. Биохимический анализ крови: повышение концентрации мочевины, креатинина, гиперкалиемия, гипонатриемия, гипох-лоремия.
Коагулограмма: в зависимости от периода заболевания признаки гиперкоагуляции (укорочение тромбинового времени до 10-15 с, времени свертывания крови, повышение концентрации фибриногена до 4,5-8 г/л, протромбинового индекса до 100-120%) либо гипокоагуляции (удлинение тромбинового времени до 25-50 с, удлинение времени свертывания, снижение концентрации фибриногена до 1-2 г/л, протромбинового индекса до 30-60%).
Динамика общеклинических, биохимических, электролитных, КОС, коагулопа-тических, иммунологических, инструментальных показателей, отражающих степень выраженности основных патофизиологических симптомов (инфекционно-токсического, ОПН, ДВС и др.).
Инструментальные методы: УЗИ почек, ЭКГ, рентгенография органов грудной клетки. Специфическая лабораторная диагностика
РНИФ: исследования проводят в парных сыворотках, взятых с интервалом 5-7 сут. Диагностически значимым считают нарастание титра антител в 4 раза и более. Метод высокоэффективен, подтверждаемость диагноза достигает 96-98%. Для повышения эффективности серодиагностики ГЛПС рекомендуют проводить забор первой сыворотки до 4-7-го дня болезни, а второй - не позже 15-го дня заболевания. Используют также твердофазный ИФА, который позволяет определить концентрацию IgM-антител. С целью ранней диагностики применяют ПЦР для обнаружения фрагментов вирусной РНК в крови.
Дифференциальная диагностика
ГЛПС следует дифференцировать с другими ГЛ, однако ареал их распространения не совпадает с ареалом распространения ГЛПС, кроме ОГЛ. В начальном периоде болезни проводят дифференциальную диагностику с гриппом, риккет-сиозами, клещевым энцефалитом, в дальнейшем с болезнями, характеризующимися триадой симптомов: лихорадка, поражение почек, геморрагический синдром. Актуальна дифференциальная диагностика с острыми хирургическими заболеваниями брюшной полости (табл. 21.38).

Показания к консультации других специалистов
Консультация хирурга для исключения острых хирургических заболеваний органов брюшной полости, при подозрении на разрыв почки. Консультация реаниматолога в случае развития ИТШ при ОПН для решения вопроса о проведении гемодиализа.
Пример формулировки диагноза
А98.5 ГЛПС, олигурический период, тяжелая форма. Осложнение: ИТШ-1 (РНИФ - положительная).
Показания к госпитализации
Больные ГЛПС подлежат обязательной ранней госпитализации в инфекционные или терапевтические стационары, независимо от тяжести и периода заболевания. Амбулаторное наблюдение и лечение больных с подозрением на ГЛПС недопустимо. Транспортировка пациента должна быть максимально щадящей, с исключением толчков и тряски.
ЛЕЧЕНИЕ Тактика ведения больных ΓЛПС
Ранняя госпитализация - до 3-4-го дня болезни. Щадящая транспортировка. Строгий постельный режим до конца периода полиурии. Учет водного баланса (в дневниках).
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Щадящая диета без ограничения соли. В период олигоанурии исключаются продукты, богатые белком (мясо, рыба, бобовые) и калием (овощи, фрукты). В стадии полиурии эти продукты необходимы. Контроль гемодинамики, общего анализа крови, общего анализа мочи, коагулограммы, азотистых шлаков.
I. Этиотропная (противовирусная) терапия: (обязательно назначение этих препаратов в первые 3-5 дней заболевания): иммунобиологические средства: рекомбинантный ИФН-α2а и ИФН-α2b [Реаферон-ЕС-Липинт♠, Реаферон-Липинт♠, Реаферон-ЕС♠, интерферон альфа-2b (Реальдирон♠)]; рекомбинантный ИФН-α2b в свечах [интерферон альфа-2b (Виферон♠)]; человеческий лейкоцитарный интерферон в свечах. Противовирусные химиопрепараты: рибавирин (Виразол♠, Рибамидил♠) перорально по 200 мг 5 р/сут 5 дней;
индукторы эндогенного ИФН [тилорон (Амиксин♠) по 125 мг 2 р/сут, 2 дня подряд и 125 мг однократно на 3-й день внутрь; 1-фенил-2,3-диметил-4 йодпиразолон (Йодантипирин♠) перорально по 200 мг (2 таблетки) 3 раза в день в первые 4 дня, затем по 100 мг 3 раза в сутки в последующие 5 дней]. При невозможности приема капсулирован-ного рибавирина (неукротимая рвота, кома) с учетом противопоказаний рекомендуют в/в введение рибавирина с начальной нагрузочной дозой 33 мг/кг; через 6 ч - по 16 мг/кг через каждые 6 ч в течение 4 дней (всего 16 доз); через 8 ч после введения последней из этих доз - по 8 мг/кг каждые 8 ч в течение 3 дней (9 доз). Лечение рибавирином в данной дозе может быть продолжено в зависимости от состояния больного и мнения лечащего врача, но не должно превышать 7 дней. При возможности перорального приема рибавирина необходимо прекратить внутривенное введение рибавирина и перейти на капсулированные формы в соответствии со схемой лечения, приведенной выше.
II. Патогенетическая терапия. В начальном периоде
1.Дезинтоксикационная терапия: 5-10% раствор декстрозы (Глюкозы♠) с аскорбиновой кислотой, кокарбоксилазой по 400-600 мл, 0,9% раствор натрия хлорида с аминофиллином (Эуфиллином♠); антиоксиданты (аскорбиновая кислота, альфа-токоферола ацетат♠).
2.Лечение ДВС-синдрома (фазы гиперкоагуляции). Дезагреганты: пентокси-филлин (Трентал♠, Пентилин♠, Агапурин♠), аминофиллин (Эуфиллин♠), растворы гидроксиэтил крахмала (ГЭК); антикоагулянты: гепарин натрия (Гепарин♠) 5-10 тыс. ед. в сутки - кратковременно, под контролем активированного частичного тромбопластинового времени (АЧТВ), времени свертывания крови (ВСК); ангиопротекторы: рутинρ, пармидинρ (продектинρ), этамзилат (Дицинон♠); ингибиторы протеаз: апротинин (Контрикал♠, Гордокс♠, Трасилол 500 000♠); свежезамороженная плазма.
3.Лечение инфекционно-токсического шока (противопоказаны симпатомиме-тики!): [эпинефрин (Адреналин♠), норэпинефрин (Норадреналин♠), фенилэфрин (Мезатон♠)], за исключением допамина; не показаны спазмолитики, декстран [ср. мол. масса 50 000-70 000] (Полиглюкин♠); объем инфузий - до 40-50 мл/кг массы в сутки под контролем диуреза): восстановление объема циркулирующей крови (ОЦК) - кристаллоиды [полиионные солевые растворы, 10% раствор декстрозы (Глюкозы♠)] и коллоиды [растворы ГЭК, СЗП, альбумин человека (Альбумин♠)] в изоволюмическом режиме - 3:1; оптимизация гемодинамики (глюкокортикоиды в разовой дозе от 2-3 до 6 мг/кг массы, при отсутствии эффекта или при шоке
III ст. - допамин (0,5% или 4% по 5 мл); коррекция КЩС (буферные солевые растворы, 4% раствор натрия гидрокарбоната, кокарбоксилаза); купирование ДВС-синдрома; кислородотерапия, ИВЛ; мочегонные препараты - только(!) после нормализации гемодинамики, петлевые диуретики - фуросемид (Лазикс♠) (0,5-1 мг/кг), противопоказано введение маннитола; больным старше 50 лет необходимо назначение сердечных гликозидов (Строфантин К♠, Коргликон♠ в/в). В олигоанурическом периоде
1. Коррекция уремической интоксикации (в период олигурии не вводятся коллоидные растворы декстрана [декстран [ср. мол. масса 35 000-45 000] (Реополиглюкин♠), декстран [ср. мол. масса 50 000-70 000] (Полиглюкин♠), дек-стран [ср. мол. масса 30 000-50 000] + маннитол + натрия хлорид (Реоглюман♠)], с осторожностью растворы ГЭК (при
выраженной тромбоцитопении), глюкокор-тикоиды (кроме случаев коллапса, отека мозга и легких):
◊промывание желудка и кишечника 2% содовым раствором (осторожно); ◊ внутривенные инфузии 10-20% декстрозы (Глюкозы♠) с инсулином, 0,9% раствора натрия хлорида с аминофиллином (Эуфиллином♠), аскорбиновой кислотой, кокарбоксилазой; при тяжелых формах - 10-20% раствора альбумина человека (Альбумина♠);
◊прием энтеросорбентов [энтеросорбρ, лигнин
гидролизный (Полифепан♠), полиметилсилоксана полигидрат (Энтеросгель♠)];
◊ для снижения белкового катаболизма - ингибиторы протеаз, парентеральное питание [Интралипид♠, аминокислоты для парентерального питания (Нефрамин♠¤)].
2. Борьба с гипергидратацией, ацидозом и электролитными нарушениями. Лечение олиго- (мочи менее 900-600 мл/сут) и олигоанурии (менее 350 мл/сут)
должно исходить из главного принципа: «лучше недолить, чем перелить». Для этого необходимо:
а) расчет вводимой жидкости, не превышающей 500-700 мл объема потерь (с мочой, рвотой и диареей);
б) стимуляция диуреза фуросемидом (Лазиксом♠) в режиме ударных доз (200300 мг одномоментно, в вену, струйно) после ощелачивания (4% натрия гидрокарбонат 100-200 мл) и введения белковых препаратов [альбумин человека (Альбумин♠), СЗП]. Если при введении первой дозы получено не менее 100-200 мл мочи, через 6-12 ч возможно повторное введение фуросе-мида (Лазикса♠) в той же дозе. Общая доза препарата не должна превышать 800-1000 мг. В период анурии (мочи менее 50 мл/сут) использование фуро-семида нежелательно; в) коррекция ацидоза проводится назначением 4% натрия гидрокарбоната, объем введения (в
мл) которого рассчитывается по формуле: 0,6 × масса тела больного (кг) × ВЕ (ммоль/л). При невозможности определения рН и ВЕ крови больным с олигоанурией допускается введение до 200-300 мл 4% натрия гидрокарбоната в сутки;
г) коррекция гиперкалиемии - глюкозо-инсулиновая смесь, кальция глюконат 10% до 30-40 мл/сут, бескалиевая диета; избегать введения препаратов, содержащих ионы калия и магния.
3.В этот период продолжается ДВС, преобладает фаза гипокоагуляции и, нередко, манифестируется геморрагический синдром. Поэтому начатая в лихорадочный период коррекция ДВС проводится по тем же принципам.
4.Симптоматическая терапия: анальгетики [метамизол натрия (Анальгин♠, Баралгин М♠), дицикловерин (Триган♠), метамизол натрия + питофенон + фен-пивериния бромид (Спазмалгон♠, Спазган♠) и др.]; в случаях их неэффективности - трамадол, дроперидол, фентанил, тримеперидин (Промедол♠); десен-
сибилизирующие средства [дифенгидрамин (Димедрол♠), хлоропирамин (Супрастин♠), прометазин (Пипольфен♠) и др.]; купирование
упорной рвоты, икоты - промывания желудка, прокаин (Новокаин♠) (перорально), метоклопрамид (Церукал♠, Реглан♠¤, Перинорм♠), атропин; антигипертензивные - ами-нофиллин (Эуфиллин♠), бендазол (Дибазол♠), папаверин, антагонисты кальция [верапамил, нифедипин (Коринфар♠ , Кордафен♠ )]; противосудорожные - диазе-пам
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
(Реланиум♠, Седуксен♠, Сибазон♠), хлорпромазин (Аминазин♠), дроперидол, натрия оксибутират.
Антибактериальная терапия - при наличии инфекционных бактериальных осложнений (пневмония, абсцессы, сепсис и др.) проводится полусинтетическими пенициллинами и ЦС.
При анурии (менее 50 мл мочи в сутки) использование фуросемида противопоказано. При неэффективности консервативных мероприятий показано проведение экстракорпоральной детоксикации (гемодиализа), необходимость в которой может возникнуть на 8-12-й день болезни.
Показания:
клинические: анурия более 3-4 дней, начинающийся на фоне олигоанурии отек легких, токсическая энцефалопатия с явлениями начинающегося отека головного мозга и судорожным синдромом;
лабораторные: гиперкалиемия (6,0 ммоль/л и более), мочевина 26-30 ммоль/л и выше, креатинин более 700-800 мкмоль/л, pH 7,25 и ниже, ВЕ 6 ммоль/л и выше.
Противопоказания к гемодиализу: ИТШ, массивные кровотечения, спонтанный разрыв почки, геморрагический инсульт, геморрагический инфаркт гипофиза.
В полиурическом периоде
1.Лечение дегидратации, коррекция гипокалиемии, гипонатриемии, гипохло-ремии: прием внутрь минеральных вод, отваров изюма и кураги, растворов декстроза + калия хлорид + натрия хлорид + натрия цитрат (Регидрон♠) и декстроза + калия хлорид + натрия хлорид + натрия цитрат (Цитраглюкосолан♠¤), в количестве не менее суточного диуреза; при суточном диурезе более 5% массы тела - введение солевых растворов [калия хлорид + натрия ацетат + натрия хлорид (Ацесоль♠), калия хлорид + натрия ацетат + натрия хлорид (Хлосоль♠), лактосоль, квартасольρ, калия хлорид + кальция хлорид + магния хлорид + натрия ацетат + натрия хлорид (Квинтасоль♠)]; препараты калия - 4% раствор калия хлорида 20-60 мл/сут, калия и магния аспарагинат (Панангин♠, Аспаркам♠).
2.Коррекция реологических свойств крови: дезагреганты.
3.Для лечения воспалительных заболеваний органов мочевыводящей системы (восходящие пиелиты, пиелонефриты) назначают уросептики: производные окси-хинолина - нитроксолин (5-НОК♠, 5-Нитрокс♠¤); хинолоны - налидиксовая кислота (Невиграмон♠,
Неграм♠¤), оксолиновая кислота (Грамурин♠¤), пипемидовая кислота (Палин♠); фторхинолоны - норфлоксацин (Нолицин♠, Нормакс♠), офлоксацин (Таривид♠, Заноцин♠), ципрофлоксацин (Ципролет♠, Цифран♠, Сифлокс♠¤); нитрофураны
- нитрофурантоин (Фурадонин♠), фуразидин (Фурагин♠); антибиотики - полусинтетические пенициллины, хлорамфеникол (Левомицетин♠), ЦС.
4.Общеукрепляющая терапия - витамины, инозин (Рибоксин♠), трифосаденин (Натрия аденозинтрифосфат♠), кокарбоксилаза.
В случае развития ИТШ (чаще всего на 4-6-й день болезни) необходима интенсивная противошоковая терапия в условиях ОРИТ, которая включает введение коллоидных [декстран [ср. мол. масса 35 000-45 000] (Реополиглюкин♠), альбумин человека (Альбумин♠), свежезамороженная плазма] и кристаллоидных растворов [натрия ацетат + натрия хлорид (Дисоль♠), калия хлорид + натрия ацетат + натрия
хлорид (Ацесоль♠)] в соотношении 2:1, глюкокортикоиды (в расчете на преднизо-лон) - при ИТШ I стадии - 3-5 мг/кг/сут, II стадии - 5-10 мг/кг/сут, III стадии - 10-20 мг/кг/ сут. При отсутствии вазопрессорного эффекта от глюкокортикоидов показано введение допамина.
Прогноз
Зависит от качества медицинской помощи, штамма возбудителя. Летальность от 1 до 10% и выше. Функция почек восстанавливается медленно, но ХПН не развивается.
Примерные сроки нетрудоспособности Зависят от клинической формы и составляют от 3 нед до 2-3 мес. Правила выписки
Больные ГЛПС выписываются при нормализации диуреза, показателей азотемии (мочевина, креатинин), гемограммы, отсутствии пиурии и микрогематурии. Изогипостенурия не является противопоказанием для выписки.
Сроки выписки реконвалесцентов ГЛПС из стационара при: легкой форме - не ранее 17-19-го дня болезни; среднетяжелой - не ранее 21-23-го дня болезни; тяжелой форме - не ранее 25-28- го дня болезни.
Срок освобождения от работы после выписки составляет при легкой форме 7-10 дней, среднетяжелой - 10-14 дней, тяжелой - 15-30 дней. Вопрос о нетрудоспособности решают индивидуально.
В период реконвалесценции пациенту рекомендуется избегать тяжелого физического труда, тряской езды, переохлаждения и перегревания, посещения бани и сауны, занятий спортом на 3-6-12 мес в зависимости от тяжести заболевания.
Диспансеризация
Диспансерному наблюдению подлежат все реконвалесценты ГЛПС. Срок наблюдения для переболевших легкой формой ГЛПС - 3 мес, среднетяжелой и тяжелой - 12 мес. Наблюдение проводит врач-инфекционист, при его отсутствии - участковый терапевт. Первое контрольное обследование осуществляют через 1 мес после выписки из стационара с исследованием мочи, уровня мочевины, креатинина, АД, далее - через 3, 6, 9, 12 мес.
ПАМЯТКА ДЛЯ ПАЦИЕНТА
Рекомендовано полноценное питание с исключением раздражающей острой пищи, спиртных напитков, обильное питье (настой шиповника, щелочные минеральные воды, отвары трав с мочегонными свойствами), соблюдение режима физической нагрузки (противопоказана тяжелая физическая работа, переохлаждение, посещение бани, сауны, занятия спортом в течение 6-12 мес), показан прием общеукрепляющих средств, поливитаминов, ЛФК.
21.17.2. Омская геморрагическая лихорадка
ОГЛ - острая вирусная зоонозная природно-очаговая болезнь с преимущественно трансмиссивным механизмом передачи возбудителя, характеризующаяся волнообразной лихорадкой, общей интоксикацией, развитием геморрагического синдрома, поражением ЦНС, легких, почек и относительно доброкачественным течением.
КОД ПО МКБ-10 А98.1 Омская геморрагическая лихорадка. ЭТИОЛОГИЯ
Возбудитель - арбовирус семейства Flaviviridae рода Flavivirus. Геном представлен однонитевой РНК; по антигенной структуре близок к геному вируса клещевого энцефалита. По данным электронной микроскопии, размеры вириона составляют до 40 нм; он имеет сферическую форму, кубическую симметрию; покрыт двухслойной оболочкой, содержащей липиды и белки, имеющие антигенные свойства и определяющие группо- и
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
видоспецифические детерминанты. Размножается вирус ОГЛ в цитоплазме на мембранах комплекса Гольджи. Высокопатогенен для белых мышей, ондатр и узкочерепных полевок; вызывает паралитические явления у некоторых видов обезьян после внутримозгового инфицирования. Хорошо культивируется в клеточных культурах эмбриональной ткани мышей, кур, хомяков, обезьян и человека, но выраженный цитопатогенный эффект дает только в культурах тканей эмбриона свиньи. Вирус ОГЛ становится высоковирулентным при пассаже на белых мышах и ондатрах; представляет опасность внутрилабораторно-го заражения сотрудников, работающих с инфицированными животными. Вирус
инактивируется дезинфицирующими растворами (3% раствором карболовой кислоты, 3% раствором лизола, 1% раствором хлорамина); при температуре 70-80 °С погибает через 10 мин, при кипячении - мгновенно; при 4 °С инактивируется через 29 сут; в 50% глицерине сохраняется до 7 мес; в высушенном состоянии - до ЭПИДЕМИОЛОГИЯ
После 2002 г. эпизоотическая и эпидемическая активность природных очагов ОГЛ перестала регистрироваться, однако вирус ОГЛ на эндемичных территориях периодически выявляется. В 1989-2002 гг. регулярная эпидемическая активность имела место только на территории четырех административных районов Новосибирской области. В абсолютном большинстве случаев доминировали нетрансмиссивные пути инфицирования людей, как правило, при непосредственном контакте с инфицированными ондатрами.
Основной источник и резервуар вируса - иксодовые клещи Dermacentor ρictus и Dermacentor marginatus (вирус передается трансовариально и в процессе метаморфоза). Кроме того, в природных очагах обнаруживают грызунов, инфицированных вирусом ОГЛ (полевки, мыши, крысы, бурозубки, ондатры, бурундуки, водяные крысы и другие грызуны). Заражение людей происходит в основном через укус клещами, а также воздушно-пылевым путем от грызунов, контактным - при разделке туши животных и алиментарным - при употреблении сырой озерной воды. Естественная восприимчивость людей высокая; вирус поражает все возрастные группы населения, но преимущественно заболевают лица в возрасте 20-40 лет (в основном промысловые рабочие и люди, занятые на полевых работах в лесостепных районах).
Своеобразием ОГЛ является ее сравнительно ограниченный нозоареал, не вышедший за пределы лесостепи Западной Сибири, в пределах которой заболевания отмечались лишь в 9 районах Омской области, в 8 районах Новосибирской и
5 районах Тюменской и Курганской областей. Появившиеся в литературе сообщения о выявлении и эпидемическом проявлении очагов, сходных с ОГЛ, на Украине, в Смоленской, Северо-Казахстанской и Оренбургской областях носят характер предварительных сообщений, не получивших бесспорных подтверждений, и не дают оснований расширять известный ареал ОГЛ за пределы Западной Сибири.
Четко выражена сезонность заболеваемости: первый подъем наблюдают в весенне-летние месяцы (май-июнь) - период активности клещей (трансмиссивный путь передачи); второй - в осенние месяцы (сентябрь-октябрь) в период отлова ондатры (нетрансмиссивные пути передачи).
В отличие от эпидемических вспышек трансмиссивной природы нетрансмиссивным эпидемическим вспышкам ОГЛ, возникающим в результате контакта человека с зараженной ондатрой, присуща осенне-зимняя сезонность, что обусловлено их связью с эпизоотией ОГЛ в популяции ондатры и промыслом ее преимущественно в зимний период. Второй отличительной особенностью нетрансмиссивных вспышек ОГЛ является отсутствие бессимптомных форм инфекции, вероятно, вследствие повышения вирулентности возбудителя, прошедшего через организм ондатры, тогда как при трансмиссивном заражении
наблюдается подавляющее преобладание бессимптомных форм инфекции, что подтверждается данными изучения иммунологической структуры населения.
Данные изучения иммунологической структуры населения позволили также предположить, что эпидемический процесс в очагах ОГЛ проявляется в настоящее время не только бессимптомными, но и клинически выраженными, преимущественно стертыми формами, и только в случае возникновения эпидемических вспышек нетрансмиссивной природы (ондатровых) наблюдаются четко очерченные клинически заболевания.
После перенесенной инфекции развивается стойкий иммунитет, при котором определяются в крови вируснейтрализующие и комплементсвязывающие антитела. Гуморальный иммунитет сохраняется многие годы, вероятно, пожизненно.
МЕРЫ ПРОФИЛАКТИКИ Специфические
В очагах используют вакцину против клещевого энцефалита (вследствие схожести антигенных характеристик возбудителей развивается стойкий иммунитет против обоих заболеваний), а также применяют убитую формолвакцину из мозга белых мышей, инфицированных вирусом ОГЛ. При аварийных случаях в лабораториях проводят пассивную иммунопрофилактику сывороткой крови реконвалес-центов (по 30-50 мл внутримышечно). Неспецифические
Проводят уничтожение клещей в природе, борьбу с грызунами; необходимо соблюдение индивидуальных мер безопасности (использование защитной одежды, инсектицидов, при работе в запыленных помещениях - респираторов).
ПАТОГЕНЕЗ
Изучен недостаточно. Внедряясь в организм человека через поврежденную кожу, слизистые оболочки дыхательных путей и органов пищеварения, вирус с током крови распространяется по всему организму и поражает преимущественно эндотелий сосудов микроциркуляторного русла, надпочечники, вегетативную нервную систему и селезенку. Поражение мелких кровеносных сосудов в различных органах и тканях обусловливает развитие геморрагического синдрома.
КЛИНИЧЕСКАЯ КАРТИНА Инкубационный период составляет 2-10 сут (в среднем 5-7 сут).
В зависимости от наличия и выраженности основных симптомов выделяют:
◊типичные формы заболевания (геморрагические);
◊атипичные формы заболевания (без геморрагических проявлений). По степени тяжести заболевания выделяют:
◊легкое течение;
◊среднетяжелое течение;
◊тяжелое течение.
По характеру клинических проявлений выделяют: ◊ острое течение (без рецидива); ◊ острое рецидивирующее течение (с повторной температурной волной). Основные симптомы и динамика их развития
Начало заболевания острое, внезапное, с высокой лихорадкой, ознобом, резкой головной болью, головокружением, выраженной слабостью, мышечными болями в конечностях и
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
спине, тошнотой и носовыми кровотечениями. Температура тела с 1-х суток заболевания достигает высоких значений (39-40 °С), держится в течение 3-4 сут, а затем на 7-15-е сутки заболевания литически снижается. Почти у 50% больных в период реконвалесценции (на 2-3- й неделе течения заболевания) выявляют повторную волну лихорадки, во время которой возобновляются симптомы интоксикации с ухудшением состояния. Вторая волна заболевания продолжается 4-14 сут, но протекает легче. На фоне лихорадки больные вялые, лежат неподвижно с откинутой назад головой, заторможены, неохотно отвечают на вопросы. Возникает одутловатость и гиперемия лица, шеи; инъекция сосудов склер и конъюнктив; яркая окраска мягкого и твердого нёба («пылающий зев»), десен с развитием на них мелких и крупных кровоизлияний. С 3-4-х суток течения
заболевания развиваются геморрагические симптомы, наиболее ранний из которых - появление геморрагической сыпи на передней и боковых поверхностях груди, разгибательных поверхностях рук и ног; положительные симптомы жгута и щипка. Возможны носовые, легочные, желудочно-кишечные и маточные кровотечения, чаще необильные, но повторяющиеся на протяжении заболевания несколько раз. В период обострения иногда выявляют общемозговые и менинге-альные симптомы, преходящие очаговые симптомы. Часто выявляют поражения органов дыхания в форме бронхита и мелкоочаговой пневмонии, что представляет характерную особенность клинической картины ОГЛ (в отличие от других ГЛ). Диурез снижен, но развития почечной недостаточности не выявляют. Вовлечение органов пищеварительной системы выражается тошнотой, рвотой, горечью и сухостью во рту, гепатомегалией, болями в эпигастрии. Характерны обратимые изменения сердечно-сосудистой системы в виде брадикардии, расширения границ сердца влево, глухости сердечных тонов и артериальной гипотензии. Течение периода реконвалесценции зависит от наличия повторной лихорадочной волны и осложнений.
Осложнения
Осложнения возникают редко. К ним относят отит или паротит (нередко гнойного характера), пиелит, поздние очаговые пневмонии. У большинства больных ОГЛ заканчивается полным выздоровлением. В неосложненных случаях прогноз благоприятный.
Летальность и причины смерти
При тяжелом течении смерть может наступить в ранние сроки в результате интоксикации или кровотечения и на 30-45-е сутки течения заболевания от септических осложнений. Летальность не превышает 1%.
ДИАГНОСТИКА Клиническая диагностика
A.Жалобы: высокая лихорадка, озноб, резкая головная боль, головокружение, выраженная слабость, мышечные боли в конечностях и спине, тошнота, носовые кровотечения.
Б. Анамнез: повторное повышение температуры тела в период реконвалесцен-ции.
B.Эпидемиологический анамнез: пребывание в эндемичных для ОГЛ районах, укус клеща, особенности профессиональной деятельности, сезонность - май-июнь, сентябрь-октябрь.
Г. Клинические признаки: острое начало с резким подъемом температуры тела, миалгией; часто возникают бронхит и пневмония; развитие геморрагического (петехиальная сыпь, кровоизлияния в склеру, кровохарканье; носовые, желудочно-кишечные, легочные и маточные кровотечения) и менингеаль-ного синдромов при отсутствии выраженных проявлений почечной недостаточности.
Специфическая и неспецифическая лабораторная диагностика Неспецифическая лабораторная диагностика.

•Клинический анализ крови. Выявляют повышение содержания гемоглобина и числа эритроцитов, лимфопению, умеренный нейтрофилез со сдвигом влево, тромбоцитопению, уменьшение СОЭ до 3-7 мм/ч.
•Общий анализ мочи. Характерны: протеинурия, микрогематурия, цилиндру-рия, наличие в осадке мочи уже со 2-х суток течения заболевания зернистых клеток почечного эпителия и эпителия МВП (до 20-30 в поле зрения).
Специфическая лабораторная диагностика: метод флюоресцирующих антител (в парных сыворотках), РСК, РН, РПГА, ПЦР.
Инструментальные методы
При рентгенографии органов грудной клетки выявляют картину интерстици-альной пневмонии.
На ЭКГ выявляют обратимые диффузные изменения миокарда в виде деформации и расширения комплекса QRS, а также изменения вольтажа зубцов Р и Т. Проводят УЗИ почек.
Дифференциальная диагностика ОГЛ дифференцируют от других ГЛ, клещевого энцефалита, лептоспироза (табл. 21.39).
Показания к госпитализации
Больные ОГЛ подлежат обязательной госпитализации в инфекционный стационар независимо от тяжести и периода заболевания. Амбулаторное наблюдение и лечение больных с подозрением на ОГЛ недопустимо. Транспортировка пациента должна быть максимально щадящей с исключением толчков и тряски.
ЛЕЧЕНИЕ Режим. Диета
Необходимо соблюдение постельного режима.
Рекомендовано щадящее питание - дробное, в теплом виде, с переходом на общий стол (№ 15) в период реконвалесценции.
Медикаментозное лечение
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Включает патогенетическое и симптоматическое лечение. Этиотропное лечение Не разработано.
Патогенетическое лечение
А. Дезинтоксикационная терапия - внутривенное введение 5-10% растворов декстрозы (Глюкоза♠), изотонического раствора натрия хлорида с аскорбиновой кислотой и кокарбоксилазой, энтеросорбенты (лигнин гидролизный, повидон).
Б. Профилактика ДВС-синдрома: дезагреганты - пентоксифиллин, ксантинола никотинат, дипиридамол, ангиопротекторы - кальция глюконат, этамзилат, руто-зид,
свежезамороженная плазма, ингибиторы протеаз - апротинин; антиоксидан-ты (витамин Е, Убихинон композитум♠).
При осложнениях бактериальной этиологии назначают антибиотики: пеницил-лины, ЦС, хлорамфеникол, фторхинолоны.
Прогноз
В сравнении с ГЛПС и КГЛ прогноз при ОГЛ достаточно благоприятный и зависит от соблюдения принципов госпитализации, ухода за больными, проведения своевременного и комплексного медикаментозного лечения, профилактики развития осложнений.
Примерные сроки нетрудоспособности
Выписку больных проводят при удовлетворительном состоянии пациента и нормализации лабораторных показателей (клинических анализов крови и мочи). Сроки нетрудоспособности определяют индивидуально. Срок освобождения от работы после выписки составляет: при легкой форме заболевания - 7-10 сут, среднетяжелой - 10-14 сут, тяжелой - 15-30 сут. Диспансерное наблюдение
Диспансеризации подлежат все реконвалесценты ОГЛ. Срок наблюдения для переболевших легкой формой ОГЛ - 3 мес, среднетяжелой и тяжелой - 12 мес. Наблюдение проводит инфекционист, а при его отсутствии - участковый терапевт. Первое контрольное обследование осуществляют через 1 мес после выписки из стационара (исследуют мочу и кровь), последующие - через 3, 6, 9 и 12 мес.
Санаторно-курортное лечение
Рекомендуется полноценное питание с исключением раздражающей острой пищи, спиртных напитков; соблюдение физического режима (противопоказаны: тяжелая физическая работа, переохлаждение, посещение бани, сауны, занятия спортом в течение 6-12 мес). Назначают прием общеукрепляющих ЛС, поливитаминов. Показаны санатории для лечения пациентов общего профиля.
21.17.3. Желтая лихорадка
Желтая лихорадка (англ. Yellow fever, лат. Febris flava, нем. Yelbfibeга - амариль-ная лихорадка) - острая природно-очаговая трансмиссивная вирусная инфекционная болезнь, характеризующаяся поражением сосудов, печени, почек, геморрагическим синдромом, тяжелым циклическим течением.
Желтую лихорадку относят к группе карантинных заболеваний (особо опасные инфекции), подлежащих международной регистрации.
КОДЫ ПО МКБ-10
A95 Желтая лихорадка. A95.0 Лесная желтая лихорадка. A95.1 Городская желтая лихорадка. A95.9 Желтая лихорадка неуточненная.
ЭТИОЛОГИЯ
Возбудитель - РНК-содержащий вирус Visceronhilus
tropicus рода Flavivirus семейства Flaviviridae, относящийся к группе арбовирусов. Капсид имеет сферическую форму; размеры около 40 нм. В окружающей среде малоустойчив: быстро инактивируется при низких значениях рН, воздействии высокой температуры и обычных дезинфицирующих средств. Длительно сохраняется при низких температурах (в жидком азоте до 12 лет) и при высушивании. Установлено антигенное родство с возбудителями лихорадки денге и японского энцефалита. Вирус желтой лихорадки агглютинирует эритроциты гусей, вызывает цитопатический эффект в клетках линий Hela, KB, Детройт-6. Вирус желтой лихорадки отнесен к 1-й группе патогенности (все виды работ с такими вирусами проводятся в максимально изолированных лабораториях). Вирус может быть выделен из крови больного желтой лихорадкой в течение первых трех дней болезни с использованием белых мышей и обезьян, а также из печени и селезенки в секционных (смертельных) случаях. Возможно также использование клеток некоторых членистоногих, в частности комаров Aedes aegyρti. Показано, что при длительных пассажах в культуре клеток и куриных эмбрионах патогенность вируса для обезьян существенно снижается, что используют для приготовления вакцин.
ЭПИДЕМИОЛОГИЯ В настоящее время различают два эпидемиологических типа желтой лихорадки:
◊эндемическая желтая лихорадка (джунглевая, или зоонозная);
◊эпидемическая желтая лихорадка (городская, или антропонозная).
На американском континенте переносчиками возбудителя являются комары
рода Haemagogus и Aedes, а в Африке - ряд видов рода Aedes, среди которых основную роль играют A. africanus и A. simρsoni. Главный источник и резервуар инфекции при джунглевой форме желтой лихорадки - дикие животные (обезьяны, опоссумы, сумчатые, грызуны и другие), а при городской форме - человек. Заразный период у животных определить невозможно, у человека же этот период начинается за 1-2 дня до появления клинических признаков заболевания, длится в течение 3-4 дней. A. africanus во время сухого сезона сохраняет активность в кронах деревьев и тем самым постоянно обеспечивает циркуляцию вируса. Обычно заражают-
ся люди, по роду своей деятельности часто посещающие леса. Инфицированный человек, в свою очередь, представляет источник вируса для комара A. aegypti, обитающего рядом с жилищем человека. Для размножения комары используют декоративные водоемы, бочки с водой и другие временные вместилища воды; часто нападают на человека. В организме комара возбудитель сохраняется в течение всей жизни насекомого, однако трансовариальной передачи возбудителя не происходит. При температуре окружающей среды 25 °С комар становится способным передать возбудителя человеку через 10-12 сут после заражения, а при 37 °С - 4 сут. В организме комара вирус сначала размножается в тканях средней кишки, затем через гемолимфу попадает практически во все органы насекомого, в том числе слюнные железы; при этом количество вируса возрастает в тысячи раз по сравнению с исходным уровнем. Патологические изменения у комаров происходят на клеточном уровне, однако не влияют на физиологические показатели и продолжительность жизни насекомого.
На развитие возбудителя в организме комара влияет объем поглощенной им крови и количество полученного при этом вируса (заражение комара происходит только при попадании в него определенного минимального количества вирионов). Если циркуляция вируса происходит по цепочке «человек-комар-человек», то желтая лихорадка становится
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
типичным антропонозом. Вирусемия у больного развивается в конце инкубационного периода и в первые 3 сут течения заболевания. Вирус, передаваемый комарами, поражает людей любого возраста и пола. В эндемических очагах взрослые болеют реже детей.
Природные очаги желтой лихорадки располагаются в тропических зонах Южной Америки и Африки. По данным ВОЗ, эндемичными в настоящий момент являются 45 стран Африки и 13 стран Южной и Центральной Америки, в частности: Конго, Судан, Сенегал, Боливия, Перу, Бразилия, Мексика, Камерун, Нигерия, Замбия, Уганда, Сомали. Однако вспышки этого заболевания могут возникать практически на любых территориях, где есть переносчики вируса: от 42° северной до 40° южной широты. Вирус распространяется из эндемичных очагов при помощи инфицированных людей и переносчиков. При наличии условий для распространения возбудителя (вирусоносители, большое количество переносчиков и восприимчивых людей) возможно развитие эпидемии. Больной в отсутствие переносчика эпидемиологически не опасен. Путь передачи только трансмиссивный. Комар A.
aegypti обитает в субтропических районах России, но случаев желтой лихорадки в нашей стране выявлено не было. Врожденным иммунитетом к желтой лихорадке человек не обладает. У переболевших развивается пожизненный иммунитет. Восприимчивость людей к вирусу очень высокая, при этом в эндемичных районах часто происходит латентная иммунизация местного населения малыми дозами вируса.
МЕРЫ ПРОФИЛАКТИКИ Специфические
Для профилактики желтой лихорадки большое практическое значение имеет иммунизация населения. С этой целью используют две живые вакцины: вакцина на основе штамма 17Д и, реже, вакцина на основе штамма Дакар.
Вакцина на основе штамма 17Д весьма эффективна, надежный иммунитет развивается в течение 1 нед у 95% привитых и сохраняется в течение 30-35 лет (возможно, пожизненно). Во многих странах ревакцинацию проводят каждые 10 лет.
Для предупреждения распространения желтой лихорадки по существующим Международным санитарным правилам необходимо обязательно учитывать все случаи заболевания.
Лицам, направляющимся в зону, эндемичную для данного заболевания, необходимо сделать прививку. Это обязательно и для лиц, выезжающих из такой зоны. Вакцинация рекомендована людям, выезжающим в страны: Ангола, Аргентина, Бенин, Гвинея-Бисау, Боливия, Бразилия, Буркина-Фасо, Бурунди, Венесуэла, Габон, Гамбия, Гана, Гвинея, Гуана, Демократическая Республика Конго, Камерун, Кения, Колумбия, Конго, Кот-д?Ивуар, Либерия, Мавритания, Мали, Нигер, Нигерия, Панама, Парагвай, Перу, Руанда, Сенегал, Судан, Суринам, Сьерра-Леоне, Того, Уганда, Французская Гвиана, Центральная Африканская Республика, Чад, Эквадор, Экваториальная Гвинея, Эфиопия, Южный Судан.
Для предупреждения распространения комаров самолеты и корабли, посещающие эндемичные для желтой лихорадки местности или места распространения A.
aegypti, подвергают обязательной дезинсекции. Большое значение имеет выявление первых случаев заболевания. По рекомендации ВОЗ его следует предполагать при выявлении случаев острой лихорадки с развитием желтухи в течение 2 нед после начала заболевания, сопровождающейся кровотечениями или смертью в течение 3 нед.
Неспецифические
Для полной ликвидации вспышек заболевания желтой лихорадкой необходима научно обоснованная и настойчивая борьба с переносчиками возбудителя - комарами. Как показал опыт практической работы в эндемичных очагах, в большинстве случаев достаточно снизить численность популяции переносчиков - ниже критической плотности, при которой цикл
передачи возбудителя полностью прерывается. Полную ликвидацию переносчиков в определенных районах не проводят не только из-за экономической нецелесообразности и административных проблем, но и по причине опасности возникновения необратимых изменений биоценоза.
Тем не менее достаточно убедителен пример полной ликвидации A. aegypti в городских условиях ряда стран Центральной и Южной Америки и особенно в США. Сложнее бороться с комарами в сельской местности и лесных районах, в частности вне жилища человека или в лесу.
Для достижения быстрого эффекта уничтожения взрослых особей насекомых используют химические инсектициды. Наибольшее распространение получили фосфорорганические соединения, в частности малатион и различные препараты группы пиретроидов.
В последние годы получили распространение препараты, приготовленные на основе культур Вас. thuringiensis, применяемые для уничтожения комаров на личиночной стадии развития.
Существуют специальные методы зашиты человека от укусов комарами - сетки, закрывающие обнаженные участки тела (особенно голову и шею) или кровать. Сетки, одежду и отдельные участки тела обрабатывают репеллентами. Для предупреждения распространения возбудителя необходимо принимать меры по предотвращению контакта больного человека с переносчиками. Въезд в эндемичные по желтой лихорадке страны требует наличия международного свидетельства о вакцинации от данной инфекции. ПАТОГЕНЕЗ
Заражение происходит при укусе инфицированным комаром. Вирус по лимфатическим сосудам проникает в регионарные ЛУ, в которых происходит его репликация во время инкубационного периода. По прошествии нескольких дней он поступает в кровь и распространяется по всему организму. Длительность виру-семии 3-6 сут. В это время вирус попадает главным образом в эндотелий сосудов, печень, почки, селезенку, костный и головной мозг. Характерен выраженный
тропизм возбудителя к кровеносной системе этих органов. В результате возникает повышенная проницаемость сосудов микроциркуляторного русла. Развиваются дистрофия и некроз гепатоцитов, поражение клубочковой и канальцевой систем почек. Развитие тромбогеморрагического синдрома обусловлено как поражением сосудов и микроциркуляторными расстройствами, так и нарушением синтеза в печени плазменных факторов гемостаза.
Кожные покровы умерших обычно окрашены в желтый цвет, часто багровые из-за венозной гиперемии. Характерны дегенеративные изменения печени, почек, сердца. Печень и почки значительно увеличены, с мелкоточечными кровоизлияниями, жировой дистрофией, очагами некроза (в тяжелых случаях субтотального). В печени обнаруживают тельца Каунсильмена, в ядрах клеток печени - ацидофильные включения (тельца Торреса). Они образуются вследствие размножения вируса в клетках и изменений в их ядрах. Несмотря на существенные изменения в печени и в почках, после выздоровления наблюдают полное восстановление их функций без исхода в фиброз ткани печени и почек.
В ряде случаев причина смерти - поражение почек, характеризующееся набуханием и жировой дистрофией почечных канальцев вплоть до некроза. В канальцах скапливаются коллоидные массы, кровяные цилиндры. Изменения в клубочках почек часто незначительны. Селезенка переполнена кровью, ретикулярные клетки фолликулов гиперплазированы. Дегенеративные изменения происходят в мышце сердца; в перикарде выявляют кровоизлияния. Характерны множественные кровоизлияния в желудке, кишке, легких, плевре, а также периваскулярные инфильтраты в головном мозге.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
КЛИНИЧЕСКАЯ КАРТИНА Инкубационный период обычно составляет 3-6 сут (редко до 10 сут). Классификация
По тяжести течения выделяют следующие формы заболевания: легкую, средне-тяжелую, тяжелую, молниеносную.
Основные симптомы и динамика их развития В типичных случаях заболевание имеет двухволновое течение с тремя периодами:
◊ начальный лихорадочный (период гиперемии); ◊ период ремиссии со снижением температуры тела; ◊ период венозного стаза (реактивный).
Заболевание начинается, как правило, остро, без продромы. Высокая лихорадка развивается уже в течение 1-х суток. Подъем температуры сопровождается ознобом, болями в мышцах спины и конечностей и сильной головной болью. Часто тошнота, рвота.
Обычно температура тела снижается до нормальных значений к исходу 3-х суток, но при тяжелом течении лихорадка может длиться 8-10 сут. Затем температура вновь повышается, обычно не достигая первоначальных высоких значений. В начале заболевания появляются гиперемия лица, шеи и верхней части туловища, выраженная инъекция сосудов склер, отечность век, припухлость губ, одутловатость лица («амарильная маска»). Характерны светобоязнь и слезотечение. Слизистая оболочка рта и язык ярко-красного цвета. Больные страдают бессонницей. Появляются тошнота, рвота с примесью желчи. Пульс достигает 100130 ударов в минуту, в дальнейшем развивается брадикардия. АД в норме. Увеличены печень и селезенка, возможна их болезненность при пальпации. В общем анализе крови выявляют лейкопению и лимфопению, СОЭ не увеличена. Характерна протеинурия.
С началом желтушного окрашивания склер, конъюнктив и мягкого нёба снижается АД и появляется цианоз. Состояние больных значительно ухудшается. Возможны носовые кровотечения, кровоточивость десен, в рвотных массах выявляют кровь. При более легком течении наступает стадия ремиссии, при этом температура тела снижается до нормы, общее состояние улучшается, прекращаются тошнота и рвота, лицо бледнеет, исчезает одутловатость. Однако уже через несколько часов вновь происходит резкое ухудшение состояния, температура тела быстро повышается. Эти признаки свидетельствуют о переходе заболевания в наиболее тяжелый период - венозного стаза, наблюдаемый примерно у 15% больных и характеризующийся развитием желтухи, геморрагического диатеза и ОПН. Выявляют кровоточивость десен, а также носовые, маточные и кишечные кровотечения. На фоне полиморфной сыпи на коже возникают геморрагии. Нередко появляется рвота цвета кофейной гущи. АД падает; тоны сердца приглушены; пульс слабого наполнения до 40 в минуту. Состояние больного часто отягощается поражением почек с развитием олигурии. Количество белка в моче возрастает до 10 г/л и больше, появляются зернистые и гиалиновые цилиндры. В крови нарастает уровень мочевины и креатинина. Печень увеличена, болезненная. Возрастает количество связанного и свободного билирубина, повышается активность альдо-лазы и аминотрансфераз. Лейкопения достигает 1,5-2,5×109 на литр. Замедляется свертывание крови, возрастает СОЭ. Указанные изменения наиболее выражены на 6-7-е сутки заболевания - критический период для больного. Летальный исход наступает в 50% случаев, чаще от ОПН с развитием уремической комы (отек головного мозга, потеря сознания) и токсического энцефалита, реже от печеночной комы или сердечно-сосудистой недостаточности (миокардита). При благоприятном течении заболевания с 8-9-х суток общее состояние больных постепенно улучшается. Происходит нормализация клинических и лабораторных показателей. Астения сохраняется в течение недели. Возможны также субклинические формы течения заболевания. Диагноз устанавливают ретроспективно с использованием серологических методов исследования.
Осложнения
Осложнениями желтой лихорадки являются: ИТШ, пневмония, абсцесс почек, энцефалит, миокардит, гангрена мягких тканей, пневмония, паротит, сепсис.
Летальность и причины смерти
Молниеносная форма приводит к смерти на 3-4-е сутки течения заболевания. При тяжелой форме летальные исходы диагностировали на 6-7-е сутки.
Смерть наступает при развитии острой почечной, печеночной и сердечнососудистой недостаточности. Часто выявляют симптомы токсической энцефалопатии.
ДИАГНОСТИКА Клиническая диагностика
Предварительный диагноз устанавливается на основании:
1)прибытия или нахождения в эндемичном регионе (страны Африки и Южной Америки);
2)симптомов болезни («седловидная» или «двухволновая» температурная кривая, геморрагический синдром, желтуха, поражение почек, печени и селезенки).
Специфическая и неспецифическая лабораторная диагностика Неспецифическая
Лабораторные данные: увеличение билирубина, АЛТ, АСТ, мочевины, креати-нина, лейко- и лимфопения, увеличение СОЭ, в моче - белок, цилиндры, эритроциты).
Специфическая
Окончательный диагноз подтверждается биологическим методом: внутримоз-говое заражение новорожденных или молодых лабораторных мышей.
1.Выделение возбудителя из крови.
2.ИФА для индикации антигена возбудителя (результат через 3 ч).
3.РН, РСК, РТГА, РНГА ставят с парными сыворотками, взятыми к концу первой недели болезни и спустя 2-3 дня. Результат считают положительным при четырехкратном повышении титра антител.
4.При летальном исходе гистологически исследуют печень, где выявляют очаги субмассивного и массивного некроза печеночных долек и ацидофильные тельца Каунсильмена.
Алгоритм постановки диагноза
Этап 1. Проводят эпидемиологический анамнез (больной пребывал в тропических зонах Южной Америки или Африки). (При положительных результатах исследование продолжают.) Этап 2. Изучают течение заболевания. Начало острое, выражены интоксикация и высокая лихорадка. (При положительных результатах исследование продолжают.)
Этап 3. Выявляют боль в животе, рвоту, тошноту, жидкий стул, головную боль, миалгию, возбуждение. (При положительных результатах исследование продолжают.)
Этап 4. Выявляют наличие геморрагического синдрома (носовые кровотечения, кровоточивость десен, примесь крови в рвотных массах), субиктеричность или иктеричность кожи и склер. (При положительных результатах исследование продолжают.)
Этап 5. Диагностируют увеличение печени и селезенки, одутловатость лица (с багровосиневатым оттенком). Конец исследования.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Диагноз: желтая лихорадка (следует провести серологическую диагностику для исключения других ГЛ).
Дифференциальная диагностика
Желтую лихорадку дифференциально диагностируют с тропической малярией, желтушной формой лептоспироза, ВГ, менингококкемией, а также с ГЛ Ласса, Марбург и Эбола и ГЛПС (табл. 21.40).
Показания к консультации других специалистов В ряде случаев необходима консультация невролога, кардиолога, хирурга. Пример формулировки диагноза А95 Желтая лихорадка средней тяжести.
Показания к госпитализации
На территории РФ не регистрируется. Показания зависят от медицинских правил разных стран.
ЛЕЧЕНИЕ
Организационно-режимные мероприятия: госпитализация всех больных в стационар и строгий постельный режим! Диета молочно-растительная с комплексом витаминов (С, В).
Медикаментозное лечение
Этиотропного (противовирусного) лечения нет. Некоторые авторы рекомендуют назначать рибавирин в дозе 800-1200 мг и вводить сыворотку переболевших людей. Патогенетическое и симптоматическое лечение: ◊ дезинтоксикация (глюкозо-солевые растворы, растворы альбумина); ◊ профилактика и лечение геморрагического синдрома (преднизолон, аминокапроновая кислота, коллоидные растворы, по показаниям - переливание
крови);
◊при почечной недостаточности - стимуляция диуреза, по показаниям гемодиализ;
◊при поражении печени - детоксикация организма - Гепасол-Нео♠, гепатопротекторы, декстроза (Глюкоза♠) и др.;
◊при наслоении вторичных бактериальных инфекций - антибиотики. Рекомендации по применению гепарина натрия (Гепарин♠) и глюкокортикои-дов основывают только на теоретических данных; контролируемых исследований не проводили.
Прогноз
Прогноз благоприятный при легкой и среднетяжелой формах заболевания. При тяжелых формах летальность достигает 25%. Даже при тяжелых формах после 12-го дня заболевания наступает выздоровление. Пожилые люди плохо переносят заболевание. Наименьшая летальность среди детей.
Примерные сроки нетрудоспособности
Определяют на основе тяжести течения заболевания и наличия осложнений. Сроки нетрудоспособности составляют от 1 мес (при среднетяжелом течении) до 12 мес (при тяжелом течении и наличии осложнений).
Диспансеризация
Срок диспансерного наблюдения определяют, исходя из тяжести перенесенного заболевания: при легкой форме он составляет 3 мес, при среднетяжелой и тяжелой - 12 мес. Через 1 мес после выписки проводят первое обследование в стационаре или КИЗ. Лицам с выявленными нарушениями или ухудшением показана повторная госпитализация.
Памятка для пациента
После выписки из стационара больные должны соблюдать диету в течение 6 мес (такую же, как при вирусных гепатитах). Необходимо ограничить физические нагрузки на 3-6 мес. Рекомендации врач определяет индивидуально в зависимости от тяжести течения заболевания и наличия осложнений.
21.17.4. Лихорадка денге
Лихорадка денге - острая зооантропонозная арбовирусная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя, распространенная в странах тропического и субтропического пояса. Различают две клинические формы болезни: классическую и геморрагическую (шоковый синдром денге).
Классическая лихорадка денге (синонимы - денге, костоломная лихорадка) характеризуется двухволновой лихорадкой, артралгией, миалгией, экзантемой, полиаденитом, лейкопенией и доброкачественным течением болезни.
ГЛД (ferbis hemorragica dengue, шоковый синдром денге) характеризуется развитием тромбогеморрагического синдрома, шока и высокой летальностью.
КОДЫ ПО МКБ-10 А90 Классическая лихорадка денге. А91 Геморрагическая лихорадка денге. ЭТИОЛОГИЯ
Возбудитель лихорадки денге относится к арбовирусам,
роду Flavivirus, семейству Flaviviridae. Геном представлен однонитевой РНК. Размеры вириона 40-45 нм. Имеет дополнительную суперкапсидную оболочку, с которой связаны антигенные и гемагглютинирующие свойства. Вирус хорошо сохраняется при низких температурах (-70 °С) и в высушенном состоянии; чувствителен к формалину и эфиру, инактивируется при обработке протеолитическими ферментами и при нагревании до 60 °С. Известны четыре антигенных серотипа вируса денге: DEN I, DEN II, DEN III, DEN
IV. Серотип денге-1 вызывает более высокую и продолжительную вирусемию в крови больных, чем серотипы 2 и 3. Вирус денге передается человеку через укусы комаров и поэтому входит в экологическую группу арбовирусов. Выраженной зависимости клинической картины от серотипа вируса не установлено. Вирус обладает слабой цитопатической активностью. Его репликация происходит в цитоплазме пораженных клеток. У обезьян он вызывает бессимптомную инфекцию с формированием прочного иммунитета. Вирус патогенен для новорожденных белых мышей при заражении в мозг или
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
внутрибрюшинно. Вирус размножается в культурах тканей почек обезьян, хомячков, яичек обезьян, а также на линиях клеток HeLa, КВ и кожи человека.
ЭПИДЕМИОЛОГИЯ
Источник возбудителя инфекции - больной человек и обезьяны, у которых заболевание может протекать латентно.
В эндемичных регионах существуют природные очаги болезни, в которых циркуляция вируса происходит между обезьянами, лемурами, белками, летучими мышами и, возможно, другими млекопитающими. Переносчики - комары рода Aedes (A. aegyρti, A. alboρictus, A. cutellaris, A. ρolinesiensis), возможно, определенная роль принадлежит комарам родов Anopheles и Culex.
Комары рода Aedes после кровососания становятся заразными через 8-12 дней в зависимости от температурных условий. Их способность к заражению сохраняется в течение жизни, т.е. 1- 3 мес, однако при температуре воздуха ниже 22 °С размножения вируса в организме комара не происходит, поэтому ареал денге меньше ареала комаров-переносчиков и ограничивается 42° северной и 40° южной долготы. В странах с умеренным и холодным климатом регистрируются завозные спорадические случаи классической лихорадки денге, очень редко - геморрагической.
Заражение человека в эндемичных регионах привело к формированию стойких антропургических очагов инфекции, независимых от природных условий. В этих
очагах источник возбудителя - больной человек, который становится заразным почти за сутки до начала болезни и остается заразным в течение первых 3-5 дней болезни.
Основной переносчик возбудителя в человеческой популяции - комар A. aegypti, обитающий в жилище человека. Самка комара кусает человека днем. Комар наиболее активен при температуре 25-28 °С, при этой же температуре его численность достигает максимума, а сроки заразительности после кровососания минимальны. Комар является пожизненным перносчиком вируса (от 1 до 5 мес). Человек высоковосприимчив к лихорадке денге, заражение происходит даже при однократном укусе комаром. У человека каждый из четырех типов вируса способен вызывать классическую форму лихорадки денге и ГЛД. Иммунитет после перенесенной болезни кратковременный, длится несколько лет, типоспецифический, поэтому после перенесенной болезни человек остается восприимчивым к другим сероти-пам вируса. Крупные эпидемии всегда связаны с заносом вируса, не свойственного данному региону, или в регионы (страны), где отсутствует эндемическая заболеваемость. Эпидемиология классической лихорадки денге и ГЛД существенно различается. Классическую денге наблюдают среди местных жителей, преимущественно детей и приезжих любого возраста, а ГЛД заболевают главным образом дети. Пики заболеваемости приходятся на две возрастные группы: дети до 1 года, имеющие пассивный иммунитет против вируса другого типа, и дети 3-летнего возраста, переболевшие классической денге. В первой группе формируется иммунный ответ по типу первичного, во второй - по типу вторичного. Тяжелая форма ГЛД - шоковый синдром денге чаще всего развивается при заражении вторым типом вируса при инфицировании детей, перенесших в прошлом денге, вызванную вирусами I, III или IV типа. Так, во время эпидемии на Кубе в 1981 г. было установлено, что у более 98% больных тяжелое течение болезни и шоковый синдром денге были связаны с заражением вирусом II типа при наличии антител к вирусу I типа.
МЕРЫ ПРОФИЛАКТИКИ
Профилактические мероприятия включают уничтожение комаров и обезвреживание мест их выплода. Используют индивидуальные средства защиты от комаров, сетки на оконных и дверных проемах. В случаях экстренной профилактики применяют специфический иммуноглобулин или иммуноглобулин из плазмы доноров, проживающих в эндемичных районах. Средства профилактики, лицензированные и рекомендованные к применению в
эпидемических районах, до настоящего времени не разработаны. Сложность разработки вакцины связана в первую очередь с описанным феноменом ADE, однако в настоящее время ряд препаратов для вакцинации, включая тетравалентную вакцину денге, проходят различные этапы испытаний.
ПАТОГЕНЕЗ
Заражение происходит при укусе инфицированным комаром. Первичная репликация вируса происходит в регионарных ЛУ и клетках эндотелия сосудов. В конце инкубационного периода развивается вирусемия, сопровождающаяся лихорадкой и интоксикацией. В результате вирусемии поражаются различные органы и ткани. Именно с органными поражениями связывают повторную волну лихорадки. Выздоровление связано с накоплением в крови комплементсвязывающих и вируснейтрализующих антител, которые сохраняются в течение нескольких лет. Подобная схема патогенеза характерна для классической денге, которая развивается при отсутствии предшествующего активного или пассивного иммунитета.
При ГЛД, помимо клеток эндотелия, поражаются клетки макрофагально-моноцитарной системы [моноциты, гистиоциты, звездчатые ретикулоэндоте-лиоциты (купферовские клетки)]. Это связано с феноменом иммунологического
усиления, сущность которого состоит в том, что у лиц, имеющих антитела против вируса денге (чаще I, III или IV типов), в результате пассивного (дети до 1 года) или активного иммунитета (инфицированные другим типом вируса, чаще II) образуются циркулирующие иммунные комплексы «антиденге иммуноглобулин-вирус денге», которые связываются с Fcрецепторами моноцитов. Вследствие этого происходит резкая активация его репликации, уровень вирусемии, по экспериментальным данным, возрастает более чем в 50 раз. Развивается генерализованная воспалительная реакция, сопровождающаяся активацией комплемента, резким повышением проницаемости сосудов микроциркуляторного русла, приводящим к плазморее со снижением объема циркулирующей крови, поступлением в кровоток тканевых факторов гемостаза, активацией системы гемостаза развитием ДВСсиндрома с потреблением факторов гемостаза, приводящим к коагулопатии потребления, расстройствам микроциркуляции. Клинически эти процессы манифестируют геморрагическим синдромом и развитием шока.
КЛИНИЧЕСКАЯ КАРТИНА
Инфицирование вирусом денге может быть бессимптомным, а также протекать как недифференцируемая лихорадка, лихорадка денге или ГЛД (рис. 21.12).
Инкубационный период длится от 3 до 15 дней, чаще 5-8 дней. Различают классическую, атипичную ГЛД (без шокового синдрома денге и сопровождающегося им).
Классическая лихорадка денге начинается с кратковременного продромального периода. Во время него отмечают недомогание, конъюнктивит и ринит. Однако чаще продромальный период отсутствует, и болезнь начинается с озно-
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Рис. 21.12. Клинические проявления лихорадки денге
ба, быстрого повышения температуры до 38-41 °С, сохраняющегося в течение 3-4 дней (начальный период болезни). Больные жалуются на сильную головную боль, боли в глазных яблоках, особенно при движении, мышцах, крупных суставах, позвоночнике, нижних конечностях. Это приводит к затруднению при любом движении, обездвиживает больного (название болезни происходит от английского «dandy» - медицинские носилки). При тяжелом течении болезни наряду с сильной головной болью возможны рвота, бред, потеря сознания. Нарушается сон, ухудшается аппетит, во рту появляется горечь, резко выражена слабость и общее недомогание.
Уже с первого дня болезни изменяется внешний вид больного: лицо ярко гипе-ремировано, выражена инъекция сосудов склер, гиперемия конъюнктив. Часто на мягком небе появляется энантема. Язык обложен. Глаза прикрыты из-за светобоязни. Отмечается увеличение печени, периферических ЛУ. К концу 3-х суток или на 4-е сутки температура критически снижается до нормы. Период апирек-сии длится обычно 1-3 дня, затем температура повышается вновь до высоких цифр. У некоторых больных периода апирексии в разгар болезни не наблюдают. Характерный симптом - экзантема. Сыпь появляется обычно на 5-6-й день болезни, иногда раньше, сначала на грудной клетке, внутренней поверхности плеч, затем распространяется на туловище и конечности. Характерна пятнисто-папулезная сыпь, которая часто сопровождается зудом, оставляет после себя шелушение.
Общая продолжительность лихорадки - 5-9 дней. В гемограмме в начальном периоде - умеренный лейкоцитоз и нейтрофилез без сдвига формулы влево, позже - лейкопения, лимфоцитоз. Возможна протеинурия.
При атипичной лихорадке денге наблюдают лихорадку, анорексию, головную боль, миалгию, эфемерную сыпь, полиаденопатия отсутствует. Длительность болезни не превышает 3 сут.
Клиническая картина геморрагической лихорадки денге
Типичные случаи ГЛД характеризуются четырьмя главными клиническими признаками: высокой температурой, геморрагиями, гепатомегалией и недостаточностью кровообращения.

Болезнь начинается с внезапного сильного озноба, повышения температуры тела до 39-40 °С, головной боли, кашля, явлений фарингита. В отличие от классической денге миалгию и артралгию наблюдают редко. В тяжелых случаях быстро развивается прострация. Характерна выраженная гиперемия и одутловатость лица, блеск глаз, гиперемия видимых слизистых оболочек. Нередко отмечают скарлатиноподобную сыпь, в основном на разгибательных поверхностях локтевых и коленных суставов.
В последующие 3-5 дней болезни появляется кореподобная пятнисто-папулезная или скарлатиноподобная сыпь на туловище, а затем - на конечностях и лице. Отмечают боли в эпигастральной области или по всему животу, сопровождающиеся многократной рвотой. Печень болезненна, увеличена.
Через 2-7 дней температура тела часто снижается до нормального или гипотер-мического уровня, проявления болезни могут регрессировать, наступает выздоровление. При тяжелом течении состояние пациента ухудшается. Самый частый геморрагический признак - положительный тест со жгутом. У большинства больных возникают гематомы в местах инъекций. На коже появляются петехии, подкожные кровоизлияния, возможны кровотечения. Значительно снижается количество тромбоцитов, показатель гематокрита повышается на 20% и более. Характерно развитие гиповолемического шока.
ВОЗ предлагает следующую классификацию ГЛД (табл. 21.41).
В тяжелых случаях после нескольких дней высокой температуры состояние больного внезапно ухудшается. Во время падения температуры (между 3 и 7-м днем болезни) появляются признаки нарушения кровообращения: кожа становится холодной, покрывается цианотичными пятнами, часто встречается цианоз кожи вокруг рта и тахикардия. Больные беспокойны, жалуются на боль в животе. Некоторые больные заторможены, однако затем у них развивается возбуждение, после чего наступает декомпенсированная стадия шока. Состояние прогрессивно ухудшается. На лбу и в дистальных отделах конечностей появляется петехиаль-ная сыпь, АД резко снижается, уменьшается его амплитуда, пульс нитевидный, усиливаются тахикардия и одышка. Кожа холодная, влажная, нарастает цианоз. На 5-6-й день возникает кровавая рвота, мелена, судороги. Продолжительность шока невелика. Больной может умереть в течение 12-24 ч или быстро выздоравливает после соответствующих противошоковых мероприятий. Выздоровление при ГЛД с шоком или без шока наступает быстро и протекает без осложнений. Благоприятный прогностический признак - восстановление аппетита.
При исследовании крови выявляют тромбоцитопению, высокий показатель гематокрита, удлинение протромбинового (у одной трети пациентов) и тромбо-пластинового времени (у половины больных), гипофибриногенемию, появление в крови продуктов деградации фибрина (ПДФ-2), метаболический ацидоз. Почти всегда отмечают гемоконцентрацию (свидетельствует о потере плазмы), даже у больных без шока. Число лейкоцитов варьирует от лейкопении до небольшого лейкоцитоза. Часто выявляются атипичные лимфоциты.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
У некоторых больных лихорадкой денге и ГЛД наблюдают признаки поражения ЦНС, такие как судороги, гиперкинезы и длительное (более 8 ч) нарушение сознания.
К числу осложнений относят шок, пневмонию, энцефалит, менингит, психоз, полиневрит. ДИАГНОСТИКА
Диагноз геморрагической формы денге по критериям ВОЗ устанавливают при наличии следующих симптомов:
◊быстрое повышение температуры до 39-40 °С, сохраняющееся в течение 2-7 дней;
◊появление признаков тромбогеморрагического синдрома (петехии, пурпура, кровоизлияния, кровотечения);
◊увеличение печени;
◊тромбоцитопения (менее 100х109/л), повышение гематокрита на 20% и более;
◊развитие шока.
Первые два клинических критерия в сочетании с тромбоцитопенией и гемокон-центрацией или повышенным уровнем гематокрита достаточны для постановки диагноза ГЛД.
Необходимо также учитывать эпидемиологический анамнез (пребывание в эндемичной местности, укусы комарами).
Классическую форму денге диагностируют при наличии характерных симптомов: боль в суставах и мышцах, двухволновая лихорадка, сыпь, ЛАП, околоорбитальная и головная боль.
При классической лихорадке денге могут возникать слабовыраженные проявления геморрагического диатеза, не отвечающие критериям ВОЗ. В этих случаях диагностируют лихорадку денге с геморрагическим синдромом, но не ГЛД.
Лабораторная диагностика лихорадки денге может основываться на обнаружении в крови больного вируса, вирусной нуклеиновой кислоты, антигенов или антител к вирусу.
Окончательный диагноз лихорадки денге устанавливают на основании вирусологического и серологического исследований. Существуют два основных метода диагностики лихорадки денге: выделение вируса и обнаружение повышения титра антител к вирусу денге (в парных сыворотках крови в РСК, РТГА, РН-вирусов). Вирус в крови, плазме или клетках тканей может быть обнаружен в продромальный или лихорадочный период заболевания в течение первых 4-5 дней. Для выделения вирусов предпочтительно использование клеточных линий комаров - С6/36. Выделение вируса дает более точные результаты, но для подобного рода исследований требуется специально оборудованная лаборатория. В эти же сроки целесообразно использовать методы генодиагностики для выявления РНК вируса денге (ОТПЦР или ПЦР в реальном времени). Серологические тесты значительно проще, и на их постановку уходит меньше времени. Однако возможны перекрестные реакции с другими фла-вивирусами. Это может быть причиной ложноположительных результатов. Диагноз лихорадки денге считается подтвержденным в случае обнаружения вируса денге в культуре, или вирусной РНК в ОТ-ПЦР, или сероконверсии IgM в парных сыворотках крови, или 4- кратного прироста титра IgG в парных сыворотках.
Дифференциальная диагностика Классическую форму денге дифференцируют от гриппа, кори, флеботомной лихорадки.
Геморрагическую форму денге дифференцируют от менингококкемии, сепсиса, тропической малярии, лихорадки Чикунгунья и других ГЛ.
Показания к консультации других специалистов
При развитии шока - консультация реаниматолога, неврологических осложнениях (расстройства сознания, судороги) - невролога.
Пример формулировки диагноза
А91 Геморрагическая лихорадка денге II степени. ЛЕЧЕНИЕ
Этиотропных средств лечения лихорадки денге нет. Все больные в зависимости от тяжести симптоматики делятся на 3 категории (А, В, С). В неосложненных случаях (категория А) проводится симптоматическая терапия в домашних условиях, включающая жаропонижающие препараты, борьбу с дегидратацией и наблюдение врача. В случаях появления «симптомов тревоги», болезни беременных, детей (категория В) лечение проводят в условиях стационара. Лечение тяжелых случаев лихорадки денге, связанных с развитием шока, геморрагиями и наруше-
нием функции органов (категория С), проводится в ОРИТ. Высокая температура и рвота вызывают жажду и обезвоживание организма, поэтому больные должны пить как можно больше жидкости. При ГЛД без шока проводят регидратационную терапию, преимущественно пероральную. За больными необходимо тщательно наблюдать для выявления ранних признаков шока.
Больных немедленно следует госпитализировать при наличии любого из приведенных ниже признаков и симптомов шока:
◊возбуждение или заторможенность;
◊холодные конечности и цианоз вокруг рта;
◊учащенный слабый пульс;
◊снижение пульсового давления или гипотензия;
◊резкое увеличение гематокрита.
Повышение гематокрита, развитие ацидоза - показания к парентеральному введению щелочных и полиионных растворов. При шоке показано введение свежезамороженной плазмы или плазмозаменителей. В большинстве случаев необходимо вводить не более 20-30 мл плазмы на 1 кг массы тела. Введение жидкости следует продолжать с постоянной скоростью (10-20 мл/кг/ч) до явного улучшения дыхания, пульса и температуры. В качестве заменителя плазмы эффективен декстран (Декстран 40♠). Показана оксигенотерапия. Эффективность глюкокор-тикоидов, гепарина натрия (Гепарин♠) сомнительна. Заместительную терапию прекращают при снижении гематокрита до 40%. Переливание крови не показано. Антибиотики назначают в случае присоединения бактериальных осложнений. При благоприятных условиях наступает полное выздоровление.
Прогноз
При классической лихорадке денге прогноз обычно благоприятный, летальность при ГЛД - до 40%, при адекватной терапии - 5-10%. Наиболее высокая летальность у детей до 1 года.
Примерные сроки нетрудоспособности Определяют индивидуально в зависимости от клинической картины, наличия осложнений. Диспансеризация
Диспансерное наблюдение за переболевшими не регламентировано. 21.17.5. Болезнь, вызванная вирусом Эбола
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Болезнь, вызванная вирусом Эбола (БВВЭ, Ebola virus disease - EVD, ГЛ Эбола), - вирусная ГЛ человека и других приматов, вызванная представителями
рода ebolaviruses, характеризующаяся высокой контагиозностью, тяжелым течением, развивающимся геморрагическим синдромом с показателями летальности, достигающими 90%.
КОД ПО МКБ-10 А98.4. ЭТИОЛОГИЯ
Вирус Эбола принадлежит к
виду Ebolavirus рода Ebola семейства Filoviridae отряда Mononegavirales. Вирионы имеют вид длинных нитей, могут завиваться. Наружный диаметр вирионов 70-100 нм, средняя длина 665 нм, в электронно-микроскопических препаратах встречаются частицы длиной до 14 000 нм. Геном вируса Эбола представлен одной молекулой одноцепочечной РНК, содержащей 7 генов, с молекулярной массой 4,0-4,2 МДа, что соответствует длине примерно в 19 200 нуклеотидов и 1,1% массы вириона. В центре вириона располагается тяж диаметром 20 нм, который составляет основу цилиндрического спирального рибонуклеопротеида диаметром 30 нм. Между рибонуклеопротеидом и оболочкой вириона располагается промежуточный слой толщиной 3,3 нм. Вирион имеет наружную липопротеиновую мембрану толщиной 20-30 нм, на поверхности которой на расстоянии 10 нм друг от друга располагаются шипы длиной 7-10 нм. Вирус Эбола содержит гликопротеин, который может оказывать прямое разрушающее действие на клетки сосудов, что является одной из причин геморрагического синдрома.
Жизненный цикл вируса Эбола начинается с прикрепления вириона к специфическим рецепторам клетки посредством структур, относящихся к С-типу лекти-нов или интегринов, с последующим слиянием вирусной оболочки с клеточной мембраной. Затем происходит рассечение гликопротеина вирусной оболочки и высвобождение вирусного нуклеокапсида. Далее посредством вирусной РНК-полимеразы происходит транскрипция генов в матричную РНК с последующим ресинтезом 7 структурных белков. Вновь синтезируемые структурные белки и нуклеотиды самостоятельно собираются и накапливаются вблизи клеточной мембраны. Выход вирионов из клетки происходит способом «отпочковывания». Внедрение вируса в незараженную клетку ведет к повторению цикла.
Для человека патогенны 4 из 5 известных вирусов Эбола: Бундибуджио вирус (BDBV), Судан вирус (SUDV), Тай форест вирус (TAFV), Эбола вирус (EBOV, бывший Заир Эбола). Последний (Заир) считается самым опасным по причине максимальной летальности и наиболее частой встречаемости. Пятый вирус, вирус Рестон (RESTV), не вызывает заболевания у людей, однако может вызвать заболевания других приматов. Все пять вирусов тесно связаны с семейством marburgviruses, но существующие антигенные отличия между ними обусловливают отсутствие перекрестных антигенных реакций.
Вирус Эбола имеет среднюю степень устойчивости к повреждающим факторам окружающей среды. Вирус способен выживать на абиотических предметах в течение нескольких часов в высушенном состоянии, а в биологических жидкостях организма вне человека - в течение нескольких дней. Ebolaviruses гибнут при термической обработке в течение 30-60 мин при температуре 60 °С и в течение 5 мин - при кипячении. Для дезинфекции поверхностей используют жирора-створители, такие как некоторые спиртосодержащие продукты, моющие средства, гипохлорит натрия (отбеливатель) или гипохлорит кальция.
ЭПИДЕМИОЛОГИЯ
Впервые вирус Эбола был идентифицирован в экваториальной провинции Судана и прилегающих районах Заира в 1976 г. Вирус был выделен в районе реки Эбола в Заире. Это
дало название вирусу. Вспышки БВВЭ происходят периодически в тропических регионах Африки к югу от Сахары. По данным ВОЗ, между 1976 и 2013 гг. наблюдалось в общей сложности 24 вспышки БВВЭ, во время которых заболели 1716 человек. В марте 2014 г. в Западной Африке началась эпидемия БВВЭ, продолжавшаяся до 1916 г., распространившаяся на Либерию, Сьерра-Леоне, Гвинею. По состоянию на конец 2015 г. зарегистрировано 28 575 слу-
чаев заболевания. Летальный исход наступил у 11 313 заболевших (летальность 39,6%).
Естественным резервуаром вируса Эбола в природе считаются некоторые виды плотоядных рукокрылых, которых часто ошибочно именуют «летучими мышами». К наиболее вероятным кандидатам в природные резервуары БВВЭ относят три вида плотоядных
рукокрылых: Hypsignathus monstrosus, Epomops franqueti и Myonycteris torquata. Данные виды рукокрылых, вероятно, являются носителями вируса, не проявляя никаких клинических признаков заболевания. Из 24 растений и 19 видов позвоночных животных, экспериментально инокулированных EBOV, только указанные выше рукокрылые оказались инфицированными. В 20022003 гг. обследование в Габоне и Республике Конго 1030 диких животных, включая 679 «летучих мышей», показало обнаружение РНК EBOV только у последних.
Помимо рукокрылых, источником возбудителя инфекции могут быть другие дикие животные, инфицированные вирусом Эбола, - несколько видов обезьян (шимпанзе, гориллы, бабуины) и антилоп. Животные, в свою очередь, могут заразиться, когда едят фрукты, частично съеденные (надкусанные) рукокрылыми, переносящими вирус.
Вирус Эбола передается при непосредственном контакте с биологическими жидкостями зараженного человека или животного. Передача вируса возможна также при прямом контакте с предметами, загрязненными биологическими жидкостями больных. Вирус могут содержать слюна, слизь, рвотные массы, кал, пот, слезы, грудное молоко, моча и сперма. Однако наибольшее значение в передаче вируса имеют кровь, фекалии и рвотные массы. Входными воротами для вируса являются слизистые рта, носа, глаз, открытые раны, порезы и ссадины. Способствует передаче вируса контакт с поверхностями или объектами, зараженными вирусом, особенно инъекционным медицинским инструментарием (иглами и шприцами).
После выздоровления у людей, переболевших БВВЭ, вирус может сохраняться в течение более чем 3 мес в сперме, что может привести к инфицированию половым путем. В периоде реконвалесценции отмечается также возможность присутствия вируса в грудном молоке кормящих матерей и слезной жидкости, однако продолжительность выделения вируса не установлена.
Особую опасность представляют трупы умерших от БВВЭ. Таким образом, в группе риска находятся как люди, занимающиеся традиционными ритуальными обрядами, так и те, кто участвует в бальзамировании. 69% случаев заражения вирусом Эбола в Гвинее в 2014 г.
произошло в результате контакта с инфицированными трупами во время похоронных ритуалов.
Работники здравоохранения, осуществляющие уход за больными с БВВЭ, подвергаются наибольшему риску заражения. Риск возрастает при отсутствии соответствующей защитной одежды: масок, халатов, перчаток и средств защиты глаз; при неправильной обработке загрязненной одежды. Такая ситуация часто встречается в некоторых регионах Африки со слабо развитой системой здравоохранения. Там была отмечена передача вируса при повторном использовании медицинского инъекционного инструментария.
При вспышках БВВЭ передача вируса от человека к человеку аспирационным (воздушнокапельным) путем не актуальна; воздушно-капельный путь передачи возбудителя был
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
продемонстрирован только в лабораторных условиях. Отсутствие воздушно-капельного пути передачи среди людей связывают с низким уровнем вируса в респираторном тракте, недостаточном, чтобы привести к заражению.
Сведений о трансмиссивной передаче возбудителя при участии комаров или других насекомых не получено. Другие возможные пути передачи изучаются.
Восприимчивость людей к вирусу Эбола высокая. После выздоровления формируется стойкий иммунитет. Частота повторных случаев заболевания не превышает 5%.
МЕРЫ ПРОФИЛАКТИКИ
Люди, осуществляющие уход за больными БВВЭ, должны носить защитную одежду, включая маски, перчатки, халаты и очки. Эти же меры безопасности распространяются на лиц, участвующих в погребальных обрядах, бальзамировании тел умерших от БВВЭ и имеющих отношение к секционному материалу. Все оборудование, медицинские отходы, выделения пациента должны быть продезинфицированы. Отказ от прямого контакта с инфицированными людьми и регулярное мытье рук с помощью мыла и воды значительно снижают риск инфицирования. Приготовление пищи из мяса диких животных должно происходить с соблюдением тех же мер безопасности, что и при работе с больными БВВЭ. Мясопродукты должны быть подвергнуты достаточной для уничтожения вируса термической обработке.
В медицинских лабораториях, где проводятся диагностические тестирования, требуется соблюдение 4-го уровня биологической безопасности. Сотрудники лаборатории должны быть обучены и носить соответствующие средства индивидуальной защиты. Эффективным методом профилактики распространения БВВЭ является принудительная изоляция - карантин. Лица, имевшие контакт с больными БВВЭ, подлежат обсервации в течение 21 дня. Для специфической профилактики БВВЭ российскими учеными в конце 2015 г. предложена генно-инженерная гетерологичная вакцина на основе двух векторов аденовируса шимпанзе и вируса везикулярного стоматита - «Гам-Эвак Комби». Клинические испытания указанной вакцины планируются в 2016-2017 гг. на территории Республики Гвинея.
ПАТОГЕНЕЗ
Как указано выше, входными воротами для вируса Эбола являются слизистые оболочки и поврежденные участки кожи. Клетками-мишенями являются клетки эндотелия сосудов, несколько типов иммунных клеток (макрофаги, моноциты, дендритные клетки), гепатоциты. Дальнейшая репродукция вируса происходит в ЛУ. Оттуда вирус быстро проникает в кровоток, лимфатическую систему и разносится по всему организму. Подобно другим филовирусам, вирус Эбола очень эффективно реплицируются во многих клетках: моноцитах, макрофагах, дендритных клетках, гепатоцитах, фибробластах и клетках надпочечников. Вирусная репликация запускает высвобождение высокого количества провоспалительных цитокинов (ФНО, ИЛ-6, ИЛ-8 и др.) и приводит к развитию системной воспалительной реакции.
Макрофаги являются первыми клетками, зараженными вирусом, и это заражение приводит к их апоптозу. Лимфоциты также подвергаются запрограммированной клеточной гибели, что приводит к аномально низкой их концентрации в крови. В этой связи у больных БВВЭ наступает вторичный иммунодефицит. Уклонение вируса от иммунной защиты организма происходит путем ингибирова-ния ранних этапов активации нейтрофилов. Это связано с синтезом вирусом малого растворимого гликопротеина, образующего димерные комплексы, нарушающие распознавание иммунокомпетентными клетками вируса Эбола.
Эндотелиальные клетки могут быть инфицированы в течение 3 дней после воздействия вируса. Повреждение клеток эндотелия возникает благодаря синтезу вирусом Эбола
специфического гликопротеина. Массивные кровотечения, возникающие при тяжелом течении болезни, являются результатом коагулопатии, связанной с присоединением синдрома ДВС.
Полиорганные поражения возникают вследствие вторичного иммунодефицита, обусловленного генерализованным разрушением клеток системы мононуклеарных фагоцитов (СМФ) и повреждением эндотелия капилляров микроциркуляторного
русла. Последнее приводит к нарушению метаболических процессов, гипоксии и ацидозу органов и тканей. Посмертно обнаруживаются некротические изменения во всех органах и тканях, особенно выраженные в ЛУ, печени, селезенке.
Выздоровление сопровождается выработкой специфических антител к возбудителю, которые циркулируют минимум 10 лет, однако выполняют ли они про-тективную роль - неизвестно.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период при БВВЭ составляет от 2 до 21 дней, в среднем от 4 до 10 дней. Однако недавние расчеты на основе математической модели указывают, что в 5% случаев он может быть продолжительнее 21 дня.
Болезнь начинается остро. Появляется резкая слабость, лихорадка, снижение аппетита, миалгии, артралгии, головная боль и боль в горле. Лихорадка, как правило, выше, чем 38,3 °С, часто сопровождается рвотой, диареей и болью в животе. Характерны одышка, боль в груди, развитие энцефалопатии. На 5-7-й дни болезни у половины больных появляется макуло-папулезная сыпь. В эти же сроки возможно появление геморрагического синдрома, который характеризуется появлением подкожных геморрагий, петехий, гематом (особенно в местах инъекций), кровоизлияниями в склеры, кровохарканьем, рвотой «кофейной гущей», желудочно-кишечными кровотечениями в виде мелены (при кровоточивости слизистых проксимальных отделов ЖКТ) и/или свежей крови в стуле (при толстокишечных кровотечениях). Причиной появления геморрагического синдрома является остро развивающаяся коагулопатия. Массивные желудочно-кишечные кровотечения служат неблагоприятным прогностическим признаком. В этом случае больные в последние дни жизни часто находятся в коме.
Летальность колеблется между 25% и 90%, в среднем около 50%. Однако эти цифры никак не отражают истинного положения вещей. Известно, что летальность определяется количеством умерших от данного конкретного заболевания по отношению ко всем заболевшим, включая, естественно, не только тяжелые, но и легкие, и среднетяжелые формы. В случае с БВВЭ мы имеем некий «срез» исключительно тяжелых форм, так как в местах распространения данной болезни учет ведется только госпитализированных больных, тогда как госпитализируются исключительно больные, находящиеся в тяжелом состоянии. Таким образом, высокий уровень госпитальной летальности обусловлен тем, что большая часть африканских больниц на территории распространения БВВЭ выполняет не столько лечебную, сколько «изолирующую», карантинную функцию ввиду острейшей нехватки даже элементарных медикаментов. Есть основания полагать, что адекватная патогенетическая терапия, даже при отсутствии специфических противовирусных препаратов, позволит снизить летальность до 5-10%.
Причиной летального исхода в большинстве случаев является ИТШ и/или гиповолемический дегидратационный шок, который наступает, как правило, через 6-16 дней от начала заболевания. В случаях выздоровления, которое начинается в среднем между 7-14-м днями болезни, длительно сохраняются миалгии и артрал-гии, слабость, гепатомегалия, снижение зрения и слуха.
ДИАГНОСТИКА
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Патогномоничные симптомы при БВВЭ отсутствуют. При диагностике учитывают эпидемиологические сведения: пребывание в местностях с природными очагами БВВЭ, контакт и уход за больными БВВЭ, контакт (отлов, обработка, приготовление и употребление в пищу) животных из природных очагов. При сочетании вышеуказанных эпидемиологических данных с лихорадкой, головной болью, рвотой, слабостью, диареей, миалгиями и присоединением геморрагического синдрома, осложнений и признаков полиорганного поражения следует исключать БВВЭ.
Лабораторная диагностика
Неспецифическими лабораторными изменениями при БВВЭ являются тром-боцитопения, первоначальная лейкопения с последующим лейкоцитозом, повышение активности трансфераз (АЛТ, АСТ), нарушений в системе гемокоагуляции, соответствующие ДВСсиндрому.
Специфическая диагностика БВВЭ заключается в изоляции вируса, обнаружении его РНК или белков или антител против вируса в крови человека. Изоляция вируса на культуре клеток, обнаружение вирусной РНК методом ПЦР и вирусных антигенов с помощью ИФА используются уже на ранних стадиях заболевания, а также для обнаружения вируса в трупном материале. Обнаружение антител против вируса является наиболее надежным в поздних стадиях заболевания и у пациентов, которые выздоравливают. Антитела класса IgM могут быть обнаружены через 2 дня после появления симптомов, а IgG-антитела могут быть обнаружены от 6 до 18 дней после появления первых симптомов. Во время вспышек заболевания выделение вируса на клеточных культурах затруднено в связи с объективными трудностями. Более доступными методами диагностики являются ПЦР и ИФА. В 2014 г. был предложен для использования экспресс-тест, который дает результат в течение 15 мин с достоверностью 92%.
Дифференциальная диагностика
Ранние симптомы БВВЭ могут быть схожи с другими заболеваниями, распространенными в Африке, в том числе с малярией и лихорадкой денге. Сходную клиническую симптоматику имеет ГЛ Марбурга. Полная дифференциальная диагностика обширна и требует учета множества других инфекционных заболеваний, таких как брюшной тиф, дизентерия, риккетсиозы, холера, сепсис, боррелиоз, леп-тоспироз, сыпной тиф, чума, трипаносомоз. Неинфекционные заболевания, требующие проведения дифференциальной диагностики с БВВЭ, включают острый лейкоз, гемолитико-уремический синдром, тромботическую тромбоцитопеническую пурпуру, наследственную геморрагическую телеангиэктазию, болезнь Кавасаки.
ЛЕЧЕНИЕ Лечение проводят в условиях инфекционного стационара и режима строгой изоляции.
Специфического этиотропного лечения БВВЭ в настоящее время не существует. Из 9 противовирусных препаратов, испытываемых в том числе в конце 2014 г. и начале 2015 г., ни один не доказал своей клинической эффективности и безопасности.
Патогенетическая терапия направлена на борьбу с интоксикацией, дегидратацией, коррекцией нарушений в свертывающей и противосвертывающей системах крови, поддержкой функций жизненно важных органов и систем. Дезинтоксикационная терапия строится по общим принципам. Наряду с гемо-дилюцией и форсированием диуреза требуется коррекция кислотно-основного состояния крови и контроль объема циркулирующей крови. Регидратационная терапия предполагает инфузионное введение полиионных растворов. В целях коррекции нарушений свертывающей и противосвертывающей систем крови и профилактики ДВС-синдрома используются тромбоцитарная масса, свежезамороженная плазма, дезагреганты прямого действия
(низкомолекулярные препараты гепарина, варфарин). При развитии ОПН показана ультрафильтрация плазмы.
В качестве средств симптоматической терапии применяют болеутоляющие, противорвотные средства, транквилизаторы. Рекомендуется избегать применения аспирина или НПВС для снятия боли в связи с риском кровотечений, связанных с использованием этих препаратов.
Случаи выздоровления у части больных осложняются возникновением орхита, выпадением волос, шелушением кожи, снижением остроты зрения, слезотечением, фотофобией, артралгией, миалгией. В связи с этим продолжительность нетрудоспособности может достигать 3 мес.
21.17.6. Геморрагическая лихорадка Ласса
ГЛ Ласса - острая зоонозная природно-очаговая вирусная инфекционная болезнь с различными механизмами передачи возбудителя, характеризующаяся развитием геморрагического синдрома, язвенно-некротического фарингита, пневмонии, миокардита, поражением почек и высоким уровнем летальности.
КОД ПО МКБ-10
A96.2 Лихорадка Ласса. ЭТИОЛОГИЯ
Возбудитель - Lassa virus рода Arenavirus семейства Arenaviridae; относят к комплексу аренавирусов Старого Света LChM/Lassa. Имеет антигенное родство с другими аренавирусами (возбудителями лимфоцитарного хориоменингита и ГЛ Южной Америки). Вирус имеет капсид сферической формы, с диаметром частиц 50-300 нм, покрытый липидной оболочкой, включающей гликопротеины (G1 и G2). Нуклеокапсид состоит из белка
(N) и РНК, два фрагмента которой (L и S) кодируют синтез компонентов вириона в инфицированной клетке. Патогенен для некоторых видов обезьян, белых мышей, морских свинок. В культуре клеток Vero репликация вируса сопровождается цитопатическим эффектом. Вирус устойчив к воздействию факторов окружающей среды. Инфекционность вируса в сыворотке
крови и слизистых секретах без специальной обработки не снижается в течение длительного времени, инактивируется жировыми растворителями (эфир, хлороформ и др.).
ЭПИДЕМИОЛОГИЯ
Лихорадка Ласса распространена в странах Западной (Сьерра-Леоне, Либерия, Гвинея, Нигерия, Сенегал, Мали) и Центральной (Центрально-Африканская Республика, Демократическая Республика Конго, Буркина-Фасо) Африки. География распространения болезни продолжает расширяться за счет вовлечения в эпидемический процесс новых территорий. В 2011 г. впервые лихорадка Ласса официально зарегистрирована в Гане, в 2014 г. - в Бенине. В странах Западной Африки, по оценочным данным ВОЗ, ежегодно отмечено от 200 тыс. до 500 тыс. случаев лихорадки Ласса, из которых около 5 тыс. заканчивается летальным исходом. Возможен завоз лихорадки Ласса в неэндемичные страны и возникновение там очага заболевания при контактной передаче возбудителя. С 1969 г. по настоящее время известно о 34 случаях заноса инфекции в страны Европы (Великобритания, Германия, Швеция, Нидерланды), Северной Америки (США, Канада), Израиль, Японию, ЮАР и Гану.
Наиболее часто лихорадка Ласса заносилась в Великобританию и США из Сьерра-Леоне и Нигерии. Заносы инфекции в 1980, 2000, 2009 гг. произошли из стран, где случаи лихорадки Ласса не регистрировались. В 2015 г. лихорадка Ласса была занесена в США из Либерии.
Источник и резервуар возбудителя - многососковая крыса (Mastomys natalensis), обитающая в большинстве стран Африки вблизи жилья человека. Вирус также выделен и от других
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
африканских грызунов (M. erythroleucus, M. huberti). Животные выделяют вирус в окружающую среду с экскретами и слюной.
Механизмы передачи возбудителя: аэрозольный, фекально-оральный. Пути передачи: воздушно-капельный, пищевой, водный, контактный. Факторы передачи: пищевые продукты, вода, а также предметы, загрязненные мочой грызунов. Заражение людей в природных очагах может происходить при вдыхании аэрозоля, содержащего экскреты грызунов; употреблении воды из инфицированных источников; недостаточно термически обработанного мяса зараженных животных.
Больной человек представляет большую опасность для окружающих. Основной фактор передачи - кровь, однако вирус содержится и в экскретах больного. Заражение при этом происходит воздушно-капельным, контактным и половым путями. Выделение вируса больными может продолжаться до месяца и более. Заражение происходит через микротравмы при попадании на кожу крови или выделений больного. Зарегистрированы случаи заболеваний медицинского персонала при использовании инструментов, контаминированных возбудителем, проведении хирургических операций и вскрытии трупов.
Передача возбудителя от человека человеку аэрогенным путем ведет к появлению вторичных внутрисемейных вспышек, а также к возникновению нозокоми-альных вспышек, сопровождающихся высокой летальностью. Восприимчивость высокая. К возбудителю чувствительны все группы населения независимо от возраста и пола. Постинфекционный иммунитет напряженный и длительный, повторные случаи заболевания не описаны. В эндемичных районах антитела выявляют у 10-15% населения, что свидетельствует о возможности бессимптомного или легкого течения заболевания.
МЕРЫ ПРОФИЛАКТИКИ Специфическая профилактика не разработана.
Неспецифическая профилактика состоит в защите помещений от проникновения грызунов и дератизационных мероприятиях в природных очагах. Медицинский
персонал должен быть обучен уходу за контагиозными больными и обязан работать в защитной одежде, респираторах или марлевых масках, перчатках, очках. Рекомендована строгая изоляция больных (желательно в специальные пластиковые или стекляннометаллические кабины с автономным жизнеобеспечением) на срок не менее 30 сут от начала заболевания. Наблюдение за лицами, контактировавшими с больными, продолжают в течение 17 сут. Проводят заключительную дезинфекцию. Для экстренной профилактики лихорадки Ласса применяют риба-вирин (внутрь по 0,2 г 4 р/сут в течение 10 сут). Проводят карантинные мероприятия в отношении лихорадящих больных, прибывших из стран Центральной и Западной Африки.
ПАТОГЕНЕЗ
Входные ворота возбудителя - слизистые оболочки органов дыхания и пищеварения, поврежденная кожа. После первичной репликации вируса в лимфоидных элементах в месте внедрения, развивается вирусемия с гематогенной диссеминаци-ей возбудителя, поражением многих органов и систем. Вирус обладает тропностью к различным органам и тканям человека и вызывает некротические изменения в клетках печени, селезенки, миокарда, почек, надпочечников, эндотелия мелких сосудов, что и определяет клинические проявлении болезни. В тяжелых случаях вследствие цитопатического эффекта вируса и клеточных иммунных реакций повреждение эндотелиальных клеток в сочетании с нарушением функций тромбоцитов приводит к повышенной «ломкости» и проницаемости сосудистой стенки. Возникают глубокие расстройства гемостаза с развитием ДВС-синдрома, коагуло-патии потребления и тромбогеморрагического синдрома.
Наиболее характерным гистологическим изменением при лихорадке Ласса является мультиочаговый некроз гепатоцитов. При электронной микроскопии в печени и других органах обнаруживают вирусные частицы. В сердце находят небольшой интерстициальный отек миокарда без признаков миокардита. В легких невыраженный отек без значительных геморрагий, в некоторых случаях слабо выраженный интерстициальный пневмонит с инфильтрацией мононуклеарными клетками и мегакариоцитозами. В почках характерен тубулярный и гломеруляр-ный некроз. Селезенка уплотнена, обнаруживают атрофию белой пульпы, инфильтрацию интимы селезеночных вен лимфоидными клетками. В ЛУ лимфоидное истощение и дегенерация, эритрофагоцитоз. В слизистой оболочке ЖКТ - признаки воспаления и петехии.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период длится 3-21 сут, чаще 7-14 сут. Общепринятой классификации не существует. Выделяют: легкое, среднетяжелое и тяжелое течение заболевания.
Основные симптомы и динамика их развития
Начало заболевания подострое или постепенное. Появляются общее недомогание, умеренные мышечные и головные боли, невысокая лихорадка, конъюнктивит. В этом периоде у большинства больных появляется характерный язвенно-некротический фарингит, а также увеличение шейных ЛУ. К концу первой недели заболевания температура тела достигает 3940 °С; нарастают симптомы интоксикации; присоединяются тошнота, рвота, боли в грудной клетке и животе; развивается диарея, приводящая к дегидратации. Со второй недели возможно появление пятнисто-папулезной сыпи; у большинства больных геморрагические явления (подкожные кровоизлияния, носовые, легочные, маточные и другие кровотечения). Характерны брадикардия, артериальная гипотензия;
возможно снижение слуха, появление судорог и очаговых неврологических симптомов. При неблагоприятном течении болезни выявляют отечность лица и шеи, выявляют свободную жидкость в плевральной и брюшной полостях, нарастает геморрагический синдром. В тяжелых случаях смерть наступает на 7-14-е сутки. У выживших больных через 2-4 нед температура тела литически снижается. Выздоровление медленное. В течение нескольких недель сохраняется общая слабость, в ряде случаев происходит выпадение волос и развивается глухота; возможны рецидивы заболевания.
В гемограмме отмечают лейкопению, в дальнейшем лейкоцитоз и резкое увеличение СОЭ (40-80 мм/ч). Удлиняется протромбиновое время, развивается гипокоагуляция. В тяжелых случаях - сгущение крови, декомпенсированный метаболический ацидоз, повышение уровня мочевины и креатинина. В моче - протеинурия, лейкоцитурия, гематурия, зернистые цилиндры.
Осложнения Пневмония, миокардит, ОПН, шок, острый психоз.
Летальность и причины смерти
Летальность составляет 30-50% и выше (особенно высока у беременных в III триместре). Причины смерти: ИТШ и гиповолемический шок, ОПН, геморрагический синдром.
ДИАГНОСТИКА
Клиническая диагностика лихорадки Ласса затруднена из-за отсутствия специфических симптомов заболевания. Из клинических проявлений наибольшее диагностическое значение имеют: подострое начало, сочетание лихорадки, язвенного фарингита, гастроэнтерита, геморрагического синдрома и почечной недостаточности, отек лица и шеи (в тяжелых случаях). Большое значение имеют эпидемиологические данные (пребывание в
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

эндемическом очаге, контакт с грызунами, лихорадящими больными). При исследовании крови выявляют лейкопению со сменой на лейкоцитоз, сдвиг нейтрофильной формулы влево, тромбоцитопению, повышенную СОЭ; гипопротеинемию; повышение активности аминотрансфераз, азотемию, гипокоагуляцию, декомпенсированный метаболический ацидоз. При исследовании мочи выявляют протеинурию, гематурию, цилиндрурию.
Специфическая диагностика
Вирусологические и серологические исследования проводят в специальных лабораториях с IV уровнем биологической безопасности. Абсолютный диагностический признак заболевания - выделение вируса из крови, смыва с зева, слюны, мочи и экссудатов (плеврального, перикардиального, перитонеального) больного; а также от умерших - из проб внутренних органов. В клинической практике используют определение фрагментов генома вируса методом ОТ-ПЦР, RT PCR. Эффективны методы диагностики путем определения антигенов вируса и антител: ИФА (ELISA) и РНИФ. Диагноз подтверждают серологически (при возрастании титров антител к вирусу Ласса в 4 раза и больше). По рекомендации ВОЗ при наличии у лихорадящих больных в эндемичных регионах антител класса IgG в титрах 1:512 и выше с одновременным выявлением антител класса IgM ставят предварительный диагноз «лихорадка Ласса». Постановка РСК имеет ретроспективное значение. Дифференциальная диагностика
Дифференциальную диагностику проводят с заболеваниями, протекающими с длительной лихорадкой (брюшной и сыпной тиф, сепсис, малярия), диареей (вирусные диареи), геморрагическим синдромом (другие ГЛ), лептоспирозом, гер-пангиной, стрептококковым фарингитом, дифтерией, пневмонией (табл. 21.42).
Показания к консультации других специалистов и дополнительным методам диагностики Проводятся по индивидуальным показаниям. ЛЕЧЕНИЕ Показания к госпитализации
Все больные подлежат госпитализации и строгой изоляции в инфекционных специализированных отделениях не менее чем на 30 дней от начала болезни.
Режим. Диета
Больной нуждается в строгом постельном режиме и круглосуточном медицинском наблюдении.
Предпочтительна диета из полужидкой легкоусвояемой пищи без ограничения количества белков и поваренной соли (стол № 4).
Медикаментозное лечение
Противовирусное лечение проводят внутривенным введением рибавирина в течение 10 сут (начальная доза препарата - 2 г, затем по 1 г каждые 6 ч в течение 4 сут и по 0,5 г каждые 8 ч в последующие 6 сут). В ранние сроки заболевания в ряде эндемичных регионов применяют плазму реконвалесцентов.
Патогенетическое лечение направлено на борьбу с шоком, геморрагическим синдромом, сердечной и ДН, а также на проведение дезинтоксикационных мероприятий и инфузионной регидратации солевыми растворами. Антибиотики применяют при бактериальных осложнениях.
Прогноз
Прогноз серьезный. При тяжелом течении заболевания летальность до 50% и выше. Снижается при проведении своевременного комплексного лечения. При легком и среднетяжелом течении прогноз благоприятный. Период реконвалесцен-ции затяжной.
Примерные сроки нетрудоспособности В случае благоприятного исхода выздоровление длительное. С учетом тяжести заболевания
реконвалесцентов считают нетрудоспособными в течение 4-6 нед после выписки из стационара.
Диспансерное наблюдение Диспансерное наблюдение за переболевшими не регламентировано. Санаторно-курортное лечение
Санаторно-курортное лечение по индивидуальным показаниям (не ранее 3-6 мес после болезни).
21.17.7. Геморрагическая лихорадка Марбург
ГЛ Марбург - острая зоонозная эндемическая вирусная инфекционная болезнь, проявляющаяся интоксикацией, универсальным васкулитом, поражением ЖКТ, печени, почек. Относится к особо опасным инфекционным болезням.
КОД ПО МКБ-10
A98.3 Болезнь, вызванная вирусом Марбург. ЭТИОЛОГИЯ
Возбудитель - Marburgvirus рода Marburgvirus семейства Filoviridae. Вирусные частицы полиморфные (нитевидной, спиралевидной или округлой формы) длиной в среднем 790 нм и диаметром 80 нм. Содержат негативную однонитевую РНК, липопротеин. В состав вириона входит 7 белков. Белковый состав вируса Марбург близок к родственному ему филовирусу Эбола, но имеет некоторые отличия. Считают, что штаммоспецифические антигены сосредоточены в области поверхностного белка гликопротеида (GР), а группоспецифический антиген - в области белка нуклеопротеида (NP). Гемагглютининов и гемолизинов не выявлено. Вирус выделяют и пассируют in vitro в перевиваемых культурах клеток почки зеленой мартышки (Veго) и in vivo на морских свинках. Репликация происходит в цитоплазме пораженных клеток. Вирус обладает средней устойчивостью к факторам внешней среды, при
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
комнатной температуре сохраняет вирулентность длительное время. Инактивировать можно при нагревании до 60 °С в течение 30 мин и с помощью органических растворителей [этанола (Этиловый спирт♠), хлороформа].
ЭПИДЕМИОЛОГИЯ
Ареал распространения вируса - центральная и западная территории Экваториальной Африки, а также юг континента (Центрально-Африканская республика, Габон, Судан, Заир, Либерия, Кения, Родезия, Гвинея, Южно-Африканская Республика).
По официальным данным ВОЗ, за период с 1967 по 2014 гг. выявлено 588 случаев заболевания, из которых 478 закончились летальным исходом. В 2014 г. зарегистрирован спорадический случай заболевания со смертельным исходом у медработника в Демократической Республике Конго. За период с 2005 г. по первую половину 2015 г. отмечено два эпизода заноса болезни в США и Нидерланды туристами, посетившими пещеры в Уганде.
Резервуар вируса Марбург не установлен. Летучие мыши рода Rousettus (нильский крылан или египетская летучая собака) рассматриваются предположительно как природный резервуар вируса. Источником возбудителя для человека являются обезьяны, в частности, африканские зеленые мартышки Cercopithecus aethioρs. Механизмы передачи возбудителя: аэрозольный, артифициальный. Пути передачи: воздушно-капельный, контактный, инъекционный. Вирус содержится в крови, носоглоточной слизи, моче и сперме (до 3 мес). Заражение людей происходит при прямом контакте с кровью и органами обезьян, также через поврежденную кожу (при уколах, порезах), при попадании вируса на конъюнктивы. Больной человек контагиозен для окружающих. Описан случай передачи возбудителя половым путем.
Восприимчивость людей к вирусу Марбург высокая. Постинфекционный иммунитет длительный. Сведения о повторных заболеваниях отсутствуют. Сезонность и периодичность вспышек не выявлены.
МЕРЫ ПРОФИЛАКТИКИ Специфические Не разработаны. Неспецифические
Профилактика состоит в выявлении больных и изоляции их в боксах, перевозке больных в транспортных изоляторах, использовании индивидуальных средств личной защиты от заражения при работе с больными, выполнении рекомендаций ВОЗ по завозу обезьян и работе с ними. Для экстренной профилактики развития лихорадки Марбург применяют специфический иммуноглобулин.
ПАТОГЕНЕЗ
Входные ворота вируса - поврежденная кожа, слизистые оболочки ротовой полости и глаз. Первичная репликация вируса происходит в клетках моноцитарно-макрофагальной системы. Затем развивается вирусемия, сопровождаемая подавлением функций иммунной системы и генерализованными нарушениями микроциркуляции, что приводит к возникновению ДВСсиндрома и полиорганным поражениям. В головном мозге, легких, миокарде, почках, печени, селезенке, надпочечниках, половых и других органах обнаруживают очаги некрозов и кровоизлияний. Самые обширные некрозы отмечаются в печени и лимфатической системе. В печени выявлены эозинофильные цитоплазматические включения, похожие на тельца Каунсильмена при желтой лихорадке. В лимфоидной ткани обнаруживают очаги некроза. В легких наблюдают интерстициальный пневмонит, в мелких артериолах - эндартериит. Нейропатологические изменения включают множественные мелкие геморрагические инфаркты с пролиферацией нейроглии.
КЛИНИЧЕСКАЯ КАРТИНА Инкубационный период 3-16 сут.
Основные симптомы и динамика их развития
Начало заболевания острое. Характерны: высокая лихорадка в течение 2 нед, выраженная интоксикация, головная боль, миалгии, боли в пояснично-крестцовой области. При осмотре выявляют конъюнктивит, энантему, везикулезно-эрозивные изменения слизистой оболочки ротовой полости, бради-кардию. Тонус мышц повышен, пальпация их болезненна. С 3-4-х суток течения заболевания возникают рвота и водянистая диарея, приводящие к быстрому обезвоживанию организма. На 5-6-е сутки возможно появление макуло-папулезной сыпи с последующим шелушением кожи. С 6-7-х суток выявляют геморрагические проявления в виде кожных геморрагий, носовых, желудочно-кишечных и других кровотечений, а также гепатит, миокардит, поражение почек. Для поражения ЦНС характерны адинамия, заторможенность и менингизм. В конце первой недели возможно развитие ИТШ. Ухудшение состояния больных наступает на 8-10-е сутки и на 15-17-е сутки течения заболевания (иногда заканчивающееся летально).
В периоде реконвалесценции, продолжающемся 3-4 нед, возможна длительная диарея, выраженная астенизация, психические расстройства, выпадение волос.
При исследовании крови отмечают лейкопению с относительным нейтрофи-лезом, анемию с анизо- и пойкилоцитозом, тромбоцитопению, признаки ДВС-синдрома, гиперкреатининемию, гиперазотемию, декомпенсированный ацидоз, в моче - протеинурию.
Осложнения
Гепатит, миокардит, орхит с атрофией яичка, шок, поперечный миелит, увеит; реже - пневмония и психозы.
Летальность и причины смерти
Летальность около 25%, но может достигать 50%. Причины смерти: отек легких и мозга, гиповолемический шок, ИТШ, ОПН, ДВС-синдром.
ДИАГНОСТИКА
Клиническая диагностика лихорадки Марбург затруднена из-за отсутствия патогномоничных симптомов. Диагностическое значение имеет следующее сочетание: острое начало заболевания, тяжелое течение, наличие везикулезно-эрозивных изменений слизистой оболочки полости рта, геморрагический синдром, экзан-
тема, рвота, диарея, обезвоживание, поражение ЦНС (расстройства сознания, менингеальный синдром). Основное значение имеют эпидемиологические данные (пребывание в местностях с природными очагами лихорадки Марбург, работа с тканями африканских мартышек, контакт с больными) и результаты серологических, вирусологических, электронномикроскопических исследований.
Неспецифическая лабораторная диагностика включает общий (выявляют анемию, анизоцитоз, пойкилоцитоз, базофильную зернистость эритроцитов, лейкопению, сдвиг нейтрофильной формулы влево, атипичные лимфоциты, тромбоци-топению); биохимический анализ крови (гипопротеинемия, повышена активность аминотрансфераз, амилазы, азотемия), коагулограмму (выражена гипокоагуля-ция) и определение кислотно-основного состояния крови (обнаруживают деком-пенсированный метаболический ацидоз); общий анализ мочи (характерна про-теинурия).
Специфическая лабораторная диагностика
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Специфическую лабораторную диагностику осуществляют с использованием тех же вирусологических и серологических методов [выделение культуры вируса, ПЦР, РНИФ, ИФА (ELISA), РН, РСК и др.], что и при лихорадке Эбола. У умерших вирус обнаруживают при электронной микроскопии или с помощью РНИФ. Все исследования проводят в лаборатории с максимальным уровнем защиты.
Дифференциальная диагностика
Лихорадку Марбург дифференцируют от тех же заболеваний, что лихорадку Эбола (других ГЛ, лептоспироза, тифо-паратифозных заболеваний, малярии, сепсиса, кори, менингококковой инфекции) (табл. 21.43).
Показания к консультации других специалистов и дополнительным методам диагностики По индивидуальным показаниям.
ЛЕЧЕНИЕ Показания к госпитализации
Больные с подозрением на лихорадку Марбург подлежат обязательной экстренной госпитализации и строгой изоляции.
Режим. Диета
Строгий постельный режим и круглосуточное медицинское наблюдение. Столу № 4 без ограничения количества белков и поваренной соли.
Медикаментозное лечение Этиотропное лечение не разработано.
Патогенетическое лечение имеет основное значение. Направлено на борьбу с обезвоживанием, ИТШ, геморрагическим синдромом. Есть данные об эффективности сыворотки реконвалесцентов, плазмафереза и больших доз ИФН.
Прогноз
Летальность - 25%, смерть наступает обычно на 8-17-е сутки заболевания. Период реконвалесценции затяжной, 3-4 нед.
Примерные сроки нетрудоспособности Несколько месяцев после выписки из стационара. Диспансеризация Не регламентировано.
Санаторно-курортное лечение - по индивидуальным показаниям (не ранее 3-6 мес после острого периода болезни).
21.18. ЛИХОРАДКА ЗАПАДНОГО НИЛА
ЛЗН (энцефалит Западного Нила) - острая вирусная зоонозная природно-очаговая болезнь с трансмиссивным механизмом передачи возбудителя. Характеризуется острым началом, выраженным ЛИС и поражением ЦНС.
КОД ПО МКБ-10 А92.3. ЭТИОЛОГИЯ
Вирус ЛЗН принадлежит роду Flavivirus семейства Flaviviridae и относится к арбовирусам. Геном представлен однонитевой РНК.
Репликация вируса происходит в цитоплазме пораженных клеток. Вирус ЛЗН обладает значительной способностью к изменчивости. Наибольшая изменчивость характерна для генов, кодирующих белки оболочки, ответственные за антигенные свойства вируса и его взаимодействие с мембранами тканевых клеток, с которыми связана вирулентность штамма. Штаммы вируса ЛЗН, выделенные в различных странах и в различные годы, имеют генетические различия и обладают различной вирулентностью. Группа «старых» штаммов ЛЗН, выделявшихся в основном до 1990 г., не связана с тяжелыми поражениями ЦНС. Группа «новых» штаммов (Израиль-1998/Нью-Йорк-1999, штаммов Сенегал-1993/Румыния- 1996/Кения-1998/Волгоград-1999/Израиль-2000) связана с заболеваниями человека, протекающими с поражением ЦНС.
ЭПИДЕМИОЛОГИЯ
Резервуар вируса в природе - птицы водно-околоводного комплекса, переносчик - комары, в первую очередь орнитофильные комары рода Culex. Между ними происходит циркуляция вируса в природе, они определяют возможный ареал распространения ЛЗН - от экваториальной зоны до регионов с умеренным климатом. В настоящее время вирус ЛЗН выделен более чем от 40 видов комаров, входящих не только в род Culex, но и в роды Aedes, Anopheles и др. Значение конкретных видов комаров в эпидемическом процессе, протекающем на определенной территории, не выяснено. Работами российских ученых установлена зараженность аргасовых и иксодовых клещей в природных очагах ЛЗН. Дополнительную роль в сохранении и распространении вируса играют синан-тропные птицы. Роль переносчика в этих случаях играют городские популяции комаров, размножающиеся во влажных подвальных помещениях. Вспышка ЛЗН в 1999 г. в Нью-Йорке сопровождалась массовым падежом ворон и гибелью экзотических птиц в зоопарке; в 20002010 гг. эпизоотия распространилась на всю территорию США, часть Канады, Мексики, Аргентину. Эпидемии в Израиле в 2000 г. предшествовала эпизоотия в 1998-2000 гг. среди гусей на фермах. Около 40% домашних птиц в районе Бухареста осенью 1996 г. имели антитела к вирусу ЛЗН. Вместе с «городскими» орнитофильными и антропофильными комарами домашние и городские птицы могут формировать антропургический очаг ЛЗН.
Описаны заболевания млекопитающих, в частности эпизоотии лошадей (от десятков до тысяч случаев).
В связи с высоким уровнем заболеваемости ЛЗН в США в 2002-2010 гг. отмечали случаи заражения ЛЗН реципиентов крови и органов. С начала XXI в. ЛЗН стала эндемичной в 20 странах Европы с теплым и умеренным климатом, в 28 регионах РФ - от Калужской области до Алтайского края.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
В странах с умеренным климатом болезнь имеет выраженную сезонность, обусловленную активностью комаров-переносчиков. В северном полушарии заболеваемость отмечается с конца июля, достигает максимума в конце августа - начале сентября и прекращается с наступлением холодов к октябрю-ноябрю.
Восприимчивость человека к ЛЗН высокая, но преобладает субклиническое течение инфекции. Перенесенная болезнь оставляет после себя выраженный иммунитет. Об этом свидетельствует тот факт, что в гиперэндемичных регионах (Египет) антитела обнаруживают более чем у 50% населения.
ПРОФИЛАКТИКА
Специфическая профилактика не разработана. Мероприятия по общей профилактике ЛЗН направлены на снижение численности комаров, что достигается проведением обработок мест выплода комаров в городской черте и на прилегающих
территориях, а также на территориях вблизи загородных баз отдыха, профилакториев, детских лагерей. Подлежат дезинсекционной обработке подвалы жилых и общественных зданий в городской и сельской местности. Обработку можно проводить и вне эпидемического сезона для уничтожения комаров, зимующих в стадии имаго. Рекомендуется снижение плотности популяций синантропных птиц (вороны, галки, воробьи, голуби и др.). Мероприятия по общественной профилактике ЛЗН проводят по эпидемическим показаниям на основе регулярного эпидемиологического надзора и обследования территории.
Меры неспецифической индивидуальной профилактики сводятся к применению в эпидемический период (июнь-октябрь) репеллентов и одежды, защищающей от укусов комаров, минимизации времени, проводимого на открытом воздухе во время максимальной активности комаров (вечером и утром), установке сеток на окна, выбору для отдыха мест с наименьшей численностью комаров. В эндемичных регионах особое значение имеет санитарно-просветительская работа среди населения.
ПАТОГЕНЕЗ
Первичная репликация вируса происходит в месте укуса комаров в различных клетках, затем вирус реплицируется в ЛУ и проникает в кровь, вызывая поражение эндотелия сосудов и микроциркуляторные расстройства, в части случаев - развитие тромбогеморрагического синдрома. Установлено, что вирусемия кратков-ременна и неинтенсивна. Ведущее в патогенезе болезни - поражение оболочек и вещества мозга, приводящее к развитию менингеального и общемозгового синдромов, очаговой симптоматики. Смерть наступает, как правило, на 7-28-й день болезни вследствие нарушения жизненно важных функций из-за отека и набухания вещества мозга с дислокацией стволовых структур, некрозом нейроцитов, кровоизлияниями в ствол мозга.
На аутопсии обнаруживают отек и полнокровие оболочек мозга, мелкоочаговые периваскулярные кровоизлияния, крупные геморрагии (до 3-4 см в диаметре), расширение желудочков мозга, полнокровие сосудистого сплетения, множественные очаги размягчения в полушариях мозга, мелкоточечные кровоизлияния в дно IV желудочка, у 30% умерших - дислокацию ствола мозга. При микроскопическом исследовании определяют васкулиты и периваскулиты оболочек мозга, очаговый энцефалит с образованием мононуклеарных инфильтратов. В сосудах головного мозга - картина полнокровия и стаза, фибриноидное набухание и некроз сосудистой стенки. В ганглиозных клетках - выраженные дистрофические изменения вплоть до некроза, выраженный периваскулярный и перицеллюлярный отек.
Существенные изменения обнаруживают со стороны сердца: дряблость мышцы, стромальный отек, дистрофия миоцитов, участки фрагментации мышечных волокон и

миолиза. В почках - дистрофические изменения. У части больных определяют признаки генерализованного тромбогеморрагического синдрома.
Вирус обнаруживают методом ПЦР в СМЖ, тканях головного мозга, почках, сердце, в меньшей степени - в селезенке, ЛУ, печени.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период продолжается от 2 дней до 3 нед, чаще 3-8 дней. Болезнь начинается остро с повышения температуры тела до 38-40 °С, а иногда и выше в течение нескольких часов. Повышение температуры сопровождается выраженным ознобом, интенсивной головной болью, болью в глазных яблоках, иногда рвотой, болями в мышцах, пояснице, суставах, резкой общей слабостью. Интоксикационный синдром выражен даже в случаях, протекающих с кратковременной лихорадкой, причем после нормализации температуры длительно сохра-
няется астения. Наиболее характерные симптомы ЛЗН, вызванной «старыми» штаммами вируса, помимо перечисленных, - склерит, конъюнктивит, фарингит, полиаденопатия, сыпь, гепатолиенальный синдром. Нередки диспепсические расстройства (энтерит без болевого синдрома). Поражение ЦНС в виде менингита и энцефалита встречается редко. В целом течение болезни доброкачественное.
Картина болезни, вызванной «новыми» штаммами вируса, существенно отличается от вышеописанной. Ю.Я. Венгеровым и А.Е. Платоновым (2000) на основании наблюдений и серологических исследований предложена клиническая классификация ЛЗН (табл. 21.44). Субклиническую инфекцию диагностируют при скрининговых исследованиях населения по наличию антител класса IgM или нарастанию титра антител класса IgG в 4 и более раз. Гриппоподобная форма не имеет клинической специфики. Она наименее изучена, так как часто, в связи с кратковременностью расстройства здоровья, больные не обращаются к врачу или же их заболевание расценивают на уровне поликлиники как грипп, ОРВИ.
При гриппоподобной форме с нейротоксикозом на 3-5-й день болезни происходит резкое ухудшение состояния, что выражается усилением головной боли, появлением тошноты, рвоты, мышечного тремора, атаксии, головокружения и других симптомов поражения ЦНС. Лихорадка в этих случаях высокая, длительностью 5-10 сут. Классическую симптоматику - склерит, конъюнктивит, диарею, сыпь - наблюдают в единичных случаях. Доминируют симптомы поражения ЦНС: интенсивная головная боль диффузного характера, тошнота, у половины больных - рвота. Частые симптомы - головокружение, адинамия, заторможенность, корешковые боли, гиперестезия кожи. Более чем у половины больных определяют менингеальный синдром, в части случаев - повышение АД. При исследовании СМЖ, помимо повышения ЛД, другой патологии нет.
У пациентов с менингеальной формой болезни менингеальные симптомы нарастают в течение 2-3 дней; наиболее резко выражена ригидность мышц затылка. По сравнению с
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
гриппоподобной формой с нейротоксикозом также выражена общемозговая симптоматика, отмечают преходящие очаговые симптомы. Наиболее характерны: ступор, мышечный тремор, анизорефлексия, нистагм, пирамидные знаки.
При проведении спинномозговой пункции прозрачная или опалесцирующая СМЖ вытекает под повышенным давлением. Цитоз варьирует в широких пределах - от 15 до 1000 клеток в 1 мкл (в большинстве случаев 200-300 клеток в 1 мкл)
и носит чаще смешанный характер. При исследовании в первые 3-5 дней болезни у части больных цитоз нейтрофильный (до 90% нейтрофилов). Смешанный цитоз сохраняется нередко до 2-3 нед, что, по-видимому, связано с наличием некроза значительной части нейроцитов. Этим объясняется и более медленная санация СМЖ, нередко затягивающаяся до 3-4-й нед болезни. Количество белка в пределах 0,45-1,0 г/л, содержание глюкозы - у верхних границ нормы или повышено, осадочные пробы слабоположительные. Течение болезни доброкачественное, продолжительность лихорадки 12 сут, менингеальные симптомы регрессируют в течение 3-10 сут. После нормализации температуры сохраняются слабость, повышенная утомляемость.
Менингоэнцефалическая форма болезни протекает наиболее тяжело, летальность близка к 50%. Начало болезни бурное, гипертермия и интоксикация с первых дней болезни. Менингеальные симптомы выражены слабо или умеренно. С 3-4-го дня нарастают общемозговые симптомы: спутанность сознания, возбуждение, бред, сопор, в части случаев переходящий в кому. Часто отмечают судороги, парезы черепных нервов, нистагм, реже - парезы конечностей, в наиболее тяжелых случаях доминируют дыхательные расстройства, центральные нарушения гемодинамики. Летальность до 50%. У выздоровевших нередко сохраняются парезы, мышечный тремор, длительная астения. Плеоцитоз СМЖ от 10 до 300 клеток в 1 мкл, содержание белка достигает 0,6-2,0 г/л.
Картина крови при ЛЗН характеризуется особенностями, свойственными для тяжелых вирусных инфекций: преобладает тенденция к лейкоцитозу, нейтро-филез без сдвига влево, отмечается лимфопения, увеличение СОЭ. Несмотря на отсутствие клинической симптоматики, в моче - протеинурия, цилиндрурия, лейкоцитурия.
Летальность среди госпитализированных больных составляет около 4-5%, что позволяет отнести ЛЗН к тяжелым (опасным) вирусным нейроинфекциям.
ДИАГНОСТИКА
Клиническая диагностика спорадических случаев ЛЗН проблематична. В эндемичном для ЛЗН регионе с умеренным климатом всякий случай гриппоподобного заболевания или нейроинфекции в июне-октябре подозрителен на ЛЗН, но может быть диагностирован только с использованием лабораторных тестов. Во время вспышек диагноз может быть поставлен со значительной степенью достоверности на основании клинико-эпидемиологических данных: связи заболевания с укусами комаров, выездами за город, проживанием вблизи открытых водоемов, отсутствия повторных случаев заболеваний в очаге и связи заболевания с употреблением пищевых продуктов, воды из открытых водоемов, наличия в доме проживания подвалов, населенных комарами.
Вирус ЛЗН может быть выделен из проб крови и, реже, СМЖ, взятых у больных в острый период болезни, как правило, до 5-го дня от начала заболевания. Лабораторными моделями для выделения вируса могут быть новорожденные и молодые мыши и различные виды клеточных культур.
В те же сроки возможно обнаружение РНК вируса ЛЗН с помощью ПЦР. Материал для обследования методом ПЦР (плазма и/или сыворотка крови, СМЖ) необходимо забирать с использованием одноразовых пробирок и медицинского инструментария с соблюдением

правил асептики и хранить при температуре -70 °С или в жидком азоте до момента проведения исследования.
Серологическая диагностика ЛЗН возможна с использованием методов РТГА, РСК, РН. В настоящее время в практике наибольшее применение получил ИФА, позволяющий обнаружить антитела к вирусу класса IgM и IgG. Ранние антитела класса IgM определяют в первые дни болезни, и их титры достигают очень высокого уровня через 1-2 нед от начала заболевания. Для серологической диагностики необходимо
взять две пробы крови: первая проба - в острый период болезни до 7-го дня от начала заболевания; вторая проба - через 2-3 нед после взятия первой.
Диагноз ЛЗН может быть поставлен по результату обнаружения антител к вирусу класса IgM в одной пробе крови, на основании нарастания содержания IgI в парных сыворотках в 4 и более раз.
Примерная схема диагностики ЛЗН представлена на рис. 21.13.
Рис. 21.13. Диагностический алгоритм при лихорадке Западного Нила Дифференциальная диагностика
Дифференциальную диагностику проводят в зависимости от клинической формы ЛЗН. В отличие от гриппа при ЛЗН отсутствуют признаки ларинготрахеи-та, продолжительность лихорадки часто превышает 4-5 сут. От ОРВИ ЛЗН отличается отсутствием катаральных явлений со стороны ВДП, высокой лихорадкой и выраженной интоксикацией.
От менингитов другой этиологии, прежде всего энтеровирусной, менингеаль-ная форма ЛЗН отличается высокой и длительной лихорадкой, резкой интоксикацией, смешанным плеоцитозом, медленной санацией СМЖ. При энтеровирус-ных менингитах нейтрофильный и смешанный плеоцитоз возможен при первом исследовании СМЖ в ранние сроки, а через 1- 2 сут становится лимфоцитарным
(более 90%).
Наиболее сложна дифференциальная диагностика с герпетическим энцефалитом. При его наличии, чаще на фоне лихорадки, наблюдают внезапный приступ генерализованных судорог с последующей комой, однако дифференциальная диагностика возможна только на
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
основании исследований крови и СМЖ с использованием полного комплекса иммунологических методов и ПЦР, а также КТ или МРТ головного мозга.
В отличие от бактериальных менингитов при менингеальном и менингоэн-цефалическом вариантах течения ЛЗН СМЖ прозрачная или опалесцирующая, существует явное несоответствие между тяжелой картиной болезни и слабо выраженной
воспалительной реакцией СМЖ, с повышенным или нормальным уровнем глюкозы в ней, уровень лактата не превышает 3-4 ммоль/л. Даже при наличии лейкоцитоза крови отсутствует нейтрофильный сдвиг влево.
От туберкулезного менингита симптомы поражения ЦНС у больных ЛЗН отличаются тем, что появляются и нарастают уже в первые 3-5 дней болезни (при туберкулезном менингите - на 2-й неделе), лихорадка и интоксикация в первые дни болезни более выражены, на 2-3-й неделе происходит улучшение состояния, уменьшается лихорадка, регистрируется неврологическая симптоматика, на фоне снижающегося цитоза СМЖ уровень глюкозы не меняется.
Вотличие от риккетсиозов при ЛЗН отсутствуют первичный аффект, характерная сыпь, гепатолиенальный синдром, воспалительные изменения СМЖ наблюдаются с большим постоянством, РСК и другие серологические тесты с риккетсиозными антигенами - отрицательные. Ареал распространения, сезонность ЛЗН могут совпадать с ареалом КГЛ, однако при КГЛ выявляют геморрагический синдром, воспалительные изменения СМЖ отсутствуют. При исследовании крови с 3-5-го дня болезни обнаруживают лейко- и нейтропению, тромбоцитопению.
Вотличие от малярии лихорадка у больных ЛЗН ремиттирующая, нет апирек-сий между приступами, повторных ознобов и гипергидроза, нет желтухи, гепато-лиенального синдрома, анемии.
Дифференциальная диагностика ЛЗН с наиболее актуальными нозоформами представлена в табл. 21.45 и 21.46.

Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/


Пример формулировки диагноза
А92.3 ЛЗН. Менингеальная форма. Тяжелое течение болезни (ИФА на 7-й день болезни: IgMАт в титре 1:320, IgG-Ат - 1:20; на 18-й день болезни IgM-Ат в титре 1:1280, IgG-Ат - 1:640).
Показания к госпитализации
Госпитализация производится по клиническим показаниям: гипертермия 40 °С и выше, наличие менингеальной, общемозговой и очаговой неврологической симптоматики.
ЛЕЧЕНИЕ Режим. Диета
В остром периоде болезни режим постельный.
Специальной диеты не требуется. При расстройствах сознания, бульбарных нарушениях показано зондовое или зондово-парентеральное питание.
Медикаментозная терапия
Эффективность противовирусных препаратов для лечения ЛЗН не доказана. Для борьбы с церебральной гипертензией и ОНГМ применяют фуросемид взрослым 20-60 мг в сутки, поддерживают нормальный объем циркулирующей крови. При нарастании симптомов ОНГМ назначают однократно маннитол в дозе 0,5 г/кг массы тела в 10% растворе, вводить быстро в течение 10 мин, с последующим введением 40 мг фуросемида в/в, назначают дексаметазон (Дексазон♠) в дозе 0,25-0,5 мг/кг/сут в течение 2-4 сут.
Дезинтоксикацию и компенсацию потерь жидкости осуществляют путем внутривенных инфузий полиионных растворов [раствор калия хлорид + натрия гидрокарбонат + натрия хлорид (Трисоль♠)], поляризующей смеси и коллоидных растворов [10% раствор альбумина человека (Альбумина♠), криоплазма, декстран [ср. мол. масса 35 000-45 000] (Реополиглюкин♠), декстран [ср. мол. масса 30 000-50 000] + маннитол + натрия хлорид (Реоглюман♠)] в соотношении 2:1. Оптимальный суточный объем вводимой жидкости,
включая пероральное и зондовое введение, - 3-4 л для взрослых и 100 мл/кг массы тела для детей.
Для борьбы с гипоксией используют ингаляции кислорода через назальные катетеры. Больных переводят на ИВЛ по следующим показаниям - чрезмерная одышка (ЧД в два раза и более выше нормы), стойкая гипоксемия (РаО2 менее 70 мм рт.ст.), гипокапния (РаСО2 менее
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
25 мм рт.ст.) или гиперкапния (РаСO2 более 45 мм рт.ст.), кома, генерализованные судороги. Проводят коррекцию электролитных нарушений и осмолярности крови.
По индивидуальным показаниям назначают противосудорожные, седатив-ные препараты, антиоксиданты, средства, улучшающие мозговой кровоток (пентоксифиллин), при наличии вторичных бактериальных осложнений - антибиотики.
Больным необходимо сбалансированное энтерально-парентеральное питание, включающее комплекс витаминов и микроэлементов, полноценный уход (профилактика гипостатической пневмонии, пролежней, контроль стула и диуреза).
Выписку больных осуществляют после стойкой нормализации температуры, регресса неврологических нарушений и санации СМЖ. Минимальная продолжительность стационарного лечения для больных с нейротоксикозом - 10 сут, менингитом - 20 сут, менингоэнцефалитом - 30 сут. После выписки из стационара больные с неврологическими нарушениями нуждаются в диспансерном наблюдении неврологом до полного восстановления трудоспособности и регресса неврологической симптоматики.
21.19. ЛИХОРАДКА ЗИКА
Лихорадка Зика - острая зооантропонозная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя, характеризующаяся лихорадкой, сыпью, способностью проникать через плацентарный барьер и вызывать у плода тяжелое поражение ЦНС. Распространена в странах тропического и субтропического пояса.
КОД ПО МКБ-10
A92.8 Другая уточненная комариная вирусная лихорадка. ЭТИОЛОГИЯ
Возбудителем заболевания является вирус Зика (англ. Zika virus, ZIKV), относящийся к арбовирусам семейства Flaviviridae рода Flavavirus, которые являются возбудителями: желтой лихорадки, лихорадки Денге, клещевого энцефалита, ОГЛ, энцефалита Повассан, Японского энцефалита, энцефалита Сент-Луис, энцефалита Долины Муррея и ЛЗН. Структура вируса схожа со структурой других флавивирусов, имеет нуклеокапсид сферической формы диаметром около 50 нм с мембраной, являющейся гликопротеиновой оболочкой, поверхностные белки которой располагаются в икосаэдрической симметрии. Внутри нуклеокап-сида находится одноцепочечная линейная РНК, содержащая 10 794 нуклеоти-дов, кодирующая 3419 аминокислот, составляющих белковые структуры вируса. Прикрепление вируса к цитоплазматическим клеточным мембранам и его проникновение внутрь клетки обусловлено наличием специального мембранного белка Е.
Репликация вирусной РНК происходит на поверхности эндоплазматического ретикулума в цитоплазме клеток-мишеней. Для синтеза собственного полипротеина вирус использует белки зараженных им клеток хозяина. Далее в процессе репликации РНК в клеточную мРНК происходит синтез собственных структурных и неструктурных нуклеопротеинов, сборка вирусной клетки и выход вируса посредством лизиса клетки хозяина.
Следует также отметить высокую способность флавивирусов к мутациям, обусловленным несовершенством механизма копирования генетической информации, что может приводить к изменению антигенных свойств и вирулентности вируса.
Впервые вирус был выделен от макак-резус (лат. Macaca mulatta) 18 апреля 1947 г. в ходе работы по мониторингу за лесной формой желтой лихорадки в лесу Зика (Уганда). Двумя днями позже лихорадящие обезьяны были доставлены в лабораторию, где их сывороткой были заражены мыши. Через 10 дней у всех мышей были отмечены симптомы заболевания. В дальнейшем возбудитель был
выделен из мозга зараженных животных. В 1948 г. вирус впервые выделен из организма самки комара рода Aedes Aegiρti, а в 1968 - из биоматериалов представителей коренного населения Нигерии.
ЭПИДЕМИОЛОГИЯ
С 1951 по 1981 г. были зафиксированы спорадические случаи заболевания на территории Африки - в Уганде, Танзании, Египте, Центральной Африканской Республике, Сьерра-Леоне, Габоне, Сенегале, а также в некоторых странах Азии, включая Индию, Малайзию, Филиппины, Таиланд, Вьетнам и Индонезию. В апреле 2007 г. на островах Яп на территории Федеральных Штатов Микронезии впервые была зафиксирована вспышка лихорадки Зика с лабораторно подтвержденными случаями заболевания (выделена РНК вируса Зика в биоматериалах от пациентов в острой фазе болезни). В 2013 г. отмечена вспышка на территории Французской Полинезии. В 2015 г. началось активное распространение вируса на территории Центральной и Южной Америки.
По данным ВОЗ, в настоящее время вирус Зика распространен в тропических районах с большими популяциями комаров. Известно, что он циркулирует в Африке, Южной и Центральной Америке, Южной Азии и Западной части Тихого океана (рис. 21.14, см. цв. вклейку). Завозные случаи зарегистрированы на территории Австрии, Германии, Дании, Ирландии, Испании, Италии, Португалии, Финляндии, Швейцарии и РФ, а также в Израиле, Австралии и Корее. Все заболевшие вернулись из регионов, эндемичных по лихорадке Зика.
Источник возбудителя - больные люди, здоровые вирусоносители, обезьяны, зараженные вирусом. От человека к человеку и от животных вирус передается посредством укуса комарами рода Aedes (A. Aegiρti и А. alboρictus). Наибольшую эпидемическую опасность представляет комар A. Aegiρti, который распространен в тропических и субтропических районах, но не выживает при более низких температурах. А. alboρictus также способен переносить вирус, но может впадать в состояние спячки и выживать в регионах с более низкой температурой. Комары инфицируются вирусом от зараженных людей и животных. Не исключена возможность адаптации вируса к организму комаров других видов.
Для самок комаров A. Aegiρti и А. Alboρictus характерно прерывистое питание, в следствие чего они кусают нескольких человек за цикл питания. Они нападают на нескольких человек или животных. Через 3 дня после завершения цикла питания самка комара откладывает яйца, которые могут сохраняться до года при отсутствии воды. В водной среде яйца превращаются в личинки, а далее - в половозрелые особи. Для цикла развития нужно очень небольшое количество воды. Комары вышеописанных видов могут пролетать расстояние не более 400 м, но часто заносятся людьми, например в багажниках машин и другими видами транспорта, с вещами, растениями на большие расстояния. При возможности выживания и размножения в новом температурном климате комары могут приводить к распространению вируса в регионах, куда были завезены.
Основной механизм передачи возбудителя - трансмиссивный. В настоящий момент описаны случаи заражения половым путем, как при гетеро-, так и при гомосексуальных контактах, при переливании крови. По некоторым данным, вирус способен персистировать в семенной жидкости более 60 сут после начала лихорадочного заболевания, в то время как в крови вирусная нагрузка не определяется со второй недели после появления первых симптомов болезни. Данные о возможности гетеросексуальной передачи вируса отсутствуют.
Естественный резервуар вируса неизвестен. ПРОФИЛАКТИКА
Профилактика и контроль заболеваемости заключается в сокращении численности комаров путем преобразования и/или уничтожения мест их размножения, снижении вероятности их контакта с населением путем использования репеллентов, москитных сеток на дверях и
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
окнах, противомоскитного полога для сна. Следует помнить, что для размножения комарам рода Aedes требуется очень малое количество воды, поэтому нужно опорожнять сельскохозяйственные резервуары с водой (ведра, бочки, горшки для растений и т.д.). Большую роль также играет санитарно-просветительская работа с населением. Особую осторожность следует соблюдать при поездках в эндемичные по заболеванию районы: использовать средства индивидуальной защиты (репелленты, рекомендованные местными органами здравоохранения, закрытую форму одежды), а также избегать мест распространения комаров.
Пациентов, зараженных вирусом Зика, и их половых партнеров (особенно беременных) необходимо информировать о риске половой передачи вируса Зика, противозачаточных мерах и безопасном половом поведении.
Женщинам, имевшим незащищенный половой контакт и не желающим забеременеть из-за высокой вероятности заражения вирусом Зика, необходимо обеспечить незамедлительную медицинскую консультацию, доступные контрацептивные препараты и медицинские услуги.
В целях предотвращения осложнений беременности и развития патологии плода следует информировать мужчин и женщин репродуктивного возраста, проживающих в регионах с высоким риском передачи вируса Зика или возвращающихся из таких зон, о всех возможных рисках и уведомлять их о предпочтительном отсрочивании беременности (не менее полугода), а также предоставлять рекомендации по использованию контрацепции.
Половым партнерам беременных, проживающим в ареале распространения вируса Зика или возвращающимся из него, следует придерживаться безопасного полового поведения или воздерживаться от половых контактов (предпочтительно), по крайней мере на протяжении беременности.
Парам или женщинам, планирующим беременность и возвращающимся из регионов зарегистрированной местной передачи вируса Зика, настоятельно рекомендуется отложить попытку зачатия не менее чем на 8 нед, чтобы полностью исключить вероятность заражения вирусом Зика, либо не менее чем на 6 мес, если у мужчины-партнера наблюдались симптомы болезни. Мужчинам с клиническими проявлениями лихорадки Зика (сыпь, лихорадка, боль в суставах, боль в мышцах, конъюнктивит) следует придерживаться безопасного секса или воздерживаться от сексуальных контактов минимум 6 мес. Женщин следует должным образом проинформировать об этой рекомендации.
В климатических условиях Российской Федерации риска распространения лихорадки Зика нет. При планировании отдыха в странах тропического и субтропического регионов предпочтительно выбирать страны, благополучные в эпидемиологическом отношении по лихорадке Зика.
При появлении одного или нескольких симптомов заболевания (жар, сыпь, конъюнктивит, боли в мышцах и суставах, озноб, общая слабость) в течение 2-3 нед после возвращения из стран, эндемичных по вирусу Зика, необходимо незамедлительно обратиться к врачу.
ПАТОГЕНЕЗ
Патогенез лихорадки Зика мало изучен. Установлено, что в первую очередь вирус поражает дермальные фибробласты, кератиноциты эпидермиса, незрелые дендритные клетки в месте внедрения, затем достигает ЛУ с последующим гематогенным распространением. За адгезию и проникновение вируса внутрь клеток-
мишеней отвечает фосфатидилсериновый рецептор AXL, находящийся на поверхности иммунных клеток кожи. В этих клетках были обнаружены пораженные ядра в месте предполагаемого внедрения вируса. Повышение репликации вируса вызывает в клетках продукцию интерферона I типа и аутофагосом. Доказана высокая чувствительность вируса к ИФН I и II типа. На протяжении болезни отмечается стойкое повышение активности Т-
клеток (в основном Th1, Th2, Th9 и Th17), выражающееся увеличением уровня соответствующих цитокинов с четким возрастанием к периоду реконвалесценции.
Манифестация заболевания, по данным ВОЗ, происходит в 1 из 5 случаев заражения, что характерно и для других флавивирусных инфекций.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период не известен. По некоторым данным он составляет от 2 до 7 дней, по другим - может длиться до 2 мес (в связи с чем в США введен запрет на донорство в течение 2 мес для всех вернувшихся из эндемичных районов).
Длительность болезни составляет от 2 до 7 сут. Чаще заболевание начинается с появления лихорадки, хотя в некоторых случаях может протекать на фоне нор-мотермии. Характерны головная боль, боли в мышцах и суставах, конъюнктивит. Обычно на 2-3-й день болезни на коже туловища, шеи, верхних и нижних конечностей (иногда включая ладони и стопы)
появляется пятнистая или пятнисто-папулезная сыпь (рис. 21.15, см. цв. вклейку). Для элементов сыпи характерны нисходящая последовательность распространения, зуд. Сыпь может сохраняться от 2 до 14 дней. Часто отмечается развитие конъюнктивита. В редких случаях заболевание может сопровождаться головокружением, ретроорбитальными болями, рвотой, диареей, болями в животе, отеками (чаще у беременных). В целом заболевание протекает доброкачественно и, в отличие от лихорадки денге, развитие геморрагического синдрома не отмечается. Известны случаи проявления заболевания изолированным конъюнктивитом. Особую опасность болезнь представляет для беременных в I триместре беременности, что обусловлено проникновением вируса через гематоплацентарный барьер с последующим развитием внутриутробной инфекции, приводящей к серьезной патологии развития плода (микроцефалия). Существуют данные о связи лихорадки Зика с развитием синдрома Гийена-Барре, а также различными аутоиммунными реакциями. Кроме того, неясно, способствует ли вирусная инфекция Зика самопроизвольным абортам и мертворождению, однако РНК вируса Зика была обнаружена в эмбрионах после выкидышей, произошедших у инфицированных женщин. Быстро накапливающиеся во время настоящей вспышки фактические данные подтверждают наличие связи между вирусной инфекцией Зика и другими серьезными аномалиями головного мозга плода.
В настоящее время нет свидетельств того, что вирус Зика у переболевших женщин представляет опасность инфицирования плода при будущих беременностях. Вирус Зика обычно циркулирует в крови инфицированного человека около недели.
ЛЕЧЕНИЕ
Этиотропная терапия не разработана. Рекомендовано симптоматическое лечение, соблюдение постельного режима, применение НПВС, обильное питье. При выраженном кожном зуде рекомендуется применение системных антигистамин-ных препаратов, местно - водный раствор ментола, каламиновый лосьон. Особое внимание следует уделять беременным пациенткам.
ДИАГНОСТИКА
В связи с клиническим сходством с другими тропическими лихорадками клиническая диагностика малоинформативна.
Для лабораторной диагностики лихорадки Зика методом выбора является ПЦР и выделение вируса из образцов крови (до 10-го дня с начала болезни), мочи и
слюны (до 29-го дня с момента заражения), а также семенной жидкости на поздних сроках (более 30 дней после заражения). Серологическая диагностика малоинформативна в силу перекрестных реакций с другими флавивирусами, такими как вирус Денге, Западного Нила и желтой лихорадки.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
21.20. БЕШЕНСТВО
Бешенство (гидрофобия Hydrophobia, Rabies, Lyssa) - вирусная зоонозная природно-очаговая и антропургическая инфекционная болезнь с контактным механизмом передачи возбудителя (через слюну зараженного животного), характеризующаяся развитием энцефалита с нарушением витальных функций.
КОД ПО МКБ-10 А.82. ЭТИОЛОГИЯ
Возбудитель бешенства - РНК-содержащий вирус, относящийся к
семейству Rabdoviridae рода Lyssavirus. Существует 7 генотипов вируса бешенства. Классические штаммы вируса бешенства (1 генотип) высокопатогенны для млекопитающих. Генотипы 2-7 включают в себя лиссаподобные штаммы, обладающие высоким уровнем гомологии аминокислотных и нуклеотидных последовательностей с вирусом бешенства. Считается, что весь спектр животных, поражаемых этими вирусами, до конца неизвестен, повидимому, это мелкие млекопитающие и членистоногие (грызуны, насекомоядные и плотоядные летучие мыши и др.). Вирион имеет форму пули, размер - 60-80 нм в диаметре; состоит из сердцевины (РНК, связанная с белком); окружен липопротеиновой оболочкой с гликопротеиновыми шипами. Гликопротеин G отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенным (типоспецифический антиген) и иммуногенным свойствами. Антитела к нему нейтрализуют вирус и определяются в реакции нейтрализации. Различают дикий (уличный) и фиксированный штаммы вируса бешенства. Дикий штамм вируса циркулирует среди животных и патогенен для человека. Фиксированный штамм был
получен Пастером путем многократного пассирования дикого вируса через мозг кроликов, в результате чего вирус приобрел новые свойства - утратил патогенность для человека, перестал выделяться со слюной, инкубационный период сократился с 15-20 дней до 7 дней и в последующем не изменялся. Полученный вирус с постоянным инкубационным периодом Пастер назвал фиксированным и в последующем использовал его в качестве антирабической вакцины. Оба вируса идентичны по антигенам. Вирус бешенства быстро погибает под действием солнечных и ультрафиолетовых лучей, при нагревании до 60 °С. Чувствителен к дезинфицирующим веществам, жирорастворителям, щелочам и др., сохраняется при низких температурах (-20-70 °С). Вирус культивируют путем внутримозгово-го заражения лабораторных животных (кроликов, белых мышей, крыс, хомячков, морских свинок, овец и др.) и в культуре клеток почек хомячка, нейробластомы мыши, фибробластов человека и куриного эмбриона. Вирус патогенен для человека и практически для всех видов теплокровных животных, включая грызунов и птиц.
ЭПИДЕМИОЛОГИЯ
Основным резервуаром бешенства в природе являются дикие млекопитающие, различные в разных регионах мира. Выделяют две эпидемиологические формы заболевания - городское бешенство (антропургические очаги), основной резервуар которого - домашние собаки и кошки, и лесное бешенство, резервуаром которого служат различные дикие животные. По данным ВОЗ, более чем в 99% случаев заболевания людей вирус бешенства передается домашними собаками. Программа вакцинации собак признана ВОЗ самым эффективным способом для уменьшения риска этой болезни. В некоторых странах Юго-Восточной Азии достигнут значительный прогресс в снижении смертности людей от бешенства. Так, в ШриЛанке массовая вакцинация собак привела к снижению смертности от бешенства с более чем 350 случаев в 1973 г. до 50 в 2010 г., в Таиланде - со 170 случаев смерти в 1991 г. до 7 в 2011 г. В России в природных очагах по-прежнему основными распространителями болезни являются лисица, енотовидная собака, волк, корсак, в тундровой зоне - песец. В связи с
интенсивной циркуляцией вируса в эпизоотические очаги все чаще вовлекаются дикие животные других семейств. В последние годы зарегистрированы случаи бешенства у барсуков, хорьков, куниц, бобров, лосей, рысей, диких кошек, серых крыс, домовых мышей. Выявлены случаи заболевания белок, хомяков, ондатр, нутрий, медведей. Домашнее животное обычно заражается бешенством от диких животных. Человек может встретиться с источником инфекции как в городе, так и на природе, заражение происходит при укусе больным животным, а также при ослюнении кожи (если есть микротравмы) и слизистых. Неповрежденные слизистые проницаемы для вируса бешенства, а неповрежденная кожа - нет. Заболевание может передаваться также при укусе летучими мышами-вампирами, чаще это происходит в Мексике, Аргентине и Центральной Америке, однако в последнее время зарегистрированы случаи бешенства после укусов насекомоядных летучих мышей (США, Европа, Австралия, Африка, Индия), единичные - в России (Белгородская область), в Украине. Доказана возможность аэрогенного пути заражения этой инфекцией (заражение спелеологов, побывавших в пещерах, заселенных летучими мышами; случай лабораторного заражения в результате аварии и др.). Описаны случаи передачи бешенства от донора к реципиенту через инфицированный трансплантат роговицы. В 2004 г. впервые сообщено о возможности передачи бешенства при пересадке солидных органов: от энцефалита неизвестной этиологии умерли реципиенты почек, печени и сегмента артерии, полученных от одного и того же донора. От человека человеку бешенство не передается, однако при работе с больными людьми или животныминеобходимо соблюдать меры предосторожности: использовать защитную одежду (халат, шапочку, перчатки, очки и др.) и проводить дезинфекцию инструментария, оборудования, помещения и др.
Восприимчивость к бешенству не является всеобщей. Развитие бешенства у покусанного зависит от того, содержится ли во время укуса в слюне животного вирус бешенства и попал ли он в результате укуса или ослюнения к человеку. Существуют данные, что только 12-30% людей, укушенных животными с доказанным бешенством и не привитых антирабической вакциной, заболевают бешенством. Согласно современным данным, почти 50% собак с доказанным бешенством не выделяют вирус со слюной. Несмотря на это, особая тяжесть исхода этой инфекции (100% летальность) диктует необходимость обязательного проведения всего комплекса лечебно-профилактических мероприятий (согласно действующей инструкции) в тех случаях, когда зафиксирован факт нанесения покусов или ослю-нения больным животным.
Бешенство встречается более чем в 150 странах, на всех континентах, за исключением Антарктиды. Ежегодно в мире от бешенства погибают от 40 до 70 тыс. человек. Наиболее неблагополучными являются такие регионы, как Азия, Африка и Латинская Америка. По данным ВОЗ, 40% людей, подвергшихся укусам предположительно бешеных животных, - это дети в возрасте до 15 лет. Ежегодно более 15 млн людей в мире получают постэкспозиционную вакцинацию для предотвращения развития болезни; по оценкам, это позволяет ежегодно предотвращать сотни тысяч случаев смерти от бешенства. Бешенство по наносимому экономическому ущербу занимает 5-е место среди инфекционных болезней. В последние годы в мире наблюдается активизация природных очагов этой инфекции как во всем мире, так и в различных регионах Российской Федерации, что неизбежно ведет к увеличению числа заболевших людей. В России ежегодно регистрируется около 20 случаев этого заболевания, однако ухудшение эпизоотической ситуации по бешенству в стране заставляет признать повышенную угрозу заболевания бешенством для населения.
МЕРЫ ПРОФИЛАКТИКИ
Иммунизация против бешенства - профилактическая и лечебно-профилактическая. С профилактической целью иммунизируют лиц, работа которых связана с риском заражения (ветеринары, лесники, охотники, собаколовы, работники бойни, таксидермисты, сотрудники лабораторий, работающих с уличным вирусом бешенства). Первичная иммунизация включает 3 инъекции (0, 7 и 30-й дни) по 1,0 мл. Первая ревакцинация проводится через 1 год
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
- 1 инъекция, 1,0 мл. Следующие ревакцинации - каждые 3 года, 1 инъекция, 1,0 мл. При проведении профилактической иммунизации существуют противопоказания - острые инфекционные и неинфекционные заболевания, хронические заболевания в стадии обострения или декомпенсации, системные аллергические реакции на предшествующее введение данного препарата (генерализованная сыпь, отек Квинке и др.), аллергические реакции на антибиотики группы аминогликозидов, беременность.
Лечебно-профилактическая иммунизация проводится при контакте и укусах людей бешеными, подозрительными на бешенство или неизвестными животными, противопоказаний в этом случае не существует. Беременность и грудной возраст не являются поводом для отказа от проведения лечебно-профилактической иммунизации. Вакцинированному запрещается употребление спиртных напитков в течение курса прививок и 6 мес после его окончания. Следует также избегать переутомления, переохлаждения, перегревания.
Постэкспозиционная профилактика бешенства включает обработку раны и введение антирабической вакцины в сочетании с иммуноглобулином антирабиче-ским. Одновременно проводится профилактика столбняка в соответствии с существующими схемами.
Оказание первой помощи пострадавшим от укусов животных должно проводиться немедленно или как можно раньше после укуса. Раны, царапины, ссадины, места ослюнения обильно промываются струей воды с мылом или другим моющим средством, края ран обрабатываются 70° спиртом или 5% йодом, накладывается стерильная повязка. Края раны в первые 3 дня не иссекают и раны не зашивают. Наложение швов показано в следующих случаях: при обширных ранах, когда следует наложить несколько наводящих кожных швов после предварительной обработки раны; для остановки наружного кровотечения (необходимо прошить кровоточащие сосуды); по косметическим показаниям (наложение кожных швов на раны лица). После местной обработки раны немедленно начинают лечебнопрофилактическую иммунизацию, для чего необходимо направить пострадавшего в травматологический пункт.
В настоящее время в РФ для проведения вакцинно-сывороточной профилактики бешенства используются антирабические вакцины и иммуноглобулин антира-бический. Используются культуральные вакцины. Наиболее широко используется вакцина антирабическая культуральная концентрированная очищенная инакти-вированная сухая (КОКАВ). Культуральные вакцины лишь в единичных случаях вызывают реакции местного и общего характера. При тяжелых множественных укусах опасной локализации наряду с вакциной вводится иммуноглобулин анти-рабический - гетерологичный (лошадиный) или гомологичный (человеческий), нейтрализующий вирус бешенства. Иммуноглобулин антирабический должен вводиться как можно раньше, в первые часы после укуса (не позднее 3 сут) - с целью создания пассивного иммунитета до момента выработки активного специфического иммунологического ответа, формируемого после введения вакцины. Для приготовления обычно применяющегося в практике иммуноглобулина антирабического используют сыворотку иммунизированных животных (лошадей, мулов, овец и др.), поэтому при его введении с целью профилактики анафилактической реакции необходимо соблюдать определенные правила (введение по Безредке). Доза иммуноглобулина антирабического определяется из расчета 40 МЕ на 1 кг массы при введении гетерологичного иммуноглобулина и 20 МЕ на 1 кг массы - при введении гомологичного. Для того чтобы определить необходимую для введения дозу иммуноглобулина, необходимо вес пострадавшего умножить на 40 (20) МЕ и разделить полученное число на активность иммуноглобулина, также измеряемого в МЕ, которая указана на этикетке. Рассчитанная доза иммуноглобулина инфильтрируется вокруг ран и в глубину раны, если анатомическое расположение раны не позволяет вводить всю дозу вокруг раны, то остаток иммуноглобулина вводят внутримышечно в другие места, чем вакцина. Иммуноглобулин антирабический
должен вводиться как можно раньше, в первые часы после укуса (не позднее 3 сут) - с целью создания пассивного иммунитета до момента выработки активного специфического иммунологического ответа, формируемого после введения вакцины. Для приготовления обычно применяющегося в практике иммуноглобулина антирабического используют сыворотку иммунизированных животных (лошадей, мулов, овец и др.), поэтому при его введении с целью профилактики анафилактической реакции необходимо соблюдать определенные правила (введение по Безредке). Доза иммуноглобулина антирабического определяется из расчета 40 МЕ на 1 кг массы при введении гетерологичного иммуноглобулина и 20 МЕ на 1 кг массы - при введении гомологичного. Для того чтобы определить необходимую для введения дозу иммуноглобулина, необходимо вес пострадавшего умножить на 40 (20) МЕ и разделить полученное число на активность иммуноглобулина, также измеряемого в МЕ, которая указана на этикетке. Рассчитанная доза иммуноглобулина инфильтрируется вокруг ран и в глубину раны, если анатомическое расположение раны не позволяет вводить всю дозу вокруг раны, то остаток иммуноглобулина вводят внутримышечно в другие места, чем вакцина. Иммуноглобулин антирабический не применяется после введения антирабической вакцины. Применение КОКАВ позволяет
не применяется после введения антирабической вакцины. Применение КОКАВ позволяет
значительно сократить дозы и кратность введения вакцины - вакцина вводится 6 раз в дозе 1,0 мл в дельтовидную мышцу (детям - в мышцы бедра) на 0, 3, 7, 14, 30 и 90-й дни. КОКАВ обладает более высокой степенью очистки и безвредности и более высокой иммуногенной активностью, чем культурная анти-рабическая вакцина (КАВ). При осмотре пострадавшего от укуса человека в каждом случае необходимо решить вопрос о постэкспозиционной профилактике бешенства. Следует приложить все усилия для поимки животного, напавшего на человека. Умерщвлению подлежат все дикие животные, укусившие человека, а из домашних животных - больные, невакцинированные, бродячие, совершившие неспровоцированное нападение на человека, ведущие себя необычно или имеющие другие признаки бешенства. Голову животного немедленно направляют на исследование в специализированную лабораторию для иммунофлуоресцентного окрашивания головного мозга на антигены вируса бешенства. При отрицательном результате слюна животного не может содержать возбудителя и профилактика не требуется. Если человек был укушен
диким животным, поймать которое не удалось, одновременно проводят активную и пассивную иммунизацию. В местности, где бешенство среди домашних животных не распространено, внешне здоровых собак и кошек изолируют и наблюдают за ними 10 сут (наблюдение ведется только за собаками и кошками). При появлении симптомов заболевания или при изменении в поведении животное умерщвляют, а его голову направляют в специализированную лабораторию для иммунофлуо-ресцентного окрашивания головного мозга на антигены вируса бешенства. Если животное в течение 10 сут не заболело, в момент укуса его слюна не могла содержать вирус бешенства. В этом случае начатую иммунизацию прекращают (пациент успевает получить три инъекции вакцины - на 0, 3 и 7-й день после укуса). В местности, где бешенство распространено среди собак, оправдано немедленное исследование головного мозга животного, особенно в случаях тяжелых укусов. Схема лечебно-профилактических прививок КОКАВ и иммуноглобулина антира-бического приведена в инструкции к этим препаратам. Иммуноглобулин антираби-ческий вводится не позднее 3 сут после нанесенных повреждений и не применяется после введения антирабической вакцины. Для лиц, получивших ранее полный курс лечебнопрофилактических или профилактических прививок, с окончания которого прошло не более 1 года, назначают три инъекции вакцины по 1,0 мл на 0, 3, 7-й день; если прошел 1 год и более или был проведен неполный курс иммунизации, то по 1,0 мл на 0, 3, 7, 14, 30 и 90-й день. По показаниям - комбинированное применение иммуноглобулина антирабического и вакцины (схема 1).
ПАТОГЕНЕЗ
После укуса вирус бешенства проникает в организм человека через поврежденный эпидермис или слизистые оболочки, включая неповрежденные, внедряется в поперечнополосатые мышцы; в нервную систему вирус попадает через нервно-мышечные синапсы и сухожильные рецепторы Гольджи (в этих структурах имеются уязвимые для вируса безмиелиновые нервные окончания). Далее вирус медленно, со скоростью около 3 мм/ч, продвигается по нервным волокнам в ЦНС, по-видимому, с аксоплазматическим током (ретроградный аксональный транспорт). При естественном заражении бешенством виремии нет, но в некоторых опытах на животных циркуляция вируса в крови зарегистрирована. До сих пор дискутируется вопрос о том, происходит ли репликация вируса в месте внедрения, в мышцах (до того, как он попадает в нервную систему) или же вирус вначале попадает в нейроны дорзальных ганглиев или передних рогов спинного мозга, где и реплицируется. Достигнув ЦНС, вирус инфицирует нейроны, репликация происходит почти исключительно в сером веществе. После репликации в нейронах мозга вирус распространяется в обратном направлении по вегетативным нервным волокнам - в слюнные железы (это и объясняет наличие вируса в слюне уже в конце инкубационного периода), в слезные железы, в роговицу, почки, легкие, печень, кишечник, поджелудочную железу, скелетные мышцы, кожу, сердце, сосочки языка, надпочечники и волосяные фолликулы и др. Наличие вируса в
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
волосяных фолликулах и роговице используется для прижизненной диагностики заболевания (наличие вирусного антигена исследуется в биоптате кожи, взятом в заушной области, и в мазке-отпечатке с роговицы). Смерть наступает вследствие поражения жизненно важных центров - дыхательного и сосудодвигательного.
Патоморфологическое исследование мозга умерших выявляет умеренные воспалительные изменения с относительно негрубой деструкцией нервных клеток, сопровождающиеся отеком-набуханием вещества головного мозга. Гистологическая картина напоминает таковую при других вирусных инфекциях ЦНС: полнокровие, более или менее выраженный хроматолиз, пикноз ядер и нейронофагия, инфильтрация периваскулярных пространств лимфоцитами и плазматическими клетками, пролиферация микроглии, гидропическая дистрофия. Обращает внимание несоответствие между тяжелыми неврологическими проявлениями болезни и скудными
патоморфологическими изменениями, обнаруживаемыми в тканях мозга. В клетках мозга вирус бешенства образует оксифильные цитоплазматические включения (тельца БабешаНегри), чаще всего обнаруживаемые в гиппокампе, клетках Пуркинье коры мозжечка, стволе мозга, гипоталамусе и спинальных ганглиях. Включения имеют размер около 10 нм, представляют скопления вирусных частиц в цитоплазме нейроцитов. У 20% больных тельца Бабеша-Негри выявить не удается, однако их отсутствие не исключает диагноза бешенства.
КЛИНИЧЕСКАЯ КАРТИНА
Для бешенства характерна цикличность течения болезни. Различают инкубационный период, периоды предвестников (продромальный), возбуждения и параличей. Длительность инкубационного периода может быть различной - от 7 дней до года и более (что регистрируется достаточно редко), чаще - от 30 до 90 дней. Длительность инкубационного периода зависит от локализации укусов (чем больше расстояние до головного мозга, тем продолжительность его длиннее), их глубины и обширности. Наиболее короткий инкубационный период отмечается при укусах дикими плотоядными животными в область лица, головы, шеи, промежности, гениталий, наиболее длительный - при одиночных укусах в туловище и в нижние конечности. Как правило, болезнь начинается с продромального периода: появляются неприятные ощущения и боли в месте укуса, этому может предшествовать появление лихорадки. Одновременно отмечаются бессонница, подавленное настроение, раздражительность, чувство страха, тоски, повышенная чувствительность к слуховым и зрительным раздражителям, гиперестезия кожи, чувство нехватки воздуха. Чаще всего наблюдается повышенная эмоциональная лабильность с продолжительностью от нескольких часов до нескольких дней. Затем выявляются симптомы острого энцефалита, первыми признаками которого служат приступы психомоторного возбуждения. Вскоре присоединяются изменение сознания, галлюцинации, агрессивность, психомоторное возбуждение, бред, мышечные спазмы, судороги. Больной пытается убежать, укусить, нападает с кулаками. Затем этот период сменяется периодом успокоения. На этом фоне возникает приступ болезни («пароксизм бешенства»), сопровождающийся судорогами мышц глотки, гортани, диафрагмы, возможно нарушение дыхания и глотания. Наблюдается психомоторное возбуждение, гиперсаливация, рвота. Приступы длятся несколько секунд или минут, в дальнейшем частота приступов нарастает, они провоцируются попыткой пить (гидрофобия), дуновением воздуха (аэрофобия), ярким светом (фотофобия) или громким звуком (акустикофобия). На высоте развития приступа возможна остановка дыхания. Между приступами сознание, как правило, проясняется. К симптомам энцефалита скоро присоединяются признаки нарушения стволовых функций. Поражение черепных нервов ведет к диплопии, парезу лицевых нервов, нарушению зрения и глотания. Слюнотечение в сочетании с дисфагией приводит к появлению пены во рту, которая характерна для больных бешенством. Следующая стадия болезни - паралитическая, когда прекращаются судороги и возбуждение, проясняется сознание. Однако на фоне мнимого улучшения состояния наступает смерть от паралича дыхательного или сосудодвига-тельного центров. Возможны
различные варианты течения болезни - отсутствие продромального периода или развитие «тихого» бешенства, часто развивающегося после укусов летучих мышей, для которого характерно развитие восходящих параличей, напоминающих синдром Гийена-Барре. Поставить диагноз «тихого» бешенства чрезвычайно трудно, об этом свидетельствуют описанные в литературе случаи передачи вируса от человека к человеку при трансплантации роговицы от доноров, умерших, как предполагали, от синдрома Гийена-Барре. Это привело к развитию бешенства и гибели двух реципиентов, в ткани головного мозга которых были обнаружены тельца Бабеша-Негри, а из замороженного донорского материала был выделен вирус бешенства.
Исходом заболевания является смерть больного. Через 4 сут после появления первых симптомов умирает половина больных, через 20 сут - все. Если проводится ИВЛ, возможно развитие поздних осложнений: синдром гиперсекреции антидиуретического гормона, несахарный диабет, нестабильность гемодинамики, аритмии, РДСВ, желудочно-кишечные кровотечения, тромбоцитопения и др.
В 2005 г. был описан экспериментальный курс лечения бешенства у 15-летней девочки, приведший к выздоровлению. Лечение включало в себя создание искусственной (кетаминовой) комы и применение противовирусных препаратов (рибавирина и амантадина). Пациентка была госпитализирована в госпиталь г. Милуоки (США), в связи с чем протокол лечения получил название Милуокского. Впоследствии в разных странах мира было произведено более 40 попыток спасения жизни людей, заболевших бешенством, с помощью предложенной схемы лечения. Сообщается, что положительного эффекта удалось добиться примерно в 16% случаев, при этом многие исследователи считают, что выживаемость нескольких пациентов могла быть связана не столько с использованием Милуокского протокола, сколько с особенностями иммунной системы выживших пациентов и, возможно, с низкой вирулентностью вируса. Подтверждением роли указанных факторов в выживании людей в случае инфицирования вирусом бешенства являются данные о том, что в перуанских джунглях обнаружены люди, в крови которых определялись антитела к вирусу бешенства. Это означает, что бешенство при определенных условиях (пока не вполне ясных) может быть не смертельным заболеванием.
ДИАГНОСТИКА
Прижизненный диагноз бешенства может быть подтвержден определением вирусного антигена в первые дни болезни (метод флюоресцирующих антител - МФА - в отпечатках роговицы или в биоптатах кожи затылка), а также определением нейтрализующих антител после 7-10-го дня болезни реакцией нейтрализации. У невакцинированных больных диагноз бешенства подтверждает четырехкратное нарастание титра нейтрализующих антител при исследовании парных сывороток. У вакцинированных больных при постановке диагноза опираются на абсолютный уровень нейтрализующих антител в сыворотке, а также на присутствие этих антител в СМЖ. После проведения постэкспозиционной профилактики нейтрализующие антитела в СМЖ обычно не появляются либо их титр менее 1:64, в то время как при бешенстве титр нейтрализующих антител в СМЖ колеблется от 1:200 до 1:160 000. С диагностической целью используют также метод ПЦР для обнаружения РНК вируса бешенства в биоптатах ткани мозга (при биопсии мозга).
Посмертный диагноз бешенства может быть подтвержден при помощи нескольких методов. Широко используется гистологический метод, являющийся экспресс-методом, при котором ответ может быть получен через 1-2 ч с достоверностью 85-90%; он основан на обнаружении телец Бабеша-Негри в мазках-отпечатках головного мозга. Тельца Бабеша-Негри при обработке препарата кислыми красками приобретают рубиновый цвет и обнаруживают базофильную внутреннюю структуру. Биологический метод основан на заражении исследуемым материалом лабораторных животных (сосунков белых мышей, сирийских хомячков) и в дальнейшем, после гибели животных, обнаружении телец Бабеша-Негри в
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
мозговой ткани погибших животных; ответ может быть получен на 25-30-й день исследования. Используются также иммунологический (флюоресцирующих антител - МФА или ИФА) и вирусологический методы, основанные на выделении и идентификации вируса бешенства.
Для посмертного лабораторного исследования у человека используются кусочки мозговой ткани (2-3 г, мозжечок, аммонов рог, кора больших полушарий), слюн-
ных желез, роговицы, которые помещают в стерильную посуду с 50% раствором глицерина на физиологическом растворе. Забор материала должен осуществляться в условиях строгого соблюдения противоэпидемического режима и мер личной профилактики, доставка в лабораторию осуществляется в герметически упакованном виде, в сумке-холодильнике. В качестве материала для лабораторного исследования у животных чаще всего направляется голова животного, а если животное мелкое - то труп целиком. Материал помещают в полиэтиленовые пакеты, а затем в герметические контейнеры с кусочками льда.
Дифференциальная диагностика бешенства проводится с заболеваниями, сопровождающимися развитием сходной клинической симптоматики (табл. 21.47).
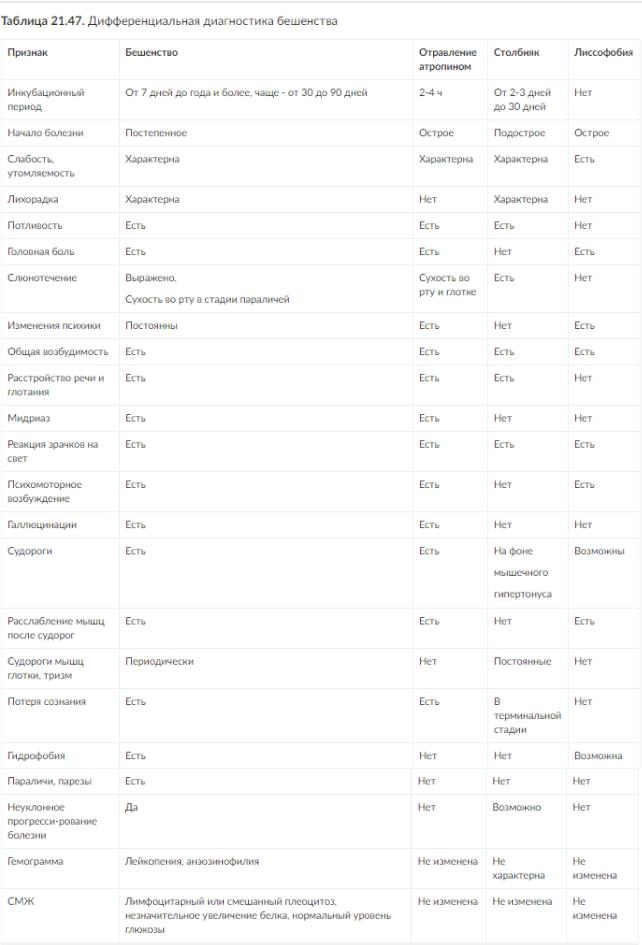
Показаниями к консультации хирурга является наличие множественных рваных и
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
нагноившихся ран, невропатолога - клинико-лабораторные данные, свидетельствующие об энцефалите иной природы.
Пример формулировки диагноза: А82 Бешенство. Осложнение - ОНГМ.
Перечень показаний к госпитализации пострадавших с укусами, царапинами и ослюнения животными и больных гидрофобией:
1)хирургические - множественные рваные раны, укусы в лицо, шею, кисти и пальцы рук;
2)отягощенный терапевтический анамнез;
3)инфицированные укушенные раны (кроме кисти);
4)инфицированные укушенные раны кисти;
5)отягощенный аллергологический анамнез, лица с необычными поствакцинальными реакциями и осложнениями на антирабические препараты и повторно прививаемые;
6)отягощенный неврологический анамнез;
7)отягощенный психоневрологический анамнез;
8)беременные, пострадавшие от укусов животных;
9)новорожденные, пострадавшие от укусов животных;
10)больные гидрофобией и пострадавшие от укусов с инфекционными заболеваниями.
Режим определяется показанием к госпитализации. Больные гидрофобией госпитализируются в отделение реанимации и/или интенсивной терапии.
Диета. Развитие гидрофобии сопровождается нарушением глотания, что требует установки назогастрального зонда и проведения зондового питания.
ЛЕЧЕНИЕ
Больной госпитализируется в ОРИТ инфекционной больницы, где с соблюдением противоэпидемиологических мероприятий проводят инфузионную, противо-судорожную и седативную терапию, при необходимости назначают мышечные релаксанты, ИВЛ, наркотические средства и средства для наркоза.
Прогноз неблагоприятный. Бешенство относится к абсолютно смертельным заболеваниям.
21.21. КЛЕЩЕВОЙ ЭНЦЕФАЛИТ
Клещевой энцефалит (весенне-летний энцефалит, таежный энцефалит, русский энцефалит, дальневосточный энцефалит, клещевой энцефаломиелит) - природно-очаговая вирусная инфекционная болезнь с трансмиссивным механизмом пере-
дачи возбудителя, характеризующаяся лихорадкой и преимущественным поражением ЦНС. КОДЫ ПО МКБ-10 А84.0 Дальневосточный клещевой энцефалит (русский весенне-летний энцефалит).
А84.1 Центрально-европейский клещевой энцефалит. ЭТИОЛОГИЯ
Вирус клещевого энцефалита принадлежит к семейству Flaviviridae роду Flavivirus и включает три подтипа - европейский, дальневосточный и сибирский. Вирион вируса клещевого энцефалита имеет сферическую форму, кубический тип симметрии и покрыт
липопротеиновой суперкапсидной оболочкой. Размер вириона - 40-45 нм. Геном представлен линейной одноцепочечной РНК положительной полярности, размер которой составляет примерно 11 тыс. п.о. В составе генома 10 генов, три из которых кодируют структурные вирусные белки Е, М и С, входящие в состав вириона, a остальные 7 - неструктурные белки NS1, NS2a, NS2b, NS3, NS4a, NS4b, NS5, необходимые для осуществления процесса его репликации в зараженной клетке. Нуклеокапсид содержит РНК и протеин С (core). Оболочка состоит из двух гликопротеидов (мембранного М, оболочечного Е) и липидов. Вирус культивируют в куриных эмбрионах и культурах тканей различного происхождения. При длительном пассировании патогенность вируса снижается. Репликация вируса происходит в цитоплазме клетки. Геномная РНК выполняет функции матрицы для синтеза дочерних молекул РНК, а также - информационной РНК для синтеза клеточных белков. Геном вируса транслируется с образованием полипротеина, который затем с помощью клеточных протеаз расщепляется на вирусные белки. Сборка нуклеокапсидов осуществляется в цитоплазме, а окончательное формирование новых вирионов - в ходе почкования вируса через клеточные мембраны. Завершение цикла репродукции вируса, в конечном счете, приводит к гибели клетки.
Генетические различия между европейским и дальневосточным вариантами вируса весьма значительны и составляют 16,8-16,9% нуклеотидных замен, а между дальневосточным и сибирским - 4,6%. Штаммы европейского подтипа вируса распространены в Европе до территории Сибири. На Дальнем Востоке преобладает дальневосточный подтип. Сибирский подтип широко циркулирует в Восточной и Западной Сибири, обладает своеобразной антигенной характеристикой, отличается от дальневосточных штаммов по уровню патогенности для лабораторных животных и обладает повышенной способностью к длительной персистенции в организме человека. С генетическим разнообразием возбудителя связаны различия в клинической картине клещевого энцефалита в Европе, Сибири и на Дальнем Востоке.
Вирус стабилен при рН 8,0, чувствителен к органическим растворителям и детергентам, инактивируется при температуре 40 °С.
Среди лабораторных животных наиболее чувствительны к заражению вирусом белые мыши, сосунки крыс, хомяки и обезьяны, среди домашних животных - овцы, козы, свиньи, лошади. Вирус при кипячении погибает в течение 2-3 мин, легко разрушается при пастеризации, обработке растворителями и дезинфектанта-ми, но способен длительно сохранять жизнеспособность при низких температурах, в высушенном состоянии. Вирус достаточно долго сохраняется в таких продуктах питания, как молоко или масло, которые иногда могут быть источниками инфицирования, устойчив к низким концентрациям соляной кислоты, поэтому возможен пищевой путь заражения.
ЭПИДЕМИОЛОГИЯ
Клещевой энцефалит - природно-очаговое заболевание. Основной резервуар и переносчик вируса в природе - иксодовые клещи Ixodes persulcatus, Ixodes ricinus с трансфазовой (личинка-нимфа-имаго) и трансовариальной передачей возбудителя. Дополнительные резервуары вируса - дикие и домашние животные, птицы. Благодаря широкому кругу хозяев происходит непрерывная циркуляция вируса в природе.
Клещ заражается вирусом при питании на животных с надпороговыми уровнями вирусемии. Личиночные и нимфальные стадии клещей передают или воспринимают вирус преимущественно при питании на мелких лесных животных, прежде всего, мышевидных грызунах. Прокормителями половозрелых клещей являются в основном средние и крупные животные: зайцы, косули, олени. Птицы также могут быть прокормителями клещей и участвуют в циркуляции вируса. В антропурги-ческих очагах прокормителями клещей являются домашние животные, прежде всего - крупный и мелкий рогатый скот. Козы могут быть не только прокормите-лями клеща, но и являться источником заражения человека, так
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
как молоко этих животных может содержать вирус в высоких дозах. Довольно эффективным является и половой путь передачи вируса клещевого энцефалита от самцов клещей к самкам во время спаривания, в результате чего может быть инфицировано до 50% самок.
Вертикальная передача вируса от зараженных самок через яйца личинкам имеет место, но она менее эффективна - не более 1% потомства.
Основной путь инфицирования человека - трансмиссивная передача через присасывание клещей. Риск инфицирования людей тесно связан с активностью клещей. Клещи I. persulcatus обычно проявляют максимум активности с апреля по середину июля, а для клещей I. ricinus характерен второй небольшой пик активности в начале осени. Чаще болеют лица в возрасте 20-60 лет. В структуре заболевших в настоящее время преобладают городские жители. Возможна также передача вируса алиментарным путем (при употреблении в пищу сырого молока коз и коров), в результате раздавливания клеща при его удалении с тела человека и, наконец, аэрозольным путем при нарушении условий работы в лабораториях.
Вирус клещевого энцефалита распространен в 25 странах Европы и Азии, главным образом в умеренной климатической зоне. Ареал вируса в основном совпадает с ареалом клеща Ixodes persulcatus в Азии, клеща Ixodes ricinus - на территории Европы. На протяжении периода от начала официальной регистрации клещевого энцефалита (1944 г.) до настоящего времени в России было зарегистрировано две больших волны подъема заболеваемости (рис. 21.16). Первая волна достигла своего пика в середине 1950-х гг., когда было выявлено более 5000 случаев. Затем отмечался длительный постепенный спад заболеваемости до середины 1970-х гг.. Следующая волна достигла максимума в 1996 г. и 1999 г., при этом цифры заболеваемости достигли небывало высокого уровня (7,0 на 100 тыс. населения, или более 10 тыс. случаев в абсолютном выражении).
Восприимчивость к клещевому энцефалиту высокая, независимо от пола и возраста, особенно среди лиц, впервые посещающих природный очаг. У коренных жителей преобладают субклинические формы инфекции (один клинический случай на 60 инаппарантных). Иммунитет после перенесенного клещевого энцефалита стойкий, пожизненный. В крови переболевших в течение всей жизни сохраняются вируснейтрализующие антитела.
Больной как источник инфекции для окружающих не опасен. МЕРЫ ПРОФИЛАКТИКИ
Профилактические мероприятия можно разделить на две основные группы: специфические и неспецифические.

Специфическая профилактика
Специфическая профилактика включает активную и пассивную иммунизацию населения. Вакцинацию осуществляют тканевой культуральной вакциной (троекратные прививки) с последующей ревакцинацией через 4, 6 и 12 мес. В России используются две отечественные культуральные инактивированные высокоочи-щенные вакцины, приготовленные из дальневосточных штаммов вируса клещевого энцефалита Софьин (Предприятие Института полиомиелита и вирусных энцефалитов, Москва) и 205 (НПО «Микроген», филиал в г. Томске «Вирион»). Зарегистрированы и разрешены к применению также вакцины фирмы «Бакстер» (США, производство в Австрии) и «Новартис» (Германия). У непривитых больных значительно чаще встречаются паралитические формы, выше процент остаточных явлений и летальность. Тяжелые формы среди непривитых в 4 раза чаще, чем у привитых.
Специфическую пассивную профилактику проводят гомологичным донорским иммуноглобулином как предэкспозиционно (до предполагаемого присасывания клеща, при выходе в зону риска), так и постэкспозиционно (после укуса клеща). Иммуноглобулин вводят в/м из расчета 0,1 мл/кг однократно за несколько часов до выхода в лесную зону или в течение первых суток после укуса клеща. В последующие 2-3 дня эффективность постэкспозиционной иммунопрофилактики снижается. Остается актуальным поиск альтернативных препаратов для экстренной профилактики клещевого энцефалита. В литературе сообщается об обнадеживающих результатах использования некоторых препаратов ИФН и индукторов ИФН-α. Однако эффективность и безопасность этих препаратов нуждаются в подтверждении.
Неспецифическая профилактика и мероприятия в очаге
Неспецифическая профилактика связана с защитой человека от нападения клещей. Общественная профилактика направлена на уничтожение или сокращение
численности клещей. Методика обработок предусматривает использование ака-рицидных препаратов с коротким остаточным действием. Такие препараты, как «Таран 10% в.к.э.», «Байтекс 40% с.п.», «Цифокс», «Акаритокс» и другие, быстро разлагаются в окружающей среде, нанося меньший ущерб природе, чем ДДТ. Меры личной профилактики предусматривают использование при посещении леса специально подобранной одежды, применение различных репеллентов, взаимоосмотры после посещения лесов и парков в
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
черте города. В настоящее время разработаны эффективные противоэнцефалитные костюмы («Биостоп»), которые с помощью специальных складок на брюках и рукавах создают препятствия для передвижения клещей по одежде. Кроме того, ткань костюмов импрегнируется акарицидными препаратами, приводящими к гибели членистоногих. Разработано и доступно для населения значительное число акарицидных и акарициднорепеллентных средств для обработки одежды в виде брусков («Претикс») или аэрозолей («Пикник Супер», «Максимум-антиклещ», «Гардекс Экстрим», «Фумитокс-антиклещ» и
др.)
ПАТОГЕНЕЗ И ПАТОМОРФОЛОГИЯ
После внедрения вирус локально размножается в клетках кожи. На месте присасывания клеща в тканях развиваются дегенеративно-воспалительные изменения. При алиментарном пути заражения фиксация вируса происходит в эпителиальных клетках ЖКТ. Вирусемия при клещевом энцефалите имеет двухволновой характер. Первая волна вирусемии (транзиторная) обусловлена проникновением вируса в кровь из мест первичной локализации. В конце инкубационного периода возникает вторая волна вирусемии, совпадающая по времени с началом размножении вируса во внутренних органах. Заключительная фаза - внедрение и репликация вируса в клетках ЦНС и периферической нервной системы. «Плюс-нитевая» РНК вируса клещевого энцефалита способна непосредственно транслировать генетическую информацию на рибосомы чувствительной клетки, т.е. выполнять функции мРНК.
Патологоанатомически клещевой энцефалит характеризуется диффузным воспалительным поражением головного и спинного мозга (полиэнцефаломиелит). Поражается преимущественно серое и в меньшей степени - белое вещество. Наиболее распространенные и интенсивные изменения отмечаются в ядрах продолговатого мозга и нервных клетках аммонова рога. Во всех секционных наблюдениях на первый план выступают повреждения сосудов микроциркуляторного русла и двигательных нейронов. Наблюдаемые поражения неспецифичны и включают воспаление, гиперплазию, глиальную пролиферацию и некроз нейронов. Прогредиентные формы клещевого энцефалита связывают с длительным сохранением вируса в активной форме в клетках ЦНС. В развитии персистирующей инфекции значительную роль отводят мутантным формам вируса.
Летальность при клещевом энцефалите связывают с развитием бульбарного и судорожнокоматозного синдромов. Смерть чаще всего наступает в остром периоде заболевания (1-7-й день). Частота смертельных исходов зависит от генотипа циркулирующего вируса и варьирует от единичных случаев в Европе и европейской части России до 10% на Дальнем Востоке.
КЛИНИЧЕСКАЯ КАРТИНА
Заболевание, независимо от формы, в подавляющем большинстве случаев начинается остро. Редко наблюдается период продромы длительностью 1-3 дня.
Клиническая классификация клещевого энцефалита основана на определении формы, тяжести и характера течения заболевания (табл. 21.48).

Инкубационный период при трансмиссивном пути заражении составляет 5-25 (в среднем 7- 14) дней, а при пищевом - 2-3 дня.
Основные симптомы и их динамика
Лихорадочную форму клещевого энцефалита регистрируют в 40-50% случаев. У большинства больных заболевание начинается остро. Лихорадочный период длится от нескольких часов до 5-6 дней. В острый период болезни температура тела повышается до 38-40 °С и выше.
Иногда наблюдают двухволновую и даже трехволновую лихорадку.
Больных беспокоят различной интенсивности головная боль, общая слабость, недомогание, озноб, чувство жара, потливость, головокружение, боль в глазных яблоках и светобоязнь, снижение аппетита, боли в мышцах, в костях, в позвоночнике, в конечностях, в пояснице, в области шеи и в суставах. Характерна тошнота, возможна повторная рвота в течение одного или нескольких дней. Отмечают инъекцию сосудов склер и конъюнктив, гиперемию лица, шеи и верхней половины туловища, выраженную гиперемию слизистых оболочек, ротоглотки. В ряде случаев отмечают бледность кожного покрова. Возможен менингизм.
В большинстве случаев заболевание заканчивается полным клиническим выздоровлением. Однако у ряда пациентов после выписки из стационара сохраняется астеновегетативный синдром.
Менингеальная форма - наиболее распространенная форма клещевого энцефалита. В структуре заболеваемости она составляет 50-60%. Клиническая картина характеризуется выраженным общеинфекционным и менингеальным симптомами.
В большинстве случаев начало болезни острое. Температура тела повышается до 39-39,5 °С. Лихорадка сопровождается ознобом, чувством жара и потливостью. Характерна головная боль различной интенсивности и локализации. Отмечают анорексию, тошноту и частую рвоту. В некоторых случаях выражены миастения, боли в глазных яблоках, светобоязнь, шаткая походка и тремор рук. При осмотре выявляют гиперемию лица, шеи и верхней части туловища, инъекции сосудов склер и конъюнктив.
Менингеальный синдром при поступлении обнаруживают у половины больных. У остальных он развивается на 1-5-й день пребывания в стационаре. Выявляют преходящую очаговую симптоматику, асимметрию лица, анизокорию, недоведение глазных яблок кнаружи, нистагм, оживление или угнетение сухожильных рефлексов, анизорефлексию. Давление СМЖ, как правило, повышено (250-300 мм вод.ст.). Плеоцитоз СМЖ составляет от нескольких десятков до нескольких сотен клеток в 1 мкл. Преобладают лимфоциты, в ранние сроки могут преобладать нейтрофилы. Содержание глюкозы в СМЖ нормальное или повышенное. Изменения в СМЖ сохраняются сравнительно долго: от 2-3 нед до нескольких месяцев. Астеновегетативный синдром сохраняется дольше, чем при лихорадочной форме. Характерны раздражительность, плаксивость. Доброкачественное течение
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
менингеальной формы клещевого энцефалита не исключает возможности развития в дальнейшем клинической картины хронической формы заболевания.
Менингоэнцефалитическая форма отличается тяжелым течением и высокой летальностью. Частота этой формы в отдельных географических регионах составляет от 5 до 10%, на Дальнем Востоке - до 15%. Для острого периода болезни характерны высокая температура, более выраженная интоксикация, выраженные менингеальные и общемозговые симптомы, а также признаки очагового поражения головного мозга.
Характерны глубокие нарушения сознания вплоть до развития комы. У больных, поступавших в бессознательном и сопорозном состоянии, наблюдают двигательное возбуждение, судорожный синдром, мышечную дистонию, фибриллярные и фасцикулярные подергивания в отдельных мышечных группах. Часто oбнаруживают нистагм. Характерно появление подкорковых гиперкинезов, геми-парезов, а также поражения черепных нервов: III, IV, V, VI пар, несколько чаще VII, IX, Х, XI, XII пар. При стволовых поражениях появляются бульбарный, буль-бопонтинный синдромы, реже - симптомы поражения среднего мозга. Отмечают нарушение глотания, поперхивание, гнусавый оттенок голоса или афонию, паралич мышц языка, при распространении процесса на мост - симптомы поражения ядер VII-VI черепных нервов. Нередко выявляют пирамидные знаки, повышение рефлексов, клонусы, патологические рефлексы. Поражения ствола мозга чрезвычайно опасны из-за возможного развития нарушений дыхания и сердечной деятельности. Бульбарные расстройства - одна из основных причин высокой смертности при менингоэнцефалитической форме клещевого энцефалита. При исследовании СМЖ обнаруживают лимфоцитарный плеоцитоз, концентрация белка повышена до 0,6-1,6 г/л.
Гемиплегия среди очаговых поражений нервной системы занимает особое место. В первые дни лихорадочного периода (чаще у лиц старшего возраста) развивается синдром гемиплегии по центральному типу, по течению и по локализации напоминающий сосудистые поражения нервной системы (инсульты). Эти нарушения часто нестойкие и уже в раннем периоде имеют тенденцию к обратному развитию. У 27-40% пациентов развивается астеновегетативный синдром. К остаточным явлениям относится парез лицевого нерва.
Полиомиелитическая форма - самая тяжелая форма инфекции. Наиболее часто встречалась в прежние годы, в настоящее время наблюдается у 1-2% больных.
Неврологический статус характеризуется значительным полиморфизмом. У больных с полиомиелитической формой заболевания возможно внезапное развитие слабости в какойлибо конечности или появление онемения в ней. В дальнейшем в этих конечностях развиваются двигательные нарушения. На фоне лихорадки и общемозговых симптомов развиваются вялые парезы шейно-плечевой мускулатуры и верхних конечностей. Нередко парезы симметричны и охватывают всю мускулатуру шеи. Поднятая рука падает пассивно, голова свисает на грудь. Сухожильные рефлексы не вызываются. В конце второй недели развиваются атрофии пораженных мышц. Парезы и параличи нижних конечностей встречаются редко.
Течение болезни всегда тяжелое. Улучшение общего состояния наступает медленно. Лишь у половины больных умеренно восстанавливаются утраченные функции. В СМЖ выявляют плеоцитоз от нескольких сотен до тысячи клеток в 1 мкл.
Остаточные явления при полиомиелитической форме характерны для всех больных. Отмечаются слабость мышц шеи и верхних конечностей, симптом «свисающей» головы, парез мышц верхних конечностей, гипотрофия мышц шеи, плечевого пояса, предплечий, межреберных мышц. При этой форме высока инва-лидизация больных. Полирадикулоневритическую форму диагностируют у 1-3% больных. Ведущие симптомы - мононевриты (лицевого и седалищного нервов), шейно-плечевой радикулоневрит, а также полирадикулоневрит с восходящим течением или без него. В клинической картине
преобладают невралгии, корешковые симптомы, болезненность мышц и нервов, периферические параличи или парезы. У больных появляются боли по ходу нервных стволов, парестезии (чувство «ползания мурашек», покалывание).
Двухволновая лихорадка встречается при всех формах заболевания, но чаще при менингеальной форме. Этот тип лихорадки более характерен для заболеваний, вызванных центрально-европейским и восточно-сибирским генотипами вируса. Для первой лихорадочной волны обязательно наличие выраженного инфекционно-токсического синдрома. Наблюдается острое начало, внезапное повышение температуры до 38-39 °С, сопровождающееся головной болью и общей слабостью. Спустя 5-7 дней состояние больных улучшается, температура тела нормализуется, но через несколько дней повторно повышается. Нередко на фоне второй волны у больных появляется менингеальный синдром.
Хроническое прогредиентное течение наблюдают у 1-3% больных. Хронические формы возникают спустя несколько месяцев, а иногда и лет после острого периода болезни, преимущественно при менингоэнцефалитической, реже - менингеаль-ной формах болезни.
Основная клиническая форма хронического периода - кожевниковская эпилепсия, которая выражается в постоянных миоклонических гиперкинезах, захватывающих прежде всего мышцы лица, шеи, плечевого пояса. Периодически, особенно при эмоциональном напряжении, происходит приступообразное усиление и генерализация миоклоний или переход их в большой тонико-клонический приступ с потерей сознания. Наблюдается также синдром хронического подо-строго полиомиелита, обусловленного медленно прогрессирующей дегенерацией периферических мотонейронов передних рогов спинного мозга, который клинически характеризуется нарастающими атрофическими парезами конечностей, в основном верхних, с постоянным снижением мышечного тонуса и сухожильных рефлексов.
Гиперкинетический синдром характеризуется появлением спонтанных ритмичных мышечных сокращений в отдельных мышечных группах паретических конечностей уже в остром периоде болезни. Нередко прогредиентные формы сопровождаются нарушениями психики вплоть до деменции. Часто клинические симптомы носят смешанный характер, когда прогрессирование гиперкинезов сочетается с нарастающей амиотрофией и, иногда, психическими нарушениями. По мере нарастания тяжести симптомов больные инвалидизируются.
В последние годы относительно редко наблюдаются тяжелые клинические формы острого периода, что не исключает развития в дальнейшем хронической прогредиентной формы болезни.
ДИАГНОСТИКА
Диагноз основан на анамнестических, клинико-эпидемиологических и лабораторных данных. Большое значение в эндемичных регионах придают посещению леса, парка, дачи в весенне-летний период, факту присасывания клеща, а также употреблению в пищу некипяченого козьего или коровьего молока.
Клиническая диагностика
Ранние клинические диагностические признаки заболевания - повышение температуры тела до 39-40 °С, ознобы, головная боль, головокружение, тошнота, рвота, общая слабость, боли в мышцах, суставах, пояснице.
При осмотре обращают внимание на наличие гиперемии лица, шеи и верхней части туловища, инъекцию сосудов склер, конъюнктивит и гиперемию ротоглотки. Больные вялые, адинамичные. Необходимо тщательно осмотреть кожные покровы, так как на месте
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
присасывания клещей могут оставаться точки или различных размеров гиперемированные пятна. У всех больных необходимо исследовать неврологический статус.
Лабораторная диагностика
В крови обнаруживают умеренный лимфоцитарный лейкоцитоз, иногда сдвиг влево с увеличением количества палочкоядерных лейкоцитов, повышение СОЭ. При двухволновом течении заболевания на первой волне у большинства больных наблюдается лейкопения с относительным лимфоцитозом, во время второй волны - лейкоцитоз с нейтрофильным сдвигом и повышение СОЭ. При менингеальных и очаговых формах заболевания в СМЖ обнаруживают лимфоцитарный плеоцитоз, от нескольких десятков до нескольких сотен клеток в 1 мкл.
Специфическая диагностика
При обращении за медицинской помощью лиц, пострадавших от укусов клещей, снятых с них членистоногих исследуют на вирусофорность с помощью экспресс-методов. У больных с подозрением на клещевой энцефалит проводят исследование крови с целью выявления вирусемии, а также парных проб сыворотки крови на специфические антитела. При эпидемиологическом расследовании групповых заболеваний (семейных вспышек) проверяют молоко коз, коров на зараженность вирусом.
Стандарт диагностики - ИФА, который позволяет отдельно определять общий пул антител к вирусу, IgG и IgM. Определение IgM важно для диагностики не только острых случаев заболевания, но и обострений хронического течения. IgG - следствие перенесенного заболевания или вакцинации. Альтернативным экспресс-методом для индикации и идентификации вируса является ПЦР, специфические фрагменты вирусного генома.
Для изоляции вируса из природного материала или от больных лиц используют методы заражения сосунков белых мышей, молодых мышей массой 5-6 г или клеточных культур. Идентификация вируса может осуществляться с использованием ряда серологических реакций или ПЦР.
Дифференциальная диагностика
Дифференциальную диагностику клещевого энцефалита проводят с тремя основными группами заболеваний:
◊другими трансмиссивными инфекциями, переносимыми иксодовыми клещами;
◊инфекционными болезнями с острым началом и выраженными общеинфекционными проявлениями; ◊ другими нейроинфекциями.
В регионах, эндемичных по клещевому энцефалиту, как правило, встречаются другие трансмиссивные инфекции: системный клещевой боррелиоз и клещевой риккетсиоз. Общее для этих инфекций - присасывание клеща в анамнезе, примерно одинаковые инкубационные периоды и наличие симптомов интоксикации в остром периоде. Схема дифференциальной диагностики иксодовых трансмиссивных инфекций представлена в табл. 21.49.

Примечание. «-» - данный симптом не встречается; «+» - данный симптом возможен; «++» - характерный симптом.
Одновременное заражение (от 0,5 до 5-10%) возбудителями клещевого энцефалита и боррелиями клещей I. persulcatus определяется существованием сопряженных природных очагов этих инфекций и возможностью развития у одного больного признаков обоих заболеваний, т.е. микст-инфекции. Для постановки диагноза микст-инфекции обязательно наличие клинических признаков двух инфекций. Диагноз клещевого энцефалита основан на характерной клинической картине заболевания и обнаружении в сыворотке крови IgM или нарастания титров IgG к вирусу клещевого энцефалита. Диагноз клещевого боррелиоза основан на клинической картине (мигрирующая эритема, синдром Баннварта, неврит лицевого нерва, полирадикулонейропатия, миокардит, полиартрит) и определении в сыворотке крови диагностических титров IgM к Borrelia burgdorferi или нарастании титров IgG в ИФА.
При дифференциальной диагностике клещевого энцефалита с гриппом необходимо учитывать сезонность заболевания, факт посещения леса, наличие контакта с клещами или факт переохлаждения, а также результаты лабораторных исследований.
ГЛПС от клещевого энцефалита отличают мучительные боли в поясничной области, выраженные изменения в клиническом анализе крови (с 3-5-го дня болезни нейтрофильный лейкоцитоз, сдвиг лейкоцитарной формулы влево, появление плазмоцитов, повышение СОЭ до 40-60 мм/ч) и развитие почечной недостаточности, характеризующейся олигурией, низкой относительной плотностью мочи, протеинурией.
При проведении дифференциальной диагностики менингеальных форм клещевого энцефалита с менингитами, вызванными другими вирусами (энтеровирусами,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
эпидемического паротита, герпесвирусами), прежде всего, необходимо обращать внимание на сезонность заболевания и указание в анамнезе на посещение леса, укусы и нападение клещей. Наряду с клинической симптоматикой заболевания, большое значение имеет ПЦР-диагностика.
Для туберкулезного менингита характерен продромальный период, постепенное развитие менингеальных симптомов с вовлечением в процесс черепных нервов. По мере нарастания менингеальных симптомов увеличивается вялость и адинамия, больные постепенно впадают в сопорозное состояние. Возбуждение встречается редко. Головная боль резко выражена. СМЖ вытекает под высоким давлением, плеоцитоз лимфоцитарный, содержание белка повышено, глюкозы - снижено. Характерно образование в СМЖ нежной пленки, иногда с наличием микобакте-рий туберкулеза, что окончательно уточняет диагноз. При рентгенологическом исследовании часто наблюдают различные изменения в легких туберкулезного характера. В анамнезе часто встречается туберкулез у самого больного или в его кружении.
Показания к консультациям специалистов
Все больные клещевым энцефалитом подлежат обязательной консультации врача-невролога. Больным с прогредиентным течением клещевого энцефалита амбулаторную и стационарную помощь оказывает невролог, при необходимости для консультаций привлекают врачейинфекционистов.
ЛЕЧЕНИЕ
Все больные с подозрением на клещевой энцефалит подлежат госпитализации в специализированное отделение инфекционной больницы с наличием ОРИТ.
Показан строгий постельный режим, независимо от общего состояния и самочувствия в течение всего лихорадочного периода и 7 дней после нормализации температуры. Специальная диета не требуется. В течение лихорадочного периода рекомендуют обильное питье: морсы, соки, гидрокарбонатные минеральные воды.
Этиотропное лечение назначают всем больным клещевым энцефалитом, независимо от ранее проведенной вакцинации или применения с профилактической целью противоэнцефалитного иммуноглобулина.
В зависимости от формы заболевания иммуноглобулин против клещевого энцефалита вводят внутримышечно в следующих дозах:
◊больным с лихорадочной формой: ежедневно в разовой дозе 0,1 мл/кг, на протяжении 3-5 дней до регресса общеинфекционных симптомов (улучшение общего состояния, исчезновение лихорадки). Курсовая доза для взрослых составляет не менее 21 мл препарата;
◊больным с менингеальной формой: ежедневно в разовой дозе 0,1 мл/кг 2 р/сут с интервалом 10-12 ч не менее 5 дней до улучшения общего состояния пациента. Курсовая средняя доза - 70-130 мл;
◊больным с очаговыми формами: ежедневно в разовой дозе 0,1 мл/кг 2-3 р/сут с интервалами 8-12 ч не менее 5-6 дней до снижения температуры и стабилизации неврологических симптомов. Курсовая средняя доза для взрослого составляет не менее 80-150 мл иммуноглобулина; ◊при крайне тяжелом течении заболевания разовая доза препарата может быть
увеличена до 0,15 мл/кг. Для лечения клещевого энцефалита используется также рибонуклеаза (РНК-аза), которая задерживает репликацию вируса в клетках нервной
системы, проникая через ГЭБ. Рибонуклеазу рекомендуют вводить в/м в изотоническом растворе натрия хлорида (препарат разводят непосредственно перед выполнением инъекции) в разовой дозе 30 мг через 4 ч. Суточная доза вводимого в организм фермента составляет 180
мг. Лечение продолжают в течение 4-5 дней, что обычно соответствует моменту нормализации температуры тела.
Эффективность использования в острый период препаратов ИФН-α2 и индукторов эндогенного ИФН изучена недостаточно. Тем не менее, некоторыми исследователями получены обнадеживающие результаты применения препаратов ИФН [реаферона, ИФН-α (Лейкинферон♠¤) и др.] в остром периоде клещевого энцефалита. Продолжается изучение использования аналогов нуклеозидов (нуклеоти-дов), например рибавирина. Неспецифические лечебные мероприятия направлены на борьбу с общей интоксикацией, отеком мозга, внутричерепной гипертензией, бульбарными расстройствами. Рекомендуют дегидратирующие средства (петлевые диуретики, манни-тол), 5% раствор декстрозы (Глюкоза♠), полиионные растворы; при дыхательных нарушениях - ИВЛ, ингаляция кислорода; для снижения ацидоза - 4% раствор натрия гидрокарбоната. При менингоэнцефалитической, полиомиелитической и полирадикулоневритической формах болезни назначают глюкокортикоиды. Преднизолон применяют в таблетках из расчета 1,5-2 мг/кг в сутки равными дозами в 4-6 приемов в течение 5-6 дней, затем дозу постепенно снижают на 5 мг каждые 3 дня (курс лечения 10-14 дней). При бульбарных нарушениях и расстройствах сознания преднизолон вводят парентерально. При судорожном синдроме назначают клоназепам, фенобарбитал, примидон, бензобарбитал, вальпрое-вую кислоту, диазепам. При тяжелом течении для профилактики бактериальных осложнений проводят антибактериальную терапию. Применяют ингибиторы про-теаз (апротинин). Хроническая форма клещевого энцефалита с трудом поддается терапии, эффективность специфических средств значительно ниже, чем в остром периоде. Рекомендуют общеукрепляющую терапию, глюкокортикоиды короткими курсами (до 2 нед) из расчета преднизолона по 1,5 мг/кг. Из противосудорожных препаратов при кожевниковской
эпилепсии применяют бензобарбитал, фенобарбитал, примидон. Целесообразно назначение витаминов, особенно группы В, при периферических параличах - антихолинэстеразных средств (неостигмина метил-сульфата, амбенония хлорида, пиридостигмина бромида).
В большинстве случаев клещевой энцефалит заканчивается выздоровлением. Прогноз при менингеальной и лихорадочной форме благоприятный. При менин-гоэнцефалитической, полиомиелитической и полирадикулоневритической - существенно хуже. В реконвалесцентном периоде в 20-50% случаях развивается астеническое состояние различной продолжительности - от нескольких недель до нескольких месяцев. Летальность при клещевом энцефалите связывают с развитием бyльбарного и судорожно-коматозного синдромов. Частота смертельных исходов зависит от генотипа циркулирующего вируса и варьирует от единичных случаев в Европе и европейской части России до 10% на Дальнем Востоке. При очаговых формах больные в большинстве случаях инвалидизируются. Примерные сроки нетрудоспособности
Больных с лихорадочными и менингеальными формами выписывают из стационара на 14-21- й день нормальной температуры при отсутствии менингеальных симптомов, больных с очаговыми формами - в более поздние сроки, после клинического выздоровления. Примерные сроки нетрудоспособности с учетом амбулаторного лечения и реабилитации составляют при лихорадочной форме 2-3 нед, менингеальной форме - 4-5 нед, менингоэнцефалитической, полирадикулонев-ритической - 1-2 мес, полиомиелитической - 1,5-3 мес.
Диспансерное наблюдение
Все перенесшие клещевой энцефалит, независимо от клинической формы, подлежат диспансерному наблюдению в течение 1-3 лет. Диспансеризацию больных (за исключением больных лихорадочной формой) проводят совместно с неврологом. Основание для снятия с диспансерного учета - полное восстановление
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
работоспособности, удовлетворительное самочувствие, полная санация СМЖ, отсутствие очаговой симптоматики.
Санаторно-курортное лечение
Санаторно-курортное лечение проводят не ранее 3-6 мес после выписки из стационара в санаториях климатического и общеукрепляющего профиля. С целью реабилитации используются дозированные физические нагрузки, бальнеотерапия, ЛФК, электропроцедуры.
Приложение к главе 21. Натуральная оспа
Натуральная оспа (лат. variola, variola major) - антропонозная, особо опасная вирусная инфекционная болезнь с аэрозольным механизмом передачи возбудителя, характеризующаяся тяжелой интоксикацией, двухволновой лихорадкой и везикулезнопустулезными экзантемой и энантемой.
Код по МКБ-10: B03 Оспа.
Этиология
Возбудитель натуральной оспы - крупный ДНК-содержащий вирус Orthopoxvirus
variola семейства Poxviridae рода Orthopoxvirus. Размеры кирпичеобразных вирионов - 250300×200×250 нм. Вирион имеет сложное строение (рис. 21.3). Снаружи расположена оболочка, которая формируется при выходе из клетки. Наружная липопротеидная мембрана, включающая гликопротеиды, собирается в цитоплазме вокруг сердцевины. Нуклеопротеидный комплекс, заключенный во внутреннюю мембрану, состоит из белков и одной молекулы двухцепочечной линейной ДНК с ковалентно замкнутыми концами.
Рис. 21.3. Вирион вируса натуральной оспы
Вирус имеет четыре основных антигена: ранний ES-антиген, формирующийся до начала синтеза вирусной ДНК; родоспецифический LS-антиген, относящийся к неструктурным полипептидам; группоспецифический нуклеопротеидный NP-антиген (продуцирует образование вируснейтрализующих антител), состоящий из ряда структурных полипептидов; видоспецифический гемагглютинин - гликопротеид, локализующийся в липопротеидной оболочке вириона.
Основные биологические свойства, имеющие значение при лабораторной диагностике натуральной оспы:
при размножении в цитоплазме эпителиальных клеток образуются специфические цитоплазматические включения - включения В (виросомы) или тельца Гварниери (рис. 21.4);
на хорион-аллантоисной оболочке куриных эмбрионов вирус размножается с образованием четко ограниченных мономорфных куполообразных оспин белого цвета (рис. 21.5);
обладает умеренной гемагглютинирующей активностью;
вызывает цитопатическое действие и феномен гемадсорбции в клетках перевиваемой линии почек эмбриона свиньи.
Рис. 21.4. Тельца Гварниери (цитоплазматические включения типа В)
Рис. 21.5. Оспины на хорион-аллантоисной оболочке куриных эмбрионов, вызванные вирусами оспы обезьян (1), натуральной оспы (2), вакцины (3) и оспы коров (4)
Возбудитель натуральной оспы высокоустойчив к воздействию факторов окружающей среды. В оспенных корках при комнатной температуре вирус сохраняется до 17 мес; при температуре -20 °С - 26 лет (срок наблюдения), в сухой среде при 100 °С инактивируется через 10-15 мин, при 60 °С - через 1 ч. Погибает под действием 1-2% раствора хлорамина через 30 мин, 3% раствора фенола - через 2 ч.
Эпидемиология
Источник и резервуар возбудителя - больной с последних дней инкубационного периода до полного выздоровления (максимальную опасность больные представляют с 3-8-го дня болезни).
Механизм заражения - аэрозольный. Передача возбудителя происходит воздушно-капельным или воздушно-пылевым путем. Факторы передачи: инфицированные вирусом воздух, пыль, нательное и постельное белье. Возможно заражение через конъюнктиву, поврежденную кожу; у беременных - трансплацентарное заражение плода. Эпидемическую опасность также представляют трупы умерших от оспы. Естественная восприимчивость людей достигает 95%. После перенесенного заболевания, как правило, развивается стойкий иммунитет, но возможно и повторное заболевание (у 0,1-1% переболевших). Натуральная оспа - высококонтагиозное заболевание. Высокий уровень заболеваемости с эпидемическим характером и циклическими подъемами через каждые 6-8 лет регистрировался в странах Африки, Южной Америки и Азии. Чаще заражались дети в возрасте 1-5 лет. В эндемичных странах подъем заболеваемости отмечался в зимне-весенний период.
Последний случай натуральной оспы в мире был зарегистрирован в Сомали 26 октября 1977 г. В 1980 г. было официально объявлено, что натуральная оспа ликвидирована в результате выполнения Глобальной программы ВОЗ по ликвидации натуральной оспы. В связи с риском преднамеренного высвобождения вируса натуральной оспы вследствие террористического акта глобального характера некоторые страны производили противооспенные вакцины с целью восполнения их запасов. Противооспенная вакцина на основе vaccinia вируса (VACV) - это единственная в настоящее время вакцина, с помощью которой была ликвидирована инфекционная болезнь человека. В 1980 г. ВОЗ сертифицировала ликвидацию оспы во всем мире. Комитет ВОЗ по ортопоксвирусным инфекциям в 1990 г. рекомендовал в виде исключения проводить вакцинацию исследователям, работающим с патогенными ортопоксвирусами (в том числе с вирусом натуральной оспы) в специализированных лабораториях и в очагах оспы обезьян.
При выявлении больных натуральной оспой или при подозрении на заболевание устанавливают режимно-ограничительные мероприятия (карантин) в полном объеме. Контактных лиц изолируют в специализированное обсервационное отделение на 14 дней. Для экстренной профилактики применяют метисазон и рибавирин (Виразол♠) в
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
терапевтических дозах с одновременным применением оспенной вакцины. В РФ вакцина не сертифицирована.
Патогенез
При аэрозольном механизме заражения поражаются клетки слизистой оболочки носоглотки, трахеи, бронхов и альвеол. В течение 2-3 дней вирус накапливается в легких и проникает в регионарные ЛУ, где активно реплицируется. По лимфатическим и кровеносным путям (первичная виремия) он попадает в селезенку, печень и свободные макрофаги лимфатической системы, в которых размножается. Через 10 дней развивается вторичная виремия, инфицируются клетки кожи, почек, ЦНС, других внутренних органов и появляются первые признаки болезни. Характерный для вируса тропизм к клеткам кожи и слизистых оболочек приводит к развитию типичных оспенных элементов. В паренхиматозных органах развиваются изменения дистрофического характера. При геморрагической оспе поражаются сосуды с развитием ДВС.
Клиническая картина
Инкубационный период длится в среднем 10-14 дней (от 5 до 24 дней). При вариолоиде - 1517 дней, при алястриме - 16-20 дней.
Классификация
Существует несколько клинических классификаций. Наибольшее распространение получила классификация Rao (1972), признанная комитетами ВОЗ (табл. 21.33), и классификация по степени тяжести клинических форм (табл. 21.34).

Примечание. * - элементы сыпи проходят характерную эволюцию (макула → папула → везикула → пустула → корки); ** - общее количество наблюдений - 3544; *** - общее количество наблюдений - 3398.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Основные симптомы и динамика их развития
Течение заболевания разделяют на четыре периода: продромальный (2-4-е сутки), период высыпаний (4-5-е сутки), период нагноения (7-10-е сутки) и реконвалесценции (30-40- е сутки). В продромальный период внезапно с ознобом повышается температура до 39-40 °С,
возникает сильная головная боль, миалгия, боль в поясничной области и животе, тошнота, иногда рвота. У некоторых больных на 2-3-и сутки в области бедренного треугольника Симона и грудных треугольников появляется кореподобная или скарлатиноподобная продромальная сыпь (rose rach). С 3-4-х суток болезни на фоне снижения температуры возникает истинная сыпь, свидетельствующая о начале периода высыпаний. Cыпь распространяется центробежно: лицо → туловище → конечности. Элементы сыпи проходят характерную эволюцию: макула (пятно розового цвета) → папула → везикула (многокамерные пузырьки с пупковидным втяжением в центре, окруженные зоной гиперемии) → пустула → корки. На одном участке сыпь всегда мономорфная. На лице и конечностях, включая ладонные и подошвенные поверхности, элементов экзантемы больше (рис. 21.6, 21.7). Энантема характеризуется быстрым превращением везикул в эрозии и язвы, что сопровождается болезненностью при жевании, глотании и мочеиспускании. С 7-9-х суток, в период нагноения, везикулы превращаются в пустулы. Резко повышается температура, нарастают явления интоксикации.
Рис. 21.6. Натуральная оспа в стадии пустул. Высыпания на кистях рук, включая ладони
Рис. 21.7. Сыпь у больного сливной формой натуральной оспы на 8-й день болезни
К10-14-м суткам пустулы начинают подсыхать и превращаться в желтовато-бурые, затем черные корки, что сопровождается мучительным кожным зудом.
К30-40-м суткам болезни, в период реконвалесценции, происходит шелушение, иногда пластинчатое, и отпадение корок с образованием рубчиков лучистого строения розового цвета, впоследствии бледнеющих, придающих коже шероховатый вид.
Осложнения
Первичные: ИТШ, энцефалит, менингоэнцефалит, панофтальмит.
Вторичные (связаны с присоединением бактериальной инфекции): ирит, кератит, сепсис, бронхопневмония, плеврит, эндокардит, флегмоны, абсцессы и др.
Летальность
Летальность при классической (обычной) натуральной оспе и алястриме (рис. 21.8) среди непривитых в среднем составляла соответственно 28 и 2,5%. При геморрагической и плоской оспе погибали 90-100% больных, при сливной - 40-60%, а при среднетяжелой - 9,5%. При вариолоиде, оспе без сыпи и оспе без температуры летальных исходов не зарегистрировано.
Рис. 21.8. Внешний вид больного алястримом ("белой оспой") на 4-й день болезни при возникновении экзантемы
Диагностика
Вирусологическое исследование соскобов с папул, содержимого элементов сыпи, мазков изо рта, из носоглотки проводят на куриных эмбрионах или чувствительных клеточных культурах с обязательной идентификацией в РН. Для выявления антигенов вируса в исследуемом материале и обнаружения специфических антител в сыворотке крови, взятой при госпитализации и через 10-14 сут, используют ИФА.
Дифференциальная диагностика
Натуральную оспу необходимо дифференцировать с ветряной оспой (рис. 21.9, 21.10), оспой обезьян (рис. 21.11), везикулезным риккетсиозом (отличается первичным аффектом и регионарным лимфаденитом), пузырчатками неясной этиологии (характерен симптом Никольского и наличие в мазках-отпечатках акантолитических клеток); в продромальный период и при оспенной пурпуре - с лихорадочными заболеваниями, сопровождающимися мелкоточечной пятнистой или петехиальной сыпью (менингококкемия, корь, скарлатина, ГЛ) (табл. 21.35).
Рис. 21.9. Экзантема при натуральной оспе на 9-й день болезни (1) и при ветряной оспе
(2)
Рис. 21.10. Полиморфизм элементов экзантемы при ветряной оспе Рис. 21.11. Оспа обезьян у человека
Таблица 21.35. Дифференциально-диагностические признаки натуральной оспы, оспы обезьян и ветряной оспы
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Признак |
Нозологические формы |
|
|
|
натуральная оспа |
ветряная оспа |
оспа обезьян |
||
|
||||
Особенности продромального периода |
|
|
||
Длительность |
2-4 дня |
1-2 дня |
2-3 дня |
|
Температура тела |
39,0-40,0 °С |
37,5-38,5 °С |
38,0-39,5 °С |
|
Головная боль |
Сильная |
Умеренная |
Сильная |
|
Боль в поясничной области и |
Сильная |
Умеренная (у детей не Нет |
||
крестце |
|
бывает) |
|
|
Боль в горле |
Нет |
Нет |
Умеренная |
|
Лимфаденит |
Нет |
Нет |
Регионарный ( |
|
|
|
|
двусторонний) |
|
Генерализованная ЛАП |
Нет |
Нет |
Иногда |
|
Продромальная сыпь |
На 2-3-й день |
Нет |
Чаще - нет, ред |
|
Характер типичной экзантемы |
|
день |
||
|
|
|||
Сроки появления от начала |
4-5-й день |
2-3-й день |
2-4-й день |
|
болезни |
|
|
|
|
Температурный фон |
Снижение температуры тела |
Повышение |
Снижение тем |
|
Этапность появления |
На лице, затем - на предплечьях, |
На любых участках |
На лице, затем |
|
элементов |
туловище, конечностях, ладонях и |
тела, кроме ладоней и |
туловище, коне |
|
|
подошвах |
подошв |
ладонях и подо |
|
Однотипность элементов |
Мономорфная |
Полиморфная |
Мономорфная |
|
Вторичные подсыпания |
Нет |
3-4 волны через 24- |
Нет |
|
|
|
48 ч |
|
|
Эволюция развития |
Макула → папула → многокамернаяМакула → папула → |
Макула → пап |
||
элементов сыпи |
везикула → пустула → корки → |
везикула → пустула |
везикула → пу |
|
Биологические маркеры |
рубец |
(очень редко) → корки корки → рубец |
||
|
|
|
||
Внутриклеточные включения Цитоплазматические - тельца |
Ядерные - тельца |
Цитоплазматич |
||
|
Гварниери |
Арагао |
включения В |
|
Поражения на хорион- |
Мономорфные белые |
Не образуются |
Мелкие с цент |
|
аллантоисной оболочке |
куполообразные четко |
|
геморрагией; к |
|
куриных эмбрионов |
отграниченные |
|
единичные |
|
Предельная температура |
38,5 °С для O. variola var. |
- |
39,0 °С |
|
развития оспин на хорион- |
majoris (37,5 °С для O. variola var. |
|
|
|
аллантоисной оболочке |
manoris - вируса алястрима) |
|
|
|
Гемагглютинирующая |
Слабо выражена |
Отсутствует |
Высокая |
|
активность |
|
|
|
|
Цитопатическое действие и |
Да |
Нет |
Нет |
|
феномен гемадсорбции при |
|
|
|
|
культивировании |
|
|
|
|
Больные госпитализируются на 40 дней от начала болезни. Режим постельный (длится до отпадения корочек). Для уменьшения зуда кожи рекомендуются воздушные ванны. Диета - механически и химически щадящая (стол № 4).
Медикаментозная терапия
Этиотропная терапия:
метисазон по 0,6 г (дети - по 10 мг на 1 кг массы тела) 2 раза в день в течение 4-6 сут;
рибавирин (Виразол♠) - по 100-200 мг/кг 1 раз в сутки в течение 5 дней;
иммуноглобулин противооспенный - по 3-6 мл в/м;
профилактика вторичной бактериальной инфекции - полусинтетические пенициллины, макролиды, ЦС.
Патогенетическая терапия: сердечно-сосудистые препараты, витаминотерапия, десенсибилизирующие средства, глюкозо-солевые и полионные растворы, ГК.
Симптоматическая терапия: анальгетики, снотворные препараты, местная обработка: полости рта 1% раствором натрия гидрокарбоната 5-6 раз в день, а перед едой - 0,1-0,2 г бензокаина (Анестезин♠), глаз - 15-20% раствором сульфацетамида (Сульфацил натрия♠) 3-4 раза в день, век - 1% раствором борной кислоты 4-5 раз в день, элементов сыпи - 3-5% раствором калия перманганата. В период образования корочек для уменьшения зуда применяют 1% ментоловую мазь.
Прогноз
Зависит от клинической формы.
Диспансерное наблюдение
Не регламентировано.
Приложение к главе 21. Медленные инфекции центральной нервной системы
Медленные инфекции ЦНС - группа инфекционных болезней человека и животных, вызываемых вирусами и прионами, которая характеризуется медленным (годы и десятилетия) развитием с прогрессирующим поражением ЦНС, приводящим к летальному исходу.
Патоморфологически эти заболевания объединяло наличие поражения ЦНС в виде губкообразного состояния серого и белого вещества головного мозга (status spongiosus) без признаков воспаления, сопровождающегося образованием амилоида и выраженным глиозом. Возможность трансмиссии (передачи) заболевания от больного организма здоровому позволила назвать всю группу "трансмиссивные губкообразные энцефалопатии" (ТГЭ), или "трансмиссивные спонгиоформные энцефалопатии" (ТСЭ). Обнаружение у возбудителей ТГЭ--признаков, характерных для вирусов (возможность персистенции в культуре клеток, полученных из больного организма, неспособность размножения на искусственных питательных средах, способность проходить через бактериальные фильтры с диаметром пор от 25 до 100 нм) поддерживало теорию вирусной этиологии заболевания. Однако наличие у возбудителей трансмиссивных губкообразных энцефалопатий свойств, не имеющих аналогий с известными вирусами (беспрецедентная устойчивость к действию физических и химических факторов), позволило считать, что эту группу болезней вызывают "необычные вирусы". В связи с этим некоторое время (с 1977 по 1985 г.) в группе медленных инфекций
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
выделяли инфекции, вызываемые обычными и "необычными вирусами" (Gajdusek D., 1985). Развитие медицинской вирусологии и молекулярной биологии позволило сделать следующий шаг в изучении медленных инфекций в период с 1985 по 1997 г. (Oesch B., Prusiner S.B.), и теория "необычных вирусов" была опровергнута. Американский биохимик S.B. Prusiner в 1997 г. окончательно доказал, что инфекционный агент скрепи является модифицированной изоформой нормального белка организма хозяина, кодируемого геномом организма хозяина и не содержащего в своем составе нуклеиновых кислот. S.B. Prusiner назвал этот инфекционный агент прионом (от англ. словосочетания "protein only infectious agent"). Таким образом был идентифицирован новый класс инфекционных агентов, так как была открыта принципиально новая группа этиологических агентов инфекционных болезней человека и животных, не нуждающихся для репродукции в нуклеиновых кислотах, а использующих для воспроизведения гены и белки инфицированного организма.
По этиологическому признаку и особенностям патогенеза и патоморфологии все медленные инфекции разделяют на две группы:
1)вызванные вирусами: подострый склерозирующий панэнцефалит, прогрессирующий краснушный панэнцефалит, лимфоцитарный хориоменингит, медленная инфекция ЦНС у инфицированных ВИЧ, ПМЛ;
2)вызванные белками - прионами: спорадическая болезнь Крейтцфельдта-Якоба, наследственная (семейная) болезнь Крейтцфельдта-Якоба, семейная смертельная бессонница, синдром Герстмана-Штрейсслера-Шейнкрена, куру, ятрогенная болезнь Крейтцфельдта-Якоба, новый вариант болезни Крейтцфельдта-Якоба.
Медленные инфекции, вызываемые вирусами
При расширенном понимании медленных инфекций к ним с достаточным основанием могут быть отнесены и заболевания, вызываемые известными вирусами, которые, персистируя в организме, провоцируют развитие иммунопатологического процесса с воспалительной реакцией в ЦНС (коревые энцефалиты, энцефалиты, вызываемые вирусом краснухи, и др.).
В группу истинно медленных инфекций можно отнести болезни, при которых инфекционный агент вызывает в основном дегенеративные изменения ЦНС с нерезко выраженной воспалительной реакцией на фоне сниженного иммунного ответа организма (СПИД, подострый склерозирующий панэнцефалит, прогрессирующая мультифокальная лейкоэнцефалия).
Медленные вирусные инфекции чаще развиваются, если заражение произошло внутриутробно (вирусы краснухи, кори, герпеса, аденовирусы, цитомегаловирусы) или ребенок заразился на первом году жизни (корь). В этом случае остаточный материнский иммунитет снижает ответную реакцию иммунной системы, а вирус, продолжая находиться в ЦНС и будучи защищенным от иммунного надзора, обусловливает развитие хронического прогрессирующего инфекционного процесса.
Подострый склерозирующий панэнцефалит (ПСПЭ) (лейкоэнцефалит Ван-Богарта, узелковый панэнцефалит Петте-Деринга, энцефалит с включениями Даусона).
Код ПО МКБ-10
A81.1
Этиология и эпидемиология ПСПЭ. Возбудителем является вирус кори, который был обнаружен в мозговой ткани больных ПСПЭ. ПСПЭ болеют дети и подростки, перенесшие корь в первые 15 мес жизни. Заболеваемость ПСПЭ - 1 на 1 млн.
Патогенез. В основе патогенеза лежит персистенция вируса кори в клетках головного мозга после перенесенной болезни, которая, в свою очередь, является следствием нарушения иммунологических механизмов. Вследствие репродукции вируса в ЦНС активизируются аутоиммунные процессы, происходят повреждение и гибель нейронов, медленное разрушение интеллекта, двигательные нарушения, всегда летальный исход.
Патоморфология. В веществе мозга находят энцефалит c наличием глиозных узелков ("узелковый панэнцефалит"). Ван-Богартом была выявлена демиелинизация в подкорковых образованиях (лейкоэнцефалит). Даусон находил особые ядерные включения в комплексе с глиозной пролиферацией. При патологоанатомическом исследовании видно, что изменения локализуются преимущественно в сером и белом веществе полушарий мозга, стволе мозга и мозжечке. Микроскопически обнаруживают периваскулярную лимфомоноцитарную инфильтрацию, повреждение и дегенеративные изменения нейронов, пролиферацию глии.
Клиническая картина. Болезнь развивается обычно в возрасте 5-15 лет. Неврологический статус характеризуется двигательными нарушениями в виде гиперкинезов, изменений мышечного тонуса, трофическими, вегетативными расстройствами и эпилептическими приступами. Наряду с этим развивается быстро прогрессирующее слабоумие.
Выделяют 4 стадии заболевания. Первая стадия продолжительностью 2-3 мес проявляется недомоганием, эмоциональной лабильностью и неврозоподобной симптоматикой в виде повышенной раздражительности, тревожности, а также нарушением сна. У больного меняется поведение (уходы из дома, психопатоподобные реакции). К концу этой стадии отмечается нарастание сонливости, выявляются расстройства речи (дизартрия и афазия), нарушения координации движений - апраксия, расстройства письма - аграфия, агнозия, постепенно снижается уровень интеллекта, прогрессирует утрата памяти. Вторая стадия болезни проявляется гиперкинезами в виде подергиваний всего туловища, головы, конечностей, миоклонии. Далее к этим расстройствам присоединяются генерализованные эпилептические приступы и пирамидная симптоматика. Появляется двоение в глазах, развиваются гиперкинезы, спастические параличи, больной перестает узнавать предметы, возможна потеря зрения. Третья стадия болезни (6-8 мес от начала болезни) характеризуется прежде всего тяжелыми нарушениями дыхания, глотания, гипертермией и непроизвольным криком, плачем, смехом. В четвертой стадии присоединяются такие проявления болезни, как опистотонус, децеребрационная ригидность, сгибательные контрактуры, а также слепота. В финале болезни больной впадает в коматозное состояние, появляются трофические расстройства. Болезнь заканчивается летальным исходом, который наступает не позднее 2 лет от ее начала. Хронические формы более редки. В этих случаях в течение 4-7 лет выявляются разные формы гиперкинезов, нарастающей тяжести и явления слабоумия.
Диагностика. В крови и СМЖ обнаруживается высокий уровень антител к вирусу кори. На ЭЭГ, как правило, выявляются неспецифические изменения.
Профилактика кори одновременно является профилактикой ПСПЭ. У вакцинированных против кори заболеваемость ПСПЭ в 20 раз меньше.
Прогрессирующий краснушный панэнцефалит
При заражении беременной женщины вирусом краснухи происходит его проникновение через плаценту в ткани плода, где, активно размножаясь, он вызывает грубые и зачастую несовместимые с жизнью нарушения в органах и тканях. Возможно и длительное присутствие вируса в организме внешне здорового новорожденного, а затем, спустя много месяцев или лет, персистирующий вирус способен вызывать у ребенка развитие прогрессирующего краснушного панэнцефалита. Эта медленная вирусная инфекция имеет сходство с ПСПЭ и проявляется в течение второго десятилетия жизни комплексом
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
постепенно прогрессирующих нарушений двигательной и умственной функции с неизбежным смертельным исходом.
Лабораторная диагностика: используют реакцию торможения гемагглютинации, флюоресцирующие антитела, РСК, серологическая диагностика включает выявление специфических IgМ к вирусу краснухи. Профилактика. Необходима вакцинация 8-9-летних девочек. Применяются убитые и живые вакцины.
Лимфоцитарный хориоменингит
МКБ-10 A87.2.
Лимфоцитарный хориоменингит - вирусная инфекция, сопровождающаяся преимущественным поражением мозговых оболочек и сосудистых сплетений ЦНС. Возбудитель лимфоцитарного хориоменингита относится к семейству аренавирусов и передается человеку от грызунов. Заражение человека происходит вследствие употребления в пищу продуктов, загрязненных экскрементами грызунов, чаще всего домовых мышей.
Патоморфология. В отдельных летальных случаях при патоморфологическом исследовании выявлено расширение периваскулярных пространств бульбарного отдела мозга, регистрируется сосудистый стаз в коре и стволе мозга. Воспалительные явления затрагивают оболочки, эпендиму и сосудистые сплетения мозга, где выявляется лимфоцитарная инфильтрация.
Болезнь развивается в двух формах - острая инфекция и медленная форма лимфоцитарного хориоменингита. При острой форме, протекающей в форме серозного менингита, наблюдаются озноб, сильная головная боль, тошнота, рвота, длительная лихорадка до 3940 °С. Течение менингита обычно благоприятное, улучшение состояния и санация ликвора наблюдаются на 3-4-й неделе болезни.
Медленная форма лимфоцитарного хориоменингита также характеризуется острым началом, развитием менингеального синдрома на фоне высокой лихорадки. Острая стадия сменяется постепенным улучшением состояния, но затем вновь нарастает слабость, появляется головокружение, развивается атаксия и быстрая утомляемость. Постепенно присоединяются головные боли, ослабление памяти, изменение характера, угнетение психической деятельности, признаки поражения черепных нервов. Заболевание может продлиться до 10 лет и сопровождаться развитием парезов и параличей с последующим летальным исходом.
Профилактика. Дератизация.
Патогенез медленной формы инфекционного процесса при внутриутробном заражении плода вирусом лимфоцитарного хориоменингита точно неизвестен. Однако известно, что при этой форме развивается менингоэнцефалит, эпендиматит, появляются сращение мозговых оболочек, заращение ликворопроводящих путей с развитием гидроцефалии и выраженная лимфоклеточная инфильтрация. В ликворе выявляются высокие титры антител к вирусу лимфоцитарного хориоменингита. Как правило, обнаруживаются явления энцефаловаскулита и дегенеративные изменения. Гидроцефалия выявляется при рождении ребенка или развивается на 1-9-й неделе жизни. Часто синдром гидроцефалии сочетается с хориоретинитом. Дети обычно мало реагируют на окружающее, лежат в вынужденной позе с приведенными к туловищу руками, вытянутыми и скрещенными ногами. Летальный исход может наступить в течение нескольких месяцев после рождения или через 2-3 года.
Медленная инфекция центральной нервной системы при инфицировании вирусом иммунодефицита человека
СПИД, вызываемый ВИЧ, характеризуется поражением ЦНС, которое можно также отнести к медленным инфекционным процессам в ЦНС. Патогенез поражения ЦНС при нейроСПИДе связан с непосредственным нейротоксическим действием вируса, а также с патологическим действием цитотоксических Т-клеток и антимозговых антител.
Патоморфологически возможно выявление атрофии мозга с характерными спонгиоформными изменениями (губчатость мозгового вещества) и демиелинизацией в разных структурах. Особенно часто такие изменения отмечаются в семиовальном центре, белом веществе полушарий и реже - в сером веществе, подкорковых образованиях. Наряду с выраженной гибелью нейронов наблюдаются астроглиальные узелки. Прямое поражение мозга при ВИЧ-инфекции характеризуется развитием подострого энцефалита с участками демиелинизации.
Клинически отмечается так называемый ВИЧ-ассоциированный познавательнодвигательный комплекс, включающий три заболевания: ВИЧ-ассоциированную деменцию (согласно МКБ-10, регистрируется под кодом B22.0), ВИЧ-ассоциированную миелопатию и ВИЧ-ассоциированные минимальные познавательно-двигательные расстройства.
Для ВИЧ-деменции (включается СПИД-комплекс деменции, ВИЧ-энцефалопатия или подострый энцефалит) характерны замедление психомоторных процессов, невнимательность, снижение памяти, медлительность, трудности в концентрации внимания, решении задач и чтении. Часты апатия, снижение спонтанной активности и социальная отгороженность. В некоторых случаях заболевание может выражаться в атипичных аффективных расстройствах, психозах или припадках. Неврологическое обследование обнаруживает тремор конечностей, нарушение быстрых повторных движений, нарушения координации, атаксию, мышечную гипертензию, генерализованную гиперрефлексию, парезы глазодвигательных нервов. При последующем прогрессировании деменции возможно присоединение очаговых неврологических симптомов, двигательных нарушений - экстрапирамидных, гиперкинезов, нарушений статики, координации движений. В период развернутой картины деменции возможны также грубые аффективные расстройства, расстройства влечений и регресс поведения в целом. При преимущественной локализации процесса в лобной доле формируется вариант деменции с мориоподобным (дурашливым) поведением.
При ВИЧ-ассоциированной миелопатии преобладают двигательные расстройства, связанные с поражением спинного мозга. Для ВИЧ-ассоциированного поражения ЦНС характерно несоответствие тяжести клинических проявлений и выраженности патоморфологических изменений. У ряда больных с отчетливыми клиническими проявлениями ВИЧассоциированной деменции патоморфологически может быть выявлено только "побледнение" миелина и слабовыраженный центральный астроглиоз.
ПМЛ. Синоним - субкортикальная энцефалопатия, ПМЛ-заболевание ЦНС, развивающееся при иммунодефицитных состояниях.
Код по МКБ-10. A81.2.
Этиология. ПМЛ - заболевание, вызываемое вирусом
JC семейства Papovaviridae рода Polyomavirus. Впервые вирус был выделен в 1971 г. Педжетом из тканей мозга больного, страдавшего ПМЛ, и был назван по инициалам этого пациента. Пути передачи инфекционного агента изучены недостаточно, считается, что возбудитель может передаваться как воздушно-капельным, так и фекально-оральным путем. В подавляющем большинстве случаев инфекция протекает бессимптомно, несмотря на то что
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
инфицировано около 75% взрослого населения. Достаточно редко у лиц с иммунодефицитами на фоне СПИДа, лимфомы, лейкемии, саркоидоза, туберкулеза, фармакологической иммуносупрессии вирус JC вызывает развитие ПМЛ. Вирус JC проявляет выраженный нейротропизм и избирательно инфицирует клетки нейроглии (астроциты и олигодендроциты), что обусловлено наличием специфических клеточных факторов, активирующих промоторы в геноме возбудителя. Мутации гена-промотора вируса - один из основных механизмов, детерминирующих повышение тропности вируса к глиальным клеткам и, соответственно, к тканям ЦНС. Это объясняет тот факт, что заболевание развивается только у небольшой части инфицированных лиц при наличии иммунодефицита.
Патоморфология. Обнаруживают множественные очаги демиелинизации в полушариях большого мозга, стволе и мозжечке с максимальной плотностью на границе серого и белого вещества.
Клиническая картина. Постепенное начало. Течение прогрессирующее. Появляется слабость, отмечается гемианопсия или другие изменения полей зрения. В клинической картине преобладают нарушения высших мозговых функций и расстройства сознания с последующей грубой деменцией. Заболевание заканчивается летальным исходом в течение 1-6 мес.
Диагностика: состав СМЖ в норме, КТ и МРТ выявляют очаги пониженной плотности в белом веществе мозга, в биоптатах мозговой ткани обнаруживают вирусные частицы (электронная микроскопия), выявление антигена иммуноцитохимическим методом, выявление фрагментов вирусного генома (в СМЖ методом ПЦР). Вирус JC размножается в культуре клеток приматов.
Лечение. Эффективное лечение отсутствует.
Прионные болезни
Прионные болезни относят к группе нейродегенеративных заболеваний человека и животных, которые представляют собой прогредиентные формы поражений мозга.
Код по МКБ-10: A81.9.
Этиология
Этиологическим агентом прионных болезней человека и животных является белковая молекула, названная прионом и являющаяся конформером (конформационной формой) нормального клеточного белка, обнаруживаемого в организме всех млекопитающих и человека. В организме человека ген, кодирующий синтез клеточного прионного белка, локализован в 20-й хромосоме и обозначается как PRNP. Неинфекционный, клеточный прионный белок принято обозначать как PrPC ("c" - начальная буква англ. слова "cell", клетка). Клеточный прионный белок участвует в передаче физиологических сигналов, взаимодействуя с компонентами синапсов, т.е. принимает участие в функционировании сигнальных систем клеток, в частности нейронов. Полупериод жизни PrPC составляет 4-6 ч.
Для обозначения конформационной формы клеточного прионного белка, имеющей инфекционные свойства, используют буквосочетание PrPSc. Инфекционность прионного белка обозначают первые буквы наиболее распространенной в природе прионной болезни скрепи - "Sc" (scrapie). Инфекционные формы прионов являются низкомолекулярными (молекулярная масса 27-30 кДа) белковыми частицами, иногда обозначаемыми как PrP27-30, длина полипептидной цепи составляет 253-254 аминокислотных остатков.
Поскольку было показано, что инфекционный прионный белок отличается от обычного третичной структурой, т.е. конформационно, вскоре появилось новое понятие - "конформационные болезни" (R.W. Carrel). Этим термином стали обозначать болезни,
вызываемые изменением третичной структуры белков, т.е. нарушением исходной пространственной организации белковых молекул, свойственной здоровому организму. "Конформационные болезни" характеризуются тем, что вследствие изменения конститутивных белков они (белки) могут превратиться из жизненно необходимых в смертельно опасные и вызывать фатальные для организма последствия.
Механизм репродукции и скорость репродукции инфекционных прионов
Процесс накопления инфекционного прионного белка обусловлен прежде всего необходимостью контакта двух молекул - исходного белка PrPC и инфекционного прионного белка PrPSc. В процессе взаимодействия с нормальным клеточным белком
PrPC инфекционный белок индуцирует в нем структурные (конформационные) изменения и превращает его в себе подобный, необратимо инфекционный белок. Таким образом, процесс накопления инфекционного прионного белка происходит не в результате синтеза в зараженном организме молекул PrPSc, а вследствие конформационных изменений уже присутствующих в организме нормальных молекул PrPC. Количество образующихся молекул PrPSc полностью зависит от количества синтезируемых в организме нормальных молекул PrPC, т.е. от экспрессии гена PRNP, кодирующего PrPC. Процесс накопления инфекционного прионного белка носит лавинообразный характер, так как каждая претерпевшая конформацию молекула делает себе подобную, и на следующем этапе две инфекционные частицы конформируют еще две нормальные молекулы, образуется уже четыре инфекционных частицы и т.д., в геометрической прогрессии.
Длительность инкубационного периода прионных инфекций обусловлена инфицирующей дозой и скоростью синтеза PrPC в клетках. Если клетки инфицируются одиночными инфекционными молекулами, число молекул PrPSc, образующихся в течение суток, достигает 500-1000, в течение года до 500 тыс. Это неизмеримо меньше по сравнению со скоростью размножения бактерий и вирусов (многие миллионы частиц в течение часов). Даже с учетом репродукции прионов в геометрической прогрессии число инфекционных молекул, образующихся в течение года, ничтожно мало по сравнению с количеством нейронов в головном мозге человека (приблизительно 1048 нейронов).
Необходимо отметить, что прионы различных видов животных имеют достаточно серьезные отличия в первичной структуре. Поскольку инфекционный прион только инициирует процесс конверсии нормального клеточного гомолога в PrPSc, в результате инфекционного процесса появляются прионы со свойственной только этому виду первичной структурой. Получены молекулярно-биологические доказательства преодоления прионами межвидовых барьеров и способности адаптироваться к новому хозяину, т.е. доказана возможность передачи возбудителя прионных инфекций от животных к человеку.
Морфология прионов
Прионы в инфицированных клетках обнаруживаются преимущественно в микросомальной фракции. Морфологически прионы в тканях организма представлены полимерной формой (агрегированные молекулы инфекционного прионного белка PrP27-30) и выглядят как палочковидные элементы (фибриллы). Эти элементы полиморфны и могут быть гладкими, лентообразными и скрученными спиралевидными структурами. По ультраструктурным и гистохимическим свойствам они идентичны амилоиду, но этот амилоидоподобный материал неинфекционен, так как инфекционными свойствами обладают только индивидуальные молекулы прионов. Фибриллы прионов имеют длину от 25 до 550 нм и диаметр 11 нм.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Физико-химические свойства прионов
Для прионов характерен необычно высокий уровень резистентности к химическим и физическим факторам, нетипичный даже для термостабильных белков. Прионы стабильны при температуре 90 °С в течение 30 мин и инактивируются только при автоклавировании в течение 30 мин при 135 °С. Инфекционные молекулы прионов гидрофобны и имеют выраженную тенденцию к агрегации между собой и с клеточными белками и структурами. Прионы (PrPSc) резистентны к альдегидам, нуклеазам, органическим растворителям, неионным и ионным детергентам, УФ-облучению и ионизирующей радиации.
Биологические свойства прионов
Первично репродукция прионов осуществляется в дендритных клетках, лимфатических железах, селезенке и тимусе. PrPSc аккумулируется в клетках, накапливаясь в цитоплазматических везикулах. Прионы могут распространяться путем аксонального транспорта, из селезенки через грудной лимфатический проток и далее по нервным стволам, наступает поражение головного мозга и верхних отделов спинного мозга. Штаммовые различия проявляются в длительности инкубационного периода, топографии поражаемых структур мозга, специфичности по отношению к хозяину. Однако, как уже было сказано выше, прионы способны адаптироваться к новому хозяину, т.е. преодолевать межвидовые барьеры. Получены доказательства существования генетического контроля повышенной резистентности и чувствительности к прионам.
Течение инфекционного процесса
Наблюдается очень длительный инкубационный период. Характерно полное отсутствие иммунного ответа организма-хозяина на инфекцию. Течение инфекции хроническое, прогрессирующее, без ремиссий.
Основные факторы патогенности прионов
Прионы индуцируют апоптоз инфицированных клеток. Доказана способность молекул PrPSc создавать блокаду репликации генома митохондрий и вызывать их дегенерацию. Накопление PrPSc в синаптических структурах и связанная с этим дезорганизация синапсов, возможно, являются причиной развития глубоких неврологических дефектов и деменции.
Патоморфология
В морфологическом плане отмечаются общие черты у всех прионных болезней. Вследствие повреждающего действия прионов происходят вакуолизация и гибель нейронов, в результате чего мозг визуально выглядит подобно губке (спонгиоформное перерождение).
Макроскопически определяется атрофия головного мозга. Гистологически выявляются спонгиоформная дегенерация, атрофия и утрата нервных клеток, разрастание глии (астроцитарный глиоз), гибель волокон белого вещества (лейкоспонгиоз), амилоидные бляшки, содержащие прионный белок, а также отсутствие воспалительных реакций. Заболевания данной группы патогистологически отличаются соотношением интенсивности спонгиоза, амилоидоза и глиоза в мозговой ткани, кроме того, у каждой из этих болезней имеются существенные клинико-эпидемиологические особенности.
Профилактика
Методы дезинфекции, рекомендованные в практической деятельности стационаров и направленные на инактивацию прионов
В отношении прионов эффективность способа инактивации может считаться доказанной только после обработки инфекционного материала инактивирующими агентами с последующим заражением интрацеребрально лабораторных животных этим обработанным образцом. Поскольку до сих пор не достигнуто единого мнения по вопросу о максимальной продолжительности инкубационного периода, пока невозможно и судить об отсутствии остаточной инфекционной активности обработанного инактиваторами образца. В настоящее время нет законодательно принятой методики титрования инфекционной активности прионов.
ВОЗ на современном этапе рекомендует три типа обработки неодноразового медицинского инструментария:
физическая обработка: автоклавирование при 134-138 °С в течение 18 мин;
химическая обработка: замачивание в 1 н растворе NаOH в течение 1 ч при 20 °С;
химическая обработка: замачивание в 2,5-12,5% растворе хлорной извести в течение 1 ч при 20 °С.
Признано, что определенный риск представляет обработка патологоанатомических образцов, поэтому персоналу лабораторий строжайше вменяется в обязанность сжигать любой одноразовый инструментарий наряду с образцами исследуемого материала.
Использованные материалы, связанные с лечением пациента с болезнью КрейтцфельдтаЯкоба (БКЯ) или больного, входящего в группу риска заражения БКЯ, немедленно сжигаются.
На эндоскопическое оборудование должен быть наложен карантин в случае подозрения на БКЯ у пациента. При любом порезе или проколе кожи медработника во время выполнения медицинских манипуляций больному рекомендуется обработка раны 12,5% раствором хлорной извести в течение 5-10 мин после тщательного промывания. При любом попадании в глаза зараженного материала необходимо тщательное и длительное промывание глаз водой или изотоническим раствором натрия хлорида.
Экстренная профилактика заражения персонала не разработана.
Классификация
У человека определены четыре нозологических варианта прионных болезней, которые манифестируют в виде спорадических, наследственных и инфекционных форм:
1)БКЯ - может регистрироваться спорадическая, наследственная и инфекционная формы;
2)cиндром Герстмана-Штреусслера-Шейнкера - наследственная форма;
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
3)семейная смертельная бессонница - наследственная форма;
4)куру - инфекционная форма.
Все прионные болезни человека относятся к медленным нейроинфекциям из группы подострых губкообразных энцефалопатий, характеризующихся прогрессирующими тяжелыми поражениями ЦНС и всегда заканчивающихся летально.
Спорадическая болезнь Крейтцфельдта-Якоба
Код по МКБ-10: A81.0.
Спорадическими называют отдельные, разрозненные, эпидемиологически не связанные ни с установленным общим источником, ни с определенным единым путем или фактором передачи возбудителя БКЯ.
Общая заболеваемость одинакова во всех регионах мира и составляет 0,3-1 случай на 1 млн жителей. Впервые болезнь обнаружена в Германии в начале 1920-х годов и получила
название по именам впервые описавших ее врачей. Не установлено связи спорадической БКЯ с особенностями распространения скрепи у овец, так как спорадическая БКЯ встречается с одинаковой частотой в Австралии и Новой Зеландии, где скрепи не регистрируется, и в Англии, эндемичной по скрепи. Заболевание обычно регистрируется в старшей возрастной группе, максимально в 60-65 лет. Средняя продолжительность жизни с момента появления признаков болезни 8 мес, 90% больных умирают в течение первого года болезни. Продромальные симптомы отмечаются у 1/3 больных за несколько недель или месяцев до появления кардинального признака БКЯ - прогрессирующей деменции. В продромальном периоде больные жалуются на астению, нарушение сна и аппетита, потерю либидо. Первые проявления заболевания выражаются в виде зрительных нарушений, иногда заболевание дебютирует мозжечковой атаксией. Члены семьи заболевшего замечают изменения в поведении больного в виде апатии, паранойи, деперсонализации, эмоциональной лабильности. Классическим клиническим проявлением БКЯ является прогрессирующая деменция в сочетании с миоклонией. На ЭЭГ выявляются типичные периодические комплексы, состав СМЖ не изменен. Эпидемиологические исследования показали, что случаи прогрессирующей деменции в сочетании со следующими синдромами (2 или более): миоклонусом, корковой слепотой, пирамидной, экстрапирамидной или мозжечковой недостаточностью, типичными изменениями ЭЭГ (двух-/трехфазные острые волны с частотой 1-2 в секунду) практически всегда при патоморфологическом исследовании оказываются случаями БКЯ. Наряду с типичной формой БКЯ выявляются ее атипичные варианты с продолжительностью болезни более 2 лет. Также атипичными считаются формы болезни, проявляющиеся мозжечковыми нарушениями в большей степени, чем психическими (атактическая форма). Описаны варианты БКЯ с преобладанием в клинической картине симптома корковой слепоты вследствие поражения затылочных долей. К панэнцефалитическому типу БКЯ относятся случаи с дегенерацией белого вещества мозга и губчатой вакуолизацией серого вещества. В случае выраженной мышечной атаксии на ранних этапах болезни диагностируется амиотрофический вариант БКЯ. Семейные (наследственные) случаи спорадической болезни Крейтцфельдта-Якоба
Вновь выявленный случай БКЯ относят к семейным только тогда, когда подобное заболевание прежде было установлено в этой же семье у одного из ближайших родственников (например, у отца, матери и т.п.). Семейные случаи БКЯ составляют примерно 10-15% всех регистрируемых случаев. Зависимости поражения от пола, возраста, принадлежности к отцовской или материнской линии не установлено.
В случае семейной БКЯ регистрируются мутации в кодонах 178, 200 PRNP. Мутация в кодоне 178 приводит к БКЯ только в том случае, если в положении 129 (локус полиморфизма)[1]метионин (Мет) заменяется на валин (Вал).
Это доказывает, что генетический полиморфизм в кодоне 129 PRNP,
кодирующем метионин и/или валин, может влиять на экспрессию мутации в PRNP и определять клинические отличия болезни. Так, показано, что в случаях, обусловленных данной мутацией, основные признаки болезни развиваются медленнее (20 мес), заболевание проявляется в более раннем возрасте, а картина ЭЭГ не всегда типична для БКЯ.
Ятрогенная болезнь Крейтцфельдта-Якоба Ятрогенная БКЯ может рассматриваться как внутрибольничная инфекция.
Все выявленные случаи ятрогенных прионных болезней классифицируются как БКЯ, и в настоящее время доказано, что этот вариант БКЯ обусловлен реализацией искусственного (артифициального) механизма передачи возбудителя. К этой форме относят случаи БКЯ, если в эпидемиологическом анамнезе пациента установлено какое-либо медицинское вмешательство, связанное с источником, - возможным носителем инфекционных прионных белков. Серьезному риску подвергаются реципиенты твердой мозговой оболочки, спинного мозга, роговицы. Опасным в эпидемиологическом плане считается введение пациенту экстракта гипофиза человека (гормон роста и гонадотропин) лекарственных препаратов, приготовленных из головного мозга и других органов животных. В общей сложности известны 174 случая ятрогенной БКЯ, зарегистрированные в мире к 1998 г.: 94 - в результате введения гормона роста человека; 4 - в результате введения гонадотропина человека; 69 - в результате трансплантации твердой мозговой оболочки; 3 - при пересадке роговицы; 2 - в результате применения недостаточно обработанных инструментов, ранее использованных при операции больных БКЯ; 2 - в результате вживления глубинных внутримозговых электродов, ранее использовавшихся у больной БКЯ; 1 - при пересадке печени; 2 случая - при переливании донорской крови.
[1] Полиморфизм - одновременное присутствие двух или более генетических форм одного вида в таком численном отношении, что их нельзя отнести к повторным мутациям (например, у 50% населения земного шара в определенном кодоне валин, а у остальных 50% - метионин).
Гормон человеческого роста из гипофиза трупов применялся для лечения детей от карликовости с конца 1950-х до 1985 г. В настоящее время натуральный гормон роста заменен на генно-инженерный. После призыва экспертов ВОЗ во многих странах мира осознана необходимость введения ограничений на применение трансплантатов в нейрохирургической практике, а также на использование в медицинских целях любых биологических жидкостей и тканей от лиц, ранее подвергавшихся пересадке тканей и органов, получавших гормоны гипофиза либо имеющих в семейном анамнезе БКЯ.
Новый вариант болезни Крейтцфельдта-Якоба
О новом варианте болезни Крейтцфельдта-Якоба (нвБКЯ) впервые появились сведения в 1994 г. в Великобритании, затем - во Франции. С этого года стали регистрироваться случаи смерти от БКЯ, характеризующиеся поражением лиц молодого возраста (от 16 до 40 лет, в среднем 26 лет), в то время как классическая БКЯ крайне редко развивается в возрасте до 40 лет - не более чем в 2-3% случаев. НвБКЯ отличался также более длительным течением заболевания (в среднем 12-14 мес). К 1998 г. было известно уже о 24 случаях нвБКЯ в
Европе, причем 22 из них - в Великобритании. Появление этого варианта БКЯ последовало за эпизоотией спонгиоформной энцефалопатией крупного рогатого скота ("коровье бешенство", губчатая энцефалопатия коров - ГЭК) в Великобритании, которая началась с 1986 г.
Заболевание отличали прогрессирующая неврологическая симптоматика и летальный исход.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
К 1992 г. эпизоотия достигла своего пика - регистрировалось 1000 случаев заболеваний коров в неделю. Источником инфекционного прионного белка была мясокостная мука, которую готовили из субпродуктов и голов овец (традиционных носителей патологической формы прионного белка) и применяли для кормления коров. Животные заражаются перорально. Инфекционный прионный белок накапливается в фагоцитах, затем попадает в мозг, где вызывает амилоидоз, дегенерацию нервной ткани с характерными губкообразными изменениями в головном мозге.
В настоящее время полностью установлена связь между нвБКЯ и ГЭК, так как по трем генетическим маркерам прионы, полученные от погибших в результате ГЭК животных, оказались сходными с прионами, выделенными от больных нвБКЯ людей. Кроме того, нвБКЯ в основном выявляется в Великобритании, где регистрируются самые крупные эпизоотии ГЭК, также известно, что ГЭК выявлена не только у крупного рогатого скота, но и у животных других видов (кошки, собаки, антилопы), что свидетельствует о преодолении возбудителями ГЭК межвидового барьера и возможности заражения человека. Волна нвБКЯ была относительно небольшой, но, тем не менее, к 2003 г. в Великобритании выявлено уже 148 вероятных и подтвержденных случаев этого заболевания. Человек заражается нвБКЯ от больных животных, употребляя в пищу инфицированные продукты животного происхождения. По степени вероятности заражения наиболее опасно употребление в пищу в первую очередь мозга и глаз, затем - лимфоидной ткани, спинного мозга, эндокринных желез и печени. При разделке туши высока вероятность попадания тканей мозга на мышцы животного, кроме того, доказана инфекционность и мышц зараженного животного. При попадании в ЖКТ прионы инфицируют дендритные клетки пейеровых бляшек, затем дендритные клетки "заселяют" ЛУ и способствуют диссеминации прионов по организму (занос в ПНС и ЦНС).
Инкубационный период развития болезни у человека вариабелен - от 1 года до 20 лет.
Морфологически нвБКЯ характеризуется амилоидными бляшками, окруженными вакуолями; спонгиоформными изменениями, больше выраженными в базальных ганглиях; выраженным таламическим астроглиозом; скоплением прионного белка в церебральной и мозжечковой коре.
Как при новом, так и при классическом варианте БКЯ отсутствуют признаки воспалительного процесса с повышением температуры.
НвБКЯ клинически отличается от классического тем, что заболевание дебютирует психическими нарушениями в виде тревоги, депрессии, изменений поведения, иногда регистрируются дизестезии лица и конечностей. Через несколько недель или месяцев присоединяются неврологические нарушения, в основном мозжечковые. В позднем периоде болезни отмечаются нарушения памяти, деменция, миоклонии или хорея, пирамидные симптомы. На ЭЭГ, как правило, отсутствуют характерные для БКЯ изменения. Больные погибают в течение первого полугодия, редко доживают до года, еще реже до 2 лет. Описаны такие галопирующие случаи, когда заболевание протекает по типу острого энцефалита, и больной погибает в течение нескольких недель.
В настоящее время ряд стран вводит запрет на донорство для людей, проживавших в Великобритании и Франции в период эпизоотии спонгиоформной энцефалопатией крупного рогатого скота.
Наследственные прионные болезни
К настоящему времени обнаружено более 15 наиболее изученных мутаций в гене, кодирующем клеточный аналог прионов, в связи с чем не вызывает сомнения наследственная природа ряда болезней человека, связанная с мутациями PRNP.
Семейная смертельная бессонница (синоним - фатальная семейная инсомния)
Впервые описана в 1986 г. Семейная смертельная бессонница - редкое заболевание, наследуемое по аутосомно-доминантному типу. При этом заболевании регистрируется мутация в кодоне 178, которая также отмечается у больных БКЯ. Какое заболевание будет развиваться, зависит от того, какая аминокислота находится в положении 129; если метионин, то развивается семейная смертельная бессонница, если валин, то БКЯ.
Описана семья, в которой зарегистрирована мутация в кодоне 183. Описано 26 итальянских и итало-американских семей. Заболевание может дебютировать в возрасте от 25 лет до 71 года и имеет вариабельное по длительности течение (от 6-13 до 24-48 мес). Основными клиническими признаками семейной смертельной бессонницы являются: некурабельная бессонница, утрата циркадных ритмов, двигательные расстройства и деменция. К ранним симптомам относятся вегетативные нарушения: изменения потоотделения и саливации, запоры, гипертензию, тахикардия, тахипноэ, иногда лихорадка. Спонгиозные поражения локализуются преимущественно в ядрах таламуса.
Синдром Герстмана-Штреусслера-Шейнкера
ГШШ - редкое семейное заболевание, относящееся к генетически обусловленным формам спонгиозных энцефалопатий с аутосомно-доминантным типом наследования (мутации гена PRNP). В популяции регистрируется с частотой 1 случай на 10 млн населения. Клинические проявления болезни регистрируются на 3-м или 4-м десятилетии жизни. В отличие от БКЯ деменция может не развиваться. Начальными проявлениями болезни являются мозжечковые нарушения. В зависимости от локализации мутации в PRNP, в развернутой стадии болезни могут доминировать мозжечковые или экстрапирамидные расстройства, паралич взора или глухота и слепота. Продолжительность болезни 4-5 лет.
Инфекционные прионные болезни
Куру
Код по МКБ-10: A81.8.
Куру была первой болезнью из группы прионных, заразность которой была доказана экспериментальным заражением обезьян биологическим материалом, полученным от людей. Куру является эндемической медленной инфекцией, встречающейся в восточной части о. Новая Гвинея. Впервые болезнь была обнаружена в 1953 г., а затем описана американским исследователем D. Gajdusek в 1957 г. Заболевание было выявлено у племен народности форе, которые практиковали обычаи ритуального каннибализма. Представители данных племен, включая детей, употребляли в пищу мозг своих предков без термической обработки. Когда традиции каннибализма были упразднены законодательным порядком, заболеваемость на острове резко упала, и в конце XX в. случаи заболевания регистрировалась только у лиц, родившихся до 1956 г., когда произошел официальный запрет каннибализма. Заболевание может начаться в возрасте от 5 до 60 лет и старше. Инкубационный период - от 5 до 30 лет (в среднем 8,5 года). Центральным клиническим симптомом этого заболевания является прогрессирующая мозжечковая атаксия, затем присоединяются дизартрия, тремор головы, неконтролируемый смех ("куру" переводится как "смеющийся" или "дрожащий от страха"). Длительность заболевания от 4 мес до 3 лет. Больные погибают от ДН или бронхопневмонии на фоне выраженной мышечной гипотонии. Деменция наступает только на поздних стадиях болезни. ЭЭГ обычно не изменена. На вскрытии выявляется атрофия мозжечка, преимущественно червя. Микроскопически также наибольшие изменения локализуются в мозжечке и выражаются в утрате нейронов, глиозе и амилоидных бляшках. В коре большого мозга изменения представлены неярко выраженным спонгиозом.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Диагностика прионных инфекций
Стандарт диагностики прионных болезней не разработан.
Электроэнцефалография
Установлено, что у 60-80% больных БКЯ выявляются 0,5-2,0 Гц генерализованные 2-3- фазные комплексы, повторяющиеся с частотой 1 раз в секунду (сходные характеристики ЭЭГ могут выявляться и при других патологиях головного мозга). Однако негативный результат ЭЭГ не может служить основанием для отмены диагноза БКЯ.
Магнитно-резонансная томография
МРТ имеет невысокую диагностическую значимость, так как у 80% обследованных регистрируются неспецифические сигналы. Тем не менее МРТ позволяет выявить атрофию мозга, выраженность которой усугубляется по мере прогрессии заболевания.
Исследование спинномозговой жидкости
Возможно проведение теста на наличие нейроспецифического белка 14-3-3. Данное исследование методом ИФА или вестерн-блоттинга демонстрирует хорошую чувствительность и специфичность при спорадических случаях БКЯ как на ранних, так и на поздних стадиях заболевания. При семейных случаях и ятрогенной БКЯ этот метод менее информативен (специфичность около 50%).
Исследование крови
Возможна идентификация прионов методом иммуноблоттинга в периферических лимфоцитах. Наибольшее распространение, в том числе и в России, получила система TeSeE™ (набор реагентов для очистки и определения методом ИФА in vitro патогенной формы прионного белка). Данная система в рамках ЕС утверждена в качестве экспресс-теста на губчатые энцефалопатии и скрепи крупного рогатого скота, овец и коз.
Набор TeSeE™ является иммуноферментным, использует два моноклональных антитела для обнаружения аномальных белков прионов, устойчивых к действию протеиназы К, в тканях, собранных от инфицированных животных.
Основным минусом набора TeSeE™ является недостаточная чувствительность определения, на что указывают сами производители.
Молекулярно-генетические исследования
В настоящее время разработаны методы иммуноблоттинга с применением моноклональных антител (МКА-15В3), позволяющих распознавать PrPSc и PrPc .
Применяются методы ПЦР, позволяющие проводить секвенирование генома человека, а также анализ и локализацию мутаций гена PRNP.
Исследование аутопсийного материала
Выявляются Status spongiosus (формы вакуолизации нервной ткани), признаки церебрального амилоидоза, образование характерных амилоидных бляшек.
Биологические методы диагностики
Трансгенные мыши, несущие ген, кодирующий нормальный PrP человека, рекомендованы ВОЗ для тестирования инфекционной активности материалов, подозрительных на контаминацию прионами.
Дифференциальную диагностику БКЯ проводят со всеми болезнями, одним из проявлений которых является деменция: болезнь Альцгеймера, васкулиты, нейросифилис,
стрептококковый менингит, герпетический энцефалит, миоклонус-эпилепсия, болезнь Паркинсона и т.д.
Лечение
Лечение прионных болезней не разработано.
Больные с клиническими проявлениями нетрудоспособны. Прогноз неблагоприятен, заболевание заканчивается летальным исходом.
Глава 22. Протозоозы
Амебиаз (англ. amebiasis) - антропонозная протозойная болезнь, вызываемая Entamoeba histolytica, с фекально-оральным механизмом передачи. Характеризуется язвенным поражением толстой кишки, тенденцией к хроническому рецидивирующему течению, внекишечными осложнениями в виде абсцессов печени и других органов.
КОДЫ ПО МКБ-10
A06 Амебиаз. A06.0 Острая амебная дизентерия. A06.1 Хронический кишечный амебиаз. A06.2 Амебный недизентерийный колит. A06.3 Амебома кишечника. A06.4 Амебный абсцесс печени. A06.5 Амебный абсцесс легкого (J99.8). A06.6 Амебный абсцесс головного мозга (G07). A06.7 Кожный амебиаз.
A06.8 Амебная инфекция другой локализации. A06.9 Амебиаз неуточненный. ЭТИОЛОГИЯ
Entamoeba histolytica относится к
типу Sarcomastigophora классу Sarcodina роду Entamoeba. Жизненный цикл
E. histolytica включает две стадии - вегетативную (трофозоит) и стадию покоя (циста) [1, 2, 3, 6, 8]. Мелкая вегетативная форма (просветная форма, или forma minuta) имеет размеры от 7 до 25 мкм. Разделение цитоплазмы на экто- и эндоплазму выражено слабо. Эта непатогенная, комменсальная форма обитает в просвете толстой кишки человека, питается бактериями путем эндоцитоза, подвижна, размножается вегетативно. Тканевая форма (20-25 мкм) встречается в пораженных тканях и органах хозяина. Она имеет овальное ядро, хорошо выраженную стекловидную эктоплазму и зернистую эндоплазму, очень подвижна, образует широкие тупые псевдоподии. Крупная вегетативная форма (forma magna) образуется из тканевой формы. Тело серое, округлое, больших размеров (до 60 мкм и более при движении), эктоплазма светлая, эндоплазма зернистая, мутная
и темная; пищеварительные вакуоли содержат фагоцитированные эритроциты. Именно из-за этого она также получила название «эритрофаг». По мере продвижения по толстой кишке амебы превращаются в предцистные стадии, а затем - в цисты. Цисты округлой или овальной формы (10-15 мкм) с гладкой двухконтур-ной оболочкой. Незрелые цисты содержат одно или два ядра, зрелые - четыре ядра с кариосомами.
Цисты устойчивы к воздействию факторов окружающей среды: при температуре 20 °С остаются жизнеспособными в почве несколько дней, в зимних условиях (-20 °С) - до 3 мес. Из-за устойчивости к дезинфицирующим средствам (хлор, озон) в концентрациях, применяемых на водоочистных станциях, жизнеспособные цисты могут оказаться в питьевой воде. Высокие температуры для них губительны, при высушивании и нагревании цисты быстро погибают. Вегетативные формы в окружающей среде неустойчивы и эпидемиологического значения не имеют.
При заражении человека цисты амеб с водой или с пищевыми продуктами попадают в рот, а затем в кишечник. В дистальных отделах тонкой кишки под действием кишечных ферментов оболочка цисты растворяется. Из зрелой цисты выходят четыре метацистные одноядерные
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
амебы, которые, в свою очередь, каждые 2 ч делятся надвое. В результате последующих делений они превращаются в вегетативные просветные стадии (см. выше). В кишечнике человека могут обитать следующие морфологически сходные виды амеб: патогенная - E. histolytica и непатогенные - E. disρar и E. moshkovskii, различить которые можно лишь путем анализа ДНК.
ЭПИДЕМИОЛОГИЯ
Высокая пораженность населения амебиазом имеется в Юго-Восточной Азии, Южной и Центральной Америке, Южной и Западной Африке. Болезнь встречается в ряде стран СНГ, преимущественно Закавказья и Средней Азии. Ориентировочно 500 млн человек в мире являются носителями E. histolytica, примерно у 50 млн из них развиваются колит и внекишечные абсцессы, более чем у 100 тыс. больных наступает летальный исход. В России спорадические случаи, в основном завозные, выявляют во всех регионах, но риск заболевания амебиазом выше в южных районах страны.
Источником возбудителя служит человек (в основном бессимптомный носитель просветных форм), выделяющий с фекалиями зрелые цисты амеб. Механизм передачи - фекальнооральный. Пути передачи - водный, алиментарный, контактно-бытовой. Факторами передачи служат вода, пищевые продукты (преимущественно овощи и фрукты, не подвергавшиеся термической обработке), предметы обихода. Цисты могут распространяться механическими переносчиками: мухами и тараканами, в пищеварительной системе которых амебы сохраняют жизнеспособность в течение нескольких суток.
Восприимчивость невысокая, при заражении чаще развивается здоровое носи-тельство. Сезонности не отмечают; некоторое увеличение заболеваемости в теплое время года связывают с обострениями кишечного амебиаза, вызванного различными причинами, прежде всего наслоением шигеллеза и других ОКИ. В странах умеренного климатического пояса инфицированность E. disρar в 10 раз выше, чем E. histolytica; последняя преобладает в тропических странах. Специфические антитела при инвазии E. histolytica не играют существенной протективной роли. Иммунитет при амебиазе нестойкий и нестерильный, не защищает от рецидивов и реинфекции.
МЕРЫ ПРОФИЛАКТИКИ
Основными мерами профилактики амебиаза являются: защита водоемов от фекального загрязнения и качественное водоснабжение, предотвращение загрязнения цистами амеб пищевых продуктов, раннее выявление и лечение больных и бессимптомных носителей, систематическое санитарное просвещение. При плановых обследованиях работников системы водоснабжения и питания, наряду с бактериологическими исследованиями, их исследуют также на амебиаз. Кипячение воды является более эффективным методом обеззараживания от цист амеб, чем применение химических средств дезинфекции.
ПАТОГЕНЕЗ И ПАТОМОРФОЛОГИЯ
Причина, по которой E. histolytica переходят от просветного состояния к тканевому паразитизму, не изучена. Полагают, что основной фактор вирулентности у E. histolytica - цистеинпротеиназы. В развитии инвазивных форм амебиаза имеют значение такие факторы, как интенсивность инвазии, изменение физико-химической среды кишечного содержимого, иммунодефицит, в частности при лечении глюкокортикоидами, ВИЧ-инфекции; голодание, стресс, преклонный возраст, алкоголизм и др. Отмечают относительно частое развитие инвазивных форм у женщин во время беременности и в период лактации. Вероятно, амебы переходят к тканевому паразитизму с приобретением характерных для других патогенных микроорганизмов свойств, таких как адгезивность, инвазивность, способность подавлять защитные механизмы хозяина и др. Трофозоиты прикрепляются к энтероцитам благодаря специфическому лектину - галактозо-N-ацетилгалактозамину. У E. histolytica обнаружены
гемолизины, протеазы, у некоторых штаммов - гиалуронидаза, которые могут играть существенную роль в разрушении амебами эпителиального барьера. Трофозоиты паразита способны вызывать контактный лизис нейтрофильных лейкоцитов с выделением монооксидантов, усиливающих процесс расплавления тканей. Амебы оказывают инги-бирующее воздействие на моноциты и макрофаги, что способствует их выживанию. Они способны специфически блокировать выработку клетками кишечника ИЛ (ИЛ-1ß, ИЛ-8), расщеплять комплемент (С3), IgA, IgG, влияя, таким образом, на процессы воспаления в месте внедрения паразита. Под воздействием цитолизинов и протеолитических ферментов амеб повреждаются слизистая оболочка и прилегающие слои кишечной стенки.
Первичным проявлением амебиаза служит образование небольших участков некроза в слизистой оболочке толстой кишки, которые трансформируются в язвы. Синхронности в развитии язв не отмечают. Язвы увеличиваются не только по периферии (за счет подслизистого слоя), но и вглубь, достигая мышечной и даже серозной оболочки толстой кишки. Типичные амебные язвы резко отграничены от окружающих тканей, имеют неровные края. На дне язвы - некротические массы, содержащие трофозоиты амеб. Воспалительная реакция слабо выражена. Некротический процесс в центре, подрытые и приподнятые края язвы, реактивная гиперемия и геморрагические изменения вокруг нее составляют наиболее типичные черты изъязвлений при кишечном амебиазе. Язвенный процесс может осложниться перфорацией и перитонитом, возникновением спаек брюшины.
Амебные язвы чаще локализуются в области слепой кишки. Далее в порядке убывания частоты поражения следуют: прямая и сигмовидная кишка, аппендикс и терминальный участок подвздошной кишки.
Поражение кишечника носит сегментарный характер, воспалительная реакция и интоксикационный синдром выражены слабо. Язвы заживают с образованием фиброзного рубца, поэтому могут возникнуть стриктуры и стеноз кишечника.
При хроническом амебиазе в стенке кишки иногда формируется амебома - опухолевидное образование, расположенное преимущественно в восходящей, слепой или прямой кишке. Амебома состоит из фибробластов, коллагена и клеточных элементов и содержит относительно небольшое число амеб.
Врезультате проникновения амеб в кровеносные сосуды кишечной стенки они с током крови заносятся в другие органы, где возникают очаги поражения в виде абсцессов. Наиболее часто абсцессы формируются в печени, реже - в легких, головном мозге, почках, поджелудочной железе. Их содержимое студенистое, желтоватого цвета, в крупных абсцессах гной имеет красно-коричневую окраску. Хронический абсцесс обычно имеет толстую капсулу, содержимое желтоватого цвета с гнилостным запахом. Вследствие прорыва абсцесса печени под диафрагму после ее расплавления развивается гнойный плеврит. В легких абсцессы в большинстве случаев локализуются в нижней или средней доле правого легкого. КЛИНИЧЕСКАЯ КАРТИНА
Встранах, где широко распространена E. histolytica, у 90% инфицированных лиц наблюдается неинвазивный амебиаз, и они, таким образом, являются бессимптомными «носителями» просветных форм амеб, и только у 10% инфицированных развивается инвазивный амебиаз.
Различают две основные формы инвазивного амебиаза - кишечную и внеки-шечную. Кишечный амебиаз
При локализации поражений в ректосигмоидальном участке толстой кишки клиническая картина может соответствовать дизентериеподобному синдрому с тенезмами и изредка с примесью слизи, крови и гноя в стуле. При локализации поражений в слепой кишке отмечают запор с болями в правой подвздошной области и симптомы, характерные для
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
клинической картины хронического аппендицита (в ряде случаев действительно развивается аппендицит). В подвздошной кишке амебные поражения встречаются сравнительно редко.
Клинические варианты течения кишечного амебиаза
Острый кишечный амебиаз (острый амебный колит) нередко проявляет себя только в виде диареи. Реже отмечают синдром амебной дизентерии: острое начало, схваткообразные боли в животе, тенезмы, жидкий стул с кровью и слизью. Высокая лихорадка и другие проявления интоксикационного синдрома редки. Однако у детей младшего возраста обычно возникают лихорадка, рвота, дегидратация.
Тяжело протекающая некротизирующая форма острого кишечного амебиа-за - фульминантный колит. Для этой формы характерны токсический синдром, тотальные и глубокие повреждения слизистой оболочки кишечника, кровотечения, перфорации, перитонит. Чаще его выявляют у беременных и женщин в послеродовом периоде, после назначения ГК. Летальность чрезвычайно высока. Острое течение кишечного амебиаза в эндемичных районах нередко обусловлено сочетанием с шигеллезом, малярией, брюшным тифом, которые оказывают взаи-моотягощающее влияние на течение инфекционного процесса. Например, брюшной тиф в 5-6 раз увеличивает риск развития как кишечных, так и внекишечных поражений.
Затяжной кишечный (первично-хронический) амебиаз. Характерны нарушение моторной функции кишечника, послабленный стул, запор (50% случаев) или неустойчивый стул, боли в нижней половине живота, тошнота, слабость, плохой аппетит. Со временем появляются признаки гипохромной анемии, развиваются трофические нарушения, гиповитаминоз, дисбиоз кишечника. Без противопарази-тарного лечения болезнь прогрессирует, развиваются осложнения, кахексия.
Внекишечный амебиаз
Абсцесс печени. У больных с амебным абсцессом печени указания на перенесенный ранее кишечный амебиаз или эпизод диареи выявляют только в 30-40% случаев, а амебы в фекалиях обнаруживают не более чем у 20% больных. Амебный абсцесс печени у взрослых развивается чаще, чем у детей, у лиц мужского пола чаще, чем у женского. Единичные или множественные абсцессы образуются преимущественно в правой доле печени в непосредственной близости от диафрагмы или в нижних отделах органа.
Характерна лихорадка с ознобами и обильным потоотделением в ночное время; увеличение и боль в области печени, умеренный лейкоцитоз. При крупных абсцессах возможно развитие желтухи, что считают плохим прогностическим признаком. Выявляют высокое стояние правого купола диафрагмы, ограничение ее подвижности; возможно развитие ателектазов в нижний отдел легкого. Относительно часто (10-20%) отмечают длительное скрытое или нетипичное течение абсцесса (например, только лихорадка, псевдохолецистит, желтуха) с возможным последующим прорывом его и развитием перитонита или эмпиемы плевры.
Плевролегочный амебиаз часто возникает вследствие прорыва абсцесса печени через диафрагму в легкие, реже гематогенным путем. Проявляется в виде эмпиемы плевры, абсцессов легких, печеночно-бронхиальной фистулы. Характерны боль в грудной клетке, кашель, одышка, гной и кровь в мокроте, озноб, лихорадка, ней-трофильный лейкоцитоз со сдвигом влево, повышенная СОЭ.
Вследствие прорыва абсцесса печени из левой доли через диафрагму в перикард возможно развитие амебного перикардита, что может вести к тампонаде сердца и летальному исходу.
Абсцесс мозга наблюдается редко, имеет гематогенное происхождение. Возможны единичные или множественные абсцессы. Характерны острое начало и молниеносное течение, заканчивающееся летальным исходом.
Амебное поражение кожи развивается чаще у ослабленных и истощенных больных. Язвы обычно локализуются в перианальной области, на месте прорыва абсцессов в области фистулы, у гомосексуалов их отмечают в области половых органов.
Осложнения
Основные осложнения кишечного амебиаза - перфорация кишечника (чаще в области слепой кишки, реже в ректосигмоидальном участке), амебный аппендицит, амебные стриктуры кишечника (обычно единичные, расположенные в области слепой или сигмовидной кишки), кишечное кровотечение; формирование амебомы. Наиболее серьезное осложнение при внекишечном амебиазе - прорыв абсцесса в окружающие органы.
ДИАГНОСТИКА
Опорными симптомами клинической диагностики кишечного амебиаза являются постепенное развитие заболевания со слабо выраженными признаками интоксикации или вовсе без них (за исключением случаев некротизирующей формы острого кишечного амебиаза - фульминантного колита), прогрессирующее нарастание кишечных расстройств - учащенный жидкий стул с примесью обильной слизи, равномерно окрашенной кровью, тупые боли в животе, преимущественно в правой подвздошной области, при длительном течении - гипохромная анемия. Учитываются данные эпидемиологического анамнеза: пребывание больного в эндемичной местности, употребление в пищу недостаточно обезвреженных продуктов, особенно овощей и огородной зелени, питье некипяченой воды, купание в открытых водоемах.
Лабораторная диагностика
Наиболее простой и надежный метод диагностики кишечного амебиаза - микроскопическое исследование фекалий для выявления вегетативных форм (трофозоитов) и цист. Трофозоиты лучше выявлять у больных при диарее, а цисты - в оформленном стуле. При первичной микроскопии исследуют нативные препараты из свежих проб фекалий с изотоническим раствором натрия хлорида. Для идентификации трофозоитов амеб нативные препараты окрашивают раствором Люголя или метиленовым синим. Для идентификации цист нативные препараты, приготовленные из свежих или обработанных консервантом проб фекалий, окрашивают йодом. Выявление амеб более эффективно при немедленном исследовании фекалий после назначения слабительного. В практике используют также методы обогащения,
вчастности эфир-формалиновое осаждение. Однако методом обогащения можно выявить только цисты, так как трофозоиты деформируются. Обнаружение только цист амеб не подтверждает наличия инвазивного амебиаза. В последние годы разработан чувствительный и специфичный метод ПЦР, позволяющий относительно просто и быстро идентифицировать
вфекалиях одновременно E. histolytica и E. disρar.
При клинических данных, указывающих на возможное поражение кишечника, рекомендуют проводить ректоили колоноскопию с получением биопсийного материала. Диагностику внекишечного амебиаза, в частности абсцесса печени, проводят с помощью УЗИ, КТ, МРТ.
При необходимости аспирируют содержимое абсцесса печени, однако вероятность выявления амеб в некротических массах невелика, так как они обычно расположены по периферии области поражения.
Рентгенологическое исследование позволяет выявить высокое стояние купола диафрагмы, наличие выпота в плевральную полость, абсцессы в легких.
Специфические противоамебные антитела определяют c помощью ИФА, РНИФ, РП. Чувствительность иммунологических методов: кишечный амебиаз - 75%, амебный абсцесс печени - выше 95% через 14 дней после начала заболевания, амебома - до 95%. При носительстве этими методами антитела не выявляются. РНИФ - более чувствительный метод, чем РП, и он дает положительный результат на более ранних сроках заболевания и остается
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
положительным в течение неопределенного срока после излечения. РП - более специфичный тест, и поэтому его используют а качестве подтверждающего теста; РП становится негативной через 1-12 мес после излечения. В эндемических очагах серологические методы рекомендуют применять у всех больных с подозрением на амебиаз, которым планируют назначить глюкокортикоиды.
Дифференциальную диагностику проводят с шигеллезом, бластоцистозом, балантидиазом, кампилобактериозом, неспецифическим язвенным колитом, в тропических странах - с некоторыми гельминтозами, протекающими с проявлениями гемоколита (кишечный шистосомоз, трихоцефалез и др.).
Показания к консультации других специалистов
Консультация хирурга при необходимости дифференциальной диагностики с хирургическими заболеваниями или подозрении на хирургические осложнения, при абсцессе печени, консультация пульмонолога - при абсцессе легкого.
Пример формулировки диагноза А06.1 Хронический кишечный амебиаз, А06.3 Амебома кишечника. Показания к госпитализации
Клинические, эпидемиологические. Режим во время обострений полупостельный, столы № 2, 4.
ЛЕЧЕНИЕ Медикаментозная терапия
Все препараты, используемые для лечения амебиаза, можно разделить на две группы - контактные (просветные), воздействующие на кишечные просветные формы, и системные тканевые амебоциды.
Для лечения неинвазивного амебиаза (бессимптомные носители) используют просветные амебоциды. Их рекомендуют назначать также после завершения лечения тканевыми амебоцидами для элиминации амеб, возможно, оставшихся в кишечнике. Если невозможно предотвратить повторное заражение, применение просветных амебоцидов нецелесообразно. В этих ситуациях следует назначать просветные амебоциды по эпидемиологическим показаниям, например лицам, чья профессиональная деятельность может способствовать заражению других людей, в частности сотрудникам предприятий питания и водоснабжения.
Для лечения инвазивного амебиаза применяют системные тканевые амебо-циды. Препаратами выбора считают 5-нитроимидазолы: метронидазол, тини-дазол, орнидазол. Их используют для лечения как кишечного амебиаза, так и абсцессов любой локализации (табл. 22.1). Помимо препаратов из группы 5-нитроимидазолов, для лечения инвазивного амебиаза и прежде всего амебных абсцессов печени иногда используют эметинρ и хлорохин. Препараты группы 5-нитроимидазолов хорошо всасываются, и, как правило, их назначают внутрь. Парентеральное (внутривенное) введение этих препаратов применяют при лечении внекишечного амебиаза, а также у тяжелых больных или при невозможности приема внутрь. Эметинρ из-за возможных серьезных побочных реакций, прежде всего кардиотоксического эффекта, относят к препаратам резерва, его рекомендуют вводить внутримышечно больным с обширными абсцессами, а также больным, у которых предыдущие курсы 5-нитроимидазолов оказались неэффективными. Хлорохин назначают в сочетании с эметиномρ при лечении амебных абсцессов печени.
Таблица 22.1. Химиопрепараты, используемые для лечения амебиаза

Для противопаразитарного лечения больных инвазивным кишечным амебиа-зом применяют следующие препараты: ◊ метронидазол - 30 мг/кг в сутки в 3 приема в течение 8-10 дней;
◊тинидазол - 30 мг/кг 1 р/сут в течение 3 дней;
◊орнидазол - 30 мг/кг 1 р/сут в течение 5 дней. Для лечения больных с амебными абсцессами печени и других органов применяют те же препараты из группы 5-нитроимидазолов более длительными курсами:
◊метронидазол - 30 мг/кг в день в/в или перорально в 3 приема в течение 10 дней;
◊тинидазол - 30 мг/кг 1 р/сут в течение 10 дней; ◊ орнидазол - 30 мг/кг 1 р/сут в течение 10 дней. В качестве альтернативной схемы лечения амебного абсцесса печени могут быть использованы:
◊эметинρ (дегидроэметин дигидрохлорид) - 1 мг/кг в сутки однократно в/м (не более 60 мг/сут) в течение 4-6 дней;
◊хлорохина основания - 600 мг в день в течение 2 дней, затем по 300 мг в течение 2-3 нед - одновременно или сразу же после завершения курса эметинаρ. После завершения курса лечения системными тканевыми амебоцидными ЛС с целью элиминации оставшихся амеб в кишечнике применяют следующие про-светные амебоциды:
◊дилоксанида фуроатρ по 500 мг 3 р/сут 10 дней (детям 20 мг/кг в сутки); ◊ этофамид - 20 мг/кг в день в 2 приема в течение 5-7 дней; ◊ паромомицин - 1000 мг в день в 2 приема в течение 5-10 дней. Эти же препараты применяют для санации паразитоносителей. Тяжелым больным с амебной дизентерией из-за возможной перфорации кишечника и развития перитонита рекомендуют дополнительно назначать препараты группы тетрациклина (доксициклин 0,1 г 1 р/сут).
После успешной химиотерапии абсцесса печени остаточные полости обычно исчезают в течение 2-4 мес, иногда - позднее.
Дополнительные методы лечения
Аспирацию (или чрескожное дренирование) абсцесса рекомендуют при больших размерах (более 6 см в диаметре), локализации абсцесса в левой доле или высоко в правой доле печени, сильных болях в животе и напряжении брюшной стенки, при которых вероятна угроза разрыва абсцесса, а также в случаях, когда химиотерапия неэффективна в течение 48 ч после ее начала.
Прогноз
В настоящее время амебиаз считают практически полностью излечимым заболеванием при условии ранней диагностики и адекватной терапии. Основной причиной летальных исходов служат развивающиеся осложнения кишечного амебиа-за и абсцесса печени.
Диспансеризация
Диспансерное наблюдение за переболевшими продолжают в течение года. В этот период каждые 3 мес, а также при появлении дисфункции кишечника проводят медицинские осмотры и лабораторные исследования. Работники объектов водоснабжения и питания к работе допускаются после полной санации и троекратных отрицательных результатов анализов фекалий.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
22.2. ЛЯМБЛИОЗ
Лямблиоз (жиардиаз; англ. - giardiasis) - протозойная инвазия, протекающая чаще как бессимптомное носительство, иногда с функциональными расстройствами кишечника.
КОД ПО МКБ-10
A07.1 Жиардиаз (лямблиоз). ЭТИОЛОГИЯ
Возбудитель - Lamblia intestinalis (Giardia lamblia) - относят к роду Lamblia подтипа Mastigoρhora подцарства Protozoa.
В цикле развития простейшего выделяют две стадии - вегетативной формы и цисты. Вегетативная форма - трофозоит размером 8-18×5-10 мкм, грушевидной формы. Задний конец сужен и вытянут, передний - расширен и закруглен; брюшная сторона плоская, спинная - выпуклая. Для трофозоита характерно билатерально-симметричное строение. Он имеет четыре пары жгутиков, два ядра с кариосомами и так называемый присасывательный диск - углубление, при помощи которого он прикрепляется к поверхности эпителиальной клетки кишечника хозяина. Питается лямблия осмотически всей поверхностью тела, поглощая питательные вещества и различные ферменты непосредственно из щеточной каемки. Максимальное количество паразитов находится в проксимальном отделе тонкой кишки (начальные 2,5 м), где наиболее высока интенсивность пристеночного пищеварения. Лямблии не паразитируют в желчевыводящих путях, так как концентрированная желчь оказывает губительное действие на паразитов. Размножение
происходит путем продольного деления трофозоита. Процесс образования цист занимает 1214 ч. Зрелая циста овальной формы, размером 12-14×6-10 мкм, содержит четыре ядра. Цисты, выделяемые с фекалиями, устойчивы к факторам окружающей среды: в воде при температуре 4-20 °С они остаются жизнеспособными до 3 мес. Как и цисты амеб, устойчивы к хлору [1, 5].
ЭПИДЕМИОЛОГИЯ
Источник заражения - человек, выделяющий с фекалиями зрелые цисты лямблий. Возможность заражения человека штаммами Giardia lamblia от животных (возбудитель обнаружен у собак, кошек, кроликов и других млекопитающих) в настоящее время не имеет достаточных доказательств. Механизм заражения фекально-оральный. Основной путь передачи водный. Степень загрязнения фекалиями окружающей среды - решающий фактор в уровне пораженности населения лямблиозом. В детских учреждениях большое значение имеет контактно-бытовой путь заражения. Групповые вспышки обычно обусловлены фекальным загрязнением воды, реже пищи. Цисты лямблий обнаружены в кишечнике некоторых насекомых (мух, тараканов, мучных хрущаков), которые могут способствовать их распространению [1, 5].
Лямблиоз встречается повсеместно, но наибольшую пораженность населения отмечают в странах с тропическим и субтропическим климатом. В этих странах лямблия - один из возможных возбудителей диареи путешественников. Заболевание регистрируют во всех возрастных группах. Предполагают, что у взрослых в эндемичных очагах развивается определенный защитный иммунитет. В РФ в 2015 г. было зарегистрировано 51 560 случаев лямблиоза; большую часть инфицированных (70%) составляют дети дошкольного и младшего школьного возраста. На территории центральной части РФ наиболее выражена весенне-летняя сезонность, наименьшее число случаев регистрируют в ноябре-декабре.
ПРОФИЛАКТИКА
Меры профилактики такие же, как при амебиазе и других инфекциях с фекально-оральным механизмом передачи возбудителя, отражены в методических указаниях (МУ 3.2.1882-04 «Профилактика лямблиоза»).
ПАТОГЕНЕЗ
Развитие клинических проявлений зависит от инфицирующей дозы, функционального состояния ЖКТ и иммунного статуса организма. Увеличению количества лямблий способствуют пища, богатая углеводами, резекция желудка в анамнезе и снижение кислотности желудочного сока. Препятствует размножению лямблий белковая диета. Трофозоиты обитают в двенадцатиперстной кишке, прикрепляясь с помощью присасывательных дисков к эпителиальным клеткам ворсинок и крипт. Они не проникают в слизистую оболочку кишки, однако присасывательные диски образуют углубления на микроворсинчатой поверхности эпителиальных клеток. Паразиты питаются продуктами пристеночного пищеварения и могут размножаться в кишечнике в огромных количествах. В местах паразитирования лямблий усиливаются митотические процессы, и зрелые, функционально полноценные клетки замещаются молодыми, незрелыми (частая смена эпителия); в результате нарушается всасывание компонентов пищи. Эти изменения обратимы, после излечения от лямблиоза процесс всасывания нормализуется. Лямблиозу часто сопутствует дисбиоз кишечника, особенно возрастает численность аэробной микрофлоры. Морфологические изменения при лямблиозе характеризуются укорочением сосочков слизистой оболочки двенадцатиперстной и тощей кишки, уменьшением глубины крипт. Продукты метаболизма лямблий и вещества, образуемые после их гибели, всасываются и вызывают сенсибилизацию организма. Показано, что попадание антигенов лямблий в периферическую кровь увеличивается при воспалении слизистой оболочки кишечника.
Массивная инвазия лямблиями возникает при иммунодефиците, особенно у детей с первичным в-клеточным иммунодефицитом, селективным дефицитом IgA. Лямблии способны вырабатывать IgA-протеазы, разрушающие Ig этого класса. Возможно, это имеет значение в формировании упорного рецидивирующего течения лямблиоза, резистентного к противопаразитарным ЛС.
КЛИНИЧЕСКАЯ КАРТИНА
Различают лямблиоз латентный (без клинических проявлений) и манифестный. Подавляющее большинство инфицированных становятся бессимптомными носителями лямблий. Инкубационный период от 7 до 28 дней. Во время эпидемических вспышек симптомы заболевания появляются через 5-10 дней после заражения. Клинически манифестные формы развиваются сравнительно редко. Острый период длится обычно несколько дней, после чего лямблиоз чаще переходит в подострую или хроническую стадию с кратковременными обострениями в виде жидкого стула и вздутия кишечника, похудания, повышенной утомляемости.
Наиболее частые проявления первичной инфекции - тошнота, анорексия, вздутие кишечника и урчание в животе. Стул учащенный, зловонный, маслянистый, пенистый; возможны рвота, схваткообразные боли в эпигастральной области. Эта форма лямблиоза в гигиенических условиях купируется в течение нескольких дней, хорошо поддается химиотерапии, но без специфического лечения может приобретать затяжное течение. У некоторых людей есть предрасположенность к повторному инфицированию и персистирующему лямблиозу. В этих случаях болезнь протекает месяцами и годами с периодическими обострениями в форме гастродуоденита, еюнита, дискинезии желчного пузыря. Известны клинические формы с аллергическими проявлениями в виде крапивницы с кожным зудом, приступов бронхиальной астмы с умеренной эозинофилией в крови. У детей нередки невротические симптомы: слабость, быстрая утомляемость, раздражительность,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
плаксивость, головные боли. В тропических и субтропических странах у больных лямблиозом регистрируют синдром мальабсорбции. Лямблиоз может осложниться дисбиозом кишечника.
ДИАГНОСТИКА
Лабораторная диагностика лямблиоза проводится путем исследования фекалий или дуоденального содержимого. В фекалиях обычно выявляются цисты лямблий. Однако при диарее или после назначения слабительного в фекалиях можно выявить и вегетативные формы L. intestinalis. Для обнаружения трофозоитов исследуют дуоденальное содержимое. В диагностических целях проводят также исследование мазков-отпечатков слизистой оболочки тонкой кишки, биопсийного материала, полученного при эндоскопии. Используется метод ИФА для выявления антител к антигенам лямблий в сыворотке крови. Положительный результат свидетельствует о наличии патологического процесса кишечнике. Применяется РНИФ, которая при мальабсорбции, обусловленной лямблиозом, положительна до 89% случаев, специфичность достигает 71%, но в случае диареи, вызванной лямблиями, результат обычно негативный. Разработаны тестовые наборы (метод иммунохроматографии) для экспресс-определения антигенов лямблий и криптоспоридий в кале человека.
Дифференциальную диагностику проводят с гельминтозами и другими диарей-ными инфекциями.
ЛЕЧЕНИЕ
Специфическое лечение проводят при обнаружении лямблий и наличии у больного клинических проявлений. Для этих целей используют нижеперечисленные ЛС.
•Метронидазол. Внутрь взрослым назначают по 400 мг 3 р/сут 5 дней или по 250 мг 3 р/сут 7-10 дней; детям 1-3 лет - по 0,5 г/сут 3 дня, 3-7 лет - по 0,6-0,8 г/сут 3 дня, 7-10 лет - по 1-1,2 г/сут 5 дней.
•Тинидазол назначают внутрь однократно, взрослым по 2 г (при необходимости можно повторить), детям - по 50-75 мг/кг.
•Орнидазол применяют внутрь по 1,5 г 1 раз в день (вечером) в течение 5-10 дней; детям с
массой тела до 35 кг препарат назначают по 40 мг/кг в 1 прием.
•Ниморазол назначают внутрь по 500 мг 2 р/сут в течение 6 дней.
•Нифурател принимают внутрь: взрослые по 400 мг 2-3 р/сут в течение 7 дней, дети - по 15 мг/кг 2 р/сут 7 дней.
•Албендазол. Внутрь взрослым по 400 мг 2 р/сут 7 дней; детям - 10 мг/кг в сутки, но не более 400 мг в течение 7 дней. Показана высокая лямблиоцид-ная эффективность албендазола, который может быть средством выбора при лечении лямблиоза в случаях сочетании инвазии с кишечными нематодоза-ми.
В практике лечения лямблиоза в последнее время стали применять Нитазоксанидρ - противопаразитарный препарат широкого спектра действия (в РФ не зарегистрирован) - внутрь взрослым по 100 мг 2 раза в день 3 дня.
После курса специфического лечения проводят контрольное исследование фекалий. Прогноз Прогноз благоприятный.
Диспансеризация
Диспансерное наблюдение проводят по клиническим и эпидемиологическим показаниям: при длительном упорном течении лямблиоза рекомендуется наблю-
дение сроком до 6 мес с двукратным или троекратным паразитологическим исследованием.
22.3. МАЛЯРИЯ
Малярия (англ. malaria, франц. paludisme) - антропонозная трансмиссивная протозойная болезнь человека, характеризующаяся циклическим течением, возможностью рецидивов, проявляющаяся лихорадочными приступами, гепатоспле-номегалией, анемией.
КОДЫ ПО МКБ-10
B50 Малярия, вызванная Plasmodium falciparum. B50.0 Малярия, вызванная Plasmodium falciparum, с церебральными осложнениями.
B50.9 Малярия, вызванная Plasmodium falciparum, неуточненная. B50.8 Другие виды тяжелой и осложненной малярии, вызванной Plasmodium falciparum. B51 Малярия,
вызванная Plasmodium vivax. B51.0 Малярия, вызванная Plasmodium vivax, осложненная разрывом селезенки.
B51.9 Малярия, вызванная Plasmodium vivax, без осложнений.
B51.8 Малярия, вызванная Plasmodium vivax, с другими осложнениями. B52 Малярия, вызванная Plasmodium malariae.
B52.0 Малярия, вызванная Plasmodium malariae, с нефропатией.
B52.8 Малярия, вызванная Plasmodium malariae, с другими осложнениями.
B52.9 Малярия, вызванная Plasmodium malariae, без осложнений.
B53 Другие виды паразитологически подтвержденной малярии. B53.0 Малярия, вызванная Plasmodium ovale.
B53.1 Малярия, вызванная плазмодиями обезьян.
B53.8 Другие паразитологически подтвержденные малярии, не классифицированные в других рубриках. B54 Малярия неуточненная. P37.3 Врожденная малярия,
вызванная Plasmodium falciparum. P37.4 Другая врожденная малярия. ЭТИОЛОГИЯ
Возбудители малярии относятся к типу Sρorozoa семейству Plasmodiidae. У человека паразитируют четыре вида возбудителя: Plasmodium vivax - вызывает трехдневную малярию, Р. malariae - четырехдневную, P. falciparum - тропическую, P. ovale - трехдневную овале-малярию.
В экспериментальных и иногда в естественных условиях возможно заражение человека зоонозными видами плазмодиев обезьян (Р. knowlesi, Р. cynomolgi и др.) [1, 2]. Тяжелые случаи малярии у людей, вызванной P. knowlesi, стали регистрироваться с 2004 г. среди туристов в Юго-Восточной Азии.
Малярийные паразиты в процессе своей жизнедеятельности проходят следующие циклы развития со сменой хозяев:
◊бесполое развитие (шизогония) протекает в организме промежуточного хозяина - человека;
◊половое развитие (спорогония) проходит в организме окончательного хозяина - самки комара рода Anopheles.
В организм человека спорозоиты попадают при укусе зараженным малярийным комаром. После проникновения в кровь спорозоиты через 15-45 мин внедряются в гепатоциты из синусоидальных сосудов печени и начинают экзоэритроцитарный цикл (тканевая
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
шизогония). Избирательность и быстрота инвазии обусловлены наличием на мембранах гепатоцитов специфических рецепторов.
Паразиты увеличиваются, многократно делятся и образуют множество мелких одноядерных мерозоитов. Минимальная продолжительность экзоэритроцитар-ного цикла составляет 5-7 сут у P. falciparum, 6-8 сут у Р. vivax, 9 сут у P. ovale и 14-16 сут у Р. malariae. Затем мерозоиты выходят из гепатоцитов в кровь и внедряются в эритроциты, где происходит эритроцитарная шизогония. Для трехдневной и овале-малярии характерен особый тип экзоэритроцитарного развития: все паразиты или их часть способны длительное время (7-14 мес и более) находиться в гепатоцитах в «дремлющем» состоянии (гипнозоиты), и только после окончания этого периода они начинают превращаться в мерозоиты, способные заражать эритроциты. Таким образом, это обусловливает возможность длительной инкубации и возникновение отдаленных рецидивов (до 3 лет).
Эритроцитарную шизогонию сопровождают циклическое развитие и множественное деление паразитов, при этом малярийные плазмодии проходят следующие стадии: юный трофозоит (имеет форму кольца), развивающийся трофозоит, зрелый трофозоит (имеет крупное ядро), развивающийся шизонт, зрелый шизонт. После завершения процесса шизогонии эритроцит разрушается. Свободные мерозоиты активно проникают в новые эритроциты, но бóльшая их часть погибает от воздействия защитных иммунных механизмов хозяина. Продолжительность эритроцитарной шизогонии составляет у Р. vivax, P. ovale, P.
falciparum 48 ч, а у Р. malariae - 72 ч. Во время эритроцитарного цикла часть мерозоитов превращается в половые формы - женские (макрогаметоциты) или мужские (микрогаметоциты). Гаметоциты попадают в организм комара-переносчика, когда он питается кровью больного малярией или паразитоносите-ля, содержащей зрелые гаметоциты. В желудке комара через 9-12 мин мужской гаметоцит выбрасывает восемь тонких подвижных жгутов. Свободные жгуты (микрогаметы) проникают в женскую клетку (макрогамету); после слияния ядер образуется зигота - круглая оплодотворенная клетка. Далее последовательно развиваются оокинеты, ооцисты со спорозоитами, их дозревание проходит в слюнных железах комара. При оптимальной температуре воздуха окружающей среды (25 °С) спорогония продолжается 10 дней у Р. vivax, 12 дней у P. falciparum, 16 дней у Р. malariae и Р. ovale; при температуре воздуха ниже 15 °С спорозоиты не развиваются.
ЭПИДЕМИОЛОГИЯ
Малярия остается наиболее широко распространенной в мире тропической болезнью и является серьезнейшей проблемой здравоохранения для 106 стран Азии, Африки, Южной Америки. По данным ВОЗ (2014), в настоящее время 82 страны мира являются высокоэндемичными, остальные находятся в предэли-минационном периоде или достигли элиминации малярии на своих территориях. По оценкам ВОЗ (2014), в период с 2000 по 2013 г. произошло снижение случаев заболевания малярией в год с 227 млн до 198 млн. Смертность в 2013 г. составила предположительно 584 тыс. случаев (в пределах неопределенности от 367-755 тыс.). Около 90% летальных исходов регистрируется в африканском регионе, из них 70% умерших от малярии, преимущественно от тропической, составляют дети первых 5 лет жизни. В России регистрируются только завозные случаи малярии.
Источником возбудителя инфекции является только человек, переносчиком - комары
рода Anopheles. Малярия - природно-очаговая инфекция. Ее распространение в эндемичных регионах носит зонально-очаговый характер, определяемый сочетанием природных и социально-экономических факторов. P. vivax - возбудитель трехдневной малярии, широко распространен в странах Азии, Океании, Южной и Центральной Америки; на африканском континенте P. vivax постоянно обнаруживается в странах Восточной Африки у арабов, индийцев, эфиопов, европейцев; в странах Западной Африки, заселенной преимущественно представителями негроидной расы, P. vivax не встречается, что объясняется генетически обусловленной врожденной невосприимчивостью африканских негров к этому виду
плазмодиев. Ареал P. ovale невелик и состоит из 2 частей. Основная - африканская часть, занимает тропическую Африку от Гамбии - на севере до Конго - на юге континента. Вторая часть ареала - это страны западной части Тихого океана и Юго-Восточной Азии. Географический ареал тропической малярии простирается от 40° с.ш. до 20° ю.ш. P. falciparum и обусловливает до 50% заболеваемости малярией в мире. Четырехдневная малярия в настоящее время встречается в Африке, некоторых районах Центральной и Южной Америки, в странах Карибского бассейна, Юго-Восточной Азии. P. кnowlesi, резервуаром которого являются обезьяны, регистрируется в природных очагах Юго-Восточной Азии.
Возможны три пути передачи малярии: 1) через комара; 2) от матери плоду или новорожденному (вертикальная передача); 3) трансфузионно через кровь или при медицинских манипуляциях при нарушении асептики при инъекциях (шизонтная малярия). Первый путь является основным, обеспечивающим существование малярийных паразитов как биологических видов.
Источником инфекции является больной малярией человек или здоровый пара-зитоноситель, в крови которого имеются зрелые гаметоциты. Эпидемиологическая опасность источника инфекции определяется численностью гаметоцитов в крови, длительностью периода гаметоносительства и доступностью его комарам. При заражении P. falciparum человек становится источником инфекции спустя 10-12 дней после начала паразитемии и может оставаться им в течение 2 мес и более до того времени, когда бесполые паразиты исчезнут естественным путем или под влиянием лечения. При заражении другими видами малярии человек является источником инфекции от момента появления бесполых форм (14-21-й день болезни) до их исчезновения. Период развития гаметоцитов лишь на несколько часов превышает время развития бесполых форм. Гаметоциты погибают спустя несколько часов после созревания.
При вертикальной передаче малярии плод может заражаться через плаценту, что наблюдается редко. Чаще заражение происходит в родах, при попадании неко-
торого количества материнской крови в кровоток плода при отслойке плаценты. Вертикальная передача инфекции происходит у неиммунных к малярии матерей. У коренных жителей эндемичных очагов рождается иммунный ребенок, остающийся устойчивым к малярии в течение нескольких месяцев.
Восприимчивость к малярии всеобщая. Исключение составляют коренные жители Западной Африки, обладающие врожденной невосприимчивостью к Р. vivax, обусловленной отсутствием на эритроцитах африканцев рецептора для мерозоитов этого вида - изоантигенов Даффи (Fyа или Fyв). Для гиперэндемичных очагов тропической Африки, где преобладает P. falciparum, характерна относительно стабильная иммунологическая структура коренного населения: дети в возрасте до 6 мес не заболевают благодаря пассивному иммунитету, полученному от матери; большинство детей в возрасте 6-24 мес поражены P.
falciparum; пассивный иммунитет угас, активный еще не развит; в этой группе наблюдают самую высокую смертность от малярии; у детей старше 2 лет P. falciparum обнаруживают реже, течение малярии смягчено в результате приобретенного иммунитета, с возрастом интенсивность паразитемии уменьшается; у взрослых P. falciparum обнаруживают редко вследствие высокой напряженности иммунитета, при инфицировании клинические проявления отсутствуют.
Легко протекает тропическая малярия также у носителей аномального гемоглобина S (серповидноклеточная анемия) и лиц с некоторыми другими генетически обусловленными аномалиями гемоглобина и ферментов эритроцитов (дефицит Г-6-ФДГ). Малярия - сезонная инфекция. Передача ее приходится на сезон активности комаров, т.е. на теплое время года. В районах с умеренным и субтропическим климатом сезон передачи ограничивается летнеосенними месяцами с устойчивой среднесуточной температурой выше 16 °С. Длительность его колеблется от 1,5 до 6-7 мес. В тропической зоне продолжительность сезона передачи
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
инфекции является круглогодичной, а перерывы в передаче малярии связаны с режимом осадков.
Под влиянием комплекса климатогеографических и социально-экономических факторов в различных регионах сформировались очаги малярии. Очагом малярии считают населенный пункт с прилегающими к нему анофелогенными водоемами. О пораженности населения малярией судят по ряду маляриометрических индексов: паразитарный (процент лиц с паразитемией среди обследованной группы); селезеночный (процент лиц с увеличенной селезенкой в группе обследованных лиц) и другим, а также результатам серологических и эпидемиологических исследований.
По классификации ВОЗ различают 4 степени эндемии:
1)гипоэндемия - селезеночный индекс у детей от 2 до 9 лет в пределах 10%;
2)мезоэндемия - селезеночный индекс у детей 2-9 лет в пределах от 11 до 50%;
3)гиперэндемия - селезеночный индекс у детей 2-9 лет постоянно выше 50%;
4)голоэндемия - паразитарный индекс у детей в возрасте до 1 года постоянно выше 75%, селезеночный индекс у взрослых низкий (африканский тип) и лишь в отдельных районах высокий (новогвинейский тип).
Случаи малярии классифицируют как завозные, вторичные от завозного, местные, прививные.
Рецидивом называют случай малярии с повторными проявлениями болезни через несколько месяцев после первого заболевания, если лечение было неполным (например, без приема примахина при трехдневной малярии) или некачественным (несоблюдение режима приема препарата, истекший срок годности препарата и др.). Первичные проявления трехдневной малярии вне сезона передачи (например, весной следующего года) нельзя считать рецидивами, это - первичные проявления после длительной инкубации.
МЕРЫ ПРОФИЛАКТИКИ
ВОЗ осуществляет борьбу с малярией в мире в рамках программы «Обратить малярию вспять», принятой в 1998 г. В настоящее время для европейского региона ВОЗ поставлена новая цель: ликвидировать трехдневную малярию, вызванную P. vivax, и тропическую к 2015 г. В РФ основные противомалярийные мероприятия регламентируются СанПиН 3.2.3215-14. Наиболее важным звеном в комплексе мероприятий является своевременное выявление и лечение источников инфекции. В планах борьбы с переносчиками предусматриваются энтомологические наблюдения в потенциальных очагах, гидротехнические мероприятия, обработка мест выплода комаров ларвицидами, обработка помещений имагицидами. Во время пребывания в местах, где распространена малярия, следует принимать меры предосторожности по защите от укусов комаров. Необходимо проводить консультации граждан, выезжающих в эндемичные регионы, информировать их о правильном проведении индивидуальной химиопрофилактики малярии. В рекомендациях ВОЗ отмечается, что химиопрофилактику малярии следует проводить людям, выезжающим в очаги средней и высокой эндемичности. Неиммунным беременным женщинам посещать такие районы не рекомендуется.
Индивидуальную химиопрофилактику малярии в эндемичных очагах, где распространена тропическая малярия, проводят мефлохином, который рекомендуется принимать 1 раз в неделю по 250 мг в течение всего периода пребывания в очаге, но не более 6 мес. В настоящее время часто используют маларонρ - таблетки для взрослых - 250 мг атовахонаρ + 100 мг прогуанила гидрохлорида, 1 таблетка за день до въезда в зону риска заражения,
ежедневно 1 таблетка в эндемичном очаге и 7 дней после выезда. Хлорохин применяют в очагах четырехдневной, трехдневной и овале-малярии при отсутствии тропической малярии. В соответствии с существующими правилами препараты следует начинать принимать до выезда в очаг, весь период пребывания в очаге в сезон, когда существует риск заражения, и в течение 4 нед после выезда из очага. Прибывшим из высокоэндемичного региона для профилактики поздних рецидивов трехдневной и овале-малярии дополнительно назначают примахин в дозе 0,25 мг/кг (основания) в течение 14 дней. Хотя химиопрофилактика не всегда предупреждает развитие болезни, но она может предотвратить тяжелое течение малярии и летальный исход.
ПАТОГЕНЕЗ И ПАТОМОРФОЛОГИЯ
Все клинические проявления малярии обусловлены эритроцитарной шизогонией. Тканевая шизогония клинически не проявляется. Для клинической картины малярийной инфекции характерна триада симптомов: приступ лихорадки, гемолитическая анемия, гепатоспленомегалия.
Малярийный приступ связан с завершением эритроцитарной шизогонии, массовым распадом эритроцитов и выходом в кровяное русло большого числа меро-зоитов, продуктов метаболизма паразитов и гемолиза, обладающих пирогенными и токсическими свойствами, что приводит к развитию лихорадочной реакции. Приступ может возникнуть лишь тогда, когда число паразитов достигает так называемого пирогенного порога. При трехдневной, овале- и четырехдневной малярии для наступления приступа должно быть около 100 паразитов в 1 мкл крови, при тропической - до 600. Однако этот пирогенный порог является условным и зависит не столько от числа паразитов в крови, сколько от реактивности организма инфицированного человека. Известно, что при рецидивах приступы наступают при значительно более высокой паразитемии, чем при первичной малярии. Ввиду цикличности эритроцитарной шизогонии лихорадочные приступы повторяются каждые 48 ч при трехдневной, овале- и тропической малярии и каждые 72 ч - при четырехдневной.
При заражении малярией в организм человека попадает гетерогенная популяция паразитов, и шизогония в начальном периоде происходит асинхронно, в связи с чем тип лихорадки может быть неправильным. По мере формирования иммунных реакций способность к паразитированию в эритроцитах получает одна ведущая генерация плазмодия, обусловливающая свойственный данному виду ритм лихорадки. Только при тропической малярии может быть несколько ведущих генераций плазмодиев, поэтому лихорадка чаще носит неправильный характер. Экзогенным пирогенам паразитарной природы отводится в основном роль активаторов воспалительной реакции. Активированные под влиянием паразитарных антигенов лимфоциты и макрофагальные клетки выделяют большое количество цитокинов, в частности ИЛ и ФНО, свободных окислительных радикалов, происходит активация системы комплемента. Это приводит к повреждению стенок кровеносных сосудов, прежде всего на уровне микроциркуляторного русла, и другим патологическим изменениям в организме. Основным механизмом развития осложнений при тропической малярии является скопление (секвестрация) инвазированных эритроцитов в сосудах внутренних органов, преимущественно головного мозга, а также почек, печени, кишечника, костного мозга, плаценты и др. Это обусловлено изменениями свойств эритроцитов, проявляющихся цито-адгезией и розетингом. Цитоадгезия - приклеивание пораженных эритроцитов к эндотелиальным клеткам, приводит к секвестрации в капиллярах и посткапиллярных венулах. Основная роль в цитоадгезии отводится специфическим белкамлигандам, индуцируемым паразитом на поверхности эритроцитов и рецепторами, находящимися на наружной поверхности эндотелиальных клеток. В результате закупорки сосудов развивается ишемия пораженных органов. На мембранах пораженных эритроцитов появляются протуберанцы (кнобы), которые контактируют с выростами в форме псевдоподий, образующимися на эндотелиальных клетках. Некоторые штаммы Р.
falciparum имеют свойство вызывать прилипание здоровых эритроцитов к инфицированным,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
что приводит к образованию «розеток». Эритроциты становятся ригидными, что ухудшает реологические свойства крови и усугубляет нарушение микроциркуляции.
Важным повреждающим фактором является гипоксия, вызванная недостаточной кислороднотранспортной функцией зараженных эритроцитов. Наименее устойчива к гипоксии ткань мозга, что играет важную роль в генезе церебральной малярии.
Значительные нарушения возникают в системе гемостаза: при тяжелой тропической малярии наблюдаются признаки синдрома ДВС (тромбоцитопения и гипофибриногенемия). Нарушение микроциркуляции, метаболизма, отек легких, нарушение функции почек и системы гемостаза являются ведущими патогенетическими факторами развития злокачественной малярии.
Причиной анемии является разрушение эритроцитов находящимися в них паразитами. P. vivax и P. ovale инфицируют преимущественно молодые эритроциты, P. malariae поражает зрелые эритроциты, P. falciparum инфицирует эритроциты различной степени зрелости, поэтому паразитемия наиболее быстро нарастает при тропической малярии и достигает высокого уровня с поражением 20% и более эритроцитов, что приводит к интенсивному гемолизу. Дополнительными факторами гемолиза эритроцитов могут служить аутоиммунные механизмы или фиксация циркулирующих иммунных комплексов к неинфицированным эритроцитам, что также приводит к их гемолизу. В развитии анемии важную роль играет повышенная активность элементов ретикулогистиоцитарной системы, фагоцитирующей как пораженные, так и нормальные эритроциты. Развивающаяся при малярии гиперплазия ретикулоэндотелиальных элементов селезенки угнетает гемопоэз, что дополнительно усиливает анемию и тромбоцитопению.
Малярия сопровождается увеличением печени и селезенки. Вначале это обусловлено застойными явлениями в органах, но вскоре в них возникает лимфоид-ная и ретикулоэндотелиальная гиперплазия. Гемолиз эритроцитов, а также поражение гепатоцитов обусловливают желтуху.
Уменьшение всасывания углеводов и торможение глюконеогенеза в печени вызывают гипогликемию. В том же направлении действует и увеличение потребления глюкозы клетками хозяина и паразита. Активация анаэробного гликолиза приводит к накоплению лактата в крови, СМЖ и развитию ацидоза, что является одной из причин летального исхода при тяжелой тропической малярии.
Патоморфологическая картина при малярии характеризуется наличием анемии и изменением со стороны органов, богатых ретикулоэндотелиальной тканью. Вследствие отложения бурочерного пигмента гемомеланина, образующегося при разрушении эритроцитов, внутренние органы приобретают аспидно-серо-дымчатую окраску. Отмечается значительное увеличение печени и селезенки. Селезенка полнокровна, микроскопически определяются гиперплазия фолликулов, пролиферация ретикулярных клеток, нередко отмечаются инфаркты и кровоизлияния под капсулу селезенки. В печени наблюдаются гиперемия, пролиферация купферовских клеток, сосудистого эндотелия. При длительном течении болезни развиваются фиброзные изменения. В костном мозге выявляется выраженная эритробластическая реакция. В сердечной мышце обнаруживают дегенеративные изменения, кровоизлияния под внутренней оболочкой сердца. В легких находят небольшие геморрагии, сосуды легких переполнены инфицированными эритроцитами. В осложненных случаях наблюдаются пневмония, отек легких. Поражение почек при тропической малярии характеризуется увеличением и полнокровием органов, признаками интерстициального нефрита и острого тубу-лярного некроза. При длительном течении четырехдневной малярии развивается нефротический синдром, сопровождающийся отложением в клубочках активных иммунных комплексов (IgM-, IgG-комплемент). При злокачественном течении тропической малярии наблюдаются дегенеративно-деструктивные изменения коры надпочечников, некрозы и кровоизлияния, бедность органа липидами. При исследовании ЖКТ выявляются
некротические и язвенные изменения слизистой оболочки, петехиальные кровоизлияния. Наиболее характерные изменения при тяжелой тропической малярии возникают в головном мозге, где наблюдаются отек и набухание вещества мозга, периваскулярные и периганглионарные разрастания невроглии (гранулемы Дюрка). Капилляры блокированы инвазированными эритроцитами и паразитами, имеются обширные гемостазы. Развивается периваску-лярный отек с геморрагиями и очаговыми некрозами.
КЛИНИЧЕСКАЯ КАРТИНА
С учетом видовых особенностей малярийных паразитов и соответствующих различий клинических проявлений выделяют 4 формы малярии: трехдневную малярию (vivax - малярия, malaria tertiana); трехдневную овале-малярию (ovalemalaria); четырехдневную малярию (malaria quartana); тропическую малярию (falciparum-малярия, malaria tropica). В
МКБ-10 выделена отдельно - B53.1 - малярия, вызванная плазмодиями обезьян.
В соответствии с рекомендациями ВОЗ различают малярию: неосложненную, тяжелую и осложненную. Тяжелые и осложненные формы малярии характерны в основном для инфекции Р. falciparum. Болезнь, вызванная Р. vivax, Р. ovale и Р. malariae, как правило, имеет доброкачественное течение.
В течении малярийной инфекции различают первичную малярию и рецидивы - ранние и поздние.
Первичная малярия охватывает начальный период заболевания, период разгара и реконвалесценции. Без лечения или неполноценной этиотропной терапии
болезнь переходит в период рецидивного течения. Различают экзоэритроцитар-ные и эритроцитарные рецидивы, а по времени их развития, соответственно, - ранние и поздние.
Эритроцитарные рецидивы наблюдаются при заражении всеми видами плазмодиев. Ранние возникают в период до 2 мес после первичных приступов, развивающиеся в более поздние сроки относят к поздним рецидивам. При нелеченной или неадекватно леченной трехдневной и овале-малярии наступает «затишье» длительностью 6-11 мес с исчезновением паразитов из крови и клиническим «выздоровлением». Затем наступают поздние рецидивы (обусловленные активацией гип-нозоитов в печени), которые без лечения снова сменяются латентным периодом, после чего заболевание опять рецидивирует. Продолжительность существования в организме человека (без лечения) для P. falciparum составляет до 1,5 лет, для Р. vivax и Р. ovale - до 3 лет, для Р. malariae - многие годы, иногда пожизненно. Трехдневная малярия
Инкубационный период составляет от 10-21 дня или 6-14 мес. Продромальные явления перед первичным малярийным приступом наблюдаются редко, но часто предшествуют рецидивам. Они проявляются чувством общего недомогания, слабостью, разбитостью, болями в поясничной области, конечностях, незначительным подъемом температуры тела, снижением аппетита, головной болью. Продолжительность продромального периода в среднем составляет 1-5 дней. Вначале температурная кривая носит неправильный характер (инициальная лихорадка), что объясняется несинхронным выходом в кровь нескольких генераций P. vivax. В последующем начинаются типичные малярийные пароксизмы с интермиттирующей лихорадкой. В малярийном лихорадочном приступе клинически отчетливо выражены три фазы, непосредственно следующие одна за другой: стадия озноба, жара и потливости. Приступ начинается с озноба, интенсивность которого может быть разной: от легкого познабливания до потрясающего озноба. Кожа становится сухой, на ощупь шероховатой или «гусиной», холодной, конечности и видимые слизистые - цианотичными. Отмечаются сильная головная боль, иногда рвота, боли в суставах и поясничной области. Стадия озноба продолжается от нескольких минут до 1-2 ч и сменяется стадией жара. Температура тела достигает 40-41 °С, кожный покров становится сухим и горячим, лицо
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
краснеет. Головная боль, боли в поясничной области и суставах усиливаются. Стадия жара продолжается от одного до нескольких часов и сменяется периодом потоотделения. Температура тела критически падает, потоотделение нередко профузное. Продолжительность приступа составляет 6-10 ч. Характерным считается наступление приступов болезни в утренние и дневные часы. После приступа наступает период апирексии, который длится около 40 ч. Интервал между приступами 48 ч. После 2-3 приступов отчетливо выявляются увеличенные в размерах печень и селезенка. Изменения в крови характеризуются гипохромной анемией, развивающейся постепенно со 2-й недели болезни. В периферической крови выявляются лейкопения, нейтропения с палочкоядерным сдвигом, относительный лифоци-тоз, анэозинофилия и повышенная СОЭ. При естественном течении болезни без противопаразитарного лечения после 12-14 приступов интенсивность лихорадки уменьшается, приступы постепенно угасают, размеры печени и селезенки сокращаются. Однако спустя 2 нед - 2 мес вновь возникают приступы лихорадки - ранние рецидивы, характеризующиеся синхронной температурной кривой, увеличением печени и селезенки, анемией. В последующем, с нарастанием иммунитета, паразиты исчезают из крови и наступает латентный период. Если в этот период не провести лечение гистошизотропными препаратами, то через 6-8 мес, а иногда спустя 1-3 года произойдет активация «дремлющих» в гепатоцитах тканевых форм паразитов и разовьются отдаленные рецидивы. Отдаленные рецидивы характеризуются острым началом, более легким течением, ранним увеличением селезенки, коротким
числом приступов до 7-8, меньшей интенсивностью и длительностью паразитемии, наличием гаметоцитов в крови.
Овале-малярия
Овале-малярия по многим клинико-патогенетическим признакам сходна с трехдневной vivaxмалярией. Инкубационный период продолжается 11-16 дней. При овале-малярии наблюдается склонность возбудителя к первичной латенции: длительность инкубационного периода может растянуться от 2 мес до 2 и более лет. В клинической картине с первых дней болезни преобладает интермиттирующая трехдневная лихорадка, реже наблюдается ежедневная. Лихорадочные приступы с большим постоянством, в отличие от других видов малярии, наблюдаются в вечерние часы. Овале-малярия характеризуется преимущественно легким течением с небольшим числом приступов, что объясняют быстрым развитием высокого уровня иммунитета. Приступы протекают без выраженных ознобов и с меньшим уровнем температуры тела. При отсутствии лечения гистошизотропными препаратами возможны от 1 до 3 рецидивов с интервалом от 17 дней до 7 мес.
Четырехдневная малярия
Инкубационный период от 3 до 6 нед. Продромальные симптомы наблюдаются редко. Начало болезни острое. С первого приступа устанавливается интермит-тирующая лихорадка с периодичностью приступов через 2 сут. Приступ обычно начинается в полдень, средняя его продолжительность около 13 ч. Период озноба длительный и резко выражен. Период жара продолжается до 6 ч, сопровождается головной болью, миалгиями, артралгиями, иногда тошнотой, рвотой. Могут наблюдаться беспокойство больных и бред. В межприступный период состояние больных удовлетворительное. Анемия, гепатоспленомегалия развиваются медленно - не ранее чем через 2 нед от начала болезни. Проявления четырехдневной малярии купируются без лечения после 8-14 приступов, но процесс эритроцитар-ной шизогонии на низком уровне длится многие годы. Чаще всего болезнь протекает без активизации эритроцитарной шизогонии в виде паразитоносительства, что делает таких лиц потенциально опасными донорами. Заболевание протекает обычно доброкачественно, однако в эндемичных очагах четырехдневная малярия ответственна за развитие нефротического синдрома с неблагоприятным прогнозом у детей.
Тропическая малярия
Наиболее тяжелая форма малярийной инфекции. Инкубационный период составляет 8-16 дней. В конце его у части неиммунных лиц отмечаются продромальные явления продолжительностью от нескольких часов до 1-2 дней: недомогание, слабость, разбитость, ломота в теле, миалгии и артралгии, головная боль. У большинства больных болезнь начинается остро, без продромы, с подъема температуры тела до 38-39 °С. Характерно отсутствие цикличности приступов лихорадки. Приступ начинается с озноба, продолжительность которого составляет от 30 мин до 1 ч. В этот период больной бледен, кожа холодная, нередко с шероховатостью по типу «гусиной кожи». Озноб сопровождается подъемом температуры тела до 38-39 °С. С прекращением озноба наступает вторая фаза приступа - жар. У больных появляется легкое чувство тепла, иногда они испытывают чувство истинного жара. Кожа горячая, сухая, лицо - гиперемировано. Продолжительность этой фазы - около 12 ч, и она сменяется слабовыраженной потливостью. Температура тела падает до нормальных и субнормальных цифр и через 1-2 ч повышается снова. В некоторых случаях начало тропической малярии сопровождается тошнотой, рвотой, диареей. Наблюдаются: кашель, насморк, боли
в горле. В более поздние сроки появляются герпетические высыпания на губах и крыльях носа. В острой стадии у больных отмечается гиперемия конъюнктив, при тяжелом течении заболевания возможны петехиальные или более крупные субконъюнктивальные кровоизлияния. В периоде разгара озноб менее выражен, чем в первые дни болезни, его продолжительность составляет всего 15-30 мин. Лихорадка продолжается сутками, периоды апирексии регистрируются редко. При легком течении болезни высота температуры тела у больных достигает 38,5 °С, продолжительность лихорадки - 3-4 дня; при средней степени тяжести соответственно - 39-39,5 °С и 6-7 дней. Тяжелое течение болезни характеризуется повышением температуры тела до высокого уровня - 40 °С и выше, продолжительность лихорадочного периода составляет 8 и более дней. Длительность отдельных приступов (а по существу наслоение нескольких) при тропической малярии достигает 30-40 ч. Преобладает неправильный тип температурной кривой, реже наблюдается ремиттирующий, изредка - интермиттирующий и постоянный типы. Увеличение печени и селезенки обычно определяется на 3-й день болезни. При УЗИ органов брюшной полости увеличение размеров печени и селезенки определяется уже на 2-3-й день от начала клинических проявлений тропической малярии. Нарушения пигментного обмена наблюдаются у больных с тяжелым и, реже, среднетяжелым течением тропической малярии. Более чем троекратное повышение активности аминотрансфераз в сыворотке крови расценивают как показатель неблагоприятного прогноза. К метаболическим нарушениям относят изменения в системе гемостаза и гипогликемию. Нарушения со стороны сердечно-сосудистой системы проявляются тахикардией, приглушенностью сердечных тонов, гипотензией. При тяжелой форме болезни появляются изменения на ЭКГ в виде деформации конечной части желудочкового комплекса - уплощения и отрицательного зубца Т, снижения
сегмента ST, снижение вольтажа зубца R в стандартных отведениях. При тропической малярии часто наблюдаются нарушения со стороны ЦНС, связанные с высокой лихорадкой и интоксикацией: головные боли, рвота, явления менин-гизма, судороги, сонливость, иногда делириоподобные состояния, но, в отличие от церебральной формы, сознание больного сохранено. Характерными являются гемолитическая анемия и лейкопения, а в лейкоцитарной формуле - эозино- и нейтропения, относительный лимфоцитоз. При тяжелых формах болезни нередко отмечается нейтрофильный лейкоцитоз; СОЭ постоянно и значительно повышена. Тромбоцитопения - признак, типичный для всех видов малярии. Как и при других инфекционных болезнях у больных наблюдается лихорадочная протеинурия преходящего характера.
Рецидивирующее течение тропической малярии обусловлено либо неполноценным этиотропным лечением, либо наличием резистентности P. falciparum к используемым химиопрепаратам. Естественное течение тропической малярии с благоприятным исходом продолжается не более 2 нед. При отсутствии этиотроп-ной терапии через 7-10 дней
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
наступают рецидивы. Беременность является общепризнанным фактором риска при тропической малярии. Это связано с более высокой заболеваемостью беременных женщин, склонностью к тяжелым клиническим формам, риском для здоровья и жизни ребенка, с ограничением терапевтического арсенала.
Малярия у детей
У детей, как и у взрослых, трехдневная и ovale-малярии протекают сходно. Строгая периодичность приступов, свойственная малярии взрослых, у детей бывает редко. Чаще встречаются ежедневные приступы различной продолжительности, возникающие в разное время суток. У детей старшего возраста в начале болезни нередко наблюдается лихорадка постоянного типа, сменяющаяся типичными приступами. Во время приступа появляются бледность кожных покровов, цианоз,
иногда рвота, понос, общее беспокойство, судороги. В некоторых случаях отмечаются боли в животе, аппендикулярный синдром, требующий срочной консультации хирурга. Печень и селезенка увеличиваются рано и почти одновременно. При прогрессировании болезни селезенка может достигать больших размеров. Быстро развивается анемия. При трехдневной и ovale-малярии случаи со смертельными исходами - явление редкое, они встречаются у детей с резко выраженной анемией и дистрофией. У детей и подростков, получавших неадекватную терапию или не получавших лечение вовсе, описана злокачественная молниеносная форма трехдневной малярии. Она наблюдалась в средней полосе бывшего
СССР, преимущественно в весенний период года. Поражались обычно дети в возрасте от 4 до 12 лет, болевшие ранее трехдневной малярией. Злокачественные проявления малярии возникали при рецидивах или в начале болезни, чаще во время второго приступа. Внезапно во время пароксизма лихорадки появлялись сильные головные боли, рвота, судороги, сонливость, переходящая в бессознательное состояние. Через несколько часов наступала смерть. При патологоанатомическом исследовании погибших обнаруживалось острое набухание и усиленное кровенаполнение вещества головного мозга. В отличие от малярийной комы при falciparum-малярии, в капиллярах мозга выявлялись лишь единичные плазмодии. Молниеносная форма трехдневной малярии рассматривалась как гиперергическая реакция детского организма. Однако при ретроспективном анализе в подобных случаях нельзя исключить смешанную патологию: трехдневную малярию и нейровирусную инфекцию. Четырехдневная малярия у детей очень напоминает трехдневную, за исключением периодичности приступов. Однако известно, что четырехдневная малярия у детей может осложняться нефротическим синдромом, в основе которого лежит отложение иммунных комплексов на базальной мембране клубочков с повреждением ее и дегенеративными изменениями в канальцах. Чаще всего нефротический синдром развивается у детей в возрасте 5-8 лет. В этом же возрасте регистрируется и наибольшая заболеваемость четырехдневной малярией, что также подтверждает ассоциативную связь между инфекцией P. malariae и нефротическим синдромом.
В тропических странах с высоким уровнем эндемии (голо- и гиперэндемичные
очаги) falciparum-малярия остается одной из главных причин заболеваемости и смертности детей; от 5 до 15% всех случаев смерти приходится на эту болезнь. Наиболее часто и тяжело болеют дети от 6 мес до 4-5 лет, поэтому тропическую малярию у них обоснованно считают потенциально смертельной болезнью. Тропическая малярия у детей старшего возраста протекает обычно так же, как и у взрослых, и особых диагностических трудностей не представляет. У детей до 3-4 лет, особенно у детей грудного возраста, falciparum-
малярия отличается своеобразием клинической картины, в которой отсутствует самый яркий клинический симптом - малярийный приступ. В то же время наблюдаются такие симптомы, как судороги, рвота, понос, боли в животе, с быстро прогрессирующим ухудшением состояния ребенка. Отличия состоят в том, что в периоде апирексии температура не снижается до нормы, поэтому наблюдается ремиттирующая лихорадка, или в том, что с каждым разом приступы начинаются все раньше. У детей грудного возраста первые
приступы тропической малярии бывают очень тяжелыми, болезнь быстро приобретает злокачественное течение и может закончиться смертью. Ребенок становится вялым, капризным, беспокойным, у него пропадает аппетит, возможна рвота съеденной пищей. Температура тела повышается до 38-40 °С, лихорадка может быть постоянной, ремиттирующей, интермиттирующей, но нередко имеет неправильный гектический характер. Озноб часто отсутствует, приступ начинается с побледнения, затем синюшности кожи, похолодания конечностей, могут появляться выраженные симптомы нейротоксикоза, судороги, рвота, менингеальный синдром. При развитии малярийной комы появляются резкое беспокойство, затем прострация, маскообразное лицо, безучастный взгляд, судороги, рвота, потеря сознания. У детей грудного возраста отмечается выраженная
лабильность водно-солевого обмена, что предрасполагает к развитию отека органов и тканей, в том числе и головного мозга. Часто появляются боли в животе и жидкий стул. В испражнениях может быть примесь слизи и крови, иногда стул водянистый. Упорная диарея может вызвать тяжелую дегидратацию. Живот обычно увеличен в объеме. Отмечается болезненность в подреберьях. Селезенка увеличена, легко пальпируется, болезненна. При частых повторных заражениях селезенка может достигать больших размеров и занимать почти всю брюшную полость. Болезненность селезенки увеличивается при развитии периспленита или инфаркта. Известны случаи самопроизвольного или в результате травмы разрыва селезенки. Следует подчеркнуть, что увеличение селезенки у детей грудного возраста при малярии наблюдается непостоянно и примерно у 20% больных не выявляется вовсе. У детей старше 2 лет селезенка увеличена чаще, степень увеличения ее зависит от продолжительности болезни и сопутствующей алиментарной дистрофии. Нередко отмечаются увеличение и уплотнение печени, иногда ее болезненность, но реакция печени менее выражена, чем селезенки. Чем меньше возраст ребенка, тем быстрее развивается и нарастает анемия. Уровень гемоглобина в запущенных случаях падает до 30-50 г/л, уменьшается число эритроцитов до 2-1×1012/л. Характерен ретикулоцитоз. Наблюдаются лейкопения, эозинофилия, относительный лимфо- и моноцитоз, хотя во время приступов возможен нейтро-фильный лейкоцитоз, повышенная СОЭ. Паразитемия у детей младшего возраста обычно высокая: P. falciparum может поражать до 20% эритроцитов. Тяжелая анемия у детей сопровождается гипоксемией и гипоксией органов и тканей, поэтому кожа и видимые слизистые оболочки становятся бледными с землистым оттенком, развивается гипотрофия. Если лечение не проводилось, то состояние ребенка быстро ухудшается и наступает летальный исход. Усугубляет прогноз присоединение интеркуррентных заболеваний: пневмонии, сальмонеллеза и других кишечных инфекций. Малярия у людей, вызванная P. knowlesi, регистрируемая в Юго-Восточной Азии практически только среди туристов, клиническими проявлениями и тяжестью течения во многом схожа с тропической малярией.
Осложнения
Наблюдаются преимущественно при тропической малярии и возможны на всех стадиях болезни. Прогностически неблагоприятные клинические признаки, указывающие на возможность развития злокачественной малярии, - ежедневная лихорадка, отсутствие апирексии между приступами, сильная головная боль, генерализованные судороги, повторяющиеся чаще 2 раз за 24 ч, децере-брационная ригидность, гемодинамический шок (систолическое давление ниже 70 мм рт.ст. у взрослого и менее 50 мм рт.ст. у ребенка). Об этом свидетельствуют также результаты микроскопического исследования крови: высокая паразитемия (более 100 тыс. Р. falciparum в 1 мкл крови), обнаружение различных возрастных стадий паразита в периферической крови, наличие гаметоцитов, нарастающий лейкоцитоз (более 12×109/л). Показателями плохого прогноза являются также следующие лабораторные данные: снижение глюкозы крови менее 2,2 ммоль/л, декомпенсированный метаболический ацидоз, более чем троекратное повышение активности аминотрансфераз в сыворотке крови, а
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
также низкий уровень глюкозы в цереброспинальной жидкости и высокий уровень молочной кислоты (более 6 мкмоль/л), выраженная гипоальбуминемия.
Церебральная (мозговая) малярия. Под этим названием объединены тяжелые поражения ЦНС при тропической малярии, основным исходом которой является развитие коматозного состояния.
Малярийная кома может являться осложнением первичной, повторной и рецидивирующей малярии, но чаще наблюдается при первичной малярии. Встречается преимущественно у детей, беременных женщин и у лиц молодого и среднего возраста. В клинической картине церебральной малярии выделяют три периода: сомноленции, сопора и истинной комы. Стадия сомноленции характеризуется психической и физической вялостью больного, быстрым истощением. Больной ориентирован во времени и пространстве, но в контакт вступает неохотно, отвечает на вопросы односложно, быстро утомляется. Сухожильные рефлексы сохранены. Следующая за ней стадия сопора проявляется глубокой прострацией больного с редкими проблесками сознания. Возможны атаксия, амнезия, судороги, иногда эпилептиформного характера. Роговичные рефлексы сохранены, зрачки нормальные. Сухожильные рефлексы повышены, появляются патологические рефлексы. При истинной коме больной на внешние раздражители не реагирует. Наблюдаются нарушение конвергенции, расходящееся косоглазие, плавающие движения глазных яблок при открытых веках (как будто больной осматривает потолок), горизонтальный и вертикальный нистагм, паралич VI пары черепно-мозговых нервов; сухожильные и брюшные рефлексы отсутствуют, резко нарушены вегетативные функции. Выражены менингеальные симптомы и патологические рефлексы Бабинского, Россолимо и др. У детей старше 4 лет и взрослых для оценки степени нарушения сознания и комы, как и при других поражениях ЦНС, используют шкалу комы Глазго (1974). При спинномозговой пункции выявляется повышение внутричерепного давления без выраженных нарушений белкового и клеточного состава ликвора. При церебральной малярии возможно развитие психозов. В остром периоде психозы протекают в виде делирия, аменции, маниакальных состояний. Возможны эпилептические приступы. Для постмалярийных психозов характерны депрессия, психическая слабость, истерия, шизофренопо-добные синдромы, у детей возможна временная задержка психического развития. Иногда наблюдаются отдаленные последствия церебральной малярии: гемипле-гия, атаксия, очаговая симптоматика со стороны черепномозговых нервов, экстрапирамидные нарушения, моно- и полиневриты.
Гипохромная анемия относится к частым осложнениям всех форм малярийной инфекции. Тяжелая анемия диагностируется в случаях, когда гематокрит падает ниже 20%, а уровень гемоглобина - менее 50 г/л.
Серьезными проявлениями малярии являются нарушения гемостаза: кровоточивость десен, кровоизлияние в сетчатку глаз, спонтанные носовые и желудочно-кишечные кровотечения, ДВС-синдром.
ОПН диагностируется при уменьшении выделения мочи менее 400 мл/сут у взрослого и менее 12 мл/кг у детей (и нет эффекта применения фуросемида), креа-тинин сыворотки крови превышает 265 ммоль/л, мочевина - более 21,4 ммоль/л, возникает гиперкалиемия. Различают следующие стадии ОПН: начальную, оли-гоанурии, полиурии.
Гемоглобинурийная лихорадка является следствием массивного внутрисо-судистого гемолиза, что может быть обусловлено интенсивной инвазией или применением некоторых противомалярийных препаратов (хинин, примахин, сульфаниламиды) у лиц с дефицитом фермента глюкозо-6-фосфатдегидрогеназы (Г-6-ФД). При тяжелой ее форме развиваются интенсивная желтуха, выраженный геморрагический синдром, анемия и анурия, сопровождающиеся ознобом, высокой лихорадкой (40 °С), болями в поясничной области, повторной рвотой желчью, миалгиями, артралгиями. Моча приобретает темно-коричневый цвет, что обусловлено наличием оксигемоглобина. Число эритроцитов в тяжелых случаях
снижается до 1×1012/л, а уровень гемоглобина - до 20-30 г/л. Паразитов в крови при малярийной гемоглобинурии очень мало или они вовсе не обнаруживаются. При быстрой отмене противомалярийного препарата, вызвавшего гемолиз эри-
троцитов, состояние больного улучшается без серьезных последствий. В тяжелых случаях изза развития ОПН прогноз может быть неблагоприятным.
Малярийный алгид характеризуется клиническими проявлениями, свойственными ИТШ: нарушениями гемодинамики, микроциркуляции, нарушениями в системе гемостаза, полиорганной недостаточностью и гипотермией. В отличие от церебральной малярии сознание сохранено, хотя в дальнейшем возможно развитие комы. Алгид может развиваться на фоне отека легких, метаболического ацидоза и резкого обезвоживания. Обычно отмечается высокий уровень паразитемии. Прогноз во многом зависит от своевременного и адекватного лечения.
Острый отек легких у больных тропической малярией часто приводит к летальному исходу. Механизм этого тяжелейшего осложнения окончательно не изучен. Отек легких может быть спровоцирован избыточной регидратацией, гипопро-теинемией. Он может развиться и на фоне нормального давления в малом круге кровообращения.
Разрыв селезенки является редким, но грозным осложнением при любой клинической форме малярии. Разрыв органа может быть вызван перекрутом ее ножки с острым застоем крови и развитием субкапсулярной гематомы.
Нефротический синдром является осложнением четырехдневной малярии. Отличается медленным, неуклонно прогрессирующим течением с нарастанием протеинурии, гипопротеинемии, распространенными отеками, артериальной гипертонией и почечной недостаточностью. Отеки столь выражены, что дети не могут открыть глаза. Это весьма характерный симптом, который дает возможность поставить диагноз с «первого взгляда». Протеинурия достигает 10-20 г/сут. Моча содержит значительное количество глобулинов, в некоторых случаях экскреция глобулинов превышает экскрецию альбумина.
Поражения глаза возможны при тропической малярии: кератит, реже встречаются ирит, иридоциклит, помутнение стекловидного тела, хориоретинит и кровоизлияния в сетчатку. Иногда наблюдается неврит зрительного нерва, имеются сообщения о парезах III, IV и VI пар черепных нервов, паралич аккомодации.
ДИАГНОСТИКА
Диагностика малярии основывается на анализе клинической картины болезни, эпидемиологического анамнеза с обязательным подтверждением диагноза обнаружением малярийных паразитов в периферической крови. Вероятность диагноза малярии увеличивается, если в эпидемиологическом анамнезе установлено пребывание в эндемичном регионе до начала заболевания, гемотрансфузии и иные парентеральные манипуляции в период до 3 мес до начала заболевания.
Лабораторная диагностика
Основным методом лабораторной диагностики малярии является микроскопическое исследование препаратов крови («толстой капли» и «тонкого мазка»), окрашенных по Романовскому-Гимзе (МУК 4.2.3222-14 «Лабораторная диагностика малярии и бабезиозов»). Обследованию на малярию подлежат: лихорадящие больные с неустановленным диагнозом в течение 3 дней в эпидемический сезон и 5 дней в остальное время года; больные с продолжающимися периодическими подъемами температуры тела несмотря на проводимое лечение в соответствии с установленным диагнозом; реципиенты при повышении температуры тела в последние 3 мес после переливания крови; лица, проживающие в активном очаге, при любой лихорадке. С низкой паразитемией малярия протекает у лиц, принимавших до заболевания противомалярийные препараты с профилактической целью
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
(супрессивная терапия) или антибактериальные препараты [тетрациклин, доксициклин, котримоксазол [сульфаметоксазол + триметоприм] (Бисептол♠), сульфаниламиды], оказывающие подавляющее действие на плазмодии малярии.
Забор крови для исследования рекомендуется производить как во время лихорадки, так и в период апирексии. Исследования препаратов крови проводят в течение 2-3 сут до 3-4 раз в день. Исследование «толстой капли» предназначено для обнаружения паразитов, так как объем крови в ней в 30-40 раз больше, чем в «тонком мазке». Особенности морфологии и тинкториальных свойств (окра-шиваемости) разных возрастных стадий бесполых форм в эритроцитах хорошо различимы в «тонком мазке». Определение вида паразита обязательно, но особенно важно для P. falciparum, который имеет ряд присущих ему особенностей. При первичной инфекции другие более зрелые стадии паразита в периферической крови можно обнаружить в случаях тяжелого, злокачественного течения болезни. Гаметоциты созревают медленно, но сохраняют жизнеспособность в крови долго (до 6 нед), в то время как гаметоциты других видов погибают спустя несколько часов после своего созревания. Обнаружение гаметоцитов при тропической малярии имеет значение для суждения о периоде болезни: в раннем периоде (при неосложненном течении) обнаруживают только кольцевидные трофозоиты, в период разгара - кольца и гаметоциты (при первичном заражении и отсутствии лечения это свидетельствует о давности болезни не менее 10-12 дней); в периоде реконвалесценции находят только гаметоциты.
В последние годы для быстрого получения предварительного ответа используются экспресстесты (иммунохроматографические методы), основанные на обнаружении специфических антигенов плазмодиев. Тест-системы для экспресс-диагностики малярии, разработанные разными производителями, предназначены для детекции P. falciparum, P. falciparum + Р. vivax или Plasmodium species. Использование экспресс-тестов позволяет читать результат уже через 10 мин. Постановку реакции персонал лаборатории может освоить за 1-2 ч. Экспрессметоды позволяют производить самодиагностику людям, живущим или путешествующим в эндемичных регионах, и могут проводиться в полевой обстановке. В клинических условиях эти методы используются для предварительного диагноза малярии с обязательным параллельным паразитологическим исследованием препаратов крови.
В настоящее время особое значение приобретает ПЦР. Применение ПЦР позволяет выявлять носительство при низкой паразитемии и смешанную инфекцию разными видами плазмодиев, а также дифференцировать рецидив лекарственно-устойчивой falciparum-малярии с реинфекцией P. falciparum.
Дифференциальная диагностика
Дифференциальную диагностику малярии проводят с рядом инфекционных и неинфекционных заболеваний, сопровождающихся лихорадкой, анемией и гепатоспленомегалией. В зависимости от остроты течения болезни и ее длительности, малярию необходимо дифференцировать от гриппа и других острых респираторных вирусных инфекций, тифо-паратифозных заболеваний, лихорадки денге, пап-патачи, геморрагических лихорадок - Ласса, Марбурга, Эбола, желтой лихорадки, висцерального лейшманиоза, вирусного гепатита, сепсиса, лептоспироза, острого бруцеллеза, спирохетозов, ПТИ, милиарного туберкулеза, холангита, амебного абсцесса печени, острого пиелонефрита, лимфогранулематоза, гемолитической анемии, бабезиоза (затруднения здесь возникают даже при лабораторной диагностике, так как бабезии в форме «кольца» в препаратах крови очень напоминают P. falciparum в соответствующей стадии). Малярийную кому дифференцируют от комы мозговой, уремической, печеночной, диабетической, гипогликемической.
Пример формулировки диагноза
B50.0 Малярия тропическая (P. falciparum 124 тыс. паразитов в 1 мкл). Осложнения: церебральная форма, кома.
ЛЕЧЕНИЕ Показания к госпитализации
Больные малярией подлежат госпитализации; лечение больных тяжелыми и осложненными формами проводят в условиях ОРИТ.
Медикаментозная терапия
Этиотропное лечение больных малярией следует назначать немедленно после установления клинико-эпидемиологического диагноза и взятия крови для парази-тологического исследования.
На выбор тактики лечения оказывают влияние следующие факторы: вид возбудителя, регион, где произошло заражение (для суждения об устойчивости плазмодиев к противомалярийным препаратам), период болезни, тяжесть заболевания, наличие и характер осложнений.
В классификации противомалярийных препаратов по объекту воздействия можно выделить следующие основные группы (табл. 22.2):
◊гемошизонтоцидные - воздействуют на бесполые эритроцитарные стадии паразитов в крови, эффективны для лечения трехдневной и ovale-малярии, радикального излечения тропической и четырехдневной малярии; ◊ гистошизонтоцидные - воздействуют на преэритроцитарные стадии возбудителя в печени, обеспечивают радикальную химиопрофилактику тропической, частично - трехдневной малярии;
◊гаметоцидные - воздействуют на половые эритроцитарные стадии P.falciparum в крови, позволяют обезвредить источник инфекции; ◊ гипнозоитоцидные - воздействуют на гипнозоиты в печени, обеспечивают радикальное излечение трехдневной и ovale-малярии, радикальную химио-профилактику трехдневной малярии с длительной инкубацией.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

В России противомалярийные ЛС не производят (за исключением примахи-на), а ряд эффективных препаратов, широко применяемых за рубежом, в РФ не зарегистрирован, в частности производные артемизининаρ и комбинированные противомалярийные препараты.
Важнейшая проблема лечения малярии - устойчивость возбудителя тропической малярии Plasmodium falciparum к хлорохину, которая существует почти повсеместно. В некоторых эндемичных очагах уже наблюдают полирезистентность возбудителя к противомалярийным препаратам. У возбудителей трехдневной малярии (P.
vivax) лекарственная резистентность выражена значительно слабее и зарегистрирована только на отдельных эндемичных территориях.
При обнаружении у пациента P. vivax, P. ovale или P. malariae применяют препараты из группы 4-аминохинолинов, чаще всего хлорохин (Делагил♠). Схема лечения: первые 2 дня препарат применяют в суточной дозе 10 мг/кг основания (4 таблетки Делагила♠ за 1 прием), на 3-й день - 5 мг/кг (2 таблетки Делагила♠) однократно. Есть отдельные сообщения о резистентности штаммов P. vivax к хло-рохину в Бирме, Индонезии, Папуа - Новой Гвинее и Вануату. В таких случаях лечение следует проводить мефлохином или хинином по схеме лечения неослож-ненной малярии. Приступы прекращаются через 24-48 ч, а паразиты исчезают из крови через 48-72 ч после начала приема хлорохина.
Для радикального излечения (предупреждения отдаленных рецидивов) при малярии, вызванной P. vivax или P. ovale, по окончании курса хлорохина применяют тканевой шизонтоцид - примахин, который назначают в течение 14 дней в дозе 0,25 мг/кг (основания) в сутки. Штаммы P. vivax, резистентные к примахину (так называемые штаммы типа Чессон), встречаются на островах Тихого океана и в странах Юго-Восточной Азии. В этих случаях одной из рекомендуемых схем является прием примахина в дозе 0,25 мг/кг в сутки в течение 21 дня.
При обнаружении в крови неиммунных лиц P. falciparum в случаях нетяжелого и неосложненного течения, в соответствии с рекомендациями ВОЗ применяют схемы лечения артемизинин-комбинированными противомалярийными препара-
тами (ACT - Artemisinin-based Combination Therapies, WHO, 2010). Используются 2 или более противомалярийных препарата с разным механизмом действия: ◊ внутрь 3 сут:
атовахонρ 1000 мг + прогуанил 400 мг 1 р/сут; ◊ внутрь 3 сут: артесунатρ 4 мг/кг 1 р/сут + 1-е сутки сульфадоксин 25 мг/кг +
пириметамин 1,25 мг/кг 1 р/сут; ◊ внутрь 7 сут: артесунатρ 2 мг/кг 1 р/сут + доксициклин 3,5 мг/кг 1 р/сут; ◊ внутрь 3 сут: артесунатρ 4 мг/кг 1 р/сут + 2 сут: мефлохин 1 р/сут (1-е сутки - 15 мг/кг, 2-е сутки - 10 мг/кг); ◊ внутрь 2 сут: артеметерρ 80 мг 1 раз, затем по 80 мг через 8, 24 и 48 ч с момента первой дозы + 2 сут: люмефантринρ480 мг, затем по 480 мг через 8, 24 и 48 ч с момента первой дозы. В приведенных схемах указаны дозы препаратов для взрослых.
Подробные сведения, в том числе о комбинированных противомалярийных препаратах (коартемρ, маларонρ), см. главу 9.5 «Противопаразитарные препараты».
Для лечения детей на начальном этапе можно применять свечи с артесуна-томρ.
В странах Африки и других регионов, где не зарегистрированы полирезистентные штаммы Р. falciparum и в случаях завоза из этих стран, эффективны следующие комбинированные препараты: атовахон + прогуанил (маларонρ), артесунат + амодиахин, артесунат + пририметамин + сульфадоксин (Фансидар♠). Артесунатρ также может применяться в комбинации с тетрациклином (доксициклином) или клиндамицином. В странах ЮВА, где распространены полирезистентные штаммы Р. Falciparum, применяют: артесунат
+ мефлохин, артеметер + люмефантрин (коартемρ).
Если у больного не установлен вид возбудителя, то лечение рекомендуется проводить по схемам лечения тропической малярии. В случае появления у пациента рвоты менее чем через 30 мин после приема внутрь назначенного противомалярийного препарата следует повторно принять ту же дозу, если рвота отмечалась через 30-60 мин после приема таблеток, то дополнительно назначают половину дозы этого же препарата.
При выявлении гаметоцитоносительства P. falciparum назначают внутрь при-махин (основание) 0,25 мг/кг в сутки в течение 2-3 сут.
При тяжелой и осложненной тропической малярии средством выбора для лечения, по рекомендации ВОЗ (2010), является артесунатρ в/в капельно 7 сут: 1-я доза - 4 мг/кг, далее 2- 7-е сутки 2 мг/кгв сутки. Хинин является альтернативным ЛС для лечения
тяжелой falciparum-малярии и применяется в случае отсутствия арте-сунатаρ. Хинин
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
применяется в/в капельно [в 5% растворе декстрозы (Глюкоза♠) или изотоническом растворе медленно]: 10 мг/кг 4 ч, далее - 20 мг/кг в сутки в 2-3 введения с интервалом 8-12 ч (суточная доза для взрослого не должна превышать 2,0 г) с последующим переводом на пероральную форму препарата. Монотерапия хинином не обеспечивает радикального излечения (так как он быстро выводится из организма, а его длительное применение часто приводит к развитию побочных реакций). Поэтому после улучшения состояния больного проводят курс лечения мефлохином, Фансидаром♠ или тетрациклином.
Больным с тяжелыми и осложненными формами малярии проводят интенсивную патогенетическую терапию в условиях ОРИТ. При проведении регидратации следует опасаться отека легких и мозга, однако не менее опасно и состояние гипо-волемии. При недостаточной регидратации у таких больных может развиться шок и почечная недостаточность. Развивающаяся анемия обычно не угрожает жизни больного, но если гематокрит снижается до 15-20%, то следует переливать эри-троцитарную массу или цельную кровь. Переливание свежей цельной крови или концентратов факторов свертывания и тромбоцитов применяют при развитии ДВС. При гипогликемии следует прибегнуть к внутривенному введению 40% раствора декстрозы (Глюкозы♠). Основу терапии при отеке мозга составляют дезинтоксикация,
дегидратация, оксигенотерапия, борьба с гипоксией мозга и дыхательными расстройствами. По показаниям вводят противосудорожные средства. Опыт лечения церебральной малярии доказал неэффективность и даже опасность применения некоторых ЛС: осмотических диуретиков, декстранов с низким молекулярным весом, эпинефрина (Адреналина♠), простациклина, пентоксифиллина (Трентала♠), циклоспорина, гипериммунных сывороток. Не рекомендуется также проведение гипербарической оксигенации. В случаях развития острой почечной или печеночно-почечной недостаточности суточную дозу хинина уменьшают до 10 мг/кг из-за возможной кумуляции препарата и вводят растворы очень медленно - 20 капель в минуту. В начальный период ОПН назначают форсированный диурез, а при отсутствии эффекта и нарастании азотемии проводят гемодиализ. Однако следует иметь в виду, что гемодиализ способен корригировать гомеостаз кратковременно. В настоящее время показано, что значительно эффективнее применение для этих целей продленной вено-венозной гемодиафильтрации. При развитии гемоглобинурийной лихорадки отменяют препарат, вызвавший гемолиз, при необходимости заменяют другим противомалярийным ЛС, одновременно назначают глюкокортикоиды (преднизолон 1-2 мг/кг), дезинтоксикационную терапию. При разрыве селезенки показано экстренное хирургическое вмешательство.
Для лечения рецидивов тропической малярии подбирают ранее не применявшийся препарат либо используют прежний, но в комбинации с другими противомалярийными ЛС. Лечение гаметоносительства проводят примахином в течение 1-3 дней в обычных терапевтических дозах.
Для лечения больных малярией, вызванной P. knowlesi, применяются описанные выше схемы лечения falciparum-малярии.
В процессе лечения проводят определение уровня паразитемии в динамике в периферической крови. Через сутки после начала этиотропного лечения уровень паразитемии должен снизиться на 25% и более, на 3-й день - не должен превышать 25% исходного. Наличие паразитов в препарате крови на 4-й день после начала лечения при соблюдении всех условий успешной терапии служит признаком резистентности возбудителя к применяемому препарату.
Прогноз
В подавляющем большинстве случаев летальность обусловлена тропической малярией, а именно ее церебральной формой, которая встречается в 10% случаев тяжелого
течения falciparum-малярии. Летальные исходы от других видов малярии очень редки. Но и
тропическая малярия при своевременной диагностике и адекватном лечении заканчивается полным выздоровлением.
Диспансеризация
За больными, перенесшими тропическую малярию, рекомендуется установить диспансерное наблюдение в течение 1-1,5 мес и с интервалом 1-2 нед проводить паразитологическое исследование крови. Диспансеризация больных, перенесших малярию, вызванную P. vivax, P. ovale, P. malariae, должна проводиться в течение 2 лет. Любое повышение температуры тела у этих лиц требует лабораторного исследования крови с целью обнаружения малярийных плазмодиев.
22.4. ТОКСОПЛАЗМОЗ
Токсоплазмоз ( англ. toxoplasmosis) - протозойная болезнь, вызываемая Toxoplasma gondii, рода Toxoplasma характеризующаяся разнообразием вариантов течения и полиморфизмом клинических проявлений. В подавляющем числе случаев в результате инфицирования токсоплазмами развивается бессимптомное носительство.
КОДЫ ПО МКБ-10 B58 Токсоплазмоз.
Включено: инфекция, вызванная Toxoplasma gondii. Исключено: врожденный токсоплазмоз (P37.1).
B58.0 Токсоплазмозная окулопатия.
B58.1 Токсоплазмозный гепатит (K77.0).
B58.2 Токсоплазмозный менингоэнцефалит (G05.2).
B58.3 Легочный токсоплазмоз (J17.3).
B58.8 Токсоплазмоз с поражением других органов.
B58.9 Токсоплазмоз неуточненный. Впервые токсоплазмоз человека был обнаружен в 1914 г. на территории Шри-Ланки, хотя возбудитель Toxoplasma gondii был описан еще в 1908-1909 гг. при обнаружении его у североафриканских грызунов.
ЭТИОЛОГИЯ
Возбудитель - Toxoplasma gondii рода Toxoplasma относится к
типу Sporozoa классу Coccidеа подсемейству Toxoplasmatinae. В организме человека и животных T. gondii существует в следующих формах: трофозоит (тахизоит), циста (брадизоит) и ооциста. Трофозоиты размером 4-8×2-3 мкм напоминают по форме полумесяц. Цисты, покрытые плотной оболочкой, достигают размером до 100 мкм. Ооцисты - овальной формы, диаметром 9-11 и 11-14 мкм. По данным генотипирования, в настоящее время различают 3 группы штаммов токсоплазм. Первая группа имеет отношение к врожденному токсоплазмозу животных и не зарегистрирована у человека. У человека встречаются штаммы 2-й и 3-й групп токсоплазм, причем представители последней группы чаще обнаруживаются при ВИЧ-инфекции. Расшифрованы также антигены различных форм токсоплазм и установлено, что трофозоиты и цисты имеют как общие антигены, так и характерные только для каждой из них.
Человек и животные - промежуточные хозяева, могут заражаться различными формами токсоплазмы. Т. gondii является облигатным внутриклеточным
паразитом, который внедряется в эпителиальные клетки кишечника, где делится посредством эндодиогении. Затем по мере накопления трофозоиты (тахизоиты) гематогенно и лимфогенно
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
разносятся в другие органы и ткани (ЛУ, печень, легкие и др.), где также активно проникают в клетки. В пораженных клетках появляются скопления трофозоитов одной генерации, окруженные мембраной паразито-форной вакуоли, так называемые псевдоцисты. В результате ответной иммунной реакции хозяина паразиты исчезают из крови, а в инфицированных клетках-мишенях формируются покрытые плотной оболочкой цисты. При хроническом течении болезни T. gondii в виде цист, расположенных внутриклеточно, уклоняясь от иммунного ответа хозяина, сохраняют жизнеспособность неопределенно долго. Цисты локализуются преимущественно в головном мозге, сердечной и скелетных мышцах, матке, глазе.
Окончательные хозяева - кошки и другие представители семейства кошачьих также могут заражаться токсоплазмами в различных стадиях развития. Основные хозяева одновременно могут быть и промежуточными, поскольку в их организме из кишечника токсоплазмы способны перемещаться в различные органы. Размножение паразита посредством мерогонии происходит в эпителиальных клетках кишечника, в результате образуются мерозоиты. Часть мерозоитов дает начало мужским и женским половым клеткам - гамонтам. После выхода из энтероцитов мужские гамонты многократно делятся - образуются микрогаметы, имеющие сходство со сперматозоидами; из женских гамонтов формируются макрогаметы, напоминающие яйцеклетки. После оплодотворения образуется незрелая ооциста, которая с фекалиями выходит в окружающую среду. При благоприятных условиях созревание ооцист - спорогония продолжается от 2 дней до 3 нед. Зрелые цисты устойчивы к действию неблагоприятных факторов внешней среды и могут сохранять жизнеспособность до 1 года и более.
ЭПИДЕМИОЛОГИЯ
Окончательными хозяевами T. gondii являются домашняя кошка и другие представители семейства кошачьих (рысь, пума, ягуар и др.). Промежуточными хозяевами служат сотни видов животных: различные виды грызунов, хищных сумчатых, насекомоядных, непарно- и парнокопытных, приматов, зайцеобразных, птиц. Ведущее значение в распространении болезни имеют синантропные животные, прежде всего кошки, которые, в свою очередь, заражаются при поедании грызунов, птиц, мяса домашних животных, а также при попадании в их кишечник ооцист из окружающей среды. У животных наблюдается также трансплацентарный путь передачи инфекции. Человек заражается пероральным путем при употреблении инфицированного мяса, содержащего тканевые цисты (сырое или термически недостаточно обработанное мясо), при попадании ооцист с продуктами и водой, а также при проглатывании ооцист с объектов, загрязненных кошками. Возможно заражение через поврежденную кожу и слизистые оболочки при тесном контакте с инфицированным животным сырьем (у работников мясокомбинатов, скотобоен и т.п.). Описаны случаи инфицирования при пересадке органов. У больных людей с острым токсоплазмозом возбудителя обнаруживают в слюне, мокроте, моче, менструальной крови, фекалиях. Однако роль человека как источника Т. gondii определяется в основном трансплацентарной передачей плоду беременной со свежим токсоплазмозом. Передача инфекции начинается с 3- го месяца беременности и достигает максимума в III триместре. У женщин, родивших однажды инфицированного ребенка, при последующих беременностях передачи токсоплазмоза плоду не происходит.
Иммунитет при токсоплазмозе нестерильный, однако напряженность его такова, что реинвазия не наблюдается. В большинстве случаев у людей без нарушений
иммунной системы результатом заражения T. gondii является формирование здорового носительства.
Возбудитель распространен повсеместно. Уровень инфицированности населения в разных странах колеблется в широких пределах и во многом зависит от санитарно-гигиенических условий, а также особенностей питания населения. В азвивающихся странах высока
пораженность токсоплазмозом детского населения, в развитых странах инфицированность нарастает с возрастом.
МЕРЫ ПРОФИЛАКТИКИ Специфические
Основные мероприятия по предупреждению врожденного токсоплазмоза - своевременное обследование женщин детородного возраста и беременных в женских консультациях. У ВИЧинфицированных проводят первичную и вторичную профилактику токсоплазмоза. Цель первичной профилактики - предупредить заражение T. gondii или развитие токсоплазменного энцефалита у лиц с латентно протекающей формой заболевания. У ВИЧ-инфицированных с положительной серологической реакцией на токсоплазмоз проводят химиопрофилактику этио-тропными препаратами. Цель вторичной профилактики или поддерживающего лечения - предупредить рецидивы токсоплазменного энцефалита у больных
СПИДом.
Неспецифические
Профилактика токсоплазмоза состоит в тщательной термической обработке мясных продуктов и молока, соблюдении правил личной гигиены, особенно в группах риска (ветеринары, работники мясокомбинатов, охотники и др.), предотвращении загрязнения детских песочниц экскрементами кошек.
ПАТОГЕНЕЗ
Из места внедрения (чаще всего - пищеварительный тракт) токсоплазмы с током лимфы попадают в регионарные ЛУ, где размножаются и вызывают развитие лимфаденита. Затем паразиты в большом количестве поступают в кровь и разносятся по всему организму, вследствие чего возникают очаги поражения в нервной системе, печени, селезенке, ЛУ, скелетных мышцах, миокарде, глазах. Вследствие размножения трофозоитов разрушаются зараженные клетки. Вокруг очагов некроза и скопления токсоплазм формируются специфические гранулемы. При нормальном иммунном ответе организма трофозоиты исчезают из тканей, и начинается процесс формирования цист (воспалительная реакция вокруг них слабая). Заболевание переходит из острой фазы в хроническую, а еще чаще - в хроническое носительство с сохранением цист в тканях органов. В неблагоприятных для организма условиях (острые заболевания и стрессовые ситуации, оказывающие иммуносупрессивное воздействие) оболочки цист разрушаются; высвободившиеся паразиты, размножаясь, поступают в кровоток, что клинически проявляется обострением хронического токсоплазмоза. Воспалительные инфильтраты и некрозы обнаруживают в скелетных мышцах, миокарде, легких и других органах. В головном мозге появляются воспалительные очаги с последующим некрозом, что приводит к образованию петрификатов. В сетчатке и сосудистой оболочке глаза возникает продуктивно-некротическое воспаление. Злокачественное течение токсоплазмоз приобретает на фоне развернутой картины СПИДа, при этом развивается генерализованная форма заболевания, в ряде случаев являющаяся причиной гибели больных.
В ответ на воздействие антигенов токсоплазм вырабатываются специфические антитела и происходит аллергическая перестройка по типу ГЗТ.
Врожденный токсоплазмоз является следствием заражения плода от матери, первично инфицированной во время беременности. В результате паразитемии возбудитель заносится в плаценту, в которой формируется первичный очаг, а из него гематогенным путем токсоплазмы попадают в плод. Заражение плода происходит вне зависимости от наличия клинических проявлений у беременной, но исход различен при инфицировании в разные сроки беременности. Инфекция в ранние сроки эмбриогенеза заканчивается спонтанным выкидышем, мертворождением, а также приводит к тяжелым аномалиям развития (анэнцефалии, анофтальмии и др.), часто несовместимым с жизнью, или развиваются
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
признаки генерализованного токсоплазмоза. При заражении в III триместре беременности преобладают асимптомные формы, поздние клинические признаки которых проявляются через месяцы и годы [1, 2, 3].
КЛИНИЧЕСКАЯ КАРТИНА Приобретенный токсоплазмоз
У лиц с нормальным иммунным ответом в большинстве случаев токсоплазмоз протекает в латентной форме. Манифестный токсоплазмоз протекает в острой (до 0,01% инфицированных) и хронической (1-5%) форме, имея склонность к рецидивам и обострениям.
Острая форма. У лиц с нормальным иммунным ответом заболевание часто клинически не проявляется. О заражении свидетельствует наличие у них в крови специфических IgМантител с повышением их уровня в динамике и последующей сменой на IgG. При развитии манифестной формы острого приобретенного токсо-плазмоза инкубационный период длится около 2 недель. Заболевание проявляется лихорадкой, интоксикацией, ЛАП, лимфоцитозом в крови; возникают высыпания на коже, диарея. Поражение скелетных мышц проявляется миалгией, часто наблюдается артралгия. Выражены гепатолиенальный синдром и признаки поражения ЦНС. Возможны катаральные проявления, пневмония, миокардит.
Хроническая форма приобретенного токсоплазмоза может развиться первично или вследствие перенесенной острой формы заболевания. В манифестных случаях хронический токсоплазмоз характеризуется полиморфизмом клинических проявлений. Начало постепенное, со слабовыраженных проявлений общего характера: головной боли, общей слабости, повышенной утомляемости, снижения памяти, неврозоподобных изменений, нарушения сна, длительного субфебрилитета. У большинства больных выявляют ЛАП, миозиты, артралгии. При поражении миокарда больные предъявляют жалобы на одышку, сердцебиение, боли в области сердца. ЭКГ-данные свидетельствуют о развитии миокардита или миокардиодистрофии. Возможны интерстициальные пневмонии, хронический гастрит, энтероколит, поражения желчевыводящих путей и женской половой системы (нарушения менструального цикла, сальпингоофорит, эндометрит, бесплодие).
Важную роль при приобретенном хроническом токсоплазмозе играет поражение нервной системы: менингоэнцефалит, энцефалит, церебральный арахноидит, диэнцефальные и психические расстройства, судорожный синдром.
При поражении глаз возможны патологические изменения во всех оболочках, возникают поражения зрительного нерва, наружных мышц глазного яблока. В сочетании с хориоретинитом и другими изменениями иногда отмечают керато-склерит или кератоувеит.
У лиц с иммунодефицитным состоянием (СПИД, злокачественные лимфомы, применение иммунодепрессантов) латентное течение токсоплазмоза или новое заражение, как и при других оппортунистических инфекциях, переходит в гене-
рализованный процесс с поражением головного мозга, миокарда, легких и других тканей и органов. Активация латентного токсоплазмоза у ВИЧ-инфицированных происходит при содержании CD4+-лимфоцитов меньше 0,1×109/л. При этом риск развития диссеминированного процесса составляет 25-50% у больных, имеющих специфические антитела.
Клиническими особенностями церебрального токсоплазмоза у больных ВИЧ-инфекцией являются: постепенное начало заболевания с нарастанием интоксикации и неврологической симптоматики, развитие гемипареза, часто пареза лицевого нерва, дизартрии, выраженной заторможенности, сонливости, умеренных головных болей, судорожного синдрома, реже - психических нарушений. При остром развитии болезни происходит быстрое нарастание неврологической симптоматики с развитием мозговой комы. Церебральный токсоплазмоз у
больных ВИЧ-инфекцией нередко (до 10% случаев) приобретает генерализованный характер с поражением других органов. Наблюдаются поражения легких, сердца, глаз, печени. В клинической картине поражения ЦНС преобладают симптомы очагового энцефалита, свидетельствующие о поражении полушарий головного мозга, мозжечка или ствола мозга (гемипарез, афазия, дезориентация, гемианоп-сия, судорожный синдром и другие изменения). Внемозговую локализацию ток-соплазмоза при СПИДе выявляют в 1,5-2% случаев, чаще всего в виде поражения глаз (50%), проявляющегося очаговым некротизирующим хориоретинитом без воспалительной реакции, однако могут вовлекаться и другие органы (сердце, легкие, ЛУ, костный мозг, печень, поджелудочная железа, мочеполовая система и др.) [4, 9].
У детей с ВИЧ-инфекцией заболевание протекает в латентной форме. Среди клинических форм чаще выявляют церебральную, глазную, легочную, миокарди-тическую, лимфонодулярную, а также поражение органов пищеварения.
Врожденный токсоплазмоз
Развивается только при инфицировании женщины во время беременности. У женщин с ВИЧинфекцией латентная, возникшая до беременности инвазия может реактивироваться. Врожденный токсоплазмоз в 25-30% случаев протекает с клиническими проявлениями, в остальных случаях - латентно. В зависимости от сроков инфицирования матери во время беременности врожденный токсоплазмоз у ребенка может выражаться в различных формах [1, 2, 3].
Острая форма развивается при инфицировании на поздних сроках беременности. Она протекает как тяжелое генерализованное заболевание с выраженной интоксикацией, лихорадкой, высыпаниями на коже, изъязвлениями на слизистой оболочке носоглотки, желтухой, отеками, гепатоспленомегалией. Позже возникает токсоплазмозный энцефалит. Выявляют поражение глаз и других органов. Если ребенок переносит острую форму внутриутробно, он может родиться с признаками хронического врожденного токсоплазмоза: с последствиями энцефалита в виде гидроцефалии, олигофрении, судорожного синдрома, с поражением глаз (вплоть до микро- и анофтальмии). Постепенно процесс переходит во вторично-хроническую форму с резидуальными явлениями.
При хроническом врожденном токсоплазмозе (резидуальные явления у детей и подростков) выявляют остаточные явления со стороны ЦНС и органов зрения: отставание в умственном и физическом развитии, гидроцефалию, микроцефалию, парезы и параличи, микрофтальм, микрокорнеа, хориоретинит, атрофию зрительного нерва, катаракту, косоглазие, нистагм, эпилептиформные судороги.
ДИАГНОСТИКА Клиническая диагностика
Диагноз ставят, выявляя эпидемиологические факторы риска инфицирования и учитывая данные клинической картины и результатов лабораторной диагностики.
Специфическая и неспецифическая лабораторная диагностика
Паразитологические методы (исследование биоптатов ЛУ и других органов) не находят широкого применения из-за их сложности и трудоемкости. Специфические антитела классов IgM и IgG к антигенам токсоплазм выявляют в повторных серологических исследованиях: ИФА, РНГА и РИФ (но они недостаточно информативны у больных СПИДом); при церебральном токсоплазмозе в сыворотке крови и СМЖ определяют титры IgG-антител (реже IgM), выявляют ДНК возбудителя методом ПЦР. В диагностике токсоплазмоза используют внутрикожную пробу с токсоплазмином (нативным или рекомбинантным). При анализе и интерпретации результатов серологической диагностики следует учитывать
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

«иммунологическую» инкубацию - появление антител на антигены паразита только через определенный латентный период и оценивать результаты исследований в динамике. Кожная проба свидетельствует об инфицировании токсоплазмами, но не дает информации о характере течения заболевания.
Инструментальные методы
Беременным с положительными серологическими реакциями проводят УЗИ плода в динамике. При диагностике церебрального токсоплазмоза (особенно у больных СПИДом) проводят КТ, МРТ головного мозга.
Дифференциальная диагностика
Токсоплазмоз дифференцируют со многими заболеваниями инфекционной и неинфекционной природы: лимфогранулематозом, лимфолейкозом и другой патологией системы крови, туберкулезом, листериозом, иерсиниозом, ИМ, заболеваниями нервной системы и органов зрения. У детей, с учетом возраста, токсо-плазмоз необходимо дифференцировать с ЦМВИ, герпетическими инфекциями и различными ОРВИ, краснухой, ВГ. При повторных выкидышах, рождении детей с аномалиями развития у серопозитивных женщин необходимо исключать акушерскую и гинекологическую патологию.
ЛЕЧЕНИЕ
Специфическая терапия наиболее эффективна в острой фазе заболевания; больные с латентной формой хронического приобретенного токсоплазмоза в лечении не нуждаются. Эффективность этиотропных ЛС при хроническом токсоплазмозе низкая, поскольку химиопрепараты и антибиотики практически не воздействуют на эндозоиты, находящиеся в тканевых цистах. При хроническом токсоплазмозе лечение показано только при обострении процесса и при невынашивании беременности (лечение проводят вне периода беременности).
В качестве этиотропных ЛС при токсоплазмозе применяют пириметамин в сочетании с сульфаниламидами или антибиотиками. Длительность цикла лечения 7 сут. Обычно проводят 2-3 цикла с перерывами между ними в 10 сут. Суточные дозы пириметамина и сульфадиазина приведены в табл. 22.4; антибиотики назначают в обычных дозах. Возможно применение Котримоксазола♠ по 1 таблетке 2 р/сут в течение 10 сут. Проводят два цикла с интервалом 10 сут. Одновременно назначают кальция фолинат по 2-10 мг в сутки или дрожжи пивные по 5- 10 таблеток в сутки. Необходимы контроль гемограммы (возможно угнетение костномозгового кроветворения) и общий анализ мочи в динамике.
Показана хорошая эффективность применения противомалярийного препарата пириметамин + сульфадоксин (Фансидар♠), одна таблетка которого содержит 50 мг пириметамина и 500 мг сульфадоксина.
В качестве альтернативной схемы применяют доксициклин (Юнидокс Солютаб♠) - по 100 мг каждые 12 ч в сочетании с метронидазолом - по 250 мг каждые 8 ч внутрь; длительность курса - 10 дней. Эффективность такой схемы не уступает комбинации пириметамина с
сульфадиазином, а переносимость - лучше. Беременных лечат спирамицином (накапливается в плаценте и не проникает в плод). Его назначают по 3 млн ЕД 3 р/сут в течение 2-3 нед.
Лечение детей с врожденным токсоплазмозом проводят теми же препаратами, что и лечение взрослых: пириметамин по 1 мг/кг в сутки в 2 приема в комбинации с сульфаниламидами короткого действия по 0,1 г/кг в сутки в 3-4 приема. Лечение проводят циклами: 5 сут принимают пириметамин, а сульфаниламидный препарат на 2 сут дольше - 7 сут. Проводят 3 цикла с перерывами между ними в 7-14 сут. Дополнительно назначают кальция фолинат по 1- 5 мг 1 раз в 3 сут в течение всего курса лечения для устранения побочного действия антифолатов (пириметамина, сульфаниламидов). Такой же курс лечения по показаниям (например, хроническая форма заболевания, иммунодефицитное состояние, обострение хориоретинита) повторяют через 1-2 мес.
Больным токсоплазмозом с ВИЧ-инфекцией назначают те же препараты, что и другим пациентам: пириметамин - в 1-е сутки 200 мг в комбинации с сульфа-диазином (по 1 г 4 р/сут), клиндамицином (по 0,6 г 6 р/сут) или спирамицином (по 3 млн ЕД 3 р/сут). Одновременно больные принимают кальция фолинат по 10-50 мг в сутки. Курс лечения не менее 4 нед, затем назначают вторичную профилактику для предупреждения рецидивов: пириметамин по 50 мг в сутки и суль-фадиазин по 0,5 г 4 р/сут. В связи со сложностью диагностики и тяжестью течения церебрального токсоплазмоза лечение назначают даже при подозрении на заболевание. Улучшение в течение 2-4 нед лечения указывает на высокую вероятность токсоплазмоза [4].
Прогноз
Прогноз при приобретенном токсоплазмозе благоприятный, поскольку преобладает латентная форма без клинических проявлений. Генерализованные формы, наблюдающиеся у больных СПИДом и у пациентов с иммунодефицитным состоянием другой этиологии, протекают тяжело и могут закончиться летальным исходом.
Диспансеризация
В диспансерном наблюдении нуждаются больные с острой формой приобретенного и рецидивирующим течением хронического токсоплазмоза, а также серо-позитивные к антигенам токсоплазмы ВИЧ-инфицированные пациенты. Объем и
сроки диспансерного наблюдения зависят от клинической формы токсоплазмоза и характера течения заболевания. При врожденном токсоплазмозе у детей в зависимости от резидуальных явлений вопрос о диспансеризации решают совместно с невропатологами, офтальмологами и другими специалистами. Некоторые пациенты нуждаются в пожизненном диспансерном наблюдении (с поражением глаз при неэффективности этиотропного лечения, серопозитивные к антигенам токсоплаз-мы ВИЧ-инфицированные пациенты).
22.5. КРИΠТОСΠОРИДИОЗ
Криптоспоридиоз (Cryptosporidiosis) - зоонозная протозойная инфекция, характеризующаяся преимущественным поражением тонкого кишечника, диареей с развитием обезвоживания. Относится к СПИД-индикаторным заболеваниям.
КОД ПО МКБ-10 А07.2 Криптоспоридиоз. ЭТИОЛОГИЯ
Криптоспоридиоз - простейшие рода Cryptosporidium. В пределах рода систематика криптоспоридий основана на морфологических, генетических и биологических особенностях. Различные виды отличаются по размерам и форме ооцист, которые могут быть
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
круглыми или овальными, диаметром от 3 до 8 мкм. Криптоспоридии отличаются по своей гостальной специфичности (т.е. паразитируют у разных видов животных), органной локализации, патогенности, длительности и интенсивности выделения ооцист. За последнее время число видов криптоспоридий увеличилось и составляет от 12 до 20 видов. Некоторые виды криптоспоридий поражают только человека, другие поражают многие виды животных, третьи проявляют патогенность только при иммуносупрессии. У человека паразитируют чаще 2 вида криптоспоридий - C. parvum, передающиеся к человеку от животных (молодняка жвачных, мышей, крыс, собак, кошек, волков и др.), и C. hominis, паразитирующие только у человека. Однако до 30% крипто-споридий, выделенных от больных ВИЧ-инфекцией, относятся к редким видам,
например, C. baileyi и C. muris, которые паразитируют соответственно у птиц и грызунов, а также C. canis, паразитирующие у собак, и C. meleagridis, паразитирующие у индюков.
Криптоспоридии - облигатные паразиты, инфицирующие микроворсинки слизистых оболочек ЖКТ и дыхательных путей животных и человека.
Жизненный цикл криптоспоридий проходит в организме одного хозяина, включает стадии шизогонии, мерогонии, гаметогонии и спорогонии. Локализуются криптоспоридии в паразитоформной вакуоле, образованной микроворсинками кишечника, поэтому паразит располагается внутриклеточно, но экстраплаз-матически. Мерозоиты первой генерации способны пролиферировать в двух направлениях: в шизонты первой или в шизонты второй генерации, поэтому численность паразитов увеличивается. В организме хозяина образуются два типа ооцист: толстостенные - покидающие организм хозяина с фекалиями, и тонкостенные - высвобождающие спорозоиты в кишечнике, вследствие чего возможна аутоинфекция.
Ооцисты криптоспоридий, сохраняясь в окружающей среде, способны к инвазии в течение 18 мес при температуре 4 °С и 1 нед при -10 °С. При нагревании до 72 °С они погибают в течение 1 мин.
Ооцисты резистентны к действию дезинфектантов, особенно содержащих хлор. В связи с этим, а также с их малыми размерами (4-7 мкм), позволяющими проходить через многие фильтры, очистка воды от криптоспоридий с помощью современных технологий невозможна, поэтому инфекция распространяется преимущественно водным путем.
В настоящее время не существует ни одного достаточно эффективного препарата, к которому криптоспоридии были бы чувствительны.
ЭПИДЕМИОЛОГИЯ
Естественный источник инвазии для человека - различные млекопитающие, в основном домашний скот (телята, ягнята), а также животные, обитающие в местах проживания людей (грызуны и т.д.).
Криптоспоридиоз может передаваться от человека к человеку. Об этом свидетельствуют случаи заражения детей в детских учреждениях, внутрибольничные вспышки и случайные заражения лабораторного персонала. Известны случаи внутрисемейного заражения, когда взрослые заражались от детей.
Механизм передачи в основном фекально-оральный (через пищевые продукты, воду, молоко, контактно-бытовым путем); существует вероятность передачи крип-тоспоридий половым путем у гомосексуалов.
С эпидемиологической точки зрения важен тот факт, что ооцисты в инвазив-ных стадиях могут выживать в фекалиях больных на протяжении 2 нед после прекращения диареи. О значении санитарно-гигиенических условий (изменение характера питания, физикохимических свойств воды, климатических условий) свидетельствует то, что криптоспоридии
- один из этиологических факторов диареи путешественников. В связи с этим вероятен второй механизм возникновения заболевания - активация инвазии у здоровых носителей.
Более чем в 80% случаев заболевание носит спорадический характер, остальные 20% включают групповые заболевания, в том числе водные вспышки. В настоящее время считают, что водный путь - основной путь передачи инфекции.
Ооцисты выделяют из водопроводной и речной воды, из сточных вод на полях орошения, из льда, полученного с поверхности открытых водоисточников. Описаны крупные водные вспышки криптоспоридиоза, охватывающие большое число заболевших на различных территориях. Например, в 1987 г. в штате
Джорджия (США), насчитывающем почти 65 тыс. жителей, в течение одного месяца водной вспышкой криптоспоридиоза оказались охваченными 13 тыс. человек. Весной 1993 г. в г. Милуоки (штат Висконсин) в масштабную водную вспышку было вовлечено 403 тыс. жителей, в том числе 82 больных ВИЧ-инфекцией, некоторые из них погибли. При ликвидации этой вспышки затраты только на медицинскую помощь составили почти 97 млн долларов.
Заражение людей может происходить при купании в реках, озерах, плавательных бассейнах (случайное заражение воды фекалиями, высокая плотность пользователей бассейна дополняют возможность риска инфицирования). В 1994 г. зарегистрирована вспышка, связанная с употреблением яблочного сока. Описаны случаи заражения при употреблении сырого молока и приготовленного из него мороженого, а также часто употребляемых сырых овощей. В то же время имеются данные о защитном действии большого количества сырых овощей и фруктов - особенно при употреблении томатов, моркови, сельдерея. В Японии описана небольшая вспышка (4 человека), связанная с употреблением сырой говядины и говяжьей печени. Некоторые виды устриц, мидий и других морепродуктов могут содержать ооцисты криптоспоридий и даже накапливать их в раковине, а щадящие способы кулинарной обработки не способны их инактивировать. Предполагают, что в результате регулярного употребления в пищу фруктов и овощей вместе с малыми дозами ооцист формируется иммунитет, и в случае последующего заражения развивается бессимптомная инфекция.
Инфицирующая доза очень мала. В эксперименте на приматах показано, что заболевание развивается при попадании в ЖКТ 10 ооцист, а методом математического моделирования установлено, что болезнь может вызывать даже одна ооци-ста. У здоровых добровольцев клиническая картина заболевания развилась при попадании 1000 ооцист в 100% случаев и 30 ооцист в 20%.
Естественная восприимчивость людей невысока. Заболеванию больше подвержены дети до 2 лет, а также лица с иммунодефицитными состояниями (больные, получающие химиопрепараты, пациенты с онкологическими заболеваниями, сахарным диабетом, реципиенты костного мозга и органов) и особенно больные ВИЧ-инфекцией в поздних стадиях болезни. К группе риска относят также ветеринаров, животноводов, работников предприятий по убою скота. Криптоспоридиоз распространен практически повсеместно, на всех континентах.
Кумулятивная заболеваемость составляет около 1-3% в индустриально развитых странах и 5- 10% - в развивающихся. Результаты серологических исследований свидетельствуют о более широком распространении среди людей (диагностируют далеко не все случаи). Так, антитела к криптоспоридиям обнаружены в 25-35% лиц в популяциях индустриально развитых стран и около 65% - в развивающихся. Например, в США в штате Нью-Йорк, начиная с 1994 г., ежегодно регистрируется 400-500 случаев заболевания. Во время эпидемических вспышек диарей на долю криптоспоридиоза приходится до 63% числа заболевших. Умирают более 50% заболевших криптоспоридиозом больных ВИЧ-инфекцией в результате длительной (хронической) инвазии.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
По данным некоторых авторов, для криптоспоридиоза характерна сезонность с пиком в теплое время года.
Ооцисты криптоспоридий высокорезистентны к большинству дезинфектантов, используемых в домашних условиях, лечебных учреждениях, лабораториях и системах очистки воды, поэтому сложно добиться полного выведения или уничтожения ооцист.
ПРОФИЛАКТИКА
Поскольку вполне эффективной специфической терапии криптоспоридиоза не разработано, необходимо максимально ограничивать контакты больных, страдающих иммунодефицитными состояниями, с возможными резервуарами возбудителя, т.е. избегать их контакта с крупным рогатым скотом, купания в естественных и искусственных водоемах и употребления сырой воды. Лицам с нормальной иммунной системой каких-либо специальных мер профилактики не требуется. При использовании медицинского оборудования, подвергающегося возможному заражению криптоспоридиями, рекомендуется автоклавирование. Эндоскопические инструменты следует обрабатывать 2% раствором глутарового альдегида с рН 7-8,5 в течение 30 мин.
В связи с водным путем распространения криптоспоридий во многих странах ужесточаются требования к очистке водопроводной воды, в основном за счет усовершенствования технологии фильтрации.
ПАТОГЕНЕЗ
Патогенез изучен недостаточно. Преобладание холероподобной профузной водянистой диареи в клинической картине болезни предполагает продукцию энте-ротоксина, но, несмотря на многочисленные поиски, токсин у криптоспоридий не обнаружен. Некоторые исследования показали присутствие у криптоспоридий гена, ответственного за продукцию белка с гемолитической активностью, сходного с таковым у E. coli - О157 H7. Наиболее типичная локализация процесса - дис-тальные отделы тонкой кишки. После попадания ооцист в кишечник начинается усиленное размножение паразита; образующиеся мерозоиты распространяются и поражают большое число энтероцитов, вызывая в них дегенеративные изменения (атрофию ворсинок). Это сопровождается гипертрофией крипт, моно- и полиморфноядерной инфильтрацией базальной мембраны и приводит к появлению кратерообразных углублений на поверхности эпителия. При тяжелых формах болезни происходит тотальное поражение микроворсинок.
В результате массивного поражения микроворсинок нарушается всасывание воды и электролитов, повышается их секреция через кишечную стенку, что проявляется водянистой диареей. Нарушается ферментативная деятельность кишечника, возникают вторичные мальабсорбция и стеаторея. У больных с выраженным иммунодефицитом возможно поражение не только ЖКТ, но и гепатобилиарной системы и дыхательных путей.
Важнейший фактор, определяющий восприимчивость к инвазии и тяжесть заболевания, - состояние иммунитета. Доказана роль гуморального иммунитета, но главное значение имеет нарушение функции Т-клеток.
КЛИНИЧЕСКАЯ КАРТИНА
Основа клинических проявлений при криптоспоридиозе - диарейный синдром, протекающий по типу острого энтерита или гастроэнтерита и развивающийся через 2-14 дней после заражения. На протяжении 7-10 (от 2 до 26) дней у больных без иммунодефицита отмечается обильный водянистый (холероподобный) стул с неприятным запахом до 20 р/сут. Больной теряет при этом от 1 до 15-17 л жидкости в день. Профузный понос сопровождается умеренными спастическими болями в животе, тошнотой и рвотой (50%), небольшим повышением температуры тела (не выше 38 °С у 30-60% больных во время эпидемических вспышек), отсутствием аппетита, головной болью. Обычно наступает выздоровление, но у
ослабленных детей болезнь может продолжаться более 3 нед и закончиться летальным исходом. Очень редко заболевание приобретает характер колита с появлением крови и слизи в кале.
У людей с различными нарушениями иммунитета, особенно у больных на поздних стадиях ВИЧ-инфекции, болезнь принимает хронический характер (до 6-11 мес, если больной не умирает раньше) и сопровождается резким похуданием (слим-синдром). У некоторых больных СПИДом, которые были вовлечены в вышеупомянутую водную вспышку криптоспоридиоза в 1993 г. в г. Милуоки в США, частота стула достигала 90 р/сут.
Для 15% больных характерны боли в животе с локализацией в правом верхнем квадранте, тошнота, рвота; возможна желтуха, что чаще соответствует холециститу. При УЗИ выявляют увеличение и растяжение желчного пузыря, утолщение его стенок, изменения в желчных протоках. У ряда больных сильная боль в правом подреберье провоцировала проведение холецистэктомии, при этом выявляли стеноз общего желчного протока, а также отечный «торчащий» фатеров сосок, растяжение общего желчного протока. При гепатите и склерозирующем холангите развиваются лихорадка, тошнота, рвота, боли в правом подреберье. Диарея при этом может отсутствовать. Повышаются уровень билирубина, активность ЩФ и трансфераз. Поджелудочная железа поражается редко.
При поражении легких, чаще всего сочетающемся с поражением кишечника, развивается картина без характерной симптоматики (кашель, затруднение дыхания, одышка, возможна охриплость голоса). При проведении биопсии легкого или аутопсии на поверхности эпителия склерозированных бронхиол обнаруживают скопления криптоспоридий.
Возможен реактивный полиартрит с поражением коленных, локтевых, лучеза-пястных и голеностопных суставов.
Поражение органов брюшной полости при криптоспоридиозе можно обнаружить при УЗИ. При исследовании желудка видны деформация стенок и утолщение складок слизистой оболочки. При поражении двенадцатиперстной и тонкой кишки видны спастические сокращения кишечной стенки, резко выраженное расширение просвета, атрофия ворсинок слизистой оболочки, гиперсекреция и утолщение складок.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Тяжелое течение болезни развивается при выраженном иммунодефиците (число СD4лимфоцитов ниже 0,1×109/л), поэтому в анализах регистрируются изменения, свойственные его проявлениям (например, лейкопения и эритроцитопения).
Внастоящее время разработаны методы выявления ооцист криптоспоридий в испражнениях. Для этого применяют методы окраски по Цилю-Нильсену, сафранином по Кестеру и азурэозином по Романовскому-Гимзе, а также методы негативного окрашивания. Применяют методы флотации или седиментации (если в материале содержится небольшое количество ооцист), при использовании соответствующих консервантов ооцисты могут быть обнаружены в нативном материале, хранящемся в холодильнике в течение 1 года.
Впоследнее время используют моноклональные антитела с флюоресцентной меткой, что позволяет визуализировать возбудителя с высокой специфичностью и чувствительностью. Реакцию флюоресцирующих антител, ИФА и ИБ используют в эпидемиологических исследованиях. Возможно применение ПЦР.
Дифференциальную диагностику проводят с заболеваниями, сопровождающимися диареей и обезвоживанием (табл. 22.5), в частности с холерой (особенно при вспышках болезни), амебиазом, сальмонеллезом, шигеллезом, кампилобактерио-зом, а у больных ВИЧинфекцией - с ЦМВ-колитом (табл. 22.6), микроспоридио-зом, изоспорозом, заболеваниями желчевыводящей системы.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Дополнительные методы диагностики чаще требуются у больных с иммунодефицитом (например, колоноскопия, использование ПЦР при дифференциальной диагностике с другими диарейными заболеваниями).
ЛЕЧЕНИЕ Режим. Диета
Для излечения больных с легким или среднетяжелым течением болезни при отсутствии нарушений в иммунной системе достаточно полноценной диеты (стол № 4) и приема адекватного количества жидкости (солевые растворы для оральной регидратации). При тяжелом течении целесообразно проводить внутривенную регидратацию в соответствии со степенью обезвоживания.
Медикаментозная терапия Этиотропная терапия
Эффективных средств этиотропной терапии нет.
В связи с длительным, хроническим и тяжелым течением у больных СПИДом необходимо с первых дней болезни проводить комплексную терапию:
◊АРВТ (постепенно улучшает показатели иммунитета, тем самым способствует купированию диареи);
◊пероральную или внутривенную регидратацию;
◊ ферментные препараты, пробиотики, содержащие E. coli и бифидобактерии; ◊ симптоматические средства.
Прогноз у больных ВИЧ-инфекцией в поздних стадиях неблагоприятный: болезнь развивается при очень низком иммунном статусе, эффективное этиотроп-ное лечение отсутствует, даже при адекватной патогенетической и АРВТ число СD4-лимфоцитов не успевает повыситься до защитного уровня. У пациентов с нормальным числом СD4лимфоцитов или незначительным иммунодефицитом прогноз благоприятный. Все больные ВИЧ-инфекцией подлежат диспансерному наблюдению.
22.6. ПНЕВМОЦИСТОЗ
Пневмоцистоз (pneumocystosis, пневмоцистная пневмония) - оппортунистическая инфекционная болезнь, вызываемая Pneumocystis jiroveci (старое название - Pneumocystis carinii), характеризующаяся развитием интерстициальной пневмонии с выраженной ДН, возможным поражением других органов.
Среди оппортунистических инфекций при СПИДе это одно из самых распространенных заболеваний.
КОДЫ ПО МКБ-10
В59 Пневмоцистоз (Y17.3).
B20.6 Болезнь, вызванная ВИЧ, с проявлениями пневмонии, вызванной Pneumocystis carinii. ЭТИОЛОГИЯ
Пневмоцисты - одноклеточные эукариоты, имеющие ядерную оболочку и внутриклеточные органеллы. Они проходят стадии развития, свойственные простейшим. Первая фаза: трофозоиты - овальная или амебовидная клетка размером 1-5 мкм, от ее поверхности отходят выросты, с помощью которых трофозоиты плотно прилегают к эпителию легкого, поэтому в мокроте их обнаружить трудно; вторая фаза: прециста - овальная клетка размером 2-5 мкм, не имеющая выростов. Стенка прецисты состоит из трех слоев, в цитоплазме имеется несколько глыбок (делящиеся ядра); третья фаза: циста - клетка размером 3,5-6 мкм, стенки ее также состоят из трех слоев. В цитоплазме обнаруживается до 8 внутрицист-ных телец диаметром 1-2 мкм, имеющих двухслойную оболочку. Внутрицистные тельца выходят при разрушении цист и становятся внеклеточными трофозоитами, начиная новый жизненный цикл возбудителя.
В настоящее время установлено, что есть много разновидностей пневмоцист, обладающих тропностью к своему хозяину. Возбудитель, изначально названный как Р. carinii, обнаруживается исключительно у крыс, а возбудителя заболевания у человека, по предложению J.K. Frenkel, переименовали в честь чешского паразитолога Отто Ировеца (Otto Jirovec) в Р. jiroveci. Существует около 50 разновидностей P jiroveci и от одного больного можно выделить одновременно несколько разных штаммов возбудителя.
Таксономическая принадлежность пневмоцист долгое время была предметом споров. Имеется много свидетельств, в том числе секвенирование ферментов, генов рибосомальной РНК, открытие в 1992 г. гена фактора элонгации 3 (который свойственен исключительно грибам), что пневмоцисты филогенетически ближе к царству грибов. Однако они имеют и нетипичные для грибов свойства: морфология, невозможность культивирования на средах для грибов, устойчивость к противогрибковым средствам (из-за отсутствия эргостерина, характерного для строения клеточной стенки грибов) и, наоборот, чувствительность к противопротозойным препаратам, а также наличие небольшого числа копий генов рибосомальной РНК, в то время как у грибов имеются сотни их копий. До сих пор в некоторых источниках встречается указание, что это - простейшее. Тем не
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
менее, пневмоциста в настоящее время классифицирована как гриб, но благодаря морфологическим и биологическим свойствам она остается включенной в атлас медицинской паразитологии.
Данные о продукции токсинов пневмоцистами отсутствуют. Пневмоцисты не культивируются на питательных средах.
Продолжительность сохранения пневмоцист на объектах окружающей среды не изучена, однако в воздухе помещений, где находятся больные, присутствует ДНК возбудителя. Пневмоцисты чувствительны к сульфаниламидам (сульфаметокса-зол) в сочетании с пиримидинами (триметоприм), сульфонам (дапсон), некоторым противопротозойным средствам (пентамидин, метронидазол), нитрофуранам (фуразолидон). ЭПИДЕМИОЛОГИЯ
Резервуар пневмоцист в природе неизвестен. Пневмоцисты широко распространены во всех регионах мира и обнаруживаются практически у всех животных: диких, синантропных и сельскохозяйственных. Многочисленные исследования, которые особенно интенсивно проводились в 1970-1980-е гг. в бывшем СССР, показали и широкое носительство пневмоцист (33% у детей и 23% у взрослых). В конце 80-х - начале 90-х гг. был выявлен еще более высокий уровень носи-тельства у отдельных категорий детей (до 78%), а уровень инфицированности взрослых в Москве составлял 75%. Самый высокий уровень инфицированности среди взрослых и детей был зарегистрирован в эти годы в Гомеле (до 89%), что было связано с влиянием радиации как последствием событий в Чернобыле.
Заражение происходит аэрогенным путем от человека (больного или носителя). При изучении внутрибольничных вспышек пневмоцистоза доказана доминирующая роль медицинского персонала в качестве источника инфекции. В отделении для больных ВИЧинфекцией выявлено широкое носительство пневмоцист среди больных (92,9%) и персонала (80%).
Большинство исследователей считают, что механизм клинически выраженного заболевания в основном связан с активацией латентной инфекции. Люди заражаются в раннем детстве - еще до 7-месячного возраста, а в 2-4 года заражены уже 60-70% детей. С другой стороны, хорошо известны случаи групповых заболеваний пневмоцистозом и вспышки внутрибольничной инфекции не только у детей, но и у взрослых (в отделениях для недоношенных, детей раннего возраста с патологией ЦНС, в отделениях для больных гемобластозами, в туберкулезном стационаре). Описаны случаи семейного инфицирования (источниками инфекции были родители, а заболевали их ослабленные дети). Развитие рецидивов пневмоцистной пневмонии у больных ВИЧ-инфекцией, скорее всего, связано не с активацией латентной инфекции, а с новым заражением.
Нарушение клеточного и гуморального иммунитета предрасполагает к развитию заболевания, но основное значение имеет Т-клеточный иммунодефицит:
уменьшение количества CD4+-клеток и увеличение содержания цитотоксических клеток приводит к манифестации болезни.
Группы риска для развития клинически выраженной болезни - больные ВИЧ-инфекцией, недоношенные, ослабленные новорожденные и дети раннего возраста с агаммаглобулинемией или гипогаммаглобулинемией, рахитом, гипотрофией; больные лейкозом, другими онкологическими заболеваниями, реципиенты органов, получающие иммунодепрессанты, пожилые люди из домов престарелых, больные туберкулезом.
Пневмоцистоз диагностируется на протяжении всего года, но наибольшее число заболеваний приходится на зимне-весенний период с максимумом в феврале-апреле.
МЕРЫ ПРОФИЛАКТИКИ Неспецифические
Согласно современным рекомендациям по профилактике пневмоцистоза, необходимо проводить периодические проверки медицинского персонала, работающего в центрах трансплантации органов, онкологических и гематологических отделениях, реабилитационных отделениях больниц, детских закрытых учреждениях, на наличие маркеров пневмоцистоза, чтобы ограничить внутрибольничное заражение. Кроме того, необходимо максимально разобщить больных, госпитализировать заболевших пневмоцистной пневмонией в бокс или отдельную палату, усилить санитарно-гигиенический режим, проводить текущую и заключительную дезинфекцию в отделениях (влажная уборка, обработка предметов 0,5% раствором хлорамина, проветривание, ультрафиолетовое облучение); медперсонал должен правильно использовать маски.
Специфические
Химиопрофилактику пневмоцистной пневмонии проводят у больных ВИЧ-инфекцией с количеством CD4+-лимфоцитов ниже 0,2×109/л или менее 14% (превентивная терапия) и у больных, перенесших пневмоцистную пневмонию (профилактика рецидивов). Предпочтительные схемы: ко-тримоксазол (триметоприм/сульфаметоксазол) в дозе 160/800 мг 1 р/сут или 80/400 мг 1 р/сут ежедневно или 160/800 мг 1 р/сут 3 раза в неделю.
Альтернативная схема: дапсон 100 мг 1 р/сут внутрь ежедневно.
Превентивную терапию пневмоцистной пневмонии прекращают при повышении количества CD4+-лимфоцитов на фоне АРТ >200 кл./мкл в течение 3 мес или при количестве CD4+- лимфоцитов 100-200 кл./мкл и неопределяемом уровне РНК ВИЧ в течение 3 мес.
При появлении признаков активации болезни переходят на прием препарата по схеме лечения.
ПАТОГЕНЕЗ И ПАТОМОРФОЛОГИЯ
Патогенез пневмоцистной пневмонии связан с механическим повреждением стенок интерстиция легких. Р. jiroveci имеет преимущественный тропизм к легочной ткани и поражает пневмоциты 1-го и 2-го порядка. Весь жизненный цикл пневмоцист проходит в альвеоле, к стенке которой они очень плотно прикрепляются. Для развития пневмоцистам необходимо большое количество кислорода. Постепенно размножаясь, они заполняют все альвеолярное пространство, захватывая все большие участки легочной ткани. При тесном контакте трофозоитов со стенками альвеол происходит повреждение легочной ткани, постепенно снижается
растяжимость легких, в 5-20 раз увеличивается толщина межальвеолярных перегородок. Вследствие этого развивается альвеолярно-капиллярный блок, что приводит к тяжелой гипоксии. Образование участков ателектаза усугубляет нарушение вентиляции и газообмена. Показано, что пневмоцисты на своей поверхности имеют гликопротеид с антигенными свойствами легочной ткани, что делает их неуязвимыми для иммунной системы. У больных с иммунодефицитными состояниями выраженное уменьшение числа CD4+-лимфоцитов (менее 0,2×109/л) является критическим для развития манифестации болезни.
При пневмоцистной пневмонии выделяют три стадии патологического процесса в легких: отечную (длится 7-10 дней), ателектатическую (1-4 нед), эмфизематозную (продолжительность различна). На аутопсии легкие увеличены, плотные, тяжелые, бледнофиолетового цвета; ткань легких легко разрывается, на разрезе имеет мраморный вид с серовато-синюшным оттенком, отделяемое вязкое.
При гистологическом исследовании в отечной стадии в просвете альвеол и бронхиол обнаруживают пенисто-ячеистые массы, содержащие скопления пнев-моцист, вокруг которых скапливаются нейтрофилы, макрофаги и плазматические клетки. Такой пенистый альвеолярный экссудат не встречается при других заболеваниях - это патогномоничный
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
признак пневмоцистоза. В ателектатической стадии обнаруживают полнокровие, клеточную инфильтрацию межальвеолярных перегородок с последующей их деструкцией, которая наиболее выражена при рецидивирующем течении болезни при ВИЧ-инфекции. Если выздоровление наступает в последней стадии, происходит постепенное обратное развитие процесса. При рецидивах у больных СПИДом могут возникать фиброзно-кистозные изменения в легких.
При СПИДе диссеминация пневмоцист встречается в 1-5% случаев; может поражаться практически любой орган. При этом возможно развитие изолированного очага внелегочного пневмоцистоза или сочетание легочных и внелегочных поражений.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период при экзогенном заражении составляет от 7 до 30 дней, но может превышать 6 нед. Наиболее частая его продолжительность у детей - 2-5 нед.
У детей раннего возраста болезнь протекает как классическая интерстици-альная пневмония с четким соответствием стадиям патологического процесса. Заболевание начинается постепенно: у ребенка ухудшается аппетит, прекращается нарастание массы тела, появляются бледность и цианоз носогубного треугольника (особенно при еде и крике), легкое покашливание. Температура тела субфебрильная, в дальнейшем она достигает высоких цифр. Вначале при перкуссии над легкими определяется тимпанический звук, особенно в межлопаточном пространстве. Появляется одышка при физической нагрузке. Во II стадии заболевания (ателектатическая стадия патологического процесса) постепенно нарастают одышка (в покое частота дыхания достигает 50-80 в минуту), цианоз и навязчивый коклюшеподобный кашель, нередко с пенистой мокротой. В легких выслушивают жесткое, местами ослабленное дыхание, непостоянные мелко- и среднепузырчатые хрипы; наблюдают расширение грудной клетки, увеличение межреберных промежутков. В передневерхних отделах нарастает тимпанит, а в межлопаточном пространстве выявляют участки укороченного звука. Прогрессирует респираторный ацидоз, который при тяжелом поражении сменяется алкалозом. Развивается легочно-сердечная недостаточность. В этой фазе может возникнуть серповидный пневмоторакс из-за разрыва легочной ткани. При сочетании пневмоторакса с пневмомедиастинитом, а также при отеке легких
возможна гибель больного. В III стадии (эмфизематозная стадия) состояние улучшается, уменьшаются одышка и вздутие грудной клетки, но длительно сохраняется коробочный оттенок при перкуссии.
Пневмоцистоз у детей может протекать также под маской острого ларингита, обструктивного бронхита или бронхиолита.
Поскольку основную роль в развитии манифестации болезни у взрослых играют иммуносупрессивные состояния, клинически они могут выражаться следующими продромальными симптомами: слабостью, повышенной утомляемостью, похуданием, ухудшением аппетита, потливостью, субфебрилитетом. Особенно часто это наблюдается в поздних стадиях ВИЧ-инфекции (СПИД). Больные обращаются за медицинской помощью обычно не в самом начале болезни именно потому, что явные характерные признаки заболевания развиваются постепенно, а в ряде случаев пневмоцистоз у них может протекать без явных симптомов поражения легких. В этих случаях болезнь обнаруживают при рентгенологическом обследовании или уже на вскрытии.
Наиболее характерные симптомы пневмоцистной пневмонии у больных СПИДом - одышка, лихорадка, кашель. Они развиваются практически у всех заболевших. Одышка - самый ранний симптом. Вначале она появляется при умеренной физической нагрузке. Этот период может достигать нескольких недель и даже месяцев. Постепенно одышка нарастает и беспокоит больных уже в покое.
У больных СПИДом при пневмоцистной пневмонии температура повышается постепенно, достигая максимальных цифр (38-40 °С) в разгаре болезни. Повышение температуры тела иногда сопровождается ознобом, повышенной потливостью. Температурная кривая отличается постепенным нарастанием, постоянным, ремиттирующим или неправильным характером. Если этиотропная терапия эффективна, температура держится у не инфицированных ВИЧ больных 3-7 дней, а у ВИЧ-инфицированных - 7-15 дней.
Кашель, как правило, непродуктивный. Появление мокроты возможно у больных с сопутствующим бронхитом или у курильщиков. Для начала болезни характерно навязчивое покашливание из-за постоянного ощущения раздражения за грудиной или в гортани. В дальнейшем кашель почти постоянный, коклюше-подобный. Боли в грудной клетке наблюдаются редко. Они могут быть признаком остро развивающегося пневмоторакса или пневмомедиастинума. Колющая боль обычно локализуется в передней части грудной клетки и усиливается при дыхании.
В ранней стадии болезни больной бледен, отмечаются цианоз губ и носогубного треугольника, одышка при физической нагрузке. Частота дыхания 20-24 в минуту. При прогрессировании болезни цианоз нарастает, кожа приобретает серовато-цианотичный оттенок, дыхание становится поверхностным и учащенным (40-60 в минуту). Больной жалуется на нехватку воздуха. Одышка носит экспираторный характер. Отмечают тахикардию и лабильность пульса.
При осмотре в легких часто не удается выявить характерных изменений. Возможно укорочение перкуторного звука, аускультативно - жесткое дыхание, усиленное в передневерхних отделах, иногда рассеянные сухие хрипы. В начале болезни нередко выявляют двустороннюю крепитацию, преимущественно в базальных отделах, уменьшение экскурсии диафрагмы. Обычно увеличиваются размеры печени, реже - селезенки. При глубоком иммунодефиците возможно развитие внелегочного пневмоцистоза с поражением ЛУ, селезенки, печени, костного мозга, слизистой оболочки ЖКТ, брюшины, глаз, щитовидной железы, сердца, головного и спинного мозга, тимуса и т.д.
При исследовании периферической крови обычно регистрируют неспецифические изменения, характерные для поздних стадий ВИЧ-инфекции: анемию, лейкопению, тромбоцитопению. СОЭ всегда повышена до 40-60 мм/ч.
Самым характерным биохимическим неспецифическим показателем является повышение суммарной активности ЛДГ как отражение ДН. Общее содержание белка в сыворотке крови уменьшено, особенно уровень альбуминов, содержание Ig повышено.
При рентгенографии и КТ легких уже в ранних стадиях в прикорневых отделах определяют облаковидное понижение прозрачности, усиление интерстициаль-ного рисунка, затем - мелкоочаговые тени, располагающиеся в обоих легочных полях симметрично в виде крыльев бабочки. Такие изменения получили название «облаковидных», «пушистых» инфильтратов, «хлопьев снега», создающих вид «завуалированного» или «ватного» легкого. Такая же картина интерстициальной пневмонии может наблюдаться при цитомегаловирусной пневмонии, атипичных микобактериозах, лимфоидной интерстициальной пневмонии. У 2030% больных рентгенологические изменения могут вообще отсутствовать, а в ряде случаев встречаются атипичные признаки (асимметричные лобарные или сегментарные инфильтраты, поражение верхних отделов легких, как при туберкулезе, единичные инфильтраты в виде узлов; у 7% больных встречаются тонкостенные кистопо-добные полости, не заполненные фибрином или жидкостью).
При исследовании функции внешнего дыхания выявляют уменьшение жизненной емкости, общего объема и диффузной способности легких. Гипоксемия соответствует тяжести заболевания, pO2 составляет 40-70 мм рт.ст., альвеолярно-артериальная разница по кислороду - 40 мм рт.ст.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Увзрослых, как правило, болезнь носит более тяжелый характер, имеет затяжное, рецидивирующее течение с высокой летальностью. Неблагоприятные прогностические признаки - высокая активность ЛДГ более 500 МЕ/л, продолжительное течение болезни, наличие рецидивов, выраженная ДН и/или сопутствующая цитомегаловирусная пневмония, а также низкое содержание в крови гемоглобина (менее 100 г/л), альбумина и γ-глобулинов.
Убольных ВИЧ-инфекцией болезнь без адекватного лечения заканчивается летальным исходом чаще на фоне прогрессирующей дыхательной и сердечно-легочной недостаточности или в результате развития тяжелых осложнений.
Осложнения
Среди осложнений нередко отмечается пневмоторакс, который может развиться даже при небольшой физической нагрузке или проведении диагностических (чрескожная или чрезбронхиальная пункция легких) или лечебных (пункция подключичных вен) процедур. Возможно развитие серповидного пневмоторакса (часто двустороннего) в результате разрывов ткани легкого в передневерхних отделах. У детей возможно его сочетание с пневмомедиастинумом.
Иногда (особенно при длительном, рецидивирующем течении) легочные инфильтраты некротизируются, стенки между альвеолами лопаются, и при рентгенографическом исследовании становятся видны полости, напоминающие кисты и каверны, как при туберкулезе или раке легкого. У детей возможно развитие «шокового» легкого с исходом в необратимую ДН и легочно-сердечную недостаточность.
Одним из первых описанных внелегочных поражений при пневмоцистозе у больного СПИДом был пневмоцистный ретинит (в виде «ватных пятен»). При пневмоцистном тиреоидите, в отличие от воспалительного процесса щитовидной железы другой этиологии, не бывает симптомов интоксикации, преобладают опухолевидное образование на шее, дисфагия, иногда похудание. Известно о тяжелом поражении пневмоцистами всех органов (табл. 22.7).
ДИАГНОСТИКА Диагноз устанавливают на основании комплекса клинических и лабораторных данных. Клиническая диагностика
Среди клинических признаков наиболее существенное значение имеет длительно нарастающая выраженная одышка при минимальных физикальных изменениях. Часто доказательством правильного диагноза пневмоцистной пневмонии является эффективность терапии, назначаемой ex juvantibus.
Специфическая и неспецифическая лабораторная диагностика
При анализе лабораторных показателей следует опираться на повышение активности ЛДГ и снижение рО2 крови, что свидетельствует о ДН. Кроме этого, при пневмоцистозе всегда значительно повышается СОЭ. Эти признаки хотя и неспецифичны, но характерны для пневмоцистной пневмонии.
Основной материал для исследования с целью обнаружения возбудителя - мокрота, бронхиальный секрет, промывные воды бронхов или бронхоальвео-лярный лаваж, а также кусочки легочной ткани, взятые при трансбронхиальной, чрескожной или открытой биопсии. Чаще всего в связи с тяжелым состоянием больного эти манипуляции не проводятся во избежание осложнений. Исследование мокроты является наиболее доступным методом диагностики. Для получения достаточного количества мокроты, а также слизистого секрета трахеи и бронхов, где скопление пневмоцист более вероятно, назначают ингаляции растворов, стимулирующих секрецию и/или кашлевые толчки. При использовании солевой ингаляции пневмоцисты можно обнаружить в 40-50% проб мокроты. Отрицательный результат исследования мокроты не позволяет исключить пнев-моцистоз. При положительном результате нельзя исключить носительство пнев-моцист или болезнь вызвана другим возбудителем.
У больных ВИЧ-инфекцией диагностика на основе выявления антигенов и антител неэффективна. Трудности в трактовке результатов серологических исследований связаны с высоким уровнем носительства среди больных, взаимодействием различной флоры дыхательных путей и факторов тканевой резистентности, потерей иммунитета в стадии СПИДа. В последние годы для более точной диагностики разработаны иммунофлуоресцентные методы с моно- и поликлональными антителами, определение антигена в мокроте или промывных водах бронхоаль-веолярного лаважа с помощью РНИФ. Нельзя полагаться на результаты ПЦР диагностики, так как обнаружение ДНК возбудителя может быть и свидетельством носительства.
Инструментальные методы
Рентгенологическое исследование не является ценным диагностическим методом, поскольку при некоторых других оппортунистических инфекциях бывают сходные изменения, а у многих пациентов картина на рентгенограмме может быть нормальной.
В разгаре болезни на высоте ДН проводить инструментальные методы диагностики (бронхоскопия, биопсия ткани легкого) не рекомендуется во избежание развития пневмоторакса.
Дифференциальная диагностика
Дифференциальная диагностика особенно трудна у больных СПИДом при развитии других вторичных поражений, протекающих со сходной легочной симптоматикой - клинической и рентгенологической (туберкулез, ЦМВИ, ток-соплазмоз), тем более что они часто могут протекать в виде микст-инфекции с пневмоцистной пневмонией. Нужно учитывать наиболее важные клинические и лабораторные признаки (постепенно нарастающая ДН, скудность физикальных данных, высокая активность ЛДГ и СОЭ), а также эффект от терапии, часто назначаемой exjuvantibus.
Показания к консультации других специалистов
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Развитие тяжелых, угрожающих жизни осложнений (пневмоторакс, выраженная легочносердечная недостаточность, шоковое легкое) требует консультации реаниматолога с последующим проведением интенсивной терапии.
Пример формулировки диагноза
B20.06 ВИЧ-инфекция, стадия вторичных проявлений 4В (СПИД): пневмо-цистная пневмония, тяжелое течение.
Показания к госпитализации
Госпитализация больных обязательна в связи с угрозой осложнений. Режим в период разгара болезни постельный.
ЛЕЧЕНИЕ Медикаментозная терапия Этиотропная терапия
Для лечения детей без иммунодефицитных состояний используют преимущественно триметоприм/сульфаметоксазол (по 120 мг 4 р/сут), чаще в сочетании с фуразолидоном (по 1 таблетке 4 раза в день) или трихополом (по 4 таблетки в день) в течение 1-2 нед.
Лечение больных ВИЧ-инфекцией обязательно должно сочетаться с патогенетическим и симптоматическим лечением, а также с АРВТ, которую назначают в периоде реконвалесценции после пневмоцистной пневмонии.
Основная схема
Триметоприм/сульфаметоксазол назначают из расчета по триметоприму (по 15-20 мг/кг в сутки) внутрь или внутривенно капельно в течение 21 дня. Суточную дозу распределяют на 4 приема. Таким образом, пациент весом 60 кг должен получить в сутки от 12 до 15 таблеток триметоприм/сульфаметоксазола в
дозе 80/400 мг.
Альтернативные схемы: 1) дапсон 100 мг 1 р/сут внутрь + триметоприм 5 мг/кг 3 р/сут перорально в течение 21 дня; 2) клиндамицин 600-900 мг каждые 6-8 ч в/в
капельно или 300-450 мг каждые 6 ч внутрь + примахин 15-30 мг 1 р/сут внутрь в течение 21 дня.
Патогенетическая терапия направлена в основном на улучшение дыхательной и сердечнососудистой деятельности, она должна быть интенсивной при развитии ДН, отека легких, острой легочно-сердечной недостаточности. При наличии у больного ДН (рО2 <70 мм рт.ст.) показано назначение глюкокортикоидов: преднизолон по 80 мг в сутки (по 40 мг 2 р/сут) в течение 5 дней, затем по 40 мг 1 р/сут в течение 5 дней, затем по 20 мг в сутки до конца курса лечения.
Прогноз
В среднем количество выживших больных после перенесенной пневмоцистной пневмонии составляет 75-90%. При рецидивах выживают около 60% больных. Однако с введением в
широкую клиническую практику АРВТ эти показатели снижаются. Диспансеризация
Диспансерному наблюдению подлежат все больные с ВИЧ-инфекцией. Перенесшим пневмоцистную пневмонию проводят профилактику рецидивов и
АРВТ.
Глава 23. Гельминтозы
23.1. ТРЕМАТОДОЗЫ 23.1.1. Описторхоз
Описторхоз (лат. opisthorchosis, англ. opisthorchiasis, франц. opisthorchiase) - природноочаговый биогельминтоз с фекально-оральным механизмом передачи возбудителя, характеризующийся длительным течением и преимущественным поражением гепатобилиарной системы и поджелудочной железы.
КОД ПО МКБ-10 В66.0 Описторхоз. ЭТИОЛОГИЯ
Возбудитель - Opisthorchis felineus (кошачья двуустка) принадлежит к типу плоских червей (трематоды), классу сосальщиков. Имеет плоское удлиненное тело длиной 8-14 мм и диаметром 1-3,5 мм; снабжен двумя присосками - ротовой и брюшной (рис. 23.1). Описторхи - гермафродиты. Яйца бледно-желтые, почти бесцветные, с гладкой двухконтурной оболочкой, имеющей крышечку на слегка суженном полюсе и небольшое утолщение на противоположном конце. Размеры яиц - 23-24x11-19 мкм.
Возбудитель обладает сложным циклом развития (рис. 23.2). Помимо окончательных, он имеет двух промежуточных и дополнительного хозяев. У дефинитивных (основных) хозяев гельминт паразитирует в половозрелой стадии своего развития. Из желчных ходов, желчного пузыря и протоков поджелудочной железы человека и плотоядных млекопитающих (кошки, собаки, лисица, песец, соболь, росомаха, свинья домашняя и др.) яйца паразитов вместе с желчью проникают в кишечник и затем попадают в окружающую среду. Дальнейшее развитие проходит в водоемах, где описторхи сохраняют жизнеспособность до 6 мес и заглатываются первым промежуточным хозяином - пресноводным моллюском
рода Codiella, в теле которого происходит ряд превращений: из яйца выходит мира-цидий, образующий спороцисту, в которой формируются редии, рождающие большое количество личинок следующей стадии (цер-кариев). Последние выходят из моллюска и проникают в мышцы второго промежуточного хозяина - рыб семейства карповых (язь, сибирский елец, линь, европейская плотва, чебак, красноперка, сазан, карп, усач, лещ, густера, подуст, жерех, уклея), где церкарии превращаются в метацеркариев, которые через 6 нед становятся инвазионными. Рыба, пораженная метацеркариями описторхов, - источник заражения человека и многих плотоядных животных.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Рис. 23.1. Возбудитель - Opisthorchis felineus (кошачья двуустка) принадлежит к типу плоских червей (трематоды), классу сосальщиков. Имеет плоское удлиненное тело длиной 8-14 мм и диаметром 1-3,5 мм; снабжен двумя присосками. 1 - ротовая присоска; 2 - глотка; 3 - пищевод; 4 - кишечник; 5 - брюшная присоска; 6 - желточники; 7 - желточные протоки; 8 - яичник; 9 - семяприемник; 10 - матка; 11 - семенники; 12 - семявыносящий проток; 13 - половые отверстия; 14 - экскреторный канал
В желудке и двенадцатиперстной кишке окончательного хозяина происходит эксцистирование метацеркариев. Под действием желудочного сока переваривается соединительнотканная капсула, а под действием дуоденального сока метацеркарий освобождается от внутренней оболочки. Обладая положительным хемотаксисом к желчи, паразиты отыскивают отверстия желчного протока и через общий желчный проток проникают в желчные ходы и желчный пузырь, а иногда и в поджелудочную железу. Спустя 3-4 нед после заражения гельминты достигают половозрелого состояния и после оплодотворения начинают выделять яйца. Продолжительность жизни описторхов достигает 15-25 лет.
Яйца O. felineus устойчивы в окружающей среде: в пресной воде сохраняют жизнеспособность около года. Личинки описторха погибают при варке рыбы цельным куском через 20 мин, в рыбном фарше - через 10 мин после начала кипячения. При засолке рыбы личинки погибают через 4-7 сут. Горячее копчение гибельно для возбудителя, а холодное не повреждает его.
ЭПИДЕМИОЛОГИЯ
Описторхоз широко распространен на Евроазиатском континенте. В России и странах СНГ наиболее обширные очаги инфекции обнаруживают на территории Западной Сибири, Северного Казахстана (бассейн Оби и Иртыша), Пермской и Кировской областей и бассейнов рек Камы, Вятки, Днепра, Десны, Сейма, Северного Донца, Южного Буга. Самую напряженную ситуацию отмечают в Западной Сибири, где расположен крупнейший ОбьскоИртышский очаг инвазии.
Восприимчивость населения к инвазии высокая. Пораженность опистор-хозом коренного населения севера РФ достигает 80-100% и связана с особенностями питания: употреблением тер-
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/

Рис. 23.2. Жизненный цикл возбудителя описторхоза Opisthorchis felineus: А - окончательные хозяева (млекопитающие); Б - моллюск (первый промежуточный хозяин); В - рыба семейства карповых (второй промежуточный хозяин); 1 - взрослый гельминт; 2 - яйцо; 3 - мирацидий; 4 - церкарий; 5 - метацеркарий
мически не обработанной рыбы и высокой степенью инвазированности последней. Пораженность местного русского населения несколько ниже. Основной источник описторхоза в населенных пунктах - человек, домашние животные (кошки, свиньи) или синантропные грызуны. Механизм передачи - фекально-оральный, путь передачи - пищевой. Через 3-4 нед после заражения в течение многих лет (до 10-20) источник инвазии выделяет с фекалиями в окружающую среду яйца описторхов. Источник заражения для человека - рыбы семейства карповых, инва-зированные метацеркариями и употребляемые в пищу в сыром или полусыром виде. Более других заражены язь, елец, плотва. Метацеркарии устойчивы к низким температурам (в замороженной рыбе они могут сохранять жизнеспособность при -40 °С до 7 ч, при -35 °С - до 14 ч, при -28 °С - 32 ч), но чувствительны к высоким: после выделения из рыбы они погибают при 55 °С в течение 5 мин.
Описторхозу свойственна летне-осенняя сезонность. Несколько чаще болеют мужчины. Ежегодно на долю описторхоза приходится около 60% всех зарегистрированных биогельминтозов. После излечения стойкий иммунитет не вырабатывается; часто наблюдают реинфекцию.
МЕРЫ ПРОФИЛАКТИКИ
Комплекс мер борьбы с описторхозом включает следующие направления: обнаружение очагов и лечение больных описторхозом; проведение широкой санитарно-просветительной работы среди населения в очагах; дегельминтизация домашних плотоядных животных; охрана окружающей среды от фекального загрязнения; качественная термическая обработка рыбы карповых пород перед употреблением ее в пищу; борьба с промежуточными хозяевами описторхов и свободноплавающими стадиями паразита.
В домашних условиях обеззараживать рыбу рекомендуют следующими способами: прожаривать небольшие куски не менее 20 мин; варить 20 мин с момента закипания; выпекать рыбные пироги 40-60 мин; применять крепкий посол (20% соли к массе рыбы) с 10дневной выдержкой; вялить мелкие карповые породы (плотва, елец) в течение 3 нед с 2-3- дневным предварительным посолом; холодное копчение рыбы проводить после крепкого посола или промораживания в течение 3-4 нед.
ПАТОГЕНЕЗ
После употребления в пищу инвазированной рыбы метацеркарии попадают в желудок и двенадцатиперстную кишку, а через 3-5 ч достигают внутрипеченочных желчных ходов - места своего основного обитания в организме окончательного хозяина. У 20-40% зараженных лиц описторхов обнаруживают в протоках поджелудочной железы и желчном пузыре. В процессе миграции и при дальнейшем развитии они выделяют ферменты и продукты метаболизма, оказывающие сенсибилизирующее и прямое токсическое действие на организм. В динамике инвазионного процесса при описторхозе выделяют две фазы - раннюю (острую) и позднюю (хроническую).
•В основе патогенеза ранней стадии лежат токсико-аллергические реакции организма на метаболиты, выделяемые личинками в процессе их миграции и созревания, а также на антигены последних. В этой стадии наблюдают повышенную проницаемость сосудов печени и поджелудочной железы, продуктивный васкулит, эозинофильную инфильтрацию стромы органов, их отечность, пролиферацию и десквамацию эпителия желчных ходов. В ЖКТ (в двенадцатиперстной кишке), печени, легких и других органах формируются эозинофильные инфильтраты.
•В хронической стадии токсико-аллергические реакции сохраняются, но основные патологические изменения обусловлены жизнедеятельностью описторхов, которые своими присосками и шипиками оказывают раздражающее и повреждающее действие на стенку желчных и панкреатических протоков, желчного пузыря, вызывая воспалительную и регенеративно-гиперпластическую реакцию с развитием холангита и перихолангита, приводящую к фиброзу органов. Скопления паразитов и их яиц замедляют ток желчи и секрета поджелудочной железы. Гиперпластические и воспалительные процессы приводят к развитию стриктур в терминальной части общего желчного и пузырного протока, способствуют присоединению бактериальной инфекции и образованию конкрементов в желчевыводящих протоках и протоке поджелудочной железы. Часто ее сопровождает гастродуоденит (вплоть до эрозивно-язвенного).
Пролиферативные процессы при описторхозе расцениваются как предраковое состояние, в сочетании с действием экзогенных канцерогенов могут приводить к развитию холангиокарциномы. В Западной Сибири, где высок уровень поражен-ности населения описторхозом, заболеваемость холангиокарциномой в 10-15 раз выше, чем в других регионах.
Ранний иммунный ответ при описторхозе сопровождается увеличением уровня общих IgМ в 10-12 раз с максимумом на 2-3-й неделе и снижением их кон-
центрации через 6-8 нед, когда отмечают увеличение содержания IgG. В дальнейшем концентрация антител падает ниже пороговых значений, что создает условия для реинвазии и длительного паразитирования описторхов в организме. Иммуносупрессия, сопровождающая
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
инвазию, снижает резистентность к другим инфекциям, способствует тяжелому течению шигеллеза и других кишечных инфекций, часто провоцирует хроническое бактерионосительство у переболевших брюшным тифом, отягощает течение ВГ выраженным холестазом, частыми обострениями и рецидивами.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период составляет 2-6 нед после употребления в пищу пораженной рыбы. Заболевание характеризуется полиморфизмом клинической картины.
Единой классификации описторхоза не существует. Выделяют острую фазу инвазии, которая может протекать бессимптомно или стерто у коренных жителей эндемичных регионов при реинвазии или суперинфекции. Клинически выраженную форму острой фазы наблюдают у лиц, прибывших в эндемичный регион. Хроническую фазу болезни при отсутствии симптомов острой фазы расценивают как первично-хроническую; если же ей предшествует острая фаза - как вторично-хроническую. Органные поражения (желчевыводящих путей, поджелудочной железы, желудка и двенадцатиперстной кишки) могут сохраняться и после освобождения организма от описторхов, поэтому некоторые авторы выделяют резиду-альную фазу болезни.
Острую фазу при бессимптомной инвазии диагностируют по обнаружению яиц паразита в дуоденальном содержимом и фекалиях, по незначительной эозинофи-лии и повышенному содержанию специфических IgM. Стертую форму, помимо этих критериев, характеризует кратковременный субфебрилитет.
Клинически выраженная форма манифестирует внезапно возникшей лихорадкой, болями в правом подреберье, миалгией, артралгией, высыпаниями на коже, увеличением селезенки и печени, лейкоцитозом и гиперэозинофилией крови. При легкой форме лихорадка (около 38 °С) продолжается до 2 нед, возможны боли в животе неопределенной локализации, диарея, умеренный лейкоцитоз и эозинофилия. Среднетяжелая форма характеризуется лихорадкой (38-39,5 °С) ремиттирующего, постоянного или неправильного типа длительностью до 3 нед, уртикарными высыпаниями на коже, миалгией и артралгией, болями в правом подреберье, в части случаев - умеренной диареей и рвотой. Печень и селезенка увеличены; возможен астматический бронхит.
Тяжелому течению болезни свойственны высокая лихорадка, выраженная интоксикация (головная боль, бессонница, заторможенность или возбуждение, тахикардия), полиморфные кожные высыпания. Выражена картина гепатита: боли в правом подреберье, увеличение печени, желтуха, повышение уровня билирубина, увеличение активности аминотрансфераз и ЩФ. У части больных развивается эрозивно-язвенный гастродуоденит с сильными болями в эпигастральной области, тошнотой, рвотой, метеоризмом, диареей. Возможны боли в грудной клетке, одышка, кашель, летучие инфильтраты в легких. Известны случаи миокардита. Характерен гиперлейкоцитоз (20-60×109/л), эозинофилия в пределах от 10 до 80-90%, увеличение СОЭ.
Острая фаза болезни длится от 2-3 нед до 2 мес, после чего клинические симптомы стихают и болезнь переходит в хроническую фазу, признаки которой проявляются через несколько месяцев и даже лет и характеризуются значительным полиморфизмом. Чаще всего наблюдают поражение гепатобилиарной системы. Больные отмечают тяжесть в правом подреберье и эпигастральной области, ухудшение аппетита, тошноту, рвоту, диарею. Печень немного увеличена, чувствительна, плотноватая при пальпации. Функциональные показатели обычно не изменены. Желчный
пузырь увеличен, точка желчного пузыря болезненна; возможны приступы коликообразных болей. При дуоденальном зондировании количество желчи увеличено, содержание лейкоцитов в ней повышено. При поражении поджелудочной железы отмечают боли опоясывающего характера. Возможны развитие хронического гастрита, гастродуоденита,
язвенное поражение слизистой оболочки желудка и двенадцатиперстной кишки. Больные часто страдают головной болью, головокружением, бессонницей; возможна депрессия. Течение инвазии длительное (до 20 лет и более), но доброкачественное. Летальные исходы редки и связаны с осложнениями.
Осложнения
В хронической фазе болезни часто развивается гнойный холангит и холецистит, острый и хронический панкреатит, язвенная болезнь желудка и двенадцатиперстной кишки, перитонит, холангиокарцинома.
ДИАГНОСТИКА
Диагноз устанавливают на основании клинико-эпидемиологических и лабораторных данных: употребление термически не обработанной, слабосоленой рыбы в эндемичных регионах; лихорадка, токсико-аллергический синдром; лейкоцитоз и эозинофилия в крови; в хронической фазе - симптомы холецистопанкреатита, гастродуоденита.
Для клинической диагностики применяют ЭГДС, холецистографию, дуоденальное зондирование, УЗИ органов брюшной полости, определяют кислотность желудочного сока.
Специфическая лабораторная диагностика
Паразитологическая диагностика острого описторхоза невозможна, так как гельминты начинают выделять яйца только через 6 нед после начала инвазии. Для определения специфических антител используют ИФА. Применяют следующие тест-системы: для определения IgM - «Описторхис-IgM-стрип»; для определения IgG - «Тиатоп-стрип»; для определения специфических ЦИК - «Описторх-ЦИК-стрип».
Паразитологическое исследование желчи - наиболее достоверный метод диагностики описторхоза. Проводят микроскопическое исследование осадка трех порций желчи. Дуоденальное зондирование - сложная и не всегда приемлемая процедура, малопригодная для массовых обследований, поэтому наиболее распространена копроовоскопия, основанная на изучении морфологических особенностей яиц описторхов. При исследовании кала используют различные методы: качественный формалин-эфирный, химикоседиментационный Березанцева, количественный Столла и полуколичественный Като. Применяют также флотационные методы Фюллеборна и Горячева. При незначительной инвазии яйца опи-сторхов обнаруживают непостоянно, поэтому необходимо неоднократное парази-тологическое обследование больных после процедур, стимулирующих желчеотток (тюбаж по Демьяновичу, прием холекинетиков).
Дифференциальная диагностика
Дифференциальная диагностика описторхоза сложна, что связано с полиморфизмом и неспецифичностью клинических симптомов.
Острую фазу описторхоза необходимо дифференцировать с брюшным тифом, гриппом, воспалительными заболеваниями органов брюшной полости (холецистит, холангит, панкреатит), глистными инвазиями (трихинеллез, фасциолез, парагонимоз), пневмонией, ОКИ, ВГ.
Острый описторхоз с признаками гепатита отличается от ВГ лихорадкой на фоне желтухи, более выраженным болевым синдромом, высокой эозинофилией, увеличением активности ЩФ в сочетании с умеренно выраженными признаками цитолитического синдрома. В отличие от гриппа острому описторхозу свойственны увеличение и болезненность печени, эозинофилия.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Хроническую фазу описторхоза дифференцируют с фасциолезом, хроническим холециститом, панкреатитом, гастродуоденитом, язвенной болезнью желудка и двенадцатиперстной кишки, хроническим гепатитом другой этиологии.
Показания к консультации других специалистов
При возникновении симптомов острого холецистита, панкреатита - консультация хирурга, при стойкой желтухе - гепатолога, онколога, хирурга, при выраженных изменениях со стороны ЦНС - консультация невролога, при аллергических проявлениях - аллерголога.
Пример формулировки диагноза
В66.0 Хронический описторхоз. Хронический холецистопанкреатит (яйца Opisthorhis felineus в дуоденальном содержимом).
ЛЕЧЕНИЕ
Лечение больных описторхозом должно быть комплексным, индивидуальным и учитывать сопутствующие заболевания. Госпитализацию больных осуществляют по клиническим показаниям. Назначают щадящий режим, диету № 5 в течение 6 мес.
Препарат выбора - празиквантел или его отечественный аналог Азинокс♠¤. Лечение, как правило, амбулаторное (кроме больных с выраженными симптомами острой фазы, тяжелыми органными поражениями, токсико-аллергическими проявлениями). В острой фазе терапию начинают после купирования лихорадки, устранения интоксикации и аллергических симптомов. Препарат назначают в суточной дозе 75 мг/кг массы тела после еды в 3 приема с интервалом 4-6 ч. Максимальная разовая доза - 2 г, суточная - 6 г. Препарат не рекомендуют детям до 2 лет и беременным в I триместре. Кормящие женщины в день приема и на следующий день не должны кормить ребенка грудным молоком. Противопоказано употребление алкоголя. Возможны кратковременные побочные эффекты: головная боль, головокружение, чувство опьянения, диспепсические расстройства. Эффективность одного курса лечения составляет 90-94%.
В острой фазе проводят дезинтоксикационную и десенсибилизирующую терапию с использованием антигистаминных препаратов. В тяжелых случаях назначают преднизолон по 40-60 мг в сутки в течение 5-7 дней, в хронической стадии -
желчегонные препараты, спазмолитики, ферментные препараты, тюбаж с сернокислой магнезией, боржоми. При присоединении бактериальных осложнений применяют противомикробные препараты.
Прогноз
При отсутствии бактериальных осложнений прогноз обычно благоприятный; серьезный - при развитии гнойных процессов в желчевыводящих путях, при желчном перитоните и остром панкреатите; неблагоприятный при развитии холангиокарциномы или рака печени.
Диспансеризация Врачебную экспертизу осуществляют при тяжелом и осложненном течении инвазии.
Диспансеризацию проводят в течение 1-2 лет. Кратность осмотров гастроэнтеролога и объем реабилитационных мероприятий определяют индивидуально.
При аллергических проявлениях контрольное обследование на яйцевыделение осуществляют через 3, 6, 12 мес после окончания антигельминтной химиотерапии. Проводят троекратное исследование фекалий и дуоденальное зондирование.
23.1.2. Фасциолез
Фасциолез (лат. fasciolosis, англ. fascioliasis) - хронический зоонозный биогельминтоз, вызываемый паразитированием трематод семейства Fasciolidae; характеризуется преимущественным поражением желчевыделительной системы.
КОД ПО МКБ-10 B66.3 Фасциолез. ЭТИОЛОГИЯ
Возбудители фасциолеза - два вида трематод. Fasciola heρatica (двуустка печеночная) имеет плоское листовидное тело длиной 20-30 мм, диаметром 8-12 мм от коричневого до серого цвета с зеленоватым оттенком, на кутикуле имеются мелкие шипики. Ротовая и брюшная присоски развиты слабо, они сближены между собой и расположены в передней части
тела. Fasciola gigantica (двуустка гигантская), длиной 33-76 мм, диаметром 5-12 мм. Fasciola heρatica и Fasciola gigantica относятся к
типу Plathelminthes классу Trematoda семейству Fasciolidae.
Они имеют крупные овальные яйца размером 0,125-0,150×0,062-0,081 мм, хорошо выраженную оболочку и крышечку. Цвет яиц желтовато-бурый, во внешнюю среду они выделяются незрелыми. Окончательные хозяева - жвачные животные (мелкий и крупный рогатый скот, свиньи, лошади и др.), иногда крысы, а также человек. Гельминты паразитируют в желчевыводящей системе в течение 3-5 лет и более. В окружающую среду яйца выделяются с фекалиями, дальнейшее их развитие возможно только в пресной воде. Выделившиеся из яиц личинки (мирацидии) проникают в тело промежуточного хозяина - брюхоногих моллюсков Lymnaea truncatula и других видов Lymnaea, из которых спустя 30-70 дней после длительных и сложных преобразований выходят хвостатые церкарии. Они сбрасывают хвост, инцистируются и превращаются в шаровидной формы адоле-скарии, которые прикрепляются к стеблям подводных растений или к поверхностной пленке воды. В организм окончательного хозяина личинки попадают с водой или растениями.
ЭПИДЕМИОЛОГИЯ
Основной источник заражения окружающей среды - овцы и крупный рогатый скот. Человек заражается при употреблении в пищу зараженных адолескариями дикорастущих растений (щавель, дикий лук, кресс-салат, огородная зелень), а также сырой воды из непроточных водоемов. Заражение возможно также при мытье салатных трав прудовыми водами. При употреблении фасциолезной печени животных в кишечник попадают яйца, которые не могут вызвать заболевание, однако могут обнаружиться при исследовании кала. Фасциолез, вызванный Fasciola heρatica, распространен практически во всех регионах мира, но более
широко в странах Азии, Африки и Южной Америки. В Европе наибольшее число случаев фасциолеза зарегистрировано в Португалии и Франции. В некоторых регионах России и в странах СНГ регистрируют спорадические случаи, отдельные вспышки иногда возникают в Центральной Азии, Закавказье. Очаги фасциолеза, вызванного Fasciola
gigantica, встречаются во Вьетнаме, на Гавайских островах и в некоторых странах Африки. Яйца фасциол в водоемах и на пастбищах сохраняются жизнеспособными до 2 лет. Личинки в теле моллюска могут перезимовывать и весной завершать свое развитие.
ПРОФИЛАКТИКА
Профилактика фасциолеза предусматривает проведение мероприятий, снижающих пораженность гельминтозом сельскохозяйственных животных: профилактическая дегельминтизация скота, смена пастбищ и др. Борьбу с моллюсками - промежуточными хозяевами фасциол проводят путем мелиорации заболоченных пастбищ. Вода из стоячих и медленно текущих водных источников при использовании для питья и хозяйственных нужд
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
подлежит кипячению. Особое значение придается санитарно-просветительной работе среди населения, проживающего в эндемичной по фасциолезу местности.
ПАТОГЕНЕЗ
Миграция личинок фасциол из кишечника в печень происходит двумя путями - гематогенным и посредством их активного внедрения через перитонеальную полость, фиброзную оболочку (глиссонову капсулу) печени. Основные патологические изменения возникают во время миграции личинок через паренхиму печени, длящейся 4-6 нед и более. От момента попадания адолескариев в организм дефинитивного хозяина до развития половозрелых особей паразита проходит 3-4 мес. Обычно взрослые фасциолы локализуются в желчных протоках. Иногда личинки могут мигрировать и созревать в местах, для них не свойственных: в поджелудочной железе, подкожной ткани, головном мозге. В миграционной фазе выражены токсико-аллергические реакции вследствие сенсибилизации организма антигенами личинок, а также повреждения тканей по ходу их продвижения. Гельминты вызывают деструктивные изменения в печени, микроабсцессы, в последующем - фиброзные изменения. Взрослые особи, обитающие в желчевыводящих протоках и желчном пузыре, вызывают пролиферативный холангит с аденоматозными изменениями эпителия, перидуктальным фиброзом и фиброзом стенки желчного пузыря. Возможна обструкция желчных протоков, что создает условия для присоединения вторичной инфекции. КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период длится 1-8 нед. Выделяют острую и хроническую стадии фасциолеза. У многих лиц, подвергшихся заражению Fasciola hepatica, клинические проявления острой стадии отсутствуют, у некоторых больных в течение многих месяцев инвазия протекает бессимптомно. При клинически манифестных формах начало болезни острое: с повышением температуры тела до 38-39 °С, недомоганием, общей слабостью, потливостью, головной болью, потерей аппетита. Лихорадка может быть ремиттирующей, гектической, волнообразной. Наблюдают кашель, приступы бронхоспазма, боли в эпигастральной области, правом подреберье, тошноту, рвоту. Печень увеличена (часто более выражено увеличение левой доли), плотновата, болезненна. В некоторых случаях наблюдают желтуху, сплено-мегалию, асцит. На коже возможны высыпания уртикарного или полиморфного характера. В периферической крови лейкоцитоз, гиперэозинофилия (до 80%),
иногда признаки анемии. С переходом болезни в хроническую стадию аллергический симптомокомплекс стихает, но субфебрилитет продолжается иногда до нескольких месяцев.
Хронический неосложненный фасциолез протекает с болями в правом подреберье, подложечной области, диспепсическими явлениями. Для фасциолеза, осложненного бактериальной инфекцией желчевыводящих путей, характерны приступообразные боли, сопровождающиеся лихорадкой, лейкоцитозом. При длительном течении гельминтоза развиваются нарушения функции печени, анемия.
Осложнения - гнойный и склерозирующий холангит, гепатит, абсцесс и цирроз печени.
В результате локализации гельминта в головном мозге возникают сильная головная боль, эпилептиформные приступы, при попадании в легкие - кашель, кровохаркание.
ДИАГНОСТИКА
В острой стадии болезни диагноз основан на анамнестических, эпидемиологических данных, клинических проявлениях, а также на результатах серологических исследований (РНГА, РИФ, ИФА). Через 3-4 мес после заражения с началом откладывания яиц взрослыми гельминтами диагноз можно подтвердить овоско-пическими исследованиями фекалий и дуоденального содержимого. Следует учитывать, что при инвазии Fasciola
hepatica выделяется сравнительно мало яиц гельминта, поэтому следует использовать методы
обогащения (эфир-формалиновый или эфир-уксусный методы). Яйца фасциол могут быть обнаружены после употребления печени крупного скота, пораженной гельминтами (транзитные яйца). В таких случаях рекомендуется провести повторное исследование через 3-5 дней после исключения из питания продуктов из печени.
Для суждения о характере и степени изменений в печени и желчевыводящих путях проводят инструментальные исследования - УЗИ, КТ, МРТ печени, холе-цистохолангиографию.
Дифференциальная диагностика
Дифференциальную диагностику в острой стадии проводят с трихинеллезом, описторхозом, клонорхозом, ВГ, эозинофильным лейкозом; в хронической - с холециститом, холангитом, панкреатитом.
Показания к консультации хирурга - подозрение на развитие бактериальных осложнений со стороны гепатобилиарной системы.
Пример формулировки диагноза
B66.3 Фасциолез, хроническая стадия. Осложнение: хронический некалькулез-ный холецистит.
ЛЕЧЕНИЕ
В острой стадии назначают диету (стол № 5), антигистаминные средства. После стихания симптомов - антигельминтную терапию. Средство выбора - триклабен-дазолρ (в РФ не зарегистрирован), который применяют в суточной дозе 10 мг/кг в 1 прием, в тяжелых случаях препарат применяют в дозе 20 мг/кг в сутки, в 2 приема с интервалом в 12 ч [5]. Можно использовать празиквантел в дозах, применяемых при описторхозе, однако при
инвазии Fasciola hepatica его эффективность не превышает 40%, но значительно выше в отношении Fasciola gigantica. Для освобождения желчных протоков от погибших паразитов используют ЛС, обеспечивающие полноценный отток из желчевыводящих путей и протоков поджелудочной железы, восстановление их моторно-кинетической функции с учетом типа имеющейся дискинезии.
Эффективность противогельминтного лечения оценивают по исчезновению яиц фасциол в кале и/или дуоденальном содержимом в исследованиях через 3 и 6 мес.
Прогноз
Прогноз для жизни благоприятный. При длительном течении фасциолеза возможно развитие цирроза печени. Редкие летальные исходы обусловлены осложнениями.
Сроки нетрудоспособности Определяют индивидуально.
Диспансеризация Не регламентирована. 23.1.3. Шистосомозы
Шистосомозы, или бильгарциозы (лат. schistosomosis; англ. schistosomiasis, bilharziasi) - тропические гельминтозы, характеризующиеся в острой стадии токсико-аллергическими реакциями, в хронической - преимущественным поражением кишечника или мочеполовой системы, в зависимости от вида возбудителя.
Различают следующие нозологические формы шистосомозов: мочеполовой, кишечный, японский и протекающие с преимущественным поражением кишечника шистосомозы, вызываемые Schistosoma intercalatum и Schistosoma mekongi.
КОДЫ ПО МКБ-10
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
B65 Шистосомоз (бильгарциоз). B65.0 Шистосомоз, вызванный Schistosoma haematobium (мочеполовой шисто-сомоз).
B65.1 Шистосомоз, вызванный Schistosoma mansoni (кишечный шистосомоз). B65.2 Шистосомоз, вызванный Schistosoma japonicum. B65.3 Церкариальный дерматит. B65.8 Другие шистосомозы. B65.9 Шистосомоз неуточненный.
ЭТИОЛОГИЯ
Шистосомы относятся к
типу Plathelminthes, классу Trematoda, семейству Schistosomatidae. Пять видов
шистосом: Schistosoma mansoni, S. haematobium, S. japonicum, S. intercalatum и S. mekongi - возбудители гельминтоза у человека. Шистосомы отличаются от всех остальных представителей класса Trematoda тем, что они раздельнополые и отличаются половым диморфизмом. Тело половозрелых шистосом удлиненное, цилиндрическое, покрыто кутикулой. Имеются расположенные близко друг к другу присоски - ротовая и брюшная. Тело у самки длиннее и тоньше, чем у самца. Вдоль тела самца проходит особый копулятивный желобок (гинекоформный канал), в котором самец удерживает самку. Самец и самка почти постоянно находятся вместе. Наружная поверхность самца покрыта шипиками или бугорками, у самки шипы имеются только на переднем конце тела, остальная поверхность гладкая. Половозрелые самки и самцы спариваются и мигрируют в сосуды постоянной локализации - в систему мезентериальных вен (кишечные разновидности шистосом) или мочевого пузыря и малого таза - S. haematobium, где обитают в мельчайших венозных сосудах окончательного хозяина. Взрослые гельминты питаются компонентами крови через пищеварительную трубку и частично адсорбируют жидкую часть через кутикулу. В матке S. haematobium находится одновременно не более 20-30 яиц. Наибольшей репродуктивной способностью обладает самка S. japonicum, за сутки откладывающая от 500 до 3500 яиц. Личинка в яйце шистосомы, отложенном в мелких венах хозяина, созревает в тканях в течение 5-12 дней. Миграция яиц из кровеносных сосудов происходит благодаря наличию шипа, протеолитической активности секрета личинок, а также под влиянием сократительных движений мышечного слоя стенок сосудов, кишечника и мочевого пузыря. В окружающую среду яйца попадают с мочой (S. haematobium) или калом (S. mansoni и др.). Дальнейшее развитие происходит в воде, где оболочка яиц разрушается; из них выходят мирацидии. Цикл развития шистосом связан со сменой хозяина. Их промежуточный хозяин - пресноводные моллюски, в теле которых мирацидии в течение 4-6 нед проходят сложный процесс формирования церкари-ев (поколения инвазионных личинок, способных активно внедряться в организм окончательного хозяина). После проникновения в тело человека личинки теряют хвостовой придаток. Продолжительность жизни мирацидия - до 24 ч, церкари-ев - до 2-3 сут, половозрелых особей шистосом - 5-8 лет [1, 2, 3, 6, 9]. ЭПИДЕМИОЛОГИЯ
Основной источник заражения окружающей среды при всех шистосомозах - больной человек. Некоторые животные (обезьяны, грызуны) также могут заражаться S. mansoni, но в распространении шистосомоза значимой роли не играют. S. japonicum имеет значительно более широкий круг хозяев и, по-видимому, может поражать всех млекопитающих и достигать в них половой зрелости, поэтому животные, особенно домашние (крупный рогатый скот, свиньи, лошади, собаки, кошки и др.), могут быть резервуаром инфекции.
Промежуточные хозяева шистосом - пресноводные моллюски: для S. haematobium - родов Bulinus, Physoρsis, Planorbis; для S. mansoni - рода Biomρhalaria; для S. japonicum - рода Oncomelania. Ежедневно тело инфицированного моллюска покидают до 1500-4000 и
более церкариев, а в итоге за период жизни моллюска - до нескольких сот тысяч инвазионных личинок шистосом.
Естественная восприимчивость людей к заражению всеми 5 видами шистосом всеобщая. В высокоэндемичных очагах пораженность людей шистосомозом достигает максимума во втором десятилетии жизни, затем снижается вследствие формирующегося иммунитета. Отмечают определенный уровень невосприимчивости к суперинвазии и низкую интенсивность инвазии после реинфекции. Шистосомы
наиболее чувствительны к воздействию иммунных механизмов организма хозяина в течение первых дней после заражения, т.е. в стадии мигрирующих личинок.
Человек заражается шистосомозом при купании, стирке белья, при работе в водоемах, сельскохозяйственных работах на поливных землях, во время религиозных обрядов и других контактов с зараженной водой. Местом заражения служат как естественные, так и искусственные водоемы. Появлению новых очагов способствует строительство новых ирригационных сооружений, усиление миграции населения, связанное с хозяйственным освоением новых территорий, туризмом, паломничеством. Из различных групп населения по роду деятельности чаще заражаются сельские жители, рыбаки, садоводы, сельскохозяйственные рабочие, но особенно велик риск заражения детей (обычно заражаются дети и подростки в возрасте 7-14 лет), так как их игры часто связаны с водой. Ареал различных форм шистосомоза охватывает 74 страны и территории тропического и субтропического пояса, в которых, по данным ВОЗ, число инфицированных превышает 237 млн человек, из них более 120 млн страдают клинически манифестными формами болезни, а 20 млн имеют серьезные осложнения. В странах Африки отмечают как изолированные очаги мочеполового, кишечного шистосомоза, так и сочетанное их распространение. В ряде стран центра Западной Африки (Габон, Заир, Камерун, Чад) выявлены очаги, где регистрируют одновременно мочеполовой, кишечный и интеркалатный шистосомоз. Изолированные очаги мочеполового шистосомоза отмечают в странах Ближнего и Среднего Востока, а сочетание мочеполового и кишечного шистосомоза - в Йемене, Саудовской Аравии. Ареал японского шистосомоза охватывает Китай, Малайзию, Филиппины, Индонезию, Японию; ареал меконгового шистосомо-за - Кампучию, Лаос, Таиланд. В странах Центральной и Южной Америки и на островах Карибского бассейна (за исключением Кубы) распространен кишечный шистосомоз (S. mansoni) [1, 2, 3, 6, 9]. В РФ регистрируются только завозные случаи шистосомозов.
МЕРЫ ПРОФИЛАКТИКИ
Борьба с шистосомозами включает комплекс мероприятий, направленных на прекращение передачи инвазии, предупреждение заражения людей. Уничтожение шистосом или прекращение выделения ими яиц достигается своевременным выявлением и специфическим лечением больных. В комплекс мер профилактики входят предупреждение фекального загрязнения водоемов, уничтожение в них моллюсков и церкариев с помощью химических и биологических средств. Заражение людей в инфицированных водах можно предупредить ношением защитной одежды (перчатки, резиновые сапоги и т.п.) или применением репеллентов. В настоящее время в программах борьбы с шистосомозами наибольшее значение имеют массовая химиотерапия и применение моллюскоцидов. На всех этапах программы борьбы с шистосомозом большое значение придается активной санитарнопросветительной работе среди населения эндемичных очагов, особенно среди школьников. Лица, выезжающие в эндемичные по шистосомозам регионы и страны, должны получать полноценную и адекватную информацию о личной профилактике гельминтоза. ПАТОГЕНЕЗ
Шистосомы не размножаются в организме окончательного хозяина, поэтому их число может увеличиться только вследствие реинвазии. Патогенное влияние паразитов начинается с момента проникновения церкариев через кожу. Секреты желез мигрирующих личинок, продукты распада части из них - сильные антигены, вызывающие реакции ГЗТ. Клинически
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
это проявляется преходящей папулезной зудящей сыпью (церкариальный дерматит) и известно под названием «чесотка
пловцов». Личинки, утратившие хвостовой придаток (шистосомулы), внедряясь в периферические лимфатические и венозные сосуды, мигрируют в правые отделы сердца, в легкие, затем достигают сосудов печени, где и происходят их развитие и дозревание до взрослых особей. Через 4-6 нед после заражения, в период завершения миграции шистосомул и начала откладывания яиц созревшими самками, резко усиливаются аллергические реакции, которые лежат в основе острой («токсемиче-ской») фазы болезни, именуемой также болезнью Катаямы. По характеру клинических проявлений эта фаза напоминает сывороточную болезнь. Чаще ее наблюдают при инвазии S. jaρonicum, значительно реже - после заражения S. mansoni и другими видами возбудителя.
Из общего числа яиц шистосом, отложенных самками в мелких венозных сосудах, питающих стенки кишечника или мочевого пузыря, в окружающую среду попадает не более 50%; остальные задерживаются в тканях пораженных органов или током крови заносятся в другие органы. Основа патологических изменений в хроническом периоде болезни - совокупность воспалительных изменений вокруг яиц шистосом (формирование специфического клеточного инфильтрата - гранулемы, с последующим фиброзом и кальцификацией). В формировании гранулемы вокруг яиц участвуют Т-лимфоциты, макрофаги, эозинофилы. Вначале процесс имеет обратимый характер, но с отложением коллагена и развитием фиброза морфологические изменения в тканях становятся необратимыми. Гранулематозная реакция и фиброз вызывают нарушения кровоснабжения в стенке органа, что становится причиной вторичных дистрофических изменений слизистой оболочки, образования язв. Следствием постоянного и длительного раздражения тканей яйцами паразитов, продуктами жизнедеятельности находящихся в них личинок и их распада могут быть также гиперплазия и метаплазия эпителия слизистой. В мочевом пузыре в 85% случаев основным местом поражений, связанных с отложением яиц S. haematobium, является подслизистый слой; мышечный слой поражается реже. В мочеточниках, наоборот, глубоко расположенные слои поражаются чаще. Поскольку возбудитель кишечного шистосомоза S. mansoni локализуется в венах геморроидального сплетения и в нижней брыжеечной вене, и там же скапливаются откладываемые яйца. Основные патологические изменения развиваются преимущественно в дистальных отделах толстой кишки. S. jaρonicum, в отличие от других видов, откладывает не одиночные яйца, а группы, и они быстрее подвергаются кальцификации. При всех формах шистосомозов яйца заносятся и в другие органы, прежде всего в печень и легкие. Наиболее тяжелые поражения печени, приводящие к циррозу, развиваются при японском и кишечном шистосомозе (при инвазии S. mansoni - трубчато-индуративный фиброз Симмерса). Попадание яиц в легкие ведет к развитию обструктивно-деструктивного артериита, артериовенозных анастомозов - в результате развивается гипертензия малого круга кровообращения, которая становится причиной формирования «легочного сердца». Возможен занос яиц шистосом (чаще при инвазии S. jaρonicum) в спинной и головной мозг. Тяжесть клинических проявлений болезни во многом зависит от интенсивности инвазии, т.е. в конечном счете от количества откладываемых самками паразитов яиц и их скопления в пораженных тканях. В то же время размеры гранулем вокруг яиц, выраженность фиброза в тканях органов зависят от особенностей иммунного ответа хозяина, в частности от уровня продукции антител, образования иммунных комплексов, активности Т-лимфоцитов- супрессоров, макрофагов. Определенное значение имеют генетические факторы, которые, например, оказывают влияние на развитие трубчато-индуративного фиброза в печени. Зрелые шистосомы устойчивы к воздействию факторов иммунитета. Немаловажную роль в этом играет феномен «антигенной мимикрии», который характерен для этих паразитов. Шистосомозы могут быть факторами канцерогенеза, о чем свидетельствует то, что в очагах этого гельминтоза относительно часто встречаются опухоли мочепо-
ловой системы и толстой кишки. Опухолевый рост при шистосомозах объясняют развитием фиброза в органах, метаплазией эпителия, иммуносупрессией, а также синергизмом действия шистосом, экзо- и эндогенных канцерогенов.
КЛИНИЧЕСКАЯ КАРТИНА Мочеполовой шистосомоз
Возбудитель - Schistosoma haematobium. Самец имеет размеры 12-14×1 мм, самка - 1820×0,25 мм. Яйца удлиненные, овальные, с шипом на одном полюсе. Размер яиц - 120- 160×40-60 мкм. Самка откладывает яйца в мелких сосудах мочевого пузыря и половых органов.
В клиническом течении выделяют три стадии: острую, хроническую и стадию исхода.
Проявления, связанные с внедрением церкариев, в виде аллергического дерматита у неиммунных лиц регистрируют редко. Через 3-12 нед скрытого периода может развиться острый шистосомоз. Появляются головные боли, слабость, распространенная болезненность в спине и конечностях, отсутствие аппетита, повышается температура тела, особенно вечером, нередко с ознобом и сильным потом, наблюдают уртикарную сыпь (непостоянно); характерна гиперэозинофилия (до 50% и выше). Печень и селезенка часто увеличены. Выявляют нарушения со стороны сердечно-сосудистой системы и органов дыхания. Наиболее ранний симптом хронического мочеполового шистосомоза - гематурия, которая чаще бывает терминальной (в конце мочеиспускания в моче появляются капли крови). Отмечают боли в надлобковой области и промежности. Эти симптомы обусловлены реакцией тканей мочевого пузыря и половых органов на внедрение яиц шистосом. В более поздних стадиях может присоединиться цистит, вызванный вторичной инфекцией. При цистоскопии на слизистой оболочке мочевого пузыря обнаруживают бугорки (гистологически - конгломерат специфических гранулем) - беловато-желтые образования размером с булавочную головку, а также инфильтраты, папилломатозные разрастания, эрозии, язвы, «песчаные пятна» - просвечивающие через истонченную слизистую оболочку скопления обызвествленных яиц шистосом. Стеноз мочеточников и фиброз шейки мочевого пузыря создает условия для застоя мочи, образования конкрементов, впоследствии - гидронефроза и пиелонефрита. Отмечают также поражения половых органов: у мужчин - фиброз семенных канатиков, орхит, простатит, у женщин - папилломы и изъязвления слизистых оболочек влагалища и шейки матки. В позднем периоде возможно образование свищей мочевого пузыря, новообразований мочеполовой системы. Поражение легких и их сосудов ведет к гипертензии в малом круге кровообращения: у больных возникают одышка, ощущение сердцебиения, признаки гипертрофии правого желудочка сердца.
Кишечный шистосомоз
Возбудитель - S. mansoni. Самец имеет размеры 10-12×1,2 мм, самка - 12-16×0,17 мм. Яйца (130-180×60-80 мкм) несколько удлиненные, на боковой поверхности оболочки, ближе к одному полюсу, расположен крупный, загнутый к полюсу шип.
Вскоре после заражения возможно развитие дерматита, вслед за которым могут появиться лихорадка, слабость, головная боль. Продолжительность этих проявлений от 1 до 7-10 дней. Острый кишечный шистосомоз характеризуется лихорадкой (ремиттирующей, интермиттирующей, неправильной), ухудшением аппетита, тошнотой, рвотой, частым жидким стулом, иногда с обезвоживанием организма; возможны примесь крови в испражнениях, боли в животе, в отдельных случаях напоминающие картину «острого живота», кашель с мокротой, часто тахикардия, артериальная
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
гипотензия. Отмечают слабость, адинамию, реже - возбуждение. В крови - гиперэозинофилия, лейкоцитоз. Иногда развивается гепатит. Клинические проявления острого кишечного шистосомоза наблюдают в течение первых 3 мес после заражения.
В хроническом периоде болезни основные симптомы связаны с поражением толстой кишки, особенно ее дистального отдела. Возникает дисфункция кишечника в виде жидкого стула, чередования диареи и запора или хронического запора. Отмечают боли ноющего характера по ходу толстой кишки. При обострениях развивается дизентериеподобный синдром: стул учащен, слизисто-кровянистый, схваткообразные боли в животе, тенезмы. Лихорадка, как правило, отсутствует. Стихающее обострение сменяется запором, часто образуются трещины заднего прохода, геморрой. При колоноскопии преимущественно в дистальном отделе толстой кишки обнаруживают гиперемию, отечность слизистой оболочки, множественные точечные геморрагии; иногда - полипоз кишечника, инфильтраты в стенке кишки, напоминающие опухоль.
При шистосомозном поражении печени (гепатоспленомегалическая форма) исходом процесса становятся перипортальный фиброз и цирроз печени. Независимо от кишечных симптомов больные отмечают появление «опухоли» в верхней половине живота. Боли незначительные, беспокоит чувство тяжести, дискомфорта.
Печень увеличенная, плотная, поверхность ее бугристая. Биохимические показатели не претерпевают существенных изменений, пока не появятся признаки декомпенсации функции печени. С развитием портальной гипертензии расширяются вены пищевода и желудка, вследствие их разрыва могут возникать кровотечения. Декомпенсация портального кровообращения проявляется асцитом, увеличением селезенки.
При инвазии S. mansoni наблюдают гломерулонефрит, который обусловлен образованием и отложением иммунных комплексов.
Поражение легких, если в них не нарушено кровообращение, не дает заметных клинических проявлений. Если давление в легочной артерии превышает 60 мм рт.ст., то возникают типичные признаки хронического «легочного сердца»: одышка, чувство сердцебиения, повышенная утомляемость, кашель, цианоз губ, надчревная пульсация, акцент и раздвоение II тона над легочной артерией.
Шистосомоз кишечный интеркалатный вызывается паразитированием S. intercalatum в венах кишечника, брыжейки, системы воротной вены. Болезнь встречается в ограниченных очагах Африки, патогенетически и клинически аналогична кишечному шистосомозу, вызванному S. mansoni. Течение болезни доброкачественное, случаи портального фиброза не зарегистрированы.
Японский шистосомоз
Возбудитель - S. jaρonicum. Самец имеет размеры 9,5-17,8×0,55-0,97 мм, самка - 15-20×0,31- 0,36 мм. Яйца (70-100×50-65 мкм) округлой формы, на боковой стороне ближе к одному полюсу расположен небольшой шип.
Острый период болезни, известный как болезнь Катаямы, при японском шисто-сомозе отмечают значительно чаще, чем при инвазии S. mansoni и S. haematobium. Он может протекать в разных формах - от легких, бессимптомных до молниеносных, с внезапным началом, тяжелым течением и летальным исходом.
При хроническом японском шистосомозе преимущественно поражаются кишечник, печень и брыжейка. Работы последних лет показывают, что даже среди наиболее поражаемого возраста (дети 10-14 лет) желудочно-кишечные расстройства наблюдают только у 44% больных. Беспокоят диарея, запор или их чередование; в стуле возможны слизь, кровь. Беспокоят боли в животе, метеоризм. Иногда развивается аппендицит. Занос яиц в
портальную систему приводит к тому, что через 1-2 года после инвазии формируется перипортальный фиброз, в последующем - цирроз печени, все проявления портальной гипертензии и спленомегалия, причем
селезенка может увеличиваться до больших размеров и становиться очень плотной.
Тяжелое и частое осложнение японского шистосомоза - кровотечение из расширенных вен пищевода. Поражения легких имеют такую же природу, как и при других формах шистосомозов, но при инвазии S. japonicum развиваются реже, чем при кишечном и мочеполовом шистосомозе.
Поражение ЦНС может развиться у 2-4% инвазированных. Неврологические симптомы появляются уже через 6 нед после заражения, т.е. почти сразу после начала откладывания яиц паразитами; в большинстве случаев эти симптомы становятся заметными в течение первого года болезни. Наиболее частый симптом - джексоновская эпилепсия. Развиваются также признаки энцефалита, менингоэнцефалита, гемиплегии, параличи. В запущенных случаях кровотечения из расширенных вен пищевода, нарастающая кахексия и вторичная инфекция приводят к смерти больного.
Шистосомоз, вызываемый S. mekongi, регистрируют в бассейне реки Меконга в Лаосе, Кампучии, Таиланде. Яйца его возбудителя сходны с яйцами S. japonicum, но мельче. Патогенез и клиническая характеристика идентичны таковым японского шистосомоза.
ДИАГНОСТИКА
В остром периоде шистосомозов при проведении диагностики необходимо учитывать эпидемиологический анамнез, наличие признаков острого дерматита после купания в зараженных водоемах. Паразитологические методы исследования мочи фекалий зачастую в начале острого периода неэффективны, яйца шистосом появляются несколько позднее клинических проявлений.
Исследование мочи производят после центрифугирования, при этом следует иметь в виду, что максимальное количество яиц гельминтов выделяется с мочой в период с 10 до 14 ч дня после заражения. Инвазию оценивают как интенсивную при количестве яиц S. haematobium более 50 в 10 мл мочи и более 100 яиц S. mansoni, S. japonicum, S. intercalatum и S. mekongi в 1 г фекалий. Яйца шистосом в фекалиях обнаруживают с помощью различных методов копроовоскопии: исследования нативного, осаждения после
разведения фекалий, приготовление мазков по Като-Кац и др. Анализы необходимо повторять многократно, особенно в случаях хронического течения и развития фиброзных изменений в кишечнике.
В последние годы в эндемичных очагах для диагностики используют ИФА, чувствительность которого при инвазии S. mansoni - до 96%, S. haemotobium - до 92%. Положительный ответ - не ранее чем через 6 нед от заражения. В случаях поражения ЦНС рекомендуют использовать ПЦР-диагностику.
Инструментальные методы
Цистоскопия дает возможность выявить специфичные для мочеполового шистосомоза изменения на слизистой оболочке мочевого пузыря: гранулемы, «песчаные пятна», черные микрогрануляции, инфильтраты. Ценное дополнение цистоскопии - эндобиопсия.
При контрастной урографии наблюдают изменения структуры мочеточников. Обзорная рентгенография позволяет обнаружить изменения в легких, обызвествление стенок мочевого пузыря. Для выявления органных и функциональных нарушений используют также фиброколоноскопию (с эндобиопсией), УЗИ, МРТ, КТ органов брюшной полости и малого таза и др.
Дифференциальная диагностика
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Дифференциальную диагностику в раннем периоде проводят с ОКИ, тифо-паратифозными болезнями, висцеральным лейшманиозом, с сывороточной болез-
нью, а при выраженной эозинофилии - с миграционной фазой других гель-минтозов (стронгилоидоз, филяриозы и др.). Кишечные формы шистосомоза необходимо дифференцировать с амебиазом, шигеллезом, хроническими колитами, циррозом печени вирусной и другой природы; мочеполовой шистосомоз - с различными заболеваниями мочеполовой системы, включая воспалительные заболевания, туберкулез и рак МВП. Однако диагностика становится нетрудной после появления яиц в моче (S. haematobium) и
фекалиях (S. mansoni, S. japonicum, S. mekongi, S. intercalatum).
Показания к консультации других специалистов
Необходимы консультации проктолога при осложненном течении кишечного шистосомоза, уролога - при осложненном течении мочеполового шистосомо-за, гепатолога - при поражении печени, кардиолога - при наличии признаков «легочного сердца».
Пример формулировки диагноза
В65.1 Кишечный шистосомоз, хроническая стадия (яйца S. mansoni). ЛЕЧЕНИЕ
Противопаразитарное лечение проводят в условиях стационара. Режим полупостельный, специальной диеты не требуется. Основное средство лечения больных шистосомозом - празиквантел, высокоэффективный при всех формах гельминтоза. Препарат назначают в дозе от 40 до 75 мг/кг (более высокие дозы применяют при инвазии S. japonicum, S. mekongi) в 2-3 приема после еды с интервалом 4-6 ч в течение 1 сут. Побочные реакции регистрируются довольно часто, но они обычно кратковременные и выражены слабо:
сонливость, головокружение, головная боль, слабость, боли в животе, иногда высыпания на коже.
После завершения специфического лечения через 3-4 нед проводят контрольные исследования мочи или кала на наличие яиц шистосом; исследования повторяют троекратно с интервалом 2 нед. При неэффективности проведенного специфического лечения назначают повторно празиквантел.
Диспансеризация
Наблюдение за переболевшими проводят в течение 6 мес, а при наличии осложнений болезни - до 2-3 лет.
Прогноз
Прогноз в остром периоде наиболее серьезный при японском шистосомозе, в хроническом периоде - в случаях тяжелых поражений печени при всех формах гельминтоза и мочевыделительной системы при мочеполовом шистосомозе.
ЦЕРКАРИАЛЬНЫЙ ДЕРМАТИТ
Церкариальный дерматит (шистосоматидный дерматид, церкариоз, зуд купальщиков) - заболевание, вызываемое личинками трематод семейства Schistoso-matidae, облигатными хозяевами которых являются водоплавающие птицы. Клинические проявления характеризуются развитием локального дерматита в местах внедрения личинок.
КОД ПО МКБ-10
B65.3 Церкариальный дерматит. Этиология
Известно около 20 видов гельминтов семейства Schistosomatidae, паразитирующих во взрослом состоянии в кровеносной системе водоплавающих птиц (уток, чаек и др.) и некоторых млекопитающих, личинки (церкарии) которых способны проникать в кожу человека. У человека чаще регистрируется инвазия личинками
трихобильгарций - Trichobiharzia ocellata и T. stagnicolae. Промежуточными хозяевами этих гельминтов служат пресноводные моллюски родов Limnea и подобные, в организме которых происходит размножение и развитие личинок до инвазионной стадии - церкария, с последующим выходом их в воду. Человек является случайным неспецифическим хозяином этих видов гельминтов, и личинки, проникшие через кожные покровы человека, в дальнейшем не развиваются, а остаются в коже и погибают.
Эпидемиология
Заражение человека происходит при контакте с водой в пресных водоемах, однако и личинки шистосом морских водоплавающих птиц также могут вызывать заболевания людей после купания в море. Церкариозы широко распространены во всем мире, в том числе и в России. Загрязнение и зарастание внутренних городских водоемов создают благоприятные условия для развития моллюсков и увеличения численности городских водоплавающих птиц, в связи с чем случаи церкариозов стали отмечаться не только в сельской местности, но и в городах.
Меры профилактики
Предупреждение контакта с водой, где имеются водоплавающие птицы и биотопы моллюсков. При длительном пребывании в воде (рыбная ловля и т.п.) необходимо использовать защитную одежду (резиновые сапоги и др.) для предотвращения проникновения церкарий. Рекомендуется проводить регулярную очистку городских водоемов и мест для купания от водной растительности.
Патогенез и клиническая картина
Церкарии, активно внедряясь в кожные покровы, вызывают механическое повреждение тканей и токсико-аллергические реакции, которые проявляются в большей степени в случаях повторного заражения. После купания или контакта с водой, зараженной личинками шистосоматид, на коже (чаще на нижних конечностях) через 20-30 мин появляются зудящие эритематозно-папулезные и урти-карные высыпания. При повторном заражении и интенсивной инвазии возможно общее недомогание, повышение температуры тела, появление местных отеков и волдырей. Обычно указанные симптомы отмечаются в течение 1-2 дней, но могут держаться и 7-10 дней. Заболевание, как правило, заканчивается самопроизвольным выздоровлением.
Диагностика
Диагностика основана на характерной клинической картине и данных эпидемиологического анамнеза.
Лечение
Проводится симптоматическая терапия с включением десенсибилизирующих препаратов и средств местной терапии.
Прогноз Прогноз благоприятный. Заболевание заканчивается спонтанным выздоровлением.
23.2. ЦЕСТОДОЗЫ 23.2.1. Дифиллоботриозы
Дифиллоботриозы (лат. diρhyllobothriosis; англ. diphyllobothriasis, fish tapeworm infection) - кишечные гельминтозы, вызываемые лентецами. Характеризуются хроническим течением с преимущественным нарушением деятельности ЖКТ и развитием мегалобластной анемии.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
КОД ПО МКБ-10 В70.0 Дифиллоботриоз. ЭТИОЛОГИЯ
Возбудители дифиллоботриозов человека - лентец широкий - Diρhyllobothrium latum, и ряд так называемых малых лентецов (более 10 видов дифиллоботриид). D. latum относят к
типу Plathelminthes классу Cestoda семейству Diρhyllobothriidae. Лентец широкий достигает в длину 10 м и более, на сколексе имеет две щелевид-ные присоски, с помощью которых он прикрепляется к стенке тонкой кишки человека. Тело гельминта состоит из 3-4 тыс. члеников, поперечный размер которых больше продольного. В зрелых гермафродитных члениках формируются яйца овальной формы, покрытые желтовато-коричневой оболочкой с крышечкой на одном конце.
Развитие D. latum происходит со сменой трех хозяев. Окончательные хозяева - человек, реже - животные, питающиеся рыбой (кошка, собака, медведь, лисица и др.). В отличие от цепней зрелые членики лентеца не отрываются от стробилы. Яйца выделяются с фекалиями и сохраняют жизнеспособность в течение 3-30 дней, но продолжают развитие только при попадании в воду. В воде через 2-3 нед из яйца выходит корацидий, которого заглатывает промежуточный хозяин. В его теле происходит развитие второй личиночной стадии - процеркоида. Рачков, содержащих инвазионные личинки, проглатывает дополнительный хозяин - хищная (щука, окунь, ерш, налим) или проходная лососевая рыба (кета, горбуша), в кишечнике которого рачки перевариваются, а процеркоиды мигрируют в мышцы, икру, печень и другие органы, где превращаются в плероцеркоиды (инвазионная для человека стадия).
ЭПИДЕМИОЛОГИЯ
Основным источником заражения окружающей среды служит человек, определенную роль могут играть домашние и дикие животные, питающиеся рыбой.
Механизм заражения человека оральный. Факторы передачи - зараженная сырая, недостаточно просоленная или плохо термически обработанная рыба, а также икра. Заболеваемость дифиллоботриозом имеет очаговый характер. Чаще поражается взрослое население, особенно занятое ловлей и переработкой рыбы. Дифиллоботриозы распространены преимущественно в северном полушарии: в странах севера Европы, США, Канаде. В России основные очаги гельминтоза расположены в бассейне рек СевероЗападного региона, Волги, Енисея, Лены, на Сахалине. В РФ в 2015 г. зарегистрировано 5313 случаев дифиллоботриоза.
МЕРЫ ПРОФИЛАКТИКИ
Чтобы предотвратить заражение, употреблять в пищу рыбу следует после тщательной термической обработки или длительного посола (последнее относится и к употреблению икры). Необходимо охранять водоемы от загрязнения фекалиями человека и животных, проводить санитарно-просветительную работу среди населения очагов.
ПАТОГЕНЕЗ
Лентецы, прикрепляясь к слизистой оболочке тонкой кишки, ущемляют ее ботриями, изъязвляя, некротизируя и атрофируя травмируемые участки. При множественной инвазии гельминты могут вызывать непроходимость кишечника. Эозинофилия и катаральные явления в слизистой оболочке в раннем периоде болезни обусловлены сенсибилизацией организма к антигенам гельминта. Эндогенный гипо- и авитаминоз В12 и фолиевой кислоты лежит в основе патогенеза дифиллоботриозной мегалобластной анемии. Гельминт выделяет специфический белковый компонент (рилизинг-фактор), нарушающий связь витамина В12 и гастромукопротеина. В результате длительного паразитирования возбудителя (возможно до
20 лет), даже одной особи гельминта, анемия приобретает черты пернициозной и сопровождается поражением периферических нервов и спинного мозга. КЛИНИЧЕСКАЯ КАРТИНА
Дифиллоботриоз нередко протекает бессимптомно или со слабовыраженными ощущениями дискомфорта в животе. Однако при любом клиническом течении наблюдают отхождение крупных фрагментов гельминта с каловыми массами. При манифестном течении инвазии возникают боли в животе различной локализации, периодически приобретающие схваткообразный характер, тошнота, гиперсаливация. Аппетит иногда повышен, но отмечаются похудание и снижение работоспособности. При развитии анемии более выражены повышенная утомляемость, головокружение, сердцебиение. Раннее проявление анемии - глоссит, сопровождающийся жжением языка, атрофией его сосочков. В дальнейшем могут появиться боли при приеме пищи вследствие распространения воспалительнодистрофических изменений на десны, слизистую оболочку щек, нёба, глотки и пищевода. В тяжелых случаях наблюдается увеличение печени и селезенки. Неврологические нарушения при дифиллоботриозе: парестезии, нарушение чувства вибрации, онемение, атаксия - возникают чаще, чем при истинной пернициозной анемии, могут не сопровождаться признаками анемии. Позже нарушается проведение по боковым столбам спинного мозга, появляются спастичность, гиперрефлексия, больные становятся раздражительными, может развиться депрессия.
Осложнения
Основным осложнением дифиллоботриоза является гиперхромная (В12-де-фицитная) анемия, иногда возможно развитие кишечной непроходимости.
ДИАГНОСТИКА
Дифиллоботриоз диагностируют, основываясь на клинико-эпидемиологических данных (употребление рыбы, сочетание диспепсического синдрома с признаками анемии), выявлении яиц гельминтов при копроовоскопическом исследовании или в результате исследования выделенных при дефекации фрагментов стробилы гельминта [3].
В мазках периферической крови обнаруживают снижение уровня гемоглобина, гиперхомию эритроцитов, анизо- и пойкилоцитоз, базофильную зернистость эритроцитов (в них нередко видны тельца Жолли), ретикулоцитопению, тромбоци-топению, нейтропению.
Дифиллоботриозная В12-дефицитная анемия развивается примерно у 2% инвазированных D. latum, примерно у 40% больных понижено содержание витамина в сыворотке крови. Чаще гематологические изменения регистрируют у лиц пожилого возраста.
Дифференциальная диагностика
Дифференциальную диагностику проводят с другими гельминтозами, сопровождающимися анемией (анкилостомидоз, трихоцефалез, шистосомозы), гипер-хромными и гемолитическими анемиями.
Показания к консультации других специалистов При выраженной анемии показана консультация гематолога. Пример формулировки диагноза
В70.0 Дифиллоботриоз. Гиперхромная анемия средней тяжести. ЛЕЧЕНИЕ Показания к госпитализации
Госпитализация показана при тяжелой анемии.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Медикаментозная терапия Специфическое лечение проводят празиквантелом или никлозамидом.
Празиквантел назначают однократно в дозе 15-20 мг на 1 кг массы тела без специальной подготовки.
Никлозамид 2,0 г принимают на ночь, тщательно разжевывая и запивая водой. За 15 мин до приема рекомендуется выпить 1-2 г натрия гидрокарбоната (питьевая сода).
Контрольные анализы кала на наличие яиц дифиллоботрий проводят через 1 и 3 мес после антигельминтной терапии. В случаях возобновления отхождения фрагментов лентеца или обнаружения яиц гельминта в фекалиях больному проводят повторный курс противопаразитарного лечения.
При выраженной анемии и уровне цианокобаламина в сыворотке менее 100 пг/мл до дегельминтизации показано лечение данным препаратом в дозе 200-400 мкг/кг в течение 2-4 нед.
Диспансеризация
Диспансеризация не регламентирована. Контрольные анализы кала на наличие яиц широкого лентеца проводят через 1 и 3 мес после антигельминтной терапии. Если возобновляется отхождение фрагментов лентеца или в фекалиях обнаруживают яйца гельминта, проводят повторный курс противопаразитарного лечения.
Прогноз Прогноз при неосложненном течении гельминтоза благоприятный.
23.2.2. Тениаринхоз
Тениаринхоз (лат. taeniarhynchosis) - гельминтоз из группы цестодозов,
вызываемый Taeniarhynchus saginatus (бычьим цепнем) или Taeniarhynchus confusum и
характеризующийся развитием диспепсических явлений. КОД ПО МКБ-10
В68.1 Инвазия, вызванная Taeniarhynchus saginatus. ЭТИОЛОГИЯ
Возбудитель - Taeniarhynchus saginatus (цепень невооруженный, бычий цепень), относится к типу Plathelminthes классу Cestoda семейству Taeniidae. Тело его плоское, лентовидное и состоит из головки с четырьмя мощными присосками и множества (1000 и более) члеников (проглоттид). Длина зрелого членика 20 мм, диаметр 5 мм. Гельминт достигает в длину 4-12 м. Зрелые гермафродитные проглоттиды содержат более 140 тыс. яиц. Яйца почти шаровидной формы, внутри находится зародыш (онкосфера). Бычий цепень относится к биогельминтам, при развитии сменяет двух хозяев. Человек - окончательный хозяин, промежуточные - крупный рогатый скот, буйвол, як, зебу. В США, Японии, Восточной Африке регистрируется тениаринхоз, вызванный Taeniarhynchus confusum, также паразитирующим в тонкой кишке человека, промежуточным хозяином которого предположительно является крупный рогатый скот.
Ворганизме человека взрослые гельминты паразитируют в тонкой кишке в течение длительного времени (до 20 лет). Зрелые членики, отрываясь от стробилы, попадают в окружающую среду с фекалиями, пассивно или активно выползают из анального отверстия.
Ворганизме промежуточного хозяина личинки развиваются в мышечной и соединительной ткани, где превращаются в ларвоцисты овальной формы - цистицерки (финны). Личинки, попавшие в кишечник человека, достигают стадии взрослого гельминта через 2,5-3 мес.
ЭПИДЕМИОЛОГИЯ
Источником контаминации окружающей среды онкосферами бычьего цепня служит человек - единственный дефинитивный хозяин. Наибольшую опасность представляют лица, ухаживающие за животными (пастухи, доярки и т.д.). Заражение
животных чаще всего происходит на пастбищах. Яйца гельминта с кормом попадают в кишечник промежуточного хозяина. Через 16 нед после заражения животного его мясо становится заразным для человека. Цистицерки в мышцах животных сохраняют жизнеспособность в течение 1-3 лет. Механизм заражения человека пероральный - при употреблении в пищу сырого или недостаточно проваренного финнозного мяса животных, промежуточных хозяев гельминта. Наиболее поражено мясо молодых животных. Гельминтоз распространен в районах, где принято пастбищное и отгонное содержание скота. Тениаринхоз регистрируют во многих регионах нашей страны. Эндемичные районы - Дагестан, Республика Саха (Якутия), Бурятия, Алтайский край, Иркутская, Красноярская и Новосибирская области.
МЕРЫ ПРОФИЛАКТИКИ
Профилактику осуществляют с помощью комплекса медицинских и ветеринарных мероприятий, направленных на выявление источников инвазии при массовом обследовании населения. Проводят мероприятия по защите окружающей среды (пастбищ) от фекального загрязнения. Личная профилактика заключается в исключении из пищевого рациона сырого и недостаточно термически обработанного мяса крупного рогатого скота.
ПАТОГЕНЕЗ
Бычий цепень в кишечнике человека, как правило, паразитирует в единственном числе (старое название гельминта - солитер). Паразит, достигающий размером нескольких метров, прикрепляясь присосками к слизистой оболочке тонкой кишки, наносит повреждение, раздражает рецепторы кишечника, оказывая влияние на моторную и секреторную функции кишечника. Дополнительное механическое воздействие могут оказывать отделившиеся проглоттиды, которые провоцируют болевой синдром, особенно при прохождении через илеоцекальный клапан. Описаны случаи проникновения паразитов в червеобразный отросток, общий желчный и панкреатический проток, что приводило к обструкции и воспалительным изменениям. Возможно развитие тениаринхозной непроходимости кишечника. Интенсивное потребление паразитом пищевых веществ в процессе роста и развития создает дефицит в пищевом рационе больного. Характерно значительное снижение уровней витаминов С, группы В, А, Е в сыворотке крови. Определенное значение в патогенезе тениаринхоза имеет блокирующее действие веществ, выделяемых гельминтом, на ферментную систему кишечника человека, а также сенсибилизация продуктами метаболизма бычьего цепня.
КЛИНИЧЕСКАЯ КАРТИНА
Нередко инвазия бычьим цепнем протекает бессимптомно и проявляется только выделением члеников из заднего прохода с фекалиями и/или вне акта дефекации в результате их активного выползания из ануса. На 2-3-й неделе после заражения появляются изжога, тошнота, чувство тяжести в эпигастрии, на 8-й неделе нарушается стул. При длительной инвазии больные отмечают общую слабость, боли в животе, иногда наблюдаются снижение массы тела, диарея, повышение аппетита, возникают астеноневротические проявления: головокружение, головная боль, нарушение сна, обморочные состояния, эпилептиформные судороги. В отдельных случаях регистрируются эозинофилия в крови и анемия [1, 2, 5].
Осложнения
Осложнения: механическая кишечная непроходимость, аппендицит, холангит, панкреатит - возникают очень редко.
Прогноз
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Прогноз обычно благоприятный. ДИАГНОСТИКА
Клиническая картина малоспецифична. Подозрение на инвазию может вызывать сочетание диспепсического синдрома и потери массы тела с повышением аппетита. Проводят исследование фекалий, чтобы выявить фрагменты стробилы (проглоттид) и яйца гельминтов методами обогащения [7].
Дифференциальную диагностику проводят с другими кишечными цестодоза-ми - тениозом и дифиллоботриозом, при которых, в отличие от тениаринхоза, не наблюдается самостоятельного активного отхождения члеников гельминта из анального отверстия.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При кишечной непроходимости и острых воспалительных заболеваниях органов брюшной полости показана консультация хирурга.
ЛЕЧЕНИЕ
Препарат выбора - празиквантел, назначаемый однократно в дозе 25 мг/кг. Для дегельминтизации можно использовать также никлозамид: 2 г принимают на ночь, тщательно разжевывая и запивая водой. За 15 мин до приема рекомендуют выпить 1-2 г натрия гидрокарбоната (питьевой соды). Препарат вызывает гибель сколекса и незрелых члеников. Если выделение члеников возобновляется, проводят повторный курс лечения теми же антигельминтными препаратами. Если отхождение члеников прекращается в течение 2-3 мес после противопаразитарно-го лечения, это свидетельствует об эффективном лечении. В таких случаях проводят контрольное исследование фекалий на наличие онкосфер гельминта. Примерные сроки нетрудоспособности
Трудоспособность во время заболевания не нарушается. Диспансеризация
Диспансеризация не регламентирована. Через 2-3 мес после лечения проводят контрольное гельминтологическое исследование. При выявлении в фекалиях онкосфер повторяют курс лечения.
23.2.3. Тениоз
Тениоз (taeniosis, taeniasis) - биогельминтоз, вызываемый паразитированием в кишечнике человека свиного цепня и проявляющийся нарушением функций ЖКТ.
КОД ПО МКБ-10
B68.0 Инвазия, вызванная Taenia solium. ЭТИОЛОГИЯ
Возбудитель - Taenia solium - цепень вооруженный (свиной цепень), тип Pla-
thelminthes класс Cestoda семейство Taeniidae. Гельминт имеет плоское лентовидное тело. На шаровидном сколексе расположены четыре присоски и хоботок с двумя рядами чередующихся коротких и длинных хитиновых крючьев (всего 22-23).
Длина взрослого гельминта достигает 3-4 м, количество члеников - 800-1000, их размеры: длина 12-15 мм, диаметр 6-7 мм. В зрелом членике матка имеет 7-12 пар боковых ответвлений. Членики не обладают активной подвижностью. Каждый из них содержит 30-50 тыс. яиц. Выводное отверстие у матки отсутствует. Онкосферы свиного и бычьего цепня морфологически неотличимы.
Окончательный хозяин - человек, в кишечнике которого паразитирует половозрелая форма гельминта. В организме промежуточного хозяина - свиньи (факультативными хозяевами могут быть также дикие свиньи, собаки, кошки, иногда человек) зародыш освобождается из яйца, проникает в кишечную стенку и с кровотоком разносится по всему организму. Через 60-70 дней зародыш превращается в цистицерк (Cysticercus cellulosae) - финны, достигающие в диаметре 5-8 мм, а в паренхиматозных органах - 1,5 см. Цистицерки сохраняют жизнеспособность до 5 лет.
ЭПИДЕМИОЛОГИЯ
Источник инвазии - человек, который, будучи поражен тениозом, вместе с фекалиями выделяет в окружающую среду онкосферы. Это приводит к заражению промежуточных хозяев (свиней) финнозом. Люди заражаются при употреблении в пищу сырого или недостаточно термически обработанного финнозного свиного мяса. Тениоз регистрируют в странах, где развито свиноводство. В РФ в 2015 г. было зарегистрировано всего 55 случаев тениоза, но, возможно, это не отражает реальную ситуацию по пораженности населения данным гельминтозом.
ПРОФИЛАКТИКА
Основные меры профилактики - выявление и лечение больных, санитарное просвещение населения, благоустройство населенных мест, санитарный надзор за содержанием и убоем свиней, ветеринарный контроль мяса.
ПАТОГЕНЕЗ
При неосложненном кишечном тениозе в основе патогенеза лежат те же факторы, что и при тениаринхозе. Однако когда зрелые членики вследствие антиперистальтических сокращений забрасываются из кишечника в желудок, возможна аутоинвазия онкосферами. В этом случае тениоз может осложниться развитием цистицеркоза мозга, скелетных мышц, глаз.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина неосложненного кишечного тениоза близка к таковой при тениаринхозе. При тениозе сравнительно часто регистрируют диспепсические и астеноневротические проявления: нарушение аппетита, тошнота, рвота, боли в
животе, расстройство стула, головные боли, головокружение, нарушение сна, кратковременные обморочные состояния.
Осложнения
Осложнения редки. Возможны кишечная непроходимость, перфорация кишки, аппендицит, холангит, панкреатит, цистицеркоз. Течение доброкачественное. Летальные случаи наблюдают крайне редко, связаны они с осложнениями [1, 2, 5].
ДИАГНОСТИКА
Предположительный диагноз тениоза устанавливают на основании указания больного на отхождение члеников или небольших фрагментов стробилы гельминта при дефекации. Для подтверждения диагноза и дифференциации тениоза от тениаринхоза необходимо провести микроскопическое исследование выделяемых больным члеников.
Дифференциальная диагностика
Дифференциальную диагностику проводят с другими кишечными гельминтоза-ми, прежде всего с тениаринхозом и дифиллоботриозом.
Показания к консультации других специалистов
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
При появлении выраженных длительных болей в животе показана консультация хирурга для исключения абдоминальных осложнений. Для исключения цистицеркоза при нарушении зрения необходима консультация офтальмолога, при появлении неврологической симптоматики - консультация невролога [2].
Пример формулировки диагноза Тениоз, неосложненное течение. ЛЕЧЕНИЕ
Лечение больных тениозом проводят в стационаре никлозамидом (фенасалρ): 2 г принимают на ночь, тщательно разжевывая и запивая водой. За 15 мин до приема рекомендуется выпить 1-2 г натрия гидрокарбоната (питьевая сода). Препарат высокоэффективен, вызывает гибель сколекса и незрелых члеников. В настоящее время часто применяют празиквантел, который назначают однократно в дозе 25 мг/кг больным всех возрастных групп. Оба препарата характеризуются хорошей переносимостью, побочные реакции выражены слабо (иногда возникают тошнота, рвота, боли в животе, понос).
Трудоспособность в неосложненных случаях не нарушается. Дальнейшее ведение
Диспансеризацию не проводят. Через 1-3 мес после лечения необходимо контрольное исследование фекалий на наличие члеников гельминта.
23.2.4. Цистицеркоз
Цистицеркоз (лат. cysticercosis) - хронический биогельминтоз, вызываемый личиночной стадией свиного цепня - цистицерка (финны).
КОДЫ ПО МКБ-10 B69 Цистицеркоз.
B69.0 Цистицеркоз ЦНС.
B69.1 Цистицеркоз глаза.
B69.8 Цистицеркоз других локализаций.
B69.9 Цистицеркоз неуточненный. ЭТИОЛОГИЯ
Возбудитель - Cysticercus cellulosae (личиночная стадия Taenia solium) представляет собой образование в виде пузырька диаметром 5-15 мм, содержащего ввернутый внутрь сколекс [1, 2, 6, 9].
ЭПИДЕМИОЛОГИЯ
Цистицеркоз у человека развивается после заражения онкосферами фекально-оральным путем или в результате аутоинвазии при наличии кишечного тениоза, когда зрелые членики вследствие антиперистальтических сокращений забрасываются из кишечника в желудок. Цистицеркоз, как и кишечный тениоз, регистрируют в странах, где развито свиноводство [1, 2, 5].
ПРОФИЛАКТИКА
Предусматривается комплекс мер по недопущению инвазии животных, их санации, предотвращению загрязнения окружающей среды яйцами гельминтов. Личная профилактика цистицеркоза у человека, с учетом возможности его развития, как следствие кишечного
тениоза, предусматривает, наряду с неукоснительным соблюдением правил личной гигиены, употребление мяса и мясных продуктов только в достаточно хорошо термически обработанном виде [4].
ПАТОГЕНЕЗ
Паразитирование Cysticercus cellulosae чаще наблюдается в подкожной клетчатке, головном и спинном мозге, глазах, мышцах, сердце, печени, легких, брюшине и др. Вокруг гельминта во всех органах и тканях (кроме глаза) образуется реактивная соединительнотканная капсула, развиваются воспалительные и дегенеративные изменения. Значение фактора механического сдавливания паразитами окружающих тканей зависит от локализации цистицерков. Наиболее тяжелое течение характерно для поражения головного мозга и глаза. В мозговой ткани вокруг цистицерка развиваются васкулит, выраженная глиальная реакция, возможны энцефалит, менингит, нарушение ликвородинамики. При локализации личинки в оболочках основания мозга развивается рацемозная (ветвистая) форма цисти-церка, при этом паразит, достигающий в длину более 20 см, может опускаться по ходу спинного мозга. При поражении глаз в процесс нередко вовлекаются оба
глаза. Выраженные токсико-аллергические реакции наблюдаются при отмирании паразита, когда происходит его расплавление; при кальцификации воспалительная реакция отсутствует.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления цистицеркоза весьма разнообразны и определяются его локализацией, интенсивностью инвазии и стадией развития паразита.
Цистицеркоз подкожной клетчатки и мышц часто не имеет каких-либо явных признаков, иногда в тканях пальпируются плотные узелки. Цистицеркоз ЦНС протекает в виде церебрального, спинального поражения или сочетанных поражений полушарий большого мозга, желудочковой системы, основания мозга, поэтому и развивающаяся очаговая неврологическая симптоматика весьма разнообразна и зависит от локализации паразита. Характерна приступообразная головная боль, сопровождающаяся тошнотой, рвотой, приступами эпилепсии. Возможны нарушения психики в виде делириозных, галлюцинаторных и аментивных состояний, имеющих до определенного времени преходящий характер. При локализации цистицерков в желудочках мозга выявляют внутричерепную гипертензию, локализация паразита в IV желудочке может привести к внезапной смерти. Цистицеркоз глаза вначале проявляется нарушениями зрения, снижением его остроты, вплоть до слепоты. Внедрение цистицерка в глазницу вызывает экзофтальм. Локализация его в сердце в области предсердно-желудочкового пучка ведет к нарушению сердечного ритма.
ДИАГНОСТИКА
Примерно у 50% больных цистицеркозом регистрируют подкожную локализацию паразита. Диагноз в этом случае устанавливают на основании рентгенограммы или по результатам биопсии узлов. Цистицеркоз мозга диагностируют на основании анамнестических (в том числе заболевание тениозом), клинических и эпидемиологических данных, положительных результатов серологических исследований (ИФА, РНИФ, иммуноблот), ПЦР-диагностики.
При поражениях мозга в СМЖ возможны 2-3-значный плеоцитоз с преобладанием эозинофилов и лимфоцитов, повышение концентрации белка при нормальном содержании глюкозы и лактата.
Для идентификации поражений мозга используют КТ, МРТ, ангиографию головного мозга. Обнаружение внутриглазного цистицерка возможно при прямой офтальмоскопии и биомикроскопии, когда видны волнообразные движения живого паразита. При гибели возбудителя диагностика затруднена вследствие дезорганизации внутриглазных структур.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Дифференциальная диагностика
Дифференциальную диагностику проводят с опухолями и воспалительными заболеваниями органов, эхинококкозом, церебральным токсоплазмозом.
Показания к консультации других специалистов
К консультации других специалистов (нейрохирург, офтальмолог, хирург) прибегают, чтобы решить вопрос об оперативном лечении.
Пример формулировки диагноза В69 Цистицеркоз головного мозга, эпилептический синдром (МРТ головного мозга, ИФА). Показания к госпитализации
Больных нейроцистицеркозом и глазным цистицеркозом для обследования и лечения госпитализируют в профильные стационары.
ЛЕЧЕНИЕ
Лечение нейроцистицеркоза проводят в условиях неврологического стационара. Для противопаразитарного лечения используют празиквантел в суточной дозе 50 мг/кг массы тела в сутки в 3 приема в течение 14 дней и более или албендазол по 15 мг/кг массы тела в сутки в 2-3 приема в течение 28-30 дней. Одновременно с применением антигельминтных препаратов осуществляют противовоспалительную терапию, назначают глюкокортикоиды. Рекомендуют проводить 3 цикла лечения с интервалом 2-3 нед. При глазном цистицеркозе албендазол и празик-вантел противопоказаны. Больным с цистицеркозом мышц и подкожной клетчатки назначают симптоматическое лечение.
Хирургическое удаление одиночных цистицерков (при наличии технических возможностей) показано при поражении глаз, желудочков головного мозга и спинного мозга [1, 2, 5].
Прогноз Прогноз зависит от топографии и объема поражения тканей и органов.
При цистицеркозе мозга (особенно при многофокусных поражениях различных его отделов) и глаз прогноз неблагоприятный. Больные с такими поражениями нуждаются в длительном (практически пожизненном) наблюдении и лечении.
23.2.5. Эхинококкозы
Эхинококкозы - хронически протекающие биогельминтозы, вызываемые паразитированием у человека личинок цестод рода Echinococcus.
КОДЫ ПО МКБ-10
B67 Эхинококкоз. B67.8 Эхинококкоз печени неуточненный. B67.9 Эхинококкоз других органов и неуточненный.
ГИДАТИДОЗНЫЙ ЭХИНОКОККОЗ
Гидатидозный эхинококкоз (однокамерный эхинококкоз, эхинококкоз цист-ный,
лат. echinococcosis, англ. echinococcus disease) - хронический зоонозный биогельминтоз с фекально-оральным механизмом передачи возбудителя, характеризующийся образованием паразитарных кист в печени, реже в легких и других органах.
КОДЫ ПО МКБ-10
B67.0 Инвазия печени, вызванная Echinococcus granulosus. B67.1 Инвазия легкого, вызванная Echinococcus granulosus. B67.2 Инвазия кости, вызванная Echinococcus granulosus.
B67.3 Инвазия другой локализации и множественный эхинококкоз, вызванный
Echinococcus granulosus. B67.4 Инвазия, вызванная Echinococcus granulosus, неуточненная. Этиология
Возбудитель гидатидозного эхинококкоза Echinococcus granulosus относится к типу Plathelminthes классу Cestoda семейству Taeniidae [1, 2, 7, 9]. Половозрелый E.
granulosus - это ленточный гельминт белого цвета длиной 3-8 мм. Состоит из головки с четырьмя присосками и двойной коронкой крючьев, шейки и 2-6 члеников. Последний членик заполнен маткой, содержащей яйца (онкосферы), которые обладают инвазивной способностью и не нуждаются в дозревании в окружающей среде. Половозрелый гельминт паразитирует в тонкой кишке окончательного хозяина - плотоядных животных (собаки, волки, рыси, кошки и др.). Зрелые членики с фекалиями попадают в окружающую среду. Яйца обладают высокой устойчивостью в окружающей среде, зимой сохраняют жизнеспособность до 6 мес.
Эпидемиология
Источником инвазии E. granulosus для человека чаще всего служат домашние собаки, реже - дикие животные (волки, шакалы и др.). Основным фактором передачи являются руки, загрязненные онкосферами эхинококка, которые в обилии находятся на шерсти инвазированных собак. Заражение человека может происходить также при сборе ягод и трав, питье воды из загрязненных яйцами гельминта открытых водных источников. Заболевание чаще встречается в определенных профессиональных группах: работники скотобоен, пастухи, кожевники, охотники, члены их семей, особенно дети. Существуют различные штаммы эхинококков, адаптированных к разным промежуточным и окончательным хозяевам. На основании молекулярно-генетических исследований полиморфных вариантов маркерных генов E. granulosus выделены различные генотипы (штаммы), обозначенные в порядке от G1 до G10 [3]. Установлено, что наиболее распространенным в синантропных очагах является штамм G1 - «общий, домашних овец», который для человека является высокопатогенным. У людей также зарегистрированы отдельные случаи заражения штаммами G2 - «тасманийских овец», G5 - «крупного рогатого скота», G6 - «верблюдов», G7 - «свиней», G8 - «северных оленей». К некоторым штаммам у человека наблюдается невосприимчивость, в частности к штамму G4 - «лошадей», распространенному в странах Западной Европы и Великобритании. Эхинококкоз гидатидозный встречается на всех континентах. Чаще регистрируется в странах с пастбищным скотоводством, особенно в тех, где традиционно для охраны овец и крупного рогатого скота используются собаки. В странах южного полушария интенсивность поражения особенно высока: в Южной Америке в некоторых очагах пораженность населения достигает 30%. В странах ближнего зарубежья эхинококкоз распространен в регионах с развитым животноводством, главным образом овцеводством: Закавказье, Казахстан и другие страны Центральной Азии, Украина, Молдова. Случаи заболевания людей гидатидозным эхинококкозом зарегистрированы в 73 из 89 субъектов Российской Федерации. В 2015 г. в РФ зарегистрировано 437 случаев эхинококкоза. Наиболее неблагополучными являются Уральский, Дальневосточный и Северо-Кавказский регионы, на которые приходится до 70% всех случаев.
Меры профилактики
Состоят в соблюдении личной гигиены. Особая настороженность необходима при содержании собак в доме и уходе за животными. Проводят плановую дегельминтизацию собак. В местах, неблагополучных по эхинококкозу, необходима плановая диспансеризация групп риска (СанПиН 3.2.3215-14, п. VIII) [5].
Патогенез
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Из-за гематогенного пути распространения онкосферы эхинококка могут быть занесены в любой орган, но чаще всего эхинококковые кисты локализуются в печени (30-75%) и легких (15-20%), значительно реже в ЦНС (2-3%), селезенке, поджелудочной железе, сердце, в трубчатых костях и почках (до 1%). Превращение онкосферы в ларвоцисту у инвазированного человека длится около 5 мес; за это время она достигает в диаметре 5-20 мм. Патологическое воздействие эхинококка обусловлено механическим и сенсибилизирующим факторами. У большинства пациентов поражается единственный орган одной солитарной кистой, но может развиваться и множественный эхинококкоз. Паразит имеет ряд приспособительных механизмов, обеспечивающих его длительное развитие в организме промежуточного хозяина. К ним относят потерю ларвоцистой части рецепторов в период формирования гиалиновой оболочки, выработку иммуносупрессоров, белковую мимикрию за счет включения белков хозяина в свою оболочку. Размеры кист варьируют от 1 до 20 см (и более) в диаметре. Эхинококковая киста растет медленно в течение ряда лет, отодвигая ткани пораженных органов, где постепенно развиваются дистрофические изменения, склероз стромы и атрофия паренхимы. У 5-15% больных отмечают сдавление желчных протоков обызвествленными внутрипеченочными кистами. В легочной ткани вокруг погибшего паразита формируются ателектазы, очаги пневмосклероза, бронхоэктазы. Кисты, поражающие кости, постепенно разрушают структуру костной ткани, что приводит к патологическим переломам. При длительном течении болезни может происходить нагноение и разрыв эхинококковых кист. При вскрытии кисты (самопроизвольно или в результате повреждения ее стенок) развиваются сильные аллергические реакции на антигены, входящие в состав жидкости; высвобождение многочисленных ско-лексов ведет к диссеминации возбудителя.
Клиническая картина
Различают следующие стадии гидатидозного эхинококкоза: доклиническую, неосложненную и стадию осложнений.
При наиболее частом поражении - эхинококкозе печени первые признаки болезни обычно появляются через несколько лет и даже десятилетий после заражения. Нередко эхинококкоз диагностируют случайно (при плановой флюорографии, УЗИ) или при целенаправленном обследовании населения в очагах. Гидатидозный эхинококкоз чаще выявляют у лиц среднего возраста. В клинически манифестной стадии в неосложненных случаях у больных эхинококкозом печени отмечают снижение работоспособности, общую слабость, диспепсические расстройства, головные боли, иногда аллергические проявления: кожные высыпания, зуд, эозинофилию в крови. Печень при пальпации увеличенная, плотная (при локализации пузыря в глубине паренхимы) или мягкая, эластичная (при поверхностном расположении кисты), при кальцификации - деревянисто-плотная.
Симптоматика эхинококкоза легких определяется локализацией кисты и темпами ее роста. Даже небольшая киста, расположенная вблизи плевры, рано проявляет себя болевым синдромом, а при локализации у бронхиального ствола - упорным сухим кашлем, кровохарканьем, болями в груди, одышкой. Возможны деформация грудной клетки, сглаженность межреберных промежутков, отставание при дыхании пораженной стороны, укорочение перкуторного звука и осла-
бление дыхания над кистой. При небольших единичных кистах симптомы могут отсутствовать, но течение болезни может резко измениться при вскрытии кисты. При прорыве в бронх появляются сильный кашель, удушье, цианоз, возможны тяжелые аллергические реакции и аспирационная пневмония. Прорыв в плевральную полость приводит к развитию острого экссудативного плеврита, в тяжелых случаях развивается анафилактический шок, а перфорация в полость перикарда бывает причиной внезапной смерти.
Осложнения
Наиболее частые осложнения гидатидозного эхинококкоза печени - нагноение эхинококковой кисты (присоединение вторичной бактериальной флоры при гибели эхинококка), прорыв или сдавление кистой желчных путей с возникновением обтурационной желтухи. Возможен холангит, в последующем развитие билиарного цирроза, амилоидоза. Кисты больших размеров могут сдавливать крупные сосуды портальной системы, что приводит к развитию портальной гипертензии. Грозное осложнение - разрыв кисты, который может быть спровоцирован ударом, поднятием тяжестей, грубой пальпацией. Разрыв кисты сопровождается резкой болью и проявлениями аллергической реакции различной степени выраженности, вплоть до развития анафилактического шока. В результате разрыва жизнеспособной кисты печени происходит диссеминация возбудителя в брюшную полость и развивается вторичный множественный эхинококкоз других органов. Клинические проявления вторичного множественного эхинококкоза, обусловленного диссе-минации возбудителя после разрыва кист, появляются через 1-2 года и больше. При локализации паразита в головном мозге, глазнице, спинномозговом канале или миокарде уже маленькие кисты могут давать выраженную симптоматику, схожую с объемным поражением. Быстрое, «галопирующее» течение эхинококкоза с ускоренным ростом пузырей отмечают у лиц с иммунодефицитом, тяжелыми хроническими заболеваниями, у беременных; подобное течение нередко развивается у инвазированных, не являющихся коренными жителями очагов инвазии. Эхинококкоз легких может осложняться повторными легочными кровотечениями, острой сердечно-сосудистой недостаточностью.
Диагностика
Предполагать вероятный диагноз эхинококкоза позволяют клинические проявления (обнаружение опухолевидного, медленно растущего образования в печени, легких или других органах) и эпидемиологические данные. Рентгенологические методы обследования, УЗИ, КТ
иМРТ позволяют оценить локализацию, размеры кисты, состояние окружающих органов и тканей. В легких на рентгенограмме обнаруживают округлые, часто неправильной формы образования равномерной плотности; они не обызвествляются, в то время как примерно в 50% случаев вокруг кист в печени обнаруживают кольцо обызвествления. Небольшие кисты выявляются с помощью КТ. УЗИ - один из наиболее эффективных методов диагностики при эхиноккокозе печени и органов брюшной полости. УЗИ как скрининг-метод позволяет определить наличие объемного жидкостного образования в печени и гипертензию во внутри-
ивнепеченочных желчных протоках. КТ и МРТ обладают более высокой разрешающей способностью. КТ в осложненных случаях используется для уточнения локализации кисты и ее соотношения с соседними анатомическими образованиями. Алгоритм диагностики механической желтухи эхинококкового генеза в обязательном порядке должен включать УЗИ брюшной полости, КТ и ретроградную холангиопанкреатографию (РХПГ) с декомпрессией желчных путей. В некоторых случаях показана диагностическая лапароскопия (осторожно: пунктировать кисту нельзя из-за опасности диссеминации!).
Сероиммунологические методы (ИФА, РНГА, латекс-агглютинации) дают положительные результаты в 90% случаев и более при поражении печени, при эхинококкозе легких эффективность ниже - 60%. Титры антител бывают невысокими или реакции дают отрицательные результаты в ранний период инвазии, при невскрывшихся или медикаментозно не леченных кистах. Кроме того, при использовании ИФА примерно у 10% исследуемых регистрируются ложнополо-жительные результаты.
Паразитологическая диагностика: исследованию на цистный эхинококкоз подлежат: содержимое паразитарной кисты, ее оболочки, мокрота больного (при эхинококкозе легких), промывные воды при лаваже бронхов (в случаях вскрытия кисты в бронх), желчь (при подозрении на прорыв кисты в желчные протоки), содержимое брюшной и плевральной полостей (при вскрытии кист в полости), содержимое дренажной жидкости в разные сроки после операции, при бронхоскопии, плевральной пункции, дуоденальном зондировании. Исследованию на цист-ный эхинококкоз подвергают также материал, полученный при
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
биопсии во время операции, пункционной биопсии печени, открытой биопсии при лапаротомии или торакотомии, на аутопсии.
Дифференциальная диагностика
Дифференциальную диагностику гидатидозного эхинококкоза проводят с опухолями, паразитарными кистами другой этиологии, гемангиомами печени.
Показания к консультации других специалистов
При осложненном течении болезни (разрыв кисты, сдавление жизненно важных органов) необходима консультация хирурга для решения вопроса об оперативном лечении.
Пример формулировки диагноза
В67.0 Гидатидный эхинококк печени, неосложненное течение (КТ печени, ИФА - положительный результат).
Показания к госпитализации
Госпитализация показана при осложненном течении болезни. Лечение
Основной метод лечения больных эхинококкозом - хирургический. Важно тщательно взвешивать пользу и риск, а также показания и противопоказания к выбору подходов к лечению: хирургическое удаление кист, проведение противопаразитарной медикаментозной терапии или сочетанное лечение. При больших, поверхностно расположенных (опасность разрыва) инфицированных кистах или кистах, соединяющихся с системой желчных ходов, оперативное вмешательство носит срочный или срочно-отложенный характер и выполняется после комплексной предоперационной подготовки. Показанием к оперативному лечению является также воздействие объемного процесса на жизненно важные органы, такие как кисты легких, головного мозга, почек, костей и других органов. При множественном поражении оперативное лечение проводят поэтапно. Противопоказания: труднодоступные, отмирающие, обызвествленные или множественные мелкие кисты; учитываются общие хирургические, анестезиологические и терапевтические противопоказания. У маленьких детей и при множественных кистах показания к операции должны быть очень обоснованными. Разрешение механической желтухи при эхинококкозе печени осуществляется только оперативным путем.
Химиотерапия проводится в случаях разрыва кист, когда есть опасность обсеменения при нарушении целостности кисты во время операции, а также в случаях множественных поражений кистами небольших размеров (не более 3-5 см) печени, легких и других органов, при которых оперативное вмешательство сопряжено с высоким риском для жизни больного и невозможно технически. Противорецидивное лечение рекомендуется после операции, когда нельзя исключить наличие других локализаций паразита небольших размеров.
Противопаразитарное лечение в настоящее время проводят албендазо-лом. Препарат принимают внутрь после еды 10 мг/кг массы тела (не более 800 мг/сут) в 2 приема, курс - 28 дней, интервалы между курсами - не менее 2 нед. Продолжительность лечения клинически выраженных форм инвазии (наличие кист) - 12-18 мес. Лечение проводится при нормальных лабораторных показателях (клинический и биохимический анализы крови), в процессе лечения каждые 5-7 дней осуществляется контрольное исследование крови. Применение высоких доз албендазола в течение длительного времени само по себе становится причиной развития осложнений, обусловленных токсическим действием препарата: наблюдаются лейкопения, агранулоцитоз, алопеция, лихорадка, токсический гепатит. Одним из важных показателей, свидетельствующих о побочном действии албендазола и угрозе развития серьезных осложнений, является повышение активности аминотрансфераз. При снижении
количества лейкоцитов ниже 3,0×109/л и 5-6-кратном повышении уровня аминотрансфераз необходимо приостановить лечение до нормализации или значительного улучшения показателей. В случаях прогрессирующей лейкопении и гиперферменте-мии требуется отмена препарата. В процессе химиотерапии могут возникнуть осложнения, связанные со снижением жизнедеятельности и гибелью паразита: нагноение кист, спонтанные разрывы, возникновение полостей распада альвеолярного эхинококка с последующим абсцедированием. В этих случаях проводят антибактериальную терапию, по показаниям - хирургическое лечение. Эффективность лечения оценивают с помощью инструментальных методов и анализа динамики титра специфических антител.
Прогноз
После радикального удаления эхинококковых кист прогноз благоприятный; если невозможно оперативное лечение - неблагоприятный.
Диспансеризация
После хирургического лечения 1-2 раза в год проводят обследование, включающее клиническое, биохимическое исследование крови, серологические реакции и инструментальное исследование (УЗИ, КТ, МРТ). Реконвалесцентов снимают с учета не ранее чем через 5 лет при отсутствии признаков рецидива и стойких отрицательных результатах серологических исследований.
АЛЬВЕОЛЯРНЫЙ ЭХИНОКОККОЗ
Альвеолярный эхинококкоз (альвеококкоз, многокамерный эхинококкоз,
лат. alveococcosis, англ. alveococcus disеase) - зоонозный хронический гельминтоз, который характеризуется развитием в печени кистозных образований, способных к инфильтративному росту и метастазированию в другие органы.
КОДЫ ПО МКБ-10
D67.5 Инвазия печени, вызванная Echinococcus multilocularis.
B67.6 Инвазия другой локализации и множественный эхинококкоз, вызванные
Echinococcus multilocularis. B67.7 Инвазия, вызванная Echinococcus multilocularis, неуточненная.
Этиология
Возбудитель - Alveococcus multilocularis, развивается со сменой хозяев. Окончательные хозяева альвеококка - плотоядные животные (лисицы, песцы, собаки, кошки и др.), в тонкой кишке которых паразитируют половозрелые формы. Промежуточные хозяева - грызуны.
Половозрелая форма A. multilocularis по строению сходна с ленточной стадией
E. granulosus, но имеет меньшие размеры (длина 1,6-4 мм), головка снабжена одним венчиком коротких крючьев, матка шаровидной формы. Однако основное различие состоит в строении финны, которая у A. multilocularis имеет вид грозди пузырьков и представляет собой конгломерат экзогенно почкующихся мелких пузырьков, заполненных жидкостью или студенистой массой. У человека пузырьки часто не имеют сколексов. Рост финны происходит медленно, в течение нескольких лет.
Эпидемиология
Источник инфекции для человека - окончательные хозяева гельминта. Зрелые яйца и членики, заполненные яйцами, выделяются в окружающую среду с фекалиями животных. Заражение человека происходит при попадании в рот онкосфер из окружающей среды при охоте, обработке шкур убитых диких животных, употреблении в пищу лесных ягод и трав, обсемененных яйцами гельминта. Онкосферы альвеококка очень устойчивы к действию
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
факторов окружающей среды: они переносят температуру от -30 °С до +60 °С, на поверхности почвы при температуре 10-26 °С сохраняют жизнеспособность в течение месяца.
Альвеококкоз - природно-очаговое заболевание. Факторы, определяющие активность очагов, - обилие промежуточных хозяев (грызунов), большие территории (луга, пастбища), которые не вспахиваются, прохладный дождливый климат. Заболевания в основном отмечают среди лиц, посещающих природные очаги по профессиональной или бытовой необходимости (сбор ягод, грибов, охота, пеший туризм и др.), а также среди работников зверосовхозов. Отмечают и семейные случаи заражения. Выраженной сезонности нет. Чаще болеют мужчины в возрасте 20-40 лет, дети болеют редко.
В России заболевание встречается в Поволжье, Западной Сибири, на Камчатке, Чукотке, в Республике Саха (Якутии), Красноярском и Хабаровском крае; в 2015 г. в стране зарегистрированы всего 54 случая альвеококкоза. Эндемичные очаги гельминтоза имеются в странах Центральной Азии, Закавказья, Центральной Европы, в Турции, Иране, в центральных районах Китая, северной Японии, на Аляске, в северной Канаде.
Меры профилактики
Такие же, как при гидатидозном эхинококкозе (СанПиН 3.2.3215-14, п. VIII). Патогенез
У человека личинка A. multilocularis развивается 5-10 лет и более. Развитие и темпы роста паразита могут быть обусловлены генетическими особенностями коренного населения в эндемичных очагах. У лиц, не являющихся коренными жителями эндемических очагов, рост паразита происходит быстрее. Личиночная форма альвеококка представляет собой плотную, мелкобугристую опухоль, которая состоит из конгломерата мелких пузырьков. На разрезе она напоминает мелкопористый сыр. Альвеококковый узел - это очаг продуктивнонекротического воспаления. Вокруг очагов некроза образуется грануляционный вал, содержащий живые пузырьки альвеококка. Особенности альвеококка - инфильтрирующий рост и способность к метастазированию, что сближает данное заболевание со злокачественными опухолями. Первично всегда поражается печень. Чаще всего (75% случаев) паразитарный очаг локализуется в правой доле, реже в обеих ее долях.
Возможно солитарное и многоузловое поражение печени. Паразитарные узлы округлые, цвета слоновой кости, от 0,5 до 30 см и более в диаметре, деревянистой плотности. Компенсация функции органа возможна за счет гипертрофии непораженных отделов печени.
Восложненной стадии болезни в центре альвеококко-вых узлов практически всегда появляются полости некроза (каверны) различной формы и величины. Стенка каверны местами может истончаться, что создает предпосылки для ее разрыва. Активно размножающиеся пузырьки паразита в периферической зоне узла внедряются в ткань печени по ходу сосудисто-протоковых структур, в желчный пузырь. Развивается обтурационная желтуха, в поздних стадиях - билиарный цирроз печени. Альвеококковый узел может прорастать в желчные протоки, соседние органы и ткани (малый и большой сальники, забрюшинная клетчатка, диафрагма, правое легкое, правые надпочечник и почка, заднее средостение). Возможно метастазирование в ЛУ забрюшинной клетчатки, легкие, головной мозг, кости.
Впатогенезе важную роль играют иммунологические и иммунопатологические механизмы (иммуносупрессия, формирование аутоантител). Установлено, что скорость роста личинки зависит от состояния клеточного иммунитета.
Клиническая картина
Альвеококкоз выявляется преимущественно у лиц молодого и среднего возраста. Нередко заболевание многие годы протекает бессимптомно - доклиническая стадия. В клинически манифестной стадии симптоматика малоспецифична и определяется объемом паразитарного поражения, его локализацией и наличием осложнений. Выделяют раннюю, неосложненную стадию, стадию осложнений и терминальную стадию заболевания. По характеру течения различают: медленно прогрессирующий, активно прогрессирующий и злокачественного течения альвеолярный эхинококкоз.
Первым признаком заболевания является увеличение печени, которое обычно обнаруживают случайно. Больные отмечают дискомфорт и ощущение давления в правом подреберье или в эпигастральной области. Появляется чувство тяжести и тупая ноющая боль. Нередко отмечается увеличение и асимметрия живота. Через переднюю брюшную стенку пальпируется плотная печень с неровной поверхностью. Печень продолжает увеличиваться, становясь деревянистой плотности, бугристой и болезненной при пальпации. Больные отмечают слабость, снижение аппетита, похудание. У больных, как правило, значительно повышена СОЭ, наблюдается непостоянная эозинофилия, лимфопения. Рано появляются гиперпротеинемия с гипергаммаглобулинемией (повышается в основном уровень IgG). При осложненных формах заболевания наблюдается анемия. Показатели биохимических проб длительное время сохраняются в пределах нормы. Билирубинемия, повышение активности АСТ, АЛТ, ЩФ характерны для стадии осложнений. В этой стадии чаще всего развивается подпеченочная желтуха, особенно при центральной локализации кисты, которая начинается без болевого синдрома и нарастает медленно, сопровождается кожным зудом, который часто предшествует появлению желтухи. В случае присоединения бактериальной инфекции развивается клиническая картина абсцесса печени. Прорыв содержимого паразитарной кисты в желчные пути наблюдается редко. При вскрытии полости могут образовываться бронхопеченочные, плевро-печеночные свищи, развиваться перитонит, плеврит, перикардит. Портальная или кавальная гипертензия встречаются реже, чем желтуха. Симптомы портальной гипертензии (расширение вен на передней брюшной стенке, варикозное расширение вен пищевода и желудка, геморроидальных вен, спленомегалия, геморрагические проявления, асцит) возникают в запущенных стадиях альвеококкоза. Наиболее опасным осложнением портальной гипер-тензии является кровотечение из вен пищевода и желудка, возникающее часто внезапно. Метастазы чаще всего обнаруживаются в легких, головном мозге, реже - в почках, костях. Более чем у 50% больных наблюдается почечный синдром - протеинурия, гематурия, пиурия, цилиндрурия. Поражение почек может быть обусловлено сдавлением органа извне или за счет метастазов, нарушением почечного кровотока и пассажа мочи с развитием инфекции МВП. Присоединение иммунопатологических процессов ведет к формированию хронического гломерулонефрита, системного амилоидоза с хронической почечной недостаточностью. Более тяжело и скоротечно альвеококкоз протекает у некоренных жителей эндемичных очагов, у лиц с иммунодефицитом (первичным и вторичным), в период беременности и/или прерывании ее, при тяжелых интер-куррентных заболеваниях.
Диагностика
Диагностика основана на данных эпидемиологического анамнеза, клинико-лабораторных и инструментальных исследований.
Рентгенологические исследования, УЗИ, КТ и МРТ позволяют оценить степень поражения органов. На обзорных рентгенограммах печени у больного аль-веококкозом можно видеть мелкие очаги обызвествления в виде так называемых «известковых брызг» или «известковых кружев», в то время как при эхинококкозе обнаруживают сферически компактные участки обызвествления. Лапароскопия может быть использована для прицельной биопсии узла альвеококка, но ее можно проводить только после исключения эхинококкоза. При подпеченочной желтухе, обусловленной альвеококкозом, применяют как визуальные (гастродуоденоско-пия, лапароскопия), так и прямые рентгеноконтрастные методы
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
(ретроградная панкреатохолангиография, антеградная, чрескожная, чреспеченочная холангио-графия). Достоинствами этих методов исследования, помимо высокой информативности, является возможность использования их в качестве лечебных мероприятий, главным образом для декомпрессии желчевыводящих путей. Используют серологические методы: РЛА, непрямой гемагглютинации, ИФА; может
использоваться ПЦР, однако отрицательный результат не исключает наличия альвеококкоза у исследуемого. Лабораторная диагностика альвеолярного эхи-нококкоза регламентируется МУК 4.2.3145-13, п. 1.2.
Дифференциальная диагностика
Альвеококкоз печени необходимо дифференцировать от гидатидозного эхино-коккоза, новообразований холедохопанкреатической области, амебного абсцесса, цирроза печени.
Показания к консультации других специалистов Консультация хирурга для решения вопроса о возможности оперативного ле чения. Пример формулировки диагноза
В67.5 Альвеококкоз печени, осложненный обтурационной желтухой (УЗИ, КТ печени). Лечение Режим и диета показаны при осложненном течении болезни.
Химиотерапия проводится в случаях разрыва кист, когда есть опасность обсеменения при нарушении целостности кисты во время операции, а также в случаях множественных поражений кистами небольших размеров (не более 3-5 см) печени, легких и других органов, при которых оперативное вмешательство сопряжено с высоким риском для жизни больного и невозможно технически.
Противорецидивное лечение рекомендуется после операции, когда нельзя исключить наличие других локализаций паразита небольших размеров.
Противопаразитарное лечение проводят албендазолом. Препарат принимают внутрь после еды 10 мг/кг массы тела (не более 800 мг/сут) в 2 приема, курс - 28 дней, интервалы между курсами - не менее 2 нед. Продолжительность лечения клинически выраженных форм инвазии (наличие кист) - 12-18 мес. При возможности проводят тотальное хирургическое удаление альвеококкового узла печени в пределах интактных тканей. При кровотечении из вен пищевода наиболее эффективный метод консервативного лечения - сдавливание вен пищевода зондом Блэкмора. Паллиативные операции в сочетании с химиотерапией способны на длительное время улучшить состояние больного. В последние годы в разных странах мира проведены десятки трансплантаций печени у больных альвеолярным эхино-коккозом, однако несмотря на тщательное предоперационное исследование, немало случаев рецидива процесса или метастазирования.
Прогноз Серьезный, если невозможно оперативное лечение. Диспансеризация
Диспансерное наблюдение за переболевшим после перенесенной операции длится 8-10 лет с обследованием не реже чем 1 раз в 2 года. Снимают с учета только лиц, показавших отрицательный результат при 3- или 4-кратном серологическом исследовании в течение 3-4 лет. При появлении клинических признаков рецидива или нарастании титров антител при серологических реакциях показано обследование в условиях стационара. Больные с неоперабельными формами заболевания остаются нетрудоспособными, и наблюдение за ними пожизненное.
23.3. НЕМАТОДОЗЫ 23.3.1. Аскаридоз
Аскаридоз (лат. ascaridosis) - антропонозный геогельминтоз - нематодоз, вызываемый человеческой аскаридой - Ascaris lumbricoides. Характеризуется аллергическим синдромом в ранней (миграционной) стадии, нарушением функ-
ций ЖКТ и возможными осложнениями - в хронической (кишечной) стадии инвазии. КОДЫ ПО МКБ-10 В77.0 Аскаридоз с кишечными осложнениями.
B77.8 Аскаридоз с другими осложнениями.
B77.9 Аскаридоз неуточненный. ЭТИОЛОГИЯ
Возбудитель аскаридоза, Ascaris lumbricoides, относится к
типу Nemathelminthes, классу Nematoda отряду Rhabditida семейству Oxyuridae. В цикле развития A. lumbricoides различают следующие стадии: половозрелую форму, яйцо, инвазионное яйцо, личинку.
В связи со значительными морфологическими и метаболическими изменениями в разных стадиях развития у аскариды, как и у других видов гельминтов, существенно изменяются экзогенные и эндогенные антигены и их иммуногенные свойства.
Половозрелые особи имеют длинное тонкое тело беловато-розового цвета. Самка размером 20-40 см х 3-6 мм, самец - 15-25 см х 2-4 мм. Ротовое отверстие, расположенное на переднем конце тела, окружено тремя кутикулярными губами. Хвост короткий, у самца загнут на брюшную сторону. Внутреннее строение обычное для нематод.
Паразитируют половозрелые аскариды в тонкой кишке человека, питаясь содержимым кишечника. Каждая самка в сутки откладывает до 240 тыс. оплодотворенных и неоплодотворенных яиц. Оплодотворенные яйца (50-70х40-50 мкм) почти шаровидной или вытянутой формы, желтого или желто-коричневого цвета, имеют три оболочки. При благоприятных условиях внешней среды (наличие кислорода, высокая влажность, температура 20-25 °С) развитие личинки в яйце занимает 2-3 нед. Зрелые личинки способны в течение 20 дней сохраняться при температуре -20-27 °С. При -30 °С личинки быстро погибают, а температура 47 °С вызывает их гибель в течение 1 ч [1, 2, 3, 9]. ЭПИДЕМИОЛОГИЯ
Аскаридоз относится к геогельминтозам. Источник заражения окружающей среды - только больной аскаридозом человек. Он заражается при проглатывании инвазивных яиц. Факторами передачи служат загрязненные овощи, ягоды, другие пищевые продукты, вода, а также руки. В зоне умеренного климата сезон заражения длится до 7 мес - с апреля по октябрь, в условиях теплого влажного климата - круглый год.
Восприимчивость к аскаридозу высокая. Для жителей эндемичных очагов, подверженных частым повторным заражениям, характерно развитие определенной невосприимчивости: формируется иммунитет к суперинвазии и реинвазии. Иммунные реакции против личинок гельминта защищают хозяина от бесконтрольного увеличения интенсивности инвазии при повторном заражении.
Аскаридоз широко распространен во влажных зонах умеренного, субтропического и тропического поясов, редко регистрируется в сухих степях, отсутствует в зоне вечной мерзлоты, высокогорья и пустынь. По данным Комитета экспертов ВОЗ, аскаридозом в мире ежегодно поражаются около 900 млн человек, большинство из которых составляют дети дошкольного и школьного возраста. В РФ в 2015 г. зарегистрировано 24 115 случаев
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
аскаридоза, что не отражает реальную ситуацию по пораженности населения данным гельминтозом. Очаги аскаридоза формируются преимущественно в сельской местности, интенсивность передачи зависит от степени загрязненности почвы инвазионными яйцами, уровня сани-
тарной культуры населения и санитарного благоустройства населенных мест. Выделяют 3 типа очагов аскаридоза: высокоинтенсивный - с пораженностью людей в очаге 30% и более, средней интенсивности - 15-29%, слабой интенсивности - до 15% [1, 2, 4].
МЕРЫ ПРОФИЛАКТИКИ
Противоэпидемические мероприятия по профилактике аскаридоза регламентируются СанПиН 3.2.3215-14 (п. 10.1-10.6) [4].
В профилактике аскаридоза основное значение имеют санитарное благоустройство населенных мест и охрана почвы от фекального загрязнения. В индивидуальной профилактике важно строго соблюдать правила личной гигиены, тщательно промывать употребляемые в пищу сырые овощи, ягоды и фрукты. В очагах аскаридоза с пораженностью менее 10% населения один раз в два года проводят паразитологическое обследование 20% жителей; в очагах, где поражено более 10% жителей, ежегодно обследуют все население. Лечение инвазированных проводят с контролем эффективности через 14 дней после дегельминтизации, всего - троекратно с интервалом 7-10 дней. Обследование жителей микроочага проводят в течение 2 лет ежегодно. Для дегельминтизации используют антигельминтные препараты с учетом особенностей их применения в разных возрастных группах. Решение по проведению дезинвазии объектов и объему мероприятий по оздоровлению очага принимается органом, уполномоченным осуществлять федеральный государственный санитарно-эпидемиологический надзор.
ПАТОГЕНЕЗ
Из инвазионных яиц аскарид в тонкой кишке человека выходят рабдитовидные личинки, которые через 3-4 ч проникают в толщу слизистой оболочки. Далее происходит миграция личинок по системе портальной вены в печень, затем в легкие, где в течение 1-2 нед продолжается их развитие. В печени на 5-6-й день после заражения и в легких (на 10-й день) личинки совершают линьку. В легких, разрывая капиллярную сеть и стенки альвеол, они проникают в просвет бронхов и продвигаются по воздухоносным путям в ротоглотку. С заглатываемой слюной и пищей личинки повторно попадают в тонкую кишку, где превращаются в половозрелых самцов и самок, совершив перед этим еще две линьки. Продолжительность миграции личинок составляет около 2 нед, а созревание самок до начала откладывания яиц длится более 10 нед. В организме человека взрослая особь живет 11-13 мес.
В ранней миграционной стадии в основе патологических изменений лежит сенсибилизация организма продуктами метаболизма, линьки и распада погибших личинок. Аллергены аскарид - самые сильные среди аллергенов паразитарного происхождения. При интенсивной инвазии наблюдается механическое повреждение стенки тонкой кишки, кровеносных сосудов, ткани печени, легких. Отмечают также эозинофильные инфильтраты в легких, капиллярный стаз, геморрагии. Клинические проявления в поздней кишечной стадии связаны с механическим воздействием гельминтов и продуктов их метаболизма на слизистую оболочку кишечника, что ведет к нарушению пищеварения, моторной функции, нарушению азотистого баланса, гиповитаминозам. Один из выделяемых аскаридой полипептидов оказывает токсическое влияние на ЦНС. Аскариды могут мигрировать за пределы тонкой кишки: в желчные и панкреатические протоки, аппендикс, дыхательные пути. Иногда скопления аскарид приводят к закупорке, завороту кишки, инвагинации. Кишечная непроходимость чаще возникает при интенсивной инвазии, а инвагинация - при наличии единичных гельминтов или нескольких особей одного и того же пола. Аскариды существенно подавляют иммунологическую реактивность хозяина [1, 2, 5].
КЛИНИЧЕСКАЯ КАРТИНА
Выделяют две клинические стадии болезни - раннюю (миграционную) и позднюю (кишечную) [1, 2, 5]. Ранняя стадия часто протекает субклинически или бессимптомно. При клинически выраженной форме на 2-3-й день после заражения появляются такие признаки болезни, как недомогание, слабость, субфебрилитет. Наблюдаются уртикарные высыпания на коже, возможно увеличение печени и селезенки. Более характерен симптомокомплекс поражения легких с образованием транзиторных инфильтратов, определяемых рентгенологически, и эозинофилией в периферической крови (синдром Леффлера). В этих случаях появляются сухой кашель, иногда с мокротой с прожилками крови, одышка, боли в груди, удушье. В легких выслушивают сухие и влажные хрипы.
В кишечной стадии аскаридоз у взрослых часто протекает со слабовыражен-ными симптомами или бессимптомно. Наблюдаемые симптомы малоспецифичны (ухудшение аппетита, тошнота, иногда рвота, схваткообразные боли в животе, диарея или неустойчивый стул). Самочувствие больных ухудшается, снижается работоспособность, появляются головная боль, нарушение сна, головокружение.
У детей в ранней стадии аскаридоза может развиться пневмония, при интенсивной инвазии - тяжелая интоксикация. Снижается масса тела, дети становятся капризными, рассеянными, возможны эпилептиформные приступы, менингизм, синдром Меньера, в анализе крови - нормо- и гипохромная анемия, эозинофи-лия.
Осложнения
Различают кишечные и внекишечные осложнения аскаридоза, которые возникают в поздней стадии инвазии и часто обусловлены повышенной подвижностью взрослых гельминтов [1, 2, 5]. Наиболее частое осложнение, особенно у детей в возрасте от 4 до 8 лет, - непроходимость кишечника. При деструктивных изменениях слизистой оболочки кишечника или после оперативных вмешательств возможны проникновение аскарид в брюшную полость и развитие перитонита. Внедрение гельминтов в желчевыводящие и панкреатические ходы может привести к подпеченочной желтухе, реактивному панкреатиту, в случае присоединения вторичной бактериальной инфекции развиваются гнойный холангит, абсцессы печени, иногда аппендицит. При рвоте, антиперистальтических движениях аскариды могут попасть в пищевод, откуда они проникают в глотку, дыхательные пути, вызывая асфиксию.
ДИАГНОСТИКА
При распознавании ранней (миграционной) стадии аскаридоза необходимо ориентироваться на симптомы поражения легких в сочетании с лихорадкой и эозинофилией крови. Редко удается обнаружить личинок аскарид в мокроте. Существуют методы серодиагностики (ИФА, РЛА), но они широкого применения в практике не имеют. Лабораторная диагностика аскаридоза в кишечной стадии заключается в выявлении яиц гельминтов в фекалиях. При отрицательных результатах, в случае подозрения на гельминтоз, рекомендуют проводить повторные исследования с интервалом 1-2 нед [6, 7].
Дифференциальная диагностика
Дифференциальную диагностику аскаридоза в миграционной стадии проводят с токсокарозом, ранней фазой других гельминтозов, характеризующихся аллергическими проявлениями, острым бронхитом, пневмонией. В кишечной стадии по клиническим симптомам практически невозможно дифференцировать аскаридоз от хронических болезней ЖКТ. При возникновении осложнений, в зависимости от их характера, дифференциальную диагностику проводят с кишечной непрохо-
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
димостью, холангитом, абсцессом печени, панкреатитом другой этиологии. В этих случаях необходимы дополнительные инструментальные исследования (УЗИ органов брюшной полости) и консультация хирурга.
Пример формулировки диагноза В77.0 Аскаридоз, кишечная непроходимость. ЛЕЧЕНИЕ Показания к госпитализации
Лечение больных проводят амбулаторно или в дневном стационаре. Госпитализации подлежат больные с хирургическими осложнениями аскаридоза.
Медикаментозная терапия Все больные аскаридозом подлежат лечению антигельминтными средствами [1, 2, 5, 8].
Албендазол назначают взрослым однократно в дозе 400 мг внутрь после еды, детям старше 3 лет - по 10 мг/кг в 2 приема в течение 1-3 дней.
Мебендазол показан взрослым и детям старше 2 лет внутрь по 100 мг 2 р/сут в течение 3 дней.
Пирантел назначают по 10 мг/кг однократно внутрь после еды.
При приеме указанных антигельминтных препаратов не требуется специальной диеты и назначения слабительных средств.
Патогенетическая и симптоматическая терапия необходима при длительной и интенсивной инвазии: применяют пробиотики и ферментативные препараты.
Дополнительные методы лечения
При возникновении хирургических осложнений необходимо оперативное или инструментальное вмешательство.
Прогноз
Прогноз при неосложненном течении аскаридоза благоприятный. В отсутствие повторного заражения через 9-12 мес наступает самоизлечение вследствие естественной гибели гельминтов. Осложнения аскаридоза сравнительно редки, однако они представляют серьезную угрозу здоровью и могут привести к летальному исходу, особенно у детей. Диспансеризация
Диспансерное наблюдение за переболевшими осуществляют в течение 2-3 мес. Контрольные исследования фекалий на наличие яиц аскарид проводят троекратно: через 14 дней после дегельминтизации и повторно с интервалом 7-10 дней. При неэффективности курс лечения следует повторить.
23.3.2. Трихоцефалез
Трихоцефалез (трихиуриаз, трихуроз, лат. trichocephalosis, англ. trichocephaliasis, trichuriasis) - антропонозный геогельминтоз, характеризующийся хроническим течением с преимущественным нарушением функций ЖКТ.
КОД ПО МКБ-10 B79 Трихуроз.
ЭТИОЛОГИЯ
Возбудитель - власоглав, Trichocephalus
trichiurus, тип Nemathelminthes класс Nematoda отряд Enoplida семейство Trichocephalidae. П
ередняя часть тела гельминта тонкая, волосовидная, хвостовой отдел утолщен; отношение нитевидной части к утолщенной у самки составляет 2:1, у самца - 3:2. Длина тела самки 3035 мм, тела самца - 30-45 мм. У самок задний конец изогнут, у самцов имеет вид спирали.
Яйца власоглава имеют форму бочонка размером 0,02X0,05 мм, коричневую толстую оболочку, на полюсах расположены бесцветные пробочки. Взрослые особи гельминта паразитируют в толстой, чаще в слепой кишке. Здесь самки откладывают до 1500 до 3000 яиц
всутки. Яйца с фекалиями попадают в окружающую среду. Они должны пройти инкубацию
впочве в течение 3 нед и более, после чего личинка приобретает инвазионные свойства. В жизненном цикле Trichocephalus trichiurus отсутствует фаза миграции, паразит обладает
низкой иммуногенностью. Когда яйцо проглочено, в тонкой кишке высвобождается личинка, она внедряется в ворсинки, через несколько дней перемещается в толстую кишку, где достигает зрелости через 3 мес. Среди взрослых особей преобладают самки. Продолжительность жизни власоглава около 5 лет [1, 2, 3, 6].
ЭПИДЕМИОЛОГИЯ
Трихоцефалез относят к группе геогельминтозов. Источник загрязнения окружающей среды - больной человек. Созревание яиц власоглава в почве длится 20-25 дней. Человек заражается в результате заглатывания зрелых яиц с загрязненными овощами, фруктами, ягодами, водой. Власоглав - убиквитарный паразит. Трихоцефалез распространен преимущественно в тропических и субтропических странах, влажных районах умеренного климата. По данным ВОЗ и других источников, в мире трихоцефалезом поражены 604 млн человек. В РФ гельминтоз распространен на Северном Кавказе и в центральных черноземных областях. Болеют преимущественно дети в возрасте от 5 до 15 лет. В 2015 г. в РФ зарегистрировано 206 случаев трихоцефалеза. В нашей стране в 90-е годы ХХ столетия для оценки эпидемиологической ситуации по паразитарным заболеваниям были приняты показатели заболеваемости вместо показателей пораженности. Официально регистрируемое число больных не соответствует реальной ситуации, что особенно видно на примере трихоцефалеза.
ПРОФИЛАКТИКА
В профилактике центральное место занимают мероприятия по охране почвы от фекального загрязнения, а также соблюдение правил личной гигиены (СанПиН
3.2.3215-14, п. 10.1-10.6). ПАТОГЕНЕЗ
В патогенезе трихоцефалеза главную роль отводят травмирующему действию возбудителя. Власоглавы тонким головным концом повреждают слизистую оболочку, проникая до подслизистого, а иногда и мышечного слоя. При интенсивной инвазии наблюдают геморрагии, образование эрозий и язв в кишечнике. Власоглавы - факультативные гематофаги. Полагают, что инвазированные люди теряют 0,005 мл крови на одного паразита в день, поэтому наличие более 800 гельминтов в кишечнике у детей служит причиной гипохромной анемии. Сенсибилизирующее воздействие на организм метаболитов паразита также имеет определенное значение, но ограничивается чаще тканями кишки, что способствует развитию диареи. Клинические проявления гельминтоза очевидны при паразитировании большого количества власоглавов. Симптомы болезни наблюдаются у людей, выделяющих более 5000 яиц возбудителя в 1 г фекалий.
КЛИНИЧЕСКАЯ КАРТИНА
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
У большинства больных с низкой интенсивностью инвазии клинические проявления выражены слабо или отсутствуют. При умеренной инвазии больные предъявляют жалобы на ухудшение аппетита, тошноту, слюнотечение, диарею, метеоризм. Возможны спастические боли в животе с локализацией в правой подвздошной области. Больные отмечают слабость, раздражительность, головокружение, головную боль. При массивной инвазии развивается гемоколит, проявляющийся болевым синдромом, тенезмами, кровянистым жидким стулом. Дети, больные трихоцефалезом, отстают от сверстников в физическом и умственном развитии. В тропических странах трихоцефалезу приписывают роль фактора, способствующего развитию кишечного амебиаза и его тяжелому течению.
Осложнения трихоцефалеза - выпадение прямой кишки, гипохромная анемия, дисбиоз кишечника, кахексия. Трихоцефалез - фактор риска развития аппендицита.
ДИАГНОСТИКА
Лабораторная диагностика трихоцефалеза основана на обнаружении яиц гельминтов в фекалиях методами обогащения, регламентированными Методическими указаниями (МУК 4.2.3145-13). Взрослых гельминтов в кишечнике обнаруживают при эндоскопии (колоноскопия).
Дифференциальная диагностика
Дифференциальную диагностику проводят с другими кишечными гельминто-зами, шигеллезом, амебиазом, язвенными колитами. При подозрении на хирургические осложнения показана консультация хирурга, при подозрении на язвенный колит - консультация проктолога.
Пример формулировки диагноза
B79 Трихоцефалез. Осложнение: гипохромная анемия. ЛЕЧЕНИЕ
Противопаразитарное лечение больных трихоцефалезом проводят амбулатор-но. В госпитализации нуждаются больные с тяжелым и осложненным течением инвазии.
Применяют следующие лекарственные препараты.
◊Албендазол - внутрь после еды по 400 мг 1 раз в день 3 дня подряд.
◊Мебендазол - внутрь по 100 мг 2 раза в день через 20-30 мин после еды в течение 3 дней.
◊Карбендацимρ - внутрь после еды по 10 мг/кг в сутки в течение 3-5 сут.
При проведении противопаразитарного лечения назначать специальную диету, слабительные средства не требуется. При сохраняющихся нарушениях со стороны ЖКТ после этиотропной терапии назначают ферментные препараты и про-биотики.
Трудоспособность нарушается при массивной инвазии. Сроки нетрудоспособности определяют индивидуально.
В случаях упорной инвазии проводят повторный курс лечения спустя 3-4 нед.
Контрольное исследование фекалий необходимо через 3-4 нед после завершения курса лечения антигельминтным препаратом.
Прогноз Прогноз обычно благоприятный, может быть отягощен развитием гипохром-ной анемии и
кишечных осложнений при интенсивной инвазии.
Диспансеризация Не регламентирована. 23.3.3. Энтеробиоз
Энтеробиоз (лат. enterobiosis, англ. enterobiasis, oxyuriasis) - антропонозный контагиозный гельминтоз человека, характеризующийся перианальным зудом и кишечными расстройствами.
КОД ПО МКБ-10 B80 Энтеробиоз. ЭТИОЛОГИЯ
Возбудитель энтеробиоза - острица (Enterobius vermicularis), относящаяся к
типу Nemathelminthes классу Nematoda отряду Rhabditida семейству Oxyuridae. Тело взрослых гельминтов веретенообразное; длина самки 9-12 мм, самца - 3-5 мм.
У самки хвостовой конец заострен, у самца - спирально загнут на вентральную сторону.
Яйца асимметричные, продолговатой формы, размером 0,05×0,02 мм; оболочка их прозрачная, с двойным контуром. Зрелая самка паразитирует в слепой кишке. В ночное время, когда сфинктер расслабляется, она самостоятельно выходит через анальное отверстие и в перианальных складках откладывает от 5000 до 15 000 яиц, после чего погибает. Содержащийся в яйце зародыш развивается в инвазионную личинку в течение 4-5 ч. Длительность жизни остриц с момента заражения до выхождения зрелых самок для яйцекладки составляет около 30 сут. Яйца, относительно устойчивые к высыханию, загрязняют нательное и постельное белье, где сохраняют инвазивность до 2-3 нед. Особенность жизненного цикла E. vermicularis - отсутствие фазы миграции и низкая иммуногенность.
ЭПИДЕМИОЛОГИЯ
Источником заражения служит только инвазированный человек. Механизм заражения фекально-оральный. Основной фактор передачи - загрязненные яйцами остриц руки, а также предметы домашнего обихода, игрушки. Яйца остриц находят на полу, коврах, ночных горшках и др. Расчесы из-за сильного зуда в перианальной области способствуют скоплению яиц под ногтями, где личинки заканчивают развитие до инвазионного состояния. Иногда возможна ретроин-вазия, когда яйца остриц созревают в аногенитальной зоне, личинки заползают обратно в кишечник и там созревают. Контагиозность очень высока. Несмотря на небольшую длительность жизни остриц, вследствие возможности частых повторных заражений энтеробиоз может длиться годами. Энтеробиоз распространен повсеместно, преимущественно в странах с умеренным климатом. Интенсивность поражения в значительной степени зависит от санитарной культуры населения. Энтеробиозом в основном поражаются дети дошкольного и младшего школьного возраста. По оценкам ВОЗ, в мире этим гельминтозом ежегодно поражается около 350 млн человек; в России энтеробиоз - один из наиболее распространенных гельминтозов. В 2015 г. в РФ было зарегистрировано 221 793 инвазированных E. vermicularis; для сравнения - зараженных аскаридами было примерно в 10 раз меньше - 24 115.
МЕРЫ ПРОФИЛАКТИКИ
В профилактике энтеробиоза значение придают выявлению источника инвазии и устранению путей передачи возбудителя (СанПиН 3.2.3215-14, п. ХI; СП 3.2.3110-13 «Профилактика энтеробиоза»). С этой целью один раз в год (после летнего периода при формировании детского коллектива или по эпидемическим показаниям) проводят плановые профилактические обследования детей и обслуживающего персонала. Детей, больных
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
энтеробиозом, в период лечения и проведения контрольного обследования отстраняют от посещения дошкольных и образовательных учреждений. Если выявлено 20% и более зараженных энтеробиозом при проведении плановых профилактических обследований в организованных коллективах, в соответствии с нормативными документами одновременно всем детям и персоналу проводят противогельминтное лечение (двукратно с интервалом в 2 нед). В очаге энтеробиоза необходимо строго соблюдать чистоту жилища, служебных, школьных помещений. Лица, соприкасающиеся с больными, должны соблюдать чистоту тела, одежды, мыть руки перед едой и после посещения туалета.
ПАТОГЕНЕЗ
Острицы вызывают механическое повреждение при фиксации на слизистой оболочке кишечника, особенно сильно травмируют ее самки своим длинным и острым
хвостовым концом. Механическое раздражение и действие продуктов жизнедеятельности гельминтов вызывают зуд кожи в перианальной зоне. Острицы иногда погружаются в толщу слизистой оболочки кишки, при этом вокруг них формируются гранулемы. В результате заноса патогенных микроорганизмов вглубь тканей острицы могут способствовать развитию тифлита, аппендицита, а сами гельминты, проникая в червеобразный отросток, способны вызвать аппендикулярную колику. Эктопическая миграция остриц бывает причиной вагинита, эндометрита и сальпингита у девочек. Описаны случаи, когда гельминтов находили в органах брюшной полости при нарушении целостности кишечной стенки, обусловленном другими болезнями, на фоне которых протекала инвазия.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления энтеробиоза больше выражены у детей, у взрослых гельминтоз может протекать бессимптомно или субклинически. Наиболее частый симптом - зуд в области заднего прохода. При низкой инвазии зуд возникает периодически, по мере созревания очередных поколений самок остриц. Зуд появляется вечером или ночью, когда гельминты выползают из анального отверстия. При интенсивной инвазии зуд и жжение становятся постоянными и изнуряющими, распространяются на область промежности, половые органы. Длительное и сильное расчесывание зудящих мест (вокруг заднего прохода, в области промежности, половых губ) способствует лихенизации кожи и развитию экзематозного дерматита, пиодермии, сфинктерита, иногда парапроктита. Больные, особенно дети, становятся раздражительными, жалуются на плохой сон, повышенную утомляемость; у детей регистрируются обмороки, эпилепти-формные припадки, никтурия. При массивной инвазии возникают нарушения со стороны ЖКТ: боли и урчание в животе, метеоризм, тошнота, рвота, запор или понос, иногда с примесью слизи. При проникновении остриц в червеобразный отросток могут появиться симптомы «острого живота», в таких случаях больных оперируют: в удаленном аппендиксе обнаруживают катаральные изменения, в его просвете и толще слизистой оболочки находят яйца и взрослых гельминтов.
Осложнения
Дерматит.
ДИАГНОСТИКА
Взрослых гельминтов иногда обнаруживают на поверхности испражнений. Метод выбора для выявления яиц остриц - исследование материала (соскоба), полученного с перианальных складок с помощью тампона, шпателя, прозрачной липкой ленты (предпочтительнее операционная пленка ЛПО-1, ЛПО-2), методом отпечатка с применением стеклянных глазных палочек с клеевым слоем по Рабиновичу. Рекомендуют не менее трех повторных исследований, чтобы полностью исключить вероятность инвазии (МУК 4.2.3145-13). Дифференциальная диагностика
Дифференциальную диагностику следует проводить с другими болезнями, проявляющимися перианальным зудом: геморроем, заболеваниями прямой кишки (язвенные, необластозные поражения), сахарным диабетом, нейродерматитом и др.
Показания к консультации других специалистов
Необходимы консультации гинеколога при зуде в области половых органов у женщин, консультации хирурга - при болях в животе (возможен аппендицит).
Пример формулировки диагноза
В80 Энтеробиоз (яйца Enterobius vermicularis в соскобе из промежности). Показания к госпитализации
Для проведения противопаразитарного лечения госпитализации больных не требуется. ЛЕЧЕНИЕ Препараты выбора - албендазол, мебендазол; в качестве альтернативны - пирантел.
Албендазол назначают внутрь: взрослым по 400 мг однократно, детям от 2 лет - 5 мг/кг однократно; повторный прием в той же дозе через 2 нед.
Мебендазол внутрь по 10 мг/кг однократно; повторный прием в той же дозе через 2 нед. Пирантел внутрь по 5-10 мг/кг однократно; повторный прием в той же дозе через 2 нед.
Необходимость повторного лечения выбранным антигельминтным препаратом через 2 нед связана с тем, что из-за возможности ре- и суперинвазий один курс может не оказать должного эффекта.
Непременные условия успешной дегельминтизации при энтеробиозе - одновременное лечение всех членов семьи (детского коллектива) и строгое соблюдение гигиенического режима для исключения повторного заражения. Перед лечением проводят тщательную влажную уборку помещения. Больного ребенка рекомендуется вымыть (душ), перед сном сменить нижнее белье, надеть трусы, плотно облегающие бедра. Утром ребенка необходимо подмыть, сменить нижнее белье, постельное белье заменить или прогладить горячим утюгом. В помещении ежедневно следует проводить влажную уборку. То же самое выполняют при проведении повторного курса лечения.
Контроль за эффективностью лечения с помощью указанных выше парази-тологических методов проводят через 15 дней после полного завершения курса лечения.
Прогноз Обычно благоприятный.
23.3.4. Стронгилоидоз
Стронгилоидоз (лат. strongyloidosis) - гельминтоз из группы кишечных нема-тодозов, вызываемый Strongyloides stercoralis; протекающий с аллергическими реакциями, а позже - с диспепсическими расстройствами; человек заражается при проникновении личинок через кожу или при проглатывании их с пищей.
КОДЫ ПО МКБ-10 В78 Стронгилоидоз.
B78.0 Кишечный стронгилоидоз.
B78.1 Кожный стронгилоидоз.
В78.7 Диссеминированный стронгилоидоз. В78.0 Стронгилоидоз неуточненный.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
ЭТИОЛОГИЯ
Возбудитель стронгилоидоза человека - Strongyloides stercoralis (кишечная угрица) - мелкая раздельнополая нематода, относится к
типу Nemathelminthes, классу Nematoda, отряду Rhabditida, семейству Strongyloididae. Извест но более 50 этого рода червей, но большинство из них безопасны для человека. Спорадически у больных в Африке и в Папуа - Новая Гвинея выделяется вид Strongyloides fuelleborni [1, 2, 3, 4].
Развитие Strongyloides stercoralis происходит без промежуточного хозяина. Половозрелые паразитические самки длиной 2,2 мм и шириной 0,03-0,04 мм имеют бесцветное нитевидное тело, суживающееся к переднему концу, и конический хвост. Свободноживущие самки несколько меньших размеров: длиной 1 мм и шириной около 0,06 мм. Самцы, свободноживущие и паразитические, имеют одинаковые размеры (0,07 мм в длину и 0,04- 0,05 мм в ширину). Цикл развития S. stercoralis сложный, возможно несколько вариантов. При первом варианте развития половозрелые гельминты паразитируют в организме хозяина (человека), личинки развиваются в окружающей среде. При втором варианте в окружающей среде формируются половозрелые формы, размножение и развитие всех стадий гельминта происходят без участия теплокровного хозяина. При третьем варианте личинки, не выходя из организма хозяина, трансформируются в половозрелые формы. Таким образом происходит чередование паразитического и свободножи-вущего поколений гельминта.
В организме человека половозрелые черви паразитируют в верхних отделах тонкой кишки, иногда в желчных и панкреатических протоках, но чаще всего в либеркюновых криптах, где самки ежедневно откладывают до 40 яиц (размером около 0,05×0,03 мм), здесь же из них выходят рабдитовидные личинки, которые с фекалиями попадают в окружающую среду. Личинки имеют размеры 0,25×0,016 мм, конически заостренный задний конец тела, пищевод с двойным расширением (рабдитовидный пищевод). При неблагоприятных условиях среды рабдитовидные личинки линяют и через 3-4 дня превращаются в филя-риевидных личинок (инвазионная стадия), имеющих несколько большие размеры (0,5×0,017 мм), слегка расщепленный задний конец тела, очень тонкий пищевод. Личинки способны перемещаться в почве. В организм человека личинки проникают активно через кожу или заносятся пассивно через рот с загрязненными овощами, фруктами, водой. При всех видах заражения филяриевидные личинки совершают миграцию по организму хозяина, подобно личинкам аскариды. Самки внедряются в слизистую оболочку кишечника и через 17-28 дней после заражения начинают откладывать яйца.
При инвазии S. stercoralis патогенное воздействие обусловлено сильным сенсибилизирующим действием их антигенов, особенно в стадии миграции
личинок. В то же время паразиты вызывают частичный иммунный ответ на суперинвазию, что ограничивает их распространение за пределы тонкой кишки. При благоприятных условиях (температуре и влажности почвы) рабдитовидные личинки дают начало половозрелому поколению (самкам и самцам). Феномен самозаражения (аутосуперинвазии) обусловливает многолетнее течение строн-гилоидоза.
ЭПИДЕМИОЛОГИЯ
Человек - основной источник заражения окружающей среды. Заражение человека в большинстве случаев происходит в результате активного проникновения личинок через кожу при соприкосновении с зараженной почвой (перку-танный путь). Однако возможны другие пути заражения: алиментарный (при употреблении овощей и фруктов, загрязненных личинками гельминта), водный (при питье воды из загрязненных источников водоснабжения). Описаны случаи профессионального заражения при нарушении правил техники безопасности в лабораториях во время паразитологических исследований фекалий больных. Существует также механизм внутрикишечного самозаражения (аутоинвазии),
благодаря которому новые паразитические поколения образуются, минуя сво-бодноживущую фазу; рабдитовидные личинки могут превращаться в инвазив-ные филяриевидные прямо в кишечнике при долгом нахождении в нем (например, при запорах). В этом случае перелинявшие личинки внедряются в стенку кишечника, и цикл повторяется. Благодаря этому механизму стронгилоидоз может персистировать у человека десятилетиями, даже после выезда из очага. При стронгилоидозе возможен также половой путь заражения (у гомосексуа-лов). Некоторые эндемичные очаги поддерживаются сохранением в почве свободноживущих поколений червей. Заражение обычно происходит весной, летом и осенью. Гельминтоз чаще регистрируют у жителей сельской местности, так как к группам риска заражения стронгилоидозом относят лиц, по роду трудовой деятельности контактирующих с почвой. Кроме того, в группу риска входят также лаборанты паразитологических лабораторий, лица, находящиеся в наркологических отделениях, психиатрических клиниках и интернатах для умственно отсталых. В 70 странах мира, по оценочным данным, число пораженных составляет от 100 до 200 млн человек. Стронгилоидоз распространен во влажных тропиках и субтропиках, в меньшей степени в зоне умеренного климата. Однако регистрируют повсеместно вследствие интенсивного завоза с эндемичных территорий. В умеренном климатическом поясе наблюдают спорадические случаи. Наиболее высокий уровень пораженности населения в РФ регистрируют в Ростовской области, Краснодарском крае, Приамурье; в странах СНГ - в Молдове, на Украине, в Азербайджане, Грузии, Абхазии.
МЕРЫ ПРОФИЛАКТИКИ
Профилактические мероприятия предусматривают охрану окружающей среды от фекального загрязнения, активное выявление больных стронгилоидозом среди групп риска по клиническим показаниям: при заболеваниях ЖКТ (язвенная болезнь), аллергозах (линейные формы крапивницы), эозинофилии крови, а также при профилактических осмотрах.
Меры личной профилактики - необходимо избегать хождения босиком и других контактов открытых участков тела с почвой на эндемичных территориях, а также тщательное мыть овощи и огородную зелень перед употреблением. Необходимо проводить систематическую санитарно-просветительскую работу среди населения по мерам индивидуальной профилактики.
ПАТОГЕНЕЗ
В ранней стадии патологические изменения в тканях и органах на путях миграции личинок обусловлены сенсибилизацией организма продуктами метаболизма гельминтов и их механическим воздействием. Паразитирование самок и личинок вызывает в ЖКТ воспалительную реакцию. При миграции личинки могут попасть в печень, легкие, почки и другие органы и ткани, где развиваются гранулемы, дистрофические изменения и микроабсцессы. Возможно многолетнее бессимптомное течение кишечной инвазии, способной быстро реактивироваться при подавлении клеточного иммунитета.
У ослабленных и иммунокомпрометированных лиц (имеющих раковые заболевания, СПИД, после трансплантации органов, химиотерапии и лечения глюкокор-тикоидами) стронгилоидоз может переходить в диссеминированную форму, когда личинки паразитов распространяются по всему организму. Эта форма болезни может протекать тяжело, вызывая паразитемию, менингит, миокардит.
КЛИНИЧЕСКАЯ КАРТИНА Длительность инкубационного периода не установлена.
Различают острую (раннюю миграционную) и хроническую стадии гельминтоза. У большинства инвазированных ранняя миграционная стадия протекает бессимптомно.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
В манифестных случаях в этот период стронгилоидоза преобладает сим-птомокомплекс острого инфекционно-аллергического заболевания. При пер-кутанном заражении в месте внедрения личинок появляются эритематозные и макуло-папулезные высыпания, сопровождающиеся зудом. Больные жалуются на общую слабость, раздражительность, головокружение и головную боль, повышение температуры тела (до 38-39 °С). Наблюдаются симптомы бронхита или пневмонии: кашель, иногда с примесью крови в мокроте, одышка, бронхоспазм. Рентгенологически обнаруживают «летучие» инфильтраты в легких. Эти явления продолжаются от 2-3 сут до недели и более. Через 2-3 нед после заражения у большинства больных появляются симптомы поражения ЖКТ: тупые или схваткообразные боли в животе, диарея, сменяющаяся запором, нарушение аппетита, саливация, тошнота, рвота. Возможно увеличение печени и селезенки. В периферической крови эозинофилия до 30-60%, лейкоцитоз, увеличение СОЭ. Через 2-3 мес описанные симптомы стихают, и заболевание переходит в хроническую стадию, для которой характерны полиморфизм клинических проявлений с преобладанием нарушений деятельности ЖКТ (в том числе дуодено-желчно-пузырный синдром), функциональные расстройства ЦНС и вегетативной нервной системы и аллергические симптомы.
Для желудочно-кишечной формы свойственно длительное течение с периодическими обострениями симптомов гастрита, энтерита, энтероколита (изжога, боль в животе, метеоризм, похудание, анорексия, тошнота, рвота, понос). При интенсивной инвазии слизистая изъязвляется, возможно развитие пареза кишечника. В таких случаях заболевание протекает по типу язвенной болезни двенадцатиперстной кишки, язвенного колита или острого живота. Нередко при этой форме инвазии наблюдают признаки дискинезии билиарной системы. Длительная инвазия может приводить к нарушению всасывания в кишечнике и синдрому мальабсорб-ции. Симптомы могут напоминать целиакию, включая стеаторею, гипоальбумине-мию и периферические отеки.
Нервно-аллергическая форма протекает с астеноневротическим синдромом, уртикарной сыпью (линейная, кольцеобразная) с сильным зудом. При аутосупе-ринвазии (при задержке личинок в перианальных складках вследствие фекального
загрязнения кожи), наблюдающейся чаще у лиц с психическими расстройствами и низкой санитарной культурой, возникает упорный дерматит в области промежности, на ягодицах, внутренних поверхностях бедер.
Примерно у 10% больных возможно поражение органов дыхания с развитием астмоидного бронхита.
При смешанной форме могут быть выражены все проявления заболевания или некоторые из них. При тяжелом течении инвазии наблюдаются истощающая диарея с обезвоживанием, синдром мальабсорбции, анемия, кахексия. Возможны серьезные осложнения: язвенные поражения кишечника, нередко заканчивающиеся перфоративным перитонитом, паренхиматозной дистрофией печени, некротическим панкреатитом.
У ослабленных больных, злоупотребляющих алкоголем, с иммунодефицитом (при СПИДе, лейкозе, лучевой терапии, длительном приеме глюкокортикоидов, цитостатиков), отмечается крайне неблагоприятное течение стронгилоидоза, который переходит в гиперинвазивную и диссеминированную форму. Стронгилоидная гиперинвазия обусловлена высокой численностью паразитов и характеризуется проникновением филяриевидных личинок во многие органы и ткани. Миграция личинок в головной мозг вызывает тромбоз сосудов, отек и быструю гибель больного. При диссеминированном стронгилоидозе нередко отсутствует один из характерных лабораторных признаков - эозинофилия. Стронгилоидоз относят к числу СПИД-ассоциированных паразитарных болезней.
Осложнения
Основное осложнение стронгилоидоза - развитие гиперинвазивного синдрома с поражением печени, почек, сердца, брюшины, ЛУ, поджелудочной и щитовидной железы, простаты, яичников. Известны случаи аппендицита, вызванного инвазией S. stercoralis. Поражения почек иногда проявляются нефротическим синдромом [1, 2, 3, 7].
ДИАГНОСТИКА
Для лабораторной диагностики необходимо обнаружение личинок S. stercoralis в фекалиях или в дуоденальном содержимом с помощью специальных методов (метод Бермана, его модификации и др.). При массивной инвазии личинок можно обнаружить в нативном мазке фекалий. При генерализации процесса обнаружение личинок гельминта в кале нередко затруднено, их чаще находят в дуоденальном содержимом, они могут появляться также в мокроте и в моче [8, 9].
Методом ИФА возможно обнаружение IgG-антител. Разработана ПЦР-диагностика.
Дополнительные инструментальные исследования (рентгенологическое исследование легких, УЗИ, ЭГДС с биопсией слизистой оболочки желудка и двенадцатиперстной кишки) проводят по клиническим показаниям.
Дифференциальная диагностика
Дифференциальная диагностика на основании клинической картины затруднена, что объясняется полиморфизмом проявлений стронгилоидоза. В миграционной стадии стронгилоидоз дифференцируют от миграционной стадии аскаридоза и других гельминтозов, в хронической - от язвенной болезни желудка и двенадцатиперстной кишки, хронического холецистита, панкреатита.
Показания к консультации других специалистов Показаны консультации гастроэнтеролога, пульмонолога, невролога, кардиолога. Пример формулировки диагноза
В78.1 Кишечный стронгилоидоз хронический, среднетяжелое течение. Показания к госпитализации
Лечение больных неосложненным стронгилоидозом проводят в амбулаторных условиях; больных генерализованным и гиперинвазивным стронгилоидозом госпитализируют в инфекционный стационар.
ЛЕЧЕНИЕ
Препаратом выбора в настоящее время считают ивермектин (в РФ не зарегистрирован). Он эффективен для лечения острой и хронической формы стронги-лоидоза, а также диссеминированной гиперинфекции. Ивермектин назначают в дозе 200 мкг/кг массы тела однократно. Пока препарат плохо изучен у детей [10].
Албендазол - альтернативный препарат, назначают в суточной дозе 400-800 мг (детям старше 2 лет по 10 мг/кг в сутки) в 1-2 приема в течение 3 дней, при интенсивной инвазии - до 5 дней.
Противопаразитарное лечение проводят на фоне приема антигистаминных препаратов. Использовать глюкокортикоиды противопоказано. Характер патогенетической и симптоматической терапии зависит от тяжести течения болезни и нарушений в деятельности органов и систем.
При эффективном лечении возможно временное увеличение (при невысоком исходном уровне) или значительное снижение (при высоком исходном уровне) эозинофилии крови. Кожный зуд, экзантемы, артралгии исчезают вскоре после лечения.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Контроль за эффективностью лечения больных стронгилоидозом проводят непосредственно после окончания лечения и через месяц. Для этого троекратно исследуют кал с интервалом 1- 2 дня на наличие личинок S. stercoralis. В сомнительных случаях целесообразно исследовать дуоденальное содержимое.
Больным, получающим иммуносупрессивную терапию, больным с ВИЧ-инфекцией даже при отрицательных контрольных анализах после эффективного лечения целесообразно проводить ежемесячное профилактическое противопара-зитарное лечение указанными выше препаратами в половинной дозе курсами по 2 дня.
Примерные сроки нетрудоспособности Сроки нетрудоспособности определяют индивидуально для каждого больного. Прогноз
Прогноз благоприятный в неосложненных случаях при проведении этио-тропной терапии в ранние сроки болезни. При тяжелом течении, особенно протекающем на фоне иммунодефицита, прогноз серьезный. При возникновении осложнений, реинвазии и аутоинвазии прогноз весьма серьезный. Особенно тяжело протекает стронгилоидоз у больных ВИЧ/СПИД, так как сопровождается выраженными деструктивными изменениями в стенке кишки, иногда приводящими к перфорации, генерализации инвазии с поражением многих органов и систем, прежде всего ЦНС, легких.
Диспансеризация Диспансеризация не регламентирована. 23.3.5. Трихинеллез
Трихинеллез (лат. trichinellosis, англ. trichinosis) - биогельминтоз, вызываемый нематодами рода Trichinella. Характеризуется острым течением, лихорадкой, болями в мышцах, отеками, гиперэозинофилией и различными аллергическими проявлениями.
КОД ПО МКБ-10 В75 Трихинеллез. ЭТИОЛОГИЯ
Возбудители трихинеллеза - круглые черви семейства Trichinellidae, включающего два вида - Trichinellа spiralis c тремя вариантами (T. s. spiralis, T. s. nativa, T. s. nelsoni) и Trichinella pseudospiralis. В России наибольшее значение имеют T. s. spiralis и T. s. nativa. Trichinella s. spiralis распространена повсеместно, паразитирует у домашних свиней, патогенна для человека. Trichinellа s. nativa встречается в северном полушарии, паразитирует у диких млекопитающих, чрезвычайно устойчива к холоду, патогенна для человека. Trichinella s. nelsoni встречается в Экваториальной Африке, паразитирует у диких млекопитающих, малопатогенна для человека. Trichinella pseudospiralis распространена повсеместно, паразитирует у птиц и диких млекопитающих. Патогенность для человека не доказана.
Трихинеллы - мелкие нематоды с цилиндрическим бесцветным телом, покрытым прозрачной кутикулой кольчатой структуры. Длина неоплодотворенной самки 1,5-1,8 мм, оплодотворенной - до 4,4 мм, половозрелого самца - около 1,2-2 мм, диаметр гельминтов менее 0,5 мм. В отличие от других нематод трихинеллы - живородящие гельминты. Их личинки, юные трихинеллы, имеют палочковидную форму, длину до 0,1 мм; через 18-20 дней развития личинка удлиняется до 0,7-1,0 мм.
Один и тот же организм теплокровного животного для трихинелл служит сначала дефинитивным (кишечные трихинеллы), а затем промежуточным (инкапсулированные в мышцах личинки) хозяином. В организм нового хозяина паразит попадает с мясом животных,
в котором содержатся живые инкапсулированные личинки. Под действием желудочного сока капсула растворяется, личинки в тон-
кой кишке через час активно внедряются в слизистую оболочку. На 4-7-е сутки самки начинают производить живых личинок. Каждая самка в течение репродуктивного периода, длящегося 10-30 дней, рождает от 200 до 2000 личинок. Из кишечника личинки током крови разносятся по всему организму. Дальнейшее развитие паразита возможно только в поперечнополосатых мышцах. На 3-й неделе после заражения личинки становятся инвазионными и принимают типичную спиралевидную форму. К началу 2-го месяца после заражения вокруг них в мышцах формируется фиброзная капсула, которая через 6 мес начинает обызвествляться. В капсулах личинки сохраняют жизнеспособность 5-10 лет и более. В мышцах человека капсулы личинок трихинелл размером 0,3-0,6 мм всегда имеют лимоновидную форму [1, 2, 3, 6, 9].
ЭПИДЕМИОЛОГИЯ
Источником возбудителя инфекции для человека служат пораженные трихинеллами домашние и дикие животные. Путь заражения оральный. Человек заражается при употреблении в пищу инвазированного трихинеллами мяса: чаще свинины, реже мяса диких животных (медведя, кабана, барсука, моржа и др.). Личинки трихинелл, находящиеся в мышцах животных, устойчивы к высоким и низким температурам. Нагревание мяса, содержащего инкапсулированные личинки трихинелл, в микроволновой печи до 81 °С не обеспечивает их инактивации. При варке куска мяса толщиной около 10 см личинки погибают только через 2-2,5 ч. Личинки устойчивы к таким видам кулинарной обработки, как соление, копчение, замораживание. Наибольшую опасность представляют термически не обработанные мясные продукты: строганина, сало (шпик) и т.д.
Трихинеллез - природно-очаговый биогельминтоз. Четких границ между природными и синантропными очагами во многих случаях провести не удается, так как возможен обмен возбудителем между дикими и домашними животными. Известно более 100 видов млекопитающих, которые могут быть хозяевами трихинелл. Возбудитель циркулирует между хищными (бурые и белые медведи, псовые, кошачьи, куньи), факультативно-плотоядными парнокопытными животными (кабан, северный олень, лось) и грызунами (крысы, полевки, лемминги и др.). Возможно также заражение ластоногих (морж, тюлень) и китообразных (белуха). Циркуляция трихинелл в природе осуществляется преимущественно через хищничество и поедание падали. Инкапсулированные личинки трихинелл проявляют жизнеспособность и заразность в течение 4 мес после полного разложения трупа инвазированного животного.
Синантропные очаги вторичны. Циркуляция возбудителя в них обычно идет по цепи «домашняя свинья-крыса-домашняя свинья». В циркуляции трихинелл человек не участвует, так как в цикле развития гельминта является биологическим тупиком. Заболеваемость трихинеллезом часто носит групповой характер.
Ареал распространения трихинеллеза среди людей соответствует таковому среди животных. В природе среди млекопитающих трихинеллез регистрируют повсеместно, за исключением Австралии. Заболеваемость человека существенно различается по регионам мира. В России синантропный трихинеллез распространен в умеренно-северных, умеренных и южных зонах, на юге Дальнего Востока, Камчатке. Основные районы трихинеллеза, где заражение связано
супотреблением в пищу мяса диких животных, - это Магаданская, Камчатская области, Красноярский край, Республика Саха (Якутия) и Хабаровский край. Очаги смешанного типа
сциркуляцией возбудителя между синантропными (свинья, кошка, собака) и дикими (кабан, медведь, грызуны) животными встречаются на Северном Кавказе. Заболеваемость трихинеллезом в РФ в 90-е гг. XX в. достигала 0,7 на
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
100 тыс. населения. Благодаря усилению мер профилактики стала снижаться - в 2012 г. составила 0,08 (зарегистрировано 118 случаев, из них 1 с летальным исходом); в 2015 г. - 38 случаев - 0,02 на 100 тыс. населения.
МЕРЫ ПРОФИЛАКТИКИ
Меры профилактики паразитарных болезней на территории РФ регламентируют СанПиН 3.2.3215-14 [4]. Основу профилактики трихинеллеза составляют обеспечение ветеринарносанитарного надзора и санитарно-просветительная работа. Для предупреждения заболевания людей наибольшее значение имеют обязательная ветеринарная экспертиза используемого в пищу мяса, которое допускается к реализации только после тpихинеллоскопии. Исследованию подлежат также и туши диких животных, добытых на охоте. Большое значение имеет информирование населения через средства массовой информации о гельминтозе и путях его распространения, а также распространение зоотехнических знаний среди лиц, содержащих свиней в личном хозяйстве. По каждому случаю заболевания трихинеллезом проводят экстренное эпидемиологическое расследование с целью выявить источник инвазии и предотвратить ее распространение. Всем лицам, заведомо употреблявшим в пищу мясные продукты, инвазированные трихинеллами, проводят превентивное лечение.
ПАТОГЕНЕЗ
В основе патогенеза трихинеллеза лежит сенсибилизация организма к антигенам гельминта, проявляющаяся в разной степени в кишечной, миграционной и мышечной стадиях инвазии. К концу первой недели после заражения преимущественно в тонкой кишке обнаруживают самок трихинелл, погруженных в слизистую оболочку, вокруг которых развивается местная катарально-геморрагическая воспалительная реакция. При тяжелой инвазии наблюдаются язвенно-некротические повреждения слизистой оболочки кишечника. Взрослые особи выделяют иммуносупpессивные вещества, подавляющие бурную воспалительную реакцию, что способствует миграции личинок. В тощей кишке активизируется система кининов, других гормонов, вызывающих функциональные расстройства, болевой синдром. Метаболиты мигрирующих личинок, освобождающиеся после их гибели, - это антигены, обладающие сенсибилизирующим, ферментативным и токсическим свойствами. Вследствие этого развиваются выраженные аллергические реакции с поражением кровеносных сосудов, коагуляционными нарушениями, тканевым отеком, повышением секреторной активности слизистых оболочек. На второй неделе личинок обнаруживают не только в скелетных мышцах, но и в миокарде, легких, почках, головном мозге. В паренхиматозных органах личинки погибают. Развивающиеся иммунопатологические реакции ведут к тяжелым поражениям: миокардиту, менингоэнцефалиту, пневмонии. Воспалительные процессы со временем стихают, но через 5-6 нед могут сменяться дистрофическими, последствия которых исчезают только через 6-12 мес. Из скелетных мышц чаще всего поражаются группы с обильным кровоснабжением (межреберные, жевательные, глазодвигательные мышцы, диафрагма, мышцы шеи, языка, верхних и нижних конечностей). У больных с тяжелой формой болезни находят 50-100 личинок трихинелл и более в 1 г мышечной массы. К концу 3-й недели личинки приобретают спиралевидную форму, вокруг них наблюдается интенсивная клеточная инфильтрация, на месте которой затем формируется фиброзная капсула. Процесс образования капсулы нарушается при чрезмерной антигенной нагрузке (при массивной инвазии), а также под воздействием веществ с иммунодепрессивными свойствами (глюкокортикоиды и др.). В паренхиматозных органах встречаются узелковые инфильтраты. В миокарде личинки трихинелл обусловливают появление множественных воспалительных очагов в интерстициальной ткани, но настоящие капсулы в сердечной мышце не формируются. При интенсивной инвазии в миокарде
развиваются очагово-диффузная воспалительная реакция и дистрофические изменения; возможны образование гранулем и развитие васкулитов с поражением артериол и капилляров мозга и мозговых оболочек.
Для трихинеллеза характерен стойкий нестерильный иммунитет, который обусловлен наличием инкапсулированных личинок возбудителя в мышцах зараженных людей. Высокое содержание специфических антител в сыворотке крови отмечается с конца 2-й недели и достигает максимума на 4-7-й неделе. Комплекс реакций в энтеpальной стадии предупреждает проникновение в кровоток значительной части личинок, что ограничивает их распространение в организме.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период при трихинеллезе в среднем длится 10-25 дней, может составлять от 5-8 дней до 6 нед. При заражении в синантропных очагах (после употребления инфицированного мяса домашних свиней) наблюдается обратная зависимость между продолжительностью инкубационного периода и тяжестью течения болезни: чем короче инкубационный период, тем тяжелее клиническое течение. При заражении в природных очагах такой закономерности обычно не отмечают.
В зависимости от характера клинического течения различают следующие формы трихинеллеза: бессимптомную, абортивную, легкую, средней степени тяжести и тяжелую.
Первые симптомы в виде тошноты, рвоты, жидкого стула, болей в животе у некоторых больных появляются в ближайшие дни после употребления зараженного мяса и могут длиться от нескольких дней до 6 нед.
При бессимптомной форме единственным проявлением может быть эозинофи-лия крови.
Для абортивной формы характерны кратковременные (длительностью 1-2 дня) клинические проявления.
Основные симптомы трихинеллеза - лихорадка, боли в мышцах, миастения, отеки, гиперэозинофилия крови.
Лихорадка ремиттирующего, постоянного или неправильного типа. В зависимости от степени инвазии повышенная температура тела у больных сохраняется от нескольких дней до 2 нед и дольше. У некоторых больных субфебрилитет сохраняется несколько месяцев.
Отечный синдром появляется и нарастает довольно быстро - в течение 1-5 дней. При легкой и среднетяжелой формах болезни отеки сохраняются 1-2 (реже до 3) нед, при тяжелом течении отечный синдром развивается медленнее, но сохраняется дольше и может рецидивировать. Сначала, как правило, появляется периорбитальный отек, сопровождающийся конъюнктивитом и затем распространяющийся на лицо. В тяжелых случаях отеки переходят на шею, туловище, конечности (неблагоприятный прогностический признак).
У больных трихинеллезом наблюдаются макуло-папулезные высыпания на коже, иногда приобретающие геморрагический характер, подконъюнктивальные и подногтевые кровоизлияния.
Мышечный синдром проявляется миалгией, которая при тяжелом течении принимает генерализованный характер, сопровождается миастенией. Боли появляются сначала в мышцах конечностей, затем в других группах мышц, в том числе жевательных, языка и глотки, межреберных, глазодвигательных. В поздней стадии трихинеллеза могут развиться мышечные контрактуры, приводящие к обездвиживанию больного.
При поражении легких, развивающемся в течение первых 2 нед болезни, наблюдаются кашель, иногда с примесью крови в мокроте, признаки бронхита, на рентгеновских снимках определяются «летучие» инфильтраты в легких.
В периферической крови, обычно с 14-го дня, нарастают эозинофилия, лейкоцитоз, характерны гипопротеинемия (снижено содержание альбуминов), снижение уровня калия,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
кальция, повышение активности ферментов (КФК, АСТ и др.) в сыворотке крови. Эозинофилия достигает максимальных значений на 2-4-й неделе и может сохраняться на уровне 10-15% в течение 2-3 мес и дольше. Наблюдается определенная зависимость между высотой эозинофилии и выраженностью клинических признаков трихинеллеза. Трихинеллез легкого течения проявляется небольшим повышением температуры тела (до 38 °С), отеком век, слабо выраженными болями в мышцах конечностей и невысокой эозинофилией.
Для трихинеллеза средней степени тяжести характерны инкубационный период 2-3 нед, острое начало с лихорадкой до 39 °С в течение 1-2 нед, отеком лица, умеренными болями в мышцах конечностей, лейкоцитозом 9-14×109/л и эозино-филией 20-25% и выше.
При трихинеллезе тяжелого течения короткий инкубационный период (менее 2 нед), длительная высокая температура не менее 2 нед, генерализованные отеки, в значительной степени обусловленные ускоренным катаболизмом белка и гипопро-теинемией, миалгии с мышечными контрактурами и полной обездвиженностью больного. В гемограмме - гиперлейкоцитоз (до 20×109/л), гиперэозинофилия (до 50% и выше), однако при крайне тяжелом течении эозинофилия может отсутствовать или быть незначительной (плохой прогностический признак). Нередко встречается диспепсический и абдоминально-болевой синдром, более чем у 50% больных возникает гепатомегалия.
Общая продолжительность манифестных форм болезни в зависимости от тяжести течения колеблется от 1-2 до 5-6 нед. Период реконвалесценции при тяжелой форме трихинеллеза может составлять 6 мес и более. Мышечные боли и отечность лица могут периодически рецидивировать, сопровождаясь лихорадкой и другими симптомами. Рецидивы протекают легче первичного заболевания.
Летальность и причины смерти
Тяжесть течения трихинеллеза и его исход во многом зависят от органных поражений, развивающихся на 3-4-й неделе болезни; одно из серьезнейших среди них - миокардит. С его развитием возникают тахикардия, гипотония, возможны нарушение сердечного ритма, развитие сердечной недостаточности. Границы сердца расширены, на ЭКГ выявляют диффузные поражения миокарда, иногда коронарные нарушения. Миокардит при трихинеллезе - одна из главных причин летального исхода, наступающего в период с 4-й по 8-ю неделю болезни. Следующая после миокардита причина смерти - поражение легких. При средне-тяжелом течении клинически и рентгенологически выявляют признаки бронхита и «летучие» инфильтраты в легких. При тяжелой форме легочные поражения могут иметь вид долевой пневмонии с появлением серозного выпота в полости плевры. Возможен отек легких, чему способствует также развитие сердечнососудистой недостаточности. Возможно присоединение вторичной бактериальной инфекции. Поражение ЦНС проявляется головной болью, сонливостью, иногда бредом, менингизмом, связанным с отечным синдромом. В поздние сроки регистрируют тяжелые нарушения, такие как полиневриты, острый передний полиомиелит, тяжелая псевдопаралитическая миастения (myasthenia gravis), менингит, энцефалит с развитием психозов, локального пареза или паралича, комы. Летальность при отсутствии адекватного лечения может достигать 50%.
ДИАГНОСТИКА
Во время вспышек и групповых заболеваний при наличии типичных симптомов у больных постановка диагноза трихинеллеза не вызывает трудностей. Необходимо установить общий источник заражения и, по возможности, провести исследование остатков пищи (мяса или мясных продуктов) на наличие личинок трихинелл. Трудности возникают при диагностике спорадических случаев. В подобных ситуациях большое значение имеет эпидемиологический анамнез.
Паразитологические методы лабораторной диагностики регламентирует МУК 4.2.3145-13 (п. 1.3). При отсутствии данных об источнике заражения иногда прибегают к биопсии мышц (дельтовидной или икроножной у лежачих больных или длинной мышцы спины у ходячих больных): кусочек мышечной ткани массой 1 г исследуют под микроскопом при малом увеличении на наличие личинок трихинелл.
Серологические методы диагностики можно использовать только на 3-й неделе болезни, так как в первые 2 нед преобладают реакции местного иммунитета (кишечная фаза инвазии) и концентрация специфических антител в крови низкая. Используют ИФА с антигеном T. spiralis и РНГА. Сроки появления диагностических титров антител зависят от интенсивности инвазии и вида возбудителя: у больных трихинеллезом, которые заразились при употреблении мяса свиньи, сильно инвази-рованного трихинеллами, антитела выявляются на 15-20-е сутки после заражения; если интенсивность инвазии меньше, сроки выявления антител удлиняются. При заражении мясом диких животных (Г. s. nativa) начальные сроки выявления антител могут составлять до 1,5 мес. Титры специфических антител могут нарастать в течение 2-4 мес после заражения, заметно снижаясь через 4-5 мес, однако могут оставаться на диагностическом уровне до 1,5 года, а при интенсивном заражении - до 2-5 лет. Для ранней серологической диагностики трихинеллеза желательна одновременная постановка двух серологических реакций: ИФА и РНГА. Чувствительность в этих случаях достигает 90-100% и специфичность - 70-80%. У лиц, употреблявших зараженное трихинеллами мясо, проводят серологическое обследование через 2-3 нед после превентивного лечения. Диагностические показатели серологических реакций - подтверждение того, что эти лица переболели трихинеллезом.
У всех больных трихинеллезом, наряду с клиническими анализами крови и мочи, проводят биохимический анализ крови, ЭКГ, рентгенологическое исследование легких, определяют уровень электролитов в плазме.
Дифференциальная диагностика
Дифференциальную диагностику проводят с ОКИ, брюшным тифом и парати-фами, ОРЗ, сыпным тифом, корью, лептоспирозом, иерсиниозом, отеком Квинке. При нарастании эозинофилии в крови трихинеллез дифференцируют от острой фазы других гельминтозов (описторхоз, фасциолез, стронгилоидоз, токсокароз), эозинофильного лейкоза, узелкового периартериита, дерматомиозита.
Показания к консультации других специалистов Консультации специалистов, другие лабораторные исследования проводят по показаниям. Пример формулировки диагноза В75 Трихинеллез, легкое течение болезни. РНГА 1:320.
ЛЕЧЕНИЕ Показания к госпитализации
Лечение больных среднетяжелой и тяжелой формой трихинеллеза проводят в условиях инфекционного стационара или ЛПУ общетерапевтического профи-
ля. Лечение в значительной степени индивидуально и включает специфическую (этиотропную) и патогенетическую терапию.
Медикаментозная терапия
Противопаразитарная терапия направлена на уничтожение кишечных трихинелл, мышечных трихинелл, пресечение продукции личинок, нарушение процесса их инкапсуляции. Для этих целей применяют албендазол и мебендазол.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Албендазол назначают внутрь после еды по 400 мг 2 р/сут больным с массой тела 60 кг и более или по 15 мг/кг в сутки в два приема больным с массой тела менее 60 кг. Длительность лечения 14 дней.
Мебендазол назначают внутрь через 20-30 мин после еды в дозе 10 мг/кг в сутки в 3 приема. Длительность курса лечения 14 дней.
При легком течении болезни эти же препараты назначают курсом длительностью до 7 дней. Превентивное противопаразитарное лечение лиц, употреблявших в пищу инва-зированные мясные продукты, проводят албендазолом в тех же дозах в течение 5-7 дней. Наиболее эффективна этиотропная терапия в инкубационном периоде, когда можно предотвратить клинические проявления, или в первые дни болезни, когда трихинеллы еще находятся в кишечнике. Во время мышечной стадии заболевания и инкапсуляции эффективность этиотропной терапии значительно ниже, и ее применение в этот период может даже способствовать обострению болезни.
Больным назначают антигистаминные препараты, ингибиторы простагланди-нов, НПВС. При тяжелой инвазии с неврологическими расстройствами, миокардитом, ИТШ, легочной недостаточностью используют глюкокортикоиды: обычно преднизолон в суточной дозе 20-60 (по показаниям до 80) мг внутрь в течение 5-7 дней. В связи с тем что глюкокортикоиды могут удлинять период и количество ларвопродукции в кишечнике, рекомендуют назначать противопаразитарные препараты (албендазол или мебендазол) в течение всего периода применения глюкокортикоидов и несколько дней после их отмены. Опасность представляют также возможные язвенные поражения кишечника в сочетании с нарушениями в системе гемостаза. У таких больных резко возрастает риск ульцерогенного действия глюкокортикоидов, особенно при одновременном назначении НПВС (индометацин, диклофенак и т.п.). В этих случаях для профилактики язвенных поражений в ЖКТ необходимо применять ингибиторы протонного насоса (омепразол и др.). Больным
трихинеллезом тяжелого течения с генерализованными отеками (вследствие ускоренного катаболизма белка и гипопротеинемии) рекомендуют инфузионную терапию с введением дезинтоксикационных средств и препаратов для парентерального белкового питания.
Прогноз
Прогноз благоприятный при легкой и среднетяжелой форме инвазии. Возможно кратковременное возобновление некоторых клинических проявлений: миалгии, умеренных отеков, эозинофилии в анализах крови. При тяжелой форме с осложнениями прогноз серьезный: при поздней диагностике и запоздалом противопара-зитарном лечении возможен летальный исход; при злокачественном течении он может наступить уже в первые дни болезни.
Примерные сроки нетрудоспособности
Трудоспособность восстанавливается в течение 2-6 мес, при тяжелой форме трихинеллеза - только через 6-12 мес.
Диспансеризация
Диспансеризацию переболевших осуществляют вpач-инфекционист или участковый терапевт в течение 6 мес и более, в зависимости от тяжести течения и нали-
чия осложнений. Реконвалесцентов осматривают через 2 нед, 1-2 и 5-6 мес после выписки из стационара, обязательно выполняют клинический и биохимический анализы крови, а также ЭКГ переболевшим в тяжелой форме. Наличие изменений на ЭКГ и других остаточных проявлений - основание для того, чтобы продлить период наблюдения до 1 года.
23.3.6. Токсокароз
Токсокароз (лат. toxocarosis) - хронический тканевый гельминтоз, вызываемый миграцией личинок гельминта собак Toxocara canis в организме человека. Характеризуется рецидивирующим течением с поражением внутренних органов и глаз.
КОД ПО МКБ-10 В83.0 Висцеральная мигрирующая личинка. ЭТИОЛОГИЯ
Возбудитель токсокароза (аскарида собачья) относится к
типу Nemathelminthes классу Nematoda подотряду Ascaridata роду Toxocara. T. canis - раздельнополые нематоды, половозрелые особи которых достигают относительно больших размеров (длина самки 9-18 см, самца - 5-10 см). Яйца токсокары шаровидной формы, размером 65-75 мкм. Т. canis паразитирует у собак и других представителей семейства псовых.
В жизненном цикле данного гельминта выделяют циклы развития - основной и два вспомогательных. Основной цикл развития токсокар соответствует схеме «собака-почва- собака». После заражения собаки алиментарным путем в ее тонкой кишке из яиц выходят личинки, которые затем мигрируют подобно аскаридам в организме человека. После созревания самок токсокар в тонкой кишке собака с фекалиями начинает выделять яйца паразита. Такой тип развития гельминта осуществляется у щенков в возрасте до 2 мес. У взрослых животных личинки гельминта мигрируют в различные органы и ткани, где вокруг них образуются гранулемы. В них личинки длительное время сохраняют жизнеспособность, не развиваются, но периодически могут возобновлять миграцию.
Первый тип вспомогательного цикла характеризуется трансплацентарной передачей личинок токсокар плоду по схеме «окончательный хозяин (собака)-
плацента-окончательный хозяин (щенок)». Таким образом, родившийся щенок уже содержит гельминтов. Кроме того, щенки могут получить личинок при лактации.
Второй тип вспомогательного цикла происходит с участием паратенических (резервуарных) хозяев. Ими могут быть грызуны, свиньи, овцы, птицы, земляные черви. В их организме мигрирующие личинки не способны превращаться во взрослых особей. Однако при поедании резервуарного хозяина собакой или другим животным семейства псовых личинки, попадая в кишечник облигатного хозяина, развиваются во взрослых гельминтов.
Таким образом, широкому распространению токсокароза среди животных способствует совершенный механизм передачи возбудителя, при котором сочетаются прямой (заражение яйцами из окружающей среды), вертикальный (заражение плода личинками через плаценту), трансмаммарный (передача личинок с молоком) пути передачи и заражение через паратенических хозяев [1, 2, 3, 5, 6, 9].
Продолжительность жизни половозрелых особей в кишечнике основных хозяев составляет 4- 6 мес. Самка Т. canis откладывает более 200 тыс. яиц в сутки. Срок созревания яиц в почве (от 5 сут до 1 мес) зависит от температуры окружающей среды и влажности. В средней полосе России яйца токсокар могут сохранять жизнеспособность в почве в течение всего года.
ЭПИДЕМИОЛОГИЯ
Токсокароз - зооноз с фекально-оральным механизмом передачи возбудителя. Источник инвазии в синантропном очаге для людей - собаки, загрязняющие почву фекалиями, которые содержат яйца токсокар. Люди не могут быть источником инфекции, так как в организме человека взрослые особи паразита из личинок не образуются и яйца не выделяются. Человек
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
служит резервуарным, или парате-ническим, хозяином токсокар, являясь для паразита «биологическим тупиком».
Пораженность собак токсокарами в зависимости от пола, возраста, способа их содержания практически во всех районах очень высокая - до 40-50% и выше, а в сельской местности может достигать 100%. Наибольшую пораженность отмечают у щенков в возрасте 1-3 мес. Прямой контакт с собаками не играет существенной роли в заражении людей. Основные предпосылки передачи возбудителя - загрязненность почвы яйцами гельминта и контакт людей с ней. В настоящее время доказано значение геофагии в пораженности детей токсокарозом. Геофагия - пример прямого заражения возбудителями гельминтозов без участия каких-либо других факторов передачи, причем человек в этих случаях получает массивную инвазию, предопределяющую, как правило, тяжелое течение болезни. Отмечают высокую пораженность токсокарозом владельцев приусадебных, дачных земельных участков, огородов, а также людей, живущих во дворах, где выгуливают собак, что подтверждает роль бытового контакта с почвой при заражении яйцами токсо-кар. Яйца токсокар могут передаваться с овощами и столовой зеленью. Факторами передачи токсокар бывают контаминированная шерсть животных, вода, руки. Установлена роль тараканов в распространении гельминтоза: они поедают значительное количество яиц токсокар и выделяют в окружающую среду до 25% яиц в жизнеспособном состоянии.
Токсокароз распространен повсеместно. Установлена относительно высокая пораженность некоторых профессиональных групп. В группу риска входят: ветеринары, сотрудники собачьих питомников, охотники, находящиеся в тесном контакте с охотничьими собаками, продавцы овощных магазинов и рынков, постоянно контактирующие с немытыми овощами, земля на которых может быть заражена личинками токсокар, работники коммунальных служб. Люди заражаются токсокарозом в течение всего года, однако чаще заражение происходит в летне-осенний период, когда количество яиц в почве и контакт с ней максимальны. В РФ в 2015 г. зарегистрировано 2507 случаев токсокароза, что, вероятно, не отражает реальную
ситуацию по пораженности населения данным гельминтозом. МЕРЫ ПРОФИЛАКТИКИ
Профилактика включает соблюдение личной гигиены, обучение детей санитарным навыкам. Важны своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4-5 нед, а также беременных самок. Необходимо ограничивать численность безнадзорных собак, оборудовать специальные площадки для выгула. Следует проводить систематическую санитарно-просветительскую работу среди населения, сообщать информацию о возможных источниках инвазии и путях передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии: ветеринарные работники, владельцы домашних животных, персонал питомника служебных собак, землекопы и др. (СанПиН 3.2.3215-14, п. Х).
ПАТОГЕНЕЗ
T. canis - несвойственный человеку возбудитель гельминтоза, личинки которого никогда не превращаются во взрослых особей. Это возбудитель гельминтоза животных, способный в миграционной (ларвальной) стадии паразитировать у человека и вызывать заболевание, получившее название синдрома «Visceral larva migrans». Синдром характеризуется длительным рецидивирующим течением и полиорганными поражениями аллергической природы. В организме человека из яиц токсокар, попавших в рот, а затем в желудок и тонкую кишку, выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает; их окружает воспалительный инфильтрат, и образуются гранулемы. При интенсивной инвазии гранулематозное поражение тканей наблюдают в легких, поджелудочной железе, миокарде, ЛУ, головном мозге и других органах. Личинка в организме человека может выживать до 10
лет. Такая ее жизнеспособность связана с выделением маскирующей субстанции, способной защитить личинку от агрессии эозинофилов и антител хозяина. Личинки гельминта, находящиеся в тканях, под влиянием различных факторов периодически возобновляют миграцию, что обусловливает рецидивы заболевания. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Экскреторно-секреторные антигены живых и соматические антигены погибших личинок оказывают сильное сенсибилизирующее действие с развитием реакций ГНТ и ГЗТ, которые проявляются отеками, кожной эритемой, нарушением проходимости дыхательных путей. Определенное значение в патогенезе имеют иммунные комплексы «антигенантитело». Недостаточно изучены факторы, определяющие возникновение токсокароза глаз. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма. По сравнению с аскаридами и некоторыми другими гельминтами, T.
canis обладает наиболее сильным поливалентным иммуносупрессивным действием. Установлено, что при токсокарозе у детей уменьшается эффективность вакцинации и ревакцинации против кори, дифтерии и столбняка.
КЛИНИЧЕСКАЯ КАРТИНА
Выделяют две основные формы токсокароза - висцеральную и глазную. Некоторые исследователи предлагают подразделять токсокароз на следующие формы:
◊висцеральный токсокароз, включающий поражение дыхательной системы, пищеварительного тракта, мочеполовой системы, миокарда (редко);
◊токсокароз ЦНС;
◊токсокароз мышц;
◊токсокароз кожи;
◊токсокароз глаз;
◊диссеминированный токсокароз.
По степени выраженности клинических проявлений различают токсокароз манифестный и бессимптомный, а по длительности течения - острый и хронический.
Висцеральным токсокарозом болеют как дети, так и взрослые, однако у детей эта форма встречается намного чаще, особенно в возрасте от 1,5 до 6 лет. Клиническая картина токсокароза малоспецифична и имеет сходство с клиническими симптомами острой фазы других гельминтозов. Основные клинические проявления острого токсокароза - рецидивирующая лихорадка, легочный синдром, увеличение размеров печени, полиаденопатия, кожные проявления, эозино-филия крови, гипергаммаглобулинемия. У детей заболевание нередко развивается внезапно или после короткого продромального периода. Температура тела чаще субфебрильная (в тяжелых случаях инвазии - фебрильная), более выражена в период легочных проявлений. Отмечают разнообразного типа рецидивирующие высыпания на коже (эритематозные, уртикарные), возможно развитие отека Квинке, синдрома Маскла-Веллса (Muscle-Wells syndгomе) и др. Кожный синдром может сохраняться длительное время, иногда это основное клиническое проявление болезни. Обследование на токсокароз детей с диагнозом «экзема», проведенное в Нидерландах, показало, что среди них 13,2% имеют высокие титры специфических антител к токсокарам. У большинства зараженных, особенно у детей, умеренно увеличены периферические ЛУ. Поражение дыхательной системы встречается у 50-65% больных висцеральным токсокарозом и может выражаться в различной степени - от катаральных явлений до тяжелых астмоидных состояний. Особенно тяжело поражение протекает у детей раннего возраста. Возможны рецидивирующий бронхит, бронхопневмония. Больных беспокоят сухой кашель,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
частые приступы ночного кашля, заканчивающиеся иногда рвотой, в некоторых случаях появляется тяжелая экспираторная одышка, сопровождающаяся цианозом. Выслушивают рассеянные сухие и разнокалиберные влажные хрипы. Рентгенологически выявляют усиление легочного рисунка, картину пневмонии; часто определяют облаковидные инфильтраты, что в сочетании с другими клиническими симптомами (лихорадкой, ЛАП, гепатоспленомегалией, кожно-аллергическим синдромом, гиперэозинофильным лейкоцитозом) позволяет поставить диагноз синдрома Леффлера. Одна из наиболее серьезных проблем, связанных с токсокарозом, - его взаимосвязь с бронхиальной астмой. Показано, что у 20% больных атопической формой бронхиальной астмы, протекающей с гиперэозинофилией, выявляют антитела к токсокарозному антигену (Ig классов G и/или Е).
Гепатомегалию регистрируют у 40-80% больных. Печень при пальпации уплотненная, гладкая, часто напряженная, при этом примерно у 20% больных увеличена селезенка. Установлена предрасполагающая роль токсокар в развитии пиогенных абсцессов печени, которые бывают как единичными, так и множественными, располагаются в обеих долях печени. Абдоминальный синдром наблюдают в 60% случаев. Характерны боли и вздутие живота, тошнота, иногда рвота, диарея.
Вхронической стадии токсокароз протекает с обострениями и ремиссиями. После острого периода инвазия длительное время может протекать практически бессимптомно или субклинически. В хронической стадии даже в период ремиссии у детей сохраняются субфебрилитет, слабость, ухудшение аппетита, иногда похудание, полиаденопатия, увеличение печени, иногда кожно-аллергический синдром.
Вотдельных случаях токсокарозу сопутствует миокардит: описано развитие эндокардита Леффлера (эндокардит фибропластический пристеночный с эози-нофилией). Имеются сообщения об эозинофильных панкреатитах, о развитии нефротического синдрома. Личинки, обнаруженные в биоптатах мышечной ткани, подтверждают, что при токсокарозе поражаются мышцы. В тропических странах выявляют пиогенные миозиты, по-видимому, вызванные токсокарами.
Одно из главных и наиболее постоянных проявлений висцеральной формы ток-сокароза - длительная эозинофилия крови, вплоть до развития эозинофильно-лейкемоидных реакций. Относительный уровень эозинофилов, как правило, превышает 30%, а в отдельных случаях может достигать 90%. Общее количество лейкоцитов также повышается до 15-20×109/л, а в некоторых случаях - до 80× 109/л. Эозинофилия может сохраняться месяцами и даже годами. У детей нередко отмечают умеренную анемию. Характерны увеличение СОЭ, гипергаммаглобулинемия. При поражении печени повышены уровни билирубина и активности трансфераз.
При миграции личинок токсокар в головной мозг выявляют признаки поражения ЦНС (судороги типа «petit mal», эпилептиформные припадки). В тяжелых случаях регистрируют менингоэнцефалит, парезы и параличи, нарушения психики.
Описаны случаи диссеминированного токсокароза с одновременным поражением печени, легких и ЦНС у больных с иммунодефицитом (на фоне лучевой терапии, лечения глюкокортикоидами, при ВИЧ-инфекции и др.).
Глазной токсокароз чаще встречается у детей и подростков и редко сочетается с висцеральными поражениями. Наблюдаются два типа поражений - солитарные гранулемы и хронические эндофтальмиты с экссудацией. Характерно одностороннее поражение глаз с развитием хронического эндофтальмита, хориоретинита, иридоциклита, кератита, папиллита, косоглазия. Возможны кровоизлияния в сетчатку, поражение зрительного нерва, эозинофильные абсцессы цилиарного тела, панофтальмит, отслойка сетчатки. Наблюдаются также поражения личинками параорбитальной клетчатки, проявляющиеся периодическими отеками. При резком отеке может развиться экзофтальм. Количество эозинофилов в
периферической крови у больных токсокарозом глаз обычно нормальное или повышено незначительно.
Осложнения
Возможно нарушение функций жизненно важных органов (мозга, глаз и др.). В некоторых случаях вероятно развитие бронхиальной астмы. Глазной токсока-роз - одна из возможных причин потери зрения.
Летальность и причины смерти
Летальные исходы при токсокарозе редки, наблюдаются при массивной инвазии и связаны с миграцией личинок в миокард и важные в функциональном отношении участки ЦНС.
ДИАГНОСТИКА
Прижизненный паразитологический диагноз токсокароза возможен крайне редко и только при исследовании биопсионного материала, когда в тканях удается обнаружить и верифицировать личинки T. canis. Диагноз устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики. Учитывают наличие стойкой длительной эозинофилии, хотя в случаях глазного токсокароза она не является обязательным симптомом. Указание на содержание в семье собаки или на тесный контакт с собаками, геофагия свидетельствуют об относительно высоком риске заражения токсокарозом.
Иммунологические исследования направлены на определение специфических IgG к антигену T. canis методом ИФА, обладающим высокой чувствительностью и достаточной специфичностью при висцеральной локализации личинок - 93,7 и 89,3% соответственно, однако недостаточно информативны при поражениях глаз. Титр антител 1:400 свидетельствует об инвазированности, но не о болезни, о заболевании токсокарозом свидетельствует титр 1:800 и выше. У больных с хронической формой болезни с выраженным легочным синдромом уровень специфических антител, как правило, повышен умеренно (1:800; 1:1600), однако у этой группы больных закономерно выявляется повышенное содержание специфических противотоксокарных антител класса IgE. Для подтверждения результатов ИФА используется иммуноблотинг. Не всегда имеется прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза, так же как и корреляция между уровнем антител и гиперэозинофилией крови. В связи с циклическим течением инвазии с рецидивами и ремиссиями возможны значительные колебания в динамике клинических, гематологических и иммунологических показателей. В плане клинического исследования у больных токсокарозом рекомендуется проводить биохимический анализ крови, рентгенологическое исследование легких, по показаниям - бронхоскопию, бронхографию, ЭКГ, УЗИ органов брюшной полости. Надежных методов диагностики глазного токсокароза не существует. Во многих случаях диагноз выясняется только при гистологическом исследовании. В диагностических целях используют УЗИ и КТ глаза. Иногда диагноз может быть поставлен только на основании эффекта от проведенного курса противопарази-тарного лечения. Вопросы диагностики и лечения больных глазным токсокарозом должны решаться совместно врачами - офтальмологом и инфекционистом. Дифференциальная диагностика
Дифференциальную диагностику токсокароза следует проводить с ранней стадией гельминтозов, свойственных человеку (аскаридоз, стронгилоидоз, шистосо-мозы, описторхоз, фасциолез), бронхиальной астмой, а также с многочисленными заболеваниями, которые сопровождаются эозинофилией в периферической крови (синдром Леффлера, тропическая легочная эозинофилия при лимфатических филяриозах, хронический неспецифический полиартрит у детей, лимфогранулематоз, рак, медикаментозная сенсибилизация, пристеночный фибропластиче-ский миокардит и др.). Глазной токсокароз необходимо дифференцировать от ретинобластомы и хориоретинита туберкулезной,
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
цитомегаловирусной и другой этиологии. Надежных методов диагностики глазного токсокароза не существует. Во многих случаях диагноз ставят только при гистологическом исследовании. В диагностических целях используют УЗИ и КТ орбиты. Иногда диагноз можно поставить только на основании эффекта от проведенного курса противопаразитарного лечения.
Пример формулировки диагноза
В83.0 Хронический висцеральный токсокароз, среднетяжелое течение. Легочный синдром. ИФА 1:1600.
Показания к госпитализации
Лечение больных с тяжелой формой и детей до 3 лет проводят в стационаре. Больные токсокарозом неконтагиозны и в изоляции не нуждаются.
ЛЕЧЕНИЕ
Единой схемы этиотропной терапии токсокароза нет. Применяют противо-нематодозные препараты: албендазол, мебендазол, диэтилкарбамазин, ивермек-тин. Все перечисленные антигельминтные препараты эффективны в отношении
мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов. В зарубежных странах средствами выбора являются диэтилкарбамазин и ивермектин, которые в РФ не зарегистрированы и в аптечную сеть не поступают.
Албендазол назначают внутрь после еды в дозе 10-12 мг/кг в сутки в два приема (утром и вечером) в течение 10-14 дней. В процессе лечения препаратом необходимо выполнять контрольные анализы крови (возможность развития агрануло-цитоза) и биохимическое исследование (гепатотоксическое действие препарата). При небольшом повышении активности аминотрансфераз препарат не отменяют.
Мебендазол назначают внутрь по 200-300 мг/сут в 2-3 приема в течение 10-15 дней; проводят 2 цикла с интервалом 2 нед.
Диэтилкарбамазин (в РФ не зарегистрирован) назначают внутрь в дозе 3-4 мг/кг в сутки, курс лечения 21 день.
Ивермектин (в РФ не зарегистрирован) - схемы лечения уточняются.
Противопаразитарную терапию при глазном токсокарозе проводят по тем же схемам, что и при висцеральном токсокарозе. Показания к лечению определяют индивидуально, в зависимости от характера поражения глаз и с учетом возможных осложнений в результате лечения. До начала цикла лечения рекомендуют применять глюкокортикоиды в течение 1 мес (1 мг/кг преднизолона в сутки). Гранулемы удаляют микрохирургическими методами, для разрушения личинок токсокар в средах глаза используют лазеркоагуляцию.
Больным токсокарозом при лихорадке назначают жаропонижающие ЛС, для купирования аллергических проявлений - антигистаминные препараты, при наличии признаков бронхообструкции проводят бронхолитическую терапию.
При бессимптомном течении инвазии с низкими титрами специфических антител этиотропную терапию не проводят.
Прогноз
Прогноз при неосложненном токсокарозе благоприятный; при массивной инвазии и поражениях глаз - серьезный.
Примерные сроки нетрудоспособности
Сроки нетрудоспособности определяют индивидуально. Диспансеризация
Диспансерное наблюдение за переболевшими проводят врач-инфекционист или врачи общего профиля (терапевт, педиатр). Больные подлежат врачебному осмотру каждые 2 мес. Дополнительные исследования и консультации проводят по показаниям, в зависимости от клинических проявлений. Критериями эффективности лечения служат улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения. Диспансерное наблюдение устанавливают за лицами с низкими титрами противотоксокарных антител и при появлении у них клинических признаков болезни проводят специфическую терапию.
23.3.7. Дирофиляриозы
Дирофиляриозы - трансмиссивные зоонозные гельминтозы, возбудители которых - филярии рода Diroflaria, подрода Diroflaria (D. immitis и др.) и Nochtiella (D. repens и др.) при попадании в организм человека не завершают биологический цикл развития, но могут вызывать патологические изменения в тканях и органах в месте локализации [1, 2, 5].
В патологии человека основное значение имеет вид Diroflaria repens, вызывающий подкожный дирофиляриоз. Инвазия D. immitis, протекающая как сердечно-легочный дирофиляриоз, в Российской Федерации не регистрировалась [1, 2].
ДИРОФИЛЯРИОЗ, ВЫЗЫВАЕМЫЙ DIROFILARIA REPENS (ПОДКОЖНЫЙ ДИРОФИЛЯРИОЗ)
КОД ПО МКБ-10 В74.8 Другие виды филяриатоза. Этиология
Dirofilaria repens - нематода. Самка D. repens: тело сужено к концам, кутикула белая с четкой продольной и нежной поперечной исчерченностью. Длина тела половозрелой самки - 120150 мм, ширина - 0,48-0,55 мм. Самец - длиной 58,0-70,0 мм, максимальная ширина - 0,41 мм. Основной признак нематод рода Dirofilaria - наличие кутикулярной орнаментации в виде продольных гребней на поверхности тела гельминтов. При большом увеличении на теле дирофилярий просматривается также нежная поперечная исчерченность кольцевидной формы, благодаря которой D. repens могут активно продвигаться под кожей. Взрослые паразиты в организме окончательного хозяина (собак, кошек и других животных) находятся в подкожной соединительной ткани. Самка дирофилярии - живородящая, за сутки рождает до 30 тыс личинок. Микрофилярии D. repens имеют длину 0,22-0,29 мм, по ширине равны диаметру эритроцита. Микрофилярии циркулируют по кровеносным и лимфатическим сосудам, поэтому могут проникать в любые органы и ткани. Они не имеют чехлика, передний конец - закругленный, задний - заостренный, нитевидный. Ядерная колонка не доходит до вершины хвостового конца.
Цикл развития гельминта протекает при участии промежуточных хозяев - комаров разных видов. У собак после заражения при укусе комарами дирофи-лярии в течение 6 мес развиваются до половой зрелости и сохраняются в жизнеспособном состоянии до 2 лет. У человека после заражения примерно через 2 мес личинки превращаются в молодых, неполовозрелых дирофилярий размером 1-2 см, которые в
течение 3 мес активно мигрируют по подкожной клетчатке. В последующие 3 мес они превращаются во взрослых особей, оседающих под кожей в любых частях тела и в глазах. В организме человека их размножение, как правило, невозможно, хотя описаны единичные случаи обнаружения микро-филярий D. reρens в подкожной опухоли.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Эпидемиология
Дирофиляриоз, вызываемый Dirofilaria reρens, является распространенным гельминтозом животных - собак, кошек, волков, леопардов, виверры, которые являются их окончательными хозяевами. Промежуточными хозяевами и специфическими переносчиками дирофилярий служат комары разных родов [1, 2, 5]. На территории России подкожный дирофиляриоз является единственным трансмиссивным гельминтозом, передающимся практически всеми видами комаров - Culex, Anopheles, Aedes, Ochlerotatus, Culiseta, Coquillettidia. Развитие личинок диро-филярий до инвазивной стадии в переносчике происходит только при температуре воздуха выше +14 °С, оптимальная температура - +24 °С. Развитие паразита в теплокровном животном заканчивается за 193 дня. Из-за неактивности переносчика в холодное время года один оборот инфекции обязательно захватывает два последовательных сезона передачи.
Подкожный дирофиляриоз, вызываемый D. reρens, регистрируется в странах Азии, Африки, Северной и Южной Америки, Европы, в южных территориях Российской Федерации и в сопредельных странах - Украине, Беларуси, прибалтийских странах. С 1960-х гг. северная граница распространения этого гельминтоза в нашей стране переместилась с 40° с.ш. до 58° с.ш. в начале ХХI в. В последние годы участились местные случаи инвазии D. reρens людей в Московской, Тульской областях, что подтверждает расширение ареала дирофиляриоза в направлении северных регионов страны. Этому способствуют миграционные процессы людей и животных. Фактором увеличения частоты дирофиляриоза может быть также формирование синантропных очагов, где реализуется паразитарная система с передачей возбудителя в цепи: собака-комар-собака и человек. К началу 2014 г. на территории 42 субъектов РФ было зарегистрировано более 900 случаев подкожного дирофиляриоза у людей. Меры профилактики
Мероприятия по профилактике дирофиляриозов отражены в СанПиН 3.2.3215-14. Профилактика заражения человека и животных дирофиляриями основывается на прерывании трансмиссивной передачи инвазии: истреблении комаров, выявлении и дегельминтизации инвазированных домашних собак, предотвращении контакта комаров с домашними животными и человеком. Медицинскими работниками проводится разъяснительная работа с населением о профилактике дирофиляриоза с использованием средств массовой информации.
Клиника и патогенез
Инкубационный период - от 2 нед до 6 мес и более. Личинки D. reρens у человека вызывают образование узлов под кожей и слизистыми оболочками и могут локализоваться в области грудной клетки, живота, верхних и нижних конечностей, половых органов, а также в области лба, под кожей век, под конъюнктивой и реже - в глазном яблоке. Личинка в период от 1 мес до 2 лет от момента заражения превращается во взрослую особь, которая в организме человека может образовывать паразитарную опухоль, содержащую круглого гельминта диаметром 1-3 мм и длиной до 30-120 мм. Специфические симптомы у некоторых больных обусловлены миграцией на ранней стадии паразитирования гельминта (до образования
тонкостенной капсулы) и проявляются перемещением «опухоли» под кожей (до 30 см в сутки). Больные ощущают шевеление внутри уплотнения. Опухолевидные образования могут подвергаться нагноению с развитием абсцессов и регионарного лимфаденита. Почти у половины инвазированных наблюдается поражение органа зрения, обычно в области конъюнктивы век. Отмечаются слезотечение, блефаро-спазм, гиперемия кожи век, чувство инородного тела в глазу. Снижение остроты зрения бывает только в случаях поражения глазного яблока. Редкая локализация паразита внутри глазного яблока сопровождается отслойкой сетчатки. В случаях локализации гельминта в глазнице возникает воспаление глазничной клетчатки, приводящее к экзофтальму и ограничению подвижности глазного
яблока. При локализации дирофилярий в половых органах возникают боли, гиперемия и отек кожи. Описаны единичные случаи дирофиляриоза легких, вызванных D. reρens, у жителей Средиземноморья и южных областей РФ. Иногда наблюдаются общие симптомы инвазии: головная боль, слабость, субфебрильная лихорадка, боли в месте локализации гельминта с иррадиацией по ходу нервных стволов. Эозинофилия в крови, в отличие от многих других гельминтозов, при подкожном дирофиляриозе практически не наблюдается.
Диагностика
Выявление случаев инвазии D. reρens обычно происходит случайно. Диагноз устанавливается по клинико-эпидемиологическим данным и подтверждается при извлечении гельминта из узла хирургическим путем (МУК 4.2.3145-13). В лабораторию доставляются следующие объекты для исследований: взрослые дирофиля-рии или их фрагменты, выделенные хирургическим путем или самопроизвольно вышедшие из пораженных тканей, гистологические препараты внутренних органов и тканей, кровь, пунктаты подкожных опухолей, удаленные подкожные опухоли, гранулемы, кисты, цисты и другие патологические образования. Разработаны методы ИФА для выявления соматических антигенов гельминтов, а также методы на основе ПЦР, позволяющие дифференцировать виды дирофилярий - D. reρens и D. immitis, в частности в очагах, где среди животных регистрируется инвазия обоими видами гельминтов.
Дифференциальная диагностика
Дифференциальную диагностику проводят с опухолями: фиброма, атерома, киста и др. При поражении глаз необходимо дифференцировать с токсокарозом, цистицеркозом, конъюнктивитами, иридоциклитами другой этиологии.
Показания к консультации других специалистов
В зависимости от локализации поражений необходимы консультации хирурга и офтальмолога.
Лечение
Лечение хирургическое. Необходимо гельминта (часто обнаруживают одну особь паразита) удалить полностью. Прогноз
Обычно благоприятный.
Глава 24. Болезни, вызываемые членистоногими
Педикулез
Педикулез - паразитарная антропонозная болезнь с контактным механизмом передачи возбудителя, основным симптомом которой является кожный зуд. Синоним заболевания - вшивость.
Коды по МКБ-10
В85 Педикулез и фтириаз.
В85.0 Педикулез, вызванный Pediculus humanus capitis.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
В85.1 Педикулез, вызванный Pediculus humanus corporis.
В85.2 Педикулез неуточненный.
В85.3 Фтириаз.
В85.4 Педикулез, сочетанный с фтириазом.
Этиология
Возбудителей относят к роду Anoplura, семейству Pediculidae. Вши - облигатные кровососущие эктопаразиты. Головная вошь, Pediculus (humanus) capitis, обитает на волосистой части головы; платяная, Pediculus (humanus) corporis (vestimenti), - на белье и одежде; лобковая (площица), Phthirus pubis, - на волосах лобка, подмышек, бороды, усов, туловища, бровей. Вши живут и размножаются при температуре окружающей среды 2830 °С, ниже 15 °С откладывание яиц прекращается. Головная и лобковая вши откладывают яйца (гниды) на волосы на расстоянии 1-3 мм от поверхности кожи, платяная вошь прикрепляет яйца к волокнам ткани вблизи швов. Через 5-12 дней из яиц выходит кровососущая личинка (нимфа), которая после трех линек превращается в половозрелую особь (имаго). Жизненный цикл возбудителя 16 сут. Продолжительность жизни взрослой особи 30-40 сут (максимально 60 сут).
Эпидемиология
Источник паразита - зараженные люди. Путь передачи контактный. Миграция вшей усиливается при снижении (если источник возбудителя - труп) или повышении температуры тела (источник возбудителя - лихорадящий человек). Заражение происходит при контактах в транспорте, коллективах (детские учреждения), в семьях при проживании в антисанитарных условиях, пользовании общими вещами (постельное и нательное белье). Заражение фтириазом происходит практически всегда при половых контактах: это одно из наиболее распространенных заболеваний, передающихся таким путем.
Восприимчивость высокая; у представителей белой расы выше, чем у чернокожих. Педикулез распространен повсеместно, платяной - преимущественно в странах с низким уровнем санитарной культуры. Платяные вши являются переносчиком возбудителей эпидемического сыпного и возвратного тифов.
Меры профилактики
Неспецифические
К ним относят соблюдение общих правил личной гигиены, смену нательного и постельного белья не реже одного раза в неделю, систематическое мытье и расчесывание волос, гигиену половых органов. При платяном педикулезе проводят мероприятия по борьбе со вшами:
белье и одежду подвергают кипячению или камерной дезинфекции. Одежду и постельные
принадлежности, не подлежащие стирке и камерной дезинфекции, обрабатывают инсектицидами.
Патогенез
Нанося укус, вошь впрыскивает в ранку вещества, вызывающие зуд. Расчесывание мест укусов приводит к экзематизации кожи и присоединению вторичной инфекции. Зуд нарушает сон и вызывает невротические состояния, особенно у детей.
Клиническая картина
Инкубационный период при заражении половозрелой особью составляет 6-12 дней.
Классификация
Различают педикулез туловища, головной и лобковый педикулез (фтириаз).
Основные симптомы и динамика их развития
Клиническая картина зависит от интенсивности инвазии. При небольшом числе паразитов и низкой чувствительности кожи зараженные могут долгое время не предъявлять жалоб. Главный субъективный симптом - зуд в области головы, туловища или лобка, в зависимости от вида паразита. При головном педикулезе в процессе осмотра выявляют импетигинозные очаги, покрытые желтой ("медовой") коркой, фолликулиты, участки экзематизации кожи, особенно в области затылка, висков, заушных складок. Нередко обнаруживают лимфаденит. В запущенных случаях наблюдают образование колтуна - спутанных и склеенных гнойным экссудатом волос. При платяном педикулезе поражаются участки кожи, плотно соприкасающиеся с одеждой (к ним относятся плечи, верхняя часть спины, аксиллярные впадины, шея, реже - живот, поясница, бедренно-паховая область). В местах укусов платяных вшей возникают уртикарно-папулезные высыпания с последующей синюшностью, гиперпигментацией кожи и частым присоединением вторичной пиодермии (эктимы). При хроническом педикулезе кожа утолщается, приобретает бурую окраску (меланодермия), шелушится. Заметны беловатые рубчики после гнойничковых поражений, осложнивших расчесы. Эти изменения кожи обозначают как "болезнь бродяг". При фтириазе зуд незначительный. В местах укуса лобковой вши возникают стойкие серовато-голубоватые округлые или овальные пятна диаметром до 1 см (голубые пятна, maculae coeruleae).
иагностика
Клиническая диагностика
Клиническая диагностика основана на сборе анамнеза (жалобы больного на зуд) и тщательном осмотре пациента. Головных вшей обнаруживают при вычесывании волос (лучше над листом белой бумаги), гнид находят у корней, их оболочки - по ходу волос. Возбудителей легко обнаружить в складках нательного белья или одежды, которая соприкасается с кожей. Площицы видны как серовато-бурые точки у корней волос, здесь же расположены мелкие беловатые плотные гниды. Лиц, больных фтириазом, нужно обследовать для выявления заболеваний, передающихся половым путем (обнаруживают у 30% пациентов).
Дифференциальная диагностика
Проводят с крапивницей, нейродермитом, экземой.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Пример формулировки диагноза с учетом МКБ-10
В85.1 Педикулез, вызванный платяной вошью, вторичная пиодермия.
Медикаментозная терапия
Лечение амбулаторное. При головном педикулезе используют малатион (1% шампунь или 0,5% лосьон) и перметрин, при лобковом педикулезе - перметрин (Медифокс♠ 5% концентрат для приготовления эмульсии и Медифокс♠ 20% эмульсия).
Трудоспособность не нарушается.
Диспансеризация
Не проводят.
Чесотка
Чесотка (scabies) - антропонозная клещевая болезнь, поражающая роговой слой эпидермиса, с контактным механизмом передачи возбудителя.
Код по МКБ-10
● В86 Чесотка.
Этиология
Возбудитель - паразитический чесоточный клещ Sarcoptes scabiei hominis. Размеры женской особи: длина 0,3 мм и ширина 0,25 мм; самцы вдвое меньше. После оплодотворения самка проникает под роговой слой эпидермиса с помощью кератолитического секрета и прокладывает там ходы на границе с зернистым слоем, куда откладывает яйца. Через 3- 5 дней из них появляются личинки, проходящие несколько стадий развития на поверхности кожи. Скорость продвижения самки в ходе - 0,5-2,5 мм/сут. Продолжительность жизни
половозрелых особей в организме 40-60 дней, в окружающей среде при температуре 8-14 °С - до 3 нед, при 18-20 °С - 2-3 дня, при 60 °С - примерно 1 ч. Чаще всего одновременно паразитирует 5-7 клещей, при норвежской чесотке - тысячи и миллионы.
Эпидемиология
Резервуар и источники возбудителя - зараженный человек. Нелеченый больной представляет собой эпидемиологическую опасность в течение всего периода заболевания. Заражение происходит при прямом контакте (например, при рукопожатии, прикосновении), чаще всего в постели с источником либо через вещи, зараженные клещами (особенно одежду, постельные принадлежности, перчатки). Естественная восприимчивость высокая. Наибольшей инвазивностью обладают личинки. Постинвазионный иммунитет отсутствует. Болезнь распространена повсеместно. Вспышки возникают в осенне-зимнее время, в условиях скученности, миграции населения, стихийных бедствий (семьи, закрытые коллективы).
Меры профилактики
Профилактика направлена на развитие навыков личной гигиены и повышение качества жизни в санитарно-эпидемиологическом аспекте. Больных госпитализируют, одежду и белье подвергают камерной дезинсекции или дезинфекции. Лиц, контактировавших с источниками инфекции, совместно обследуют инфекционист и дерматолог.
Патогенез
Экскременты, оставляемые паразитом во внутрикожных ходах, вызывают аллергическую реакцию. При нарушениях в иммунной системе идет генерализация процесса с развитием норвежской чесотки.
Клиническая картина
Период от проникновения возбудителя в кожу до появления первых признаков заболевания чаще всего составляет 7-14 дней (возможна продолжительность до 6 нед).
Основные симптомы:
▪зуд (особенно интенсивный ночью, в период наибольшей активности клеща);
▪чесоточные ходы с характерной локализацией на коже;
▪другие поражения кожи с характерной локализацией.
На боковых поверхностях пальцев и кистей, в межпальцевых складках заметны слегка возвышающиеся прямые или изогнутые линии беловатого или грязно-серого цвета длиной от 1 мм до 1 см - чесоточные ходы. На переднем (слепом) конце хода часто виден пузырек - место расположения клеща. Сам возбудитель может выглядеть как черная точка. В покрышке чесоточного хода самка делает отверстия - "вентиляционные шахты". На коже живота, боковой поверхности груди, молочных желез, мошонки, полового члена, бедер, ягодиц, поясничной области рассеяны множественные розовые узелки и папуловезикулезные элементы диаметром 1-3 мм, нередко с геморрагической корочкой на верхушке. На локтях часто возникают наслоения гнойно-кровянистых корок (симптом Арди). У детей, особенно раннего возраста, чесоточные ходы бывают на коже ладоней и подошв. К атипичным формам относят стертую и норвежскую чесотку. Последняя может встречаться при психических заболеваниях и иммунодефиците (у больных ВИЧ-инфекцией, наркоманов). Симптомы норвежской чесотки - массивная инвазия, распространенность поражения, формирование в типичных местах бурых корок толщиной до 2-3 см, частое присоединение пиодермии, возможна эозинофилия.
Осложнения
Пиодермия, лимфаденит, экзема.
Диагностика
Диагноз устанавливают на основании жалоб на кожный зуд, обнаруженных при осмотре типичных чесоточных ходов с пузырьком в его конце.
Метод специфической лабораторной диагностики - микроскопическое исследование клеща, изъятого с помощью иглы с конца чесоточного хода. Также возможно проведение щелочного препарирования: кожу обрабатывают 10% раствором щелочи с последующим исследованием соскоба мацерированного эпидермиса.
Дифференциальная диагностика
Дифференциальный диагноз проводят с псевдочесоткой, акариазом, нейродермитом, экземой, почесухой, токсикодермией, крапивницей.
Показания к консультации других специалистов
Консультация дерматолога.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
Пример формулировки диагноза
В86 Чесотка, вторичная сухая экзема.
Показания к госпитализации
Больные госпитализируются по эпидемиологическим показаниям. Специального режима и диеты не требуется.
Медикаментозная терапия
Перметрин (Медифокс♠) 5% эмульсия, крем; бензилбензоат 20% эмульсия, мазь 10%, 20%; пиперонилбутоксид + эсбиол (Спрегаль♠, Франция) - аэрозоль для наружного применения, сера (Серная мазь♠) 33%.
Болезнь не угрожает жизни пациента, без лечения длится годами. Трудоспособность не нарушается, после завершения лечения пациент может приступить к работе.
Диспансеризация
Диспансеризацию не проводят.
Памятка для пациента
Чесотка - распространенная болезнь. Вызывается очень маленьким, видимым только через лупу клещом, который паразитирует в коже и вызывает нестерпимый зуд. Клещ может передаваться при контакте с больным, во время полового акта, при пользовании предметами обихода и одеждой больного, при проезде в общественном транспорте, в местах скопления людей (рынки, зрелищные мероприятия). При появлении зуда кожи, зудящих высыпаний необходимо обратиться к врачу-инфекционисту или дерматовенерологу, которые при наличии чесотки назначают эффективное лечение.
Тунгиоз
Тунгиоз - паразитарная болезнь, вызываемая песчаной блохой, характеризуется развитием аллергической реакции, болезненностью и эритематозной папулой.
Код по МКБ-10
● В88.1 Тунгиоз (инвазия песчаной блохой).
Этиология
Возбудитель - песчаная блоха, Tunga penetrans. Паразитирует в коже, питаясь кровью. Яйца выделяет в окружающую среду. Первоначальный размер половозрелой блохи - 1 мм, в коже достигает 1 см.
Эпидемиология
Резервуар и источники возбудителя - теплокровные животные и человек. Период контагиозности не определен. Болезнь распространена в Южной Азии, Южной и Центральной Америке, Африке. Заражение происходит при хождении босиком по песку, лежании на пляже. Оплодотворенная самка совершает прыжки высотой до 35 см до тех пор, пока не внедрится в кожу теплокровного животного или человека.
Профилактика
Ношение закрытой обуви, применение репеллентов.
Патогенез
Обусловлен раздражающим действием экскретов паразита и сдавлением окружающих тканей растущей блохой. После гибели и отторжения паразита наступает репарация тканей.
Клиническая картина
Поражаются чаще стопы и голени. В месте внедрения блохи видна черная точка, затем красная болезненная папула. Проникновение блохи в подногтевое пространство вызывает резкую боль, часто зуд, аллергические высыпания на коже.
Осложнения
Вторичная гнойная инфекция, столбняк, анаэробная газовая инфекция.
Диагностика
Визуальное обнаружение отверстия в месте внедрения паразита в эпидермис.
Дифференциальный диагноз
Аллергические дерматиты, укусы насекомых.
Формулировка диагноза
В88.1 Тунгиоз правой стопы.
Лечение
Удаление блохи хирургическим путем, аппликация мазей с инсектицидами.
Миазы
Миаз - инвазия личинками некоторых видов мух и оводов; характеризуется полиморфизмом клинических проявлений в зависимости от локализации паразита.
Коды по МКБ-10
●В87 Миаз.
●В87.0 Кожный миаз.
●В87.1 Раневой миаз.
●В87.2 Глазной миаз.
●В87.3 Носоглоточный миаз.
●В87.4 Миаз уха.
●В87.8 Миаз других локализаций. Миаз мочеполовой, миаз кишечный.
●В87.9 Миаз неуточненный.
Книга в списке рекомендаций к покупке и прочтению сайта https://meduniver.com/
