- •САмостійна робота № 1
- •Загальні методичні вказівки Класифікація органічних сполук.
- •Типи органічних реакцій.
- •Алкани, циклоалкани в природі та техніці.
- •Дієнові вуглеводні, їх характеристика.
- •Багатоядерні ароматичні вуглеводні з ізольованими бензольними ядрами.
- •Нафта, її переробка та склад.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 2
- •Загальні методичні вказівки Похідні вуглеводнів. Ізомерія та номенклатура.
- •Фізичні та хімічні властивості похідних вуглеводнів.
- •Фторпохідні органічні сполуки. Добування та застосування.
- •Основні представники галогенопохідних, їх застосування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 3
- •Загальні методичні вказівки Феноли та нафтоли.Ізомерія і номенклатура.
- •Засоби добування та властивості фенолів та нафтолів.
- •Прості ефіри – номенклатура, ізомерія, властивості.
- •Основні представники. Епоксиди.
- •Етилен оксид в харчовій промисловості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 4
- •Загальні методичні вказівки Кетони – ізомерія, номенклатура.
- •Властивості та добування кетонів.
- •Окремі представники, їх характеристика.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 5
- •Загальні методичні вказівки Двоосновні карбонові кислоти – ізомерія та номенклатура.
- •Властивості, добування та застосування двоосновних карбонових кислот.
- •Мурашина та оцтова кислота, їх характеристика та добування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 6
- •Загальні методичні вказівки Похідні карбонових кислот,їх характеристика.
- •Галогенангідриди –номенклатура, засоби добування та властивості.
- •Ангідриди карбонових кислот –добування, властивості.
- •Окремі представники: оцтовийта фталевий ангідриди.
- •Пероксиди, їх характеристика.
- •Складні ефіри –властивості,добування.
- •Мила, їх властивості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 7
- •Загальні методичні вказівки Дубильні речовини.
- •Галова кислота, її властивості.
- •Альдегідо- та кетонокислоти. Добування та номенклатура.
- •Окремі представники кетонокислот. Пировиноградна кислота.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 8
- •Загальні методичні вказівки Засоби добування нітросполук.
- •Нітробензол.
- •Аліфатичні діазосполуки.
- •Аміди кислот.
- •Сечовина, її властивості.
- •Нітрили кислот.
- •Акрилонітрил в хімічній промисловості
- •Органічні сполуки сірки.Застосування та добування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 9
- •Загальні методичні вказівки Важливі представники п’ятичленнихгетероциклів з одним гетероатомом.
- •Важливі представники п’ятичленних гетероциклів з двома гетероатомами.
- •Важливі представники шестичленних гетероциклів з одним гетероатомом.
- •Складні гетероциклічні сполуки, їх характеристика.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 10
- •Загальні методичні вказівки Методи досліджень ліпідів.
- •Добування та переробка жирів та масел.
- •Поверхнево-активні речовини.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 11
- •Загальні методичні вказівки Стереохімія моносахаридів.
- •Найважливіші представники моносахаридів, їх застосування у харчовій промисловості.
- •Таутомерія моносахаридів в розчинах.
- •Високомолекулярні полісахариди.
- •Крохмаль, його будова, властивості та застосування у харчовій промисловості.
- •Целюлоза, її будова, властивості та застосування у промисловості.
- •Глікоген, як тваринний крохмаль.
- •Пектинові речовини, їх властивості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 12
- •Загальні методичні вказівки
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 13
- •Загальні методичні вказівки Аденозинтрифосфорна кислота
- •Біосинтез білків
- •Терпени, їх характеристика, класифікація та властивості.
- •Біциклічні терпени.
- •Стероїди, їх властивості та роль в житті людини.
- •Гормони, їх властивості та роль в житті людини.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 15
- •Загальні методичні вказівки
- •Завдання для виконання самостійної роботи
- •Рекомендована література
САмостійна робота № 3
Тема: Феноли та нафтоли. Прості ефіри.
Повинні знати: ізомерію та номенклатуру фенолів та нафтолів, хімічні та фізичні властивості фенолів та нафтолів, застосування фенолів та нафтолів, ізомерію та номенклатуру простих ефірів, хімічні та фізичні властивості простих ефірів
Повинні вміти: писати ізомери та структурні формули фенолів, нафтолів та простих ефірів
План.
Феноли та нафтоли. Ізомерія і номенклатура.
Засоби добування та властивості фенолів та нафтолів.
Прості ефіри – номенклатура, ізомерія, властивості.
Основні представники. Епоксиди.
Етилен оксид в харчовій промисловості.
Загальні методичні вказівки Феноли та нафтоли.Ізомерія і номенклатура.
Феноли — органічні речовини, молекули яких містять гідроксильні групи —ОН, сполучені з вуглеводневими радикалами. Загальна назва фенолів — гідроксильні сполуки.
Ф е н о л и — це гідроксильні сполуки, в яких гідроксильна група сполучена безпосередньо з атомом вуглецю бензольного ядра. Найпростішим представником фенолів є гідроксибензол, або фенол, який має одну гідроксильну групу в бензольному ядрі:
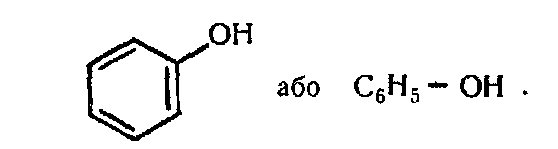
За кількістю гідроксильних груп розрізняють одноатомні, двохатомні та трьохатомні феноли. Двохатомні феноли мають три ізомери — орто-, мети- і пара-, що розрізняються розміщенням гідроксильних груп одна відносно одної.
Фенол — це безбарвна кристалічна речовина з характерним запахом, температура плавлення становить 40,9°С. На повітрі фенол частково окислюється, внаслідок чого набуває рожевого забарвлення. При потраплянні на шкіру викликає подразнення. Тривіальна назва фенолу — карболова кислота.
Нафталін, безбарвні кристали з характерним запахом. Добре розчинні в органічних розчинниках, погано – у воді. Переганяється з водяним паром.
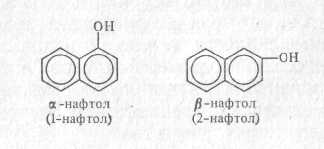
Першими називають феноли, а другими – нафтоли.

фенол о-кризол м-кризол п-кризол
(оскибензол) (2-окситолуол) (3-окситолуол) (4-окситолуол)
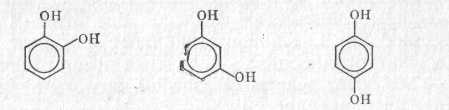
пірокатехін резорцин гідрохинон
(о-диксибензол) (м-диоксибензол) (п-диоксибензол)
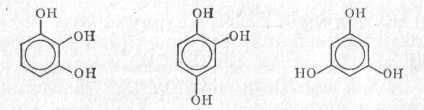
пірогалол оксігідрохинон флороглюцин
(1,2,3-триоксібензол) (1,2,4-триоксібензол) (1,3,5-триоксібензол)
Ізомерія фенолів та нафтолів пов’язана з різним положенням гідроксильних груп, будовою та положенням замісника. Феноли, крім цього, можуть бути ізомерні ароматичним спиртам.
Засоби добування та властивості фенолів та нафтолів.
Засоби добування.
Добування фенолу спільно з ацетоном (кумольний спосіб).
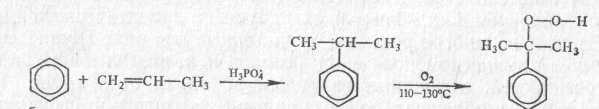
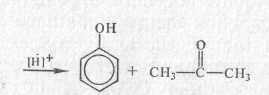
бензол пропілен ізопропілбензол гідроперекись фенол ацетон
(кумол) ізопропілбензол
Добування з бензолсульфокислот.
Добування фенолу парофазним каталітичним гідролізом бензолхлориду.
![]()
бензол хлорбензол фенол
Виділення з кам’яновугільної смоли.
С2Н5ОН
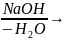 С6Н5ОNа
С6Н5ОNа
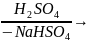 С6Н5ОН
С6Н5ОН
фенолят нарію фенол
Добування з солей відповідних сульфокислот та хлорфенолів двох - та багатоатомних фенолів і нафтолів.
Добування з солей діазонія.
С6Н5N2+Cі + Н2О → С6Н5ОН +N2 + НСІ
Фізичні властивості. Феноли і нафтоли – кристалічні речовини з характерним запахом, погано розчинні у воді. Відрізняються значно високою температурою кипіння порівнюючи з відповідними спиртами.
Хімічні властивості:
1.Взаємодія з лужними металами. Лужні метали реагують з фенолом з утворенням фенолятів і водню:
2C6H5OH+2Na 2C6H5ONa+H2
2C6H5ONa+H2
Феноляти є солями слабкої кислоти - фенолу. Вони розкладаються з утворенням фенолу під час пропускання крізь їх розчини оксиду вуглецю (IV) і оксиду сірки (IV), наприклад:
C6H5Na+CO2+H2O C6H5OH+NaHCO3
2. Взаємодія з лугами. Як слабка кислота фенол вступає до реакції нейтралізації з лугами, утворюючи феноляти:
C6H5OH+NaOH C6H5ONa+H2O
3. Взаємодія з галогенопохідними алканів приводить до утворення простих ефірів, наприклад:
C6H5OH+C2H5I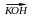 C6H5-O-C2H5+HI
C6H5-O-C2H5+HI
4. Реакція заміщення в бензольному ядрі. Ці реакції, як правило, відбуваються за механізмом електрофільного заміщення. Електрофільні частинки займають положення в бензольному ядрі з підвищеною електронною густиною (2,4 і 6-положення). Так, фенол дуже легко бромується бромною водою:

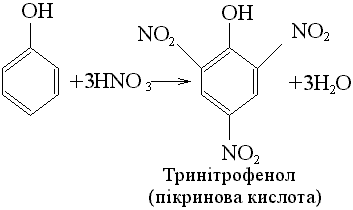
Фенол легко нітрується азотною кислотою:
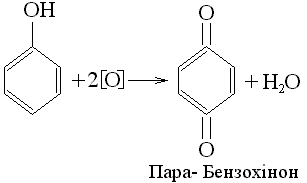
5. Окислення. Фенол досить легко окислюється. При взаємодії дихромату калія з концентрованою сірчаною кислотою утворюється пара-бензохінон: