
- •САмостійна робота № 1
- •Загальні методичні вказівки Класифікація органічних сполук.
- •Типи органічних реакцій.
- •Алкани, циклоалкани в природі та техніці.
- •Дієнові вуглеводні, їх характеристика.
- •Багатоядерні ароматичні вуглеводні з ізольованими бензольними ядрами.
- •Нафта, її переробка та склад.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 2
- •Загальні методичні вказівки Похідні вуглеводнів. Ізомерія та номенклатура.
- •Фізичні та хімічні властивості похідних вуглеводнів.
- •Фторпохідні органічні сполуки. Добування та застосування.
- •Основні представники галогенопохідних, їх застосування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 3
- •Загальні методичні вказівки Феноли та нафтоли.Ізомерія і номенклатура.
- •Засоби добування та властивості фенолів та нафтолів.
- •Прості ефіри – номенклатура, ізомерія, властивості.
- •Основні представники. Епоксиди.
- •Етилен оксид в харчовій промисловості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 4
- •Загальні методичні вказівки Кетони – ізомерія, номенклатура.
- •Властивості та добування кетонів.
- •Окремі представники, їх характеристика.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 5
- •Загальні методичні вказівки Двоосновні карбонові кислоти – ізомерія та номенклатура.
- •Властивості, добування та застосування двоосновних карбонових кислот.
- •Мурашина та оцтова кислота, їх характеристика та добування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 6
- •Загальні методичні вказівки Похідні карбонових кислот,їх характеристика.
- •Галогенангідриди –номенклатура, засоби добування та властивості.
- •Ангідриди карбонових кислот –добування, властивості.
- •Окремі представники: оцтовийта фталевий ангідриди.
- •Пероксиди, їх характеристика.
- •Складні ефіри –властивості,добування.
- •Мила, їх властивості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 7
- •Загальні методичні вказівки Дубильні речовини.
- •Галова кислота, її властивості.
- •Альдегідо- та кетонокислоти. Добування та номенклатура.
- •Окремі представники кетонокислот. Пировиноградна кислота.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 8
- •Загальні методичні вказівки Засоби добування нітросполук.
- •Нітробензол.
- •Аліфатичні діазосполуки.
- •Аміди кислот.
- •Сечовина, її властивості.
- •Нітрили кислот.
- •Акрилонітрил в хімічній промисловості
- •Органічні сполуки сірки.Застосування та добування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 9
- •Загальні методичні вказівки Важливі представники п’ятичленнихгетероциклів з одним гетероатомом.
- •Важливі представники п’ятичленних гетероциклів з двома гетероатомами.
- •Важливі представники шестичленних гетероциклів з одним гетероатомом.
- •Складні гетероциклічні сполуки, їх характеристика.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 10
- •Загальні методичні вказівки Методи досліджень ліпідів.
- •Добування та переробка жирів та масел.
- •Поверхнево-активні речовини.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 11
- •Загальні методичні вказівки Стереохімія моносахаридів.
- •Найважливіші представники моносахаридів, їх застосування у харчовій промисловості.
- •Таутомерія моносахаридів в розчинах.
- •Високомолекулярні полісахариди.
- •Крохмаль, його будова, властивості та застосування у харчовій промисловості.
- •Целюлоза, її будова, властивості та застосування у промисловості.
- •Глікоген, як тваринний крохмаль.
- •Пектинові речовини, їх властивості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 12
- •Загальні методичні вказівки
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 13
- •Загальні методичні вказівки Аденозинтрифосфорна кислота
- •Біосинтез білків
- •Терпени, їх характеристика, класифікація та властивості.
- •Біциклічні терпени.
- •Стероїди, їх властивості та роль в житті людини.
- •Гормони, їх властивості та роль в житті людини.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 15
- •Загальні методичні вказівки
- •Завдання для виконання самостійної роботи
- •Рекомендована література
Сечовина, її властивості.
Карбамід,або сечовина, є діамідом вугільної кислоти, його формула має вигляд
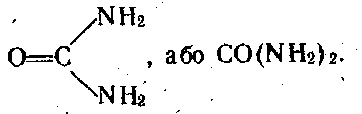
Це безбарвна кристалічна речовина, добре розчинна У воді. Під час нагрівання з розчинами кислот або лугів карбамід гідролізується:
![]()
Карбамід взаємодіє із спиртами, утворюючи уретани, наприклад, з етанолом утворюється етилуретан: .
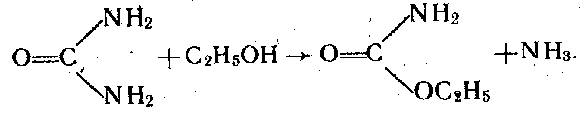
У промисловості карбамід добувають нагріванням аміаку з оксидом вуглецю (IV) при підвищеному тиску:
![]()
Сечовина є цінним азотним добривом, її також додають у корм худобі.
Сечовину використовують для добування пластмас — амінопластів шляхом сумісної поліконденсації з формальдегідом. Приблизна будова амінопластів:
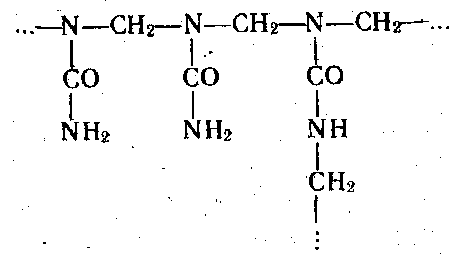
З уретанів добувають поліуретани, які використовують для виробництва пластмас, еластомерів, клеїв, герметизуючих речовин.
Нітрили кислот.
Нітрили,
або ціаніди,—
органічні сполуки складу
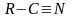 ,
де
— вуглеводневий радикал (аліфатичний
або ароматичний). Нітрили належать до
похідних карбонових кислот, від яких і
отримують назви. Приклади нітрилів
оцтової, акрилової та бензойної кислот:
,
де
— вуглеводневий радикал (аліфатичний
або ароматичний). Нітрили належать до
похідних карбонових кислот, від яких і
отримують назви. Приклади нітрилів
оцтової, акрилової та бензойної кислот:
![]()
Нітрилом мурашиної кислоти можна вважати синильну (ціановодневу) кислоту НСN.
Найпростіші нітрили — безбарвні рідини. Вони є добрими розчинниками органічних речовин.
Нітрили гідролізуються при наявності кислот або лугів, утворюючи аміди кислот або кислоти, наприклад:
![]()
або
![]()
Каталітичним гідруванням нітрилів можна добути аміни (первинні):
![]()
Для добування нітрилів звичайно використовують реакцію між галогенопохідними вуглеводнів і ціанідом калію КСN або натрію NаСN:
![]()
Як вихідну речовину для синтезу нітрилів можна використовувати аміди кислот, які віддають воду під дією водовідбирних речовин, наприклад Р2О5:
![]()
Акрилонітрил в хімічній промисловості
Акрилонітрил СН2=СН—СN — нітрил акрилової кислоти.. Це безбарвна рідина, розчиняється у воді. У промисловості акрилонітрил добувають у великих кількостях окислювальним амонолізом (дія аміаку і кисню) пропілену:
![]()
Менше значення має метод, заснований на приєднанні синильної кислоти до ацетилену:
![]()
Акрилонітрил — важливий мономер у синтезі багатьох полімерів. Полімеризацією його добувають поліакрилонітрил
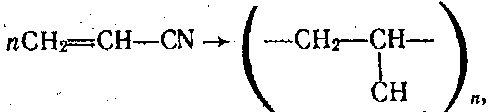
з якого виробляють синтетичне волокно нітрон. З цього волокна виготовляють синтетичні трикотажні тканини, хутра.
Важливе практичне значення мають різні співполімери акрилонітрилу: зі стиролом, метилметакрилатом, бутадієном. Співполімеризацією акрилонітрилу з бутадієном-1,3 добувають бутадієн-нітрильний каучук, до складу якого входить 20—40 % акрилонітрилу. З цих каучуків добувають стійку проти спрацювання та теплостійку гуму.
Органічні сполуки сірки.Застосування та добування.
Сірка і кисень, є елементами однієї і тієї ж групи періодичної системи, мають однакові властивості не тільки неорганічних сполук, але і органічних. Сірка відмінно від кисню в органічних сполуках проявляє різні валентності.
Типи органічних сполук сірки.
Назва |
Сполуки сірки |
Кисневмісні аналоги |
Тіоли (меркаптани) |
R –SH |
R – OH |
Сульфіди (тіоефіри) |
R – S – R |
R – O – R |
Дисульфіди |
R – S – S – R |
R – O – O – R |
Тіокетони |
R – C – R S |
R – C – R O |
Сульфенові кислоти |
R – S – OH
|
|
Сульфінові кислоти |
R – S – OH O
|
|
Сульфонові кислоти (сульфокислоти) |
O R – S – OH O |
|
Сульфоксиди |
R – S – R O |
|
Сульфони |
O R – S – R O |
|
Солі сульфонію |
R3S+Х- |
|
Тіоли. Дисульфіди. Тіоли (тіоспирти, меркаптани) – однозамісні органічні похідні сірководню. Вони володіють характерним, дуже нав’язливим запахом, більш сильним та неприємним, чим запах сірководню. Зустрічаються вони в рослинному та тваринному світі, наприклад пропантіол С3Н7SH – у свіженарізаній цибулі, бутантіол С4Н9SH – у виділеннях скунсу. Сірка входить до складу деяких білкових амінокислот та ферментів. У відмінності від спиртів та води тіоли та сірководень не ассоційовані, так як сірка не утворює водневих зв’язків. Тому вони значно гірше розчиняються у воді, чим у спирті та кип’ять при низьких температурах.
Тіоли добувають наступними способами.
По реакції алкілгалогенідів згідросульфідом натрію:
С2Н5Вr + NaSHС2Н5SH + NaBr
При пропусканні парів спирту та сірководню над нагрітим каталізатором (окись торію, 4500С):
ROH + Н2S RSH + Н2О
При взаємодії алкенів з сірководнем у кислому середовищі:
СН3
СН3
– С = СН2
+ Н2S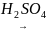 СН3
– С –SH
СН3
– С –SH
СН3 СН3
З тіосечовини та алкілгалогенідів у лужному середовищі:
NH2
RCl + S = C + 3NaOH RSH + 2NH3 + Na2CO3 + NaCl
\ NH2
Тіофеноли добувають з ароматичних діазосполук.
По хімічним властивостям тіоли подібні до сірководнів. Вони володієють більш вираженими кислотними властивостями, чим відповідні спирти: розчиняються у водних розчинах лугів, утворюючи солі – тіоляти (меркаптіди) R–SNa. З тяжкими металами утворюють нерозчинні тіоляти. Характерними є тіоляти ртуті:
2СН3SH + HgO (СН3S)2Нg + Н2О
Тіоли та спирти різно відносяться до окиснення. При окисненні спиртів збільшується ступень окиснення вуглецю, а не кисню. При окисненні тіолів в першу чергу окислюється сірка. В пом’якшених умовах утворюються дисульфіди.
Тіоефіри. Сульфоксіди. Сульфони. Тіоефіри (диалкілсульфіди) R –S – R – двузамісні органічні похідні сірководню. Їх можна добувати по реакції алкілгалогенідів з сульфідами або тіолятами лужних металів:
2СН3І + Na2SСН3 – С –СН3+ 2NaІ
С2Н5Вr +С2Н5SNaС2Н5–S – С2Н5 + NaBr
Тіоефіри – нейтральні рідини, які кип’ять вище, чим відповідні тіоли. Вони легко окислюються (Н2О2, СН3СООН) з утворенням сульфоксідів та сульфонів.
Представником диалкілсульфідів є β,β-дихлордіетилсульфід (іпріт), який використовували у першу світову війну в якості отруйних речовин шкіряно-наривної дії – СІСН2 – СН2 –S – СН2 – СН2СІ.
Діаллілдисульфід СН2 = СН – СН2 –S–S – СН2 – СН = СН2. Міститься у часнику, звідки і пішла назва аллільного радикалу. З часнику готують антибіотик алліцин – моносульфоксід діаллілдисульфіду:
СН2 = СН – СН2 –S–S – СН2 – СН = СН2
О
Сульфонові кислоти. Сульфохлориди. Сульфоновими кислотами або сульфокислотами, називають органічні сполуки, які містять у молекулі сульфогрупу – SО3Н (залишок сірчаної кислоти), яка пов’язана через сірку з вуглецевим радикалом. Аліфатичні сульфокислоти можна добути при енергійному окисленні тіолів, а також по реакції галогенопохідних з сульфітом натрію:
С2Н5І + Na2SО3С2Н5SО3Na + NaІ
етилсульфонат натрію
Під дією мінеральних кислот з солей можуть бути виділені вільні сульфокислоти.
Промислове значення має фотохімічне сульфохлорування алканів або циклоалканів: RH + SO2 + Cl2RSO2Cl + HCl
Отримані сульфохлориди при гідролізі утворюють сульфокислоти:
RSO2Cl + Н2О RSO2ОН + HCl
При дії лугів на сульфохлориди або вільні сульфокислоти легко утворюють солі – алкілсульфонати:
RSO2Cl + 2NaOHRSO2ОNa + NaCl + Н2О
RSO2ОН +NaOHRSO2ОNa +Н2О
Алкілсульфонати є добрими миючими речовинами, які мають перевагу перед натрієвими солями карбонових кислот. Ароматичні сульфокислоти добувають прямим сульфіруванням ароматичних вуглеводнів сірчаною кислотою. Реакція сульфірування – одна з характерних реакцій електрофільного заміщення у ароматичних сполук. Для сульфірування використовують концентровану сірчану кислоту або олеум.
Ароматичні сульфокислоти – кристалічні, гігроскопічні, добре розчинні у воді речовини. Часто сульфогрупу вводять у молекеулу органічної сполуки для підвищення його розчинності у воді. Це має велике практичне значення у промисловості барвників. Велике використання у виробництві органічних барвників знаходять сульфокислоти нафтолів, особливо β-нафтоли.
Барвники, отримані при участі хромотропової кислоти, дають різне забарвлення при контакті з різними протравами.
Сульфохлориди ароматичних кислот можна добути безпосереднім сульфохлоруванням ароматичних вуглеводнів хлорсульфонової кислоти (надлишок):
С6Н5
– СН3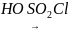 CН3
– С6Н4
–
SO2Cl
CН3
– С6Н4
–
SO2Cl
толуолсульфохлорид
З амміаком вони легко утворюють аміди сульфокислот – сульфаміди (сульфонаміди):
С6Н5 – SO2Cl + 2Н – NH2 С6Н5 – SO2– NH2+NH4Cl
Багато похідних сульфамідів є лікарськими та дезинфікуючими засобами.
