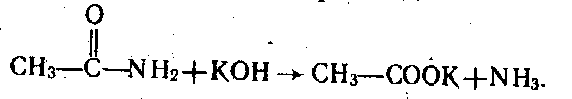- •САмостійна робота № 1
- •Загальні методичні вказівки Класифікація органічних сполук.
- •Типи органічних реакцій.
- •Алкани, циклоалкани в природі та техніці.
- •Дієнові вуглеводні, їх характеристика.
- •Багатоядерні ароматичні вуглеводні з ізольованими бензольними ядрами.
- •Нафта, її переробка та склад.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 2
- •Загальні методичні вказівки Похідні вуглеводнів. Ізомерія та номенклатура.
- •Фізичні та хімічні властивості похідних вуглеводнів.
- •Фторпохідні органічні сполуки. Добування та застосування.
- •Основні представники галогенопохідних, їх застосування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 3
- •Загальні методичні вказівки Феноли та нафтоли.Ізомерія і номенклатура.
- •Засоби добування та властивості фенолів та нафтолів.
- •Прості ефіри – номенклатура, ізомерія, властивості.
- •Основні представники. Епоксиди.
- •Етилен оксид в харчовій промисловості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 4
- •Загальні методичні вказівки Кетони – ізомерія, номенклатура.
- •Властивості та добування кетонів.
- •Окремі представники, їх характеристика.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 5
- •Загальні методичні вказівки Двоосновні карбонові кислоти – ізомерія та номенклатура.
- •Властивості, добування та застосування двоосновних карбонових кислот.
- •Мурашина та оцтова кислота, їх характеристика та добування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 6
- •Загальні методичні вказівки Похідні карбонових кислот,їх характеристика.
- •Галогенангідриди –номенклатура, засоби добування та властивості.
- •Ангідриди карбонових кислот –добування, властивості.
- •Окремі представники: оцтовийта фталевий ангідриди.
- •Пероксиди, їх характеристика.
- •Складні ефіри –властивості,добування.
- •Мила, їх властивості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 7
- •Загальні методичні вказівки Дубильні речовини.
- •Галова кислота, її властивості.
- •Альдегідо- та кетонокислоти. Добування та номенклатура.
- •Окремі представники кетонокислот. Пировиноградна кислота.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 8
- •Загальні методичні вказівки Засоби добування нітросполук.
- •Нітробензол.
- •Аліфатичні діазосполуки.
- •Аміди кислот.
- •Сечовина, її властивості.
- •Нітрили кислот.
- •Акрилонітрил в хімічній промисловості
- •Органічні сполуки сірки.Застосування та добування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 9
- •Загальні методичні вказівки Важливі представники п’ятичленнихгетероциклів з одним гетероатомом.
- •Важливі представники п’ятичленних гетероциклів з двома гетероатомами.
- •Важливі представники шестичленних гетероциклів з одним гетероатомом.
- •Складні гетероциклічні сполуки, їх характеристика.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 10
- •Загальні методичні вказівки Методи досліджень ліпідів.
- •Добування та переробка жирів та масел.
- •Поверхнево-активні речовини.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 11
- •Загальні методичні вказівки Стереохімія моносахаридів.
- •Найважливіші представники моносахаридів, їх застосування у харчовій промисловості.
- •Таутомерія моносахаридів в розчинах.
- •Високомолекулярні полісахариди.
- •Крохмаль, його будова, властивості та застосування у харчовій промисловості.
- •Целюлоза, її будова, властивості та застосування у промисловості.
- •Глікоген, як тваринний крохмаль.
- •Пектинові речовини, їх властивості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 12
- •Загальні методичні вказівки
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 13
- •Загальні методичні вказівки Аденозинтрифосфорна кислота
- •Біосинтез білків
- •Терпени, їх характеристика, класифікація та властивості.
- •Біциклічні терпени.
- •Стероїди, їх властивості та роль в житті людини.
- •Гормони, їх властивості та роль в житті людини.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 15
- •Загальні методичні вказівки
- •Завдання для виконання самостійної роботи
- •Рекомендована література
Аліфатичні діазосполуки.
Найпростішими та важливими представниками аліфатичних діазосполук є діазометан СН2N2. Аліфатичні діазосполуки мають іншу будову, чим ароматичні. Молекула діазометану має лінійну будову:
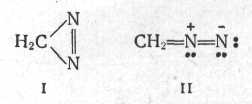
Добувають діазометан розкладанням ряду сполук, які містять групу СН3 – N – NO,
наприклад, дією лугу на N-нітрозо-N-метилацедамід:
СН3 – С – N – NO + NаОН СН3 – С – ОNа+ СН2N2 + Н2О
О СН3 О
Діазометан – жовтий газ, дуже небезпечний із-за своєї токсичності та вибуховості. Його використовують у виді розчинів у диетиловому ефірі. Завдяки високій реакційній здібності діазометан дає можливість здійснювати в пом’якшених умовах багато реакцій. Так на речовину кислотного характеру діазометан діє як метилуючий засіб:
СН3СООН + СН2N2 СН3СООСН3 +N2
С6Н5ОН + СН2N2 С6Н5 – ОСН3 +N2
Ні оцтову кислоту, ні фенол немає необхідності метилувати діазометаном – це можна здійсними, більш простими способами. Але для металування сполук, які розкладаються при нагріванні або дії кислот діазометан є ідеальним засобом.
Інша цікава здібність діазометану – вступати у реакції зі сполуками, які містять кратні зв’язки. Наприклад, з діазометану та етілену утворюється циклічна азотовмістна сполука піразолін, яка після розкладання дає циклопропан.
При дії діазометану на хлорангідриди кислот утворюються діазокетони:
О О
R – С – СІ + СН2N2 R – С – СН = N+= N- + НСІ
При нагріванні зі спиртами діазокетон утворює складний ефір, який має у кислотному радикалі на один атом вуглецю більше, чим взятий у реакцію хлорангідрид:
О
R
– С – СН = N+=
N- R
– СН2–
СООС2
Н5
+ N2
R
– СН2–
СООС2
Н5
+ N2
Таким чином за допомогою діазометану можна подовжити вуглецевий ланцюг карбонових кислот (синтез Арндта-Ейстерта).
Відомі інші представники ряду аліфатичних діазосполук, але вони не знайшли використання. Деяке значення має діазооцтовий ефір С2 Н5ОСОСНN2. Він стійкіший, чим діазометан, у часності може перегонятися у вакуумі та даже при атмосферному тиску. Вступає в ті самі реакції, що і діазометан.
Аміди кислот.
Аміди—азотовмісні похідні карбонових кислот, у яких гідроксил у карбонільній групі заміщений на аміно групу HN2. Загальна формула амідів кислот
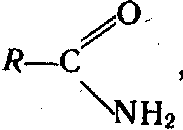
де
 —вуглеводневий
радикал. Приклади амідів мурашиної,
оцтової та пропіонової кислот:
—вуглеводневий
радикал. Приклади амідів мурашиної,
оцтової та пропіонової кислот:
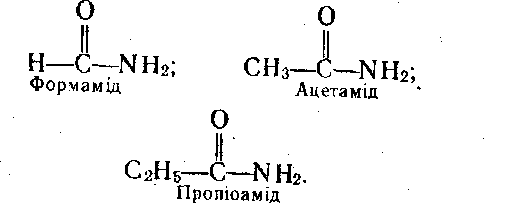
Аміди кислот – тверді речовини, за виключенням формаміду, який є рідиною; обмежено розчинні у воді, розчинність зменшується зі збільшенням молекулярної маси. Розчини мають нейтральну реакцію.
Найпростішим способом добування амідів є нагрівання амонійних солей карбонових кислот, наприклад:
![]()
У розчинах кислот і лугів аміди гідролізуються, утворюючи кислоти або їхні солі, наприклад: