
- •САмостійна робота № 1
- •Загальні методичні вказівки Класифікація органічних сполук.
- •Типи органічних реакцій.
- •Алкани, циклоалкани в природі та техніці.
- •Дієнові вуглеводні, їх характеристика.
- •Багатоядерні ароматичні вуглеводні з ізольованими бензольними ядрами.
- •Нафта, її переробка та склад.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 2
- •Загальні методичні вказівки Похідні вуглеводнів. Ізомерія та номенклатура.
- •Фізичні та хімічні властивості похідних вуглеводнів.
- •Фторпохідні органічні сполуки. Добування та застосування.
- •Основні представники галогенопохідних, їх застосування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 3
- •Загальні методичні вказівки Феноли та нафтоли.Ізомерія і номенклатура.
- •Засоби добування та властивості фенолів та нафтолів.
- •Прості ефіри – номенклатура, ізомерія, властивості.
- •Основні представники. Епоксиди.
- •Етилен оксид в харчовій промисловості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 4
- •Загальні методичні вказівки Кетони – ізомерія, номенклатура.
- •Властивості та добування кетонів.
- •Окремі представники, їх характеристика.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 5
- •Загальні методичні вказівки Двоосновні карбонові кислоти – ізомерія та номенклатура.
- •Властивості, добування та застосування двоосновних карбонових кислот.
- •Мурашина та оцтова кислота, їх характеристика та добування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 6
- •Загальні методичні вказівки Похідні карбонових кислот,їх характеристика.
- •Галогенангідриди –номенклатура, засоби добування та властивості.
- •Ангідриди карбонових кислот –добування, властивості.
- •Окремі представники: оцтовийта фталевий ангідриди.
- •Пероксиди, їх характеристика.
- •Складні ефіри –властивості,добування.
- •Мила, їх властивості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 7
- •Загальні методичні вказівки Дубильні речовини.
- •Галова кислота, її властивості.
- •Альдегідо- та кетонокислоти. Добування та номенклатура.
- •Окремі представники кетонокислот. Пировиноградна кислота.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 8
- •Загальні методичні вказівки Засоби добування нітросполук.
- •Нітробензол.
- •Аліфатичні діазосполуки.
- •Аміди кислот.
- •Сечовина, її властивості.
- •Нітрили кислот.
- •Акрилонітрил в хімічній промисловості
- •Органічні сполуки сірки.Застосування та добування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 9
- •Загальні методичні вказівки Важливі представники п’ятичленнихгетероциклів з одним гетероатомом.
- •Важливі представники п’ятичленних гетероциклів з двома гетероатомами.
- •Важливі представники шестичленних гетероциклів з одним гетероатомом.
- •Складні гетероциклічні сполуки, їх характеристика.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 10
- •Загальні методичні вказівки Методи досліджень ліпідів.
- •Добування та переробка жирів та масел.
- •Поверхнево-активні речовини.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 11
- •Загальні методичні вказівки Стереохімія моносахаридів.
- •Найважливіші представники моносахаридів, їх застосування у харчовій промисловості.
- •Таутомерія моносахаридів в розчинах.
- •Високомолекулярні полісахариди.
- •Крохмаль, його будова, властивості та застосування у харчовій промисловості.
- •Целюлоза, її будова, властивості та застосування у промисловості.
- •Глікоген, як тваринний крохмаль.
- •Пектинові речовини, їх властивості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 12
- •Загальні методичні вказівки
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 13
- •Загальні методичні вказівки Аденозинтрифосфорна кислота
- •Біосинтез білків
- •Терпени, їх характеристика, класифікація та властивості.
- •Біциклічні терпени.
- •Стероїди, їх властивості та роль в житті людини.
- •Гормони, їх властивості та роль в житті людини.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 15
- •Загальні методичні вказівки
- •Завдання для виконання самостійної роботи
- •Рекомендована література
Властивості та добування кетонів.
Властивості. Простіші кетони є безбарвними рідинами, які розчиняються у воді. Вищі кетони — тверді речовини.
Багато які хімічні властивості, характерні для альдегідів, виявляються і у кетонів.
Реакції приєднання. Так само, як і альдегіди, кетони приєднують речовини, що містять нуклеофільні частинки, наприклад ціановодень і гідросульфіт натрію:
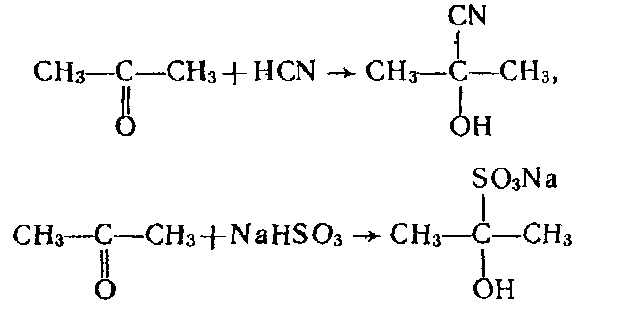
Гідрування кетонів при наявності каталізаторів приводить до утворення вторинних спиртів:
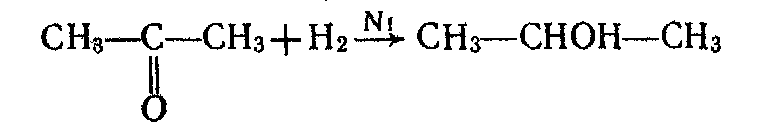
На відміну від альдегідів кетони не взаємодіють із спиртами, не вступають у реакції конденсації і полімеризації.
2. Окислення. Кетони окислюються значно важче, ніж альдегіди, і тільки сильними окиснювачами. Під час окислення кетонів відбувається розрив (деструкція) вуглецевого ідрокс і утворюється суміш продуктів. Кетони не вступають у реакцію срібного дзеркала.
3. Заміщення кисню карбонільної групи. Так само, як і в альдегідах, атом кисню в молекулі кетону може бути заміщений дією галогенідів фосфору (РСl5, РВr5) або ідроксил аміну NН2ОН:

У першій реакції утворюється дигалогенопохідна алкану, в другій — оксим.
Взаємодія з галогенами. Як і альдегіди, кетони легко реагують з хлором і бромом. Атом водню, сполучений з одним із атомів вуглецю, сполученим з карбонільною групою, заміщується на галоген:
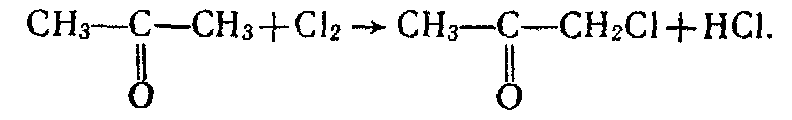
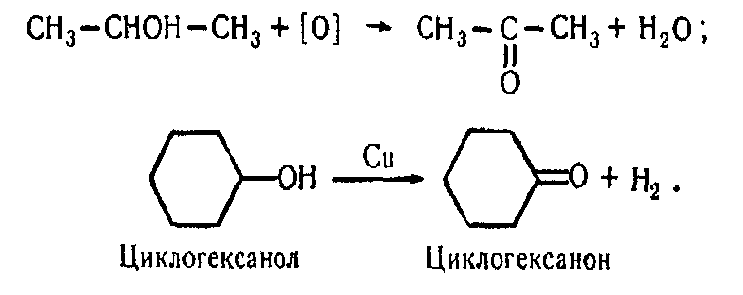
Добування.1. Кетони утворюються під час окислення або каталітичного дегідрування вторинних спиртів, наприклад:
Каталітичне дегідрування проводять з використанням мідних каталізаторів.
2. Як і альдегіди, кетони можна добути гідролізом дигалогенопохідних алканів. Щоб утворився кетон, обидва атоми галогену у вихідній сполуці повинні знаходитись біля одного (не кінцевого) атома вуглецю:
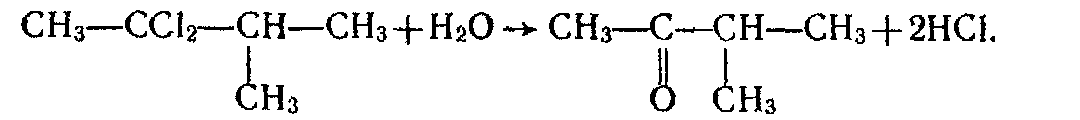
3. Кетони утворюються внаслідок приєднання води до гомологів ацетилену при наявності каталізаторів — солей ртуті (II), наприклад:
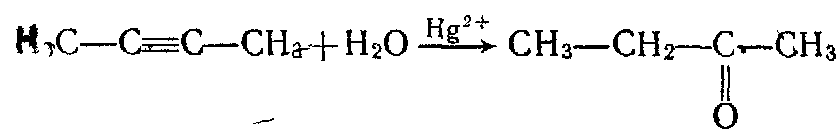
Окремі представники, їх характеристика.
Ацетон (пропанон, диметилкетон) — безбарвна рідина з характерним запахом. Температура кипіння ацетону 56,2°С. Добре розчиняється у воді і сам є розчинником органічних сполук, таких як для лаків, кіплівок, штучного ацетатного волокна, ацетилену. Використовують для снтезу хлороформу, йодоформу, кетену та ін..
Ацетон — важливий продукт хімічної промисловості. Його добувають разом з фенолом кумольним методом.Інший промисловий спосіб полягає в гідратації пропілену до утворення спирту з наступним його каталітичним дегідруванням або окисленням:
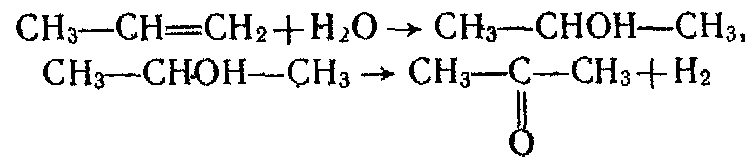
Якісною реакцією на ацетон є утворення йодоформу при дії на нього розчину лугу і йоду:
СН3 – С – СН3 + І2 + КОН СІ3 – С – СН3 СНІ3 + СН3 – СООК
║ ║
О О
Циклогексанон – рідина, температура кипіння 166°С. Добувають дегідріруванням циклогексанолу або окисленням циклогексану.
Циклогексанон використовують для виробництва капролактаму – вихідної речовини для добування синтетичного волокна капрону
При енергійному окисленні циклогексанону утворюється адипінова кислота, яка використовується для добування синтетичного волокна найлону.
Ацетофенон (метилфенилкетон) – речовина з приємним квітковим запахом, в наслідок чого його використовують у виробництві туалетного мила. Синтезують по реакції Фріделя – Крафтса.
Або окисленням етилбензолу киснем повітря у присутності каталізатору:
С6Н5
– СН2
– СН3 С6Н5
– С – СН3
+ Н2О
С6Н5
– С – СН3
+ Н2О
║
О
Ацетофенон використовують у різних синтезах. При його гідруванні утворюється метилфенілкарбінол, з якого дегідротацією добувають важливий промисловий продукт стирол:
С6Н5
– С – СН3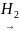 С6Н5
– СН – СН3
С6Н5
– СН – СН3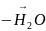 С6Н5
– СН = СН2
С6Н5
– СН = СН2
║
О ОН
При дії хлору не ацетофенон утворюється хлорацетофенон:
С6Н5 – С – СН3 С6Н5 – С – СН2СІ
║ ║
О О
Це кристалічна речовина, одна з сильних лакриматорів, використовувалася у першій світовій війні як бойова отруйна речовина.
