
- •САмостійна робота № 1
- •Загальні методичні вказівки Класифікація органічних сполук.
- •Типи органічних реакцій.
- •Алкани, циклоалкани в природі та техніці.
- •Дієнові вуглеводні, їх характеристика.
- •Багатоядерні ароматичні вуглеводні з ізольованими бензольними ядрами.
- •Нафта, її переробка та склад.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 2
- •Загальні методичні вказівки Похідні вуглеводнів. Ізомерія та номенклатура.
- •Фізичні та хімічні властивості похідних вуглеводнів.
- •Фторпохідні органічні сполуки. Добування та застосування.
- •Основні представники галогенопохідних, їх застосування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 3
- •Загальні методичні вказівки Феноли та нафтоли.Ізомерія і номенклатура.
- •Засоби добування та властивості фенолів та нафтолів.
- •Прості ефіри – номенклатура, ізомерія, властивості.
- •Основні представники. Епоксиди.
- •Етилен оксид в харчовій промисловості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 4
- •Загальні методичні вказівки Кетони – ізомерія, номенклатура.
- •Властивості та добування кетонів.
- •Окремі представники, їх характеристика.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 5
- •Загальні методичні вказівки Двоосновні карбонові кислоти – ізомерія та номенклатура.
- •Властивості, добування та застосування двоосновних карбонових кислот.
- •Мурашина та оцтова кислота, їх характеристика та добування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 6
- •Загальні методичні вказівки Похідні карбонових кислот,їх характеристика.
- •Галогенангідриди –номенклатура, засоби добування та властивості.
- •Ангідриди карбонових кислот –добування, властивості.
- •Окремі представники: оцтовийта фталевий ангідриди.
- •Пероксиди, їх характеристика.
- •Складні ефіри –властивості,добування.
- •Мила, їх властивості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 7
- •Загальні методичні вказівки Дубильні речовини.
- •Галова кислота, її властивості.
- •Альдегідо- та кетонокислоти. Добування та номенклатура.
- •Окремі представники кетонокислот. Пировиноградна кислота.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 8
- •Загальні методичні вказівки Засоби добування нітросполук.
- •Нітробензол.
- •Аліфатичні діазосполуки.
- •Аміди кислот.
- •Сечовина, її властивості.
- •Нітрили кислот.
- •Акрилонітрил в хімічній промисловості
- •Органічні сполуки сірки.Застосування та добування.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 9
- •Загальні методичні вказівки Важливі представники п’ятичленнихгетероциклів з одним гетероатомом.
- •Важливі представники п’ятичленних гетероциклів з двома гетероатомами.
- •Важливі представники шестичленних гетероциклів з одним гетероатомом.
- •Складні гетероциклічні сполуки, їх характеристика.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 10
- •Загальні методичні вказівки Методи досліджень ліпідів.
- •Добування та переробка жирів та масел.
- •Поверхнево-активні речовини.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 11
- •Загальні методичні вказівки Стереохімія моносахаридів.
- •Найважливіші представники моносахаридів, їх застосування у харчовій промисловості.
- •Таутомерія моносахаридів в розчинах.
- •Високомолекулярні полісахариди.
- •Крохмаль, його будова, властивості та застосування у харчовій промисловості.
- •Целюлоза, її будова, властивості та застосування у промисловості.
- •Глікоген, як тваринний крохмаль.
- •Пектинові речовини, їх властивості.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 12
- •Загальні методичні вказівки
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 13
- •Загальні методичні вказівки Аденозинтрифосфорна кислота
- •Біосинтез білків
- •Терпени, їх характеристика, класифікація та властивості.
- •Біциклічні терпени.
- •Стероїди, їх властивості та роль в житті людини.
- •Гормони, їх властивості та роль в житті людини.
- •Завдання для виконання самостійної роботи
- •САмостійна робота № 15
- •Загальні методичні вказівки
- •Завдання для виконання самостійної роботи
- •Рекомендована література
Алкани, циклоалкани в природі та техніці.
Приєднання води (гідратація) використовують для добування спиртів. Реакція проходить при температурі 3000С, під тиском приблизно 8 МПа, у присутності кислотних каталізаторів (фосфорна кислота на алюмосилікаті з додаванням солей кадмію, міді, кобалту):
СН2
= СН2
+ Н2О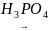 СН3
– СН2ОН
СН3
– СН2ОН
Приєднання хлору та хлорноватої кислоти дозволяє отримувати сполуки, які використовують як розчинники, а також як сировину для синтезу:
СН2
= СН2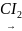 СІ – СН2
– СН2
– СІ дихлоретан (розчинник)
СІ – СН2
– СН2
– СІ дихлоретан (розчинник)
СН2
= СН2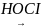 СІ – СН2
– СН2
– ОН етиленхлоргідрин
(сировина для подальшого синтезу)
СІ – СН2
– СН2
– ОН етиленхлоргідрин
(сировина для подальшого синтезу)
Ацетилен отримують в промисловості з карбіду кальцію, який отримують з вугілля та вапняку у електро пічах. Ацетилен є сировиною для синтезу багаточисельних органічних сполук. На основі карбідного ацетилену виникла велика промисловість органічного синтезу у тих країнах, які багаті на вугілля.
Метан широко розповсюджений у природі. Він є головною часткою багатьох горючих газів як природних (90 – 98%), так і штучних, які виділяються при сухій перегонці дерева, торфу, кам’яного вугілля, а також при крекінгу нафти. Природні гази, особливо попутні гази нафтових родовищ, крім метану містять етан, пропан, бутан та пентан.
Метан виділяється з дна боліт та з кам’яновугільних пластів у родовищах, де він утворюється при повільному розкладанні рослинних залишків без достоту повітря. Тому метан часто називають болотним газом або родовищним газом.
Рідкі вуглеводні використовують як пальне (вони входять до складу бензину та керосину).
Циклопропан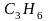 - володіє наркотичною дією, використовується
у хірургії; циклопентан
- володіє наркотичною дією, використовується
у хірургії; циклопентан
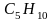 використовується у різноманітних
синтезах та як добавка, покращує якість
моторного палива; циклогексан
використовується у різноманітних
синтезах та як добавка, покращує якість
моторного палива; циклогексан
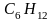 - для добування адипінової кислоти,
циклогексанолу.
- для добування адипінової кислоти,
циклогексанолу.
Дієнові вуглеводні, їх характеристика.
Алкадієни, або дієнові вуглеводні,- ненасичені вуглеводні, які містять у вуглецевому ланцюгу молекули два подвійних зв’язки.
Загальна формула дієнових вуглеводнів СnН2n-2, де п = 3,4,5,6… .Отже, будь-який алкадієн є ізомером алкіну з тим самим числом вуглецевих атомів.
Назви дієнових вуглеводнів за міжнародною номенклатурою утворюють з назв алканів з тим самим числом атомів вуглецю, замінюючи закінчення -ан на -адієн.Назви ізомерів будують за замісниковою номенклатурою аналогічно до назв алкенів. Цифри, зазначені в кінці назви, означають найменші номери атомів вуглецю в головному ланцюгу, біля яких знаходяться подвійнізвязки. Приклади:
1 2 3 1 2 3 4 1 2 3 4
Н2С = С = СН2; Н2С = НС – СН = СН2; Н2С = С – СН = СН2
пропадієн-1,2 бутадієн-1,3
СН3
2-метилбутадієн-1,3
Залежно від положення подвійних звязків у молекулах розрізняють алкадієни з кумульованими звязками, наприклад СН2 = С = СН2; спряженими звязками, наприклад СН2 = СН - СН = СН2; ізольованими звязками наприклад:
СН2 = СН – СН2 – СН2 – CН = СН2
Найбільше практичне значення мають алкадієни з спряженими подвійними звязками.
Алкадієни зі спряженими подвійними зв'язками. Розглянемо будову молекули бутадієну - 1,3.
Атоми вуглецю в молекулі бутадієну - 1,3 перебувають у стані sp2 - гібридизації. За рахунок гібридизованих sp2 - орбіталей, осі симетрії яких лежать в одній площині,в молекулі виникають σ - звязки між усіма атомами вуглецю і σ - звязки вуглець-водень. Центри всіх атомів у молекулі бутадієну -1,3 лежать в одній площині. Негібридизованір-орбіталі атомів вуглецю (по одній у кожного атома) розміщені перпендикулярно до площини молекули і перекриваються не тільки між атомами 1,2 і 3,4, а й між атомами 2,3. Електрони на таких орбіталях утворюють спільну - електронну систему. Однак перекривання р-орбіталей між атомами вуглецю 2 і 3 менш повне, ніж 1,2- і 3,4-перекривання. Алкадієни із спряженими зв’язками значно стійкіші, ніж алкадієни з кумульованими та ізольованими звзками.
За хімічними властивостями дієнові вуглеводні багато в чому подібні до алкенів.
1. Гідрування і галогенування. Алкадієни можуть приєднувати водень (у момент виділення, тобто водень у вигляді атомів Н) і галогени. Звичайно атоми водню чи галогену приєднуються до атомів вуглецю, що займають у ланцюгу положення 1 і 4 (так зване 1,4-приєднання).При цьому утворюється новий подвійний звязок між вуглецевими атомами 2 і 3.
Атоми водню можуть приєднуватися також до атомів вуглецю 1 і 2 (1,2-приєднання), при цьому другий подвійний звязок в алкадієні не змінюється. Наприклад, реакції гідрування і галогенування бутадієну - 1,3 відбуваються за рівняннями:
4 3 2 1 4 3 2 1
Н2С = СН – СН = СН2 + Н2 Н3С – СН = СН – СН3
4 3 2 1 4 3 2 1
Н2С = СН – СН = СН2 + Вr2BrН2С – СН = СН – СН2Br
4 3 2 1
(рідше – BrН2С – СНBr – СН = СН2)
При надлишку галогену відбувається галогенування і другого подвійного звязку. Повне гідрування бутадієну - 1,3 до алкану відбувається при наявності нікелевого каталізатора.
Гідрогалогенування. Приєднання хлороводню до бутадієну - 1,3 приводить до утворення продуктів 1,2 - і 1,4 - приєднання:
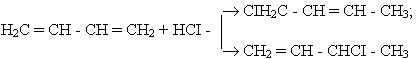
Механізм утворення цих двох продуктів можна пояснити так. Молекула бутадієну реагує спочатку з іоном водню, який згідно з правилом Марковнікова приєднується до більш гідрогенізованого атома вуглецю:
4 3 2 1 4 3 2 1
Н2С = СН – СН = СН2 + Н+ Н2С = СН – СН = СН3
В утвореному катіоні позитивно заряджений атом вуглецю притягує до себе пару електронів, що утворюють - звязок між третім і четвертим атомами вуглецю. Отже, справжня структура катіона є проміжною між двома:
+ +
Н2С = СН – СН – СН3 СН2 – СН = СН – СН3
Тому хлорид-аніон може приєднуватися до такого катіона як в положення 2, так і в положення 4.
3. Полімеризація. Як і інші ненасичені сполуки, алкадієни полімеризуються. Продуктами полімеризації деяких дієнових вуглеводнів є каучук - еластичні полімери, що мають широке застосування.
Найбільше практичне значення з алкадієнів мають бутадієн - 1,3 і 2 - метилбутадієн - 1,3.
Бутадієн-1,3. Тривіальна назва бутадієну - 1,3 - дивініл. За звичайних умов - це безбарвний газ с температурою плавлення - 4,5С. Практично не розчинний в воді. У промисловості бутадієн - 1,3 добувають дегідруванням бутану при наявності каталізаторів:
![]()
Давнім способом добування бутадієну - 1,3 є каталітична дегідратація і дегідрування етилового спирту СН3СН2ОН. Цей спосіб розробив радянський хімік С.В.Лебедєв у 1930 р. і реалізував його на першому в СРСР заводі по виробництву синтетичногокаучуку:
![]()
Бутадієн - 1,3 використовується для добування синтетичного каучуку.
2-Метилбутадієн-1,3. Тривіальна назва 2 - метилбутадієну - 1,3 - ізопрен. За звичайних умов ізопрен рідина з температурою кипіння 34С.
Ізопрен добувають дегідруванням при нагріванні 2 - метилбутану:
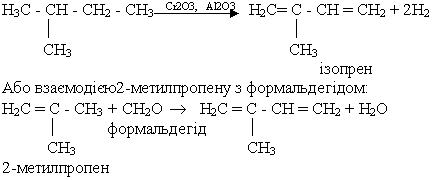
Ізопрен застосовують у виробництві синтетичного каучуку.
