
- •Термодинамика и теплопередача. Учебное пособие
- •Раздел I. Техническая термодинамика
- •Содержание
- •Раздел I
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •Тема 2. Первый закон термодинамики
- •Тема 3. Термодинамические процессы
- •Тема 4. Второй закон термодинамики
- •Тема 5. Идеальные циклы тепловых двигателей
- •Основные условные обозначения
- •Основные сечения потока
- •Сокращения
- •Используемые индексы
- •Предисловие
- •Введение
- •Раздел I техническая термодинамика
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •1.1. Структура основных понятий термодинамики авиационных гтд
- •1.2. Основные понятия и определения термодинамики
- •1.3. Реальный и идеальный газы. Параметры состояния рабочего тела
- •1.3.1. Давление
- •1.3.2. Температура
- •1.3.3. Удельный объём, плотность
- •1.4. Уравнение состояния идеального и реального газов
- •1.4.1. Уравнение состояния идеального газа
- •1.4.2. Уравнение состояния реального газа
- •1.5. Понятие о термодинамическом процессе. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •1.5.1. Равновесные (обратимые) процессы
- •1.5.2. Графическое изображение термодинамического процесса
- •1.5.3. Неравновесные (необратимые) процессы
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 2. Первый закон термодинамики
- •2.1. Внутренняя энергия рабочего тела. Изменение внутренней энергии
- •2.2. Работа газа, как форма передачи энергии в термодинамическом процессе
- •2.3. Теплота, как форма передачи энергии в термодинамическом процессе
- •2.4. Энтропия. Энтропийная “t-s” диаграмма
- •2.5. Зависимость количества работы и теплоты от характера термодинамического процесса
- •2.6. Теплоёмкость газа. Уравнение Майера. Показатель адиабаты
- •2.7. Энтальпия
- •2.8. Техническая работа (работа движущегося газа)
- •2.9. Содержание и уравнение первого закона термодинамики
- •2.10. Чистые вещества и смеси газов
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 3. Термодинамические процессы
- •3.1. Последовательность и объём расчёта термодинамических процессов
- •3.2. Изохорный процесс: определение, осуществление и исследование
- •3.2.1. Исследование изохорного процесса
- •3.3. Изобарный процесс: определение, осуществление и исследование
- •3.3.1. Исследование изобарного процесса
- •3.4. Изотермический процесс: определение, осуществление, исследование
- •3.4.1. Исследование изотермического процесса
- •3.5. Адиабатный (изоэнтропический) процесс: определение, осуществление, исследование
- •3.5.1. Исследование адиабатного процесса
- •3.6. Сравнение адиабаты и изотермы
- •3.7. Обобщающее значение политропных процессов
- •3.8. Энтальпийная “I-s” диаграмма (“I-s” координаты)
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 4. Второй закон термодинамики
- •4.1. Понятие о круговых процессах (циклах). Прямой цикл (цикл тепловой машины)
- •4.2. Полезная работа цикла. Термический кпд цикла
- •4.3. Цикл Карно и теорема Карно
- •4.4. Обратные циклы (циклы холодильных машин)
- •4.5. Второй закон термодинамики. Формулировки второго закона термодинамики
- •4.6. Второй закон термодинамики и энтропия
- •4.7. Статистическая интерпретация второго закона термодинамики
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Информация к размышлению
- •Проверьте, как Вы усвоили материал
- •Тема 5. Идеальные циклы тепловых двигателей
- •5.1. Особенности термодинамического метода исследования циклов тепловых двигателей
- •5.2. Схема устройства и принцип работы авиационного газотурбинного двигателя (гтд)
- •5.3. Идеальный цикл гтд (цикл Брайтона – Стечкина)
- •5.4. Работа и термический кпд цикла гтд
- •5.6. Сравнение циклов Брайтона и Гемфри
- •5.7. Цикл с регенерацией тепла
- •5.8. Цикл со ступенчатым подводом тепла
- •5.9. Эксергетический метод термодинамического анализа
- •5.10. Идеальные циклы двигателей внутреннего сгорания (двс)
- •5.10.1. Идеальный цикл двс с подводом тепла
- •5.10.2. Идеальный цикл двс с подводом тепла при постоянном
- •5.10.3. Сравнение циклов Отто и Дизеля
- •5.10.4. Цикл двс со смешанным теплоподводом
- •Примеры решения задач
- •Решение
- •Решение
- •4. Эффективность цикла оцениваем по величине термического кпд цикла
- •Решение
- •Проверьте, как Вы усвоили материал
- •Заключение
- •Список использованной литературы
- •Приложение
- •Международная стандартная атмосфера (мса) гост 4401–81 (фрагмент)
- •Теплофизические величины
- •Соблюдайте гост 8.417 – 2002
4.7. Статистическая интерпретация второго закона термодинамики
Статистический метод позволяет объяснить, почему реальные процессы в природе необратимы, почему возрастает энтропия замкнутой системы, в чём состоит статистическая сущность второго закона.
Рассмотрим явления расширения идеального газа в пустоту. Пусть в начальный момент времени все молекулы находятся в левой половине сосуда, закрытой заслонкой (рис. 4.9,а). Если заслонку убрать, то газ займет весь объём сосуда (рис. 4.9,б).
При этом плотность, давление и температура газа во всех точках сосуда будут одинаковыми (наступит термодинамическое равновесие). Все указанные параметры не будут изменяться, хотя хаотическое движение молекул не прекращается.
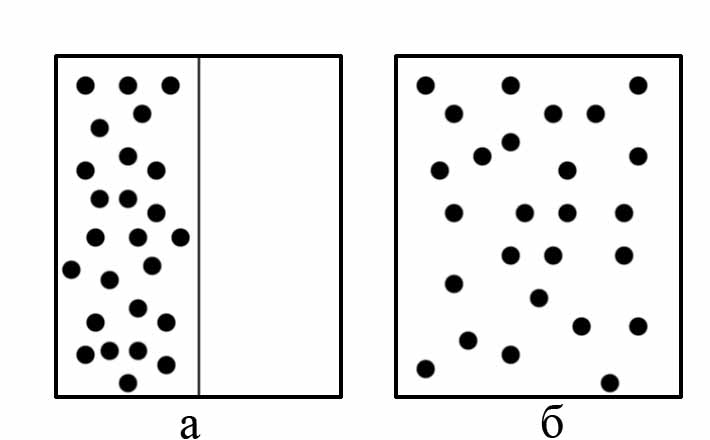
Рис. 4.9. Схема явления расширения идеального газа: а – молекулы находятся в левой половине сосуда, закрытой заслонкой, б – сосуд с открытой заслонкой
Сколько бы времени мы ни наблюдали в дальнейшем за газом, его молекулы самопроизвольно не соберутся в одной половине сосуда. Поэтому расширение газа в вакуум является необратимым процессом.
Обратите внимание на важное слово “самопроизвольно”. Мы, конечно, можем вернуть газ в левую половину сосуда, сжав его с помощью поршня, но самопроизвольно этот процесс маловероятен, особенно, если число молекул велико.
Теперь обратите внимание на слово “маловероятен”. Оказывается, все же существует возможность того, что все молекулы окажутся в одной половине сосуда. Для того чтобы характеризовать поведение частиц в системе, введём новое понятие – термодинамическую вероятность W. Она равна числу различных способов, которыми может, реализовано состояние макроскопической физической системы (макросостояние). Напомним, что в термодинамике состояние физической системы характеризуется определёнными значениями плотности, давления, температуры, объёма. Перечисленные величины определяют состояние системы в целом, её макросостояние. Однако при одних и тех же параметрах макросотояние системы частицы системы могут находиться в разных местах её объёма, иметь различные значения энергии и импульса. Каждое такое состояние называют микросостоянием.
Дадим более точное определение термодинамической вероятности. Термодинамическая вероятность W равна числу микросостояний, реализующих данное макросостояние. Ясно, что термодинамическая вероятность больше или равна единице: W ≥ 1.
При разработке молекулярно-кинетической теории учёные вынуждены были ввести вероятностные законы. Наиболее значительный вклад внесли Дж. Максвелл и Л. Больцман. В 1872 г. Больцман доказывает свою теорему, связывающую энтропию с вероятностью, и приходит к выводу, что “второе начало термодинамики оказывается вероятностным законом”.
Взгляды Больцмана были враждебно встречены всеми физиками. Полное признание его идеи нашли лишь в 1910 г., после создания броуновского движения А. Эйнштейном и её экспериментальной проверки Ж. Перреном (1870 – 1942).
В математическом виде второй закон термодинамики выражается формулой:
s = к·lnW, (4.15)
где s – энтропия;
к – постоянная Больцмана (к = 1.38∙10-23 Дж/К);
ln –натуральный логарифм (основанием является число е, равное примерно 2,7); W – термодинамическая вероятность.
Формула s = к∙lnW высечена на памятнике Больцману на Венском кладбище. Этим подчёркивается её важность для развития науки XX века. Формулу Больцмана по значимости можно поставить с двумя великими формулами, связанными с именами М. Планка и А. Эйнштейна.
Термодинамическая вероятность отличается от вероятности состояния термодинамической системы, которая всегда меньше или равна единице.
Микросостояния
непрерывно изменяются, сменяя друг
друга. Время пребывания в определенном
макросостоянии пропорционально числу
микросостояний W,
которые реализуют данное состояние.
Обозначив полное число микросостояний
системы через Wо,
можем записать выражение для расчёта
вероятности макросостояния:
![]() .
.
Вероятность макросостояния, характеризующая относительную частоту появления данного события, равна отношению числа микросостояний, реализующих макросостояние, к полному числу возможных микросостояний.
Чем больше термодинамическая вероятность W, тем больше вероятность данного макросостояния и тем большее время система будет находиться в данном состоянии.
Для равновесного состояния системы термодинамическая вероятность имеет максимальное значение. В таком состоянии система может находиться, очень долго.
Переход от маловероятных состояний к состояниям более вероятным определяет эволюцию системы и объясняет необратимость макроскопических процессов, несмотря на то, что законы, определяющие движение отдельных частиц, обратимы.
Рассмотрим пример, наглядно показывающий, как увеличение числа частиц в системе приводит к необратимости процессов, несмотря на обратимость законов движения частиц.
Пусть мы имеем в сосуде всего две молекулы. Предположим, что в начальный момент обе молекулы находятся в левой части сосуда. Возможно всего 4 способа распределения молекул между половинками сосуда (рис. 4.10.).
Из рисунка видно,
что существует один способ размещения
двух молекул в левой части сосуда (W
= 1). В этом случае вероятность данного
состояния равна:
![]() .
.
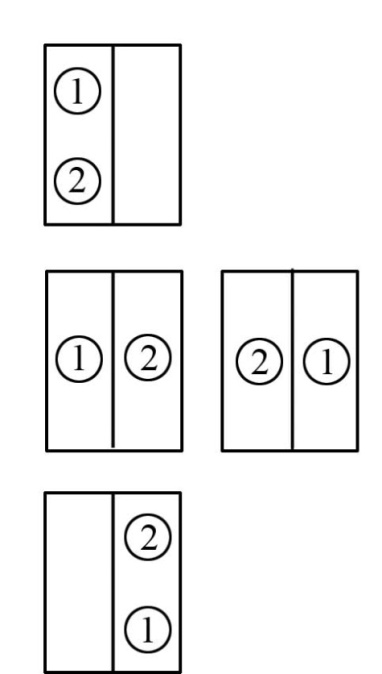
Рис. 4.10. Схема распределения 2-х молекул в половинках сосуда
Для трех молекул число возможных способов распределения молекул между половинками сосуда равно 8 (рис. 4.11.).
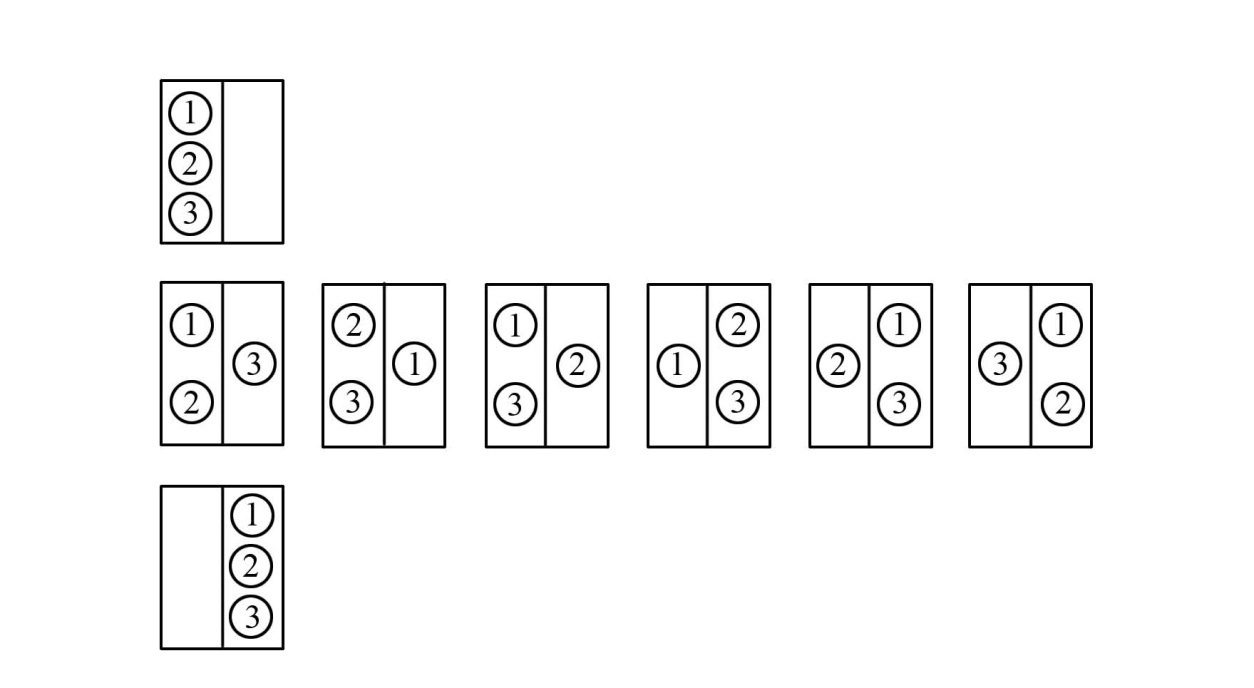
Рис. 4.11. Схема распределения 3-х молекул в половинках сосуда
Однако существует
только один способ размещения трех
молекул в левой части сосуда (W
= 1), но так как Wо
= 8, то вероятность данного события равна
![]() .
.
Для четырех молекул число возможных способов распределения молекул между половинками сосуда равно 16 (рис. 4.12.).
И опять существует
только один способ размещения четырех
молекул в левой части сосуда. В данном
случае вероятность этого события равна
![]() .
.
Так как 4 = 22,
8 = 23,
16 = 24,
то можно сделать вывод, что для n
молекул вероятность того, что все
молекулы окажутся в левой части сосуда,
равна:
![]() .
.
В реальном случае
в газе число молекул очень велико (в
одном моле любого газа содержится 6 ·
1023
молекул), поэтому вероятность того, что
все молекулы окажутся в одной половине
сосуда, равна
![]() .
.
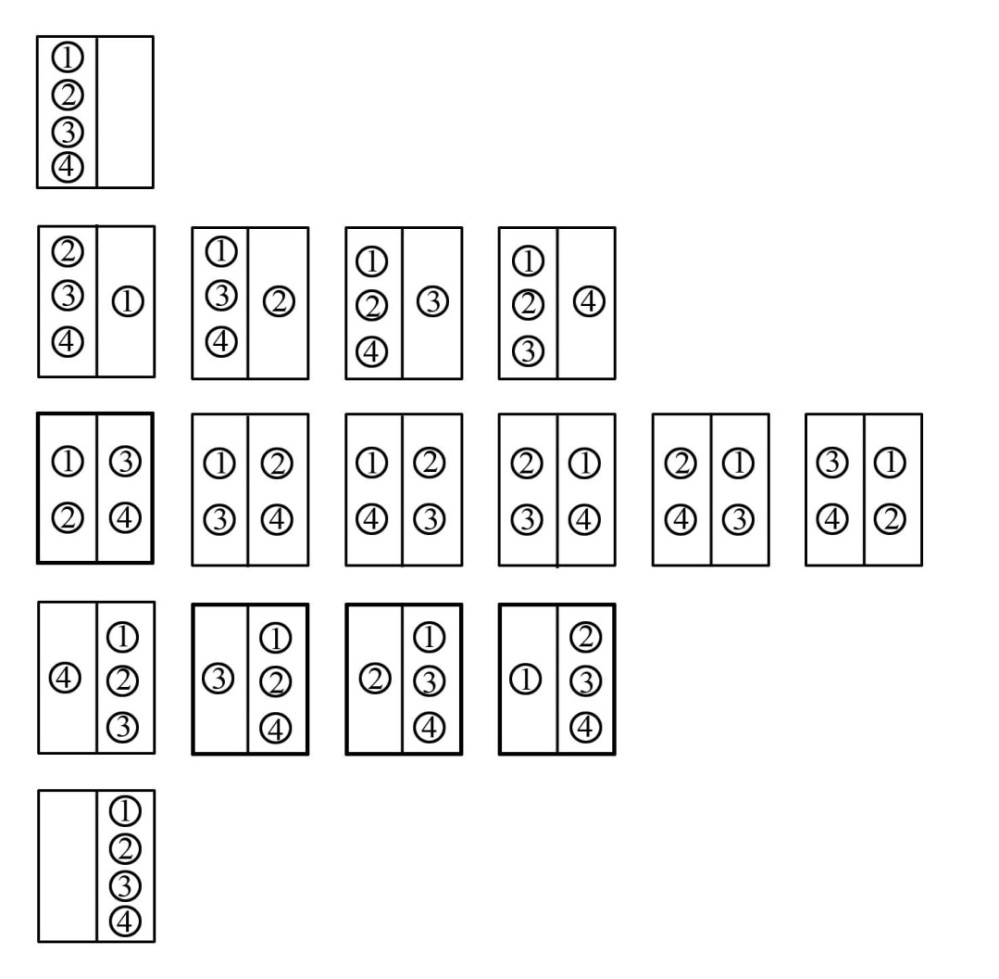
Рис. 4.12. Схема распределения 4-х молекул в половинках сосуда
Это значение настолько близко к нулю, что ситуация, когда все молекулы одного моля газа окажутся в левой части (или правой) части сосуда, никогда не реализуется.
На практике оказывается, что газ равномерно распределяется по всему сосуду, так как термодинамическая вероятность W равномерного распределения молекул максимальна.
Первый закон термодинамики не запрещает такого явления, когда в чайнике, стоящем на столе, нагревается за счёт охлаждения воздуха в комнате. Но этот процесс настолько маловероятен, что никогда не наблюдается.
Понятие “термодинамическая вероятность” помогает нам уяснить смысл второго закона термодинамики. Дело в том, что второй закон термодинамики имеет вероятностный характер. В отличие от закона сохранения энергии, который может быть применен к отдельным молекулам, атомам, электронам, ионам и другим частицам, второй закон термодинамики применим лишь к системам, состоящим из очень большого числа частиц.
Проанализируем формулу s = к∙lnW, которая в математическом виде выражает суть второго закона термодинамики. Из этой формулы видно, что энтропия s определяется только термодинамической вероятностью W. Возрастание энтропии при необратимых процессах есть следствие перехода от менее вероятных состояний к более вероятным. Ясно, что наиболее вероятное состояние – это состояние термодинамического равновесия.
Состояние макросистемы, которое реализуется малым числом микросостояний (W мало), называется упорядоченным.
Состояние, осуществляемое большим числом микросостояний (W очень велико), называется беспорядком, хаосом. Следовательно, равновесное состояние соответствует хаосу в макросистеме, т.е. наиболее неупорядоченному состоянию – состоянию с максимальной энтропией s.
Итак, энтропия является мерой неупорядоченности системы, а необратимость процессов можно трактовать как самопроизвольный переход системы от более упорядоченного состояния к менее упорядоченному, образно говоря, “от порядка к хаосу”.
Приведем примеры, иллюстрирующие полученный вывод:
- механическое движение упорядочено, а, следовательно, ему соответствует наибольшее число микросостояний по сравнению с беспорядочным тепловым движением. Поэтому механическая энергия самопроизвольно превращается во внутреннюю;
- любой вид энергии при её всевозможных превращениях, в конечном счете, переходит в энергию теплового движения, связанного с беспорядочным хаотическим движением частиц, так как любой другой вид энергии является мерой более упорядоченных движений. Например, энергия электрического тока связана с более упорядоченным движением заряжённых частиц по сравнению с тепловым, хаотическим движением;
- теплообмен самопроизвольно происходит от горячего тела к холодному до установления состояния теплового равновесия, так как этому состоянию соответствует максимальное число микросостояний.
Именно эту сторону понятия энтропии подчеркнул немецкий физик и математик А. Зоммерфельд, назвав энтропию царицей мира, которая предписывает всем процессам направление их протекания, а энергия выполняет лишь роль бухгалтера (пусть даже главного и великого), приводящего в равновесие дебет и кредит.
