
- •Термодинамика и теплопередача. Учебное пособие
- •Раздел I. Техническая термодинамика
- •Содержание
- •Раздел I
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •Тема 2. Первый закон термодинамики
- •Тема 3. Термодинамические процессы
- •Тема 4. Второй закон термодинамики
- •Тема 5. Идеальные циклы тепловых двигателей
- •Основные условные обозначения
- •Основные сечения потока
- •Сокращения
- •Используемые индексы
- •Предисловие
- •Введение
- •Раздел I техническая термодинамика
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •1.1. Структура основных понятий термодинамики авиационных гтд
- •1.2. Основные понятия и определения термодинамики
- •1.3. Реальный и идеальный газы. Параметры состояния рабочего тела
- •1.3.1. Давление
- •1.3.2. Температура
- •1.3.3. Удельный объём, плотность
- •1.4. Уравнение состояния идеального и реального газов
- •1.4.1. Уравнение состояния идеального газа
- •1.4.2. Уравнение состояния реального газа
- •1.5. Понятие о термодинамическом процессе. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •1.5.1. Равновесные (обратимые) процессы
- •1.5.2. Графическое изображение термодинамического процесса
- •1.5.3. Неравновесные (необратимые) процессы
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 2. Первый закон термодинамики
- •2.1. Внутренняя энергия рабочего тела. Изменение внутренней энергии
- •2.2. Работа газа, как форма передачи энергии в термодинамическом процессе
- •2.3. Теплота, как форма передачи энергии в термодинамическом процессе
- •2.4. Энтропия. Энтропийная “t-s” диаграмма
- •2.5. Зависимость количества работы и теплоты от характера термодинамического процесса
- •2.6. Теплоёмкость газа. Уравнение Майера. Показатель адиабаты
- •2.7. Энтальпия
- •2.8. Техническая работа (работа движущегося газа)
- •2.9. Содержание и уравнение первого закона термодинамики
- •2.10. Чистые вещества и смеси газов
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 3. Термодинамические процессы
- •3.1. Последовательность и объём расчёта термодинамических процессов
- •3.2. Изохорный процесс: определение, осуществление и исследование
- •3.2.1. Исследование изохорного процесса
- •3.3. Изобарный процесс: определение, осуществление и исследование
- •3.3.1. Исследование изобарного процесса
- •3.4. Изотермический процесс: определение, осуществление, исследование
- •3.4.1. Исследование изотермического процесса
- •3.5. Адиабатный (изоэнтропический) процесс: определение, осуществление, исследование
- •3.5.1. Исследование адиабатного процесса
- •3.6. Сравнение адиабаты и изотермы
- •3.7. Обобщающее значение политропных процессов
- •3.8. Энтальпийная “I-s” диаграмма (“I-s” координаты)
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 4. Второй закон термодинамики
- •4.1. Понятие о круговых процессах (циклах). Прямой цикл (цикл тепловой машины)
- •4.2. Полезная работа цикла. Термический кпд цикла
- •4.3. Цикл Карно и теорема Карно
- •4.4. Обратные циклы (циклы холодильных машин)
- •4.5. Второй закон термодинамики. Формулировки второго закона термодинамики
- •4.6. Второй закон термодинамики и энтропия
- •4.7. Статистическая интерпретация второго закона термодинамики
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Информация к размышлению
- •Проверьте, как Вы усвоили материал
- •Тема 5. Идеальные циклы тепловых двигателей
- •5.1. Особенности термодинамического метода исследования циклов тепловых двигателей
- •5.2. Схема устройства и принцип работы авиационного газотурбинного двигателя (гтд)
- •5.3. Идеальный цикл гтд (цикл Брайтона – Стечкина)
- •5.4. Работа и термический кпд цикла гтд
- •5.6. Сравнение циклов Брайтона и Гемфри
- •5.7. Цикл с регенерацией тепла
- •5.8. Цикл со ступенчатым подводом тепла
- •5.9. Эксергетический метод термодинамического анализа
- •5.10. Идеальные циклы двигателей внутреннего сгорания (двс)
- •5.10.1. Идеальный цикл двс с подводом тепла
- •5.10.2. Идеальный цикл двс с подводом тепла при постоянном
- •5.10.3. Сравнение циклов Отто и Дизеля
- •5.10.4. Цикл двс со смешанным теплоподводом
- •Примеры решения задач
- •Решение
- •Решение
- •4. Эффективность цикла оцениваем по величине термического кпд цикла
- •Решение
- •Проверьте, как Вы усвоили материал
- •Заключение
- •Список использованной литературы
- •Приложение
- •Международная стандартная атмосфера (мса) гост 4401–81 (фрагмент)
- •Теплофизические величины
- •Соблюдайте гост 8.417 – 2002
2.7. Энтальпия
Энтальпия (теплосодержание) представляет собой сумму внутренней энергии (U) и энергии давления (p·υ), обозначаются буквой (i)
i = U + p·υ , Дж/кг (2.31)
Учитывая, что p·υ = R·T , имеем
i = U + R·T , Дж/кг. (2.32)
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния ТДС, и может быть представлена в виде функции двух любых параметров состояния:
i1 = f 1(p, υ); i2 = f 2(p, T); i3 = f 3(υ, T); (2.33)
из изложенного не видно, какой смысл имеет введение этого нового параметра состояния. Но в дальнейшем мы убедимся в том, что энтальпия играет решающую роль в термогазодинамических расчётах теплоэнергетических установок, которыми являются ГТД и ДВС.
Как было отмечено в отношении внутренней энергии, используются не абсолютные значения внутренней энергии, а их разности в заданном интервале температур. Аналогично для энтальпии тоже не используется абсолютные значения, а важно знать их разность в заданном интервале температур, т.е. изменение энтальпии ( i1-2) в данном термодинамическим процессе. С учётом уравнения (2.32) получим выражение для определения изменения энтальпии
i 1-2 = i 2 – i 1 = U1-2 + R· T (2.34)
Начало отсчета энтальпии может быть выбрано при любой температуре, как правило, равной той, при которой условно принимается Uисх = 0. Но при этой температуре i ≠ 0, а как видно из уравнения (2.32) i исх = R·Tисх.
При бесконечно малых изменениях dU и dT из уравнения (2.10) и (2.34) следует, что
di = dU + R·dT = (Cυ+R)·dT,
а учитывая уравнение (2.27) окончательно получим
di = Cp·dT. (2.35)
При конечных изменениях этих величин, имея в виду зависимость от Т, по аналогии с уравнением (2.12) можно записать
i1-2
=
i2
– i1=![]() Cp
·
dT
= Cp
cp·(T2
– T1)
, (2.36)
Cp
·
dT
= Cp
cp·(T2
– T1)
, (2.36)
где Ср ср определяется уравнением (2.22) с индексом “р”.
Отсюда следует, что изменение энтальпии при переходе газа из одного состояния “1” в другое “2” равно количеству подводимой (или отводимой) теплоты в интервале Т1…Т2 при постоянном давлении, причем независимо от фактического перехода при любом характере изменения давления.
Из вышеизложенного можно сделать важный вывод, что энтальпия характеризует способность рабочего тела (движущегося газа) совершать работу за счёт внутренней (тепловой) энергии и энергии давления.
2.8. Техническая работа (работа движущегося газа)
Элементарная работа 1 кг газа в открытой ТДС при подводе бесконечно малого количества теплоты будет состоять из работы расширения–сжатия pdυ и приращения работы проталкивания d(pυ)
dLтехн = p·dυ – d(p·υ) . (2.37)
Приращение d(pυ) взято со знаком минус, так как эта работа совершается внешними силами над газом. Учитывая, что d(pυ) = p·dυ + υ·dp, получаем
dLтехн = – υ·dp.
Следовательно, для произвольного процесса
Lтехн
= –
![]() υ·dp
(2.38)
υ·dp
(2.38)
Это выражение называют технической работой или работой движущегося газа. В координатах “p-υ” она изображается площадью, ограниченной линией процесса и осью давлений (рис. 2.7.).
Таким образом, величина технической работы эквивалентна площади фигуры p112p2 (рис. 2.7.).
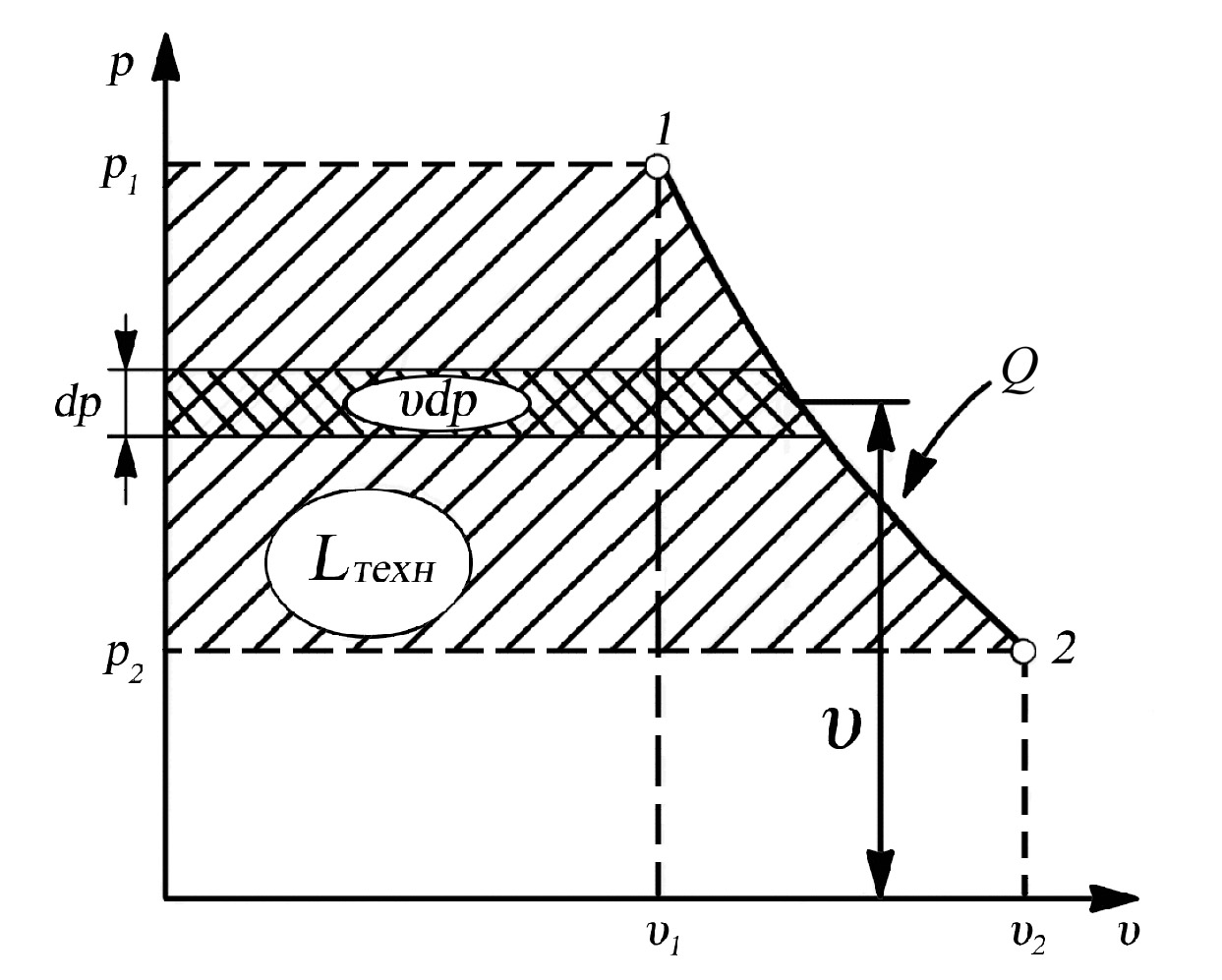
Рис. 2.7. К определению работы движущегося газа
Подчеркнём, что техническая работа – эта та работа, которая может быть совершена только в открытой термодинамической системе, и её не следует смешивать с работой расширения газа, совершаемой в закрытой системе. Различие между технической работой и работой расширения объясняется тем, что в открытой системе работа затрачивается не только на деформацию газа (сжатие или расширение), но и на ввод (или вывод) массы, а так же на изменение кинетической энергии движущегося газа.
Знак технической работы определяется знаком величины (–dp). Для процесса 1–2 (рис. 2.7.), осуществляемого с понижением давления (dp < 0), техническая работа будет положительна, так как (–dp) положительна.
