
- •Термодинамика и теплопередача. Учебное пособие
- •Раздел I. Техническая термодинамика
- •Содержание
- •Раздел I
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •Тема 2. Первый закон термодинамики
- •Тема 3. Термодинамические процессы
- •Тема 4. Второй закон термодинамики
- •Тема 5. Идеальные циклы тепловых двигателей
- •Основные условные обозначения
- •Основные сечения потока
- •Сокращения
- •Используемые индексы
- •Предисловие
- •Введение
- •Раздел I техническая термодинамика
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •1.1. Структура основных понятий термодинамики авиационных гтд
- •1.2. Основные понятия и определения термодинамики
- •1.3. Реальный и идеальный газы. Параметры состояния рабочего тела
- •1.3.1. Давление
- •1.3.2. Температура
- •1.3.3. Удельный объём, плотность
- •1.4. Уравнение состояния идеального и реального газов
- •1.4.1. Уравнение состояния идеального газа
- •1.4.2. Уравнение состояния реального газа
- •1.5. Понятие о термодинамическом процессе. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •1.5.1. Равновесные (обратимые) процессы
- •1.5.2. Графическое изображение термодинамического процесса
- •1.5.3. Неравновесные (необратимые) процессы
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 2. Первый закон термодинамики
- •2.1. Внутренняя энергия рабочего тела. Изменение внутренней энергии
- •2.2. Работа газа, как форма передачи энергии в термодинамическом процессе
- •2.3. Теплота, как форма передачи энергии в термодинамическом процессе
- •2.4. Энтропия. Энтропийная “t-s” диаграмма
- •2.5. Зависимость количества работы и теплоты от характера термодинамического процесса
- •2.6. Теплоёмкость газа. Уравнение Майера. Показатель адиабаты
- •2.7. Энтальпия
- •2.8. Техническая работа (работа движущегося газа)
- •2.9. Содержание и уравнение первого закона термодинамики
- •2.10. Чистые вещества и смеси газов
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 3. Термодинамические процессы
- •3.1. Последовательность и объём расчёта термодинамических процессов
- •3.2. Изохорный процесс: определение, осуществление и исследование
- •3.2.1. Исследование изохорного процесса
- •3.3. Изобарный процесс: определение, осуществление и исследование
- •3.3.1. Исследование изобарного процесса
- •3.4. Изотермический процесс: определение, осуществление, исследование
- •3.4.1. Исследование изотермического процесса
- •3.5. Адиабатный (изоэнтропический) процесс: определение, осуществление, исследование
- •3.5.1. Исследование адиабатного процесса
- •3.6. Сравнение адиабаты и изотермы
- •3.7. Обобщающее значение политропных процессов
- •3.8. Энтальпийная “I-s” диаграмма (“I-s” координаты)
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 4. Второй закон термодинамики
- •4.1. Понятие о круговых процессах (циклах). Прямой цикл (цикл тепловой машины)
- •4.2. Полезная работа цикла. Термический кпд цикла
- •4.3. Цикл Карно и теорема Карно
- •4.4. Обратные циклы (циклы холодильных машин)
- •4.5. Второй закон термодинамики. Формулировки второго закона термодинамики
- •4.6. Второй закон термодинамики и энтропия
- •4.7. Статистическая интерпретация второго закона термодинамики
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Информация к размышлению
- •Проверьте, как Вы усвоили материал
- •Тема 5. Идеальные циклы тепловых двигателей
- •5.1. Особенности термодинамического метода исследования циклов тепловых двигателей
- •5.2. Схема устройства и принцип работы авиационного газотурбинного двигателя (гтд)
- •5.3. Идеальный цикл гтд (цикл Брайтона – Стечкина)
- •5.4. Работа и термический кпд цикла гтд
- •5.6. Сравнение циклов Брайтона и Гемфри
- •5.7. Цикл с регенерацией тепла
- •5.8. Цикл со ступенчатым подводом тепла
- •5.9. Эксергетический метод термодинамического анализа
- •5.10. Идеальные циклы двигателей внутреннего сгорания (двс)
- •5.10.1. Идеальный цикл двс с подводом тепла
- •5.10.2. Идеальный цикл двс с подводом тепла при постоянном
- •5.10.3. Сравнение циклов Отто и Дизеля
- •5.10.4. Цикл двс со смешанным теплоподводом
- •Примеры решения задач
- •Решение
- •Решение
- •4. Эффективность цикла оцениваем по величине термического кпд цикла
- •Решение
- •Проверьте, как Вы усвоили материал
- •Заключение
- •Список использованной литературы
- •Приложение
- •Международная стандартная атмосфера (мса) гост 4401–81 (фрагмент)
- •Теплофизические величины
- •Соблюдайте гост 8.417 – 2002
2.3. Теплота, как форма передачи энергии в термодинамическом процессе
Форма обмена энергией соответствующая хаотическому, беспорядочному неорганизованному движению микрочастиц, составляющих тело, называется теплообменом, а количество энергии, переданное при теплообмене, называется количеством теплоты или теплом. Другими словами количество Q, это физическая величина характеризующая изменение внутренней энергии. Теплообмен не связан с изменением положения тела, а состоит в непосредственной передаче энергии частицами одного тела частицам другого тела.
Теплота может передаваться либо при непосредственном контакте между телом и окружающей средой (теплопроводностью, конвекцией, трением), либо на расстоянии (излучением), либо в результате осуществления химических реакций между составляющими рабочего тела (горение), причем во всех случаях возможен процесс при наличии разности температур между телами.
Во всех случаях элементарное количество теплоты dQ полученное (отданное) системой при передаче энергии в форме теплоты при изменении температуры можно определить как произведение теплоёмкости вещества на элементарную разность температур
dQ = m·С·dT, Дж (2.16)
где m – масса, а С – теплоёмкость тела.
Количество теплоты, приходящейся на 1 кг рабочего тела (газа) называется удельной теплотой и обозначается q. Измеряется в Дж/кг и определяется формулой:
q = С· T = С·(T2 – T1) , Дж/кг (2.17)
Таким образом, теплота и работа представляют собой две единственно возможные формы передачи энергии от одного тела к другому. Разница состоит в том, что:
- теплота является формой передачи энергии неупорядоченного движения частиц;
- работа является формой передачи энергии упорядоченного организованного движения.
Работа и теплота не содержатся, в какой либо части термодинамической системы, ни в источниках теплоты или работы, ни в рабочем теле. Работа и теплота появляются только тогда, когда осуществляется передача энергии или ее преобразование из одного вида в другой. Поэтому теплота и работа являются функциями термодинамического процесса, но не являются параметрами состояния.
2.4. Энтропия. Энтропийная “t-s” диаграмма
Долгое время признаком наличия теплообмена считали изменение температуры. Однако оказалось, что это не так. Достаточно вспомнить, что, например, при кипении воды к ней подводится большое количество теплоты, однако температура остается постоянной. При затвердевании жидкостей теплота отводится, но это не приводит к снижению температуры до тех пор, пока вся жидкость не превратится в кристаллы. В этих примерах теплообмен не приводит к изменению температуры. Наоборот, при сжатии газа в цилиндре температура газа растет, хотя теплота может даже отводиться, если стенки цилиндра холодные. В этом примере изменение температуры вызвано не теплообменом, а механической работой.
Физическая величина, изменение которой действительно является признаком теплообмена, была указана только в 1852 г. немецким физиком Р. Клаузиусом после глубокого научного анализа изменений, наблюдаемых в системе при обмене тепловой энергией. Позднее эта физическая величина получила название энтропии.
Энтропией называется физическая величина, изменение которой является признаком наличия обмена энергией в форме теплоты и обозначается буквой “s” и измеряется Дж/К.
Основная особенность энтропии как термодинамической величины состоит в том, что она обязательно изменяется при наличии теплообмена. При подводе теплоты к термодинамической системе энтропия системы возрастает, при отводе – уменьшается. Кроме теплообмена, никакие другие воздействия на систему не могут изменить значения энтропии.
Главная трудность в понимании физического смысла энтропии состоит в том, что энтропия не оказывает воздействия на измерительные приборы и поэтому её нельзя измерить, как это делают, например, с давлением или объёмом. Впоследствии будет показано, что можно лишь вычислить изменение энтропии по изменению тех параметров, которые доступны для непосредственного измерения в системе (давления, температуры, объёма). Следовательно, энтропия является функцией состояния термодинамической системы. Связь между количеством теплоты и изменением энтропии такая же, как связь между количеством работы и изменением объёма системы.
Элементарное количество теплоты равно произведению абсолютной температуры системы на изменение энтропии системы:
dq = T·ds. (2.18)
Полное количество теплоты в каком-либо процессе определяется в виде интеграла.
Q1-2
=
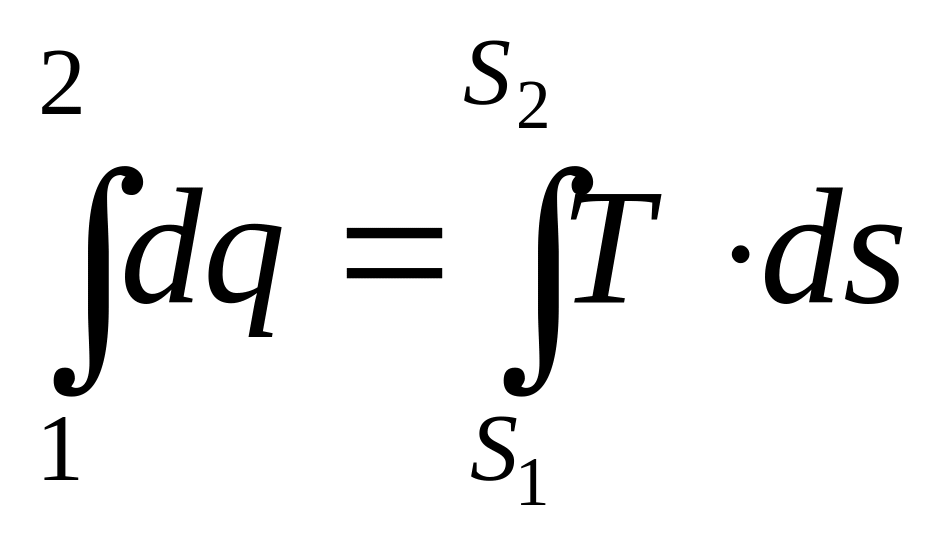 (2.19)
(2.19)

Рис. 2.3. Изображение теплоты в “T-s” диаграмме
Так же как и в случае работы, для аналитического вычисления количества теплоты по выражению (2.19) требуется знать уравнение, связывающее значения температуры и энтропии в каждой точке данного процесса, т. е. уравнение:
Т = f (s).
Это уравнение, будучи уравнением, связывающим между собой два параметра в процессе, также является уравнением процесса. Графическое изображение уравнения T = f (s) представляет собой так называемую энтропийную диаграмму (или тепловую диаграмму) процесса 1–2 (рис. 2.3.). В “T-s” диаграмме количество теплоты выражается точно так же, как и количество работы в “p-υ” диаграмме, а именно, в виде площади под линией процесса (пл. а12б).
Определить, подводится теплота к системе или отводится от нее (т. е. определить знак количества теплоты) можно по изменению энтропии.
Уравнение (2.18) показывает, что при подводе теплоты к системе (dq > 0) энтропия увеличивается (ds > 0) и, наоборот, при отводе теплоты от системы (dq < 0), энтропия уменьшается (ds < 0).
В связи с тем, что энтропия не может быть измерена никаким прибором, выражения (2.18) и (2.19) используются в основном для графического определения количества теплоты и для теоретического анализа изменений, происходящих в термодинамических системах при взаимодействии их с окружающей средой. В частности, именно на основе уравнения (2.18), как мы увидим дальше, можно найти связь между изменением энтропии и другими параметрами состояния.
Для изолированной термодинамической системы энтропия не меняется, если в ней совершаются обратимые процессы, т.е. s = const, следовательно, ds = 0.
