
- •Термодинамика и теплопередача. Учебное пособие
- •Раздел I. Техническая термодинамика
- •Содержание
- •Раздел I
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •Тема 2. Первый закон термодинамики
- •Тема 3. Термодинамические процессы
- •Тема 4. Второй закон термодинамики
- •Тема 5. Идеальные циклы тепловых двигателей
- •Основные условные обозначения
- •Основные сечения потока
- •Сокращения
- •Используемые индексы
- •Предисловие
- •Введение
- •Раздел I техническая термодинамика
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •1.1. Структура основных понятий термодинамики авиационных гтд
- •1.2. Основные понятия и определения термодинамики
- •1.3. Реальный и идеальный газы. Параметры состояния рабочего тела
- •1.3.1. Давление
- •1.3.2. Температура
- •1.3.3. Удельный объём, плотность
- •1.4. Уравнение состояния идеального и реального газов
- •1.4.1. Уравнение состояния идеального газа
- •1.4.2. Уравнение состояния реального газа
- •1.5. Понятие о термодинамическом процессе. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •1.5.1. Равновесные (обратимые) процессы
- •1.5.2. Графическое изображение термодинамического процесса
- •1.5.3. Неравновесные (необратимые) процессы
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 2. Первый закон термодинамики
- •2.1. Внутренняя энергия рабочего тела. Изменение внутренней энергии
- •2.2. Работа газа, как форма передачи энергии в термодинамическом процессе
- •2.3. Теплота, как форма передачи энергии в термодинамическом процессе
- •2.4. Энтропия. Энтропийная “t-s” диаграмма
- •2.5. Зависимость количества работы и теплоты от характера термодинамического процесса
- •2.6. Теплоёмкость газа. Уравнение Майера. Показатель адиабаты
- •2.7. Энтальпия
- •2.8. Техническая работа (работа движущегося газа)
- •2.9. Содержание и уравнение первого закона термодинамики
- •2.10. Чистые вещества и смеси газов
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 3. Термодинамические процессы
- •3.1. Последовательность и объём расчёта термодинамических процессов
- •3.2. Изохорный процесс: определение, осуществление и исследование
- •3.2.1. Исследование изохорного процесса
- •3.3. Изобарный процесс: определение, осуществление и исследование
- •3.3.1. Исследование изобарного процесса
- •3.4. Изотермический процесс: определение, осуществление, исследование
- •3.4.1. Исследование изотермического процесса
- •3.5. Адиабатный (изоэнтропический) процесс: определение, осуществление, исследование
- •3.5.1. Исследование адиабатного процесса
- •3.6. Сравнение адиабаты и изотермы
- •3.7. Обобщающее значение политропных процессов
- •3.8. Энтальпийная “I-s” диаграмма (“I-s” координаты)
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 4. Второй закон термодинамики
- •4.1. Понятие о круговых процессах (циклах). Прямой цикл (цикл тепловой машины)
- •4.2. Полезная работа цикла. Термический кпд цикла
- •4.3. Цикл Карно и теорема Карно
- •4.4. Обратные циклы (циклы холодильных машин)
- •4.5. Второй закон термодинамики. Формулировки второго закона термодинамики
- •4.6. Второй закон термодинамики и энтропия
- •4.7. Статистическая интерпретация второго закона термодинамики
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Информация к размышлению
- •Проверьте, как Вы усвоили материал
- •Тема 5. Идеальные циклы тепловых двигателей
- •5.1. Особенности термодинамического метода исследования циклов тепловых двигателей
- •5.2. Схема устройства и принцип работы авиационного газотурбинного двигателя (гтд)
- •5.3. Идеальный цикл гтд (цикл Брайтона – Стечкина)
- •5.4. Работа и термический кпд цикла гтд
- •5.6. Сравнение циклов Брайтона и Гемфри
- •5.7. Цикл с регенерацией тепла
- •5.8. Цикл со ступенчатым подводом тепла
- •5.9. Эксергетический метод термодинамического анализа
- •5.10. Идеальные циклы двигателей внутреннего сгорания (двс)
- •5.10.1. Идеальный цикл двс с подводом тепла
- •5.10.2. Идеальный цикл двс с подводом тепла при постоянном
- •5.10.3. Сравнение циклов Отто и Дизеля
- •5.10.4. Цикл двс со смешанным теплоподводом
- •Примеры решения задач
- •Решение
- •Решение
- •4. Эффективность цикла оцениваем по величине термического кпд цикла
- •Решение
- •Проверьте, как Вы усвоили материал
- •Заключение
- •Список использованной литературы
- •Приложение
- •Международная стандартная атмосфера (мса) гост 4401–81 (фрагмент)
- •Теплофизические величины
- •Соблюдайте гост 8.417 – 2002
3.5. Адиабатный (изоэнтропический) процесс: определение, осуществление, исследование
Адиабатным называется термодинамический процесс, в котором рабочее тело (система) не обменивается теплотой с окружающей средой.
Таким образом, характеристикой адиабатного процесса является условие q = 0 или s = const (ds = 0), которое должно соблюдаться в течение всего процесса. Поскольку dq = 0, а dT ≠ 0, то теплоёмкость адиабатного процесса Cад = dq/dT = 0. Практически адиабатными могут считаться процессы, проходящие в хорошо изолированных от теплообмена устройствах, а также быстро протекающих процессах, что теплообмен, между газом (рабочим телом) и стенками окружающими газ, не успевает произойти. Газ (рабочее тело) при этом получает или теряет ничтожное количество теплоты.
Примером адиабатного процесса могут служить процессы сжатия воздуха во входном устройстве и компрессоре ГТД, процессы расширения газа в турбине и выходном устройстве ГТД при определённых допущениях. Необходимо пренебречь трением и предположить, что нет теплообмена через стенки корпусов элементов ГТД (идеальные входное устройство, компрессор, турбина, выходное устройство).
3.5.1. Исследование адиабатного процесса
1. Уравнение адиабатного процесса имеет вид:
p·υk = const, (3.32)
где k – показатель адиабаты.
Для того чтобы получить уравнение адиабатного процесса (3.32) воспользуемся уравнениями первого закона термодинамики (2.41 и 2.44) в дифференциальной форме:
dq = dU + p·dυ,
di = dq + υ·dp.
Перепишем данные уравнения в другом виде, используя известные соотношения и условия протекания процесса q = 0, т.е.
0 = Сυ·dT + p·dυ,
Сp·dT = 0 + υ·dp.
Далее преобразуя, получим:
![]()
или
![]() .
.
Для решения этого дифференциального уравнения, проинтегрируем его считая, что Cp и Cυ остаются постоянными:
![]() ;
;
k·lnυ + lnp = const, и окончательно получаем
p·υk = const, что и требовалось доказать.
2. Соотношение между параметрами в адиабатном процессе получаются из уравнения процесса (3.32)
p·υk
=
p1·![]() =
p2·
=
p2·![]() =
const .
(3.33)
=
const .
(3.33)
Это уравнение (3.33) даёт соотношение между давлениями и объёмами в адиабатном процессе
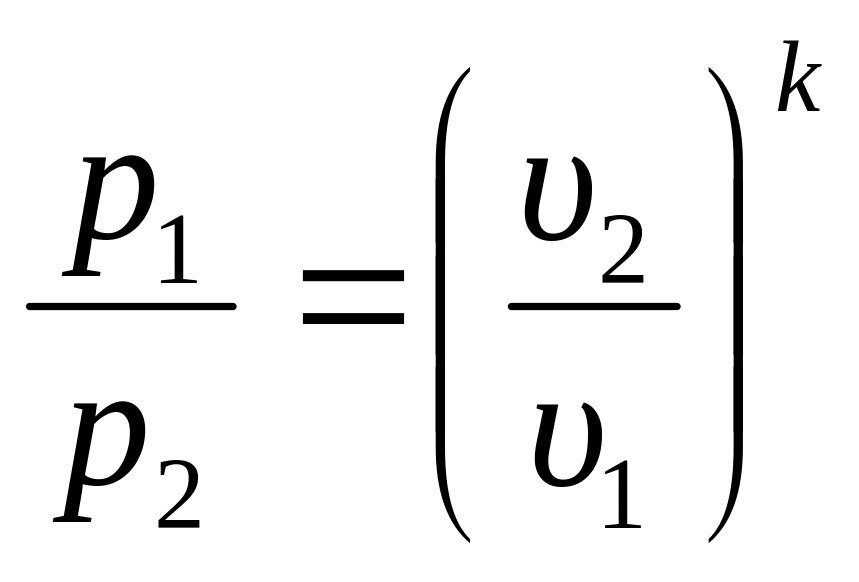 ;
;
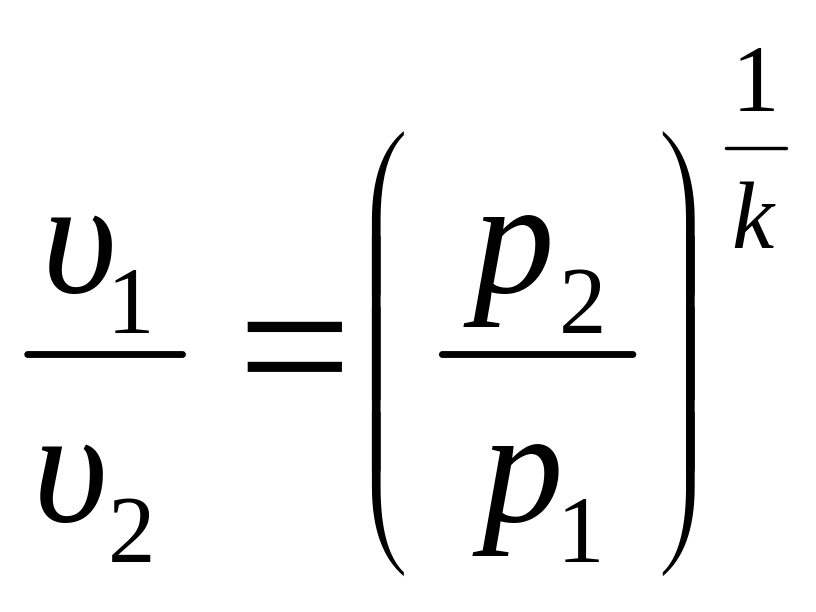 .
(3.34)
.
(3.34)
Соотношение между температурами и объёмами получим из уравнения (3.34) путём его преобразования и использования уравнения состояния идеального газа (1.11)
p1·υ1·![]() = p2·υ2·
= p2·υ2·![]() (3.35)
(3.35)
R·T1· = R·T2· . (3.36)
Из уравнения (3.36) находим соотношение между температурами и объёмами в начале и в конце адиабатного процесса:
 ;
;
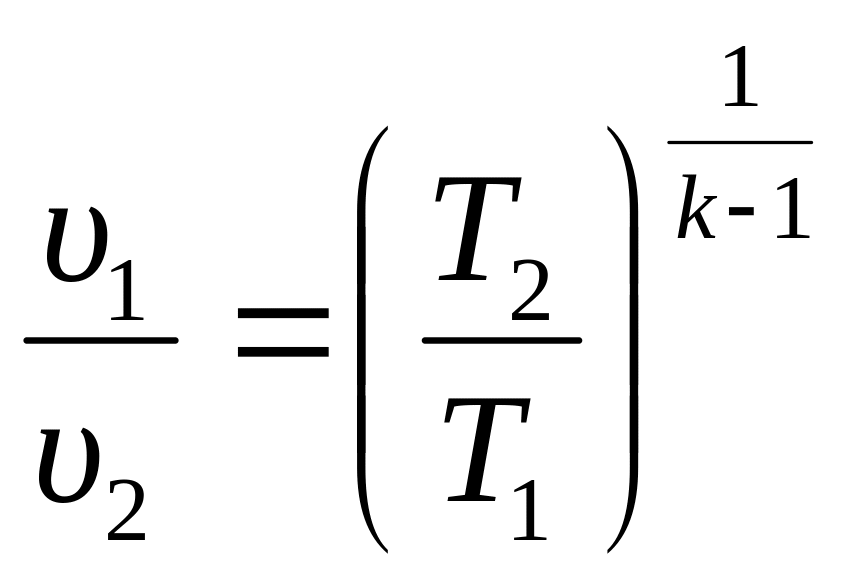 .
(3.37)
.
(3.37)
Заменив в уравнении (3.37) отношение объёмов из уравнения (3.34) отношений давлений получим:
=
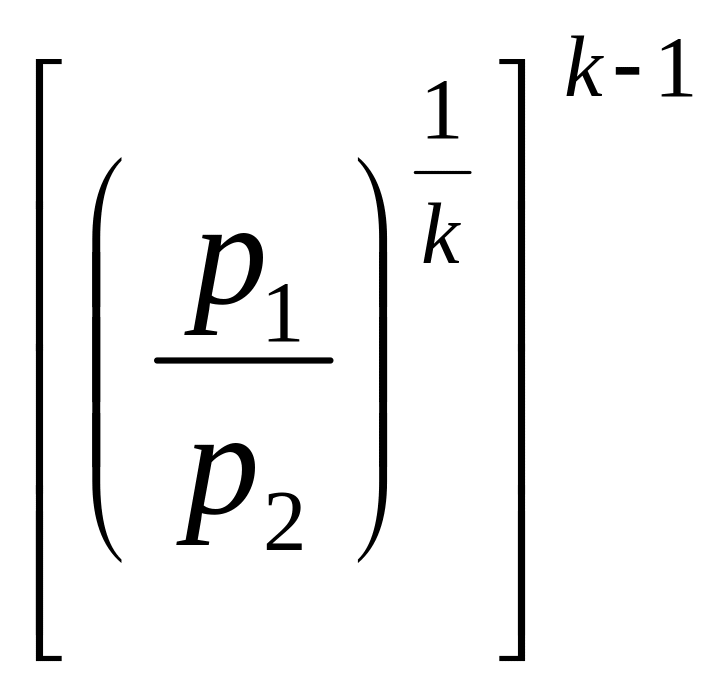 .
(3.38)
.
(3.38)
И окончательно соотношение температур и давлений в адиабатном процессе будет иметь вид
 ;
;
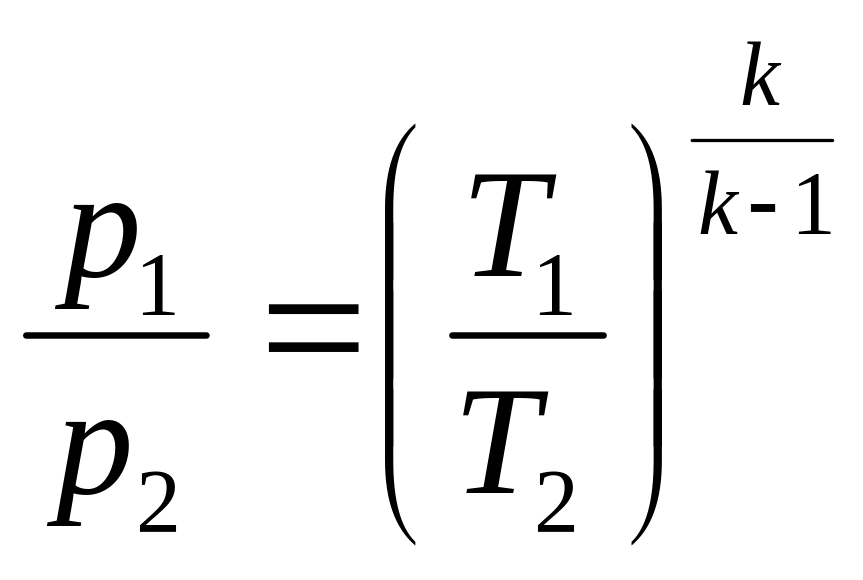 .
(3.39)
.
(3.39)
Полученное выражение (3.34), (3.37), (3.39) дают нам соотношение между параметрами рабочего тела в начале и в конце адиабатного процесса.
Кроме полученных соотношений полезно определить соотношение между давлениями и плотностями, а также между температурами и плотностями рабочего тела, имея в виду, что плотность есть величина обратная удельному объёму.
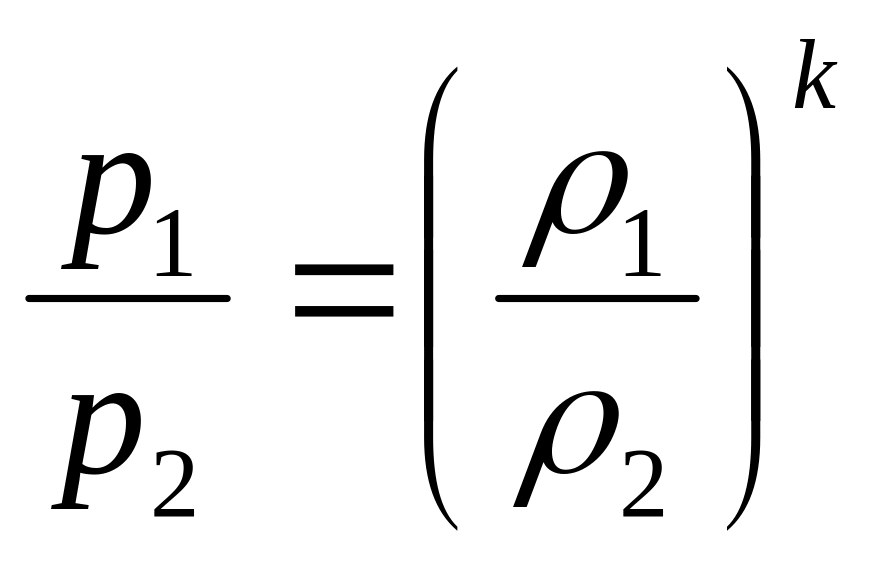 ;
;
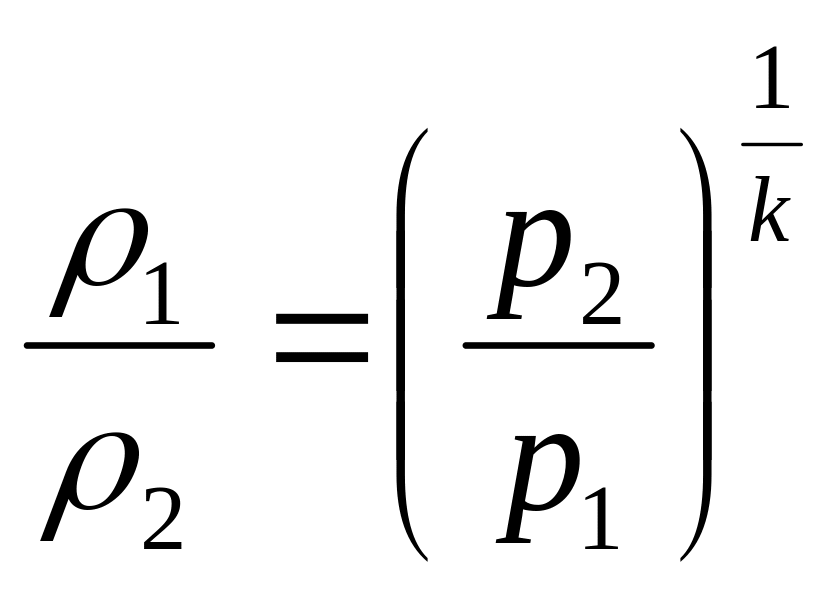 .
(3.40)
.
(3.40)
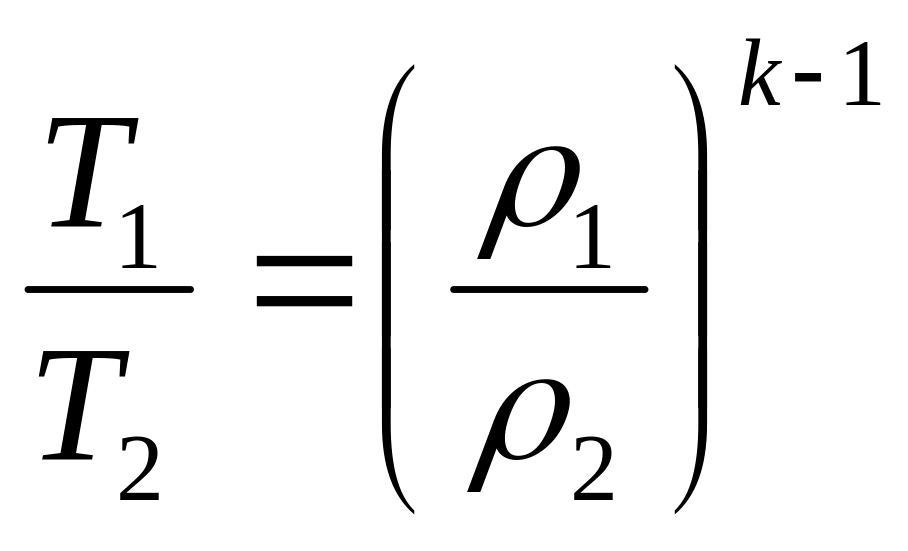 ;
;
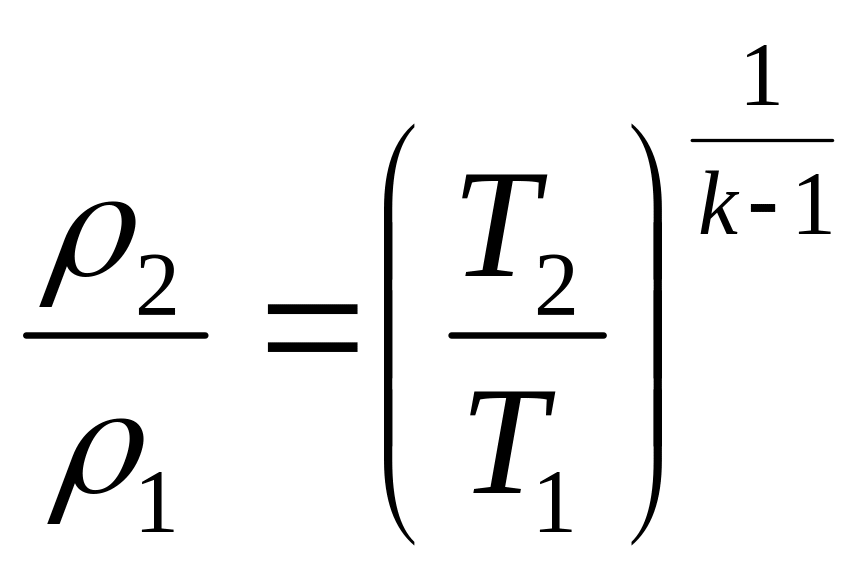 .
(3.41)
.
(3.41)
3. Графическое построение процесса.
График процессов в “p-υ” координатах представляет собой неравнобокую гиперболу, а в координатах “T-s” будет представлять собой отрезок прямой, параллельной оси абсолютной температуры.

Рис. 3.7. Адиабатный процесс: а – рабочая диаграмма процесса,
б – тепловая диаграмма процесса
4. Определение величин входящих в первый закон термодинамики:
а) qад = 0 по условию протекания процесса;
б) ∆Uад = Cυ·∆T = Cυ·(T2 – T1);
в) Работа газа в адиабатном процессе определяется по уравнению (2.15)
Lад
=
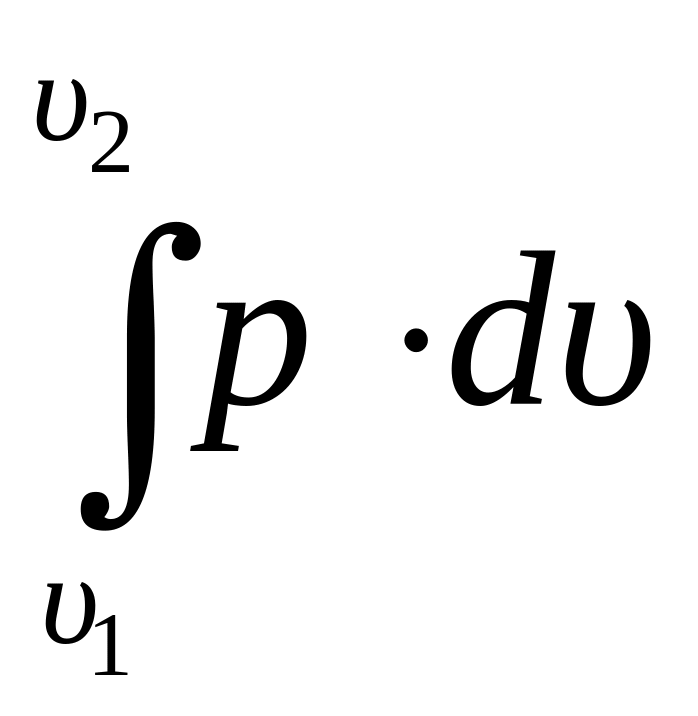 ,
в котором текущее значение давления p
определено через объём по уравнению
(3.33)
,
в котором текущее значение давления p
определено через объём по уравнению
(3.33)
p
=![]() =
=
![]() .
.
Далее, проведя ряд преобразований, используя известные зависимости между параметрами, получим выражение для определения адиабатной работы газа
Lад
=
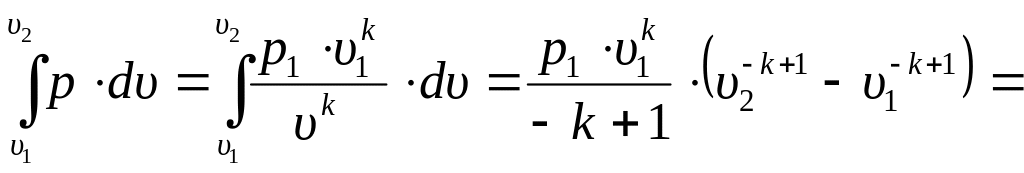
![]()
![]() .
(3.42)
.
(3.42)
Используя уравнение состояния (1.11) получим выражение адиабатной работы через изменение температур:
Lад
=
![]() .
(3.43)
.
(3.43)
Из первого закона термодинамики имеем:
qад = ∆Uад + Lад, т.к. qад = 0 → Lад = –∆Uад.
Применив соотношение (2.11) и (2.30) получим:
Lад = –∆Uад = Cυ·(T2 – T1) = . (3.44)
Преобразуем соотношение (3.44) воспользовавшись выражением (3.39), получим работу в адиабатном процессе расширения через изменение давлений
Lад.
расш. =
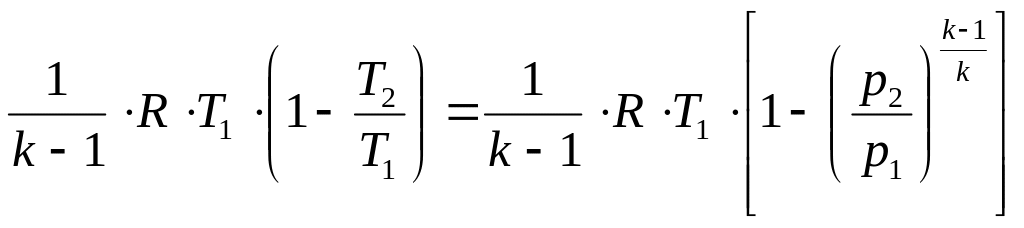 . (3.45)
. (3.45)
А адиабатная работа сжатия (по принятому правилу определения знаков работы) будет иметь следующий вид:
Lад.
сж. =
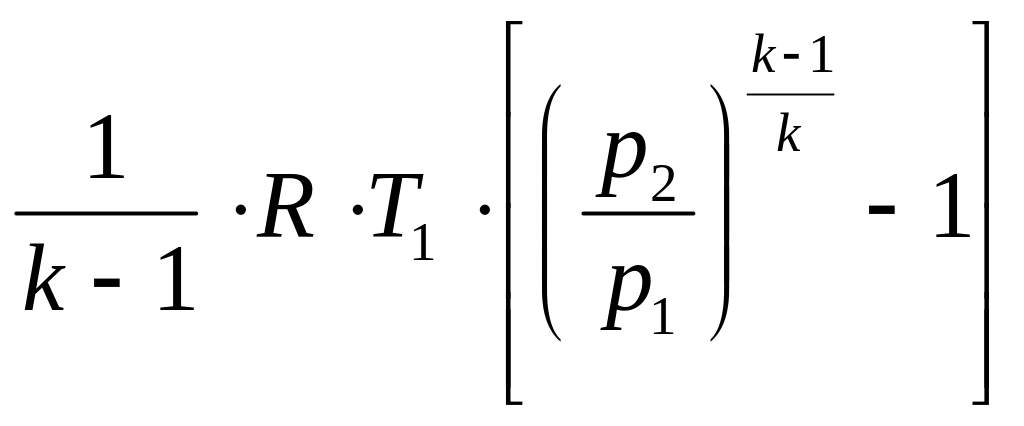 .
(3.46)
.
(3.46)
г) ∆s = 0, таким образом, в адиабатном процессе энтропия системы сохраняется неизменной.
5. Распределение энергии в адиабатном процессе определяет равенство:
Lад = –∆Uад.
Это равенство показывает, что в адиабатном процессе работа расширения (процесс 1–2) осуществляется за счёт уменьшения внутренней энергии рабочего тела, а работа сжатия (процесс 2–1) затрачивается на увеличение его внутренней энергии. Схема распределения энергии представлена на рис. 3.8.
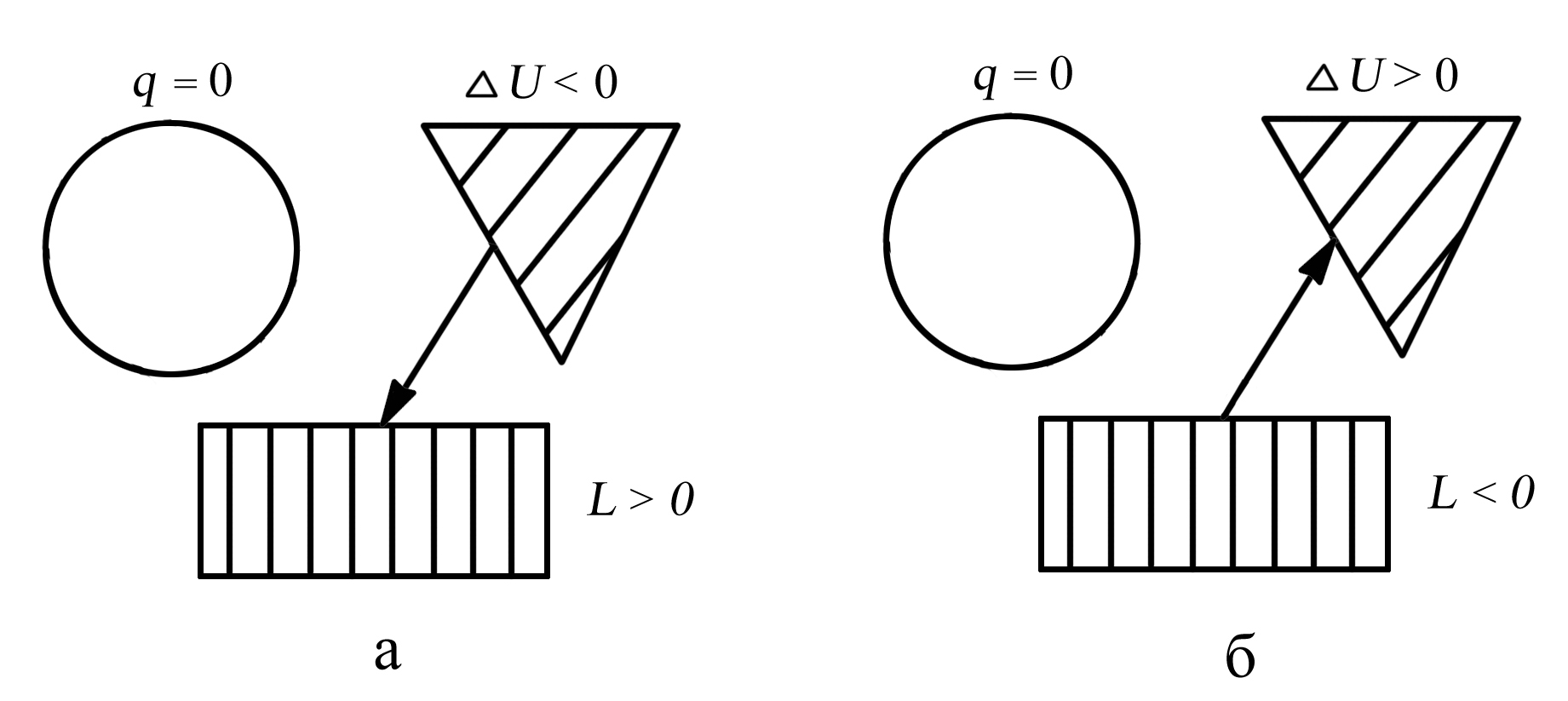
Рис. 3.8. Распределение энергии в адиабатном процессе: а – при расширении рабочего тела (процесс 1–2), б – при сжатии рабочего тела (процесс 2–1)
