
- •Термодинамика и теплопередача. Учебное пособие
- •Раздел I. Техническая термодинамика
- •Содержание
- •Раздел I
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •Тема 2. Первый закон термодинамики
- •Тема 3. Термодинамические процессы
- •Тема 4. Второй закон термодинамики
- •Тема 5. Идеальные циклы тепловых двигателей
- •Основные условные обозначения
- •Основные сечения потока
- •Сокращения
- •Используемые индексы
- •Предисловие
- •Введение
- •Раздел I техническая термодинамика
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •1.1. Структура основных понятий термодинамики авиационных гтд
- •1.2. Основные понятия и определения термодинамики
- •1.3. Реальный и идеальный газы. Параметры состояния рабочего тела
- •1.3.1. Давление
- •1.3.2. Температура
- •1.3.3. Удельный объём, плотность
- •1.4. Уравнение состояния идеального и реального газов
- •1.4.1. Уравнение состояния идеального газа
- •1.4.2. Уравнение состояния реального газа
- •1.5. Понятие о термодинамическом процессе. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •1.5.1. Равновесные (обратимые) процессы
- •1.5.2. Графическое изображение термодинамического процесса
- •1.5.3. Неравновесные (необратимые) процессы
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 2. Первый закон термодинамики
- •2.1. Внутренняя энергия рабочего тела. Изменение внутренней энергии
- •2.2. Работа газа, как форма передачи энергии в термодинамическом процессе
- •2.3. Теплота, как форма передачи энергии в термодинамическом процессе
- •2.4. Энтропия. Энтропийная “t-s” диаграмма
- •2.5. Зависимость количества работы и теплоты от характера термодинамического процесса
- •2.6. Теплоёмкость газа. Уравнение Майера. Показатель адиабаты
- •2.7. Энтальпия
- •2.8. Техническая работа (работа движущегося газа)
- •2.9. Содержание и уравнение первого закона термодинамики
- •2.10. Чистые вещества и смеси газов
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 3. Термодинамические процессы
- •3.1. Последовательность и объём расчёта термодинамических процессов
- •3.2. Изохорный процесс: определение, осуществление и исследование
- •3.2.1. Исследование изохорного процесса
- •3.3. Изобарный процесс: определение, осуществление и исследование
- •3.3.1. Исследование изобарного процесса
- •3.4. Изотермический процесс: определение, осуществление, исследование
- •3.4.1. Исследование изотермического процесса
- •3.5. Адиабатный (изоэнтропический) процесс: определение, осуществление, исследование
- •3.5.1. Исследование адиабатного процесса
- •3.6. Сравнение адиабаты и изотермы
- •3.7. Обобщающее значение политропных процессов
- •3.8. Энтальпийная “I-s” диаграмма (“I-s” координаты)
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 4. Второй закон термодинамики
- •4.1. Понятие о круговых процессах (циклах). Прямой цикл (цикл тепловой машины)
- •4.2. Полезная работа цикла. Термический кпд цикла
- •4.3. Цикл Карно и теорема Карно
- •4.4. Обратные циклы (циклы холодильных машин)
- •4.5. Второй закон термодинамики. Формулировки второго закона термодинамики
- •4.6. Второй закон термодинамики и энтропия
- •4.7. Статистическая интерпретация второго закона термодинамики
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Информация к размышлению
- •Проверьте, как Вы усвоили материал
- •Тема 5. Идеальные циклы тепловых двигателей
- •5.1. Особенности термодинамического метода исследования циклов тепловых двигателей
- •5.2. Схема устройства и принцип работы авиационного газотурбинного двигателя (гтд)
- •5.3. Идеальный цикл гтд (цикл Брайтона – Стечкина)
- •5.4. Работа и термический кпд цикла гтд
- •5.6. Сравнение циклов Брайтона и Гемфри
- •5.7. Цикл с регенерацией тепла
- •5.8. Цикл со ступенчатым подводом тепла
- •5.9. Эксергетический метод термодинамического анализа
- •5.10. Идеальные циклы двигателей внутреннего сгорания (двс)
- •5.10.1. Идеальный цикл двс с подводом тепла
- •5.10.2. Идеальный цикл двс с подводом тепла при постоянном
- •5.10.3. Сравнение циклов Отто и Дизеля
- •5.10.4. Цикл двс со смешанным теплоподводом
- •Примеры решения задач
- •Решение
- •Решение
- •4. Эффективность цикла оцениваем по величине термического кпд цикла
- •Решение
- •Проверьте, как Вы усвоили материал
- •Заключение
- •Список использованной литературы
- •Приложение
- •Международная стандартная атмосфера (мса) гост 4401–81 (фрагмент)
- •Теплофизические величины
- •Соблюдайте гост 8.417 – 2002
2.6. Теплоёмкость газа. Уравнение Майера. Показатель адиабаты
Теплоёмкость характеризует одно из свойств, какого–либо рабочего тела и, как известно, представляет собой количество подводимой или отводимой теплоты соответственно при нагреве или охлаждении рабочего тела на 1 Кельвин. При данных исходных параметрах состояния (Т, р или Т) теплоемкость 1 кг рабочего тела определяется в бесконечно малом интервале температур dT
![]() C
= lim
C
= lim
![]() , Дж/(кг·К). (2.20)
, Дж/(кг·К). (2.20)
Эта теплоёмкость, в основном применяемая при расчётах, является удельной массовой, которую для краткости будем называть просто теплоёмкостью (заметим, что существуют и другие удельные теплоёмкости – единицы объёма или одного моля, но они используются редко).
Теплоёмкость зависит от трех основных факторов. Прежде всего, от природы вещества. Газ, жидкость, твёрдое тело естественно имеют своё определённое и конкретное значение теплоёмкости, характерное только данному веществу. Например, теплоёмкость воды в 4 раза больше, чем теплоёмкость воздуха, теплоёмкость водорода в 14,5 раз больше, чем теплоёмкость воздуха и в 3,5 раза больше, чем теплоёмкость воды и т.д.
Второй фактор – это исходные параметры состояния, при которых теплоёмкость определяется. Для газов (рабочих тел ГТД и ДВС) теплоёмкость зависит практически только от температуры С = f (T). Заметим, что у идеальных газов теплоёмкость от температуры не зависит. Но у рабочих тел ГТД и ДВС, хотя и близких к идеальным газам, влияние температуры все, же заметно. Так, в характерных для ГТД диапазонах изменения температуры воздуха от ~ 250 до 800 К и продуктов сгорания от 700 до 1 600 К теплоёмкости возрастают соответственно примерно на 10 % и на 15 %. Условие С = const принимают лишь при весьма приближённых расчётах. Поэтому будет учитываться зависимость от температуры и теплоёмкости и также других, связанных с ней и рассматриваемых ниже параметров. Но влияние давления и удельного объёма при не очень высоких давлениях до ~ (70·105…100·105 Па) ничтожно мало.
С учётом зависимости “С” от Т конечное количество теплоты Q подводимой к единице массы рабочего тела при его нагреве (или отводимой при охлаждении) в конечном интервале температур Т, определяется из уравнения (2.20)
Q1-2
=
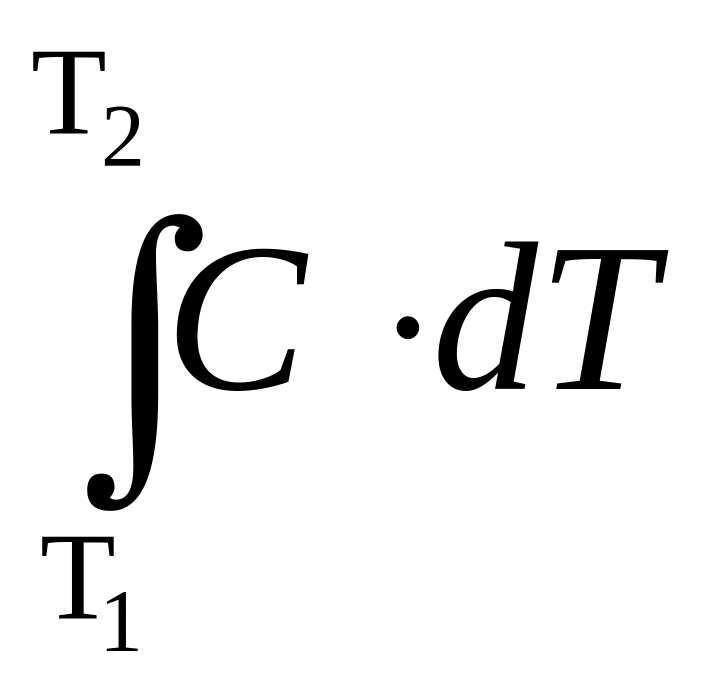 = Ccр·(T2
– T1),
(2.21)
= Ccр·(T2
– T1),
(2.21)
где индексами 1 и 2 обозначены начальное и конечное состояние рабочего тела; Сср – среднее значение теплоемкости в интервале температур Т1…Т2.
С достаточной точностью (хотя и приближённо) Сср может быть определена как среднее арифметическое теплоёмкостей (иногда их называют истинными в отличие от средней) при температурах Т1 и Т2.
Ccp = 0,5·[C (T1) + C (T2)] (2.22)
Значение С = С (Т) приводятся в справочниках в виде таблиц или графиков.
Третий фактор, влияющий на теплоёмкость, относится к сжимаемым рабочим телам – газам. Рассмотрим, в чем проявляется влияние этого фактора.
П![]() редположим,
что имеется жёсткая закрытая
термодинамическая система неизменного
объёма, приведённая на рис. 2.6., а в виде
цилиндра, закрытого неподвижным поршнем.
В цилиндре содержится 1 кг рабочего
тела. Поэтому не изменяется так же
удельный объём , но давление
изменяется, например, при подводе теплоты
возрастает.
редположим,
что имеется жёсткая закрытая
термодинамическая система неизменного
объёма, приведённая на рис. 2.6., а в виде
цилиндра, закрытого неподвижным поршнем.
В цилиндре содержится 1 кг рабочего
тела. Поэтому не изменяется так же
удельный объём , но давление
изменяется, например, при подводе теплоты
возрастает.
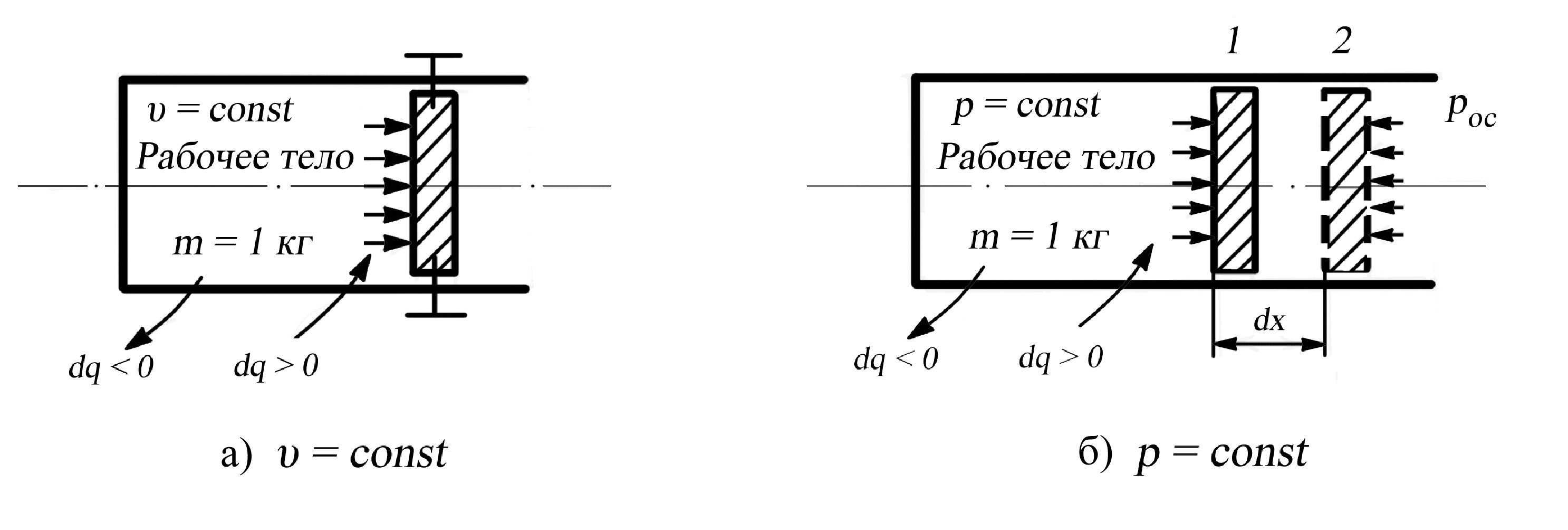
Рис. 2.6. К определению теплоёмкости рабочего тела
при υ = const (a), p = const (б)
Таким образом, осуществляется только один вид энергообмена – теплообмен. Истинная теплоёмкость при постоянном объёме определяется уравнением (2.20), в котором для данного случая соответствующие величины снабжены индексом υ
С
υ
=
![]() (2.23)
(2.23)
Сохраняются и уравнения (2.21) и (2.22) также с индексами υ т.е. qυ1-2 и Cυ ср.
Теперь, пусть система на рис. 2.4,б оставаясь закрытой, станет нежёсткой – поршень в цилиндре может свободно перемещаться в обе стороны. Тогда, например, при подводе теплоты (dq > 0) и нагреве рабочего тела давление остается постоянным, но газ расширяется, и его удельный объём возрастет на величину dυ = F·dx, где F – площадь поршня. Осуществляются оба вида энергообмена – теплообмен и работа изменения объёма, определяемая уравнением (2.14) при бесконечно малом перемещении поршня и (2.15) при конечном перемещении, причем при р = const Lυ = р·(υ2 – υ1).
В результате подводимая к термодинамической системе теплота затрачивается и на нагрев газа и на работу термодинамической системы над окружающей средой (при отводе теплоты все описанные явления происходят в обратном направлении также при р = const). Обозначим бесконечно малую теплоту, отводимую термодинамической системе в процессе р = const с индексом р, dqр . По аналогии с уравнением (2.23) истинная теплоёмкость при постоянном давлении равна
Ср
=
![]() .
(2.24)
.
(2.24)
Поскольку dqp > dqυ из–за наличия работ изменения объёма dLυ , то Ср > Cυ. В уравнениях (2.21) и (2.22) соответствующие величины также снабжаются индексом р т.е. qp1-2 и Cp cp.
При теплообмене параметры состояния газа р и υ по-разному изменяются в жёсткой и нежёсткой термодинамических системах, соответственно υ = const, р = var и р = const, υ = var. Но на количество поглощаемой непосредственно только газом теплоты (или отводимой от газа) это не влияет, поскольку, как отмечалось ранее, теплоёмкость газов практически не зависит от параметров состояния р и υ, а только от температуры Т. Поэтому в жёсткой (υ = const) и нежёсткой (р = const) термодинамических системах при одинаковых изменениях, температуры в данном случае бесконечно малых dT газ поглощает (или отдает) одинаковое количество теплоты dqυ. С учётом уравнения (2.14) количество теплоты, подводимой к нежёсткой термодинамической системе (а не только) определяется суммой
dqp = dqυ + p·dυ. (2.25)
Продифференцируем уравнение состояния (1.11)
d(pυ) = υ·dp + p·dυ = R·dT . (2.26)
В данном частном случае для системы р = const это уравнение упрощается, т.к. dp = 0, поэтому имеем:
p·dυ = R·dT . (2.26′)
Используя полученное уравнение (2.26′), а так же уравнения (2.23) и (2.24) из уравнения (2.25) получим
Cp = Cυ + R или Ср – Cυ = R. (2.27)
Это уравнение, связывающее Ср , Cυ и R называются уравнением Майера. Приведем порядок величин, входящих в это уравнение, например, для воздуха при стандартной температуре 288 К (15 °С): Ср = 1005 Дж/(кг·К), Cυ = 718 Дж/(кг·К), R = 287 Дж/(кг·К). Теплоёмкости Ср и Cυ зависят от температуры, а их разность численно равная значению газовой постоянной R от температуры не зависит. В этом и состоит физический смысл газовой постоянной R, которая численно равна величине работы, совершенной газом массой в 1 кг при изменении температуры в 1 К при постоянном давлении.
В термодинамике и при термодинамических расчетах ГТД и ДВС широко используется отношение теплоёмкостей
![]() ,
(2.28)
,
(2.28)
которое называется показанием адиабаты. Сущность этого термина выяснится из дальнейшего изложения, хотя, казалось бы, что Ср и Cυ никакого отношения к адиабатной системе не имеют.
Показатель адиабаты, как и теплоёмкости, зависит от вида газа и от температуры. Поскольку с ростом температуры обе теплоёмкости Ср и Cυ возрастают, то зависимость “k” от температуры получается довольно слабой, причём убывающей по Т. Например, для воздуха при Т = 288 К показатель адиабаты k = 1,401, а при Т = 800 К (527 °С) – k = 1,353; для продуктов сгорания при Т = 700 К (427 °С) – k = 1,350, а при Т = 1 500 К (1 227 °С) – k = 1,295. В приближённых расчётах обычно принимают: для воздуха k = 1,4, для продуктов сгорания k = 1,33.
Из уравнений (2.27) и (2.28) получаются следующие соотношения, которые часто используются при расчётах.
Ср
=![]() ·R
(2.29)
·R
(2.29)
Сυ
=![]() ·R
(2.30)
·R
(2.30)
