
Fatenkov_-_Vnutrennie_bolezni_1_tom
.pdf154 |
Часть 1. Заболевания органов дыхания |
|
|
перенесенный в предшествующие 6 месяцев, сложные нарушения ритма (III и IV функциональные классы); ОФВ1, составляющий менее 1 л; МВЛ, составляющая менее 40% от должной величины; гиперкапния (Ра СО2 в покое должно быть нормальным), выраженная легочная гипертензия; и ожидаемый ОФВ1 после операции < 800 мл, который рассчитывают по формуле: величину относительной перфузии непораженного легкого (в% от общей легочной перфузии), определенную с помощью перфузионной сцинтиграфии, умножают на ОФВ1. Если он будет больше 1 л, пневмэктомию проводить можно. Если же послеоперационный ОФВ1 будет приближаться к 800 мл, показания к операции ограничиваются.
При немелкоклеточном раке I и II стадий основной метод лечения – резекция, даю-
щая шанс на полное выздоровление . У больных со стадией T3N0M0 (или Т3N1M0) резекция необходима, но при отсутствии распространения опухоли за пределы легкого, расположе-
. У больных со стадией T3N0M0 (или Т3N1M0) резекция необходима, но при отсутствии распространения опухоли за пределы легкого, расположе-
ния опухоли близко к трахее и внутри бронха и других указанных противопоказаний. Объем операции определяет консилиум онкологов. Обычно проводится иссечение опухоли в пределах здоровой ткани – пульмонэктомия или лобэктомия с удалением прилежащих лимфатических узлов. Опухоли Т3N1,2M1 и Т4 неоперабельны.
Лучевая терапия как самостоятельный метод лечения показана больным НМРЛ I и II стадий. При неполном удалении опухоли необходимо проводить дополнительную лучевую терапию . Неоперабельным по общемедицинским показаниям больным НМРЛ с I и II стадией показана лучевая терапия по радикальному плану
. Неоперабельным по общемедицинским показаниям больным НМРЛ с I и II стадией показана лучевая терапия по радикальному плану . При III и IV стадиях проводят паллиативную лучевую терапию при болях в груди, кашле и кровохорканье
. При III и IV стадиях проводят паллиативную лучевую терапию при болях в груди, кашле и кровохорканье .
.
Химиотерапия по паллиативной программе показана больным распространенным НМРЛ (III – IV стадии), но выживаемость в целом увеличивается незначительно.
При мелкоклеточном раке хирургическое лечение проводят редко. Показанием для операции является опухоль без метастазов в лимфоузлы средостения. Основной метод лечения мелкоклеточного рака – индукционная химиотерапия (в том числе в составе комбинированного лечения). Химиотерапию проводят работоспособным больным, не имеющим тяжелых сопутствующих заболеваний сердечно-сосудистой системы, печеночной и почечной недостаточности, с нормальной функцией костного мозга.
Проводят лечение специалисты-онкологи этопозидом в сочетании с цистпластином; доксорубицином, циклофосфамидом и этопозидом (АСЕ); ифосфамидом, карбоплатином
иэтопозидом (ICE) или препаратом платины и этопозидом (РЕ) . Курсы лечения проводят каждые 3 недели при обязательном регулярном контроле общего и биохимического
. Курсы лечения проводят каждые 3 недели при обязательном регулярном контроле общего и биохимического
анализа крови. После 6–8 курсов оценивают эффективность лечения. После достижения полной ремиссии рекомендуют продолжить химиотерапию до 5–6 курсов. При обнаружении метастазов в головной мозг проводят облучение головного мозга. Облучение мозга проводят и с профилактической целью при достижении полной ремиссии.
Комбинированное лечение – химиотерапия в сочетании с рентгеновским облучением показано больным с обеими стадиями МРЛ. В последние годы появились новые схемы высокодозной полихимиотерапии в сочетании с аутотрансплантацией костного мозга.
Унеизлечимых больных обычно развиваются тревожные состояния и упорные боли. Таким больным необходимы производные бензодиазепина (феназепам, диазепам, нозепам
идр.), хлорпромазин в сочетании с атропином, наркотические анальгетики. При неполной окклюзии трахеи и бронхов эффективна лазерная деструкция бронхиального компонен-
та опухоли, скопления некротических тканей, сгустков крови и застойного секрета. При медленном инфильтративном росте опухоли, сдавливающей трахею и вызывающей одышку, показаны глюкокортикоиды внутрь или внутримышечно, бронходилататоры, атропин, препараты красавки и кислородотерапия.
У30–40% больных раком легкого развиваются вторичные гнойные осложнения (обтурационный пневмонит, интеркуррентная вирусная и бактериальная инфекции, ана-
Глава 18. Рак легкого |
155 |
|
|
эробные бактерии и грибковые поражения слизистых оболочек), при которых проводят антибиотикотерапию. Эффективны при вторичных инфекциях фторхинолоны и НПВС.
При накоплении экссудата в плевральной полости проводят простое удаление жидкости и введение цитостатиков, радионуклидов, склерозирующих средств (тальк) и антибиотиков (тетрациклин). Если развивается эмпиема плевры, устанавливают дренаж с широким просветом и промывают полость гнойника антисептическими растворами.
У 40–60% больных раком легкого развиваются метастазы в костях, чаще всего в позвонках,режевгубчатыхкостяхпроксимальнеелоктевыхиколенныхсуставов.Метастазы в костях сопровождаются резкими болями, деформацией конечностей и патологическими переломами. Уменьшение болей, возможно, при паллиативном облучении. При патологических переломах применяют хирургическое лечение.
Прогноз. Прогноз при раке легкого неблагоприятный, зависит от патологического варианта опухоли и стадии заболевания на момент выявления. Средняя продолжительность жизни без лечения 7–12 месяцев. Пятилетняя выживаемость в зависимости от гистологи-
ческого типа (%): |
|
– аденокарцинома: |
|
все гистологические типы |
17 |
бронхоальвеолярный рак |
42 |
– плоскоклеточный рак |
15 |
– мелкоклеточный рак |
менее 3 |
– немелкоклеточный рак |
8–10 |
Профилактики рака легкого не существует.
Глава 19
ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ
Тромбоэмболия легочной артерии (ТЭЛА) – это закупорка артериального русла легкого тромбом, образованным в венозной системе, правом предсердии или желудочке.
Этиология. Наиболее частой причиной ТЭЛА является отрыв венозного эмбола, ис-
точник которого находится в глубоких венах подвздошно-бедренного отдела или малого таза. Факторами риска ТЭЛА являются способствующие тромбообразованию травмы, включая и операционные, гинекологические заболевания, болезни вен нижних конечностей, хроническая сердечная недостаточность, ожирение, длительный постельный режим, беременность, злокачественные новообразования и применение эстрогенов (пероральных контрацептивов). Одной из частой причин ТЭЛА является наследственная предрасположенность к повышенной свертываемости крови – лейденская мутация, приводящая к появлению фактора свертываемости V, устойчивому к естественному антикоагулянту (протеину С).
В зависимости от объема выключенного артериального русла различают малую эмболию с объемом выключенного русла 25%, субмассивную – 50%, массивную (две и более долевых артерий) – более 50% и смертельную – более 75%. Вслед за эмболией у 25–30% развивается инфаркт легкого.
Патогенез. ТЭЛА приводит к выраженному повышению легочного артериального сопротивления, обусловливающего перегрузку правого желудочка, переходящую в
ряде случаев в его острую недостаточность. Одновременно уменьшаются сердечный вы-

156 |
Часть 1. Заболевания органов дыхания |
|
|
брос и сердечный индекс, снижается артериальное давление, уменьшается коронарный кровоток. Развиваются нарушения газообмена и гипоксемия в результате уменьшения газообменнойповерхностилегкого,увеличениямертвогопространстваинеравномерности
 . В результате повышается альвеолярно-артериальная разница парциального давления кислорода, развивается артериальная гипоксемия с парциальным давлением кислорода в артериальной крови менее 80 мм рт. ст., которая обычно сопровождается гипокапнией. Рефлекторно у больных с ТЭЛА развивается гипервентиляция, повышается сопротивление дыхательных путей вследствие бронхоспазма. Отек, кровоизлияния в альвеолы и недостаток сурфактанта уменьшают податливость легких и усугубляют дыхательную недостаточность.
. В результате повышается альвеолярно-артериальная разница парциального давления кислорода, развивается артериальная гипоксемия с парциальным давлением кислорода в артериальной крови менее 80 мм рт. ст., которая обычно сопровождается гипокапнией. Рефлекторно у больных с ТЭЛА развивается гипервентиляция, повышается сопротивление дыхательных путей вследствие бронхоспазма. Отек, кровоизлияния в альвеолы и недостаток сурфактанта уменьшают податливость легких и усугубляют дыхательную недостаточность.
Клиническая картина ТЭЛА характеризуется сильными болями в грудной клетке, резкой одышкой, чувством страха, кашлем с кровохарканьем, коллапсом. У пожилых больных возможна потеря сознания, гемиплегия, судороги.
Состояние больных обычно тяжелое. Выявляются цианоз слизистых, кожи шеи и верхней половины грудной клетки, набухание шейных вен, положительный венный пульс, тахипноэ. При аускальтации легких выслушиваются ослабленное везикулярное дыхание, сухие свистящие хрипы, особенно в момент развития ТЭЛА, крепитация. При исследовании сердца обнаруживают усиленный сердечный толчок, акцент II тона над легочной артерией, тахикардию, повышение центрального венозного давления.
Лабораторные и инструментальные исследования Исследование крови. Общий анализ крови обычно нормальный. Современным диа-
гностическим тестом является количественное определение D-димеров в плазме с помощью ИФА. У 90% больных с ТЭЛА уровень D-димеров превышает 500 нг/мл. Анализ ГАК решающего диагностического значения не имеет.
Hа ÝÊÃрегистрируют синусовую тахикардию и признаки перегрузки правых отделов сердца,режевстречаютсянарушенияритма,такиекакмерцательнаяаритмияитрепетание предсердий. Электрическая ось сердца отклонена вправо, глубокий зубец S в I отведении, патологический зубец Q и отрицательный зубец Т в III отведении (синдром SI–QIII–TIII), P-pulmonale. Отрицательный зубец Т в отведениях V1–V4 может быть при острой дилатации правого желудочка.
ЭхоКГ позволяет выявить признаки увеличения давления в легочной артерии, правожелудочковой недостаточности и исключить другие заболевания, имеющие сходную с
ТЭЛА клиническую картину (инфаркт миокарда, расслаивающую аневризму аорты, тампонаду сердца).
ÓÇÈ позволяет выявить тромбоз глубоких вен, но приблизительно у трети больных с ТЭЛА исследование дает отрицательный результат. Характерным признаком наличия тромба в бедренно-подколенном сегменте вен нижней конечности является их неспадение при надавливании.
Рентгеноскопия грудной клетки. Hа рентгенограммах грудной клетки изменений обычно нет, изредка выявляют субсегментарные ателектазы. У половины больных обнаруживают небольшой плевральный выпот и иногда субплевральные инфильтраты, преимущественно в нижних долях. Вследствие гиповолемии в легких появляются области повышенной прозрачности. Специфическими признаками ТЭЛА являются симптом Вестермарка – локальное обеднение сосудистого рисунка и симптом Хемптона – субплевральная клиновидная тень над диафрагмой.
Вентиляционно-перфузионное сканирование легких. При подозрении на эмболию легочной артерии проводят специальные исследования – сопоставление вентиляцион-
ной и перфузионной сцинтиграмм легких (
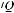 сканирование). Отсутствие изменений на сцинтиграммах позволяет исключить ТЭЛА. Hарушение перфузии в одном или более ле-
сканирование). Отсутствие изменений на сцинтиграммах позволяет исключить ТЭЛА. Hарушение перфузии в одном или более ле-
Глава 19. Тромбоэмболия легочной артерии |
157 |
|
|
гочных сегментах с соответствующими вентиляционными изменениями свидетельствуют о высокой вероятности ТЭЛА. Hа основании соотношения размеров дефектов перфузии и вентиляции и изменений на рентгенограмме вероятность ТЭЛА может быть оценена как низкая, средняя или неопределенная.
Во всех случаях, когда клинические данные и результаты неинвазивных методов диагностики сомнительны, выполняют ангиопульмонографию, так как опаснее оставить больного без лечения или, наооборот, назначить ему антикоагулянтную терапию без подтвержденного диагноза. Ангиопульмонография позволяет подтвердить диагноз, установить место закупорки и распространенность выключенного кровотока, определить степень нарушения гемодинамики в малом круге кровообращения и обьективно оценить эффективность лечения.
Прямыми ангиографическими признаками ТЭЛА являются изображение тромба, внутрисосудистые дефекты наполнения, полная обтурация сосудов с резким расширением его проксимальнее закупорки и отсутствие изображения дистальных участков.
Лечение больных с ТЭЛА включает меры по восстановлению и поддержанию основных жизненных функций, профилактике повторных эмболий и восстановлению проходимости сосудистого русла.
Восстановление и поддержание основных жизненных функций начинают с назначения кислорода для коррекции гипоксемии. Одновременно назначают вазопрессоры: добутамин (добутрекс), допамин (допмин), дофамин, норадреналин, – которые обладают мощным положительным инотропным действием.
Профилактика повторных эмболий проводится гепарином в течение первых 7–10 суток, который вводят вначале в/в струйно 5000 МЕ, затем переходят на поддерживающую дозу 1000–2000 МЕ/час. Скорость инфузии должна регулироваться по величине активированного частичного тромбопластинового времени (АЧТВ), измеряемого перед началом терапии гепарином и каждые 4–6 час во время ее проведения. АЧТВ должно превышать норму в 2 раза. При правильно подобранной дозе гепарин можно вводить п/к. Антикоагулянтный эффект обычно достигается при введении гепарина 7500-15000 МЕ п/к каждые 12 часов. В настоящее время применяют низкомолекулярные гепарины (фраксипарин, эноскипарин и др. п/к в дозе 0,5–0,8 мл 2 раза в сутки). Лечение гепарином продолжают 5–10 дней. Одновременно назначают внутрь непрямой антикоагулянт варфарин в начальной дозе 7,5–10 мг 1 раз в сутки. В последующем суточная доза препарата регулируется вели-
в течение первых 7–10 суток, который вводят вначале в/в струйно 5000 МЕ, затем переходят на поддерживающую дозу 1000–2000 МЕ/час. Скорость инфузии должна регулироваться по величине активированного частичного тромбопластинового времени (АЧТВ), измеряемого перед началом терапии гепарином и каждые 4–6 час во время ее проведения. АЧТВ должно превышать норму в 2 раза. При правильно подобранной дозе гепарин можно вводить п/к. Антикоагулянтный эффект обычно достигается при введении гепарина 7500-15000 МЕ п/к каждые 12 часов. В настоящее время применяют низкомолекулярные гепарины (фраксипарин, эноскипарин и др. п/к в дозе 0,5–0,8 мл 2 раза в сутки). Лечение гепарином продолжают 5–10 дней. Одновременно назначают внутрь непрямой антикоагулянт варфарин в начальной дозе 7,5–10 мг 1 раз в сутки. В последующем суточная доза препарата регулируется вели-
чиной МНО, которая должна быть 2,5–3. Поддерживающая доза варфарина у различных больных колеблется в широких пределах – от 2 до 15 мг/сут.
Восстановление проходимости сосудистого русла осуществляется путем системной тромболитической терапии стрептазой (стрептокиназой), урокиназой или активатором плазминогена тканевого типа и тромбэндартриэктомии.
Тромболитическая терапия противопоказана при подтвержденных геморрагических заболеваниях, после желудочно-кишечного или урогенитального кровотечения, АД выше 200/120 мм рт. ст., при нарушении мозгового кровообращения в анамнезе, недавних травм черепа, беременности, расслаивающей аневризме аорты, диабетической ретинопатии.
При проведении терапии могут развиться наружные, внутренние и скрытые кровотечения, кровоизлияния в мозг и миокард.
При кровотечениях для устранения фибринолитического состояния вводят свежезамороженную плазму. Для возмещения потерь фибриногена и фактора VIII назначают криопреципитат. У больных с выраженным увеличением времени свертывания крови целесообразно переливание тромбоцитарной массы.
158 |
Часть 1. Заболевания органов дыхания |
|
|
Стрептокиназа (стрептаза) содержит 250000, 750000 и 1500000 МЕ активного вещества для инфузий во флаконах. Оказывает фибринолитическое действие, активизирует фибринолиз, способствует превращению плазминогена в плазмин.
При ТЭЛА стрептазу вводят в/в в дозе 1,5 млн МЕ в течение 60 мин с последующей инфузией препарата в течение 45–90 мин со скоростью 2000–4000 МЕ/мин. Общая продолжительность лечения зависит от клинического эффекта, однако не должна превышать 5 дней. Если в течение 4 часов после начала лечения нет существенных изменений уровня плазминогена и фибриногена и АЧТВ по сравнению с нормальными значениями, то лечение следует прекратить в связи с резистентностью к стрептазе.
Урокиназа выпускается во флаконах, содержащих 5000, 25000, 100000, 250000, 500000
и 1000000 МЕ активного вещества. Вводят урокиназу 1 дозу 3 млн МЕ за 60 мин.
Рекомбинантный человеческий активатор плазминогена тканевого типа (актилизе, алтеплаза) вводят 100 мг за 3 часа: сначала струйно 6 мг, далее инфузия 60 мг за 1 час и 40 мг за остальные 2 часа.
В процессе введения тромболитических препаратов возможно развитие осложнений: озноб, повышение температуры тела, головные боли, снижение АД, аллергические реакции (покраснение кожи, крапивница, диспноэ), в редких случаях возможны анафилактические реакции вплоть до шока.
Тромбэндартериэктомия из легочной артерии проводится только больным с ангиографически подтвержденной ТЭЛА, если их не удается вывести из состояния шока при проведении тромболитической терапии, и если тромболитическая терапия противопоказана.
Профилактика ТЭЛА. Основные меры должны быть направлены на лечение заболеваний, вызывающих ТЭЛА. Первичная профилактика включает меры по предотвращению тромбоза в системе нижней полой вены (эластическая компрессия нижних конечностей, ЛФК лицам с длительным постельным режимом). Больным с высоким послеоперационным риском применяют лечение эноксипарином п/к в дозе 40 мг 1–2 раза в сутки.
Вторичная профилактика проводится при развившемся флеботромбозе или ТЭЛА прямыми антикоагулянтами. Возможна установка сетчатого кава-фильтра в нижнюю полую вену ниже впадения почечных вен, либо зонтичного кава-фильтра Гринфилда выше места впадения почечных вен. Показаниями к установке кава-фильтра являются повторный тромбоз на фоне лечения антикоагулянтами, невозможность проведения антикоагулянтной терапии из-за противопоказаний и правожелудочковой недостаточности у боль-
ных с повторной ТЭЛА, имеющих противопоказания к тромболизису.
Прогноз при малой и субмаксимальной эмболии при адекватном лечении, как правило, благоприятный. Массивная ТЭЛА быстро приводит к смерти, если больному не оказана своевременная фибринолитическая терапия или хирургическая помощь.
Глава 20
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
Остраядыхательнаянедостаточность(ОДН)–состояние,характеризующеесянеспо- собностью легких обеспечить необходимое поступление кислорода в артериальную кровь и выведение углекислого газа, достаточное для поддержания нормальных значений рН артериальной крови. ОДН, при которой из-за нарушения газообменной функции легких не
происходит достаточная оксигенация артериальной крови, называется гипоксемической. Если ОДН развивается при гиповентиляции и сопровождается повышением СО2 в крови и

Глава 20. Острая дыхательная недостаточность |
159 |
|
|
тканях, то она называется гиперкапнической (вентиляционной). И хотя при ОДН имеется сочетание обеих форм, их рассматривают отдельно для понимания различий патогенеза и подходов к лечению.
Гипоксемическая дыхательная недостаточностьхарактеризуется снижением РаО2 и
развивается при нарушении соотношения вентиляция/кровоток в результате преобладания последнего. Основными причинами гипоксемической дыхательной недостаточности являются:
1.Гиповентиляция любой этиологии, апноэ, асфиксия, уменьшающие вентиляцию легких.
2.Внутрилегочное шунтирование крови справа налево и нарушение диффузии газов через альвеолярно-капиллярную мембрану при травме легких (респиратор-
ный дистресс-синдром), некардиогенном отеке легких из-за выключения больших участков легких из газообмена.
3.Альвеолярная гиповентиляция при ателектазах легких, обструкции дыхательных путей, пневмонии и других процессах, при которых развиваются нарушения крово- и лимфообращения, отек межальвеолярных перегородок.
4.Уменьшение парциального давления кислорода во вдыхаемом воздухе.
Основное значение в развитии гипоксемии имеют нарушенное вентиляционно-пер- фузионное отношение (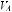
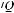 ), внутрилегочное шунтирование крови справа налево и низкое парциальное давление кислорода в смешанной венозной крови.
), внутрилегочное шунтирование крови справа налево и низкое парциальное давление кислорода в смешанной венозной крови.
Гиперкапническая (вентиляционная) недостаточность характеризуется повышени-
ем PаСО2 и снижением рН < 7,35. Она развивается при значительном снижении вентиляции или в случаях, сопровождающихся повышенным образованием СО2 и увеличением мертвого пространства, некомпенсируемым дыханием.
Снижение вентиляции наблюдается при:
1.Поражении ЦНС (нарушении мозгового кровообращения, черепно-мозговых травмах, поражении ствола мозга, отравлении наркотическими анальгетиками).
2.Нервно-мышечных нарушениях (поражениях спинного мозга при полиомиелите и вирусном энцефалите, полирадикулоневритах, миастении, токсико-инфекцион- ных поражениях при ботулизме, столбняке, бешенстве, пролонгированном действии курареподобных препаратов, гипокалемии и др).
3.Торакоабдоминальных нарушениях, обусловленных травмой грудной клетки, по-
вреждениями диафрагмы и брюшной полости, высоким стоянием диафрагмы, иммобилизацией грудной клетки.
Гиповентиляция часто развивается при обострении хронических неспецифических заболеваний легких и астматическом статусе в результате ограничения проходимости дыхательных путей, приводящего к уменьшению воздушного потока на дистальном уровне.
Повышенное образование СО2, некомпенсируемое возросшей альвеолярной вентиляцией, наблюдается при лихорадке, сепсисе, судорожных припадках и избытке углеводов при парентеральном питании. Ниже представлены компоненты системы дыхания и наиболее частые причины развития ее (табл. 9).
Клиника ОДН характеризуется следующими основными синдромами: нарушением дыхания, сознания, кровообращения и функции почек.
Нарушения дыхания весьма разнообразны. Тахипноэ (свыше 30 дыханий в минуту) и нерегулярное полипноэ, переходящее в апноэ, наблюдается чаще всего при нарастающей гипоксии. Экспираторная одышка, тахипноэ, переходящее в олигопноэ без выраженного цианоза,болеехарактерныдлягиперкапническойОДН.Обструкцияверхнихдыхательных путей сопровождается стридорозным дыханием с втяжением надключичных пространств. Патологические варианты неправильного дыхания Чейн–Стокса, Грокка и Биотта воз-
160 |
Часть 1. Заболевания органов дыхания |
|
|
никают при поражении мозга и отравлении наркотическими препаратами, и обусловлены они снижением чувствительности дыхательного центра к СО2.
Таблица 9
Компоненты системы дыхания и наиболее частые причины нарушения ее функции (Kaрlan, 1992)
Компоненты |
Причины нарушения функции |
|
|
Легкие |
|
Дыхательные пути |
Ларингоспазм, бронхиальная астма, хронические обструктивные |
|
заболевания легких, инородные тела |
Легочная ткань |
Респираторный дистресс-синдром взрослых, пневмония, пневмосклероз, |
|
эмфизема |
Сосуды |
Тромбоэмболия легочной артерии, кардиогенный и некардиогенный отек легких |
Аппарат вентиляции |
|
Центральная нервная система |
Передозировка лекарственных средств, нарушение мозгового кровообращения, |
|
гипотиреоз, повреждение спинного мозга |
Периферическая нервная |
Миастения, столбняк, Синдром Гийена–Барре, усталость дыхательных мышц |
система и дыхательные мышцы |
|
Грудная клетка и живот |
Травма, кифосколиоз, торакальные и абдоминальные операции |
Выраженность нарушений сознания связана со степенью гипоксии и гиперкапнии. Начальными проявлениями нарушений ЦНС могут быть сенсорные нарушения, замедленнаяречь,спутанноесознание,двигательноебеспокойствоидругие.Нарастаниегипоксиии гиперкапнии приводит к ступору, переходящему в сопор с полной потерей сознания. Снижение PаО2 <50 мм рт. ст. и повышение PаСО2 >80 мм рт. ст. сопровождаются развитием комы с цианозом и выраженными нарушениями функции сердечно-сосудистой системы.
Нарушения сердечно-сосудистой системы также зависят от степени гипоксемии и гиперкапнии. Бледность с мраморностью кожных покровов, холодные на ощупь конечности, тахикардия – начальные проявления гипоксемии и гиперкапнии. Нарастание гипоксемии и гиперкапнии приводит к развитию брадикардии и различным нарушениям ритма. Гипоксемическая и гиперкапническая кома всегда сопровождается резким падением АД.
На начальных стадиях ОДН почки обеспечивают бикарбонатный буфер, препятствующий развитию ацидоза. Нарушения функции почек возникают обычно при длительной гиперкапнии и характеризуются олигурией и анурией.
Одним из ведущих симптомов ОДН является цианоз, развитие которого обычно свидетельствует о выраженных нарушениях кислородотранспортной системы. Поступление кислорода к тканям зависит от способности дыхательной системы обеспечить насыщение Нb кислородом, уровня Нb крови, сердечного выброса и капиллярного кровотока в органах и способности оксигемоглобина отдать кислород тканям. Доставка кислорода к тканям равна произведению сердечного выброса на суммарное содержание кислорода в артериальной крови (cаО2) т.е. кислорода, связанного с гемоглобином и растворенного в крови:
cаО2 = 1,36 × Нb(г%) × saO2 + 0,003 × PaO2, мм рт. ст.
где
saO2 – насыщение гемоглобина кислородом артериальной крови,
PaO2 – парциальное давление кислорода в артериальной крови.
Доставка кислорода к тканям увеличивается, если повышаются сердечный выброс или saO2 и Нb. Лучше поддается нормализации добавка кислорода коррекцией Нb при его снижении. Влияние saO2 и PaO2 на величину доставки кислорода определяется уровнем PaO2. Если PaO2 >60 мм рт. ст., дальнейшее его увеличение не приводит к существенному
увеличению суммарного кислорода в крови. Если PaO2 <60 мм рт. ст., то даже небольшие его колебания приводят к выраженным изменениям саО2 и saO2.
Глава 20. Острая дыхательная недостаточность |
161 |
|
|
Потребление кислорода тканями зависит от метаболических потребностей, которые
струдом поддаются коррекции. Соответствие потребностей тканей в кислороде его по-
ступлению определяют по парциальному давлению кислорода PvO2 и насыщению гемоглобина кислородом (svO2) в смешанной венозной крови. Эти показатели определяют с помощью непрерывной спектрофотометрии или путем забора крови катетером из легочной артерии.
Нормальное значение PvO2 составляет 35–40 мм рт. ст. и svO2 – 65–70%. Снижению svO2 при ОДН способствует анемия, гипоксемия, низкий сердечный выброс и повышенное потребление О2. Повышения svO2 при тканевой гипоксии возможно при усиленном функционировании артерио-венозных шунтов, перераспределении и ускорении кровотока, отравлении клеточными ядами типа цианидов.
Цианоз в некоторой степени отражает нарушения потребления кислорода тканями. Например, периферический цианоз (цианоз конечностей) обычно возникает при уменьшении периферической перфузии. Цианоз слизистых губ, языка, конъюнктив в сочетании
сцианозом конечностей называют центральным цианозом.
Но если цианоз при гипоксемической ОДН может быть на начальных стадиях, то при гиперкапнической он появляется в более позднем периоде. При анемиях, отравлении СО2, у больных с высокой температурой, при сепсисе цианоз может отсутствовать.
Появление симптомов, свидетельствующих о дыхательной недостаточности, требует срочного анализа газов артериальной крови. Критериями дыхательной недостаточности являются снижение PаО2 < 60 мм рт. ст. при дыхании атмосферным воздухом или снижение рН < 7,35 и повышение PаСО2 > 50 мм рт. ст.
Лечение. Основное заболевание требует патогенетической терапии. Лечение ОДН практически универсально.
Ведущее значение имеет лечение кислородом для устранения гипоксемии, угрожающей жизни больного, под контролем ГАК, определяемых в динамике.
Существует два метода подачи кислорода: без интубации и с интубацией трахеи. Без интубации трахеи подачу кислорода осуществляют с помощью носовых канюль и лицевых масок. Носовые канюли вводят в ноздри на глубину до 15 см и фиксируют на голове или шее. Подача кислорода может быть стандартной струйной или из мешка. Катетер можно вводить и через микротрахеостому. Значения фракционной концентрации кислорода во вдыхаемой смеси (FiO2) при этом способе подачи кислорода неточные. Они зависят от
скорости потока, которая при подаче кислорода через носовые катетеры должна быть менее 5 л/мин, при подаче из мешка – около 2–3 л/мин. Подаваемый кислород увлажняют, пропуская его через стерильную воду или с помощью пузырьковых и аэрозольных увлажнителей. Остальной вдыхаемый объем поступает из окружающей cреды (атмосферный воздух), что значительно снижает FiO2.Скорость потока кислорода регулируется таким образом, чтобы PаО2 превысило 55–60 мм рт. ст.
Лицевые маски позволяют создавать точную концентрацию кислорода во вдыхаемой смеси (маска Вентури): 24, 28, 31, 35, 40 и 50% при потоке кислорода 4–6 л/мин. Дополнительный объем воздуха подсасывается через боковые отверстия трубки, по которой поступает кислород, по принципу эжекции. При максимальной FiO2 (50%) ухудшается увлажнение кислорода. Существуют маски с дополнительным увлажнением, позволяющим
регулировать FiO2 от 28 до 100%, но при FiO2 >60% требуется дополнительная подача кислорода. Поток должен быть в 2–3 раза больше МОД. Маску с регулируемым положительным давлением в конце выдоха (ПДКВ) применяют при спонтанном дыхании. ПДКВ повышают до 20 см вод. ст. с помощью специального клапана. Подобные маски применяют для повышения давления в дыхательных путях, что способствует открытию терминальных бронхиол и уменьшению шунтирования крови.

162 |
Часть 1. Заболевания органов дыхания |
|
|
Вспомогательная вентиляция легких (ВВЛ) – метод оксигенотерапии, позволяющий проводить дополнительно ингаляции аэрозолей и респираторную терапию в режиме ПДКВ. ВВЛ обычно применяют при гиперкапнии, не поддающейся обычной терапии. ВВЛ с перемежающимся положительным давлением улучшает альвеолярную вентиляцию
иувеличивает ЖЕЛ, ФЖЕЛ, функциональную остаточную емкость легких и показатели скорости форсированного выдоха.
ВВЛ проводится с помощью ротовых воздуходувов с резиновым загубником; носовое дыхание при этом выключают с помощью носового зажима или с помощью маски. ПДКВ обычно составляет 10–15 мм вод. ст. Такой режим применяют больным с хроническими нервно-мышечными заболеваниями и деформацией грудной клетки. Больные дышат в этом режиме 15–20 мин каждые 3–4 часа.
ВВЛ с постоянным положительным давлением через плотно прилегающую маску плохо переносится больными, особенно в случаях длительного проведения и в случаях превышения давления 10 мм рт.ст.
Исключительное значение имеет уход за дыхательными путями. Необходимо поддерживать свободную проходимость дыхательных путей с помощью глубокого дыхания
икашля, отсасывания мокроты и физиотерапии: поколачивания грудной клетки, вибрационного массажа, постурального дренажа, парокислородных ингаляций, ультразвуковой аэрозольтерапии. Физиотерапию следует проводить 3–4 раза в день с интервалами в 4–6 часов. Бронхоскопию с аспирацией проводят для удаления слизистых пробок из крупных бронхов и обнаружения причин обструкции.
Кислород в высокой концентрации обладает токсическим действием, которое проявляется образованием диффузных легочных инфильтратов и приводит к ухудшению оксигенации крови при длительной (свыше 48 часов) ингаляции, особенно через эндотрахеальную трубку смеси, содержащей более 60% кислорода. Кроме того, кислород в высокой концентрации может вызывать спадение альвеол, вытесняя из них азот, и образование ателектазов.
Эффективность применения кислорода наиболее высокая при пневмониях, ТЭЛА и бронхиальной астме, при которых имеется умеренное нарушение вентиляционно-перфу- зионного отношения. Менее эффективно лечение кислородом у больных с отеком легких и респираторным дистресс-синдромом взрослых, у которых гипоксемия вызвана резким на-
рушением 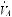
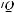 и внутрилегочным шунтированием крови. Таким больным показана интуба-
и внутрилегочным шунтированием крови. Таким больным показана интуба-
ция трахеи и перевод больного на искусственную вентиляцию легких (ИВЛ). Аналогичный подход должен быть и к больным с хроническими обструктивными заболеваниями легких, с вентиляционной недостаточностью, лечение которых проводят кислородом в невысоких концентрациях, если гиперкапния и респираторный ацидоз продолжают нарастать.
Респираторный дистресс-синдром взрослых
Респираторный дистресс-синдром взрослых (РДСВ) – это острое повреждение лег-
ких, характеризующееся некардиогенным отеком легких и сопровождающееся нарушением внешнего дыхания и гипоксией без повышения давления в левом предсердии и легочных капиллярах. Основным критерием РДСВ является падение отношения PаО2/F1O2 до 200 мм рт. ст. и ниже.
Этиология и патогенез. Основной причиной РДСВ является сепсис, обусловленный, главным образом, инфекцией органов брюшной полости. Возможно развитие РДСВ и при
других острых заболеваниях, поражающих легкие. К ним относится бактериальные и вирусные пневмонии, острый геморрагический панкреатит, обширные ожоги, массивное

Глава 20. Острая дыхательная недостаточность |
163 |
|
|
переливание крови, утопление, искусственная вентиляция легких, травмы грудной клетки, аспирация содержимого желудка, передозировка барбитуратов и наркотиков.
Ведущее значение в патогенезе РДСВ имеют повреждение альвеоло-капиллярных мембран и повышение сосудистой проницаемости для высокомолекулярных белков. Предполагают, что первичными факторами повреждения являются простагландины, токсичные кислородные радикалы и протеолитические ферменты, кинины, факторы роста, нейропептиды и вещества, активирующие комплимент, внутрисосудистое свертывание крови и фибринолиз, высвобождающиеся из нейтрофилов, макрофагов, моноцитов и лимфоцитов. Это приводит к повышению онкотического давления между плазмой и интерстициальной тканью. Жидкость начинает выходить из сосудистого русла. Одновременно повреждаются альвеоциты II, продукция которыми сурфактанта снижается. Если наруша-
ется функция сердца в результате сепсиса или повышается гидростатическое давление в легочных капиллярах при инфузионной терапии, усиливается интерстициальный и альвеолярный отек легких в большей степени в нижних отделах легких. Все это приводит к снижению транспульмонального давления и эластической тяги альвеол и усилению функции дыхательных мышц на вдохе, приводящему постепенно к их утомлению. Развивающаяся активация механорецепторов и гипоксемия являются причиной тахипноэ. Ухудшение газообмена связано также с уменьшением числа бронхов и их сужением из-за отека и бронхоспазма, повышающих сопротивление дыхательных путей. Параллельно повышаются
давление в легочной артерии и легочное сосудистое сопротивление. Снижение 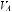
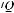 , значительный внутрилегочный сброс крови справа налево и увеличение мертвого пространства из-за окклюзии легочных капилляров – основные причины нарушения газообмена.
, значительный внутрилегочный сброс крови справа налево и увеличение мертвого пространства из-за окклюзии легочных капилляров – основные причины нарушения газообмена.
РДСВ имеет быструю динамику. В течение первых двух суток развиваются интерстициальный отек легких, переходящий в альвеолярный, ателектазы альвеолярных пространств и интерстициальное и бронхоальвеолярное воспаление. В последующие дни альвеолярный экссудат или рассасывается, или подвергается организации в результате пролиферативных процессов с переходом в интерстициальный фиброз к 3–4 недели.
Клиническая картина. Клиника РДСВ развивается быстро. На фоне исходного заболевания появляются выраженная одышка с частым поверхностным дыханием, цианоз или пятнистость кожи, не исчезающие при ингаляции кислорода. При аускультации выявляют ослабленное везикулярное дыхание, свистящие и жужжащие, иногда влажные мелкопузырчатые хрипы.
Диагноз подтверждается анализом газов артериальной крови, с помощью которого обнаруживают острый дыхательный алкалоз: низкое РaO2, нормальное или пониженное РaСO2 и повышенный показатель рH. При рентгенологическом исследовании определяют диффузную двухстороннюю инфильтрацию легких, явление отека легких, напоминающего кардиогенный, но без изменений сердца.
Течение РДСВ часто осложняется вторичной бактериальной инфекцией легких. ИВЛ с положительным давлением или с ПДКВ может привести к развитию пневмоторакса, падению СВ, тахикардии, снижению АД. Нередко на этом фоне нарушается функция других органов и систем, особенно почек. Прогноз при тяжелой нераспознанной и нелеченной гипоксемии неблагоприятный, у 90% больных наступает остановка дыхания и кровообращения. Но и при правильном лечении РДСВ выживаемость составляет 50%.
ЛечениеРДСВ включает лечение основного заболевания, оксигенацию, поддержание функции сердечно-сосудистой системы и лечение осложнений. Установление инфекционной этиологии РДСВ требует проведение антимикробной терапии.
С самого начала лечения следует устранить гипоксемию, угрожающую жизни больного, с помощью ингаляции газовой смеси с высоким содержанием кислорода. Подача кисло-
рода проводится с помощью носовых канюль и лицевых масок. Начинают со средней скорости потока (5–10 л/мин 100% О2) с последующей коррекцией по результатам измерения
