
- •Практическое руководство по химии почв
- •Введение
- •Раздел I. Валовой анализ
- •1.1. Способы разложения почв
- •1.1.1. Разложение почв кислотами.
- •1.1.2. Разложение почв сплавлением.
- •1.1.3. Разложение почвы спеканием.
- •1.2. Определение гигроскопической влажности
- •1.3. Определение потери при прокаливании
- •1.4. Спекание почвы с содой
- •1.5. Анализ элементного состава почв
- •1.5.1. Определение кремния желатиновым методом
- •Пример расчета. Для спекания взято 1,0224 г прокаленной почвы. Прокаленный осадок SiO2 весит 0,8014 г. Содержание SiO2 равно:
- •1.5.2. Определение полуторных оксидов гравиметрическим методом
- •1.5.3. Определение железа фотометрическим методом
- •1.5.4. Определение алюминия фотометрическим методом
- •1.5.5.Вычисленное содержание алюминия по разности
- •1.5.6. Определение кальция и магния комплексонометрическим методом
- •1.5.6.1. Определение кальция
- •1.5.6.2. Определение суммы кальция и магния
- •1.5.7. Пероксидный метод определения титана
- •1.5.8. Определение фосфора фотометрическим методом
- •1.6. Способы выражения результатов валового анализа
- •1.7. Пересчеты данных валового анализа
- •1.8. Использование данных валового анализа
- •1.8.1. Использование элементного состава для суждения о генезисе почв.
- •1.8.2. Использование элементного состава для оценки потенциального плодородия почвы.
- •1.8.3. Использование данных элементного состава для расчета молекулярных отношений
- •1.8.4. Использование данных элементного состава для расчета запасов химических элементов
- •Пример расчета. Найти запас SiO2 в т/га если его содержание равно 80,63 %, плотность сложения почвы 1,18 г/см3, мощность слоя 9 см.
- •1.8.5. Использование данных элементного состава при изучении биологического круговорота веществ
- •1.8.6. Использование данных элементного состава для
- •1.8.6.1. Метод прямого сравнения
- •1.8.6.2. Методы стабильного компонента
- •1.8.6.2.1. Метод молекулярных отношений
- •1.8.6.2.2. Метод элювиально-аккумулятивных (еа) коэффициентов
- •1.8.6.2.3. Метод баланса веществ
- •1.8.7. Использование данных элементного состава для диагностики минералов илистой фракции.
- •Контрольные вопросы
- •Литература
- •Раздел II. Ионно-солевой комплекс почв
- •2.1. Метод водной вытяжки
- •2.1.1. Влияние солей на сельскохозяйственные культуры
- •2.1.2. Достоинства и недостатки водной вытяжки как метода изучения засоленных почв
- •2.1.3 Анализ водной вытяжки
- •2.1.3.1. Определение величины рН водной вытяжки
- •2.1.3.2. Определение величины сухого остатка
- •2.1.3.3. Определение величины прокаленного остатка
- •2.1.3.4. Определение щелочности от растворимых карбонатов
- •2.1.3.5. Определение общей щелочности
- •2.1.3.6. Определение хлорид-ионов
- •2.1.3.7. Определение сульфат-ионов
- •2.1.3.8. Определение ионов кальция и магния комплексонометрическим методом
- •2.1.3.8.1. Определение кальция
- •2.1.3.8.2. Определение суммы кальция и магния
- •2.1.3.9. Определение натрия и калия
- •2.1.3.9.1. Определение натрия и калия методом фотометрии пламени
- •2.1.3.9.2. Определение содержания натрия и калия по разности
- •Форма 4. Данные анализа водной вытяжки
- •2.1.4. Интерпретация данных водной вытяжки
- •2.1.4.1. Характеристика солевого режима почв по величине сухого остатка
- •2.1.4.2. Оценка химизма (типа) засоления почв.
- •2.1.4.2.1. Общие принципы оценки химизма засоления почв
- •2.1.4.2.2. Оценка степени засоления почв по содержанию токсичных ионов
- •2.1.4.2.3. Оценка степени засоления почв по «суммарному эффекту» токсичных ионов
- •2.1.5. Расчет промывной нормы
- •2.2. Катионообменная способность почв
- •2.2.1. Общие представления о катионообменной
- •2.2.2. Методы определения катионообменной способности почв
- •2.2.2.1. Оценка эффективной емкости катионного обмена
- •2.2.2.2. Определение стандартной емкости катионного обмена по Бобко-Аскинази в модификации цинао
- •2.2.2.3. Определение суммы обменных оснований методом Каппена-Гильковица
- •2.2.2.4. Определение гидролитической кислотности
- •2.2.2.5. Определение обменных катионов по методу Пфеффера в модификации в.А. Молодцова и и.В. Игнатовой
- •2.2.2.5.1. Определение кальция комплексонометрическим методом
- •2.2.2.5.2. Определение суммы кальция и магния комплексонометрическим методом
- •2.2.2.5.3. Определение натрия и калия методом фотометрии пламени
- •2.2.3. Использование результатов определения катионообменной способности почв
- •2.2.3.1. Вычисление степени насыщенности почв основаниями
- •2.2.3.2. Расчет дозы извести
- •2.2.3.3. Вычисление степени солонцеватости почв
- •2.2.3.4. Расчет дозы гипса
- •Контрольные вопросы
- •Литература
- •Раздел III. Органическое вещество почвы
- •3.1. Подготовка почвы для определения содержания и состава гумуса
- •3.2. Методы определения содержания общего гумуса почвы
- •3.2.1. Прямые методы определения содержания углерода органических соединений (гумуса) почвы.
- •3.2.2. Косвенные методы определения содержания углерода органических соединений (гумуса) почвы
- •3.2.2.1. Определение гумуса методом и.В.Тюрина в модификации в.Н.Симакова
- •3.2.2.2. Другие модификации метода и.В. Тюрина.
- •3.2.2.2.1. Спектрофотометрический метод определения содержания гумуса (д.С. Орлов, н.М. Гриндель)
- •3.2.2.2.2. Определение содержания органического углерода почвы методом и.В.Тюрина в модификации б.А.Никитина.
- •3.3. Методы определения общего содержания азота почвы.
- •3.3.1. Определение общего содержания азота методом Кьельдаля.
- •3.3.2. Определение общего содержания азота микрохромовым методом и.В. Тюрина.
- •3.4. Использование данных по содержанию общего гумуса и азота
- •3.4.1. Расчет отношения c:n
- •3.4.2. Вычисление запасов гумуса, углерода и азота.
- •3.5. Методы определение группового и фракционного состава гумуса.
- •3.5.1. Определение группового и фракционного состава гумуса по методу и.В. Тюрина в модификации в.В.Пономаревой и т.А.Плотниковой
- •3.5.2. Определение группового и фракционного состава гумуса по модифицированной схеме в.В.Пономаревой и т.А. Плотниковой (т.А. Плотникова, н.Е. Орлова, 1984).
- •Ход анализа
- •3.5.3. Ускоренный пирофосфатный метод определения состава гумуса по м.М. Кононовой и н.П. Бельчиковой
- •3.6. Методы изучения некоторых свойств гумусовых кислот при анализе фракционно-группового состава гумуса
- •3.6.1. Определение порога коагуляции гуминовых кислот.
- •3.6.2. Оптические свойства гумусовых веществ.
- •3.6.2.1. Электронные спектры поглощения гумусовых веществ
- •3.6.2.2. Определение коэффициента цветности q4/6
- •3.6.3. Гель-хроматография гумусовых веществ
- •3.7. Показатели гумусового состояния почв
- •Продолжение таблицы 31
- •3.8. Методы определения содержания и состава органического вещества в болотных торфяных почвах.
- •3.8.1. Определение потери при прокаливании и зольности торфа.
- •3.8.2. Одновременное определение общего содержания углерода и азота в торфяных почвах методом Анстета в модификации в.В. Пономаревой и т. А. Николаевой
- •Вычисление результатов анализа
- •Для анализа используют следующие реактивы:
- •3.8.3. Определение общего содержания азота в растительных материалах (торфах, лесных подстилках и пр.) методом к.Е. Гинзбурга и г.М. Щегловой
- •3.8.4. Определение содержания органического азота в вытяжках из торфов микрохромовым методом и.В. Тюрина
- •3.8.5. Определение состава органического вещества торфяно-болотных почв по методу в.В. Пономаревой и т.А. Николаевой.
- •Контрольные вопросы
- •Литература
- •Раздел I. Валовой анализ ……………………………………
- •Раздел II. Ионно-солевой комплекс почв ……………………
- •Раздел III. Органическое вещество почв
3.6.2.2. Определение коэффициента цветности q4/6
При анализе состава гумуса можно ограничиться определением оптической плотности при двух длинах волн: 465 и 650 нм, или при близких к ним значениях. Пользуясь полученными значениями оптической плотности, находят коэффициент цветности:
Q4/6 = D465/D650,
где D465 – величина оптической плотности при длине волны 465 нм; D650 – величина оптической плотности при длине волны 650 нм.
По мнению М.М. Кононовой и Н.П. Бельчиковой (1961) надежные результаты при определении величины отношения Q4/6 получаются в том случае, когда содержание углерода в темноокрашенных растворах (вытяжки из черноземов, каштановых почв) колеблется от 0,03 до 0,15 г/л, в светлоокрашенных (вытяжки из подзолистых почв, красноземов, сероземов) от 0,06 до 0,18 г/л. Толщина кюветы и в том и в другом случае 1 см.
Д.С. Орлов и Л.А. Гришина (1981) рекомендуют определять величину Q4/6, используя две кюветы разных размеров.
Наиболее точны измерения оптической плотности при значениях D в интервале 0,15-0,9. Если при 465 нм оптическая плотность имеет значения около 0,3, то при 650 она будет всего лишь 0,04 - 0,1. Это может привести к большим ошибкам в измерениях. Что бы избежать этого сначала измеряют оптическую плотность для области 400 нм, затем повторяют съемку спектра от 600 до 700 нм с кюветой, рабочая длина которой больше в 3-5 раз первой кюветы. Затем по спектрам находят искомые оптические плотности для соответствующих длин волн - 465 и 650 нм Отношение Q4/6 вычисляют, учитывая размер кювет по формуле:
![]()
где L465 и L650 – толщина кювет, с которыми были произведены измерения оптической плотности при 465 (D465) и 650 нм (D650) соответственно.
Величина отношения Q4/6 не зависит от концентрации углерода в растворе и, отражая степень крутизны спектрофотометрических кривых, является характерной для гумусовых кислот того или иного типа почв. Используется этот показатель для сравнительной характеристики степени конденсированности молекул гумусовых кислот.
Чем больше величина отношения Е4:Е6, тем более развита периферическая часть молекулы и тем меньшую долю составляет ароматическое ядро.
По данным М.М. Кононовой и Н.П. Бельчиковой (1961) отношение коэффициент цветности Q4/6 у гуминовых кислот разных типов почв имеет следующие значения: для подзолистых почв – около 5,0; темно-серой лесной почвы – 3,5; обыкновенного чернозема – 3,0-3,5; каштановых почв – 3,8-4,0; сероземов – 4,0-4,5; красноземов – около 5,0. У фульвокислот коэффициент Q4/6 колеблется в пределах 6,0 – 8,5.
3.6.3. Гель-хроматография гумусовых веществ
Определение молекулярных масс является одной из наиболее сложных проблем химии гумусовых веществ. Гумусовые вещества полидисперсны, причем даже относительно гомогенная фракция любой гумусовой кислоты, полученная одним способом, другим методом может быть еще разделена на ряд фракций.
Гумусовые кислоты довольно интенсивно окрашены и содержат большой набор функциональных групп и, кроме того, склонны к образованию ассоциатов. Все это ограничивает круг пригодных методов. В настоящее время одним из наиболее эффективных приемов определения молекулярных масс гумусовых веществ считается метод гель-хроматографии.
Сущность метода гель-хроматографии заключается в пространственном разделении молекул различных размеров с помощью пористых гелей. Специально для целей гель-хроматографии создано несколько типов гелей. При изучении гумусовых веществ наиболее часто используются сефадексы. Сефадекс – это декстрановый гель, который получают на основе полисахарида, продуцируемого бактериями.
Существуют различные типы гелей, различающиеся пределом разделения (табл. 29).
Таблица 29. Пределы разделения различных типов гелей
|
Тип геля |
Область фракционирования пептидов и глобулярных белков |
|
G-10 |
< 700 |
|
G15 |
<1500 |
|
G-25 |
1000-5000 |
|
G-50 |
1000-30 000 |
|
G-75 |
3000-70 000 |
|
G-100 |
4000-150 000 |
|
G-150 |
5000-400 000 |
|
G-200 |
5000-800 000 |
Колонка для гелевой хроматографии содержит набухшие гранулы геля, пространство между гранулами геля и его поры заполнены растворителем. Колонка характеризуется следующими параметрами. Объем матрицы, или объем сухого геля, обозначают Vm. Объем растворителя внутри гранул («связанный» растворитель) называется внутренним объемом и обозначается Vi. Объем растворителя между гранулами называется внешним объемом или свободным объемом и обозначается V0. Общий объем геля будет равен:
Vt = Vm + Vi + V0.
На поверхность геля в колонке помещают определенный объем раствора гумусовой кислоты. Если гумусовая кислота содержит молекулы, различающиеся по размерам, то они будут неравномерно распределяться между гелем и растворителем. Молекулы меньшего размера будут проникать в поры геля, а крупные молекулы будут оставаться только во внешнем по отношению к гелю объеме раствора. Молекулы меньших размеров будут также находиться и во внешнем объеме раствора, но их доля в этом объеме будет меньше чем в исходном веществе, что зависит от соотношения Vt и V0.
Промывание колонки растворителем приведет к вертикальному перемещению молекул исследуемого вещества вдоль колонки. Крупные молекулы будут двигаться свободно с растворителем. Молекулы меньшего размера в каждом новом слое колонки будут распределяться по всему объему геля, т.е. проникать в его поры и вымываться из них медленнее, чем движутся крупные молекулы. В результате этого крупные молекулы будут двигаться по колонке быстрее, чем молекулы меньшего размера, движение которых тормозится диффузией в поровое пространство геля. В результате этого в колонке будут формироваться зоны (слои), содержащие молекулы различных размеров и движущиеся с неодинаковой скоростью (рис. 6).
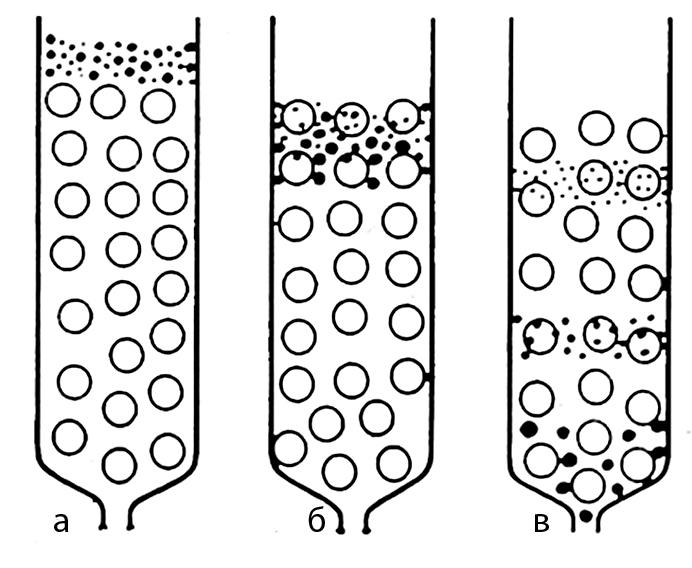
Рис. 6. Схема процесса гель-хроматографии.
а – момент внесения смеси веществ на колонку; б – начало фракционирования; в – начало выхода из колонки фракции наиболее крупных молекул.
Вытекающий из колонки раствор (элюат) собирают порциями по 2-5 мл и в каждой порции определяют оптическую плотность при длине волны 215-240 нм или содержание углерода. По полученным результатам строят график, на котором по оси абсцисс откладывают объем элюата (мл), а по оси ординат – величину оптической плотности D (или концентрацию углерода) каждой порции элюата (рис. 7).
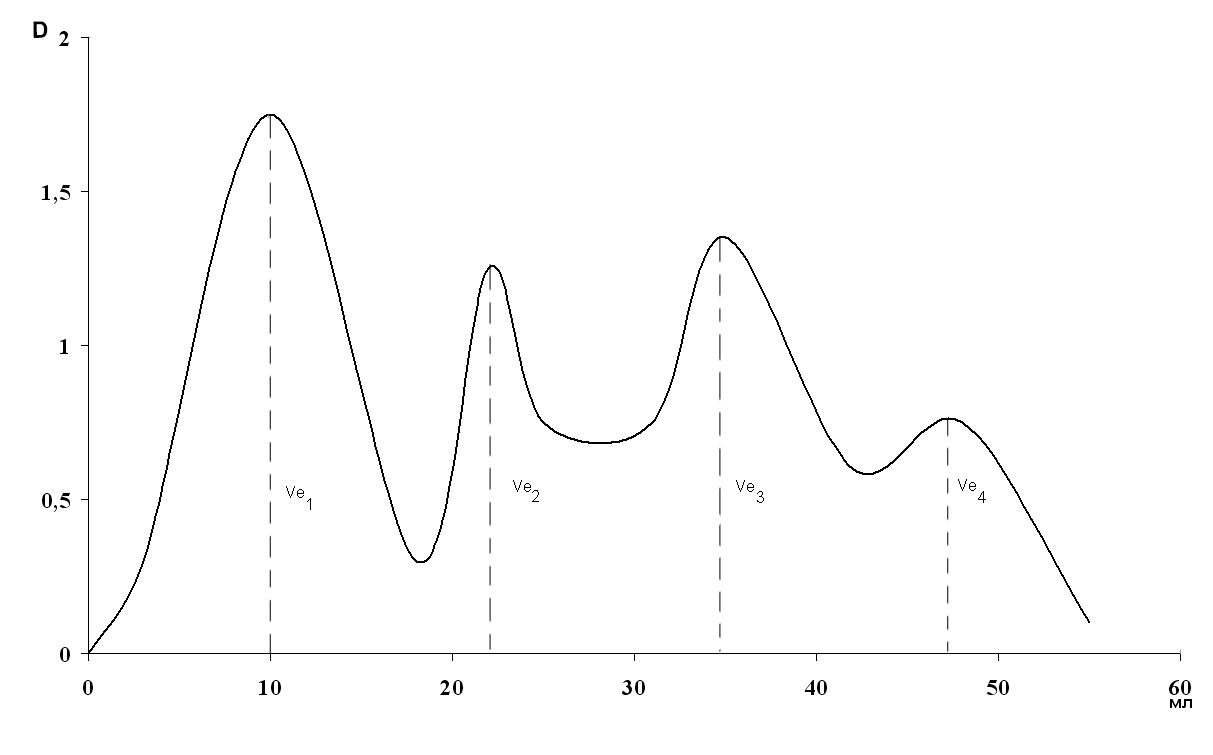
Рис. 7. Гель-хроматограмма гумата натрия.
Полученная таким образом кривая элюирования или гель-хроматограмма дает представление о соотношении молекул (частиц) с разными молекулярными массами, или о молекулярно-массовом распределении. Максимумы на гель-хроматограмме характеризуют отдельные сравнительно монодисперсные фракции, доля которых в составе препарата в первом приближении пропорциональна площади, ограниченной кривой элюирования для каждой фракции. Кроме того, с помощью максимумов на гель-хроматограмме находят молекулярные массы фракций.
Важнейшим показателем, необходимым для вычисления молекулярных масс является объем выхода элюата Ve. Это объем элюата, собранный с момента нанесения вещества на колонку и до того момента, когда на кривой появляется максимум выхода вещества.
Между объемом выхода и молекулярной массой хроматографируемого вещества существует определенная зависимость. Для глобулярных белков формула имеет вид:
lg M = M0 – (6,062 – 5,00d) ∙ (Vt/V0),
где M – молекулярная масса; M0 – константа; d – плотность набухшего геля.
Для различных типов сефадексов (G-50, G-75, G-100, G-150) эта формула имеет конкретный вид:
для G-50: lg M = 4,79 – 0,42(Ve/V0),
для G-75: lg M = 5,624 – 0,752(Ve/V0),
для G-100: lg M = 5,941 – 0,847(Ve/V0),
для G-150: lg M = 6,698 – 0,987(Ve/V0).
Для определения свободного объема (V0) используется вещество с известной молекулярной массой, которая заведомо значительно больше предела разделения геля. Обычно используется голубой декстран, молекулярная масса которого составляет 2 ∙ 106 Дальтон.
После нахождения молекулярных масс индивидуальных фракций находят среднечисловое значение молекулярной массы анализируемого вещества по формуле:
![]()
где Mn – среднечисловое значение молекулярной массы анализируемого вещества; Mi – молекулярная масса отдельной фракции; ni – содержание этой фракции в %.
Полученные результаты сводят в таблицу (табл. 30).
Таблица 30. Молекулярно-массовый состав гуминовых кислот обыкновенного чернозема, сефадекс G-75.
|
Почва |
Горизонт |
Номер фракции |
Молекулярная масса фракций |
Относительное содержание, % |
Примерная среднечисловая молекулярная масса |
|
Чернозем обыкновенный |
Апах |
1 |
≥75000 |
60 |
50700 |
|
2 |
16400 |
33 | |||
|
3 |
3600 |
7 | |||
|
АВ1 |
1 |
≥75000 |
73 |
57700 | |
|
2 |
13200 |
20 | |||
|
3 |
4500 |
7 |
Результаты гель-хроматографии гумусовых веществ во многом зависят от применяемого растворителя. При неудачно выбранном растворителе может происходить агрегирование гуминовых и гиматомелановых кислот в случае недостаточно высоких значений рН и в присутствии избытка электролита и, кроме того, адсорбция гумусовых веществ матрицей геля, что отчетливо проявляется при гель-хроматографии гумусовых кислот с высокой зольностью. Все это искажает результаты исследования.
Агрегирование способствует кажущемуся увеличению высокомолекулярной фракции в составе анализируемого вещества, тогда как частичная адсорбция изменяет соотношение в сторону кажущегося увеличения доли низкомолекулярных фракций. При необратимой адсорбции результаты становятся неопределенными и характеризуют только ту часть вещества, которая была элюирована из колонки.
Необратимую адсорбцию гумусовых кислот можно наблюдать визуально; в этом случае в верхней части колонки остается неподвижная окрашенная зона. Если взаимодействие гумусовой кислоты с гелем сефадекса обратимо, то оно тормозит передвижение вещества по колонке. Взаимодействие гумусовой кислоты с гелем можно установить на основании коэффициента распределения (Kd):
![]()
Все величины в правой части находятся опытным путем. V0 – объем элюата очень крупных молекул известного вещества, Vi – объем элюата очень мелких молекул известного вещества, Ve – объем элюата фракции анализируемого вещества. Если коэффициент Kd превышает 1, то вполне вероятно, что имело место взаимодействие гумусовой кислоты с матрицей геля. Однако при таком определении остается сомнение – не происходит ли частичная сорбция мелких молекул внутри гранул, что приведет к завышенному значению Vi. Поэтому на практике нередко предпочитают использовать другой коэффициент, характеризующий движение хроматографической зоны вдоль колонки (Kav):
![]()
Объем колонки (Vt) легко определить по ее внутреннему диаметру и длине.
Существенное влияние на результаты гель-хроматографии гумусовых веществ оказывает явление ассоциации их молекул, т.е. взаимодействие их друг с другом. В результате этого происходит кажущееся увеличение молекулярных масс фракций или появление фракций, которых в реальности не существует. Ассоциация молекул возможна за счет водородной или межмолекулярной связи, в результате взаимодействия положительно и отрицательно заряженных функциональных групп гумусовых кислот, а при недостаточной очистке препарата и за счет металлов служащих мостиками между молекулами гумусовых кислот. Для предотвращения ассоциации молекул гумусовых кислот применяют различные детергенты, подавляющие этот процесс, однако полностью исключить ассоциацию молекул, по-видимому, затруднительно.
