
- •Биологическая химия Руководство к самостоятельной работе студентов
- •Введение
- •Правила работы с тестами
- •Модуль 1 «Белки. Ферменты»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Графологическая структура
- •3.1. Реагенты, позволяющие определить n-концевую аминокислоту -
- •3.2. Реагенты позволяющие определить с-концевую аминокислоту -
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Фотоэлектроколориметр
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Графологическая структура «Методы осаждения белка»
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Графологическая структура «Выделение и очистка белков»
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Графологическая структура «Общие свойства ферментов»
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Основы иммуноферментного анализа
- •Клинико-диагностическое значение ифа
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Контрольные вопросы к модулю «Белки. Ферменты»
- •Примеры заданий тестового контроля знаний
- •Эталоны ответов
- •Модуль 2. «Биохимия питания. Общие пути катаболизма. Биоэнергетика»
- •Рекомендуемые темы реферативных сообщений
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Основные характеристики пищеварительных соков
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •2.1. Анилиновая проба на витамин д.
- •2.2. Реакция с серной кислотой.
- •5.1. Реакция с гидросульфитом натрия.
- •5.2. Реакция с раствором уксусно-кислой меди.
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Количественное определение витаминов.
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний Вид 1. Выберите один наиболее правильный ответ.
- •Самостоятельная работа
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестовых заданий контроля исходного уровня знаний Вид 1. Выбор одного наиболее верного ответа
- •Вид 2. Установить соответствие.
- •Примеры ситуационных задач
- •Задача 2. В эксперименте с изолированными митохондриями в качестве субстрата дыхания используется изоцитрат. Определите:
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •План занятия
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры заданий тестового контроля знаний
- •Ответы на тесты
- •Модуль 3 «Структура и обмен углеводов»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры тест-контроля
- •Эталоны ответов на тесты
- •Модуль 4. «Структура и обмен липидов»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры тест-контроля
- •Эталоны ответов на тесты
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Занятие № 4. Обмен сложных белков – нуклеопротеинов и хромопротеинов.
- •Методические указания к самоподготовке
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы к коллоквиуму
- •Примеры тестовых заданий
- •Эталоны ответов на тесты:
- •Модуль 6. «Взаимосвязь и регуляция обмена веществ. Гормоны»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Ситуационные задачи
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Современные методы определения количества гормонов
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы к зачетному занятию
- •Примеры тест-контроля
- •Эталоны ответов на тесты
- •Модуль 7. «Биохимия органов и тканей»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Занятие № 3. Биохимия мышечной и нервной тканей.
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •1. Качественное определение белка.
- •2. Качественное определение сахара в моче с помощью реактива Фелинга.
- •3. Качественное обнаружение сахара в моче при помощи индикаторной бумаги «Глюкотест».
- •4. Количественное определение белка в моче по методу Робертса-Стольникова.
- •5. Качественное определение кетоновых тел.
- •6. Качественная реакция на кровяные пигменты.
- •7. Качественное определение желчных пигментов.
- •8. Проба Петенкофера на желчные кислоты.
- •9. Проба Яффе на уробилин.
- •10. Качественное определение индикана в моче.
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры тестовых заданий
- •Эталоны ответов к тестовым заданиям
- •Графологическая структура модуля «Белки. Ферменты»
- •Рекомендуемая литература
- •Журналы по биохимии
- •Некоторые референтные значения биохимических показателей жидких сред организма
- •Некоторые референтные значения биохимических показателей жидких сред организма у детей
- •Оглавление
Эталоны ответов к тестовым заданиям
Вид 1. 1.1. А. –б; 1.1. Б. – а.
1.2. – г (включение пролина вызывает изгиб полипептидной цепи, делая невозможным вращение вокруг связи между a-углеродным атомом и азотом иминогруппы);
1.3. – в (гидрофобные радикалы прячутся внутри частицы белка);
1.4. – а (рIасп+ рIлиз/2).
Вид 2. 2.1. – 1-а, 2-б, 3-в, 4-г; 5-е, 6-ж, 7-д; 2.2. - 1-г, 2-в, 3-б, 4-а.
Вид 3.3.1. - 4; 3.2. –4; 3.3. – 4; 3.4. – 2,4.
Вид 4. 4.1. –Д (-, +, -), 4.2 –Е (-, -, -), 4.3 – С (+, -, -).
Эталоны ответов на ситуационные задачи
Задача 1. Аминокислотный состав пептида отличается высоким содержанием диаминомонокарбоновых кислот – лизина и аргинина, в то же время, в структуре пептида отсутствуют ароматические и гетероциклические аминокислоты - фенилаланин, тирозин, гистидин и триптофан, дающие положительную ксантопротеиновую реакцию. В частности, тирозин с концентрированной азотной кислотой реагирует по следующей схеме:
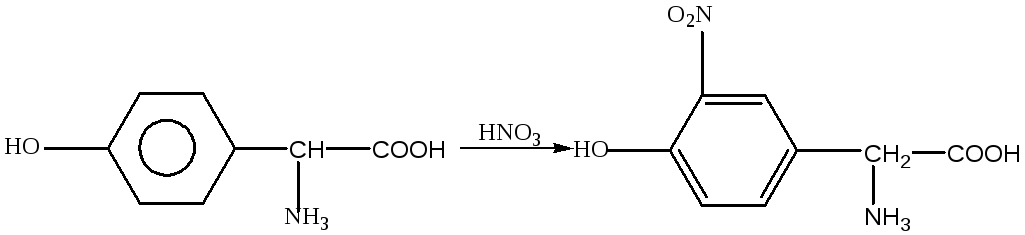 желтая
окраска
желтая
окраска
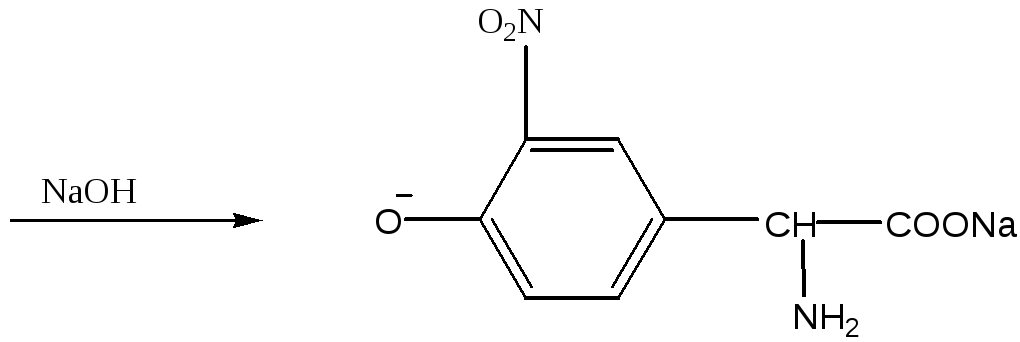
оранжевая окраска
Задача 2. В сильнокислой и щелочной среде осаждению белков препятствует заряд (отрицательный в кислой и положительный в щелочной). Поэтому, если рН исследуемой мочи не соответствует слабокислой реакции, можно получить ложно отрицательный результат.
Задача 3. В живой клетке процесс укладки синтезируемой полипептидной цепи - фолдинг регулируется особыми белками шаперонами. Эти белки контролируют формирование стабильной и биологически активной конформации, предотвращая образование из полипептидной цепи неспецифических клубков и агрегатов, а также участвуют в доставке белков к субклеточным мишеням.
Занятие № 3. Методы выделения и очистки белков.
Цель занятия.Освоить некоторые методы выделения и очистки белков, используемые в препаративной биохимии и лабораторной медицине. В результате освоения темы студент должен ознакомиться с методом электрофоретического разделения белков и научиться анализировать протеинограмму.
|
Студент должен | |
|
знать: |
уметь: |
|
-физико-химические свойства белков; -методы фракционирования белков; -методы очистки белков от низкомолеклярных примесей. |
-анализировать протеинограмму; -производить очистку белка от низкомолекулярных примесей методом гель-фильтрации и диализа. |
Содержание занятия:студентам предстоит ответить на вопросы тест-контроля и вопросы преподавателя; ознакомиться с методами электрофореза белка на бумаге, очистки раствора белка от низкомолекулярных примесей методом диализа и гельфильтрации на молселекте, проанализировать полученные данные и сделать выводы.
УИРС- решение ситуационных задач, обсуждение рефератов.
Методические указания к самоподготовке
Методы препаративной химии белков основаны на их физико-химических свойствах, поэтому при подготовке к занятию следует повторить физико-химические свойства белков. Особое внимание следует уделить коллоидным свойствам белков, таким понятиям как амфотерность аминокислот и белков, зависимость электрических свойств белков от аминокислотного состава и свойствам белков в изоэлектрическом состоянии. Для лучшего усвоения материала занятия, используя учебник, лекции и дополнительную литературу, выполните следующие задания.
|
№№ |
Задание |
Указания к выполнению задания |
|
1 |
2 |
3 |
|
1. |
Изучите методы выделения индивидуальных белков. |
1. Перечислите методы фракционирования белков, позволяющие получить индивидуальный белок. 2. Кратко сформулируйте, на каких физико-химических свойствах основаны перечисленные методы. |
|
2. |
Изучите, почему белки обладают свойствами коллоидов. |
1.Выпишите способы определения молекулярной массы белков. 2.Перечислите данные, подтверждающие высокую молекулярную массу белков. 3.Чем можете подтвердить способность белков образовывать коллоидные растворы? 5.Охарактеризуйте принцип метода диализа. Какое практическое значение имеет диализ? |
|
3. |
Вспомните электрические свойства белков. |
1. Вспомните механизм возникновения электрического заряда. Что такое изоэлектрическая точка? 2.Охарактеризуйте явление электрофореза белков. Запомните виды электрофореза. 3.Укажите факторы, от которых зависит скорость перемещения белковых молекул в поле постоянного электрического тока. 4. Напишите, на какие фракции разделяют белки сыворотки крови при электрофорезе на бумаге. Выпишите протеинограмму – соотношение белковых фракций - здорового ребенка и взрослого человека. 5. Изучите возможности электрофоретического разделения белков на полиакриламидном геле, принцип диск-электрофореза и его значение для разделения белков сыворотки крови. |
|
4. |
Повторите растворимость белков. |
1. Выясните, чем определяется растворимость белков, и какие факторы стабилизируют белковую молекулу в растворе. |
|
5. |
Изучите метод хроматографии белков. |
1.Выпишите классификацию методов хроматографического разделения белков по механизму разделения и технике проведения. Сформулируйте принцип метода адсорбционной, ионнообменной, афинной, и распределительной хроматографии. Кратко опишите процедуру гель-фильтрации и газожидкостной хроматографии. |
Подготовьте к предстоящему занятию протокол, в котором отразите принцип метода и ход работы. Не забудьте оставить достаточно места для выводов после выполнения каждой работы.
