
- •Биологическая химия Руководство к самостоятельной работе студентов
- •Введение
- •Правила работы с тестами
- •Модуль 1 «Белки. Ферменты»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Графологическая структура
- •3.1. Реагенты, позволяющие определить n-концевую аминокислоту -
- •3.2. Реагенты позволяющие определить с-концевую аминокислоту -
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Фотоэлектроколориметр
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Графологическая структура «Методы осаждения белка»
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Графологическая структура «Выделение и очистка белков»
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Графологическая структура «Общие свойства ферментов»
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Основы иммуноферментного анализа
- •Клинико-диагностическое значение ифа
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Контрольные вопросы к модулю «Белки. Ферменты»
- •Примеры заданий тестового контроля знаний
- •Эталоны ответов
- •Модуль 2. «Биохимия питания. Общие пути катаболизма. Биоэнергетика»
- •Рекомендуемые темы реферативных сообщений
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Основные характеристики пищеварительных соков
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •2.1. Анилиновая проба на витамин д.
- •2.2. Реакция с серной кислотой.
- •5.1. Реакция с гидросульфитом натрия.
- •5.2. Реакция с раствором уксусно-кислой меди.
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Количественное определение витаминов.
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний Вид 1. Выберите один наиболее правильный ответ.
- •Самостоятельная работа
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •План занятия
- •Методические указания к самоподготовке
- •Примеры тестовых заданий контроля исходного уровня знаний Вид 1. Выбор одного наиболее верного ответа
- •Вид 2. Установить соответствие.
- •Примеры ситуационных задач
- •Задача 2. В эксперименте с изолированными митохондриями в качестве субстрата дыхания используется изоцитрат. Определите:
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •План занятия
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры заданий тестового контроля знаний
- •Ответы на тесты
- •Модуль 3 «Структура и обмен углеводов»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры тест-контроля
- •Эталоны ответов на тесты
- •Модуль 4. «Структура и обмен липидов»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры тест-контроля
- •Эталоны ответов на тесты
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Занятие № 4. Обмен сложных белков – нуклеопротеинов и хромопротеинов.
- •Методические указания к самоподготовке
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы к коллоквиуму
- •Примеры тестовых заданий
- •Эталоны ответов на тесты:
- •Модуль 6. «Взаимосвязь и регуляция обмена веществ. Гормоны»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Ситуационные задачи
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Современные методы определения количества гормонов
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы к зачетному занятию
- •Примеры тест-контроля
- •Эталоны ответов на тесты
- •Модуль 7. «Биохимия органов и тканей»
- •Рекомендуемые темы реферативных сообщений
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Занятие № 3. Биохимия мышечной и нервной тканей.
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры контроля исходного уровня знаний
- •Примеры ситуационных задач
- •Самостоятельная работа студентов
- •1. Качественное определение белка.
- •2. Качественное определение сахара в моче с помощью реактива Фелинга.
- •3. Качественное обнаружение сахара в моче при помощи индикаторной бумаги «Глюкотест».
- •4. Количественное определение белка в моче по методу Робертса-Стольникова.
- •5. Качественное определение кетоновых тел.
- •6. Качественная реакция на кровяные пигменты.
- •7. Качественное определение желчных пигментов.
- •8. Проба Петенкофера на желчные кислоты.
- •9. Проба Яффе на уробилин.
- •10. Качественное определение индикана в моче.
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Примеры тестовых заданий
- •Эталоны ответов к тестовым заданиям
- •Графологическая структура модуля «Белки. Ферменты»
- •Рекомендуемая литература
- •Журналы по биохимии
- •Некоторые референтные значения биохимических показателей жидких сред организма
- •Некоторые референтные значения биохимических показателей жидких сред организма у детей
- •Оглавление
Примеры ситуационных задач
Задача 1. Проанализируйте данные экспериментов по определению скорости ферментативной реакции при различных концентрациях субстрата, а также в присутствии ингибитора. По имеющимся данным постройте график Лайнуивера–Берка, определите Кmфермента и тип ингибирования.
|
Концентрация субстрата, М |
Скорость реакции, мкмоль/мин |
Скорость в присутствии ингибитора, мкмоль/мин |
|
6´10-6 1´10-5 2´10-5 6´10-5 1,8´10-4 |
20,8 29 45 67,6 87 |
4,2 5,8 9 13,6 16,2 |
Задача 2.Используя график Лайнувивера-Берка, проанализируйте, как изменились кинетические характеристики фермента в присутствии ингибитора. Определите тип ингибирования.
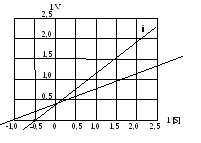
Задача 3. Зависимость V от [S] для реакции, катализируемой транскарбамоилазой, выражается сигмоидной (S-образной) кривой. После воздействия на фермент солями ртути (II) каталитическая активность фермента резко возрастает, а кривая зависимости скорости реакции от концентрации субстрата становится гиперболической. Какие выводы о механизме активации фермента ионами ртути можно сделать? Приведите примеры других ферментов, активируемых подобным образом.
Самостоятельная работа студентов
Работа № 1. Влияние активаторов и ингибиторов на активность
амилазы ротовой жидкости.
Целью данной работы является установление актвирующего и ингибирующего влияния различных ионов на каталитическую активность ферментов. Так, например, ионы натрия и хлора стимулируют активность амилазы слюны, а ионы меди, наоборот, тормозят ее.
Ход работы. Споласкивают рот, в чистую пробирку собирают 3мл слюны и разводят ее в 10 раз ( добавить 27 мл дистиллированной воды). В три пробирки налить по 10 мл разведенной в 10 раз слюны. В первую пробирку добавить 1 мл 1% раствора NaCl, во вторую-1 мл 1% раствора CuSО4, в третью- 1 мл дистиллированной воды (контроль). После этого в каждую пробирку прилить по 4 мл 0,5% раствора крахмала, пробирки встряхнуть и поместить в водяную баню или в термостат с температурой 380С на 10 мин. После истечения указанного времени с содержимым каждой пробирки проделать качественную реакцию на крахмал и пробу Троммера: к 5 каплям исследуемой жидкости прибавить 5 капель 10% раствора NaOH и 5 капель раствора CuSO4 и нагреть.
Полученные результаты занесите в таблицу, определите тип активирования и тип ингибирования.
|
№ п/п |
Субстрат |
Фермент |
Добавляемое вещество |
Проба на крахмал |
Проба Троммера |
Вывод |
Работа № 2. Конкурентное торможение сукцинатдегидрогеназы
малоновой кислотой.
Принцип методаоснован на изменении окраски метиленовой сини при восстановлении его в ходе окислительно-восстановительной реакции. При дегидрировании янтарной кислоты сукцинатдегидрогеназой акцептором водорода является метиленовая синь, которая при восстановлении обесцвечивается. Чем быстрее обесцвечивается метиленовая синь, тем выше активность сукцинатдегидрогеназы. Ингибирование фермента замедляет скорость обесцвечивания метиленовой сини.
Ход работы.В три пронумерованные пробирки поместить 3-4 капли мышечной кашицы и добавить: в первую – 0,8 мл воды, во вторую- 0,2 мл 1% раствора малоновой кислоты и 0,6 мл воды, в третью – 0,8 мл 1% раствора малоновой кислоты. Во все три пробирки добавляют по 1 мл 1% раствора янтарной кислоты и по 1 капле 1% раствора метиленовой сини. После перемешивания добавляют по 3 капли вазелинового масла. Пробирки ставят в водяную баню, нагретую до 370С. Через 5 мин наблюдают изменение окраски раствора. Сравните степень уменьшения голубого окрашивания в 3-х пробирках и сделать вывод о механизме действия малоновой кислоты на активность сукцинатдегидрогеназы.
Отметьте результат и сделайте вывод.
