
- •Триада Селье (стресса):
- •Стадия истощения.
- •3. Дыхательная недостаточность, её проявления. Изменения газового состава артериальной крови на различных стадиях дыхательной недостаточности.
- •2. Аллергические реакции III (иммунокомплексного) типа. Этиология, патогенез, клинические проявления. Патогенез сывороточной болезни. Аллергические реакции III типа (иммунокомплексные)
- •3. Хроническая почечная недостаточность; формы, причины, механизмы развития и клинические проявления. Уремическая кома.
- •2. Аллергия. Общая характеристика и значение в патологии. Связь аллергии и иммунитета. Аллергены и антитела, их виды и особенности. Стадии аллергической реакции.
- •3. Коронарная недостаточность; характеристика понятия, виды.
- •3. Острая артериальная гипотония; причины, виды и механизмы коллапса.
- •3. Нефрозы; формы, этиология, патогенез и основные клинические проявления.
- •Нефротический синдром
- •Этиология
- •Патогенез острого нефротического синдрома
- •Патогенез хронического нефротического синдрома
- •2. Изменения обмена веществ, структуры клеток и функции органов при лихорадке. Участие нервной, иммунной и эндокринной систем в развитии лихорадки. Отличие лихорадки от гипертермии.
- •3. Боль; причины и механизмы возникновения, значение для организма. Принципы обезболивания.
- •2. Местные и общие клинические проявления воспаления, их патогенез.
- •Местные (кардиальные) признаки воспаления
- •Общие признаки воспаления
- •3. Аллергические (инфекционно-аллергические) заболевания почек, Гломерулонефрит; формы, этиология, патогенез и клинические проявления, исходы.
- •Острый гломерулонефрит
- •Этиология
- •Патогенез иммунопатологического гломерулонефрита
- •2. Причины, механизмы развития, изменения газового состава артериальной и венозной крови при экзогенной, дыхательной, сердечно-сосудистой, кровяной и тканевой гипоксии. Смешанная гипоксия.
- •3. Печёночная кома; общая характеристика, виды, патогенез, клинические проявления и механизмы возникающих расстройств.
- •3. Этиология, патогенез и клинические проявления тромбофилического синдрома. Принципы лекарственной коррекции расстройств гемостаза.
- •2. Экссудация; изменения местного кровообращения и микроциркуляции, выход жидкой части крови в ткань и развитие отёка, их механизмы и значение. Виды и состав экссудатов.
- •3. Вторичные, симптоматические гипертонии (лекарственная, почечная, эндокринная, рефлексогенная и др.). Этиология, патогенез, клинические проявления, последствия, осложнения.
- •2. Общая характеристика гипоксии. Устойчивость разных органов и тканей к кислородному голоданию, факторы, определяющие устойчивость. Основные типы гипоксии.
- •3. Основные проявления расстройств деятельности почек, их происхождение. Изменения диуреза, состава мочи и крови; отёки, артериальная гипертония.
- •2. Лекарственная аллергия. Аутоаллергия.
- •1 Тип аллергии – реагеновый, атопический и анафилактический
- •Аллергические реакции I типа
- •(Реагиновые, атопические, анафилактические)
- •3. Ишемическая болезнь сердца; этиология, патогенез. Стенокардия, инфаркт миокарда; ведущие клинические проявления.
- •2. Аллергические реакции I (анафилактического, атопического) типа. Этиология, патогенез, клинические проявления. Патогенез бронхиальной астмы. Принципы лекарственной терапии.
- •1 Тип аллергии – реагеновый, атопический и анафилактический
- •Аллергические реакции I типа
- •(Реагиновые, атопические, анафилактические)
- •2. Пирогенные вещества; их химическая природа и места образования. Первичные и вторичные пирогены; лейкоцитарные пирогены (интерлейкин-I). Механизмы действия пирогенов.
- •2. Эмиграция клеток, ее молекулярные и другие механизмы. Фагоцитоз; виды, стадии, механизмы. Пролиферация; механизмы формирования и роль при воспалении.
- •2. Аллергические реакции замедленного типа (гзт) Этиология, патогенез, клинические проявления. Принципы лекарственной терапии.
- •Аллергическая реакция IV типа (туберкулиновая, клеточная, гзт)
- •Аллергические реакции IV типа
- •(Замедленного, клеточного, туберкулинового)
- •3. Патологическая гипертрофия миокарда, стадии, механизмы декомпенсации сердца.
- •Дыхательный (газовый) алкалоз
- •3. Артериальные гипотонии. Виды, причины и механизмы развития. Понятие о гипотонической болезни. Проявления и последствия гипотонических состояний.
- •Бронхо-легочная дыхательная недостаточность
- •3. Токсикомании; алкоголизм, наркомании и лекарственная зависимость. Этиология, механизмы формирования, клинические проявления на разных стадиях развития, исходы.
- •Билет 38
- •Триада Селье (стресса):
- •Стадия истощения.
- •Патогенез «шоковго легкого»
- •Синдром длительного раздавливания
- •(Краш-синдром)
- •Ожоговый шок
- •Шок в результате электротравмы
- •Кардиогенный шок
- •Гиповолемический шок
- •Постгемотрансфузионный шок
- •Токсико-септический шок
- •Травматический шок
- •Синдром длительного раздавливания
- •(Краш-синдром)
- •Ожоговый шок
- •Шок в результате электротравмы
- •Кардиогенный шок
- •Гиповолемический шок
- •Постгемотрансфузионный шок
- •Токсико-септический шок
- •Бронхо-легочная дыхательная недостаточность
- •2. Общие и специфические механизмы развития и клинические проявления коматозных состояний.
- •3. Коронарная недостаточность; характеристика понятия, виды.
- •3. Вторичные, симптоматические гипертонии (лекарственная, почечная, эндокринная, рефлексогенная и др.). Этиология, патогенез, клинические проявления, последствия, осложнения.
- •2. Проявление повреждения клетки в изменении обмена веществ, ее структуры и функции. Понятие о специфических и неспецифических проявлениях повреждения; обратимых и необратимых повреждениях.
- •3. Перегрузочная сердечная недостаточность. Понятие о перегрузке объёмом и давлением крови. Причины, механизмы развития и патоморфология перегрузочной недостаточности сердца.
- •2. Гипергидратация; виды, причины возникновения, механизмы развития, проявления и последствия. Принципы предупреждения и лечения гипергидратации.
- •3. Артериальные гипотонии. Виды, причины и механизмы развития. Понятие о гипотонической болезни. Проявления и последствия гипотонических состояний.
- •2. Патогенез сердечных, почечных, токсических, аллергических, голодных отёков. Местные и общие нарушения в тканях при отёках, их клинические проявления.
- •3. Боль; причины и механизмы возникновения, значение для организма. Принципы обезболивания.
- •3. Патологическая гипертрофия миокарда, стадии, механизмы декомпенсация сердца.
- •2. Гипероксия. Причины возникновения, формы. Механизмы повреждающего действия кислорода. Роль свободно-радикальных процессов. Понятие о системе антиокислительной защиты организма.
- •3. Виды, этиология, патогенез и клинические проявления геморрагических диатезов. Роль наследственных факторов, а также иммунопатологических механизмов в их патогенезе.
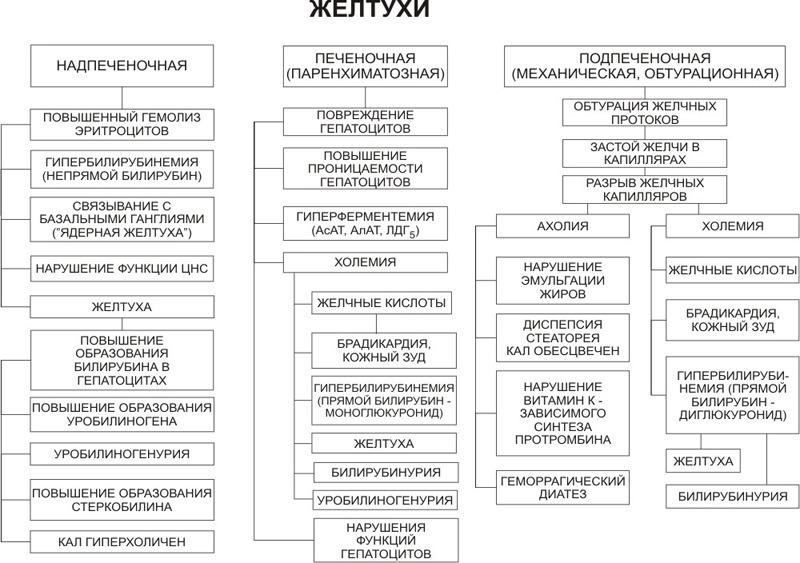
Формируется на фоне гемолитической анемии (см.анемии), связанные с эндо- и экзоэритроцитарными факторами.
У пациента гемолиз эритроцитов возрастает концентрация в крови непрямого билирубина. Печень работает хорошо, но с этой концентрацией справиться не может. В кишечнике образуется большое количество стеркобилиногенагиперхолия кала. Моча темная за счет уробилиногена.
Физиологическая желтуха новорожденных– формируется начиная с 3 суток, длится недели 3. Связано это с тем, что во внутриутробном периоде непрямой билирубин от плода по плацентарному кровотоку отправляет маме. Когда ребенок родился, этот пть прекращается и у ребенка нарастает свой непрямой билирубин, а ферментативный системы печени, ответственный за конъюгацию нарастают постепенно.
Интенсивность окрашивания ребенка не зависит от билирубина, а зависит от альбуминов.
Гемолитическая болезнь новорожденных– возникает когда у резус- мамы зарождается резус+ ребенок. На чужеродный белок плода возникают ат, они проникают и воздействуют на плод, в 1-ю очередь на эритроциты. В результате этого гемолиза образуется непрямой билирубин, он пропитывает ткани богатые липидами (головной мозг, кора надпочечников). Может быть анемическая форма (множество эритроцитов разрушено), желтушная форма (желтуха, симптом заходящего солнца), отечная форма.
Билет 38
. Нарушения обмена веществ, структуры и функции клеток и органов при гипоксии. Принципы предупреждения и лекарственной терапии гипоксических состояний.
Механизм нарушений обмена веществ
При гипоксии нарушается обмен веществ. При гипоксии формируется дефицит макроэргов и избыток АДФ и АМФ. В анаэробных условиях (голодание субстратное)активируется гликолиз, который дает мало АТФ и чтобы он поддерживал жизнь ему необходимы субстраты, поэтому активируется глюконеогенез (образование глюкозы из органических веществ) и развивается отрицательный азотистый баланс и гиперазотемии, а также гиперкетонемия. Конечный продукт гликолиза – молочная кислота, которая в норме сгорает в ЦТК или идет на синтез гликогена. Но ЦТК не работает в анаэробных условия и нарушается метаболизм или синтез лактата. В результате азотистых шлаков, кетоновых тел у пациента интоксикация и метаболический ацидоз, который способствует набуханию и дистрофии митохондрий, что усугубляет нарушение энергетики ещё в большей степени, увеличение внутриклеточного калия, метаболической ацидоз способствует вакуолизации лизосомальных мембран и повреждение клетки в конце концов. Метаболические нарушения обусловливают изменение нарушения функций органов и систем:
Нарушается высшая нервная деятельность:
Снижение критики;
Ощущение дискомфорта;
Дискоординация движений;
Нарушение логики мышления;
Расстройства сознания;
«Бульбарные расстройства»;
Система кровообращения:
Снижение сердечного выброса;
Коронарная недостаточность;
Аритмии;
Гипертензивные реакции;
Расстройства микроциркуляции;
Внешнее дыхание:
Нарушение вентиляции, диффузии, перфузии;
Острая дыхательная недостаточность;
Система пищеварения:
Расстройство аппетита;
Снижение секреторной и моторной функции желудка и кишечника;
Язвы, эрозии слизистой оболочки;
Почки:
Острая почечная недостаточность;
Печень:
Острая печеночная недостаточность.
Принципы терапии гипоксии
При атрериальной гипоксемии до 90 и ниже показана оксигенация
Введение кислорода при HbO2 менее 90%
Нормобарическая;
Гипербарическая оксигенация;
Воздействие на системы транспорта О2 к тканям;
Антигипоксанты, улучшающие транспорт О2:
Повышают КЕК – переносчики О2;
Изменяющие сродство гемоглобина к О2: стимуляторы синтеза 2,3-ДФГ, фициновая кислота, В6.
Антишгипоксанты, сохраняющие энергетику в клетках при дефиците О2:
Глюкзо + инсулин + К+;
Никотинамид – источник НАД;
Янтарная кислота – индуктор окисления НАД;
Натрия оксибутират – восстановление фумарата в сукцинат – АТФ;
Активаторы гликолиза (гутимин) и глюконеогенез (ГКС).
Искусственные переносчики электронов:
Цитохром С;
Бензохиноны;
Антиоксиданты.
3. Лейкопении и агранулоцитозы; причины, механизмы возникновения и значение для организма. Роль нарушений использования лекарственных препаратов в происхождении патологии лейкоцитов. Изменения лейкоцитарной формулы при лейкопениях и агранулоцитозах.
Лейкопении – уменьшение общего количества лейкоцитов
Механизмы развития:
Уменьшение продукции лейкоцитов в костном мозге – результат наследственных и врожденных дефектов стволовых клеток, может перейти по доминантному и рецессивному пути (например, циклическая лейкопения);
Приобретенные лейкопении – результат воздействия радиации, химических факторов (продукты перегонки нефти), ЛВ с миелотоксическим эффектом.
Лейкопения может быть результатом воздействия биологических факторов: вирус гепатита Е, Эпштейна-Барр, сальмонелла.
Или дефицит веществ – белковой ткани, дефиците витаминов, микроэлементов. Развитие в костном мозге опухолевых клеток, лейкоз, метастазы других опухолей.
Уменьшение выхода лейкоцитов из костного мозга – наследственный эффект мембраны клеток (синдром ленивых клеток); поражение мембран нейтрофилов ЛВ (сульфаниламиды, цитостатики).
Повышенное разрушение в периферической крови – аутоиммунные лейкопении (ЛВ, которые выполняют роль гаптенов). После переливания крови, при гиперспленизме на фоне цирроза печени, поражение ЖКТ (гастроэнтероколит), у курильщика, при остеомиелите.
Перераспределение лейкоцитов в сосудистом русле – застой в малом круге кровообращения, при портальной гипертензии ( в системе воротной вены), при введении гистамина.
Степени тяжести лейкопений:
3-2*10 в 9 л – легкая
1,75-1,0*10 в 9 л – средняя
Меньше 0,75*10 в 9 л - тяжелая
Тжелая лейкопения – агранулоцитоз.
Бывает: миелотоксический и аутоиммунный.
Причины:
Миелотоксический - в результате воздействия ионизирующей радиации, химических факторов
Аутоиммунный – дозовой зависимости нет
Картина костного мозга
Если миелотоксический – пустой костный мозг, т.к преобладает жировая ткань
При аутоиммунном – раздраженный костный мозг, т.к много предшественников лейкопоэза.
Картина периферической крови
Если миелотоксический, то страдают все ростки кроветворения, будут анемический синдром
Если аутоиммунный, то только лейкопения
Клинические проявления
Нейтропения меньше 0,6 – снижение резистентности к бактериальной флоре;
0,3-0,5 – все воспалительные проявления легко купируются, тяжелых некротических изменений нет
Меньше 0,3 – гнойно-некротические изменения (на уровне слизистых оболочек – стоматит, ангина, пневмония с деструкцией, на коже)
Билет 39
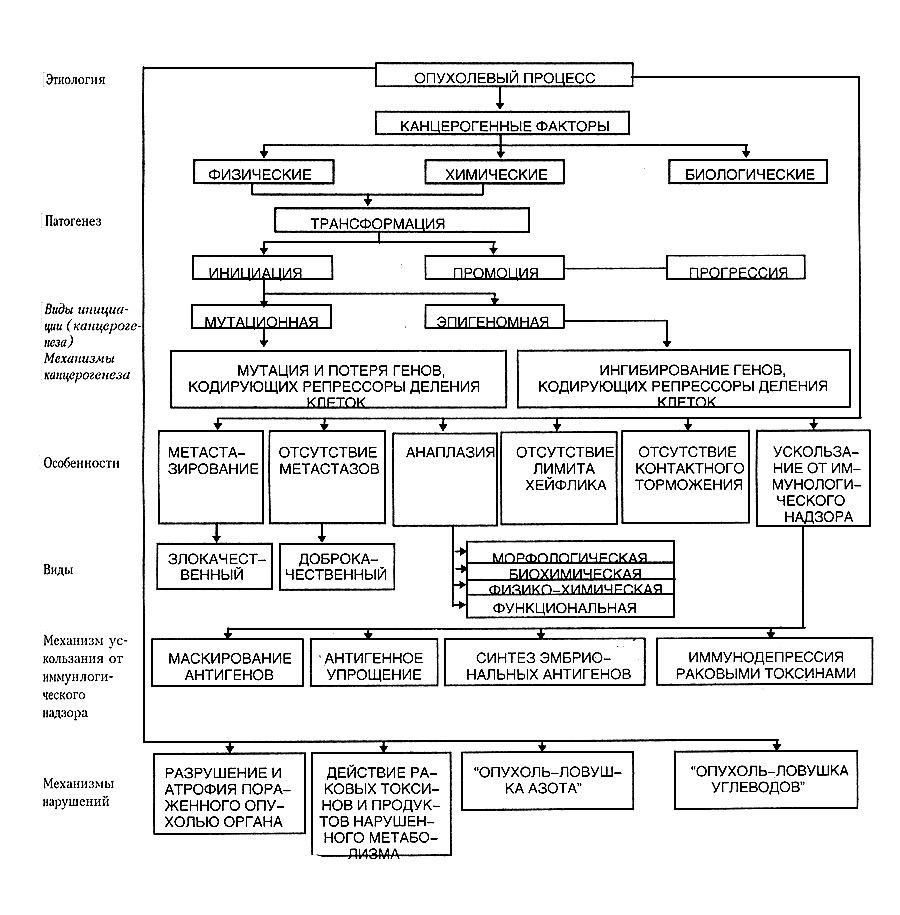
2. Этиология опухолевого процесса. Физические и химические бластомогенные факторы. Лекарственные канцерогены. Онковирусы, их виды. Понятие об онкогенах. Эндогенные канцерогены. Роль реактивности организма в возникновении и развитии опухолевого про¬цесса; антибластомная резистентность организма, неиммунные и иммунные её механизмы.
Этиология. Впервые задумались в 1785 году, 18 век. Есть причины – физические, химические, биологические; и условия (факторы риска) – снижение эффективности антиканцерогенных факторов защиты организма.
Свойства канцерогенов
Мутагенность – способность прямо или косвенно повреждать геном клети.
Высокая проницаемость серез внешние и внутренние барьеры.
Дозозависимый эффект:
Субпороговых канцерогенных доз не существует
Необратимость действия канцерогенов
Эффект суммации и кумуляции
Органотропность
Способность подавлять тканевое дыхание и иммунные реакции
Синканцерогенез – совместное действие нескольких канцерогенов и суммация их эффектов.
Коканцерогенез – усиление действия канцерогенов факторами, которые не являются сами канцерогенами.
Канцерогены физической природы.
1902 год впервые в качестве профессионального заболевания, был выявлен рак кожи у настройщика рентгеновских аппаратов.
Ионизирующая радиация – Хиросима и Нагасаки – массовые ядерные взрывы, у потерпевших в клетках изменения, характерные для действия радиации.
Химический канцерогенез – обладают органические соединения, хорошо растворяются в жирах. Среди оргнических соединений – аминоазосоединения, некрозосоединения, ароматические амины и амиды, поли и гетероцикличесвие углеводороды, ипоксиды, ахлотоксины. Неорганические соединения – азбест, хроматы, мышьяк, кобальт, бериллий.
В повседневной жизни встречаются – копченые и жареные продукты (жарение на 1 масле несколько раз), выхлопные газы, продукты нагретого асфальта, различные пищевые добавки (красители), консерванты. Афлотоксин – продукт плесневых грибов, любит жить на орехах, муке. Курение – и активное и пассивное – рак легких.
Лекарственные препараты с канцерогенным эффектом
Диэтилстилбэстрол
Хлорамфеникол (левомицетин)
Цитостатики
Барбитураты
Диуретики
Рост гормонов в канцерогенезе
Прямой канцерогенный эффект (эстрогены, андрогены);
Нарушение обмена проканцерогенов;
Стимуляция роста опухолей;
Иммунодепрессия;
Вирусная теория канцерогенеза
Впервые в начале 20 века в 1915 году был установлен факт вирусного происхождения опухолей. Взяты 2 популяции мышей: 1 – высокораковая популяция, а другая – низкораковая. Мышки беременные, после рождения мшкам прижигали молочные железы, и меняли малышей. Низкораковые детеныши заболели, и наоборот. Фактор молока .
Виды онкогенных вирусов
ДНК-вирусы – (онкоднавирусы) : аденовирусы, герпес.
РНК-вирусы – (онкорнавирусы): вирус саркомы Рауса, вирусы лейкозов – животные.
Особенности распространения у человека
Вирогенетичсекая теория Зильбера – считал, что вирус у человека передается вертикально: от родителей к детям.
Антионкогены (гены-супрессоры)
Блокада экспрессии онкогена, предотвращение инициации канцерогенеза, программирование апоптоза генотипических опухолевых клеток.
Механизм противоопухолевой защиты организма
Антиканцерогенные механизмы: препятствие проникновению канцерогенов в организм, клетку, ядро; препятствие действию канцерогенов на геном клетки.
Антимутационные – ДНК-репаразная система: подавление экспрессии онкогена; обнаружение и устранение онкогена; апоптоз.
Антицеллюлярные: неспецифическая система; специфическая защита (Т-лимфоциты).
Стадии канцерогенеза:
Инициация (мутация)
Промоция
Опухолевая прогрессия
3. Нефрозы; формы, этиология, патогенез и основные клинические проявления.
Нефротический синдром
Состояние, связанное с преимущественным поражением канальцевого аппарата почек, которое характеризуется высокой протеинурией и нарастающими нарушениями белкового, липидного и водно-электролитного обменов.
Основные причины:
Патология почек:
Гломерулонефрит;
Гломерулосклероз;
Пиелонефрит;
Внепочечная патология:
Инфекции;
Массивные ожоги;
Аутоиммунные заболевания;
Болезни системы крови;
Лекарственные поражения почек;
Злокачественные опухоли;
Сахарный диабет;
Амилоидоз;
Проявления:
Ренальные (со стороны мочи):
Нарушение канальцевой реабсорбции протеинурия, глюкозурия, липидурия, электролитурия;
Цилиндрурия – может быть, может и не быть. Образуются в кислой моче.
Экстраренальные:
Отечный синдром – отек массивный, вплоть до анасарки;
Патогенез отечного синдрома: массивная протеинурия гипоальбуминемиягипопротеинемиягипоонкия плазмыМАССИВНЫЕ ОТЕКИ.
Белки, теряемые организмом:
IgA, G, комплемента иммунодефицит;
Белки системы гемостаза тромбо-геморрагический синдром;
Альбумины гипопротеинемия;
Белки-переносчики гормонов эндокринопатия;
Трансферрин, эритропоэтин анемия;
Белки-переносчики микроэлементов, витаминов --? Ферментопатии, дистрофии, гиповитаминоз;
Артериальная гипотензия;
Нарушения липидного обмена:
Снижается липолитическая активность почек гиперлипидемия;
Дислипопротеидемия: снижение ЛПВП/ повышение ЛПНП и ЛПОНП атеросклероз;

Билет 40
2. Общая характеристика понятия, виды и патогенез шока. Стадии шока.
Шок:
Типический патологический процесс.
Возникает под воздействием сверхсильных, нередко разрушительных чрезвычайных факторов.
Характеризуется стадийным прогрессирующим расстройством жизнедеятельности организма.
В результате нарастающего нарушения функций нервной, эндокринной, сердечнососудистой и других жизненно важных систем.
Этиология шока.
Болевой:
Экзогенные факторы:
Травма
Краш-синдром
Травматические операции
Массивные ожоги
Отморожения
Электротравма
Эндогенные факторы:
Инфаркт миокарда
Почечная колика
Желчная колика
Гиповолемический шок:
Геморрагический
Дегидратационный
Гуморальный:
Анафилактический
Постгемотрансфузионный
Лучевой
Токсико-септический шок.
Психогенный.
Стадии шока:
Нейро-эндокринная (эректильная) – в ответ на чрезмерное воздействие активируется нервная и эндокринная система. Возбуждение эндокринной системы – преобладание симпато-адреналовой системы – выброс адреналина спазм перифеических сосудов, возбуждение сердечной деятельности (положительный хроно- и инотропный эффекты), увеличение сердечного выброса повышение АД – артерильная гипертензия. Гипервентиляция, гликогенолиз (гипергликемия), активация липолиза – гиперлипидемия. Адреналин активирует гликолиз.
За счет спазма периферических сосудов – централизация кровообращения. На периферии адреналин вызывает спазм прекапиллярного и посткапиллярного сфинктера – кровоснабжение только жизненно важных органов.
Гемодинамическая (торпидная) – в ишимизированных тканях накапливаются кислые продукты обмена, нарушается метаболизм БАВ (гистамин, брадикини, простагландины). На фоне метаболического ацидоза и накопления БАВ нарушается реакция прекапилляных сфинктеров на адреналин, и они расслабляются. Кровь заходит в капилляры, достигает посткапиллярных сфинктеров, а их реакция на адреналин адекватна они спазмируются – патологическое депонирование крови. ОЦК при любом шоке уменьшается – гиповолемия полицитемическая, т.к кровь застаивается в капиллярах, плазмопотеря формируется. Венозный возврат к сердцу уменьшается, т.е сердечный выброс уменьшается на фоне гиповолемии. У пациентагиперкатехолэемия – тонус сосудов высокий. У него артериальная гипотензия на фоне артериальной гипертонии. Адреналин не поможет.
Метаболическая (терминальная).
Нарушение гемодинамики ведет к развитию полиорганной недостаточности и нарушению обмена веществ. Очень важную роль в формировании нарушения метаболизма и развития полиорганной недостаточности играет эндотоксикоз. Источник эндотоксикоза – кишечник. Кишечник не кровоснабжается нарушается работа кишечника и при этом микрофлора чувствует себя хорошо, она размножается – источник токсинов. Токсины поступают в кровь, минуя печень, распространяются по всему организму. Токсины воздействуют на эндотелий сосудов (регулирует проницаемость, сосудистый тонус, гемостаз, иммунные реакции) – все функции нарушаются – эндотелиальная дисфункция.
Оксидативный стресс и гиперферментемия.
Ионообменный механизм компенсации смешанного ацидоза. В крови ацидоз сменяется на алкалоз, а внутриклеточный ацидоз ведет к аутолизу клеток – необратимое повреждение – гибель.
3. Миокардиальная некоронарогенная сердечная недостаточность; основные причины (роль стресса, гипоксии, интоксикации, инфекционных процессов и иммунопатологии, эндокринно-обменных нарушений), механизмы развития и клинические проявления.
Этиология
Эндогенные факторы:
различные гипо- и авитаминозы, особенно группы В
голодание
гипоксия – гипотоксический некроз миокарда – при этом на фоне общей недостаточности кислорода в организме, которая сама по себе ведет к повышению нагрузки на систему кровообращения, развивается некротическое повреждение мышечных волокон сердца
тиреотоксикоз; лихорадка (особенно длительная)
стресс (особенно хронический) – увеличение нагрузки на сердце
электролитно стероидное нарушение в организме – по наблюдениям Селье, при введении крысам значительного количества солей натрия в сочетании с некоторыми анионами в сердце появляются очаги повреждения дегенеративно-некротичческого типа. Эти повреждения становятся более обширными если одновременно вводятся некоторые стероидные гормоны надпочечников
циркулирующие иммунокомплексы при аутоиммунных заболеваниях, ревматизме – появлению антител и сенсибилизированных лимфоцитов, наптравленных против тканей собственного сердца, способствует проникновение в кровоток денатурированных компонентов некротизированных кардиомиоцитов
Билет 41
2. Обменные, функциональные и структурные проявления стресса, "триада Селье". Общебиологическое и индивидуальное значение стресса; его патогенетическая роль в больном организме.
Активация симпато-адреналовой системы. Повышение уровня адреналина и норадреналина. У пациенты увеличивается ЧСС и сила, спазмируются периферические сосуды, растет ОЦК, артериальное давление. Адреналин воздействует на обмен веществ – повышение сахара в крови, т.е стимулируется гликогенолиз, липолиз. Адреналин активирует процесс пероксидации липидов ( мембранные липиды). Следовательно, повышается проницаемость мембран для БАВ, субстратов. Адреналин действует только при наличии запасов в организме.
Также увеличивается потребность миокарда в кислороде. Действие адреналин не экономично, и опасно. Он лишь поможет избежать опасность, для резистентности не подходит.
Увеличивается синтез релизинг-факторов. Способствует синтезу гормона гипофиза, тропные гормоны, которые стимулируют эндокринные железы. Самая важная – кора надпочечника. Кора состоит из 3 слоев. Соматотропный стимулирует образование альдостерона – клубочковая зона коры надпочечника. Под действием АКТГ – глюкокортикостероиды. Сетчатая зона – образование половых гормонов, их образование стимулирует гонадотропный гормон. Тиреоидные гормоны вырабатываются под действием тиреотропного гормона.
Во 2-ую стадию идет продукция гормонов коры надпочечников. Они адаптируют наш организм к стрессу.
Глюкокортикостероиды (ГКС):
Они активируют глюконеогенез
Снижают активность гиалуронидазы
Повышают активность гистаминазы
Блокируют развитие тучных клеток
Снижают активность фосфолипазы и циклооксигеназы
Снижают проницаемость ГЭБ
Вызывают иммунодепрессию
Повышают секрецию HCIи угнетают слизеобразование в слизистой оболочке желудка
Минералокортикоиды (альдостерон) :
Повышают реабсорбцию натрия в почках
Поддерживают ОЦК
Повышают сократительную способность гладких мышц, за счет натрия, поддерживается АД
Активируют фагоцитоз
Стимулируют образование соединительной ткани
Андрогены
Анаболический эффект (стимулируют синтез белка)
Стимулируют микросомальное окисление (мощный детоксикационный эффект)
Эстрогены
Анаболический эффект ( синтез липидов)
Тормозят пероксидацию липидов ( мощный антиоксидантный эффект)
Стимулируют фагоцитоз
Тиреоидные гормоны
Повышают основной обмен, энергообеспечение всех процессов
Потенцируют действие адреналина
Активируют фагоцитоз
