
- •Триада Селье (стресса):
- •Стадия истощения.
- •3. Дыхательная недостаточность, её проявления. Изменения газового состава артериальной крови на различных стадиях дыхательной недостаточности.
- •2. Аллергические реакции III (иммунокомплексного) типа. Этиология, патогенез, клинические проявления. Патогенез сывороточной болезни. Аллергические реакции III типа (иммунокомплексные)
- •3. Хроническая почечная недостаточность; формы, причины, механизмы развития и клинические проявления. Уремическая кома.
- •2. Аллергия. Общая характеристика и значение в патологии. Связь аллергии и иммунитета. Аллергены и антитела, их виды и особенности. Стадии аллергической реакции.
- •3. Коронарная недостаточность; характеристика понятия, виды.
- •3. Острая артериальная гипотония; причины, виды и механизмы коллапса.
- •3. Нефрозы; формы, этиология, патогенез и основные клинические проявления.
- •Нефротический синдром
- •Этиология
- •Патогенез острого нефротического синдрома
- •Патогенез хронического нефротического синдрома
- •2. Изменения обмена веществ, структуры клеток и функции органов при лихорадке. Участие нервной, иммунной и эндокринной систем в развитии лихорадки. Отличие лихорадки от гипертермии.
- •3. Боль; причины и механизмы возникновения, значение для организма. Принципы обезболивания.
- •2. Местные и общие клинические проявления воспаления, их патогенез.
- •Местные (кардиальные) признаки воспаления
- •Общие признаки воспаления
- •3. Аллергические (инфекционно-аллергические) заболевания почек, Гломерулонефрит; формы, этиология, патогенез и клинические проявления, исходы.
- •Острый гломерулонефрит
- •Этиология
- •Патогенез иммунопатологического гломерулонефрита
- •2. Причины, механизмы развития, изменения газового состава артериальной и венозной крови при экзогенной, дыхательной, сердечно-сосудистой, кровяной и тканевой гипоксии. Смешанная гипоксия.
- •3. Печёночная кома; общая характеристика, виды, патогенез, клинические проявления и механизмы возникающих расстройств.
- •3. Этиология, патогенез и клинические проявления тромбофилического синдрома. Принципы лекарственной коррекции расстройств гемостаза.
- •2. Экссудация; изменения местного кровообращения и микроциркуляции, выход жидкой части крови в ткань и развитие отёка, их механизмы и значение. Виды и состав экссудатов.
- •3. Вторичные, симптоматические гипертонии (лекарственная, почечная, эндокринная, рефлексогенная и др.). Этиология, патогенез, клинические проявления, последствия, осложнения.
- •2. Общая характеристика гипоксии. Устойчивость разных органов и тканей к кислородному голоданию, факторы, определяющие устойчивость. Основные типы гипоксии.
- •3. Основные проявления расстройств деятельности почек, их происхождение. Изменения диуреза, состава мочи и крови; отёки, артериальная гипертония.
- •2. Лекарственная аллергия. Аутоаллергия.
- •1 Тип аллергии – реагеновый, атопический и анафилактический
- •Аллергические реакции I типа
- •(Реагиновые, атопические, анафилактические)
- •3. Ишемическая болезнь сердца; этиология, патогенез. Стенокардия, инфаркт миокарда; ведущие клинические проявления.
- •2. Аллергические реакции I (анафилактического, атопического) типа. Этиология, патогенез, клинические проявления. Патогенез бронхиальной астмы. Принципы лекарственной терапии.
- •1 Тип аллергии – реагеновый, атопический и анафилактический
- •Аллергические реакции I типа
- •(Реагиновые, атопические, анафилактические)
- •2. Пирогенные вещества; их химическая природа и места образования. Первичные и вторичные пирогены; лейкоцитарные пирогены (интерлейкин-I). Механизмы действия пирогенов.
- •2. Эмиграция клеток, ее молекулярные и другие механизмы. Фагоцитоз; виды, стадии, механизмы. Пролиферация; механизмы формирования и роль при воспалении.
- •2. Аллергические реакции замедленного типа (гзт) Этиология, патогенез, клинические проявления. Принципы лекарственной терапии.
- •Аллергическая реакция IV типа (туберкулиновая, клеточная, гзт)
- •Аллергические реакции IV типа
- •(Замедленного, клеточного, туберкулинового)
- •3. Патологическая гипертрофия миокарда, стадии, механизмы декомпенсации сердца.
- •Дыхательный (газовый) алкалоз
- •3. Артериальные гипотонии. Виды, причины и механизмы развития. Понятие о гипотонической болезни. Проявления и последствия гипотонических состояний.
- •Бронхо-легочная дыхательная недостаточность
- •3. Токсикомании; алкоголизм, наркомании и лекарственная зависимость. Этиология, механизмы формирования, клинические проявления на разных стадиях развития, исходы.
- •Билет 38
- •Триада Селье (стресса):
- •Стадия истощения.
- •Патогенез «шоковго легкого»
- •Синдром длительного раздавливания
- •(Краш-синдром)
- •Ожоговый шок
- •Шок в результате электротравмы
- •Кардиогенный шок
- •Гиповолемический шок
- •Постгемотрансфузионный шок
- •Токсико-септический шок
- •Травматический шок
- •Синдром длительного раздавливания
- •(Краш-синдром)
- •Ожоговый шок
- •Шок в результате электротравмы
- •Кардиогенный шок
- •Гиповолемический шок
- •Постгемотрансфузионный шок
- •Токсико-септический шок
- •Бронхо-легочная дыхательная недостаточность
- •2. Общие и специфические механизмы развития и клинические проявления коматозных состояний.
- •3. Коронарная недостаточность; характеристика понятия, виды.
- •3. Вторичные, симптоматические гипертонии (лекарственная, почечная, эндокринная, рефлексогенная и др.). Этиология, патогенез, клинические проявления, последствия, осложнения.
- •2. Проявление повреждения клетки в изменении обмена веществ, ее структуры и функции. Понятие о специфических и неспецифических проявлениях повреждения; обратимых и необратимых повреждениях.
- •3. Перегрузочная сердечная недостаточность. Понятие о перегрузке объёмом и давлением крови. Причины, механизмы развития и патоморфология перегрузочной недостаточности сердца.
- •2. Гипергидратация; виды, причины возникновения, механизмы развития, проявления и последствия. Принципы предупреждения и лечения гипергидратации.
- •3. Артериальные гипотонии. Виды, причины и механизмы развития. Понятие о гипотонической болезни. Проявления и последствия гипотонических состояний.
- •2. Патогенез сердечных, почечных, токсических, аллергических, голодных отёков. Местные и общие нарушения в тканях при отёках, их клинические проявления.
- •3. Боль; причины и механизмы возникновения, значение для организма. Принципы обезболивания.
- •3. Патологическая гипертрофия миокарда, стадии, механизмы декомпенсация сердца.
- •2. Гипероксия. Причины возникновения, формы. Механизмы повреждающего действия кислорода. Роль свободно-радикальных процессов. Понятие о системе антиокислительной защиты организма.
- •3. Виды, этиология, патогенез и клинические проявления геморрагических диатезов. Роль наследственных факторов, а также иммунопатологических механизмов в их патогенезе.
Билет 1
Принципы профилактики и терапии воспаления.
С точки зрения создания противовоспалительных средств большой интерес представляют вещества, влияющие на образование БАВ из фосфолипидов клеточных мембран. Основная направленность действия таких веществ сводится к следующему:
1. Ингибирование фосфолипазы А2, контролирующей образование арахидоновой кислоты; по такому принципу действуют ГКС)
2. Ингибирование ЦОГ, регулирующей синтез простагландинов E2иF2а(НПВС)
3. Блокада простаноидных рецепторов
4. Блокада 5-липооксигеназы, учавствующей в образовании лейкотриенов.
5. Блокада лейкотриеновых рецепторов.
Основные причины печеночной недостаточности. Роль инфекций, гепатотропнъгх ядов, алкоголя и лекарственных препаратов в поражении печени. Недостаточность печени; тотальная и парциальная. Расстройства обмена веществ и состава крови, нарушение барьерной и детоксикационной функций при недостаточности печени. Принципы лекарственной терапии.
Причины ПН:
Экзогенные факторы:
Физические – ионизирующая радиация
Химические – гепатотоксические:
Алкоголь и его суррогаты
Ксенобиотики
Сельскохозяйственные яды
Бытовая химия
Пищевые добавки
Лекарственные препараты: средства для наркоза (хлороформ), снотворные (хлоралгидрол), НПВС (индометацин, парацетамол), антидиабетические (сульфанилмочевина) и др.
Биологические:
Вирусы: гепатитов, герпеса, инфекционного мононуклеоза
Брюшнотифозная палочка, пневмококки, малярийный плазмодий, описторхи
Эндогенные факторы:
Нарушение кровоснабжения: шок, коллапс, кома, тромбоз сосудов печени, острая и хроническая СН, врожденные аномалии сосудов печени
Аутоиммунные болезни печени: аутоиммунные гепатиты, СКВ
Длительный холестаз: желчекаменная болезнь, аномалия желчевыводящих путей
Нарушения обмена веществ: СД, недостаточное или избыточное питание, дефицит липотропных веществ в продуктах питания, болезни накопления (гликогенозы, липидозы)
По степени выключения функций ПН может быть тотальной (нарушены все функции печени) и парциальной (частичной).
Нарушение белкового обмена:
Торможение синтеза:
Альбумина – гипоальбуминемия
Белков системы гемостаза (I,II,III,V,VII,IX,X,XI)
Транспортных белков: гаптоглобин, трансферрин, церрулоплазмин, белки-переносчики гормонов
Подавление дезаминирования аминокислот
Нарушение жирового обмена:
Снижение желчеобразования – нарушение эмульгации жирных кислот
Нарушение синтеза и окисления ЛПНП, ЛПОНП, ЛПВП
Липодистрофия печени
Нарушение углеводного обмена:
Подавление гликогенеза
Торможение гликогенолиза
Нарушение глюконеогенеза
Нарушение барьерной функции:
Нарушение расщепления в печени лекарственных препаратов
Нарушение детоксикационной функции:
Нарушение синтеза мочевины – растет содержание аммиака, увеличивается остаточный азот
Торможение детоксикации токсинов кишечного происхождения
Активация кетогенеза – кетоз
Нарушение коньюгации биллирубина – повышение непрямого биллирубина
Нарушение инактивации эстрогенов, альдостерона, АДГ
Нарушение состава крови:
Нарушение депонирования витамина B12– мегалобластическая анемия
Нарушение обмена железа – сидероахрестическая анемия
Принципы лекарственной терапии:
Гепатопротекторные средства – повышают устойчивость печени к воздействию повреждающих факторов, способствуют восстановлению ее функций, повышают ее детоксикационные возможности
Билет 2
Патогенез опухолевого процесса. Основные теории канцерогенеза, его стадии.
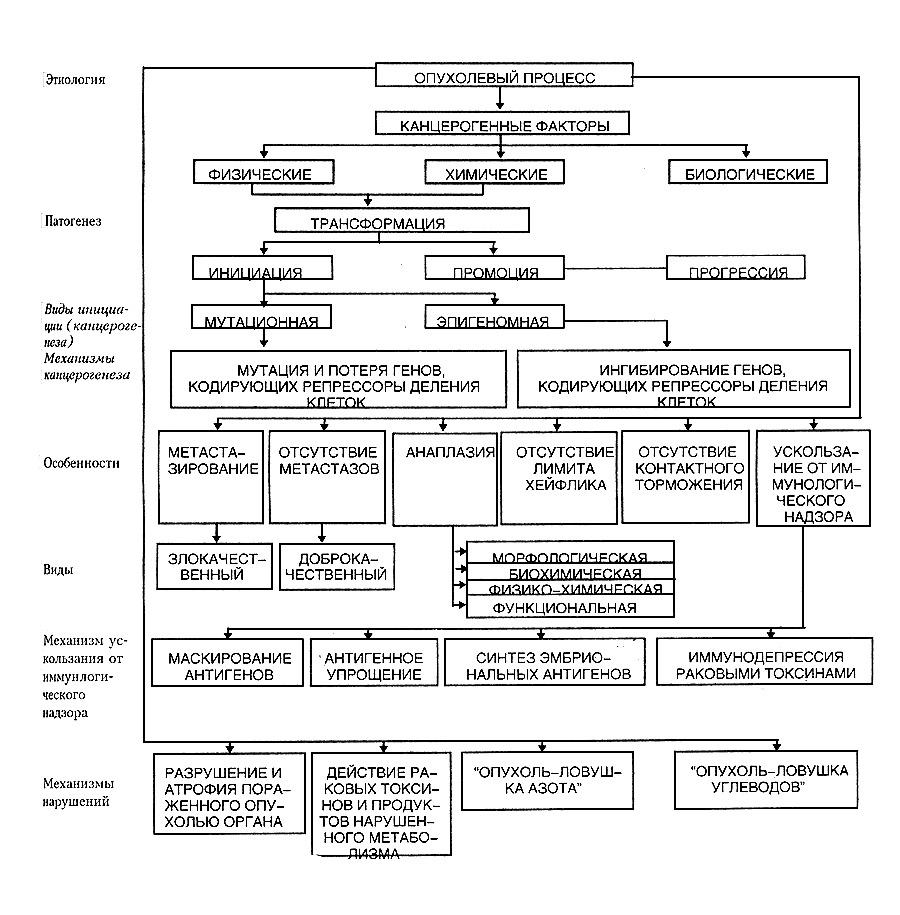 В
патогенезе опухолевого процесса
(канцерогенезе) различают стадии:
В
патогенезе опухолевого процесса
(канцерогенезе) различают стадии:
Инициация (мутация) – превращение здоровой клетки в опухоль
Промоция
Опухолевая прогрессия (если опухоль злокачественная)
Инициация – приобретение исходной здоровой клеткой способности беспредельно размножаться и передаче ее дочерним клеткам по наследству.
Промоция – второй этап развития канцерогенеза. Трансформированные клетки могут подолгу оставаться в ткани в неактивной форме. Дополнительное воздействие канцерогенным фактором, который сам не вызывает трансформацию, но стимулирует клетки к размножению, приводит к тому, что опухолевые клетки находящиеся в латентном состоянии, начинают размножаться, образуя опухолевый узел.
Прогрессия – стойкие качественные изменения свойств опухоли, преимущественно в сторону малигнизации.
Свойства канцерогенов:
Мутагенность – способность прямо или косвенно повреждать геном клети.
Высокая проницаемость через внешние и внутренние барьеры.
Дозозависимый эффект:
Субпороговых канцерогенных доз не существует
Необратимость действия канцерогенов
Эффект суммации и кумуляции
Органотропность
Способность подавлять тканевое дыхание и иммунные реакции
Синканцерогенез – совместное действие нескольких канцерогенов и суммация их эффектов.
Коканцерогенез – усиление действия канцерогенов факторами, которые не являются сами канцерогенами.
Вирусная теория канцерогенеза
Впервые в начале 20 века в 1915 году был установлен факт вирусного происхождения опухолей. Взяты 2 популяции мышей: 1 – высокораковая популяция, а другая – низкораковая. Мышки беременные, после рождения мшкам прижигали молочные железы, и меняли малышей. Низкораковые детеныши заболели, и наоборот. Фактор молока .
Виды онкогенных вирусов
ДНК-вирусы – (онкоднавирусы) : аденовирусы, герпес.
РНК-вирусы – (онкорнавирусы): вирус саркомы Рауса, вирусы лейкозов – животные.
Особенности распространения у человека
Вирогенетичсекая теория Зильбера – считал, что вирус у человека передается вертикально: от родителей к детям.
Антионкогены (гены-супрессоры)
Блокада экспрессии онкогена, предотвращение инициации канцерогенеза, программирование апоптоза генотипических опухолевых клеток.
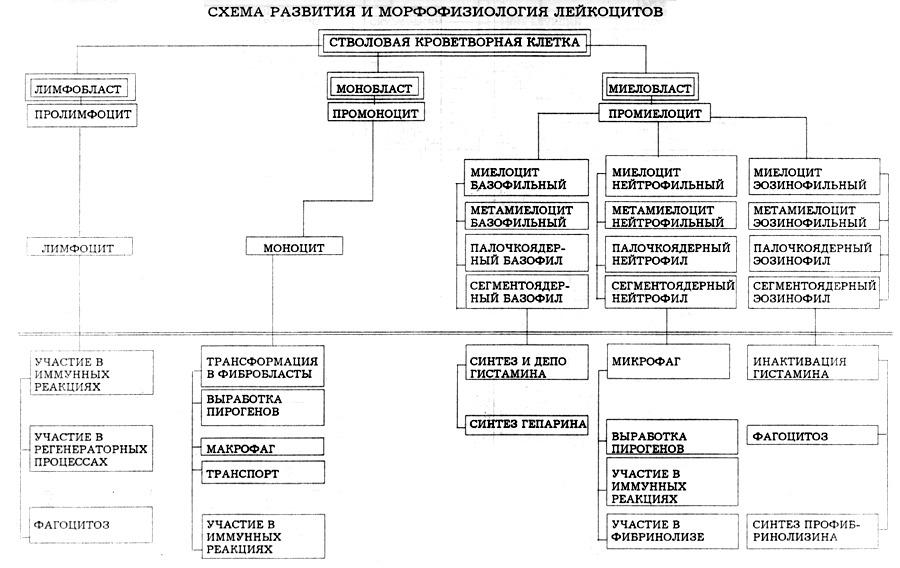
Виды лейкоцитозов, их причины, механизмы возникновения, функциональные и структурные изменения лейкоцитов и лейкоформулы.
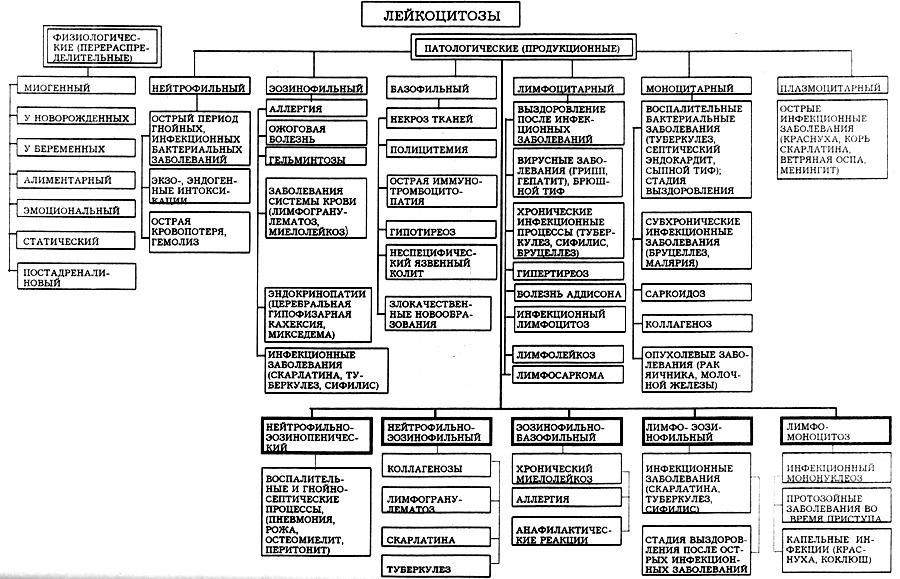
Лейкоцитоз
Физиологические:
Алиментарный
Миогенный
Эмоциональный (ярко выражен у детей)
Их механизм перераспределительный.
При беременности – увеличивается продукция лейкоцитов костном мозге
У новорожденного
Патологические:
Концентрационные – связан с гемоконцентрацией (причина – потеря жидкости: рвота, диурез). Лейкоформула не изменяется, но возрастет гематокрит.
Продукционные – лейкоформула всегда изменяется. В зависимости от того какие клетки буду увеличиваться: базофильный, эозинофильный.
Базофилы:
Накапливают БАВ (гепарин, гистамин, серотонин
Аккумулируют продукты протеолиза
Имеют рецепторы к Ig E (от 10 до 40 тыс на одной клетке)
Продуцируют БАВ (в большей степени лейкотриены)
Базофилия – встречается: при некрозе тканей, злокачественных опухолях, аллергических реакциях немедленного типа.
Эозинофилы:
Содержат гистаминазу (клетки скорой помощи)
Фагоцитируют комплексы аг+ат
Имеют гистотоксины, которые могут действовать на гельминтов
Эозинофилия развивается при:
аллергических реакциях немедленного типа
коллагенозах (ревматизм, дерматомиозит)
при инфекционных заболеваниях с аллергизацией организма (скарлатина, сифилис, туберкулез)
при гельминтозах (описторхоз, трихинеллез, эхинококкоз и др.)
Нейтрофилы – различаются по оттенку цитоплазмы. Свойства: нейтрофил – это микрофаг, он способен фагоцитировать и переваривать бактерии (этот процесс сложный), в них активируются обменные процессы, потребляет много кислорода – кислородный взрыв, т.е образуется супероксид-анион (активный кислородный радикал). Этот радикал превращается в перекись водорода. Под действием миелопероксидазы образуются коллагеновые анионы – хлор, йод, бром. Повреждаются бактериальные стенки. После повреждения нейтрофил воздействует на микроб своими животными антибиотиками (дифинзин, лактоферрин), и микроб убивается. Под действием лизосомальных ферментов идет полное переваривание микроба.
Нейтрофилы вырабатывают большое количество цитокина. Цитокин-интерлейкин-1 – мощный пироген. Цитокины обладают антитоксическим эффектом. Исходя из свойств нейтрофилов.
Нейтрофилия
острый период гнойно-воспалительных заболеваний, бактериальных инфекций
при асептических воспалениях
при различных экзо- и эндогенных интоксикациях
после острой кровопотере, острого гемолиза
Ядерный индекс нейтрофилов, или индекс сдвига ядра
ЯИН= М+Ю+П/С
Сдвиги влево (регенеративный):
Сдвиг влево до палочкоядерных – при увеличении палочкоядерных. Характерно для гнойно-воспалительных инфекций легкой степени, при утяжелении состояния индекс нарастает, т.е в крови нарастают юные и..
Сдвиг влево до юных
До миелоцитов – появляются М, Ю,П,С
Сдвиг вправо (дегенеративный): молодые формы отсутствуют совсем или единично, и увеличивается количество сегментоядерных клеток, дегенеративные формы нейтрофила (полисигметация, гипосигментация, анизоцитоз, кариолиз, цитолиз, фрагментоз ядра, вакуолизация ядра и цитоплазмы, токсическая зернистость). Сдвиг вправо говорит о низком уровне индекса.
Лимфоциты:
Определяют специфическую защиту клеточную и гуморальную;
Синтезируют лимфокины (интреферон);
Имеют мембрано-ассоциированные ферменты (липазы, перфорин-протеолитический фермент);
Лимфоцитоз:
Инфекции
Вирусные (грипп, краснуха)
Паразитарные (токсоплазмоз, хламидиоз)
Микозы
Бактериальные инфекции:
Специфические (бруцеллез, сифилиз, туберкулез)
Иерсиниоз, туляремия, лептоспироз
Протозоонозы (малярия, лейшманиоз)
Аллергические реакции замедленного типа
Моноциты – макрофаг, самая большая клетка
осуществляет фагоцитоз (противомикробная, противовирусная, противопаразитная, противоопухолевая защита)
осуществляет процессинг антигена
синтезирует цитокины
Монокины – цитокины, вырабатывающиеся моноцитами.
Организует реакцию клеточной кооперации
Моноцитоз
Инфекции:
Хронические специфические
Вирусные
Септический эндокардит
Острые протозойные
Сыпной тиф
В стадию выздоровления при гнойно-воспалительных заболевания
Злокачественные опухоли: яичника, молочной железы
Аутоиммунные заболевания
Нейтрофильно-эозинофильный лейкоцитоз
При скарлатине, описторхозе, острой фазе туберкулеза
Нейтрофильно-эозинопенический лейкоцитоз
Тяжелые гнойно-септические заболевания
Эозинофильно-базофильный лейкоцитоз
При тяжелых аллергических реакциях немедленного типа, хронический миелолейкоз
Лимфоцитарно-моноцитарный лейкоцитоз
Развивается при инфекционном мононуклеозе; острые протозойные инфекции; капельные инфекции (краснуха, коклюш); хронические специфические инфекции (туьеркулез, бруцеллез, сифилис);
Билет 3
Билет 4
2. Принципы лекарственной коррекции лихорадочных реакций. Пиротерапия.
Пиротерапия — метод лечения различных заболеваний с помощью искусственного повышения температуры тела человека, или искусственного вызывания гипертермии.
Эффект пиротерапии частично основан на повышении специфического и неспецифического иммунитета при более высокой температуре тела, на том, что при более высокой Т интенсивнее происходит синтез антител, интерферонов, интерлейкинов и других цитокинов. Частично эффект пиротерапии обусловлен общим повышением интенсивности окислительного метаболизма и усиленным образованием токсичных для микроорганизмов и паразитов свободных радикалов при более высокой температуре. Также играет роль усиление лейкопоэза и развитие гиперлейкоцитоза, усиление хемотаксиса и фагоцитарной активности лейкоцитов при повышении Т. Именно с иммуностимуляцией связывают эффективность пиротерапии при многих вялотекущих, хронических инфекционных заболеваниях, в норме протекающих без температурной реакции, без выраженного воспаления и без формирования напряжённого иммунитета.
Вторая причина эффективности пиротерапии при некоторых заболеваниях связана с повышением проницаемости сосудов и тканевых барьеров, в частности, гемато-энцефалического, гемато-офтальмического, гемато-простатического, не только для иммунных клеток и факторов гуморального иммунитета, но и для антибиотиков и других лекарств. Именно с повышением проницаемости гемато-энцефалического барьера для антибиотиков и химиопрепаратов связывают эффективность пиротерапии при сифилитическом энцефалите (прогрессивном параличе), токсоплазмозе ЦНС и других нейроинфекциях. С повышением проницаемости гемато-простатического барьера для антибиотиков связывают эффективность пиротерапии при хроническом простатите. С повышением проницаемости гемато-энцефалического барьера для антидепрессантов и антипсихотиков связывают эффективность пиротерапии при резистентных депрессиях и психозах.[источник не указан 1455 дней]
Третья причина эффективности пиротерапии связана с свойствами самих возбудителей некоторых заболеваний, которые не могут размножаться или плохо размножаются при повышении температуры тела хозяина (вне зависимости от иммуностимулирующих свойств повышенной температуры, тут идёт речь о свойствах самого возбудителя). Именно этим свойством — высокой термочувствительностью возбудителя — объясняется эффект пиротерапии при сифилисе.
В наше время пиротерапия используется достаточно редко и ограниченно. Сегодня для пиротерапии в основном используется препарат Пирогенал — очищенный липополисахаридный комплекс, добываемый из бактерий Pseudomonas aeruginosa (синегнойная палочка) и вызывающий у человека выраженное повышение температуры (как правило, до 38-39 С) при введении в мышцу, а также оказывающий сильное иммуностимулирующее влияние и повышающий проницаемость тканевых барьеров для многих лекарств. Инъекции пирогенала значительно менее болезненны, чем инъекции сульфозина, и вызывают меньшую местную реакцию, лучше переносятся, и у больных обычно не возникает резкого неприятия такого метода лечения, как это бывает с сульфозином. Сульфозин, тем не менее, ещё не везде снят с производства и выведен из употребления.
Гипертермия используется при лучевой терапии опухолей как радиомодифицирующий фактор (терморадиотерапия).
3. Острая почечная недостаточность; формы, причины, механизмы развития и клинические проявления. Принципы лекарственной терапии.
Почечная недостаточность
Синдром, развивающийся в результате значительного снижения или прекращения выделительной функции, а также нарушении других процессов в почках.
Характеризуется прогрессирующим снижением депурационной функции почек, что проявляется гиперазотемией.
Основные причины почечной недостаточности:
«Преренальные» - ведут к нарушению кровоснабжения почек:
Шок
Коллапс
Кровопотеря
Тромбоз почечных артерий
ОСН
«Ренальные»:
Острые нефриты, пиелонефриты, васкулиты;
Нефротоксические вещества;
Острый гемолиз, Краш-синдром, ДВС-синдром;
«Постренальные»:
Обтурация/сдавление мочевыводящих путей;
Перегиб мочеточников;
Патогенез ОПН:
Начальная (шоковая) стадия:
Снижение объема клубочковой фильтрации;
Прогрессирующее снижение диуреза;
Олиго-, анурическая стадия – обтурация канальцев, некроз клубочков и канальцев:
Гиперазотемия, уремия (интоксикация: слабость, головная боль, тошнота, запах мочевины изо рта, апатия, спутанность сознания, судороги, кома).
Нарушения водно-электролитного обмена (не выделяется вода): гиперволемия отек легких и мозга.
Гиперкалиемия нарушение атриовентрикулярной и внутрижелудочковой проводимости;
Гиперфосфатемия;
Гипокальциемия гиперрефлексия мышц;
Гипернатриемия артериальная гипертензия;
Гипермагниемия;
Метаболический ацидоз;
Полиурическая стадия – регенерация частично некротизированных нефронов, и склероз полностью некротизированных нефронов.
Восстановление и увеличение диуреза:
Гипоизостенурия
Гиповолемия
Дегидратация
Гипокалиемия
Стадия выздоровления – восстановление всех функций почек (6-12 месяцев).
ОПН, если почки изначально были здоровые, то в ХПН не переходит.
Хроническая почечная недостаточность (ХПН)
Развивается постепенно.
Основные причины:
«Преренальные» - обусловливают развитие первичносморщенной почки:
Артериальная гипертензия хроническая;
Атеросклероз почечных артерий;
«Ренальные» - обеспечивают поражение самой почки:
Хронический гломерулонефрит;
Хронический пиелонефрит;
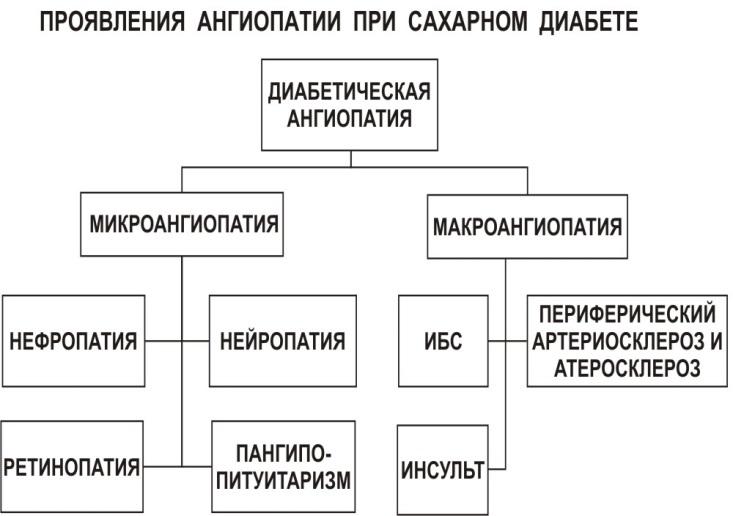
Диабетическая нефорпатия;
Амилоидоз;
СКВ – системная красная волчанка;
Врожденные пороки почек (поликистоз);
«Постренальные» - возникают вследствие нарушение оттока мочи:
МКБ (мочекаменная болезнь);
Опухоли МВП (мочевыводящих путей);
Гипертрофия простаты;
Стадии:
Скрытая стадия – поражение от 50 до 75% нефронов:
Нормазотемия;
Нормальный суточный диурез4
Снижение клубочковой фильтрации – никтурия, уменьшение клиренса эндогенного креатинина;
Явная стадия – при поражении от 75 до 90% нефронов:
Гиперазотемия (повышение креатинина, увеличение мочевины и остаточного азота);
Нормальный суточный диурез или полиурия;
Никтурия, изурия;
Снижение клиренса эндогенного креатинина;
Уменьшение канальцевой реабсорбции гипоизостенурия;
Активация РААС + снижение выработки вазодепрессоров повышение АД гипертрофия левого желудочка, ретинопатия;
Уменьшение синтеза эритропоэтина и преобладание его ингибитора гипохромная гипорегенераторная анемия;
Терминальная стадия – поражение более 90% нефронов:
Олигурия, анурия;
Гиперазотемия, уремия;
Выделение азотистых шлаков через кожу и слизистые;
Запах мочевины изо рта, кожный зуд, сыпь, кровоизлияния;
Уремический ларингит, трахеит, пневмония, плеврит, миокардит, перикардит, гастрит, колит, диарея;
Уремическая кома;
Гипергидратация отек мозга, легких;
Нарушения электролитного обмена:
Гиперкалиемия: аритмия, сердца, слабость, сонливость, апатия, вялые параличи.
Гипермагниемия: угненетение ЦНС и нервно-мышечной возбудимости.
Нарушения фосфорно-кальциевого обмена остеомаляция, остеопороз.
Метаболический ацидоз;
Токсическая тромбоцитопения геморрагический диатез;
Иммунодефицит;

Билет 5
2. Расстройства обменных и физиологических процессов, структуры тканей при сахарном диабете, клинические и биохимические проявления. Взаимосвязь сахарного диабета с ожирением, атеросклерозом и гипертонической болезнью.
Инсулин способствует поступлению глюкозы в клетки и активируя ферменты способствует ее окислению, способствует синтезу гликогена, липогенезу.
Лечение гипогликемии: полное голодание, расстройство пищеварения кишечника (полостное, пристеночное), болезнь оперированного желудка
Проявления гипогликемического синдрома:
Адренергические – мышечная дрожь, потливость, тахикардия и аритмии сердца, тревога, страх смерти.
Нейрогенные: головная боль, чувство голода, головокружения, нарушение зрения, агрессия, психическая заторможенность, спутанность сознания, судороги.
Возможные последствия гипогликемии:
Гипогликемический синдром – стойкое снижение концентрации глюкозы 3.0 ммоль/л
Гипогликемическая кома – снижение концентрации глюкозы 2.5-1.5 ммоль/л и менее, потеря сознания
Основные причины гипергликемии:
Гипергликемия: алиментарного характера – после любого приема пищи, лекарственная , нейро- и психогенные расстройства (стресс, психическое возбуждение, боль), Эндокринопатии (избыток контр-инсулярных гормонов и дефицит инсулина).
Лекарственные вещества, способствующие гипергликемии: стероидные гормоны, пероральные контрацептивы, диуретики и гипотензивные средства (тиозиды, клофилин, урегит), психотропные средства (галоперидол, аминазин, хлорпротиксен), трициклические, адреналин, изадрин, анаприлин, дифенин, НПВС (аспирин, индометацин), цитостатики (циклофосфамид, Л-аспарогиназа), эфир – хлороформ.
Эндокринопатии:
Болезнь Иценко-Кушинга
Гипертиреоз
Феохромоцитома
Избыток СТГ
Очень частая причина – инсулиновая недостаточность.

3. Одышка и кашель, их значение. Периодическое и терминальное дыхание.
Типы одышки:
Одышка с углублением и учащением дыхания:
невротические состояния
эмоциональные потрясения
снижение рО2в воздухе
напряженная мышечная работа.
Чрезмерная импульсация от периферических рецепторов - возбуждение ДЦ - чрезмерное наполнение легочных альвеол - раздражение рецепторов легких - переключение на выдох.
Часто носит приспособительный характер.
Гипервентиляция легких возникает.
Включение резервных альвеол в легких (в норме 8 л/мин; до 20 л/мин при данном виде одышки).
При гипервентиляции возникает гипокапния (удаление СО2) - нарушение мозгового кровообращения (спазм мозговых сосудов) - обморок, судороги.
Глубокое, но медленное дыхание (брадипное).
В норме: у спортсменов в покое
после гипервентиляции
в состоянии сна
Патология: стенотическое дыхание при стенозу ВДП.
Воздух в легкие поступает с трудом
Заполнение альвеол идет медленно
Повышается порог легочного рефлекса и вдох долго не тормозится и не переключается на выдох.
Инспираторная одышка: затруднена фаза вдоха, вдох как бы в 2 фазы:

Частое поверхностное дыхание (тахипноэ).
Поражение нижних дыхательных путей (пневмония, эмфизема легких)
Перераздражение легочных рецепторов - порог легочного рефлекса понижается - не требуется полного расправления альвеол - переход на частое дыхание.
при переломах ребер - щадящее дыхание (боль в грудной клетке вызывает рефлекторное уменьшение глубины дыхания).
Экспираторная одышка (нарушена фаза выдоха):

Возникает при спазме легочных дыхательных путей: приступ бронхиальной астмы.
Эластической тяги легкого недостаточно для продвижения выходящего из альвеол воздуха и включается дополнительная дыхательная мускулатура.
Типы периодического дыхания: дыхание Чейна-Стокса, Биота. Все они характеризуются чередованием дыхательных движений и пауз – апноэ. В основе развития периодических типов дыхания лежат расстройства системы автоматического регулирования дыхания.
При дыхании Чейна-Стоксапаузы чередуются с дыхательными движениями, которые сначала нарастают по глубине, затем убывают.

При дыхании Биотапаузы чередуются с дыхательными движениями нормальной частоты и глубины.

К терминальным типам дыхания относятся дыхание Куссмауля (большое дыхание), апнейстическое дыхание, гаспинг дыхание. Они сопровождаются грубыми нарушениями ритмогенеза.
Для дыхания Куссмауля характерен глубокий вдох и форсированный удлиненный выдох. Это шумное, глубокое дыхание.

Оно характерно для пациентов с нарушением сознания при диабетической, уремической, печеночной комах. Дыхание Куссмауля возникает в результате нарушения возбудимости дыхательного центра на фоне гипоксии мозга, метаболического ацидоза, токсических явлений.
Гаспинг дыхание – это единичные, глубокие, редкие, убывающие по силе вздохи.











Гаспинг дыхание является другой, необычной формой дыхательных движений и проявляется при дальнейшем значительном углублении гипоксии. Дыхательные нейроны оказываются невосприимчивыми к внешним воздействиям. На характер гаспинга не влияют напряжение Расо2, перерезка блуждающих нервов, что позволяет предположить эндогенную природу гаспинга.
Билет 6
2. Общая характеристика стресса. Стадии, механизмы развития и проявления стресса. Роль антистрессовых механизмов.
Стресс (от англ. Stress- напряжение, давление) – неспецифическая, типовая реакция нейро-эндокринной системы на действие факторов внешней или внутренней среды необычного характера, силы и/или длительности.
Основоположник учения о стрессе – Ганс Селье (1907-1982).
Причины стресса (стрессоры).
По происхождению :
Экзогенные:
физические
химические - алкоголь
биологические – бактерии, вирусы, гельминты
социальные
Эндогенные – тромб образовался и закупорил сосуд.
Стресс свойственен и животным. Появился стрессовый фактор, то животное избегает воздействия фактора, например, убегает. Все энергетические ресурсы направляются на то, чтобы избежать стресса. Также может возникнуть адаптация.
Стадии стресса – реакции.
Тревоги (St.Alarm reaction)
Резистентности (St. of resistence)
Истощения
Стадия тревоги :
Фаза шока – период воздействия стрессора на организм
Фаза противошока – ответная реакция на экстримально воздействие.
Информация о стрессоре поступает в ЦНС в кору головного мозга. Оттуда по ретикулярной формации она поступает в гипоталамус( дозорный нашего организма, связующее звено между Цнс Внс и Эндокринной). В гипоталамусе 3 основные группы нейронов: вырабатывающие релизинг факторы, вазопрессин, и катехоламины. Активация симпато-адреналовой системы. Повышение уровня адреналина и норадреналина. У пациенты увеличивается ЧСС и сила, спазмируются периферические сосуды, растет ОЦК, артериальное давление. Адреналин воздействует на обмен веществ – повышение сахара в крови, т.е стимулируется гликогенолиз, липолиз. Адреналин активирует процесс пероксидации липидов ( мембранные липиды). Следовательно, повышается проницаемость мембран для БАВ, субстратов. Адреналин действует только при наличии запасов в организме.
Также увеличивается потребность миокарда в кислороде. Действие адреналин не экономично, и опасно. Он лишь поможет избежать опасность, для резистентности не подходит.
Увеличивается синтез релизинг-факторов. Способствует синтезу гормона гипофиза, тропные гормоны, которые стимулируют эндокринные железы. Самая важная – кора надпочечника. Кора состоит из 3 слоев. Соматотропный стимулирует образование альдостерона – клубочковая зона коры надпочечника. Под действием АКТГ – глюкокортикостероиды. Сетчатая зона – образование половых гормонов, их образование стимулирует гонадотропный гормон. Тиреоидные гормоны вырабатываются под действием тиреотропного гормона.
Во 2-ую стадию идет продукция гормонов коры надпочечников. Они адаптируют наш организм к стрессу.
Глюкокортикостероиды (ГКС):
Они активируют глюконеогенез
Снижают активность гиалуронидазы
Повышают активность гистаминазы
Блокируют развитие тучных клеток
Снижают активность фосфолипазы и циклооксигеназы
Снижают проницаемость ГЭБ
Вызывают иммунодепрессию
Повышают секрецию HCIи угнетают слизеобразование в слизистой оболочке желудка
Минералокортикоиды (альдостерон) :
Повышают реабсорбцию натрия в почках
Поддерживают ОЦК
Повышают сократительную способность гладких мышц, за счет натрия, поддерживается АД
Активируют фагоцитоз
Стимулируют образование соединительной ткани
Андрогены
Анаболический эффект (стимулируют синтез белка)
Стимулируют микросомальное окисление (мощный детоксикационный эффект)
Эстрогены
Анаболический эффект ( синтез липидов)
Тормозят пероксидацию липидов ( мощный антиоксидантный эффект)
Стимулируют фагоцитоз
Тиреоидные гормоны
Повышают основной обмен, энергообеспечение всех процессов
Потенцируют действие адреналина
Активируют фагоцитоз
Синтоксический эффект гормонов– направлен на сосуществование патогенного процесса в организме.
Глюкокортикоиды обладают мембраностабилизирующим эффектом, минералокортикоиды способстуют образованию барьера на пути распространения инфекции.
Кататоксический эффект –уничтожение болезнетворного начала. Пример – фагоцитоз.
Триада Селье (стресса):
Гипертрофия коры надпочечников
Кровоизлияния в слизистую желудка и ДПК
Атрофия лимфоидной ткани
Стадия истощения.
Атрофия и кровоизлияния в кору надпочечников
Избыток тропных гормонов
Угнетение анаболических процессов
Стимуляция катаболических процессов
Стресс-лимитирующие системы
Центральные механизмы
ГАМГ-ергическая система
Тормозит функцию «командных» нейронов на действие стрессора;
Угнетает выработку кортиколиберина;
Ограничивает мобилизацию гипофиз-адреналового звена в стресс-реакции;
Уменьшает выделение норадреналина в периферических синапсах
Бензодиазепиновая система
Потенцирует все ГАМК-эффекты
Опиоидергическая система
Серотонинергическая система
Периферическая система – простагландины и антиоксиданты
3. Этиология, патогенез и формы лейкозов, особенности кроветворения. Гематологические, патоморфологические и клинические проявления основных форм лейкозов, их осложнения и исходы. Принципы лекарственной терапии.
Виды лейкозов
Делятся на острые и хронические. В основе – особенности клеточного состава при этих заболеваниях.
При острыхсубстрат особи составляют молодые бластные клетки, и зрелые потомки, и отсутствие всех промежуточных форм – лейкемический провал. Выраженность опухолевой прогрессии гораздо более выраженная.
Хронический лейкоз– субстрат – это созревающие и зрелые клетки, лейкемического провала нет. Выраженность опухолевой прогрессии менее значима.
О виду мутировавшей клетки. Острые лейкозы – бластные лейкозы. Острые: лимфобластный, монобластный, миелобластный, промиелоцитарный, эритробластный, мегакариобластный, недифференцируемый (на уровне стволовой клетки).
Хронические – ситарные лейкозы: миелолейкоз, лимфолейкоз, моноцитарный лейкоз, эритромиелоз, мегакариоцитарный.
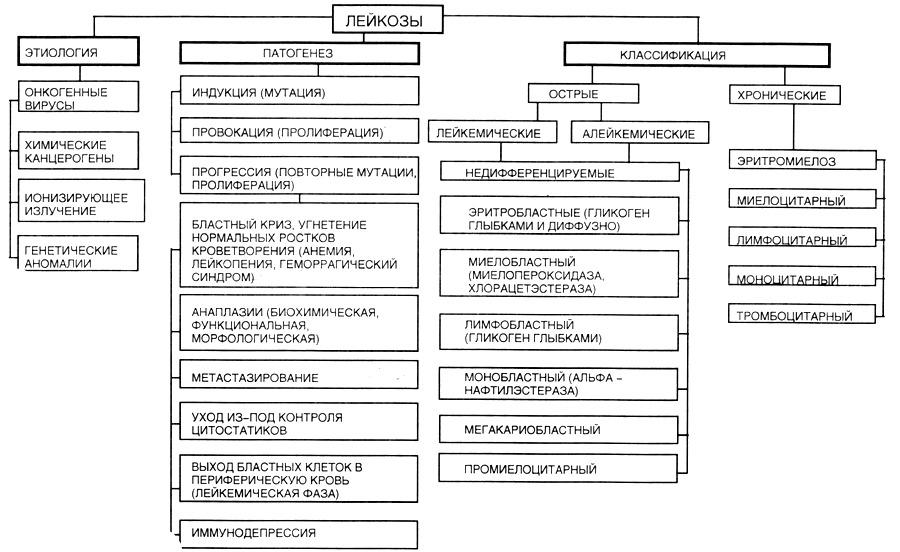
Правила опухолевой прогрессии
Фулдаса-Воробьева
Угнетение нормальных ростков кроветворения:
Эритроидного – развивается анемия, тромбоцитопения -> геморрагический синдром, лейкопения -> язвенно-некротичсекий синдром (стоматит, некротическая ткань);
Мегакариоцитарного;
Лейкоцитарного;
Увеличение числа незрелых и бластных опухолевых клеток в костном мозге – замена дифференцированных клеток опухолевыми клетками. Бластный криз (более 30% бластов в костном мозге).
Выход опухолевых клеток в периферическую кровь.
Утрата специфических свойств опухолевыми клетками – анаплазия. Выделяют: морфологическую анаплазию; биохимическую (цитохимическую) – высокая активность пероксидазы в норме, в этом случае снижается активность пероксидазы в опухолевых клетках; функциональная анаплазия – снижение фагоцитарной активности нейтрофилов;
Метастазирование – образование дочерних опухолей – хронический лимфолейкоз (значительное увеличение лимфатических узлов, печени и селезенки).
Уход из под контроля цитостатиков.
Иммунодепрессия.
Билет 7
2. Отёк, характеристика понятия. Патогенетические факторы отёка; роль нервно-гормональных механизмов в развитии отека. Виды отёков. Пути фармакотерапии отеков.
Отек– типовая форма нарушения водного баланса организма. Характеризуется накоплением избытка жидкости в межклеточном пространстве и/или полостях тела.
Классификация отеков по патогенезу:
Механические (гидростатические)- к ним относят отеки при:
Сердечной недостаточности
Активация РААС, рефлекторная выработка альдостерона.
Вследствие флеботромбоза
Тромбофлебита
Варикозной болезни
Гипоонкотические (гипопротеинемические, диспротеинемические). Связаны с уменьшением белка в крови. Это:
Голодные отеки
В основе – гипопротеинемия, которая способствует снижению онкотического давления плазмы. Вода переходит в ткани (транссудация), гиповолемия – активация РААС и продукция АДГ – задержка жидкости.
Гломерулонефрит
Нефротический синдром – массивный отек, вплоть до анасарки. К этому ведет массивная протеинурия.
Цирроз печени – в печени снижается биосинтез альбуминов, снижается инактивация альдостерона и вазопрессина, локализацию определяет портальная гипертензия.
Осмотические. Механизмы:
Нарушение вымывания электролитов и метаболитов из тканей при нарушении микроциркуляции.
Снижение активного транспорта ионов через мембраны при тканей гипоксии.
Выход ионов при альтерации клеток.
Усиление диссоциации солей при ацидозах.
Мембраногенные. При них повышение проницаемости сосудистой стенки играет важную роль. Это:
Аллергические
Токсические
Воспалительные – способствует нарушение микроциркуляции, на стадии венозной гиперемии – растет гидростатическое давление. Изменение осмотического и онкотического давления в очаге воспаления.
Эндогенные факторы: гистамин, серотонин, брадикинин, токсины.
Лимфогенные:
Врожденная гипоплазия лимфососудов и лимфоузлов
Сдавление лимфососудов и лимфоузлов опухолью
Лимфангит, лимфаденит
Оперативное удаление лимфососудов и лимфоузлов
Филяриоз – слоновость
Значение отека:
Отек жизненноважных органов может привести к гибели
Отек периферических тканей – нарушение целостности ткани, кожи. Внеклеточная жидкость сдавливает окружающие ткани нарушение трофики, нарушение иммунологической защиты, репаративных процессов
Разрастание соединительной ткани ведет к сдавливанию лимфатических сосудов
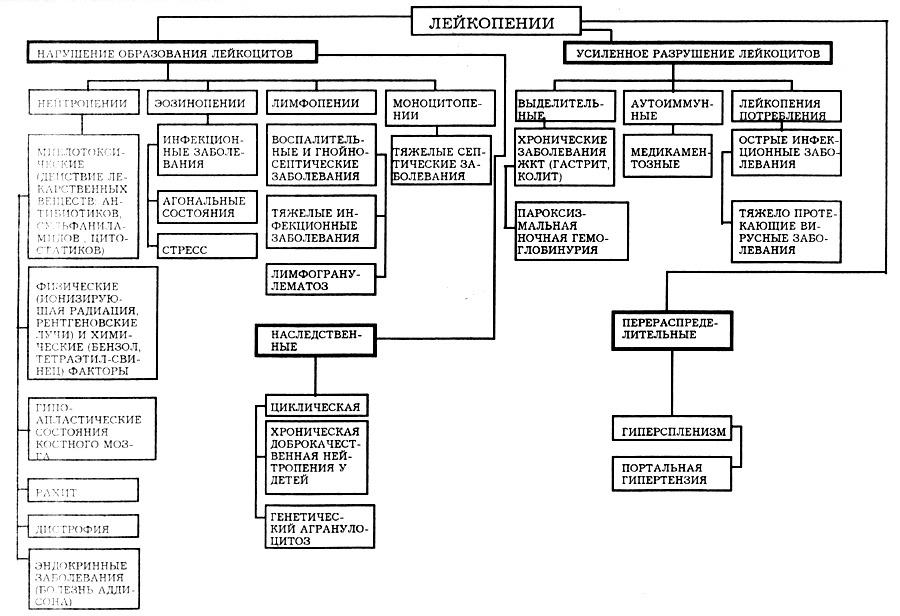
3. Лейкопении и агранулоцитозы; причины, механизмы возникновения и значение для организма. Роль нарушений использования лекарственных препаратов в происхождении патологии лейкоцитов. Изменения лейкоцитарной формулы при лейкопениях и агранулоцитозах.
Лейкопении – уменьшение общего количества лейкоцитов
Механизмы развития:
Уменьшение продукции лейкоцитов в костном мозге – результат наследственных и врожденных дефектов стволовых клеток, может перейти по доминантному и рецессивному пути (например, циклическая лейкопения);
Приобретенные лейкопении – результат воздействия радиации, химических факторов (продукты перегонки нефти), ЛВ с миелотоксическим эффектом.
Лейкопения может быть результатом воздействия биологических факторов: вирус гепатита Е, Эпштейна-Барр, сальмонелла.
Или дефицит веществ – белковой ткани, дефиците витаминов, микроэлементов. Развитие в костном мозге опухолевых клеток, лейкоз, метастазы других опухолей.
Уменьшение выхода лейкоцитов из костного мозга – наследственный эффект мембраны клеток (синдром ленивых клеток); поражение мембран нейтрофилов ЛВ (сульфаниламиды, цитостатики).
Повышенное разрушение в периферической крови – аутоиммунные лейкопении (ЛВ, которые выполняют роль гаптенов). После переливания крови, при гиперспленизме на фоне цирроза печени, поражение ЖКТ (гастроэнтероколит), у курильщика, при остеомиелите.
Перераспределение лейкоцитов в сосудистом русле – застой в малом круге кровообращения, при портальной гипертензии ( в системе воротной вены), при введении гистамина.
Степени тяжести лейкопений:
3-2*10 в 9 л – легкая
1,75-1,0*10 в 9 л – средняя
Меньше 0,75*10 в 9 л - тяжелая
Тжелая лейкопения – агранулоцитоз.
Бывает: миелотоксический и аутоиммунный.
Причины:
Миелотоксический - в результате воздействия ионизирующей радиации, химических факторов
Аутоиммунный – дозовой зависимости нет
Картина костного мозга
Если миелотоксический – пустой костный мозг, т.к преобладает жировая ткань
При аутоиммунном – раздраженный костный мозг, т.к много предшественников лейкопоэза.
Картина периферической крови
Если миелотоксический, то страдают все ростки кроветворения, будут анемический синдром
Если аутоиммунный, то только лейкопения
Клинические проявления
Нейтропения меньше 0,6 – снижение резистентности к бактериальной флоре;
0,3-0,5 – все воспалительные проявления легко купируются, тяжелых некротических изменений нет
Меньше 0,3 – гнойно-некротические изменения (на уровне слизистых оболочек – стоматит, ангина, пневмония с деструкцией, на коже)
Билет 8
2. Биологические особенности опухолевого роста; атипизм, его формы и проявления. Доброкачественные и злокачественные опухоли; механизмы инфильтративного роста, метастазирования.
Свойства опухолевой клетки
Опухоль растет сама из себя (потомство одной клетки);
Опухоль автономна (нет регуляции со стороны нервной и эндокринной систем, не реагирует на кейлоны, не имеет контактного торможения);
Беспредельный рост (опухолевые клетки «бессмертны», «иммортальны»);
Опухоль агрессивна;
Характерен АТИПИЗМ;
Виды опухолевого атипизма
Роста
Обмена веществ
Структуры
Функции
Атипизм роста проявляется в атипизме деления клеток, созревании клеток, метастазировании, рецидивировании, инвазивный рост.
Способствует метастазированию:
Большой запас ферментов (коллагеназа, эластаза, гиалуронидаза);
Слабый контакт между клетками с помощью десмосом;
Пути метастазирования
Гематогенный путь – характерен для сарком (в сосуд, и с током крови);
Лимфогенный – характерен ракам;
Полостной- по спинномозговой, брюшной, плевральной полости;
Имплантационный – на рядом лежащие органы и ткани;
Обмен веществ в опухолевых клетках
Получают энергию путем анаэробного гликолиза, конечный продукт – лактат (молочная кислота), идет тенденция к развитию метаболического ацидоза. Чтобы дочерние клетки образовывались, нужно много энергии, и нужно много субстрата. Опухолевая клетка – ловушка для глюкозы. Опухоль активно потребляет аминокислоты (все азотсодержащие вещества), холестерин, витамины, антиоксиданты. И все приводит к кахексии. Характерно расстройство внутриклеточной регуляции метаболизма, ауто- и пара-клеточная регуляция. Биохимическая деспециализация, атипизм обмена.
Атипизм структуры (клеточный и тканевой)
Benign – доброкачественная: клетки похожи друг на друга и на нормальную ткань.
Malignant – злокачественная:
Атипизм функции
Характерна гипофункция, дисфункция, гиперфункция.
Этиология. Впервые задумались в 1785 году, 18 век. Есть причины – физические, химические, биологические; и условия (факторы риска) – снижение эффективности антиканцерогенных факторов защиты организма.

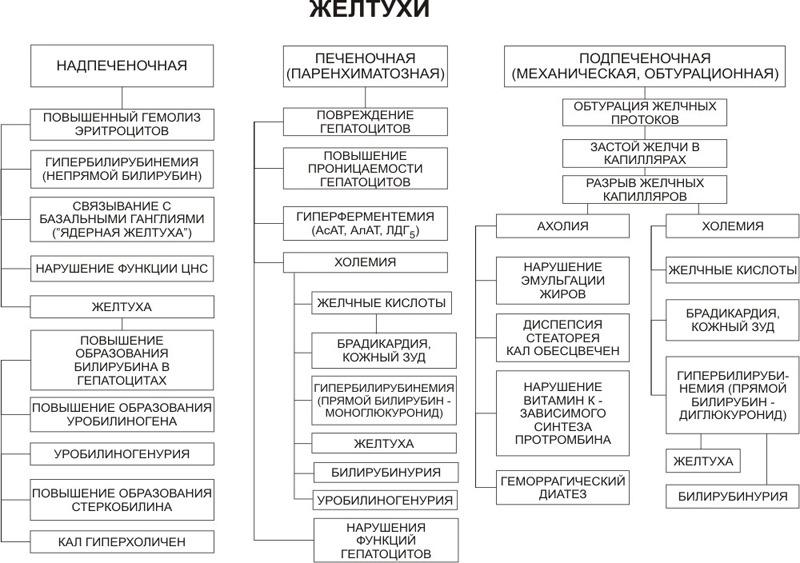
3. Желтухи; виды и проявления.
Желтуха
Это синдром, характеризующийся избыточным содержанием в крови интерстициальной жидкости и моче желчных пигментов, с желтушным окрашиванием кожи, слизистых и биологических жидкостей.
Билирубин образуется в результате гемолиза эритроцитов в РЭС. Образуется гемм билирубиннепрямой билирубин (он циркулирует в крови у всех, в норме до 20 мкмоль).
Непрямой билирубин захватывается гепатоцитами, и гепатоцит связывает его с 2 молекулами глюкуроновой кислоты прямой билирубин (связанный), т.е образуется в гепатоцитах.
Прямой билирубин по желчевыводящим путям поступает в кишечник. В кишечнике он превращается в уробилиноген по системе воротной вены поступает обратно в печень и в печни он расщепляется до пиррола. И второе вещество – стеркобилиноген, он не всасывается, идет в кал и обусловливает специфическую окраску кала.
Виды желтух:
Печеночная, или паренхиматозная.
В крови увеличивается содержание прямого билирубина моноглюкуронида. В кишечник поступает мало желчи там образуется мало стеркобилиногенакал гипохоличен, но реакция на стеркобилиноген будет положительной. Уробилиноген всасывается, поступает в печеньпечень отправляет его в общий кровоток, т.е в моче будет уробилиноген (реакция мочи положительная). Моча будет темная за счет прямого билирубина.
Еще характерный признак – холемия. У пациента будет кожный зуд, расчесы. Желчный кислоты обладают ваготропным эффектом у пациента брадикардия и артериальная гипотензия
Подпеченочная, или механическая.
Связана с обтурацией общего желчного протока. Частая причина – желчно-каменная болезнь. Кроме причинами могут быть: опухоль головки поджелудочной железы, гельминтозы (описторхи, аскариды).
Печень работает у пациента хорошо. Повышается давление внутри желчных ходов, и разрываются желчные капилляры. Признаком цитолиза является фермент щелочная фосфотаза.
В крови прямой билирубин диглюкуронил – гипербилирубинемия. Моча темная, и кожа цвета пива за счет прямого билирубина. Желчь в кишечник не поступает кал ахоличен, стеркобилиногена нет, в моче уробилиногена нет. Холемия, у пациента зуд, брадикардия, артериальная гипотензия.
В крови возрастает содержание холестерина (субстрат для синтеза желчных кислот) ксантомы – пропитывание холестерином кожи – пятна.
Формируется синдром ахолии: обесцвеченный кал, стеаторея, дисбиоз кишечника, диспепсия, кишечная аутоинтоксикация, дефицит жирорастворимых витаминов.
Дефицит жирорастворимого витамина К.
Проба Бондарь – пациенты вводят парентерально водорастворимый аналог витамина К.
Надпеченочная, или гемолитическая.
Формируется на фоне гемолитической анемии (см.анемии), связанные с эндо- и экзоэритроцитарными факторами.
У пациента гемолиз эритроцитов возрастает концентрация в крови непрямого билирубина. Печень работает хорошо, но с этой концентрацией справиться не может. В кишечнике образуется большое количество стеркобилиногенагиперхолия кала. Моча темная за счет уробилиногена.
Физиологическая желтуха новорожденных– формируется начиная с 3 суток, длится недели 3. Связано это с тем, что во внутриутробном периоде непрямой билирубин от плода по плацентарному кровотоку отправляет маме. Когда ребенок родился, этот пть прекращается и у ребенка нарастает свой непрямой билирубин, а ферментативный системы печени, ответственный за конъюгацию нарастают постепенно.
Интенсивность окрашивания ребенка не зависит от билирубина, а зависит от альбуминов.
Гемолитическая болезнь новорожденных– возникает когда у резус- мамы зарождается резус+ ребенок. На чужеродный белок плода возникают ат, они проникают и воздействуют на плод, в 1-ю очередь на эритроциты. В результате этого гемолиза образуется непрямой билирубин, он пропитывает ткани богатые липидами (головной мозг, кора надпочечников). Может быть анемическая форма (множество эритроцитов разрушено), желтушная форма (желтуха, симптом заходящего солнца), отечная форма.
Билет 9
. Сенсибилизация; механизмы развития и проявления. Медиаторы аллергии; виды, механизмы образования и высвобождения, значение в развитии воспаления и инфекций.
Первичное поступление аллергена в организм – формирование сенсибилизации.
Аллерген – макрофаг – процессинг аллергена – презентирует его Т-лимфоцитом, клетки памяти, CD-4.
Сенсибилизация – процесс выработки антител, и время нахождения их в организме.
В результате сенсибилизации идет выработка антител.
2 группы антител:
Свободно циркулирующие – гуморального типа реакции:
IgE – реагины
IgG
IgM
Фиксированные на Т-лимфоцитах – аллергия клеточного типа:
IgM – играют роль рецепторов на Т-лимфоцитах
За сенсибилизацию при атопии отвечают IgE – реагент. Их свойства – адсорбироваться на тучных клетках.
За анафилаксию отвечают IgG свободноциркулирующие.
Образование комплекса при повторном попадании аллергена происходит в крови или на поверхности тучных клеток. В результате образовании на тучных клетках – дегрануляция тучных клеток. Из этих гранул выделяется – гистамин, гепарин, серотонин, фактор хемотаксиса эозинофилов. Под действием этого комплекса активируется фосфолипаза А2, но в тучных клетках преобладает лимфооксигенвзный путь превращения арахидоновой кислоты, и образуются лейкотриен С4, Е4, D4 – медленно реагирующая субстанция анафилаксии (МРСА).
Гистамин – повышает проницаемость сосудов проявление конъюнктивита, отек кожи, кожный зуд, спазм гладкой мускулатуры кишечника – диспепсия (при пищевой), спазм матки, бронхов.
Серотонин – повышает проницаемость сосудистой стенки, отек слизистой, кожи, зуд, агрегация тромбоцитов.
Брадикинин – повышает проницаемость сосудистой стенки, зуд, боль.
Лейкотриен – вызывает мощный бронхоспазм.
3. Артериальные гипертонии. Первичная артериальная гипертония (гипертоническая болезнь). Этиология, стадии развития, патогенез, клинические проявления, последствия, осложнения.
Гипертензия – повышение давления.
Гипертония – повышение сосудистого тонуса.
Гипертензивные состояния:
гипертензивные реакции - ситуативные
артериальные гипертензии – более длительное повышение:
первичная (эссенциальная) ГБ
вторичные (симптоматические)
Гипертоническая болезнь – это повышение АД, обусловленное нарушение ВНД, приводящим к стойкому повышению прессорной функции сосудодвигательного центра.
«Невроз сосудодвигательного центра» (по Г.Ф.Лангу).
Этиология
нервно-психическое перенапряжение
условия, способствующие развитию ГБ (факторы риска):
наследственная предрасположенность
индивидуальные характеристики организма
факторы окружающей среды
наследственная предрасположенность (полигенный тип наследования):
системная мембранопатия накопление в миоцитах избытка ионов Са, Na
дисфункция рецепторов доминирование эффектов гипертензивных агентов
нарушение экспрессии генов клеток эндотелия снижение синтеза вазодилататоров
При заболевании одного из родителей риск развития ГБ возрастает в 6 раз
Индивидуальные характеристики:
тип конституции: гиперстеники – они симпатотоники, тонус симпатики преобладает
тип ВНД: неуравновешенность, преобладание возбуждения, слабый тип – холерики, меланхолики
курение – фактор повреждающий эндотелий сосудов
избыточная масса тела
гиподинамия
Факторы окружающей среды:
соленое, жирное
алкоголь
условия проживания
дисмикроэлементозы: избыток кадмия, дефицит магния
профессиональные вредности
Патогенез
Стадия: Лабильная (транзиторная) – нарушение саморегуляции сосудодвигательного центра по действием отрицательных психоэмоциональных факторов, там формируется патологическая доминанта или застойный очаг, которая не исчезает, а также она с одинаковой силой реагирует как на безусловные, так и на условные раздражители и образует устойчивые связи с подкорковыми центрами и нарушает саморегуляцию сосудистого центра
Что приводит к тому, что у пациента симпато-адреналовая система активировалась, что ведет к более длительному повышению артериального давления. Причем раз это нарушение происхоидт, то растет систолическое давление. Через несколько дней снижается в результате простогландинов. В эту стадию уже надо лечиться. Самым эффективным является помощь психологов;
Стадия: Стабильная – высокое давление постоянное. Все депрессоры уже истощены, ситуация меняется и появляются органические повреждения. Формируется гипертрофия левого желудочка, а также гипертрофируется гладко-мышечный слой артериол. Тип гипертензии систоло-диастолический;
Основные причины снижения импульсации от барорецепторов сосудов и развития гипертензии:
Повреждение барорецепторов;
Снижение растяжимость стенок артерий;
Нарушенеи проведения «депрессорной» импульсации;
Адаптация барорецепторов к длительно повышенносу АД.
Склеротическая. АД устанавливается на высоких цифрах. Возможны его колебания, но оно обычно не снижается до нормальных цифр. Наступают анатомические изменения сердечной мышцы, артериол почек и мозга. Особенностью склеротической стадии гипертонической болезни является склонность к сосудистым спазмам, что проявляется эпизодически возникающими головокружениями
Билет 10
2. Аллергические реакции II (цитолитического) типа. Этиология, патогенез, клинические проявления. Патогенез аутоиммунных (лекарственных, гаптеновых) болезней крови.
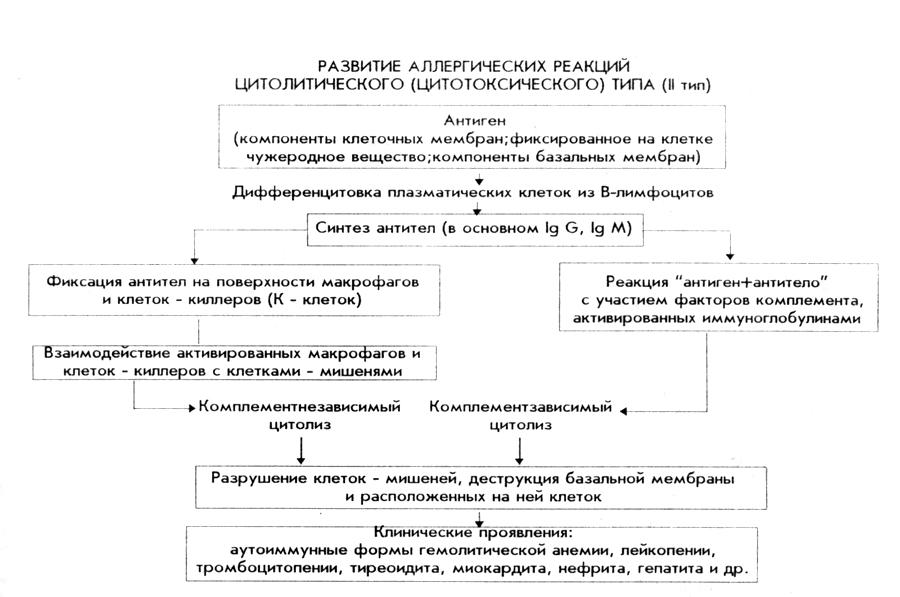
Аллергены – собственные клеточные или базальные мембраны, измененные под действием физических, химических или биологических факторов, или же могут быть первичные аллергены при поражение гистогематических барьеров.
За сенсибилизацию отвечают IgM и IgG, которые свободно циркулируют в крови.
При повторном попадании, образование комплекса происходит на поверхности клеток-мишеней происходит цитолиз, 2 путями:
Комплемент зависимый цитолиз – Аг+Ат способствует активации комплемента, комплемент приобретает протеолитическую активность, и делает каналы (дырки) в мембране клеток. Дырки – ионы Na в клетку, ионы K из клетки.
Комплемент независимый цитолиз – клетки, которые имеют рецепторы к Fc – рецептору – NK клетки, макрофаги. Если макрофаг узнал, то он съест измененную клетку.
Клинические проявления: очень часто мишенями являются клетки крови если эритроциты – аутоиммунная гемолитическая анемия, тромбоциты – аутоиммунная тромбоцитопения, гранулоциты – агранулоцитоз аутоиммунный. Еще проявление – синдром Лайела, мишень – клетки кожи – слущивание (отторжение) кожи.
3. Анемии, основные формы. Этиология, патогенез, гематологические и клинические проявления анемий. Роль лекарственных препаратов в возникновении анемических состояний, значение иммунопатологических механизмов в их развитии.
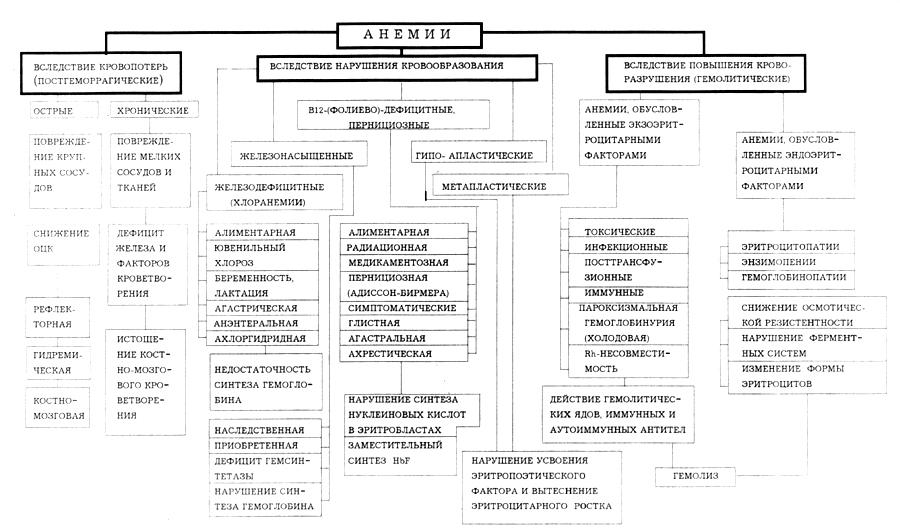
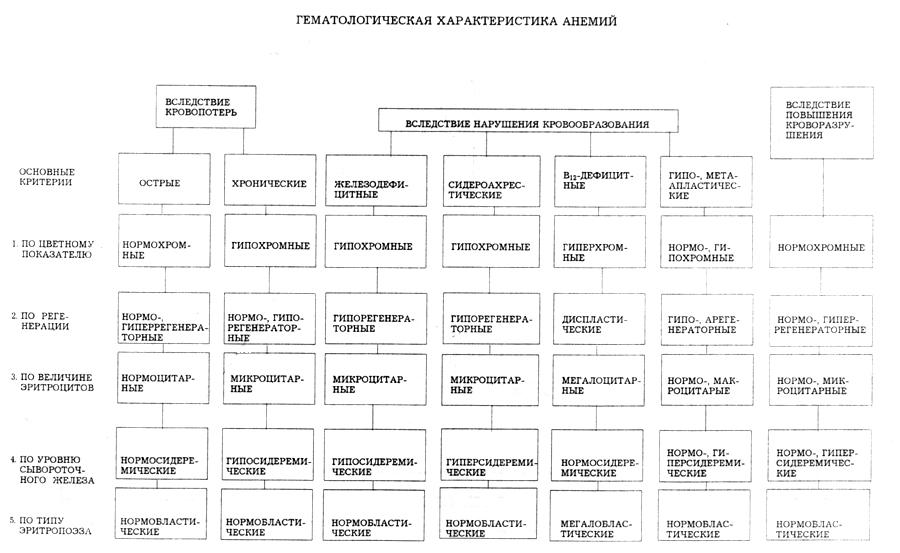

Анемии вследствие нарушения кровообразования
Железодефицитные анемии. Причины дефицита железа: менструальные потери, лактации, беременность, растущий ребенок, подросток, поражение желчно-кишечного тракта.
Проявления сидеропении
Синдром сидеропении – эпителиальный синдром (скрытая): выпадение и истончение волос, их сечение, исчерченность и повышенная ломкость ногтей, изменение слизистых оболочек (трещины в углах рта), иммунодефицит (снижение выработки лизоцима, комплемента, Ig, функциональная недостаточность микро- и макрофагов).
При явной сидеропении – анемия гипохромная, микроцитарная, гипорегенераторная.
Ферритин: мужчины 15-200 нг/мл; женщины 12-150 нг/мл
Железо сыворотки ниже 12 мкмоль/л
Уменьшение разницы между утренней и вечерней концентрациями железа сыворотки до 3,5 и менее мкмоль/л.
Сидероахрестическая (железонасыщенная) анемия
Дефект ферментов синтеза гена:
Наследственный: рецессивный сцепленный с Х-хромосомой (чаще); аутососмно-рецессивный (чаще);
Приобретенный: свинцовая интоксикация; дефицит витамина В6
Гипорегенераторная, гипохромная, гиперсидеремическая. Железо откладывается в митохондриях, в эритроидных клетках костного мозга – сидеробласты, а в периферической крови – сидероциты.
Негемовое железо откладывается во внутренних органах, формируется гемосидероз (легких, печени).
Железо как металл с переменной валентностью, способствует реакциям пероксидации.
В12 – и фолиево-дефицитные анемии
Чтобы В12 поступил в организм, нужен внутренний фактор Кастля, который вырабатывается в желудке. Витамин В12 – внешний фактор Кастля.
Причины дефицита витамина В12:
Атрофический гастрит
Аутоантитела к обкладочным клеткам желудка
Резекция желудка
Энтерит
Резекция подвздошной кишки
Дисбактериоз
На фоне печеночной недостаточности нарушается депонирование витамина В12. Повышенное разрушение витамина происходит при интенсивном курении, приеме противотуберкулезных препаратов, при воздействии закиси азота, при инфекции.
Повышенная потребность: при беременности, у ребенка, конкурентное всасывание - паразит (дифиллоботриоз).
Причины дефицита фолиевой кислоты: вскармливание ребенка козьим молоком. Повышенная потребность на фоне беременности, лактации, при интенсивном росте. Прием лекарственных препаратов: барбитураты (противосудорожные, снотворные), противотуберкулезные, цитостатики (направлен на нарушение функции витаминов) + алкоголизм и наркомания.
Дефицит этих витаминов возникает на фоне опухолей, эксфолиотивные дерматиты (слущивание большого количества клеток кожи), различные процедуры гемосорбции, диализа.
Витамин В12 – его активная форма необходима для активации фолиевой кислоты, а фолиевая кислота необходима для превращения уридин-дифосфата в тимидин, т.е. это вещество необходимо для синтеза РНК. При этом биосинтез гемоглобина не нарушается, нарушается только процесс пролиферации. Компенсаторно эритропоэз в костном мозге перестраивается на мегалобластичесий тип. Мегалобласты очень долго развиваются (10-12 дней), и циркулируют в крови намного меньше. Активируется внутримозговой гемолиз эритрокариоцитов, активируется эритрофагоцитоз, синтез антиэритроидных антител.
Картина периферической крови: у пациента гиперхромия макроцитарная и мегалоцитарная; по регененрации – диспластическая;
У пациента развивается + нейтропения, лейкопения.
Поражение ЖКТ при дефиците витамина В12
Глоссит (язык со сглаженными сосочками), гастроэнтероколит.
Поражение нервной системы
Нарушается синтез янтарной кислоты из метилмалоновой кислоты – накопление метилмалоновой кислоты.
Нарушается миелинизация – образуется фуникулярный миелоз – поражение задних боковых столбов спинного мозга – нарушение чувствительности (парестезии), нейротрофические расстройства, боли.
Дефицит витамина В12 и В9 – ведет к избытку гомоцистеина в крови – следовательно повышается риск атеросклероза и тромбоза.
Белково-дефицитная анемия
Гипо- и апластическая анемия
При гибели человека исчезают все эритроидные островки.
Наследственные:
Апластическая анемия Фанкони. Тип наследования – аутосомно-рецессивный. Микроцефалия, гипоплазия лучевой кости. Дети не выживают. У такого ребенка: тромбоцитопения (геморрагический синдром), лейкопения, нейтропения (развиваются стоматиты).
Приобретенные. Причины: воздействие ионизирующей радиации, действие химических факторов (бензол, толуол) , в частности лекарственные препараты с миелотоксическим эффектом (цитостатики, нестероидные противовоспалительные средства, барбитураты, антибиотики), биологические факторы (вирус гепатита Е, вирус Энштейна-Барр – повреждают костно-мозговые клетки).
Панмиелофтиз – чахотка костного мозга
Анемия – нормо или гипохромная, резко выражен анизо- и пойкилоцитоз, у пациенты гиперсидеремия, лейкопения, арегенераторная анемия, тромбоцитопения, апластическая.
Метапластическая анемия
Развивается на фоне опухолевого поражения костного мозга – это и лейкоз, или метастазы других органов.
Анемии вследствии повышенного кроворазрушения – гемолитические анемии
Анемии, связанные с эндоэритроцитарными факторами (наследственные) – т.е. патологии эритроцита:
Мембранопатия – эритроцитопатия
Гемоглобинопатия
Ферментопатия или энзимопатия
Анемии, связанные с экзаэритроцитарными факторами – вне эритроцита
Врожденные
Приобретенные
Мембранопатии
Белковозависимые: микросфероцитоз, эллиптоцитоз, стоматоцитоз
Липидозависимые: акантоцитоз
Наиболее часто встречается микросфероцитарная анемия, или болезнь Минковского-Шоффара. Оно передается по аутосомно-доминантному типу, и распространено в странах Балтии. Страдают белки мембраны – спектрин, анкерин. Вследствие этого мембрана пропускает ионы натрия, и поэтому клетка превращается в шарик – микросфероцит. Больные не сколько больны, а желтушны.
Триады гемолитических анемий:
Анемия – у пациента непрямой билирубин в крови повышается – желтуха (всю жизнь)
Гематоспленомегалия – разрушение эритроцитов в ретикулоэндотедиальной системе;
Желчнокаменная болезнь.
Гематологическая триада:
Ретикулоцитоз
В крови непрямая гипербилирубинемия
Снижение осмотической резистентности эритроцитов
У пациента анемия нормохромная, микроцитарная, или микросфероцитарная, нормо- или гиперрегенераторная, гиперсидеремическая.
Гемоглобинопатии
Качественные
Количественные
У взрослого 3 типа гемоглобина – основной – гемоглобин А, он имеет 2 альфа и 2 бета цепи – 96%, 2,5% - Hb A2 (в них 2 альфа и 2 сигма цепи), 1,5% - Hb F (в них 2 альфа и 2 гамма цепи). В норме сумма всех альфа цепей = сумме альфа, бета, гамма
Серповидно-клеточная анемия
Передается аутосомно-рецессивно. Распространенность – связано тесно с малярией. Глютамин заменен на гидрофобный валин, всего 1 аминокислота. В результате этого эритроциты становятся серповидными.
У гомозигот все эритроциты серповидные, они долго не живут, резкое изменение строения костей, т.к. эритроидные клетки синтезируются в костном мозге. У гетерозигот все в порядке.
Впервые внимание на эту болезнь было обращено в 70-х годах во время войны во Вьетнаме, летчики при наборе высоты теряли сознание, при вскрытии в микрососудах было микротромбообразование (во всех сосудах). Эти летчики были гетерозиготами (половина имеет нормальный гемоглобин А, а другая гемоглобин S – он выпадает в виде кристалла в осадок).
Количественные гемоглобинопатии – Талассемия (болезнь Кули)
Аутосомно-рецессивный тип наследования. Распространению способствует малярия.
Альфа-талассемия (недостаток альфа-цепей) и бета-талассемия (недостаток бета-цепей). Лишние цепи откладываются в эритроците, в середине – образуются клетки-мишени (таргетные клетки).
Ферментопатии (энзимопатии)
Дефицит глюкозо-6-фосфатдегидрогеназы
Тип наследования – рецессивный, чаще всего сцепленный с x-хромосомой. Распространение связано с малярией.
Этот фермент способствует восстановлению натрия.
Гемолиз провоцируют лекарственные препараты (сульфаниламиды, парацетамол, аспирин, примахин, метиленовый синий), вирусы, вакцины.
В местах распространения этой патологии могут провоцироваться конскими бобами – фавизм.
Они способствуют образованию активных форм кислорода, образуется перекись водорода, с перекисью борется система глютатион. Чтобы система эта работала, нужен фермент глюкозо-6-фосфатдегидрогеназа. На фоне дефицита провоцируется гемолиз.
Гемолитические анемии, связанные с экзоэритроцитарнвм фактором
Неиммунные формы: токсико-гемолитические (яд змей, бледной поганки, соли свинца, мышьяк, температурные воздействия, инфекционные факторы (гемолитический стрептококк, кишечная палочка, малярийный плазмодий); механические факторы – аппарат искусственного кровообращения, искусственные клапаны, механическое воздействие на эритроциты маршовое (солдаты на асфальте).
Иммунные формы:
- изоиммунные – гемолитическая болезнь новорожденных
- гетероиммунные возникают при переливании несовместимой крови
- аутоиммунные – против эритроцитов, измененных под действием физических факторов, химических, биологических, вырабатываются аутоантитела, способствующие разрушению эритроцитов. Для диагностики используют пробу Кумбса (прямая – выявляет аутоантитела фиксированные на эритроцитах (добавляют антиглобулиновую сыворотку), и непрямая – выявляет свободоциркулирующие аутоантитела (к сыворотке больного добавляется донорские эритроциты 1 группы, которые обладают адсорбировать неспецифические на себе антитела, и затем добавляют антиглобулиновую сыворотку, в результате склеивание – положительная).
Билет 11
. Медиаторы воспаления; виды, происхождение и роль в развитии воспаления. Белки острой фазы повреждения ткани, их значение. Понятие об антимедиаторах.
Медиатор– химические вещества, которые появляются в очаге в результате высвобождения, активации и синтеза, там же воздействуют и метаболизируются. Они свою работу выполняют местно.
По происхождению медиаторы воспаления разделяют на: клеточные и плазменные. По химической структуре выделяют:
биогенные амины:
- из тучных клеток – гистамин
- из тромбоцитов – серотонин
полипептидные:
- плазменные – контактная система плазмы крови (фактор Хагемана (XII), высокомолекулярный кининоген, прекалликреин плазмы, XI фактор); комплемент
- клеточные (тканевые): цитокины (БАВ, вырабатываются фагоцитами); лизосомальные ферменты
3. липидные – метаболиты арахидоновой кислоты (эйкозаноиды): простагландины, тромбоксаны, лейкотриены
Образование медиаторов повреждения происходит каскадно: в ответ на повреждение из симпатических терминалий выделяется адреналин активирует пероксидацию липидамембрана клеток становится более лабильной, что способствует выделению гистамина из тучных клетокгистамин действует на фактор Хагемана (XII) и на этот же фактор действует сам адреналин. Фактор Хагемана активирует колликреин-кининовую систему, конечный продукт которой – брадикинин (гормон боли)он активирует фосфолипазу А2она же активируется адреналином тоже .
Фосфолипаза А2 воздействет на фосфолипиды мембран из них образуется арахидоновая кислота. На арахидоновую кислоту может воздействовать 2 фермента: циклооксигеназа (ЦОГ), под ее действие образуются простагландины (простагландин Е2, и простогландин F2α), а также тромбоксаны; липооксигеназа (ЛОГ), под ее действие образуются лейкотриены, которые приглашают лейкоциты в очаг воспаления.
Противовоспалительные медиаторы – ограничивают развитие воспаления
гепарин – связывает биогенные амины, ингибирует комплемент, препятствует свертыванию крови, является антикоагулянтом и ингибирует адгезию и агрегацию к тромбоцитам, снижает активность колликреин-кининовой системы, структурный компонент соединительной ткани, участвует в регенерации.
Апопротеин Е – вырабатывается макрофагами, уменьшает активность иммунных реакций
Антифосфолипазы
Антиоксиданты – противовоспалительные мелиаторы
Интерлейкин 10 – ингибирует цитокины, снижает активность Т-хелперов
Липоксины – вырабатываются из арахидоновой кислоты
ГКС
Медиаторы воздействуют на микроциркуляторное русло.
Белки острой фазы
|
1.С-реактивный белок Сывороточный амилоид А α2-макроглобулин, комплемент церулоплазмин |
Эти белки отвечают за адсорбцию, обезвреживание и удаление чужеродного материала |
|
2.α1-кислый гликопротеид α1-антитрипсин гаптоглобин |
Ингибиторы протеолитических ферментов |
|
3. Церулоплазмин Лактоферрин Ферритин |
Связывают и транспортируют медь Связывают железо Белок, депонирующий железо Они связывают и транспортируют металлы с переменной валентностью (бактериостатический и антиоксидантный эффекты) |
|
4. Фибриноген Антитромбин III |
Регуляция гемостаза и фибринолиза |
