
onch_posobie
.pdfМИНОБРНАУКИ РОССИИ
ФГБОУ ВПО «Уральский государственный лесотехнический университет»
Б.П. Середа Л.С. Молочников Л.В. Демидова С.В. Целищева
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
ЭЛЕМЕНТЫ ТЕОРИИ, СПРАВОЧНЫЕ ДАННЫЕ, ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Под редакцией проф. Б.П. Середы и проф. Л.С. Молочникова
2-е издание, переработанное и дополненное
Рекомендовано учебнометодическим объединением по образованию в области лесного дела в качестве учебного пособия для студентов высших учебных заведений лесотехнического профиля
Екатеринбург
2012

УДК 546 ББК 540
О 28
Рецензенты:
Кафедра химии Воронежской государственной лесотехнической академии (зав. кафедрой доктор технических наук профессор Л.И. Бельчинская)
Зав. кафедрой общей химии и природопользования Уральского федерального университета доктор химических наук профессор М.Г. Иванов
Середа Б.П., Молочников Л.С., Демидова Л.В., Целищева С.В.
О28 Общая и неорганическая химия: Элементы теории. Справочные данные. Задания для самостоятельной работы: учеб. пособие / Б.П. Середа, Л.С. Молочников, Л.В. Демидова, С.В. Целищева. – 2-е изд. перераб. и доп. – Екатеринбург: Урал. гос. лесотехн. ун-т,
2012. – 406 с.
ISBN 9-785-94984-434-2
Учебное пособие содержит элементы теории и справочные данные всех основных разделов курса общей и неорганической химии.
Предназначено, в первую очередь, для студентов-заочников всех специальностей лесотехнических вузов, может быть использовано студентами и преподавателями других технических вузов заочной и очной форм обучения.
Печатается по решению редакционно-издательского совета Уральского государственного лесотехнического университета.
УДК 546 ББК 540
ISBN 9-785-94984-434-2 |
ФГБОУ ВПО «Уральский государственный |
|
лесотехнический университет», 2012 |
|
Середа Б.П., Молочников Л.С., |
|
Демидова Л.В., Целищева С.В., 2012 |
|
2 |

ПРЕДИСЛОВИЕ
Данное пособие предназначено для самостоятельного изучения студентами I курса всех специальностей заочной формы обучения основных разделов общей и неорганической химии в процессе выполнения домашних заданий. Пособие может быть использовано для аудиторной и внеаудиторной работы студентами I курса всех специальностей очной формы обучения, а также контроля знания студентов путем проведения коллоквиумов и контрольных работ.
В соответствии с программой изучаемого курса пособие содержит контрольные вопросы и задачи различной степени трудности и состоит из четырех частей: первая часть включает важнейшие разделы общей химии, вторая посвящена химии элементов и их соединений, в третьей приведены справочные данные, необходимые для решения предлагаемых задач. Варианты контрольных заданий для студентов-заочников содержатся в приложении. С целью облегчения самостоятельной работы студентов каждому разделу первой и второй частей предпослано краткое теоретическое введение и в первой части приведены примеры решения типовых задач. Естественно, что изложение теории носит подсобный характер и является очень кратким, поэтому ее прочтение ни в коей мере не заменяет работу с учебником. Авторам казалось полезным небольшую часть справочных данных в виде таблиц вынести из третьей части в соответствующие разделы первой и второй частей пособия.
Контрольную работу студенты-очники пишут в начале семинарского или лабораторного занятия. В нее обычно включаются 1-2 вопроса из числа тех, которые вошли в изучаемый раздел пособия. Для коллоквиума же отводятся 2-4 часа, в течение которых студенту предлагается ответить на 5-10 вопросов. Индивидуальные варианты коллоквиумов, домашних заданий и контрольных работ составляются преподавателем. Многолетний опыт преподавания химии на кафедре подтверждает эффективность такого вида самостоятельной работы и контроля знаний студентов.
Значительную часть задач авторы сопроводили ответами. Для обеспечения возможности решения задач, приведенных в пособии, справочные данные для третьей части собирались авторами из различных источников и их достоверность не всегда могла быть проверена. При решении задач и ответах на вопросы следует, в основном, пользоваться справочными данными из третьей части пособия и литературой, приведенной в конце пособия.
3

В процессе самостоятельного внеаудиторного изучения разделов общей и неорганической химии студенты-заочники в соответствии с программой выбранной специальности выполняют следующее количество контрольных работ:
-студенты специальностей 250201, 250203, 080100, 080502 одну контрольную работу;
-студенты специальностей 150405, 190500, 190601, 190603, 190701, 190702, 220301, 250401, 250403, 270200, 270205 две контрольные работы;
-студенты специальностей 240100, 240502, 261200, 261201, 280200, 280201, 280202, четыре контрольные работы.
Каждая таблица (см. приложение) имеет 100 вариантов заданий, содержащих то или иное количество контрольных работ. Каждая контрольная работа включает 10-11 вопросов и задач.
Студент выполняет вариант задания, соответствующий двум последним цифрам его студенческого билета. Например, номера студенческого
билета 123456, 654301, 543210; последние две цифры каждого из билетов ( 56, 01, 10) и есть номер варианта, который студент должен выполнить.
Задачи и вопросы по общей химии приведены в первой части пособия – разд. 1-11, по неорганической химии – во второй части пособия – разд. 12-22.
Учебное пособие подготовлено коллективом преподавателей кафедры общей и неорганической химии Уральского государственного лесотехнического университета под общей редакцией проф. Б.П. Середы и проф. Л.С. Молочникова.
Авторы выражают глубокую благодарность рецензентам: профессору Л.И. Бельчинской, профессору М.Г. Иванову; внутреннему рецензенту доценту Т.Б. Голубевой и своим коллегам за помощь в подготовке рукописи: доценту Г.В. Киселевой, заведующей лабораторией Е.С. Пономаревой и ведущему инженеру кафедры Л.В. Коминовой.
4

Часть 1
ОБЩАЯ ХИМИЯ
1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ. СТЕХИОМЕТРИЧЕСКИЕ РАСЧЕТЫ.
ГАЗОВЫЕ ЗАКОНЫ
Химический элемент – вид атомов, характеризующихся одинаковым зарядом ядра.
Атом – наименьшая частица элемента, обладающая его химическими свойствами и неделимая при химических реакциях.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами.
Относительная атомная масса элемента Аr – безразмерная величи-
на, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы изотопа углерода 12С.
Относительная молекулярная масса вещества Мr – безразмерная ве-
личина, равная отношению средней массы молекулы естественного изотопического состава вещества к 1/12 массы изотопа углерода 12С.
Моль единица количества вещества, содержащая столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12C.
Число Авогадро (NA), то есть число частиц, содержащихся в 1 моль любого вещества, равно 6,02 х1023 моль-1.
Эквивалентом элемента называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических соединениях.
Эквивалентом вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества.
Молярная масса М масса одного моля элемента или вещества.
Молярная масса эквивалента МЭ |
масса одного эквивалента эле- |
мента или вещества. |
|
Молярный объем эквивалента VЭ |
объем, занимаемый одним экви- |
валентом газа. |
|
5

Закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. Математически этот закон может быть представлен следующими формулами:
|
m1 |
= |
МЭ1 |
или |
m1 |
= |
V2 |
, |
νэкв(1) =νэкв(2) , |
(1.1) |
|
m2 |
МЭ2 |
|
|
||||||
|
|
|
МЭ1 |
VЭ2 |
|
|
||||
где m1 и m2 – массы вступивших в реакцию веществ; MЭ1 и MЭ2 |
– моляр- |
|||||||||
ные массы эквивалентов этих веществ; V2 |
и VЭ2 – объем и молярный |
|||||||||
объем эквивалента, участвующего в реакции газа, измеренные при одних и тех же давлении и температуре, экв – количество эквивалентов.
При расчете МЭ соединений можно использовать следующие формулы:
МЭ оксида (соли) = М/(Bn);
МЭ основания = М/кислотность; МЭ кислоты = М/основность,
где M – молярная масса соединения, B – валентность элемента (для оксида) или заряд катиона (для соли), n – число атомов элемента или катионов в формуле соединения; кислотность и основность – число гидроксильных групп в молекуле основания и число ионов водорода в молекуле кислоты, способных участвовать в реакциях ионного обмена.
Следует учитывать, что более корректным является расчет МЭ сложного вещества по уравнению химической реакции, в которой вещество участвует на основании данного ранее определения. Так, МЭ ортофосфорной кислоты в трех нижеследующих реакциях различна и определяется проявленной кислотой основностью (число атомов водорода, замещённых на металл):
1. Н3РО4 |
NaOH = NaH2PO4 |
H2O; |
МЭ Н |
РО |
98 /1 |
98 г/моль. |
|||
|
|
|
|
3 |
|
|
4 |
|
|
2. Н3РО4 |
2NaOH = Na2HPO4 |
2H2O; |
МЭ Н |
РО |
|
98 / 2 |
49 г/моль. |
||
|
|
|
|
3 |
|
|
4 |
|
|
3. Н3РО4 |
3NaOH = Na3PO4 |
3H2O; |
МЭ Н |
РО |
4 |
|
98 / 3 |
32, 7 г/моль. |
|
|
|
|
3 |
|
|
|
|
|
|
Закон Авогадро: в равных объемах любых газов, взятых при одинаковых температуре и давлении, содержится одинаковое число частиц.
Из закона Авогадро вытекают два важных для химических расчетов следствия.
Следствие 1. В газообразном состоянии при одинаковых температуре и давлении 1 моль всех веществ занимает один и тот же объем.
При нормальных условиях 1 моль любого газа занимает объем
22,4 л.
6

Нормальные условия (н.у.): |
|
- в системе СИ: |
|
Po= 1,013 105 Па; |
To= 273 K; |
- в системе СГСЕ: |
|
Po= 760 мм рт.ст.; |
To= 273 K. |
Подстрочным знаком ноль (Ро, То, Vo) принято обозначать значения параметров, измеренные при н.у.
Следствие 2. Молярная масса исследуемого газа равна его плотности по отношению к известному газу, умноженной на молярную массу известного газа:
M1 = D1/2 M2 , |
(1.2) |
где D1 /2 = 1/ 2 отношение плотностей газов 1 и 2, измеренных при одних и тех же условиях.
Часто плотности различных газов определяют по отношению к водороду или воздуху. Тогда
Mx = 2,016 Dxводор или Mx = 29 Dxвозд.
Если известна плотность газа 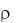 при н.у., то молярную массу газа можно вычислить по формуле
при н.у., то молярную массу газа можно вычислить по формуле
М = 22,4 .
При условиях, отличных от нормальных, пользуются уравнением состояния идеального газа (уравнением Клапейрона), объединяющим газовые законы Бойля-Мариотта и Гей-Люссака:
P1V1 |
|
P2V2 |
R, |
(1.3) |
T1 |
|
T2 |
||
|
|
|
где R – газовая постоянная, принимающая различные численные значения в зависимости от используемой в расчетах системы единиц.
Всистеме СИ: R = 8,314 Дж/(моль К).
Всистеме СГСЕ, где объем V измеряется в мл, а давление P в миллиметрах
ртутного столба (мм рт.ст.): R = 62400 мл мм рт.ст./(моль К).
Уравнение состояния идеального газа, записанное для произвольного числа молей газа, носит название уравнения Менделеева-Клапейрона:
PV = νRT = |
m |
RT, |
(1.4) |
|
|||
|
M |
|
|
где – число моль газа, m – масса газа, M – молярная масса газа. Парциальным давлением называют ту часть общего давления газовой
смеси, которая приходится на долю данного газа. То есть парциальным давлением составной части газовой смеси называется то давление, которое производила бы эта составная часть, занимая при той же температуре объем всей газовой смеси.
7

Закон парциальных давлений Дальтона: общее давление смеси га-
зов, химически не взаимодействующих друг с другом, равно сумме их парциальных давлений:
робщ = р1 + р2 + р3 + … . |
(1.5) |
Из этого следует, что парциальное давление любого компонента газовой смеси равно произведению общего давления на мольную долю этого компонента. Когда газ собирается над водой, он бывает насыщен водяными парами, и в этом случае общее давление равно сумме парциальных давлений данного газа и паров воды. Поэтому
рг = робщ рводы .
Примеры решения типовых задач
Пример 1. При взаимодействии 3,5 г железа с серой образовалось 5,5 г FeS. Вычислите MЭ железа, если MЭ серы = 16 г/моль.
Решение. С 3,5 г железа прореагировало 5,5 – 3,5 = 2,0 г серы. По закону эквивалентов (1.1)
MЭ Fe= mFe MЭ S / mS = 3,5 16/2,0 = 28 г/моль.
Пример 2. Рассчитайте MЭ и атомную массу двухвалентного металла, если 1,215 г его вытесняют из разбавленной серной кислоты 1,394 л водорода, измеренного при 40 С и парциальном давлении 700 мм рт.ст.
Решение.
1. Указанный в задаче объем выделившегося водорода приведем к н.у. Vo, для чего воспользуемся уравнением состояния идеального газа (1.3):
Pо Vо |
= |
P V |
; Vo= |
PVTo |
= |
700 1,394 273 |
= 1,12. |
|||||
Tо |
T |
|
PoT |
760 313 |
|
|||||||
|
|
|
|
|
|
|
||||||
2. Вычислим молярный объем эквивалента водорода VЭ |
при н.у. |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Н2 |
Масса 1 моль H2 |
равна 2 г и занимает объем (н.у.) |
22,4 л. |
||||||||||
Масса 1 эквивалента H2 равна 1 г и занимает объем (н.у.), который |
||||||||||||
мы обозначим как VЭ |
Н2 |
: |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 г |
VЭ H |
. |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
2 г |
22, 4 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
Следовательно: VЭ Н2 = 1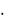 22,4/2 = 11,2 л/моль.
22,4/2 = 11,2 л/моль.
3. Вычислим MЭ металла, для чего воспользуемся законом эквивалентов (1.1), записанным для случая реакций с участием газов:
mMe |
|
V0H2 |
; |
M |
|
= m |
|
V |
0 |
|
/ V 1, 215 11, 2 /1,12 12,15 г/моль. |
|||
|
|
|
0 |
|
ЭMe |
Me |
ЭН |
|
||||||
MЭ |
|
V |
|
|
|
|
|
2 |
0H |
2 |
||||
|
Э |
|
|
|
|
|
|
|
|
|
||||
Me |
|
|
|
Н2 |
|
|
|
|
|
|
|
|
|
|
8

4. Для вычисления атомной массы металла А воспользуемся соотношением, следующим из определения понятия «эквивалент элемента»:
МЭ = A/B,
где B – валентность элемента.
A = МЭ B = 12,15 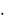 2 = 24,30 г/моль.
2 = 24,30 г/моль.
В периодической таблице Д.И. Менделеева находим, что металл с атомной массой 24,30 – это магний.
Пример 3. Найдено, что 0,455 г газа при 27 С и 800 мм рт.ст. занимают объем 380 мл. Рассчитайте молярную массу газа, если плотность воздуха при н.у. равна 1,293 г/л.
Решение. Эта задача может быть решена либо с использованием следствия 2 из закона Авогадро, либо с использованием уравнения Менде- леева-Клапейрона. Рассмотрим оба этих способа решения.
I способ
1. Используя уравнение (1.3), рассчитаем объем, занимаемый газом при н.у.:
Vo= |
PVTo |
= |
800 |
380 273 |
= 364 мл. |
PoT |
760 |
(273+27) |
2. Рассчитаем плотность этого газа при н.у.:
газ = m / Vо = 0,455/364  10-3 = 1,25 г/л. 3. Рассчитаем плотность газа по воздуху:
10-3 = 1,25 г/л. 3. Рассчитаем плотность газа по воздуху:
D = газ / возд = 1,25/1,293 = 0,967.
4. Используя следствие 2 из закона Авогадро, находим:
Мгаз = 29D = 29  0,967 = 28,0 г/моль.
0,967 = 28,0 г/моль.
II способ
Используя уравнение (1.4) и соответствующее значение газовой постоянной, получаем:
Мгаз |
= |
mRT |
|
0, 455 г 62400 мл мм рт.ст. моль |
1 К 1 300 К |
28, 0 г/моль. |
PV |
|
800 мм рт.ст. 380 мл |
|
|||
|
|
|
|
|
Пример 4. Установите химическую формулу вещества, в котором содержится 11,1 % водорода и 88,9 % кислорода.
Решение. Формула химического соединения показывает мольное соотношение между атомами, входящими в его состав.
Обозначив число атомов водорода в формуле соединения через x, а число атомов кислорода через y, запишем формулу вещества HxOy. Отношение x : y равно:
х : у = 11,1 : 88,9 = 11,1 : 5,55 = 2 : 1,
1 16
9

где знаменатели 1 и 16 атомные массы водорода и кислорода, соответственно.
Следовательно, формула вещества H2O.
Пример 5. Сколько литров водорода (н.у.) выделится при взаимодействии 49,05 г цинка с разбавленной серной кислотой?
Решение. Из уравнения реакции
Zn + H2SO4 = ZnSO4 + H2
следует, что один моль атомов цинка (65,4 г) вытесняет из серной кислоты 1 моль водорода (22,4 л при н.у.).
Поскольку по условию задачи в реакцию вступает
ν = |
m |
= |
49,05 г |
= 0,75 моль |
|
M |
65, 4 г/моль |
||||
|
|
|
атомов цинка, то и водорода выделится 0,75 моль, или
VН2 = 0,75 моль 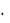 22,4 л моль-1 = 16,8 л.
22,4 л моль-1 = 16,8 л.
Пример 6. Газовая смесь при 0 С содержит 7 л углекислого газа, 8 л кислорода и 25 л азота. Вычислите парциальные давления газов, приняв общее давление газовой смеси равным 101,3 кПа.
Решение. Общий объем газовой смеси составляет 40 л. Общее число
молей газов 40 л |
22,4 моль/л = 1,786 моль. Оно складывается следующим |
образом: из 7 л |
22,4 моль/л = 0,312 моль СО2; 8 л 22,4 моль/л = |
= 0,358 моль О2; |
25 л : 22,4 моль/л = 1,116 моль N2. Мольные доли газов |
составляют: 0,312 : 1,786 = 0,175 СО2; 0,358 : 1,786 = 0,200 О2; 1,116 : |
|
: 1,786 = 0,625 |
N2. |
Следовательно, парциальные давления газов равны: 101,3 0,175 = |
|
= 17,73 кПа; |
101,3 0,200 = 20,26 кПа; 101,3 0,625 = 63,31 кПа, соот- |
ветственно. |
|
Задачи
1. В оксиде олова содержится 21,23 % кислорода. Вычислите МЭ и степень окисления олова в этом соединении.
(Отв. 29,68 г/моль)
2. При восстановлении 2,4 г оксида двухвалентного металла водородом получено 0,54 г воды. Вычислите МЭ металла и его оксида и назовите металл.
(Отв. 32 г/моль; 40 г/моль)
3. Из кислоты 5,23 г цинка вытесняют столько же Н2, что и 3,2 г кальция. Рассчитайте МЭ цинка, используя МЭ кальция.
(Отв. 32,69 г/моль)
10
