
onch_posobie
.pdf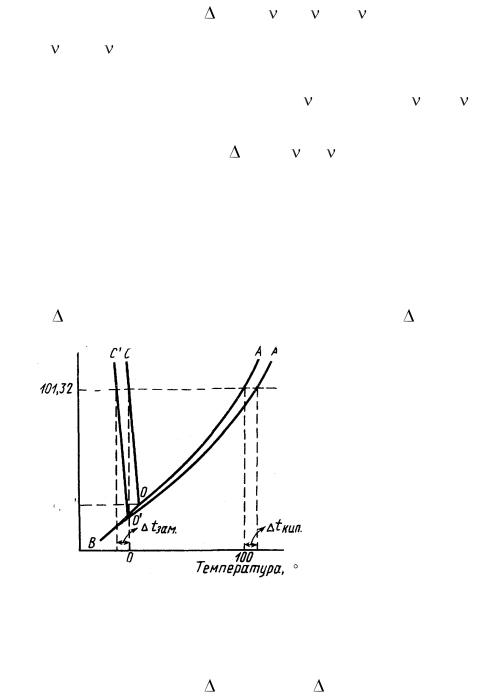
Первый закон Рауля: относительное понижение давления насыщенного пара раствора нелетучего вещества равно мольной доле растворенно-
го вещества: |
|
Р/Р0 = в-ва/( р-ля+ в-ва), |
(9.2) |
где р-ля и в-ва – количества вещества растворителя и растворенного в нем
неэлектролита, соответственно. |
|
|
При очень малых значениях |
в-ва в сумме р-ля+ |
в-ва им можно пре- |
небречь, тогда: |
|
|
Р/Р0 = |
в-ва/ р-ля. |
(9.3) |
Понижение температуры замерзания и повышение температуры ки-
пения растворов. Каждая жидкость закипает (tк – температура кипения), когда давление ее пара становится равным внешнему, и замерзает (tз – температура замерзания), если оно равно давлению пара ее твердой фазы (льда). Поэтому понижение давления пара растворов по сравнению с давлением пара чистого растворителя приводит к повышению температуры кипения tк и понижению температуры замерзания tз растворов (рис. 9.1).
Давление, кПа
|
Рис. 9.1. Диаграмма состояния воды |
|
и водного раствора нелетучего |
С |
вещества |
Второй закон Рауля: изменения температуры кипения и замерзания растворителя прямо пропорциональны моляльности раствора, то есть содержанию частиц растворенного вещества:
tк =Кэcm и tз =Ккcm. |
(9.4) |
Константы — эбуллиоскопическая Кэ и криоскопическая Kк — чис-
ленно равны повышению температуры кипения и понижению температуры замерзания растворов, соответственно, концентрация cm которых составляет 1 моль/кг. Обе константы зависят от природы растворителя. Для воды Кэ и Кк равны 0,516 и 1,86, а для бензола – 2,57 и 5,12 град·моль-1·кг, соответственно. Справочные данные для ряда растворителей представлены в табл. 9.1.
111

Таблица 9.1 Температуры кипения и замерзания, эбулиоскопические Кэ и криоскопические Кк константы некоторых растворителей
Растворители |
tкип., оС |
Кэ |
tзам, оС |
Кк |
Вода |
100 |
0,52 |
0 |
1,86 |
Этиловый спирт |
78,3 |
1,16 |
-117 |
— |
Бензол |
78 |
2,57 |
5,5 |
5,12 |
Уксусная кислота |
118,1 |
3,1 |
16,6 |
3,9 |
Дисульфид углерода |
76 |
2,34 |
-111,5 |
3,83 |
Тетрахлорид углерода |
154 |
5,03 |
-22,99 |
30 |
Примеры решения типовых задач
Пример 1. Вычислите осмотическое давление раствора, содержащего в 1,8 л 60 г глюкозы при 0 оС.
Решение.
Дано |
|
|
mглюкозы= 60 г |
В соответствии с законом Вант-Гоффа (9.1) |
|
mглюкозы |
||
Т = 273 К |
||
Росм = сМ R T = —————— RT, |
||
Vр-ра= 1,8 л = 1,8·10-3 м3 |
Mглюкозы Vр-ра |
|
|
Росм = (60 · 8,31 · 273) : (180 · 1,8·10-3) = 420 кПа |
|
Росм = ? |
Пример 2. При какой температуре осмотическое давление раствора, содержащего 18,6 г анилина С6H5NH2 в 3 л раствора, достигнет 284 кПа?
Решение.
Дано |
|
|
|
|
|
|
|
|
|
|
|
|
|
В соответствии с законом Вант-Гоффа (9.1) |
|||||||||||
mС6H5NH2 = 18,6 г |
Р |
|
|
с |
М RT |
m |
анилина |
|
RT , |
|||
Vр-ра = 3 л = 3·10-3 м3 |
|
|
|
|
|
|||||||
осм |
МанилинаVр |
|
||||||||||
Росм = 284 кПа |
|
|
|
|
|
|
ра |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Т = ? |
Т |
|
РосмМанилинаVр ра |
, |
|
|
||||||
|
|
|
|
|
||||||||
|
|
|
|
|
mанилина R |
|
|
|
|
|||
|
T |
284 103 |
93 3 10 |
3 |
|
|
|
|||||
|
|
|
|
18,6 8,31 |
|
512,6 K. |
||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
112

Пример 3. Вычислите давление пара над |
раствором, |
содержащим |
|||
18 г глицерина С3Н5(ОН)3 |
в 100 г воды, если давление пара над чистой во- |
||||
дой при данной температуре составляет 101,3 кПа. |
|
|
|||
Решение. |
|
|
|
|
|
Дано |
|
|
|
|
|
|
|
|
|
|
|
MC3H5(OH)3 = 18 г |
В соответствии с 1-м законом Рауля (9.2) |
||||
Р0 – Р |
глиц |
|
|
|
|
mH2O = 100 г |
——— = ———— , |
|
|
||
Р0 |
глиц + |
|
|
|
|
Р0 H2O = 101,3 кПа |
H O |
|
|
||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Р0 H O |
|
РH O = ? |
|
глиц |
|
|
|
2 |
|
|
|
2 |
|
|
P = Р0 |
(1 – ————) = ———— |
, |
||
|
|
глиц + |
H2O |
глиц + H2O |
|
|
|
mглиц |
18 |
|
|
|
глиц = ——— = —— = 0,196 моль, |
|
|||
|
|
Мглиц |
92 |
|
|
|
|
mH2O |
100 |
|
|
|
H2O = ——— = —— = 5,56 моль, |
|
|||
|
|
H2O |
18 |
|
|
|
РH2O = 101,3 · 5,56 : (0,196 + 5,56) = 97,85 кПа. |
||||
|
|
|
|
|
|
Пример 4. Вычислите молярную массу глюкозы, если температура кипения раствора, содержащего 27 г глюкозы в 108 г воды, составляет
100,722 о С.
Решение.
Дано |
|
|
|
|
|
|
|
|
|
|
t = tкип.р-ра – tкип. H2O = 100,722 |
о |
о |
||
mглюкозы = 27 г |
|
|
|
– 100 |
|||
|
|
В соответствии с 2-м законом Рауля (9.4) |
|||||
mH2O = 108 г |
|
|
|||||
|
|
|
mглюкозы 1000 |
|
|
||
tкип.р-ра= 100,722 |
о |
С |
|
|
|
||
|
|
|
|
|
|||
|
t = КЭ·сm= КЭ·———————— , отсюда |
||||||
КЭ = 0,52 |
|
|
|||||
|
|
|
Мглюкозы H2O |
|
|||
Mглюкозы= ? |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
КЭ mглюкозы 1000 |
|
|
||
|
|
|
Мглюкозы = ————————, |
|
|
||
|
|
|
|
t mH2O |
|
|
|
|
|
|
0,52 |
27 |
1000 |
|
|
|
|
|
Мглюкозы = ———————— = 180 г/моль. |
||||
|
|
|
0,722 |
108 |
|
|
|
113
Задачи
583. Вычислите осмотическое давление (в кПа) 10 %-го водного раствора сахарозы С12Н22О11 (плотность 1,038 г/мл) при 20 оС.
(Отв. 739)
584. При 15 оС осмотическое давление водного раствора сахарозы С12Н22О11 с заданной концентрацией составляет 725,5 кПа. Каково осмотическое давление раствора (в кПа) при 5 оС?
(Отв. 700)
585. Определите относительную молекулярную массу сахарозы , если осмотическое давление ее раствора, содержащего 30 г сахарозы в 500 мл раствора, при 25 оС составляет 4,3·105 Па.
(Отв. 342)
586. Какова температура (К) водного раствора глюкозы, в 0,65 л которого содержится 18 г С6Н12О6, если осмотическое давление составляет
147,5 кПа?
(Отв. 115,4)
587. Какое количество (моль) глюкозы С6Н12О6 содержится в 0,5 л ее водного раствора, если осмотическое давление его и 0,1М раствора сахаро-
зы С12Н22О11 при 25 оС равны?
(Отв. 0,05)
588. Каково осмотическое давление (в Па) 15 %-го водного раствора глицерина С3Н5(ОН)3 (плотность 1,0313 г/мл) при 30 оС?
(Отв. 4234)
589. Вычислите молярную концентрацию водного раствора анилина
С6Н5NН2 при 20 оС, если его осмотическое давление 432,4 кПа. |
|
|
(Отв. 0,18) |
590. Вычислите массу мочевины СО(NH2)2 (в г), |
содержащуюся в |
0,8 л ее водного раствора, если осмотическое давление |
раствора при 25 |
оС составляет 247,8 кПа. |
|
|
(Отв. 4,8) |
591. При какой температуре измерено осмотическое давление 0,05 М |
|
раствора мочевины СО(NH2)2, если оно составляет 123,9 кПа? |
|
|
(Отв. 298,6) |
592. Приготовлен водный раствор сахарозы С12Н22О11 объемом 0,3 л. При 20 оС осмотическое давление составило 71,2 кПа. Вычислите молярную концентрацию раствора и массу растворенного вещества в данном объеме раствора.
(Отв. 0,03)
593. При 40 оС давление насыщенного пара воды составляет 7375,9 Па. Вычислите понижение давления пара над 40 %-м водным раствором этилового спирта и давление насыщенного пара над этим раствором при той же температуре (в Па ).
(Отв. 1527,9)
114

594. При 20 оС давление насыщенного пара над этиловым спиртом 5866,2 Па. Вычислите понижение давления пара над раствором, содержащим 30 г бензойной кислоты С6Н5СООН в 250 г С2Н5ОН, и давление над раствором при 20 оС (в Па ).
(Отв. 258,1)
595. Рассчитайте давление пара (в Па ) над водным раствором мочевины, полученным растворением 30 г карбамида CO(NH2)2 в 550 г воды при 20 оС. Давление насыщенного пара растворителя при этой температуре равно 2332,75 Па.
(Отв. 2294,5)
596. Рассчитайте давление пара (в Па ) над 10 %-м водным раствором изопропилового спирта С3Н7ОН при 30 оС. Давление насыщенного пара растворителя при данной температуре составляет 4242,84 Па.
(Отв. 4103,3)
597. Вычислите молярную массу мочевины, если давление водяных паров ее раствора, содержащего 30 г CO(NH2)2 на 500 г воды, при 50 оС составляет 12111,6 Па, а растворителя – 12333,6 Па.
(Отв. 60)
598. При 0 оС давление насыщенного водяного пара над льдом равно 610,5 Па. Вычислите понижение давления пара над 15 %-м водным раство-
ром глицeрина С3Н5(ОН)3 и давление насыщенного пара над этим раствором при 0 оС (в Па).
(Отв. 20 и 590,5)
599. Рассчитайте давление насыщенного водяного пара (в Па) над водным раствором пероксида водорода с концентрацией 3 моль/л Н2О2 (плотность 1,035 г/мл) при 0 оС , если при этой температуре давление паров воды равно 610,5 Па.
(Отв. 577)
600. Рассчитайте давление насыщенного водяного пара над 0,5 моляльным водным раствором этиленгликоля С2Н4(ОН)2 при минус 10 оС (в Па), если при этой температуре давление насыщенного водяного пара над растворителем равно 260 Па.
(Отв. 257,7)
601. Вычислите молярную массу глицерина, если давление водяных паров его раствора, содержащего 45 г растворенного вещества на 500 г воды, при 50 оС составляет 7246,2 Па, а растворителя при этой же температу-
ре – 7375,9 Па.
(Отв. 92)
602. Какое количество (в моль) бензойной кислоты С6Н5СООН введено в 500 г метилового спирта, если понижение давления пара растворителя над раствором при 20 оС составило 40,84 Па? Давление паров спирта при этой же температуре – 12758,9 Па (принять, что 2 << 1).
(Отв. 0,05)
115
603. При какой температуре будут кипеть и замерзать децимоляльные водные растворы глюкозы C6H12O6, сахарозы C12H22O11 и глицeрина
С3Н5(ОН)3?
(Отв. 100,052 0С и -0,186 0С)
604.Какой вывод можно сделать по результатам расчета температуры
замерзания растворов, полученных растворением 34 г H2O2, 30 г CH2O, и
60 г CO(NH2)2 в 350 г воды?
605.Приготовлены 10 %-е водные растворы мочевины CO(NH2)2 и
изопропилового спирта C3H7OH. Рассчитайте температуру их замерзания.
(Отв. -3,44 0С)
606. Вычислите температуру кипения 5 %-х водных растворов мочевины CO(NH2)2 и изопропилового спирта C3H7OH.
(Отв.100,46 0С)
607. Рассчитайте массу мочевины CO(NH2)2, которую следует растворить в 250 г воды, чтобы полученный раствор имел температуру замерзания такую же, как и раствор формальдегида, содержащий 3 г CH2O в таком же количестве воды.
(Отв. 6)
608. Какова массовая доля водного раствора глюкозы C6H12O6, если он замерзает при минус 1 oC?
(Отв. 8,7)
609. Водный раствор глицерина С3Н5(ОН)3 кипит при 100,57 оС. Какую моляльную концентрацию должен иметь раствор формальдегида CH2O , кипящий при этой температуре?
(Отв. 1,1)
Для 610-613. В качестве охлаждающих жидкостей (антифризов) в двигателях автомобилей можно использовать водные растворы этиленгликоля С2Н4(ОН)2, глицерина С3Н5(ОН)3, этилового спирта C2H5OH. Какую температуру замерзания будут иметь водные растворы, приготовленные смешиванием …
610. 25 г этиленгликоля и 75 г дистиллированной воды?
(Отв. -10 oC)
611. 50 г этиленгликоля и 25 г дистиллированной воды?
(Отв. -60 oC)
612. 50 г глицерина и 50 г дистиллированной воды?
(Отв. -20,2 oC)
613. 50 г этилового спирта и 50 г дистиллированной воды?
(Отв. -40,4 oC)
614. Рассчитайте температуру кипения спиртового раствора глюкозы, содержащего 15 г C6H12O6 в 500 г C2H5OH.
(Отв. 79,26 oC)
116
615. Какова массовая концентрация водного раствора метилового спирта, замерзающего при той же температуре, что и 25 %-й водный раствор этиленгликоля С2Н4(ОН)2?
(Отв. 5,4 моль/1000 г Н2О)
616. Какова массовая концентрация водного раствора изопропилового спирта C3H7OH, замерзающего при той же температуре, что и 50 %-й водный раствор глицерина С3Н5(ОН)3?
(Отв. 10,9 моль/1000 г Н2О)
617. Рассчитайте понижение температуры замерзания и повышение температуры кипения 1,634 М раствора изопропилового спирта C3H7OH
(плотность 0,982 г/мл).
(Отв. 3,43 oC и 0,96 oC)
618. На приготовление раствора взято 0,6 моль бензойной кислоты С6Н5СООН и 250 г этилового спирта С2Н5ОН. Каково повышение темпера-
туры кипения раствора?
(Отв. 2,78 oC)
619.В 10 %-м водном растворе уксусной кислоты СН3СООН температура замерзания воды понижается до минус 3,44 оС. Рассчитайте криоскопическую постоянную воды.
620.Раствор, содержащий 25 г этилового спирта С2Н5ОН в 800 г уксусной кислоты СН3СООН, кипит при 120,2о С. Рассчитайте эбулиоскопическую постоянную уксусной кислоты.
621.Вычислите молярную массу камфоры С10Н16О, если раствор,
приготовленный растворением 15,2 г ее в 550 г бензола С6Н6, понижает температуру замерзания на 1 оС.
622.10 %-й раствор спирта в сероуглероде кипит при 81,64 оС. Вычислите молярную массу спирта.
(Отв. 46)
9.2. Растворы электролитов
Электролитами называются вещества, проводящие электрический ток в результате распада на ионы в растворенном или расплавленном состоянии.
Электролитическая диссоциация (иначе – ионизация) в растворе – это распад вещества на ионы под действием полярных молекул растворителя. Растворы электролитов в отличие от неэлектролитов дают повышенные значения тех величин, которые зависят от числа частиц растворенного вещества в данном объеме раствора: Росм, Р, tк, tз. Отношение экспериментально найденных значений этих величин для растворов электролитов к теоретическим, то есть вычисленным по уравнениям Вант-Гоффа и Рауля для растворов неэлектролитов той же концентрации, называется изотоническим коэффициентом i. Формулы, выражающие законы Вант-Гоффа и
117

Рауля, становятся применимыми к растворам электролитов после введения в них изотонического коэффициента, так как в этом случае учитывается фактическое число частиц в растворе, возрастающее за счет полной или частичной диссоциации молекул растворенного вещества на положительно и отрицательно заряженные ионы.
Полнота процесса диссоциации зависит от многих факторов: природы соединения и растворителя, концентрации раствора, температуры и т.д. При оценке способности веществ-электролитов к электролитической диссоциации говорят о «силе электролита». Количественная оценка процесса электролитической диссоциации описывается двумя величинами: степенью диссоциации и константой диссоциации КД.
Степень диссоциации электролита показывает выраженную в долях единицы или в процентах долю молекул растворенного вещества, распавшихся на ионы:
= |
Nпродиссоциировавших молекул |
100% . |
(9.5) |
|
|||
|
Nрастворенных молекул |
|
|
Степень электролитической диссоциации связана с изотоническим |
|||
коэффициентом уравнением |
|
||
|
= ( i – l ) / ( n – l ), |
(9.6) |
|
где n – число ионов, на которые распадается молекула электролита. |
|
||
Значения i, найденные по экспериментальным данным, полученным при измерении одной из величин Росм, Р, tк, tз, позволяют определить кажущуюся степень диссоциации электролитов в растворах заданной концентрации.
По значению |
для растворов с сн. = 0,1 |
моль/л все электролиты |
||
условно |
делят на три группы: сильные ( |
30 %), средней силы |
||
(3 % |
30 %), слабые ( |
3 % ). |
|
|
Пример 1. Вычислите кажущуюся степень электролитической диссоциации Ba(NO3)2 в растворе, содержащем 33,2 г соли в 300 г воды, если температура кипения этого раствора составила 100,465 оС.
Решение.
Дано |
|
|
|
m(соли) = 33,2 г |
В соответствии с (9.6) |
||
i – 1 |
|
||
mводы = 300 г |
|
||
= ————. |
|||
tкип.(опыт) = 100,465 оС |
|||
n – 1 |
|
||
|
Уравнение диссоциации соли: |
||
= ? |
|||
|
Ва(NO3)2 |
Ва2+ + 2 NO3-, |
|
118

Поэтому для раствора данной соли n = 3.
tкип (опыт)
i = ——————— ,
tкип (вычисл.)
mсоли ·1000
tкип (вычисл) = Кк Сm = Кк ——————,
Мсоли mводы
0,52·33,2·1000
tкип (вычисл) = ——————— = 0,220 ,
261·300
0,465
i = ——— = 2,114, 0,220
2,114 – 1
= ———— = 0,557 (55,7 %). 3 – 1
Пример 2. Изотонический коэффициент раствора, содержащего 178,5 г KBr в 900 г воды равен 1,7. Определите давление водяного пара над этим раствором при 50 оС, если давление паров воды при 50 оС равно
12334 Па.
Решение.
Дано |
PH O(р-ра) |
= PH O – PH O (опыт) , |
|||||||||||||||
mKBr = 178,5 г |
2 |
|
|
|
|
|
2 |
|
|
|
|
|
2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
mH O = 900 г |
|
PH O (опыт) = i |
|
|
Pвычисл. |
||||||||||||
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PH2O = 12334Па (50 оС) |
В соответствии с 1-м законом Рауля (9.2) |
||||||||||||||||
i = 1,7 |
|
Рвычисл |
|
|
|
|
|
|
|
νКВr |
, |
||||||
PH2O(р-ра) = ? |
|
РН2О |
|
|
|
|
νКВr |
|
|
νН2О |
|||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
νКВr |
mКВr |
|
178,5 |
1,5 моль, |
|||||||||||
|
|
MКВr |
|
|
119 |
|
|||||||||||
|
|
|
|
|
|
||||||||||||
|
|
νH O |
|
mH O |
900 |
|
|
50 моль, |
|||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
2 |
|
|
MH O |
18 |
|
|
|
|||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||
|
Pвычисл |
|
|
12334 1,5 |
|
359, 2 Па, |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
51,5 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
PH2O (опыт) = 1,7  359,2 = 610,6 Па,
359,2 = 610,6 Па,
PH2O(р-ра) = 12334 – 610,6 = 11723,4 Па.
119
Задачи
Для 623-625. Вычислите изотонический коэффициент и кажущуюся степень диссоциации, если осмотическое давление 0,05 М водного раствора соли при 30 оС составляет:
623. CuSO4, Pосм = 182,6 кПа;
(Отв. 1,45; 45 %)
AlCl3, Pосм = 3,74 атм.
(Отв. 3,01; 67 %)
624. Na2SO4, Pосм = 292,2 кПа;
(Отв. 2,32; 66 %)
KCl Pосм = 2,34 атм.
(Отв. 1,88; 88 %)
625. AgNO3, Pосм = 229,2 кПа;
(Отв. 1,02; 82 %)
K3PO4, Pосм = 4,11 атм.
(Отв. 3,31; 77 %)
626. Рассчитайте при 25 оС осмотическое давление воды Азовского моря
(плотность 1,014 г/см3) состава (мас. %): 1,36 NaCl; 0,04 KCl; 0,14 MgCl2; 0,12 MgSO4.
(Отв. 14,24 атм)
Для 627-631. Не производя вычислений, на основании оценки природы, данных о степени и константе диссоциации в водных растворах веществ расположите последние в порядке, соответствующем возрастанию осмотического давления их 0,5 М растворов.
627.Ba(OH)2 —С2Н5ОН —NaOH —CrCl3 —HF —CH3COOH.
628.CS2 —CuSO4 —(NH4)2HPO4 —K2SO4 —HCN —H2SO3.
629.CO(NH2)2 —Ni(NO3)2 —H2S —NH4OH —KOH —Al2(SO4)3.
630.С12Н22О11 —BaCl2 —MgSO4 —KAl(SO4)2 —H3PO4 — HCN.
631.CH2O —K2HPO4 —HF —KH2PO4 —K3PO4 —H3BO3.
Для 632-634. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли, если понижение температуры замерзания и повышение температуры кипения раствора указанного состава составляют:
632. |
1 моль NaCl в 1100 г Н2О, |
tзам = -2,79 оС; |
tкип = + 0,78 оС. |
|
|
|
|
|
(Отв. 1,65; 65 %) |
633. |
0,2 |
моль K2SO4 в 950 г Н2О, |
tзам = -0,88 оС; |
tкип = + 0,25 оС. |
|
|
|
|
(Отв. 2,26; 63 %) |
634. |
0,5 |
моль NH4Cl в 425 г Н2О, |
tзам = -3,96 оС; |
tкип = + 1,10 оС. |
|
|
|
|
(Отв. 1,01; 81 %) |
635. Вычислите кажущуюся степень диссоциации Na2CrO4, если |
||||
температура замерзания его 1,35 н. водного |
раствора (плотность |
|||
1,091 г/см3) равна минус 2,1 оС. |
|
|
||
(Отв. 32,1 %)
120
