
onch_posobie
.pdf273.Приведите электронные конфигурации атомов кислорода и се-
ры, хрома и молибдена. Почему в основном состоянии хром и молибден имеют электронные конфигурации (n-1)d5ns1, а не (n-1)d4ns2 ? Как меняется устойчивость высшей степени окисления у элементов основных и побочных подгрупп сверху вниз?
274.Почему в основном состоянии медь, серебро и золото имеют электронные конфигурации (n-1)d10ns1, а не (n-1)d9ns2 ? Какие степени окисления проявляют атомы данных элементов в своих соединениях?
275.Относительная электроотрицательность атомов элементов N, F, O, C составляет 3,5; 3,0; 2,5; 4,0. Атому какого элемента соответствует значение электроотрицательности 2,5?
276.Составьте электронную конфигурацию иона железа, содержа-
щегося в соединении Fe2(SO4)3. Сколько электронов содержится в последнем электронном слое этого иона?
277.Энергия ионизации атомов (эВ) элементов P, Si, Cl, Al составляет 10,48; 13,01; 5,98; 8,14. Атому какого элемента соответствует значение энергии ионизации 8,14 эВ?
278.Энергии отрыва электронов (эВ) от атома Al имеют значения 28,44; 5,98; 119,96; 18,82. Отрыву какого по счету электрона соответствует энергия ионизации 28,44 эВ?
5.ТЕОРИЯ ХИМИЧЕСКОЙ СВЯЗИ
Взависимости от характера распределения электронной плотности в веществе различают три основных типа химической связи: ковалентную, ионную и металлическую.
Связь, образующаяся в результате обобщения электронных плотностей взаимодействующих атомов, получила название ковалентной.
5.1. Метод валентных связей
Основное положение метода валентных связей (ВС): каждая пара атомов в молекуле удерживается вместе одной или несколькими общими электронными парами.
В представлении метода ВС ковалентная химическая связь локализована между двумя атомами, то есть она двухцентровая и двухэлектронная.
Механизм образования ковалентной связи, когда каждый из двух взаимодействующих атомов выделяет для образования общей электронной пары по одному электрону, называется обменным.
61

Под валентностью химического элемента понимается его способность к образованию химических связей. В представлении метода ВС численное значение валентности соответствует числу ковалентных связей, которые образует атом.
В образовании ковалентных связей принимают участие все неспаренные электроны атома. В ряде случаев число неспаренных электронов увеличивается в результате возбуждения атома, при котором двухэлектронные облака распадаются на одноэлектронные. В этом случае говорят о возбужденном состоянии атома элемента Э . Разделение парных электронов (расспаривание) возможно лишь в тех случаях, когда затрата энергии компенсируется энергией, выделяемой при образовании связей.
Пример 1. Объяснить механизм образования молекулы GaH3. Решение. Для объяснения факта образования молекулы GaH3 прихо-
дится предположить расспаривание электронов на 4s-орбитали и переход атома Ga в возбужденное состояние Ga .
31Ga 1s22s22p63s23p63d104s24p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4p |
|
||
|
|
4s |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
31Ga 1s22s22p63s23p63d104s14p2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
4p |
|
||||
|
|
4s |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Наличие у этой частицы трех неспаренных электронов обеспечивает образование трех ковалентных связей с тремя атомами водорода.
1H 1s1 |
|
|
|
|
|
|
|
|
|
1s |
|
|
|
|
|
||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ga + 3 H H – Ga |
|
|
|
|
|
|||
|
|
|
|
|
||||
|
|
|
4p |
|||||
|
|
|
|
4s |
|
|
||
|
|
|
|
|
|
|||
|
|
H |
|
|
|
|
||
|
|
|
|
|
|
|
||
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и свободной орбитали другого называется донорноакцепторным. По указанному механизму возникает ковалентная связь, например, при образовании комплексного иона GaH4- в результате взаимо-
действия молекулы GaH3 |
с гидрид-ионом: |
|
|
|
|
|
|
|
|||||
H |
H |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H – Ga + |
|
H |
H – Ga – H |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
4p |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
4s |
||||
H |
H |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|||||||
62

У атома Ga в молекуле GaH3 есть свободная 4р-орбиталь. У гидридиона (Н-) имеются два электрона с антипараллельными спинами на 1sорбитали. При сближении этих двух частиц двухэлектронное облако гидридиона становится общим, то есть возникает четвертая ковалентная связь.
Поскольку электронные облака имеют различную форму, их взаимное перекрывание может осуществляться различными способами. В зависимости от способа перекрывания и симметрии образующегося облака различают -, - и -связи: -связи образуются при перекрывании облаков вдоль линии соединения атомов; -связи формируются при перекрывании электронных облаков по обе стороны от линии соединения атомов; -связи обязаны перекрыванию всех четырех лопастей d-электронных облаков, расположенных в параллельных плоскостях.
Экспериментально установлено, что, несмотря на различие форм исходных электронных облаков, связи, образованные с их участием, оказываются равноценными и расположенными симметрично. Согласно представлению о гибридизации валентных орбиталей химические связи формируют электроны смешанных, так называемых гибридных, орбиталей. Гибридные орбитали получаются путем смешения атомных орбиталей. При гибридизации образуются орбитали новой, одинаковой формы и одинаковой энергии. Гибридная орбиталь имеет большую вытянутость по одну сторону от ядра, чем по другую и, следовательно, способна к большему перекрыванию с орбиталью соседнего атома. Химическая связь, образуемая с участием гибридных орбиталей, является более прочной. Число образуемых гибридных орбиталей равно числу исходных.
Связь между атомами разных элементов всегда более или менее полярна. Это обусловливается различием размеров атомов и их электроотрицательностей. Например, в молекуле HCl связующее электронное облако смещено в сторону более электроотрицательного атома хлора. Атом водорода в HCl поляризован положительно, а атом хлора отрицательно. Связь между атомами ковалентная полярная.
В зависимости от характера распределения электронной плотности молекулы могут быть полярными и неполярными. Полярные молекулы являются диполями. Расстояние между центрами тяжести положительного (+q) и отрицательного (-q) зарядов называется длиной диполя . Полярность молекулы так же, как и полярность связи, оценивают величиной ее
электрического дипольного момента |
(ч. 3, табл. 6), Кл м: |
= q . |
(5.1) |
Иногда измеряют в Дебаях. 1D = 0,33 10-29 Кл м. Значения кова- |
|
лентных молекул лежат в пределах 0 |
4D, ионных – 4 ÷ 12D (ч. 3, табл. 6). |
63

У всех молекул с симметричным расположением атомов (CCl4, BCl3, CO2 и др.) центры тяжести положительных и отрицательных зарядов совпадают. Поэтому все они являются неполярными ( = 0), хотя каждая химическая связь может быть в этом случае полярной. Двухатомные молекулы, состоящие из одинаковых атомов (F2, O2), также являются неполярными. Примером полярных молекул с ковалентными связями могут служить молекулы NH3, H2O, электрические дипольные моменты которых равны 1,46 и 1,86D, соответственно. Электрические дипольные моменты молекул с ионной связью LiH, KCl, CsI равны 5,88, 11,05 и 12,1D, соответственно.
Полярность связи качественно можно оценить разностью ОЭО образующих ее атомов (ч. 3, табл. 23). Считается, что если разность ОЭО атомов больше 2, то связь близка к ионной. Если ОЭО находится в диапазоне от 2 до 0,4, то связь ковалентная полярная. И если ОЭО меньше 0,4, связь близка к чисто ковалентной.
Пример 2. Дайте характеристику химической связи в ионе GaH4- и укажите для каждой из связей направление смещения общей электронной пары. Каковы валентность центрального атома, тип гибридизации его орбиталей и предполагаемая структурная форма частицы? Обладает ли она дипольным электрическим моментом?
Решение. Механизм образования этой частицы рассмотрен выше. Поскольку электроотрицательность галлия и водорода различна (ч. 3, табл. 23) и у галлия она меньше, чем у водорода, то связь ковалентная полярная, и у каждой из четырех связей общая электронная пара смещена к атому водорода. Таким образом, каждая связь обладает дипольным моментом. Валентность галлия в этой частице равна четырем. В образовании связей задействованы одна 4s- и три 4р-орбитали атома галлия. При этом химические связи образованы не этими исходными, а сформированными на их основе четырьмя гибридными орбиталями. Тип гибридизации – sp3. При такой гибридизации гибридные орбитали направлены к вершинам правильного тетраэдра и задают форму частицы. Поэтому ион GaH4- имеет форму правильного тетраэдра, в центре которого размещен атом Ga, а в вершинах  атомы водорода. Дипольный электрический момент этого иона равен нулю, что может быть подтверждено следующими соображениями. Каждая из четырех связей полярна (разность ОЭО водорода и галлия равна 0,5) и может быть представлена вектором. Все векторы одинаковой величины, и угол между ними приблизительно 109 28 . Легко рассчитать, что сумма проекций любых трех векторов на линию действия четвертого вектора равна ему по величине и противоположна по направлению. А, значит, сумма всех четырех векторов равна нулю.
атомы водорода. Дипольный электрический момент этого иона равен нулю, что может быть подтверждено следующими соображениями. Каждая из четырех связей полярна (разность ОЭО водорода и галлия равна 0,5) и может быть представлена вектором. Все векторы одинаковой величины, и угол между ними приблизительно 109 28 . Легко рассчитать, что сумма проекций любых трех векторов на линию действия четвертого вектора равна ему по величине и противоположна по направлению. А, значит, сумма всех четырех векторов равна нулю.
У иона GaH4- все восемь электронов, занимающие в атоме Ga гибридные sp3-орбитали, участвуют в образовании ковалентных связей Ga – H. Это обуславливает симметричное распределение электронных облаков по отношению к ядру атома галлия. В случае, если на гибридных орбита-
64

лях центрального атома размещаются несвязывающие (неподеленные) электронные пары, например, в молекуле NH3 – одна, а в H2O – две, они не образуют связей и принадлежат только центральному атому. Вся их электронная плотность сосредоточена вблизи центрального атома в отличие от связывающих электронных пар. Поэтому они более объемные и занимают больше места в окрестностях этого атома. Занимая больше места, они расталкивают связывающие электронные пары. В результате валентные углы в молекулах NH3 и H2O, например, составляют: HNH = 107,3 и HОH = = 104,5
и HОH = = 104,5 вместо предсказываемого sp3 гибридизацией орбиталей угла 109,5 . В ч. 3, табл. 13 схематически представлены пространственная конфигурация молекул и размещение в них несвязывающих электронных пар.
вместо предсказываемого sp3 гибридизацией орбиталей угла 109,5 . В ч. 3, табл. 13 схематически представлены пространственная конфигурация молекул и размещение в них несвязывающих электронных пар.
Центр электрического заряда неподеленной электронной пары, находящейся на гибридной орбитали, не совпадает с положением атомного ядра. Такое смещение заряда приводит к появлению электрического дипольного момента, вносящего существенный вклад в суммарный дипольный момент молекулы. Из этого следует, что полярность молекулы зависит не только от полярности отдельных связей и их взаимного расположения, но и от наличия неподеленных электронных пар на гибридных орбиталях, и от пространственного расположения этих орбиталей. Именно поэтому, молекула NH3 является полярной (ч. 3, табл. 6).
Пример 3. Объясните механизм образования иона [AlF6]3-. Каковы валентность центрального атома, тип гибридизации его орбиталей и предполагаемая структурная форма частицы? Обладает ли она электрическим дипольным моментом?
Решение. Образование комплексного иона можно описать уравнением
Al3+ + 6F- = [AlF6]3-.
Алюминий находится в 3-м периоде периодической системы. У него заполняется 3-й квантовый слой, включающий 3s-, 3p- и 3d-орбитали. Электронная конфигурация иона Al3+ 1s22s22p6, у него свободны все орбитали 3-го квантового слоя.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3+ |
2 |
2 |
6 |
|
|
|
|
|
|
|
3d |
||
|
|
|
|
|
|
|||||||||
Al |
|
1s 2s 2p |
|
|
|
|
3p |
|
|
|
|
|
||
|
|
3s |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Валентные электроны ионов F- размещены на 2s- и 2p-орбиталях.
|
|
|
|
|
|
F- 1s22s22p6 |
|
|
|
|
|
|
|
|
2p |
||
|
2s |
|
|
||
|
|
|
|
|
|
Для образования 6 одинаковых ковалентных связей с 6 ионами фтора 3s-, три 3p- и две 3d-орбитали иона Al3+ участвуют в sp3d2 гибридизации и
65

формируют 6 гибридных орбиталей q, направленных к вершинам правильного октаэдра (см. ч. 3, табл. 13). Каждый из шести ионов F- по донорноакцепторному механизму образует с ионом Al3+ ковалентную связь, предоставляя для этого по двухэлектронному облаку:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Al3+ + 6F- = [AlF6]3- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d |
||||||||
|
|
|
||||||||||
|
3p |
|
|
|||||||||
|
3s |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
F– |
|
|
|
|
|
|
|
|
||
|
F– |
|
|
|
F– |
|
|
|
|
|
|
|
|
Al |
|
|
|
|
|
|
|
||||
|
F– |
|
|
F– |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
F–
Таким образом, валентность алюминия в этом соединении равна шести. Каждая из 6 ковалентных связей полярная (ОЭОF = 4,10, а ОЭОAl = = 1,47 (ч. 3, табл. 23)) и может быть представлена вектором. Все векторы одинаковой величины, направлены от Al3+ к F--ионам, угол между ними 90 . Сумма этих 6 векторов равна нулю и, следовательно, электрический дипольный момент комплексного иона [AlF6]3- равен нулю.
По мере развития метода валентных связей выяснилось, что в некоторых случаях любая из возможных для данных молекулы или иона валентных схем плохо согласуется с установленными на опыте свойствами этого соединения. В подобных случаях структуру такой молекулы или иона можно выразить набором из нескольких валентных схем. Такой способ описания получил название метода наложения валентных схем. Он связан с отступлением от основополагающего положения метода ВС о двухцентровой и двухэлектронной химической связи. При таком способе описания возникает представление о многоцентровых связях или делокализован-
ной -связи.
Пример 4. Представьте графические формулы и дайте характеристику химических связей в молекуле угольной кислоты H2CO3 и карбонат ионе CO32- . Объясните плоское строение молекулы H2CO3.
Решение. Графическая формула угольной кислоты:
H – O
C = O
H – O 
66

Всего в молекуле 6 ковалентных связей, образование которых происходит по обменному механизму. Невозбужденный атом углерода имеет два неспаренных электрона, а в возбужденном состоянии – четыре:
|
|
|
|
|
|
|
|
|
|
|
|
6С 1s22s22p2 |
|
|
|
|
|
6С 1s22s12p3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2p |
|||
|
|
|
2p |
|
|
||||||
|
|
|
|
|
2s |
|
|
||||
|
2s |
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Три невозбужденных атома кислорода имеют по два неспаренных электрона и за счет них в молекуле H2CO3 образуют по две ковалентных связи:
|
|
|
|
|
|
|
|
1 |
|
2 |
2 |
4 |
|
|
|
|
|
1H 1s |
|
8О 1s 2s 2p |
|
|
|
|
|
|
|
|
|
|
|
|
|
2p |
|
|
|||
|
|
|
|
|
1s |
||||
|
|
|
2s |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Два кислорода образуют связи с водородом и углеродом, связывая при этом по одному неспаренному электрону того и другого. Третий кислород образует две связи с углеродом, связывая оставшиеся два неспаренных электрона углерода в возбужденном состоянии.
Молекула угольной кислоты имеет плоское строение за счет sp2- гибридизации орбиталей атома углерода. Гибридные орбитали, лежащие в плоскости под углом 120 , образуют три -связи с p-орбиталями трех атомов кислорода. Четвертый неспаренный электрон атома С находится на pz-орбитали, перпендикулярной к плоскости, задаваемой -связями. У третьего атома кислорода неспаренный электрон также находится на pz-орбитали, что и позволяет ему образовать -связь с электроном атома С . Поскольку перекрывание pz-орбиталей происходит одновременно выше и ниже плоскости, заданной -связями, то -связь стабилизирует плоскостное строение молекулы H2CO3.
находится на pz-орбитали, перпендикулярной к плоскости, задаваемой -связями. У третьего атома кислорода неспаренный электрон также находится на pz-орбитали, что и позволяет ему образовать -связь с электроном атома С . Поскольку перекрывание pz-орбиталей происходит одновременно выше и ниже плоскости, заданной -связями, то -связь стабилизирует плоскостное строение молекулы H2CO3.
После диссоциации молекулы угольной кислоты образуется CO32- ион. Валентное насыщение двух атомов кислорода достигается за счет присоединения каждым из них электрона после разрыва H – O связей и отщепления от молекулы двух ионов H+. Валентное насыщение третьего атома кислорода, как и в молекуле H2CO3, достигается за счет образования
-связи. Соответственно, строение такого иона изображают графической формулой
– |
|
]2 |
– |
[ –OO |
C = O |
, |
недостатком которой является локализация -связи и обусловленная этим кажущаяся неравноценность связей C – O, что противоречит эксперименту. Поэтому в подправленной за счет метода наложения валентных схем
|
|
67 |
|
[ –O |
C = O ]2– |
[ O |
C — O– ]2– |

теории ВС строение аниона CO32- изображается не одной схемой, а набором из трех равноценных:
Равноценность всех связей свидетельствует о делокализации -связи ( -электронного облака) и отрицательного заряда на все атомы кислорода. Тогда можно обойтись одной схемой с изображением делокализованного
-электронного облака в виде пунктира:
[ О  C
C 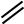 O ]2–
O ]2–
O
Пример 5. Представьте графическую формулу для молекулы хлористой кислоты HClO2. Используя данные относительной электроотрицательности атомов, дайте характеристику каждой из связей. Какие из связей характеризуются большей степенью ионности? Каков характер диссоциации молекулы в водном растворе и какова предполагаемая геометрическая форма аниона молекулы в растворе?
Решение. Графическая формула: H – O – Cl O .
O .
Невозбужденный атом кислорода имеет два неспаренных электрона, за счет которых образует две связи: с атомами водорода и хлора, у каждого из которых имеется по одному неспаренному электрону.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8О 1s22s22p4 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
2p |
|||||||||
|
|
|
2s |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1H 1s1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s |
|
|
|
|
|
|
|
|
|
|
|
||
17Cl 1s22s22p63s23p5 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
3p |
||||||
|
|
|
|
|
|
3s |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Второй атом кислорода переходит в возбужденное состояние, в результате чего у него появляется свободная 2р-орбиталь.
|
|
|
|
|
|
8О 1s22s22p4 |
|
|
|
|
|
|
|
|
2p |
||
|
2s |
|
|
||
|
68 |
|
|||
|
|
|
|||

При образовании связи с атомом хлора по донорно-акцепторному механизму этот кислород выступает в качестве акцептора. Атом хлора за счет одной из имеющихся у него трех электронных пар является донором.
3s- и 3р-орбитали атома хлора, по-видимому, находятся в состоянии sp3-гибридизации. Две из четырех гибридных орбиталей задействованы в образовании связей с атомами кислорода, а две другие занимают неподеленные электронные пары.
ОЭО атомов H, Cl и О равны 2,1; 3,0 и 3,5, соответственно (ч. 3, табл. 23). Следовательно, все три связи в молекуле хлористой кислоты являются ковалентными полярными. При этом связь водорода с кислородом является наиболее полярной (имеет наибольшую степень ионности), поскольку разность ОЭО этих атомов больше, чем разность ОЭО кислорода и хлора. Уравнение диссоциации хлористой кислоты:
HClO2 = H+ + ClO2-.
В связи с sp3-гибридизацией орбиталей атома хлора атомы кислорода хлорит аниона занимают две вершины недостроенного тетраэдра, остальные две вершины остаются при этом вакантными, и к ним направлены гибридные орбитали, содержащие неподеленные пары электронов хлора.
В ряду анионов ClO- – ClO2- – ClO3- – ClO4- по мере увеличения степени окисления хлора устойчивость анионов возрастает. Это можно объяснить тем, что при переходе от ClO- к ClO4- увеличивается число электронов, принимающих участие в образовании связей. Особо устойчив ион ClO4-, в котором все валентные электроны атома хлора принимают участие в образовании связей:
Задачи
Для 279-306. Используя основные положения метода ВС, объясните механизм образования молекулы (иона). Дайте характеристику химической связи и укажите для каждой из связей направление смещения общей электронной пары. Каковы валентность центрального атома, тип гибридизации его орбиталей и предполагаемая структурная форма частицы? Обладает ли она дипольным электрическим моментом?
Частицы |
Частицы |
69

279. |
SF6 |
и |
H2O |
293. |
PI3 |
и |
H2Se |
280. |
NCI3 |
и |
PF6- |
294. |
BF3 |
и |
H2Te |
281. |
F2O |
и |
ClF3 |
295. |
SF4 |
и |
[S2]2- |
282. |
H2S |
и |
CH4 |
296. |
NH3 |
и |
[O2]2- |
283. |
PH3 |
и SnF62- |
297. |
AsH3 |
и |
ClO- |
|
284. |
SiF62- и CO2 |
298. |
H2Se |
и |
ClO2- |
||
285. |
H2Te и SO2 |
299. |
AsI3 |
и |
SO32- |
||
286. |
PF3 |
и |
SO3 |
300. |
MgF2 |
и |
N2O |
287. |
ZnBr2 и BeF2 |
301. |
NF3 |
и |
HCN |
||
288. |
BeF2 |
и |
NOCl |
302. |
BF4- |
и CO32- |
|
289. |
BH3 |
и |
COCl2 |
303. |
AlF3 |
и |
NO3- |
290. |
CF4 |
и |
BrCl3 |
304. |
NH4+ |
и |
ClO3- |
291. |
ClO4- |
и |
AlBr3 |
305. |
CN- |
и |
SnBr4 |
292. |
PCl4+ |
и |
TeF6 |
306. |
SOF2 |
и |
O3 |
Для 307-344. Для заданной молекулы представьте графическую формулу. Укажите, между какими атомами образуются - и -связи. Используя данные относительной элетроотрицательности атомов, дайте характеристику каждой из связей. Какие из связей характеризуются большей степенью ионности? Каков характер диссоциации молекулы в водном растворе и какова предполагаемая геометрическая форма аниона молекулы в растворе?
|
Молекула |
|
Молекула |
|
Молекула |
307. |
H2SO3 |
320. |
(MgOH)2CO3 |
333. |
(CH3COO)2Cu |
308. |
H2SO4 |
321. |
HPO3 |
334. |
Ca(HCO3)2 |
309. |
HNO3 |
322. |
Al(OH)3 |
335. |
KClO2 |
310. |
H3PO4 |
323. |
NaNO2 |
336. |
ZnOHNO3 |
311. |
H3BO3 |
324. |
HCOOH |
337. |
NaHSiO3 |
312. |
HBO2 |
325. |
NaHCO3 |
338. |
K2CrO4 |
313. |
NaHSO3 |
326. |
Al2(SO4)3 |
339. |
CrHPO4 |
314. |
NaH2PO4 |
327. |
HNO2 |
340. |
Na2ZnO2 |
315. |
Na2HPO4 |
328. |
HClO4 |
341. |
CrOHSO4 |
316. |
NaBO2 |
329. |
Pb(NO3)2 |
342. |
HClO |
317. |
NaHSO4 |
330. |
Na2SiO3 |
343. |
KAlO2 |
318. |
Ca(OH)2 |
331. |
HСlO3 |
344. |
Cu3(PO4)2 |
319. |
NH4OH |
332. |
AlOHSO4 |
|
|
5.2. Метод молекулярных орбиталей
Основные положения метода молекулярных орбиталей следующие. 1. Каждому электрону в молекуле соответствует некоторая волновая
функция , которую называют молекулярной орбиталью (МО). Эти орбитали в отличие от одноцентровых атомных орбиталей (АО) являются многоцентровыми.
2. Каждая волновая функция характеризуется квантовыми числами, от которых зависят ее форма и энергия соответствующего уровня.
70
