
onch_posobie
.pdf
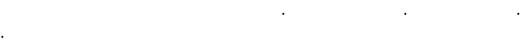


984. а) Na(т) + Н2(г) |
… |
985. |
а) Ca(т) |
+ Н2(г) |
… |
б) Na(т) + Сl2(г) |
… |
|
б) Ca(т) |
+ N2(г) |
… |
в) Na(т) + Si(т) |
… |
|
в) Ca(т) |
+ O2(г) |
… |
г) Na(т) + S(т) |
… |
|
г) Ca(т) |
+ C(т) |
… |
986. a) Li(т) + O2(г) |
… |
987. а) Ba(т) |
+ Н2(г) |
… |
|
б) K(т) + O2(г) |
… |
|
б) Ba(т) |
+ N2(г) |
… |
в) Na(т) + O2(г) |
… |
|
в) Ba(т) + S(т) |
… |
|
г) Rb(т) + O2(г) |
… |
|
г) Ba(т) |
+ C(т) |
… |
988. a) Be(т) + O2(г) |
… |
989. а) Mg(т) + O2(г) |
… |
||
б) Be(т) + C(т) |
… |
|
б) Ca(т) + O2(г) |
… |
|
в) Be(т) + S(т) |
… |
|
в) Sr(т) |
+ O2(г) |
… |
г) Be(т) + Сl2(г) |
… |
|
г) Ba(т) + O2(г) |
… |
|
Для 990-995. Используя значения |
Hо |
или Gо образования предло- |
|||
женных соединений (ч. 3, табл. 15) сделайте вывод об изменении устойчивости (прочности связи) в группе. Каково отношение этих соединений к действию воды?
990. Оксиды s-элементов I и II групп. 991. Гидриды s-элементов I и II групп. 992. Сульфиды s-элементов I и II групп. 993. Пероксиды s-элементов I и II групп.
994.Фториды s-элементов II группы.
995.Гидроксиды s-элементов I и II групп; их кислотно-основные свойства и растворимость.
Для 996-1000. Напишите в молекулярной и ионной формах реакции, лежащие в основе получения …
996.кальцинированной соды по методу Сольве:
NH3 |
NH4HCO3 |
NaHCO3 |
|
Na2CO3. |
|
||
997. жидкого стекла и кремнегеля: |
|
|
|
||||
NaCl |
NaOH |
Na2SiO3 |
SiO2 H2O. |
|
|||
998. каустической соды карбонатным методом: |
|||||||
NaCl |
NaHCO3 |
Na2CO3 |
NaOH. |
|
|||
999. каустической соды ферритным методом: |
|
||||||
NaCl |
NaHCO3 |
Na2CO3 |
NaFeO2 |
NaOH. |
|||
1000. металлического натрия: |
|
|
|
|
|||
NaHCO3 |
Na2CO3 NaCl |
Na. |
|
||||
Для 1001-1004. Напишите в молекулярной и ионной формах реакции, |
|||||||
лежащие в основе следующих превращений: |
|
||||||
1001. (NH4)2[BeF4] |
BeF2 |
Be |
Be2C CH4. |
||||
1002. BeF2 |
|
Be Na2[Be(OH)4] |
|
BeSO4 |
Na2[Be(SO4)2]. |
||
1003. BaO |
|
Ba Ba(NO3)2 |
BaO |
BaO2 |
O2 . |
||
1004. CaCO3 |
CaO |
CaCl2 |
Ca |
CaC2 |
C2H2 . |
||
|
|
|
|
195 |
|
|
|






 + 2NaCl + 2HCl.
+ 2NaCl + 2HCl.