
onch_posobie
.pdf
1061. Какой из минералов алюминия можно использовать непосредственно для его получения? Каким методом?
1062. Получение галлия, индия и таллия.
1063. Электрохимический метод получения алюминия.
1064. Дайте описание метода получения алюминия из его минерала нефелина.
1065. Дайте описание метода получения бора из его минерала тетрабората натрия (буры).
1066. В чем сущность алюмотермии? Какие металлы можно получать этим методом?
Задачи по теме «Физико-химические свойства простых веществ»
1067. На основании электронного строения атомов p-элементов III группы и изменения энергии ионизации атомов и ионов соответствующих элементов объясните изменение в ряду B–Al–Ga–In–Tl металлических свойств простых веществ. Как изменяется их устойчивая степень окисления, чем это объясняется (приведите примеры)?
1068. На основании электронного строения атомов р-элементов III группы объясните изменение в ряду B–Al–Ga–In–Tl энергии ионизации, радиусов атомов и ионов соответствующих элементов, их степеней окисления. Подтвердите примерами.
1069. Объясните, почему в ряду B-Al-Ga-In-Tl энергии ионизации и радиусы атомов изменяются не так закономерно, как в ряду щелочных металлов.
1070. Чем можно объяснить резкое различие в свойствах при переходе от бора к алюминию? Есть ли сходство в химических свойствах этих элементов? Если есть, то в чем оно выражается?
Для 1071-1078. Закончите реакции, характеризущие отношение р- элементов к простым окислителям. Дайте характеристику образующихся продуктов; реагируют ли получаемые продукты с водой, кислотами (разбавленными и концентрированными) и щелочами.
1071. а) B(т) + O2(г)
б) Al(т) + N2(г)
в) B(т) + F2(г)
г) Tl(т) + O2(г)
1072. а) B(т) + N2(г)
б) Tl(т) + Сl2(г)
в) B(т) + S(т)
г) Ga(т) + O2(г)
…1073. a) Ga(т)
… |
б) B(т) |
… |
в) Tl(т) |
… |
г) Al(т) |
…1074 а) Ga(т)
… |
б) Al(т) |
… |
в) B(т) |
… |
г) B(т) |
+O2(г)
+Сl2(г)
+S(т)
+S(т)
+As(т)
+O2(г)
+C(т)
+I2(г)
…
…
…
…
…
…
…
…
211

1075. |
а) Al(т) |
+ Cl2(г) |
… |
1077. |
a) Tl(т) |
|
б) Al(т) |
+ F2(г) |
… |
|
б) Ga(т) |
|
в) Ga(т) + Cl2(г) |
… |
|
в) In(т) |
|
|
г) Ga(т) + F2(г) |
… |
|
г) In(т) |
|
1076. |
а) B(т) |
+ Mg(т) |
… |
1078. |
a) Ga(т) |
|
б) Al(т) |
+ C(т) |
… |
|
б) Tl(т) |
|
в) B(т) |
+ Br2(г) |
… |
|
в) In(т) |
|
г) Ga(т) + S(т) |
… |
|
г) Al(т) |
|
+F2(г)
+Sb(т)
+O2(г)
+As(т)
+C(т)
+N2(г)
+Сl2(г)
+Br2(г)
…
…
…
…
Для 1079-1083. Напишите соответствующие уравнения реакций взаимодействия c водой, кислотами и щелочами (полуреакции, ионные и молекулярные уравнения) … .
1079. бора и галлия.
1080. алюминия и индия.
1081. галлия и таллия.
1082. индия и бора.
1083. таллия и алюминия.
1084. Как перевести бор в водорастворимые соединения?
1085. В чем заключается сходство химических свойств бора и кремния? В каких соединениях это сходство проявляется наиболее полно и чем это объясняется?
1086. Почему алюминий, несмотря на его высокую химическую активность, устойчив на воздухе? Как доказать активность алюминия?
1087. Почему алюминий растворяется в концентрированных растворах хлорида аммония и карбоната натрия? Приведите уравнения соответствующих реакций.
1088. Какая маса бора потребуется для получения 19,4 г кремния восстановлением его диоксида?
(Отв. 10 г)
1089. Какую массу алюминия можно окислить 1 л 0,111 н. раствора дихромата калия?
(Отв. 1 г)
1090. Какая масса индия потребуется для получения 14,8 г индата натрия NaInO2 при его окислительном сплавлении со щелочью?
(Отв. 10 г)
1091. Особо чистый алюминий получают по реакции: Al(ж) + AlF3(г) 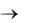 AlF(г). Какая масса технического алюминия с (Al) = 95,5 % потребуется
AlF(г). Какая масса технического алюминия с (Al) = 95,5 % потребуется
для получения 2,44 кг AlF?
(Отв. 1 кг)
1092. Используя термодинамические данные (ч. 3, табл. 15), опреде-
лите тепловой эффект реакций: а) 8В(т) + 3Fe3O4(т) = 4B2O3(т)+ 9Fe(т);
б) 2Al(т) + Fe2O3(т) = Al2O3(т) + 2 Fe(т).
212

1093. Используя термодинамические данные (ч. 3, табл. 15), определите возможность протекания предложенных реакций в стандартных условиях:
а) В2О3(т)
б) 3CO2(г)
в) Cr2O3(т)
+ 2Al(т) = Al2O3(т)
+ 4Al(т) |
= |
2Al2O3(т) |
+ 2Al(т) |
= |
Al2O3(т) |
+2B(т),
+3C(т),
+2Cr(т).
1094. Вычислите, сколько граммов технического алюминия, содержащего 5 % неметаллических примесей, необходимо взять в реакции с раствором HCl для получения 1500 л водорода? (Отв. 1269 г)
Задачи по теме «Важнейшие соединения: свойства, получение и применение»
Для 1095-1099. Используя метод ВС, рассмотрите образование химических связей в соединениях. Определите тип гибридизации, координационное число и степень окисления центрального атома, а также предполагаемое пространственное строение предложенных соединений:
1095. BF3, BH3 и BH4-. 1096. BF3 H2O и BF3 NH3.
1097. BО33- и BF4-.
1098. Na[BF4] и Na3[AlF6]. 1099. BСl3 и H[BF4].
Для 1100-1106. Дайте характеристику указанных соединений. Используя значения Hо или Gо образования (ч. 3, табл. 15), сделайте вывод об изменении в группе устойчивости (прочности связи), кислотноосновных свойств и химической активности соединений (отношение к кислотам, щелочам, воде). Ответы подтвердите соответствующими уравнениями реакций. Укажите основные области применения соединений:
1100. Гидриды бора.
1101. Оксиды Э2О3 бора и алюминия. 1102. Оксиды Э2О3 подгруппы галлия.
1103. Гидроксиды Э(НО)3 р-элементов III группы. 1104. Гидроксиды Э(НО)3 подгруппы галлия. 1105. Галогениды ЭГ3 бора и алюминия.
1106. Галогениды ЭГ3 подгруппы галлия.
1107. Из сравнения значений Hо или Gо образования фторидов бора и алюминия сделайте вывод о прочности связи В-F и Al-F. Дайте краткую сравнительную характеристику соединений по их отношению к галогенидам щелочных металлов и воде.
1108. Сравните значения Hо или Gо образования (ч. 3, табл 15) оксидов, фторидов, хлоридов, нитридов алюминия и бора. Сделайте вывод об их химической активности. Каково отношение этих соединений к воде. Приведите соответствующие уравнения реакций.
213

1109. Почему в водных растворах нельзя получить сульфид и карбонат алюминия? Ответ подтвердите уравнениями реакций.
1110. Почему свойства соединений Tl(I) напоминают свойства соединений щелочных металлов? Чем можно объяснить устойчивость соединений таллия со степенью окисления +1?
1111. Сульфиды каких 3p-элементов могут быть получены в растворе, а каких нет? Ответ обоснуйте, написав уравнения реакций.
1112. Исходя из значений стандартных электродных потенциалов (ч. 3, табл. 21), определите, может ли Tl2(SO4)3 окислить HCl, HBr, HI, H2O2, H2S. Составьте уравнения возможных реакций.
1113. Напишите уравнения гидролиза солей BF3 и BCl3. С чем связано различное отношение этих соединений к воде?
1114. Почему оксид В2О3 легко растворяется в HF и не растворяется в HCl?
1115. Что происходит при нагревании ортоборной кислоты? Напишите уравнения соответствующих реакций.
1116. Что происходит при нейтрализации ортоборной кислоты раствором гидроксида натрия? Соль какой кислоты образуется при этом?
1117. Сколько литров раствора Na2CO3 |
с = 20 % ( = 1,21 г/см3) |
нужно затратить на взаимодействие с H3BO3 |
для получения 43,5 кг буры |
Na2B4O7 10H2O?
1118. Какой объем и какого газа (н.у.) можно собрать при обработке 4,5г диборана В2Н6 водой ?
(Отв. 22,4 л)
1119. Сколько литров газообразного диборана (н.у.) потребуется для
получения 14,1 кг B2O3?
(Отв. 4,5 м3)
1120. Термическому разложению подвергнуты 57 мл диборана (н.у.). Какая масса бора при этом получена?
(Отв. 0,056 г)
1121. Вычислите рН 0,1 М водного раствора H3BO3.
(Отв. 4,6 )
1122. Вычислите теплоту образования В2О3, если при взаимодействии 100 г бора с кислородом выделилось 5824,96 кДж теплоты.
1123. Какую массу Na2B4O7 10Н2О можно получить перекристаллизацией 200 г этой соли, охлаждая раствор от 60 до 10 оС? Растворимость безводной соли при 60 оС составляет 16,65 %, при 10 оС – 1,76 %.
1124. Какую массу KAl(SO4)2 12Н2О можно получить перекристаллизацией из 2 кг насыщенного раствора при охлаждении его от 90 до 0 оС, если растворимость при этих температурах равна 109 г и 3 г, соответственно, в пересчете на безводную соль?
(Отв. 1,9 кг)
214

1125. Растворимость иодида таллия(I) при 20 оС равна 6 10-3 г на 100 г воды. Вычислите ПР этой соли.
(Отв. 3.3 10-8)
Для 1126-1129. Напишите в молекулярной и ионной формах реакции,
лежащие в основе следующих превращений: |
|
|
|
|
||||||
1126. B B2O3 |
HBO2 |
H3BO3 |
H2B4O7 |
HBO2 |
B2O3. |
|||||
1127. B |
B2O3 |
HBO2 |
|
H3BO3 |
Na2B4O7 NaBO2. |
|
||||
1128. Al2O3 |
Al |
|
AlCl3 |
AlOHCl2 |
K[Al(OH)4(H2O)2]. |
|||||
1129. Al |
Al2(SO4)3 |
Al(OH)SO4 |
Al(OH)3 |
Na[Al(OH)4]. |
|
|||||
Для 1130-1137. Составьте электронно-ионные и молекулярные урав- |
||||||||||
нения реакций: |
|
|
|
|
|
|
|
|
|
|
1130. Na2B4O7 + Н2О2 + NaOH |
… 1134. BF3 + K2CO3 + H2O |
… |
||||||||
K3[Al(OH)6] + CO2 |
|
… |
|
TlCl + NaOCl |
… |
|
||||
1131. B + Н2О + KOH |
… |
1135. B2S3 |
+ Na2S |
… |
|
|||||
Al + K2Cr2O7 + H2SO4 |
|
… |
|
Ga + KOH + H2O |
… |
|||||
1132. B2O3 + CaF2 + H2SO4 |
… |
1136. Tl2SO4 + KOH + Br2 |
… |
|||||||
Al + KNO3 + KOH |
|
… |
|
Al(NO3)3 + NH4OH ( изб.) … |
||||||
1133. B2O3 |
+ C + Cl2 |
… |
|
1137. Ga + NаOH + H2O |
… |
|||||
Ga + K2Cr2O7 + H2SO4 |
|
… |
|
AlN + HCl |
… |
|
||||
14. р-ЭЛЕМЕНТЫ IV ГРУППЫ
Углерод, кремний и элементы подгруппы германия – германий, олово и свинец составляют IVA группу таблицы Д.И. Менделеева.
Элeктронное строение атомов: С – [He]2s22p2; Si – [Ne]3s23p2; Ge – [Ar]3d104s24p2; Sn – [Kr]4d105s25p2; Pb – [Xe]4f145d106s26p2.
Конфигурация внешнего уровня атомов группы в основном состоянии – ns2np2; в возбуждённом – ns1npx1pу1pz1. У углерода – число валентных орбиталей и электронов одинаково; такое состояние имеет ещё один элемент периодической системы – водород. Углерод, как и все р-элементы II периода, не имеет d-орбиталей, что сказывается на его донорноакцепторных свойствах.
Углерод и кремний – неметаллы; в ряду Ge – Sn – Pb металлические свойства усиливаются и свинец – уже типичный металл.
Углерод существует в четырёх аллотропных модификациях: алмаз, графит, карбин ( -карбин) и поликумулен ( -карбин). Недавно открыта еще одна модификация (1980 г.), которая возможно будет названа «фуллерены». Из последних наиболее изучены фуллерены С60, образованные пяти- и шестичленными циклами (футбольный мяч); известны также С70 и С85. Фуллерены щелочных металлов обладают сверхпроводимостью. У кремния существуют две модификации – алмазо- и графитоподобная; для германия характерна алмазоподобная решетка. Олово существует в двух
215

полиморфных модификациях: α – Sn (серое олово) и β – Sn (белое олово). У серого олова кристаллическая структура аналогична структуре алмаза (кубическая гранецентрированная решетка) и устойчива при температуре ниже 13,2 0С; белое олово имеет тетраэдрическую структуру. При температуре 13,2 0С обе модификации находятся в равновесии, а при температурах ниже указанной β – Sn переходит в α – Sn, а так как структуры и плотности (см. ниже) их разные, то оловянные изделия разрушаются. Это явление получило название «оловянная чума». Свинец – голубовато-белый мягкий металл.
Степени окисления элементов изменяются от минус 4 до +4, причём в группе сверху вниз наблюдается уменьшение устойчивости четырёхвалентного состояния и увеличение устойчивости двухвалентного (эффект инертной пары). Изменяется и характер химической связи: образование ковалентных связей характерно для всех четырёхвалентных элементов, у олова(II) степень ионности связи увеличивается, а соединения свинца(II) – преимущественно ионные. Углерод и кремний не образуют отдельно существующих отрицательных ионов Эn- вследствие малого сродства их атомов к электрону; не образуют они и отдельно существующих положительных ионов Эn+, так как значения энергии ионизации у них велики.
Некоторые свойства р-элементов IV группы приведены в табл. 14.1 (см. также ч. 3, табл. 7 – 10, 14, 21):
Таблица 14.1
Свойства p-элементов IV группы
|
|
Элемент |
C |
Si |
|
Ge |
Sn |
|
Pb |
Содержание в зем- |
0,1 |
27,6 |
|
1,5 10-4 |
8.10-3 |
|
1,6.10-3 |
||
ной коре, масс. % |
|
|
|
|
|
|
|
||
Плотность, г/см3 |
3,513 (ал.) |
2,329 |
|
5,323 |
7,310 ( |
) |
11,350 |
||
|
|
|
2,260 (гр.) |
|
|
|
5,750 ( |
) |
|
Zион / r2ион |
100 |
26,3 |
|
20,7 |
8,9 |
|
6,9 |
||
ОЭО (по Полингу) |
2,50 |
1,74 |
|
2,02 |
1,72 |
|
1,55 |
||
o |
2+ |
о |
- |
- |
|
-0,247 |
-0,136 |
|
-0,126 |
E Э |
|
/ Э , В |
|
|
|||||
o |
4+ |
2+ |
- |
- |
|
0 |
0,15 |
|
1,69 |
E Э |
|
/ Э , В |
|
|
|||||
|
|
|
Степень окисления |
|
|
|
|
||
|
|
-4 |
CH4 |
SiH4 |
|
Mg2Ge |
Mg2Sn |
|
PbH4 |
|
|
+2 |
CO |
- |
|
GeF2 |
SnCl2 |
|
PbO |
|
|
+3 |
C2N2 |
- |
|
- |
- |
|
- |
|
|
+4 |
CO2 |
SiO2 |
|
GeO2 |
SnCl4 |
|
PbO2 |
|
|
|
Hо298 связи, кДж/моль |
|
|
|
|||
|
|
Э – Э |
348 |
226 |
|
163 |
195 ( ) |
|
100 |
|
|
Э – О |
358 |
452 |
|
363 |
- |
|
- |
|
|
Э О |
745 |
640 |
|
- |
- |
|
- |
|
|
Э – Н |
411 |
326 |
|
288 |
251 |
|
180 |
|
|
Э – С |
- |
301 |
|
237 |
225 |
|
130 |
216

Углерод является важнейшей составной частью живой природы, минералов, природных углей, нефти, газа, торфа. Значительная часть углерода земной коры приходится на карбонатные минералы: доломит –
MgCO3 CaCO3, кальцит – CaCO3, магнезит – MgCO3, сидерит – FeCO3 и
др. В свободном состоянии углерод встречается в виде алмаза и графита. К элементарному графиту по составу приближаются богатые (до 98 %, мас. С) ископаемые угли – антрациты. Кремний – второй по распространенности (после кислорода) элемент земной коры. Он встречается в природе в виде кремнезема SiO2, а также входит в состав силикатных (фор-
стерит – Mg2SiO4, асбест – Mg3Si2O7 2H2O, тальк – Mg3H2(SiO3)4 и др.)
2H2O, тальк – Mg3H2(SiO3)4 и др.)
и алюмосиликатных (альбит – полевой шпат – NaAl[Si3O8], ортоклаз –
KAl[Si3O8], каолин – Al2O3 2SiO2 2H2O и др.) пород. Германий, олово и свинец – малораспространённые элементы; основная масса германия рассеяна в виде примеси в других минералах: силикатах, сульфидах и др. Известны такие минералы германия как аргеродит – 4Ag2S GeS2 и германит – 3CuS FeS 2GeS2. Олово встречается в виде минерала касситерита – SnO2,
свинец – геленита – PbS, церуссита – PbCO3 , крокоита – PbCrO4 и др.
Методы получения простых веществ
В промышленности освоены методы получения искусственных алмаза и графита: при получении искусственных алмазов исходное сырьё (графит, «сажа» и др.) подвергают в присутствии катализатора действию высоких температур (выше 1200 оС) и давлений (до 5 ГПа); искусственный графит получают в виде кокса, доменного графита и графита из углеводородного сырья (пирографит) путём термической обработки ископаемого сырья антрацита, различных углеводородов при температурах 1000…2500 оС.
Кремний в виде черного аморфного продукта в промышленных условиях получают восстановлением кварцевого песка углём:
SiO2 + 2C = Si + 2CO,
а кремний для полупроводниковой техники – восстановлением его оксида или галогенида магнием, цинком, водородом, а также разложением иодида и гидрида кремния (силана):
SiO2 + 2Zn = Si + 2ZnO,
SiCl4 + 2H2 = Si + 4HCl,
SiI4 = Si + 2I2, SiH4 = Si + 2H2.
Германий получают восстановлением диоксида германия – продукта переработки отходов, главным образом руд цветных металлов и коксохимического производства, водородом:
GeO2 + 2H2 = Ge + 2H2О.
217
Кремний и германий для полупроводниковой техники дополнительно очищают методом зонной плавки, основанным на различной растворимости примесей в твёрдой и жидкой фазах продукта; примеси более растворимы в жидкой фазе и концентрируются в расплавленной зоне.
Олово извлекают из минерала касситерита пирометаллургическим методом, восстанавливая его углём:
SnO2 + 2C = Sn + 2CO.
Получение свинца включает стадии обжига его сульфидных руд и восстановления обазующегося оксида свинца(II) углём или CO:
2PbS + 3O2 = 2PbO + 2SO2, PbO + C = Pb + CO,
PbO + CO = Pb + CO2.
Применение алмаза и графита разнообразно: режущий (абразивный) материал, различные углеграфитовые материалы (электроды, тигли, волокна и др.), кокс для выплавки стали, сажа – продукт неполного сжигания различных органических веществ (пигмент, наполнитель для резины и др.), активированные угли в качестве адсорбентов и много другое.
Высокочистый кремний как полупроводниковый материал применяется в электронике и электротехнике; технический продукт – для производства различных сплавов. Как легирующая добавка он повышает прочность и коррозионную стойкость сталей; сплавы алюминия с кремнием – силумины, обладают повышенной прочностью.
Германий является важнейшим полупроводниковым материалом (изготовление транзисторов, фотоэлементов, кристаллических детекторов и др.); используется он при получении специальных сплавов с золотом, медью и стекол для инфракрасной оптики. Основная масса производимого олова расходуется на изготовление антикоррозионной белой жести – листовой стали, покрытой оловом (лужение стали); олово входит в состав многих сплавов, например, с медью (бронзы), с сурьмой и медью (антифрикционные материалы), со свинцом (различные припои). Свинец используется для изготовления пластин аккумуляторов, химической аппаратуры, а таже в производстве кабелей, средств защиты от радиации и т. д. Свинец входит и в состав многих сплавов (сплавы для подшипников).
Отношение к простым окислителям
С водородом C, Si, Ge, Sn и Pb в обычных условиях непосредственно не взаимодействуют. При темтературах же 600…1000 оС графит взаимодействует с образованием химически инертного метана СН4 , а олово и свинец образуют SnH4 и PbH4, соответственно. Метан при температуре выше 10000 разлагается:
2СН4 = С2Н2 + 3Н2.
218

Гидриды кремния и германия, получают косвенным путем, например, разложением силицидов и германидов магния:
Mg2Э + 2H2SO4 = ЭH4 + 2MgSO4.
Силан – кремниевый аналог метана; бесцветный газ, нерастворимый в воде (хотя в присутствии щелочи в ней растворяется). Смесь его с кислородом взрывается, в то время как СН4 в реакцию с О2 вступает только при нагре-
вании. В ряду SiH4(силан) – GeH4(герман) – SnH4(станнан) – PbH4 (плюм-
бан) устойчивость гидридов уменьшается; большинство из них термически неустойчивы (см. выше), на воздухе самовоспламеняются, а водой разлагаются с выделением водорода, например:
SiH4 |
+ 2О2 = SiО2 |
+ 2H2О, |
SiH4 |
+ (x +2)H2О = |
4H2 + SiО2 xH2О. |
Известны гидриды гомологического ряда ЭnH2n +2; высший представитель
силанов – Si8H18, германов – Ge3H8, а станнанов – Sn2H6.
Для кремния известны галогенсиланы, например, SiH3Cl – трихлорсилан, гидратация которого приводит к образованию силанола – аналога метанола:
SiH3Cl + H2О = SiH3ОН + НСl,
а его последующая поликонденсация – к образованию высокомолекулярных пoлиядерных соединений, так называемых силиконов. Последние широко используются при производстве средств личной гигиены (шампуни, зубные пасты, косметика и др.):
R |
R |
R |
| |
| |
| |
– Si – O – Si – O – Si – O – |
||
| |
| |
| |
R |
R |
R |
С кислородом все элементы взаимодействуют лишь при нагревании, образуя: углерод – оксиды СО и СО2, кремний – SiО2, германий – GeO и GeO2, олово – SnO2 и свинец – PbO; оксиды кремния SiО и олова SnO, а также диоксид свинца PbO2 получают косвенным путем. Оксиды СО и СО2 при нормальных условиях – газы без цвета и запаха; остальные – твердые вещества.
Газообразный СО практически не растворим в воде, очень ядовитый газ; он связывается с ионом железа гемоглобина в крови прочнее, чем кислород и тем самым препятствует поступлению кислорода в организм. Для СО характерны реакции окисления и присоединения, например:
СО + 2Н2 = СН3ОН,
СО + NaOH = HCOONa.
219

Способность СО образовывать прочные координационные связи с переходными металлами используется для получения такого класса соединений, как карбонилы Mx(CO)y – комплексные соединения, в которых металл выполняет роль комплесообразователя, а СО – лиганда, поставляющего пару электронов для образования донорно-акцепторной связи. В промышленности СО получают газификацией твердого топлива с последующей очисткой газа от СО2 обрабокой его, например, водным раствором гидроксида бария (см. разд. 12.3).
Диоксид углерода – кислотный оксид; при взаимодействии с водой имеет место равновесие:
СО2(г) + Н2О(ж) |
Н2СО3(р) |
Н+(р) + НСО3-(р) |
2Н+(р)+ СО32-(р). |
Угольную кислоту выделить в свободном состоянии не представляется возможным, поэтому её нужно считать как раствор СО2 в воде. Н2СО3 – слабая двухосновная кислота (см. ч. 3, табл. 17). Соли угольной кислоты – гидрокарбонаты и карбонаты, наоборот, устойчивы и имеют широкое применение (см. разд. 12.2).
Кремний также образует два оксида: SiО и SiО2. Монооксид SiО может быть получен при 1350…1500 0С с последующим быстрым охлаждением продуктов реакции:
SiО2 + С = SiО + СО;
при медленном же охлаждении SiО диспропорционирует:
2SiО = SiО2 + Si.
Диоксид SiО2 существует и встречается в природе в кристаллическом (кварц, тридимит, кристобалит) и аморфном (опал, трепел, диатоммит и др.) состояниях, причем наиболее термодинамически устойчив (0С) α – кварц:
α –кварц |
575 |
β –кварц |
870 |
β –тридимит |
1475 |
β –кристобалит |
|
|
|
1723 расплав SiО2
Во всех модификациях структурным элементом является кремнекислородный тетраэдр, в центре которого находится атом Si, а в вершинах – атом О, но пространственное расположение [SiO4] различно.
Химическая активность SiО2 возрастает от кварца к кристобалиту. Диоксид кремния в воде практически не растворим; устойчив он и к действию кислот, за исключением фтороводородной. При сплавлении с карбонатом натрия при температуре ≥ 1500 0С диоксид кремния образует растворимые в щелочной среде силикаты, например:
SiО2 + Na2СO3 = 2Na2O SiО2 + СО2.
SiО2 + СО2.
При взаимодействии SiО2 с фтороводородной кислотой: SiО2 + 4HF = SiF4 + 2H2O
220
