
- •Глава1.
- •Частьii.Собственныеисследования
- •Глава2. Материалыиметоды…………………………………………502.1.Общаяхарактеристикабольных……………………………………………50
- •Глава3.Результатыисследования………………………………...74
- •Глава4.Обсуждениеполученныхрезультатов…………. 221
- •Списоксокращений
- •Введение Актуальностьпроблемы
- •Научнаяновизнаисследования
- •Практическаязначимость
- •Основныеположения,выносимыеназащиту
- •Внедрениерезультатов работывпрактическоездравоохранение
- •Апробацияработы
- •ГлаваI обзорлитературы
- •ЭтиологияипатогенезИап
- •Классификация,клиническиеособенности иап
- •Пузырчаткавульгарная(Pemphigusvulgaris)
- •Пузырчаткалистовидная(эксфолиативная) /Pemphigusfoliaceus/
- •Паранеопластическаяпузырчатка(Paraneoplasticpemphigus)
- •1.5.1Общиепредставленияомолекулярной фармакологииСгк
- •СтроениеГр:
- •ИзоформыГр:
- •ЛечениебольныхИап
- •АдьювантнаятерапиябольныхИап
- •Азатиоприн
- •ЦиклоспоринA
- •Метотрексат
- •МофетилМикофенолат
- •Циклофосфамид
- •Никотинамидитетрациклин
- •Соли золота
- •Внутривенный иммуноглобулин
- •Пиридостигминабромид
- •Стероиднаярезистентность
- •Механизмы стероидной резистентности на рецепторномуровне
- •Механизмыстероиднойрезистентностинапострецепторномуровне
- •ЧастьIi.Собственныеисследования
- •Глава2.Материалыиметодыисследования
- •Общаяхарактеристикабольных
- •Характеристика больных иап, находившихся поднепосредственнымнаблюдением
- •ИзучениекатамнестическихданныхбольныхИап
- •2.1.3. Изучение клинических данных больных для определениямолекулярныхмеханизмовстероиднойрезистентности
- •МужчиныЖенщины
- •В%соотношении
- •Оборудование
- •Изучениехарактерасвязываниясмембраннымирецепторамипо
- •Исследование связывания меченого сгк внутриклеточными
- •Полимеразно-цепнаяреакцияврежимереальноговремени
- •Описаниеметода:
- •Исследование молекулярных механизмов стероиднойрезистентности напострецепторномуровне
- •Реактивы
- •Оборудование
- •Приготовлениереактивов
- •Полимеразно-цепнаяреакция
- •Определениефакторанекрозаопухолиα (tnf-α)
- •Радиоизотопныйметод
- •Постановкарадиоизотопногометода
- •Жидкостнаясцинтилляционнаярадиометрия
- •Статистическаяобработкарезультатовисследования
- •Глава3.Результатыисследования
- •Ретроспективный анализисторийболезнибольныхИап
- •Общая характеристикаклиническихданныхбольныхИап
- •Количествобольныхв%соотношении
- •% Отр. 52 Положит. 48 46
- •КоличествоСр(-)больныхИап в%соотношении
- •Нетадювантнойтерапии
- •Такимобразом:
- •3.1.2. ХарактеристикастероидчувствительныхбольныхИап
- •КоличествоСр(-)больныхИаПв %соотношении 60%
- •КоличествоСр(-)больныхИап в%соотношении
- •% Отр. 58 Положит. 42 0
- •КоличествоСр(-)больных иаПв%соотношении 80%
- •КоличествоСр(-)больныхИаПв %соотношении 100%
- •Такимобразом:
- •3.1.3.ХарактеристикастероидрезистентныхбольныхИап
- •%Соотношении
- •В%соотношении
- •Онкология
- •Такимобразом:
- •КоличествобольныхИаПв% соотношении 60%
- •КоличествобольныхИаПв% соотношении 100%
- •КоличествобольныхИаПв% соотношении
- •КоличествоСр(-)больныхИаПв %соотношении 80%
- •Такимобразом:
- •Молекулярныемеханизмыстероиднойрезистентностинарецепторномуровнеубольныхистиннойакантолитическойпузырчаткой
- •ИзучениеуровняэкспрессиимРнКα-иβ-изоформглюкокортикоидныхрецепторовустероидрезистентныхистероидчувствительныхбольныхИап
- •Бетарецептор альфарецептор
- •3.2.2АнализклиническихданныхбольныхИаПприизменениинауровнеα-иβ-изоформглюкокортикоидныхрецепторов
- •3.2.3.Изучениеколичествамембранныхивнутриклеточныхрецепторовустероидрезистентныхистероидчувствительныхбольных
- •10*3/Клетку
- •10*3/Клетку
- •3.2.4АнализклиническихданныхбольныхИаПприизменениимембранныхивнутриклеточныхрецепторов
- •МолекулярныемеханизмыстероиднойрезистентностинапострецепторномуровнеубольныхИап
- •ИзучениевключениямеченогоуридинавРнКлимфоцитовпериферическойкровиустероидрезистентныхистероидчувствительныхбольныхИап
- •Количествовключенногоуридинав
- •Значимыйпоказатель
- •АнализклиническихданныхбольныхИаПприизменениивключения ³н-уридина
- •3.4.РазработкалечениябольныхИаПазатиоприномпристероиднойрезистентности
- •3.4.1Клиническиеданныеприпримененииазатиоприна
- •MaxдозаСгк
- •2 Раза
- •ДинамикакожныхвысыпанийубольныхИаПприлеченииазатиоприномвсочетаниисСгк
- •Осложнения,возникшиеустероидрезистентныхбольныхИаПприлеченииазатиоприномвсочетаниисСгк
- •ИзучениеэкспрессиигенаNf-kBустероидрезистентныхистероидчувствительныхбольныхИаПиеединамикинафонетерапииазатиоприном
- •ЭкспрессиягенаNFkB относительногеновэкспрессииGapdhв% 90
- •Интервалзначений
- •ЭкспрессиягенаNFkB относительногеновэкспрессии
- •Интервалзначений
- •ЭкспрессиягенаNf-kBотносительно экспрессиигеновGapdhв% 90
- •АнализклиническихданныхстероидрезистентныхбольныхИап приизмененииэкспрессиигенаNf-kBнафонетерапииазатиоприном
- •Определениефакторанекрозаопухолиα(tnf-α)убольныхИап
- •Клиническиепримеры больныхИап
- •Патологоанатомический диагноз.Комбинированноеосновноезаболевание.
- •Проведены обследования:
- •60 Преднизолона
- •Преднизолон Метипред
- •Длительностьприемапрепарата
- •Былпроведенонкопоиск:
- •Заключительный клинический диагноз:
- •Глава4.Обсуждение полученных результатов
- •Практическиерекомендации
- •Библиография
Оборудование
СистемаопределенияПЦРврежимереальноговремени«iCyclerIQ5»(«Bio-Rad»,CША),
Жидкостной сцинтилляционный анализатор «Tri-Carb 3110 TR»(«PerkinElmer»,США),
Центрифуга сбакет-ротором«5804R» («Eppendorf», Германия),
Ареометрспределамиизмеренийот1.060г/см³до1.090г/см³«ASTM120H» («Amarell», Германия),
КамераГоряева(«ОООМинимед», Россия),
Микроскоп«СХ31»,(«Olympus», Япония),
Ламинарный бокс («Ламинарные системы», Россия, классбиологическойбезопасностиIIтипА),
Термостатдляпробироктипа«Эппендорф»от25до100°С«Гном»(«ДНК-Технология»,Россия),
Центрифуга типа«Vortex»«MicrospinFV-2400» («Biosan», Россия),
Микроцентрифугадляпробироктипа«Эппендорф»до16тысячg(«Eppendorf», Германия),
Сцинтилляционныефлаконы(«GreinerBio-One», Австрия).
Изучениехарактерасвязываниясмембраннымирецепторамипо
стандартнойметодике
Выделениелимфоцитов
Упациентовпроводилсязаборпериферическойкровиизлоктевой
вены.
0,2млсуспензииклеток(10-20106клеток/мл)инкубировалипри40Свтечение1часавприсутствии14С-ПВП-преднизолона.Данныйполимерныйаналогстероиданепроникаетвнутрьклеткиисвязываетсятолькосмембраннымиструктурами.Концентрациявсредеинкубациисоставляла2,510-6М.Дляопределениянеспецифическогосвязываниявпробы(дубли)с14С-ПВП-ГКвносили1000-кратныйизбытокнемеченогосвободногогормонапреднизолона.ДалеесодержимоепробпереносилинафильтрыGF/C"Whatman"идваждыотмывали5млHEPES-буфера(t=4C).Послевысушиванияфильтрыпомещаливсцинтилляционныефлаконыдля
последующейрадиометрии.
Количествоспецифическихместсвязываниянаплазматическоймембранеопределялисучетомэффективностисчета(50-60%)иудельнойрадиоактивности(5Ci/ммоль)14С-ПВП-аналогов.Специфическоесвязываниевычисляликакразницумеждуколичествомсвязанныхклетками
полимероввотсутствиинемеченыхгормонов(общеесвязывание)иколичеством14С-ПВП-аналогов,связанныхклеткамивприсутствии1000-кратногоизбытканемеченыхсвободныхгормонов(неспецифическое
связывание).
Исследование связывания меченого сгк внутриклеточными
рецепторамипометодикеLippman
0,2млсуспензииклеток(10-20106клеток/мл)инкубироваливтечениечасапри40Свприсутствии3Н-преднизолона(конечнаяконцентрация20нМ):безпрепарата(контроль)ивприсутствии100-кратногоизбытканемеченогоаналогагормона.Анализсодержаниявнутриклеточных
рецепторовпроводилипометодикеLippman(1978).Ксуспензииклетокдобавлялидигитонинвконечнойконцентрации50мкМ,которыйвызывалразрушениемембраны.Дляопределенияцитоплазматическогосвязывания
3Н-гормонаотбиралиаликвоты(20мкл)суспензииклетокипереносилиихв
пробирки,содержащие100 мкл1,5мМMgCl2врастворедекстран-покрытогоугля,тщательноперемешивалииоставлялина15минут.Далеепробыцентрифугировали(15000g,10мин)исупернатант радиометрировали.
Результаты,получаливколичествевспышеквсекунду(измеренияпроводилисьпотриплексам),которыепереводиливколичествоместсвязываниясучетомудельнойрадиоактивностиметкииэффективностисчетаприбора.
Полимеразно-цепнаяреакцияврежимереальноговремени
Дляопределенияα-иβ-изоформГРиспользовалиметодПЦРврежимереальноговремени.
Описаниеметода:
ВыделениеРНК.
ТотальнуюРНКэкстрагировалиизклетоксиспользованиемкомплектареагентовдлявыделенияРНК/ДНКизклиническогоматериала«Рибо-препвариант100» поинструкциипроизводителя:
«Раствордлялизиса»прогревалипри65ºСдополногорастворениякристаллов.
Встерильныеодноразовыепробиркивносиликлеточнуюсуспензию,центрифугировали3минпри3тыс.об/мин.Надосадочнуюжидкостьсливалиспомощьюмикропипетки.Добавляливпробиркипо300мкл
«Раствордлялизиса».
Содержимоепробирокперемешивалинацентрифугетипа«Vortex»ипрогревали5минпри65ºСвтермостате.
Впробиркидобавлялипо400мкл«Раствордляпреципетации»,перемешивалинацентрифугетипа«Vortex».
Центрифугировалипробиркинамикроцентрифуге5минпри13тыс.об/мин.
Аккуратноотбиралинадосадочнуюжидкость,незадеваяосадок,используяотдельныйнаконечникнамикропипеткудлякаждойпробы.
Добавляливпробиркипо500мкл«Раствордляотмывки3»,плотнозакрываликрышкииосторожнопромывалиосадок,переворачиваяпробирки3-5раз.
Центрифугировалипри13тыс.об/минвтечение2миннамикроцентрифуге.
Аккуратноотбиралинадосадочнуюжидкость,незадеваяосадок,используяотдельныйнаконечникнамикропипеткудлякаждойпробы.
Добавляливпробиркипо200мкл«Раствордляотмывки4»,плотнозакрываликрышкииосторожнопромывалиосадок,переворачиваяпробирки3-5раз.
Центрифугировалипри13тысячоборотов/минвтечение2миннамикроцентрифуге.
Осторожноотбиралинадосадочнуюжидкость,незадеваяосадок,используяотдельныйнаконечникна10мклдлякаждойпробы.
Помещалипробиркивтермостатпритемпературе65ºСна2миндляподсушиванияосадка(крышкипробирокдолжныбыть открыты).
Добавляливпробиркипо50мклРНК-буфера.Перемешивалинацентрифугетипа«Vortex».Помещаливтермостатпри65ºСна5мин,периодическивстряхиваянацентрифугетипа«Vortex».Центрифугировалипробиркипри13тысячоборотов/минвтечение1мин намикроцентрифуге.НадосадочнаяжидкостьсодержиточищенныеРНКиДНК(отбираливчистыемикропробирки).
Реакцияобратнойтранскрипции.
ДлявыделениякДНКисследуемыхгеновиспользовалислучайныегексонуклеотиды-праймеры(последовательностьиз6-титриплетовнуклеотидов).Таккак,гексонуклеотиды,неспецифическисвязываясьна
мРНК,нарабатываютнебольшие(короткие)перекрывающиесякДНКпрактическиповсейматрицемРНК,тоимиможноэффективноизучатьвсюпоследовательностьмРНК.
Отжиг(гибридизацию)праймеровпроводилипритемпературе70°Свтечение5минут,инкубируямРНКобразца(30мкл),эквимолярнуюсмесь4-хнуклеотидов(12мкл),праймеры-гексамеры(1,5мкл);доводиливодойобъемсмесидо75мкл.Наэтомэтапепраймеры«находят»комплементарныеучасткивисследуемойРНКигибридизуютсясними.Затемпроводилиреакцию обратнойтранскрипцииспомощьюнабора«РЕВЕРТА-L».
ВсоставнаборавходитRT-G-mix-1,RT-mix,ревертаза(MMLV),ДНК-буфер.
Порядокпостановкиреакции:
Приготовилиреакционнуюсмесьна12реакций.Дляэтоговпробиркус RT-mixвнесли5мклRT-G-mix-1,тщательноперемешалинацентрифугетипа«Vortex»,осадиликаплискрышкипробиркикратковременнымцентрифугированием.
Кполученномурастворудобавили6мклревертазы(MMLV),пипетировали5 раз,перемешатьнацентрифугетипа«Vortex».Осадиликапли скрышкипробиркикратковременнымцентрифугированием.
Внесливмикропробиркипо10мклготовойреакционнойсмеси.
Используянаконечниксаэрозольнымбарьером,добавилипо10мклРНК-пробывпробиркисреакционнойсмесью.Осторожноперемешалипипетированием.
Поставилипробиркивтермостатстемпературой37ºСна30минут.
ПолученнуювреакцииобратнойтранскрипциикДНКдляпоследующейпостановкиПЦРразвелив2разаДНК-буфером(к20мклкДНКотдельнымнаконечникомсаэрозольнымбарьеромдобавили20мклДНК-буфера, аккуратноперемешалипипетированием10раз).
РеакцияПЦР-РТ.
ДляпостановкиПЦР-РТиспользовали«НаборреактивовдляпроведенияПЦР-РТвприсутствииинтеркалирующегокрасителяSYBRGreenI»,содержащий:реакционнуюсмесь(ПЦРбуферВ-KCl,ТрисHCl(рН8,8),6,25мМMgCl2;TaqДНК-полимераза;дезоксинуклеозидфосфаты;глицерол,Tween20,интеркалирующийкрасительSYBRGreenI),25мМMgCl2,деионизированнуюводу.
Таблица7.РТ-ПЦРсупермиксна22пробы.
SYBRGreenI |
H20 |
MgCl2 |
220мкл |
165мкл |
33мкл |
Таблица8.Праймер-миксна22пробы.
-
Прямойпраймердетектируемого
гена
Обратныйпраймердетектируемого
гена
44мкл
44мкл
Таблица9.ПостановкаПЦР-РТ.
Количествопроб |
РТ-ПЦР супермикс |
Праймер-микс |
кДНК(полученнаяна2этапе) |
1проба (микропробирка) |
19мкл |
4мкл |
2мкл |
Вреакциииспользовалисьспецифическиепраймерыкэкзону1генаNR3C1:
ПрямойпраймерГРα:ATCACTTTCACTTCTGCTGG;ПрямойпраймерГРβ:GCCGGCACGCGACTCC;
ОбратныйпраймерГРα/ГРβ:CAGTGGATGCTGAACTCTTGG.
ДляпостановкиПЦР-РТиспользуютследующиеэкспериментальныепротоколы:
1.ПрограммадляамплификациикДНКГРα
ДенатурацияматричнойДНК–3мин.,94ºС
Денатурация–30сек.,94ºС
Отжигпраймеров–90сек.,60ºС
Элонгация–30сек.,72ºС
Финальнаяэлонгация–10мин.,72ºС
ПрограммадляамплификациикДНКГРβ
ДенатурацияматричнойДНК–3мин.,94ºС
 Денатурация–30сек.,94ºС
Денатурация–30сек.,94ºСОтжигпраймеров–30сек.,60ºС
Элонгация–30сек.,72ºС
Финальнаяэлонгация–10мин.,72ºС
 40циклов
40циклов
40циклов

ОценкасодержаниямРНКобразцовпроводиласьполуколичественнымметодом.Относительнаяконцентрациявычисляласькакотношениеуровняэкспрессииисследуемогогенакгену«домашнегохозяйства».ВданномэкспериментевкачестветакогогенавыступалGAPDH.СинтезмРНКгенов
«домашнегохозяйства»осуществляетсявклеткахпостоянно,иуровеньмРНКвсегдастабиленвразличныхтканях,дажепослеэкспериментальнойинкубациисразличнымиактивнымивеществами.
Прииспользованиивыбраннойметодикинеобходимоопределениефлуоресценциив«threshold»точке(crosspoint(CP))длякаждогогена.СРопределяетсякакточка,гдеподъемкривойфлуоресценцииампликоновисследуемогогеназначительновыше,чемфоновоесвечение.Количественнаяоценкавсегдаосуществляетсяв«экспоненциальную»фазу,таккакоценкавфазу«плато»считаетсянеэффективнойиз-занарастающегоистощениякомпонентовреакционнойсмеси.Даннаяточкахарактеризуетномерцикла,накоторомнакапливаетсяминимальноеколичествоспецифическогопродукта,уровеньфлуоресценциикотороговышефонового(рисунок12).
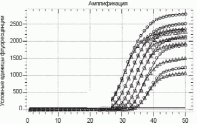
СP
 Порог
Порог
Рисунок12.Графическоепредставлениепроцессанакопленияампликонов.
Вычисленияконечныхзначенийпроизводилисьспомощью«дельта-метода»:находиласьразницамеждупороговымцикломисследуемогогенаигена«домашнегохозяйства»,такимобразомвычислялосьпроцентноесодержаниеисходноймРНКопытногообразцаотносительномРНКгена
«домашнегохозяйства».
