
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
1.7.3 Взаимная растворимость жидкостей
На растворимость жидкостей друг в друге, кроме природы жидкостей, большое влияние оказывает температура.
Рассмотрим наиболее часто встречающийся случай возрастания растворимости с повышением температуры (рисунок 1.8):
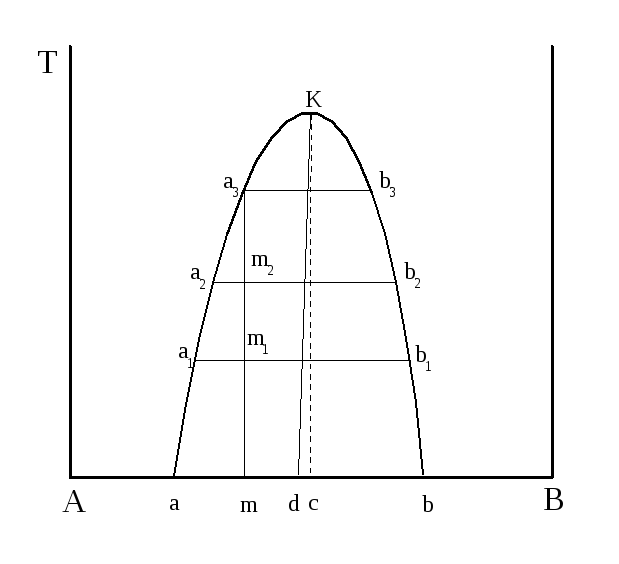
Рисунок 1.8 – Диаграмма взаимной растворимости двух жидкостей
Линия аК – линия растворимости В в А в зависимости от температуры. Линия bК – линия растворимости А в В. Область аКb – область равновесного существования двух жидких фаз, состав которых находится на линиях аК и bК. Точка К – верхняя критическая точка растворения. Возьмем систему, изображенную точкой «m». Она приготовлена путем смешения компонента А в количестве mВ и компонента В в количестве mА. Компоненты А и В растворяются ограниченно друг в друге и при смешении образуют два слоя: А в В (состава b) и В в А (состава а). Коннода аb принимается за 100 %, а отрезки аm и mb показывают относительное количество этих слоев, соответственно слоя «b» и слоя «а».
При повышении температуры взаимная растворимость компонентов увеличивается и составы равновесных жидких фаз изменяются: от точки «а» к «а1», «а2» и так далее до точки «а3» и от точки «b» к «b1», «b2», «b3». При этом количество фазы «b» (отрезок аm) постоянно уменьшается до а1m1, а2m2 и при температуре, отвечающей точке а3, исчезает совсем, система выходит из области расслаивания и становится гомогенной, то есть, компоненты А и В при более высоких температурах растворяются друг в друге неограниченно. Аналогично достигается гомогенность системы, взятой в интервале сb, здесь исчезает фаза «а». Иначе достигается гомогенность при нагревании системы «с», которая попадает в точку «К». Здесь слои не исчезают, а при нагревании их составы сближаются, в точке К оба слоя имеют одинаковый состав и поверхность раздела слоев исчезает.
Положение критической точки можно определить, применив правило В. Ф. Алексеева:
«Середины коннод ложатся на общую прямую, которая заканчивается в критической точке растворения» (прямая dk, рисунок 1.8).
Кроме рассмотренной системы с верхней критической точкой существуют такие, в которых на кривой растворимости имеется нижняя критическая точка (растворимость увеличивается с понижением температуры), и такие, в которых есть как верхняя, так и нижняя критические точки.
На растворимость двух жидкостей влияет добавление третьей жидкости. Этот вопрос подробно рассмотрен в методическом указании М. Ф. Стенникова, Н. Г. Комарова, А. В. Протопопов «Трехкомпонентные системы». – Барнаул : Изд-во АлтГТУ, 2005.- с.21-25.
1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
1.8.1 Неограниченно смешивающиеся жидкости
Равновесие жидкость – пар изображается в виде зависимости общего давления от состава жидкости и состава пара или температуры кипения от состава жидкости и пара.
1.8.1.1 Состав пара и жидкости. Законы Коновалова
Как уже рассматривалось, общее давление над идеальным раствором изменяется линейно (рисунок 1.2) с изменением состава жидкости. Состав пара отличается от состава равновесной с ним жидкости. Из закона Дальтона следует, что парциальные давления компонентов газовой смеси равны
![]() ,
следовательно:
,
следовательно:
![]() в
то время как
в
то время как![]() .
.
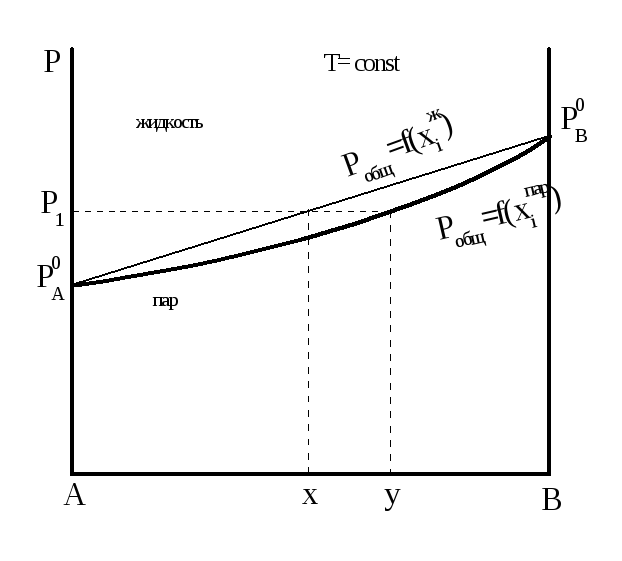
Рисунок1.9 -Зависимость общего давления от состава жидкости и пара
Эти две зависимости обычно изображают на одной диаграмме (рисунок 1.9). Линия жидкости и линия пара делят плоскость диаграммы на три фазовых поля. Верхнее поле - жидкая фаза, нижнее - пар, между этими полями - гетерогенная область находящихся в равновесии жидкости и пара. Например, при общем давлении Р1 находятся в равновесии две фазы: жидкость состава X и пар состава У.
Из рисунка 1.9 видно, что в идеальных системах пар, по сравнению с равновесной жидкостью, всегда обогащен более летучим компонентом, в данном случае компонентом В. В реальных же растворах не всегда паровая фаза обогащена более летучим компонентом.
Более общая зависимость состава пара от состава жидкости дается первым законом Д.П. Коновалова:
«В равновесной системе пар по сравнению с жидкостью обогащен тем компонентом, добавление которого повышает общее давление пара (или понижает температуру кипения раствора при постоянном давлении)».
Так в системе, изображенной на рисунке 1.9, добавление к раствору, например, компонента В, приводит к росту общего давления, следовательно, в паре будет содержаться компонента В больше, чем в жидкости. В системе же на рисунке 1.10 добавление В приводит к росту общего давления лишь до точки С (Сl), а дальнейшее добавление В снижает общее давление, следовательно, до точек С (Сl) пар обогащен компонентом В, а после этих точек - компонентом А.
Для систем с экстремумами на кривых Р =f(Х1ж) установлен второй закон Д. П. Коновалова:
«Экстремумы на кривых общего давления пара или температуры отвечают такому равновесию раствора и насыщенного пара, при котором составы обеих фаз одинаковы».
По второму закону Коновалова кривая пара и кривая жидкости, имеющие экстремумы, должны касаться в точке экстремума (рисунок 1.10).
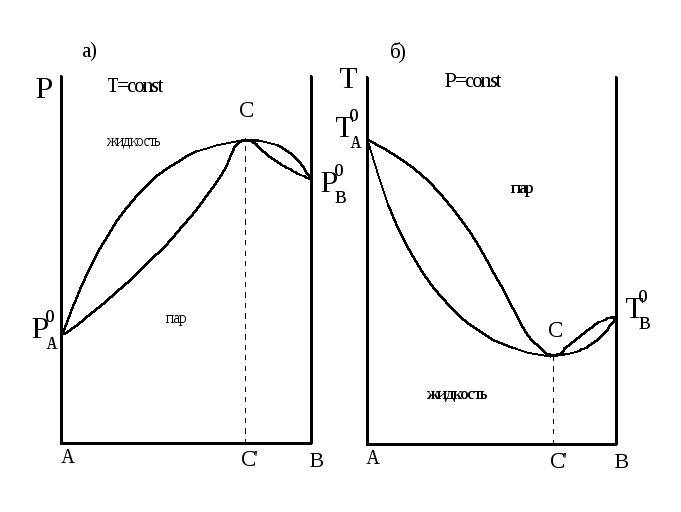
Рисунок 1.10 - Диаграммы общее давление - состав и температура кипения - состав для систем с экстремумом
На рисунке 1.10
изображены диаграммы в разных координатах:
а) давление от состава и б) температура
от состава для одной и той же системы.
Следует обратить внимание на то, что
давление насыщенного пара и температура
кипения находятся в обратной зависимости,
то есть, чем более летуч компонент (чем
выше его давление насыщенного пара),
тем ниже его температура кипения. И
наоборот, чем менее летуч компонент
(чем меньше его давление насыщенного
пара), тем выше его температура кипения,
что и отражено на рисунке 1.10. И, как
следствие, диаграмма с максимумом на
кривой
![]() (положительное отклонение от закона
Рауля) преображается в диаграмму с
минимумом на кривой
(положительное отклонение от закона
Рауля) преображается в диаграмму с
минимумом на кривой![]() .
.
Смеси, у которых
составы жидкости и равновесного с ней
пара совпадают, называются азеотропными.
Они кипят при постоянной температуре.
Соотношение между составом пара и
составом жидкости часто изображается
в координатах
![]() .
Диагональ
квадрата отвечает равному составу
жидкости и пара. Но даже для идеальных
систем составы жидкости и пара различны.
Если добавление В к раствору повышает
общее давление, то В в паре будет больше,
кривая 1 (рисунок 1.11) пойдет выше диагонали.
Если же пар содержит меньше В, чем
жидкость, то кривая 2 пойдет ниже. Системы
с азеотропом изображаются S-образной
кривой, пересекающей диагональ в точке,
отвечающей азеотропу (кривая 3).
.
Диагональ
квадрата отвечает равному составу
жидкости и пара. Но даже для идеальных
систем составы жидкости и пара различны.
Если добавление В к раствору повышает
общее давление, то В в паре будет больше,
кривая 1 (рисунок 1.11) пойдет выше диагонали.
Если же пар содержит меньше В, чем
жидкость, то кривая 2 пойдет ниже. Системы
с азеотропом изображаются S-образной
кривой, пересекающей диагональ в точке,
отвечающей азеотропу (кривая 3).
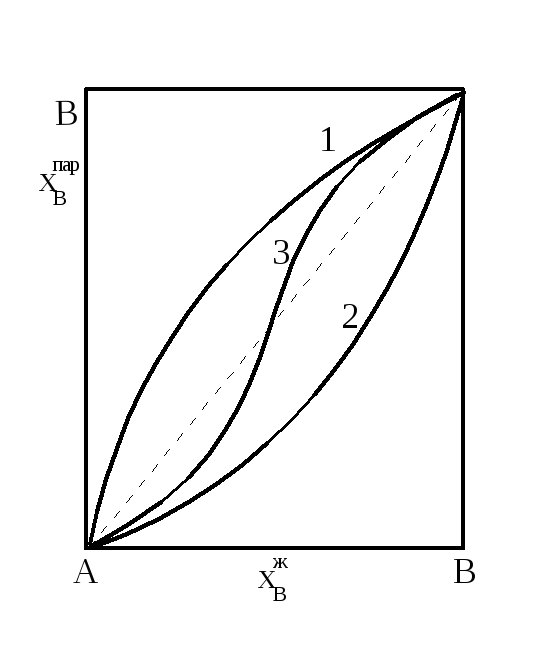
Рисунок 1.11 – Соотношение между составом жидкости и пара
