
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.4.3.1 Электролиз водного раствора CuCl2
а) с использованием медных анодов.
Пусть два медных электрода погружены в водный раствор CuCl2. На каждом электроде устанавливается равновесие при определенном скачке потенциала, определенном токе обмена, выражающем скорость перехода ионов меди в раствор, равную скорости их восстановления:
Cu
![]() Cu2+
+ 2e.
Cu2+
+ 2e.
Пока цепь электролизера разомкнута, тока нет и потенциалы обоих электродов одинаковы и равны φравн.
Кроме ионов Cu2+
и
![]() в
растворе есть ионыН+
и
в
растворе есть ионыН+
и
![]() .
Запишем реакции, которые принципиально
возможны на катоде и аноде.
.
Запишем реакции, которые принципиально
возможны на катоде и аноде.
На катоде: Cu2+ + 2e → Cu0
2Н+ + 2e → H2
На аноде: Cu0 - 2e → Cu2+
4![]() - 4e
→ O2
+ 2H2O
- 4e
→ O2
+ 2H2O
2![]() - 2e
→ Cl2
- 2e
→ Cl2
Изобразим схематически участки суммарных поляризационных кривых, отвечающих этим реакциям (рисунок 2.8). Примем во внимание, что реакции с участием Н+ и ОН- идут с большим перенапряжением (малой скоростью), кривые идут более полого, в отличие от других, идущих с большей крутизной. Относительное расположение φравн. отвечает нейтральному раствору.
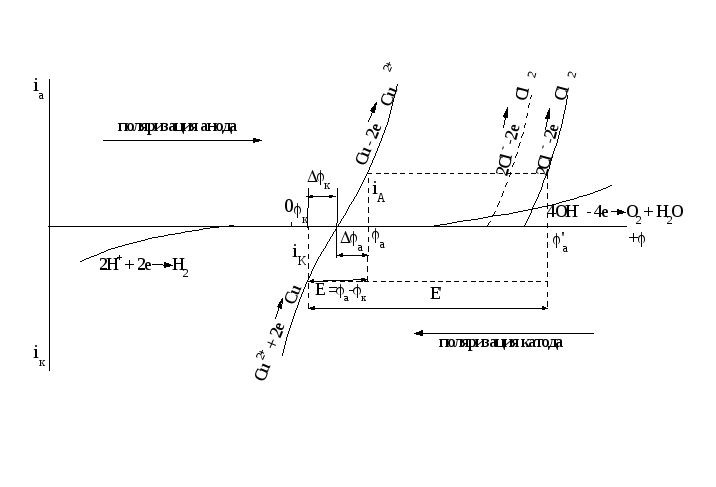
Рисунок 2.8 - Схематические поляризационные кривые при электролизе водного раствора CuCl2
Если подключить электроды к какому-либо источнику ЭДС, то потенциалы электродов будут сдвинуты от равновесных в отрицательную сторону (катод) и положительную сторону (анод), то есть произойдет поляризация электродов. Это вызовет протекание электродных процессов: на аноде единственно возможной реакцией будет окисление меди
Cu0 - 2e → Cu2+, для этой реакции нужна наименьшая величина поляризации анода. Для других реакций (окисление Cl- и OH-) нужна более высокая поляризация.
На катоде единственной реакцией будет восстановление меди, а для восстановления ионов водорода необходим более высокий отрицательный потенциал катода.
Таким образом, достаточен малый сдвиг потенциала от равновесного, чтобы оба эти процесса начались с достаточной скоростью. Так, при подаче на электроды ЭДС, равной E = φa – φк (рисунок 2.8) скорости окисления и восстановления равны iА= iК. при сдвиге потенциалов Δφa и Δφк (не равных друг другу).
б) с использованием инертных анодов.
Поместим в электролизер два электрода, один из которых (анод) состоит из инертного металла, то есть не способного растворяться при подведении к нему положительного заряда.
Воспользуемся поляризационными кривыми на рисунке (2.8). В нашем случае будет отсутствовать кривая растворения медного анода
Cu0 – 2e → Cu2+.
Все остальные кривые остаются. Подведем к электродам внешнюю ЭДС и будем поляризовать электроды. При поляризации катода, как и в случае (а), первой (и единственной) реакцией на катоде будет восстановление меди Cu2+ + 2e → Cu0.
Возьмем скорость окисления и восстановления равной iА и iК, как в случае (а). Восстановление водорода возможно при гораздо более высоком потенциале электрода и после восстановления всех ионов Cu2+ из раствора.
При поляризации анода первым достигается равновесный потенциал окисления ОН-, но поскольку окисление ОН- протекает с большим перенапряжением, то участок его поляризационной кривой вблизи от равновесного потенциала стелется вдоль абсциссы, и для возникновения тока значительной силы (протекания реакции окисления ОН- со скоростью iА) требуется ЭДС заметно большая, чем разность между равновесными потенциалами (Е´, рисунок 2.8). При повышении ЭДС достигается равновесный потенциал реакции окисления Cl-, не требующий большого перенапряжения, и начинает выделяться Cl2 при потенциале φ´а. При этом некоторое количество О2 все же может образоваться. Выделение Cl2 при меньшем потенциале можно достичь уменьшением значения равновесного потенциала хлора за счет увеличения концентрации ионов Cl- в электролизере (пунктирная кривая на рисунке 2.8). В этом случае О2 не образуется вовсе.
