
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
1.7 Растворимость
Растворимость – это способность веществ образовывать гомогенные системы. Количественно она выражается в виде концентрации насыщенного раствора. Раствор считается насыщенным, если он находится в равновесии с избытком растворяемого вещества.
Жидкие растворы могут быть образованы растворением в жидком растворителе твердого вещества, газа или жидкости.
1.7.1 Растворимость твердых веществ в жидкости
На растворимость любых веществ, прежде всего, влияет природа растворителя и растворенного вещества. Идеальные растворы образуются веществами, сходными по химическому составу и по физическим свойствам. Часто сходство и различие выражается в виде полярности молекул и отражается на растворимости: полярные вещества лучше растворяются в полярных растворителях, а неполярные вещества - в неполярных растворителях.
Из внешних факторов наиболее значимым является температура. При образовании идеальных растворов твердого вещества в жидкости влияние температуры определяется уравнением И. Ф. Шредера:
![]() ,
(1.7 )
,
(1.7 )
где Хi
- растворимость
i
–го компонента (молярная доля i
–го компонента в насыщенном растворе);
![]() - его молярная теплота плавления.
- его молярная теплота плавления.
Поскольку
![]() > 0, то и
> 0, то и![]() > 0, следовательно, идеальная растворимость
твердого вещества в жидкости при
повышении температуры всегда увеличивается.
> 0, следовательно, идеальная растворимость
твердого вещества в жидкости при
повышении температуры всегда увеличивается.
Интегрирование
уравнения (1.7) в пределах от
![]() до
до![]() и от Т1
до Т2 приводит
к уравнению:
и от Т1
до Т2 приводит
к уравнению:
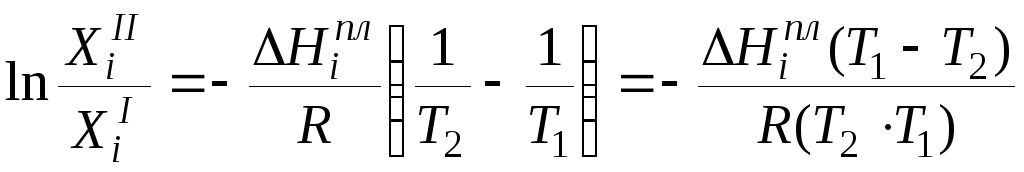 .
.
Если взять
![]() =1
(чистый компонент),Т1
=
=1
(чистый компонент),Т1
=
![]() ,
тогда:
,
тогда:
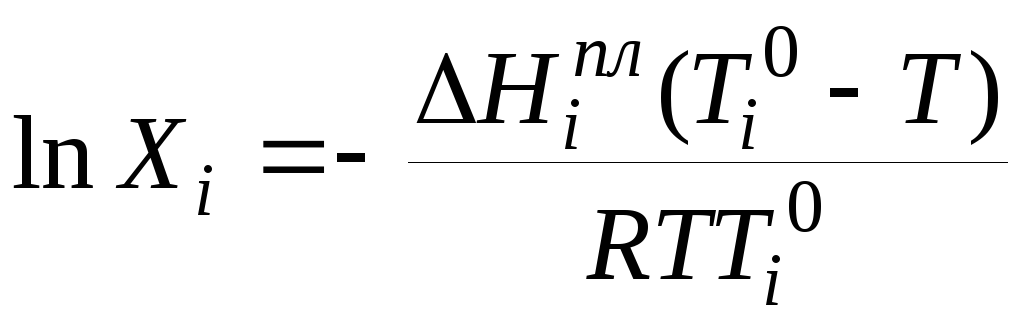 .
.
Для реальных растворов уравнение (1.7) имеет иной вид:
![]() ,
(1.8)
,
(1.8)
где аi
– растворимость, выраженная в виде
активности растворенного вещества;
![]() - молярная теплота растворения вещества
в насыщенном растворе.
- молярная теплота растворения вещества
в насыщенном растворе.
Поскольку
![]() может иметь и положительные, и отрицательные
значения, и даже равняться нулю, то и
первая производная,
может иметь и положительные, и отрицательные
значения, и даже равняться нулю, то и
первая производная,![]() ,
так же может иметь разные знаки:
,
так же может иметь разные знаки:
![]() > 0, с ростом
температуры растворимость увеличивается;
> 0, с ростом
температуры растворимость увеличивается;
![]() < 0, с ростом
температуры растворимость уменьшается;
< 0, с ростом
температуры растворимость уменьшается;
![]() = 0, изменение
температуры не влияет на растворимость.
= 0, изменение
температуры не влияет на растворимость.
1.7.2 Растворимость газов в жидкости
Влияние давления газа на растворимость выражается законом Генри:
«Парциальное давление пара растворенного вещества пропорционально его молярной доле в растворе»:
![]() ,
,
где Р2 – парциальное давление растворенного газа; К – константа Генри; Х2 – молярная доля растворенного газа в растворе.
Закон Генри получен для газов, не вступающих в химическое взаимодействие с растворителем, применим при постоянной температуре и невысоких давлениях.
Он может быть применен и для растворов летучих жидкостей при образовании бесконечно разбавленного раствора.
Для бесконечно разбавленного реального раствора парциальное давление растворителя вычисляется по закону Рауля, а растворенного вещества – по закону Генри. Это иллюстрируется рисунком 1.5.
Рассмотрим линию
парциального давления компонента А. В
области растворов с большим содержанием
компонента А он является растворителем,
и зависимость
![]() выражается прямой, совпадающей с прямой
выражается прямой, совпадающей с прямой![]() (по закону Рауля, пунктирная линия). В
области больших содержаний компонента
В, компонент А является растворенным
веществом, зависимость
(по закону Рауля, пунктирная линия). В
области больших содержаний компонента
В, компонент А является растворенным
веществом, зависимость![]() на этом участке так же прямолинейна, но
подчиняется закону Генри
на этом участке так же прямолинейна, но
подчиняется закону Генри![]() и идет по прямой, не совпадающей с
пунктирной линией, поскольку в реальных
растворах
и идет по прямой, не совпадающей с
пунктирной линией, поскольку в реальных
растворах![]() .
.
С расширением
интервала концентраций идеального
состояния раствора прямолинейные
отрезки кривых увеличиваются. Если же
раствор будет идеальным при всех
концентрациях, то уравнения законов
Рауля и Генри будут тождественными, а
![]() .
В этом случае кривые становятся прямыми
линиями (пунктирные линии на рисунке
1.5).
.
В этом случае кривые становятся прямыми
линиями (пунктирные линии на рисунке
1.5).
Закон Генри может быть записан в другой форме:
![]() .
.
«Растворимость газа, не вступающего в химическое взаимодействие с растворителем, прямо пропорциональна его парциальному давлению в газовой фазе»
Растворимость может быть выражена не только в виде молярной доли, Х, но и через концентрацию:
![]() ,
,
где С,
![]() .
.
Какую из форм
уравнения Генри следует применять,
можно определить по размерности константы
Генри:
![]() .
.
Мерой растворимости газа служит также α – коэффициент поглощения (коэффициент абсорбции). Это объем газа, приведенный к нормальным условиям (Т = 273 К, Р = 1 атм.), растворенный в одном объеме растворителя:
![]() .
.
Тогда закон Генри можно записать в виде уравнения:
![]() (1.9)
(1.9)
Величина α не зависит от давления. Если объем газа измеряется при температуре опыта, то уравнение (1.9) примет вид:
![]() ,
,
где β – коэффициент растворимости, также не зависит от давления.
![]() .
.
На растворимость газа влияет температура по уравнению:
![]() ,
,
где К
– константа Генри;
![]() - теплота растворения газа в насыщенном
растворе.
- теплота растворения газа в насыщенном
растворе.
Для большинства
газов
![]() <
0 (экзотермический эффект), следовательно,
при увеличении температуры растворимость
газа уменьшается.
<
0 (экзотермический эффект), следовательно,
при увеличении температуры растворимость
газа уменьшается.
На растворимость газов влияет присутствие третьего компонента. Так, в водных солевых растворах растворимость газов меньше, чем в чистой воде. Это явление называется «высаливанием».
Зависимость растворимости газа в водном растворе от концентрации соли выражается уравнением Сеченова:
![]() ,
,
где Х0, Х – молярные доли газа в чистой воде и солевом растворе, соответственно; С – концентрация соли, моль/л; К – константа, характерная для данной соли.
При совместной растворимости нескольких газов каждый газ растворяется в жидкости независимо от других газов (в соответствии со своим парциальным давлением и коэффициентом растворимости).
Состав растворенной газовой смеси отличается от состава газовой смеси над раствором. Так, если в воздухе содержится 78 % азота и 21 % кислорода, то в растворенном в воде воздухе содержится 63 % азота и 35 % кислорода.
