
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
3.4 Методы определения порядка реакции
Для определения порядка реакции в целом необходимо определить частные порядки по каждому веществу, вступающему в реакцию, а затем суммировать их. Для определения порядка по данному веществу необходимо создать условия, при которых будет изменяться концентрация только этого вещества.
Укажем некоторые из таких условий:
В реакции принимает участие одно исходное вещество.
Скорость реакции зависит от концентрации одного реагента и катализатора, а концентрация катализатора постоянна по ходу реакции.
Все реагенты, кроме одного, берутся в большом избытке, в результате чего их концентрации мало меняются по ходу реакции и могут рассматриваться как постоянные.
Концентрация всех реагентов, кроме одного, поддерживается постоянной каким-либо искусственным путем. Например, проводя реакции с участием иона ОН- как реагента, можно обеспечить присутствие буфера для поддержания концентрации ОН-.
При определении
порядка реакции используется основное
свойство кинетического уравнения
![]() ,
согласно которому константа скорости
и порядок реакции по ее компонентам
остаются постоянными в течение всей
реакции, а так же при изменении начальных
концентраций реагентов.
,
согласно которому константа скорости
и порядок реакции по ее компонентам
остаются постоянными в течение всей
реакции, а так же при изменении начальных
концентраций реагентов.
Метод подстановки
По ходу реакции определяют текущие концентрации исходного вещества в различные моменты времени от начала реакции.
Предполагают, что реакция первого порядка. По уравнению для константы скорости первого порядка (раздел 3.2.2, с. 78) рассчитывают все возможные значения К. Если значения К постоянны (в пределах ошибки опыта), то реакция имеет первый порядок. Если же не постоянны значения К, или закономерно убывают или возрастают, то реакция не первого порядка. Аналогично проверяют на второй порядок. Если реакция не первого и не второго порядка, то для определения порядка используют другие методы.
Графический метод
Этот метод основан на том, что кинетическая кривая может иметь линейный вид (x) = f(t), где вид (x) соответствует конкретному порядку реакции:
для первого порядка ln C = f (t),
для второго порядка 1/С = f (t),
для третьего порядка 1/С2 = f (t),
для нулевого порядка Спродукта = f (t).
Поочередно строя такие зависимости, смотрят, в каких координатах получается прямая линия.
Этот метод и метод подстановки взаимосвязаны, и нет смысла его использовать, если метод подстановки не выявил порядок реакции.
Метод начальных скоростей
Скорость расходования вещества в начальный момент времени определяется по уравнению:
![]() .
.
Для понижения
порядка проводят ряд опытов, в которых
берется вещество А
с различной начальной концентрацией,
![]() ,
а начальная концентрацияB
во всех опытах берется одинаковой. Тогда
,
а начальная концентрацияB
во всех опытах берется одинаковой. Тогда
![]() ,
где
,
где
![]() ,
,
![]() .
(3.8)
.
(3.8)
Получилось уравнение
прямой в координатах (![]() )
с тангенсом угла наклона, равным порядку
реакции,n.
Для определения начальных скоростей
получают начальные участки кинетических
кривых, поскольку лишь в начале реакции
сохраняется постоянство концентрации
вещества В.
)
с тангенсом угла наклона, равным порядку
реакции,n.
Для определения начальных скоростей
получают начальные участки кинетических
кривых, поскольку лишь в начале реакции
сохраняется постоянство концентрации
вещества В.
Порядок реакции
можно приблизительно определить по
значениям двух начальных скоростей
(![]() ),
которые соответствуют двум начальным
концентрациям реагента (
),
которые соответствуют двум начальным
концентрациям реагента (![]() ),
используя соотношение (3.8):
),
используя соотношение (3.8):
![]()
Вычитая второе
уравнение из первого, получаем
![]() откуда
откуда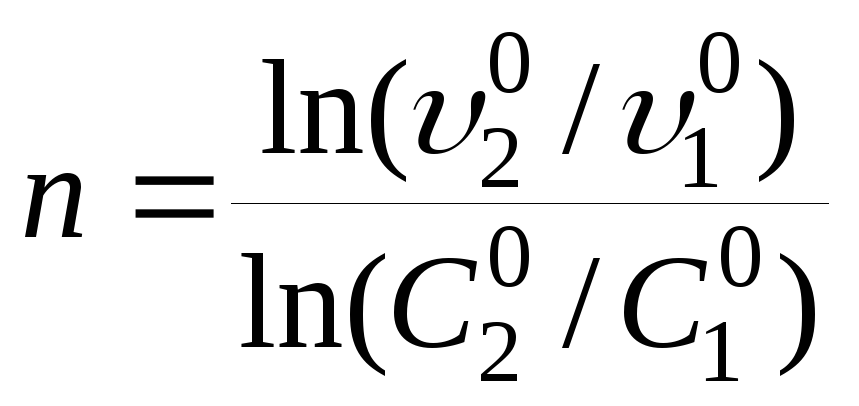 .
.
Для приближенного
расчета скоростей можно использовать
соотношение:
![]() ,
,
где
![]() - изменение концентрации реагента за
промежуток времени
- изменение концентрации реагента за
промежуток времени![]() .
.
Метод избытка (метод Вант - Гоффа)
Это метод определения порядка по изменяющейся во времени скорости реакции от концентрации реагента. Реакцию проводят при большом избытке всех реагентов, кроме одного, например А. Тогда
![]()
В процессе реакции расходуется реагент и уменьшается скорость реакции. Скорости реакции находят из полной кинетической кривой, проводя графическое дифференцирование, определяя тангенсы углов наклона касательных к кинетической кривой (рисунок 3.9).

Рисунок 3.9 – Графическое дифференцирование кинетической кривой
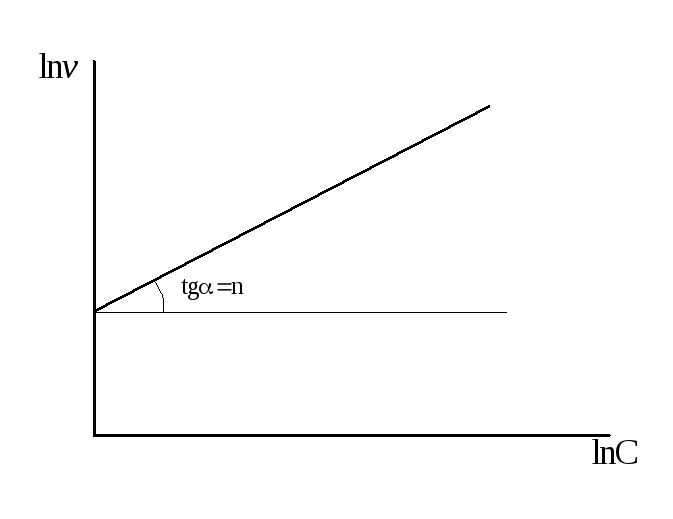
Рисунок 3.10 – Определение порядка реакции
По найденным
значениям u
строят график в координатах (![]() ),
согласно уравнению (3.8), и находят порядок,n
(рисунок 3.10).
),
согласно уравнению (3.8), и находят порядок,n
(рисунок 3.10).
Метод нахождения общего порядка реакции
Для нахождения общего порядка реакции необходимо взять реагенты в стехиометрическом соотношении. Если стехиометрическое уравнение реакции:
аА + вВ → продукты
то при СА
: СВ
= а : в,
![]() .
.
Тогда кинетическое уравнение примет вид:
![]() .
.
Далее логарифмирование
приведет к линейной зависимости
![]() от
от![]() и определению (n
+ m)
как тангенс угла наклона (аналогично
нахождению в методах 3 и 4).
и определению (n
+ m)
как тангенс угла наклона (аналогично
нахождению в методах 3 и 4).
Метод по доле непревращенного вещества к моменту времени t
Если
![]() - доля исходного вещества, не вступившего
в химическую реакцию к моменту времениt,
то
- доля исходного вещества, не вступившего
в химическую реакцию к моменту времениt,
то
![]() .
Подставляя выражение дляС
в уравнение
.
Подставляя выражение дляС
в уравнение
![]()
получаем:
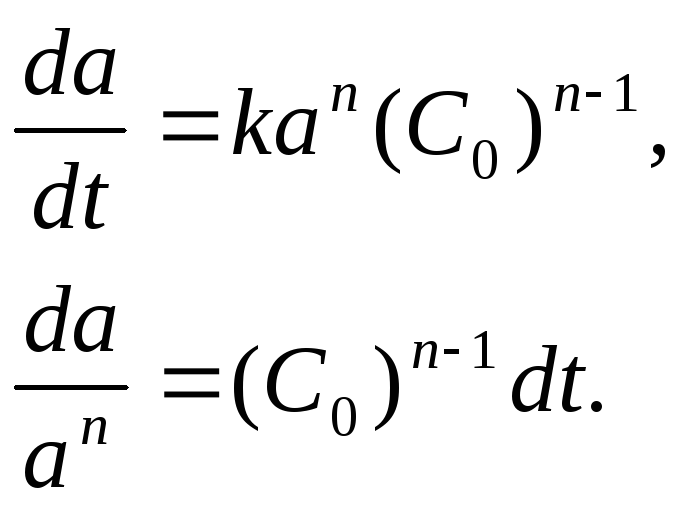
Интегрирование в пределах (а = 1; а) и (t = 0; t) приводит к уравнению:
![]()
![]()
![]() .
(3.9)
.
(3.9)
Уравнение сложно для расчета «n», поэтому его применяют в двух частных случаях:
а) проводят ряд опытов, в которых взяты разные начальные концентрации, но во всех опытах реакция доведена до одинаковой доли а. В таких условиях левая часть уравнения (3.9) постоянна, обозначим ее В:

Полученное уравнение
прямой в координатах (lnt;
lnC0)
позволяет графически найти «n»,
поскольку
![]() .
.
Если проведено два опыта с одинаковым значением а, то, записав уравнение 3.10 для обоих опытов и вычитая одно из другого, получаем уравнение для n:
![]()
-
![]()
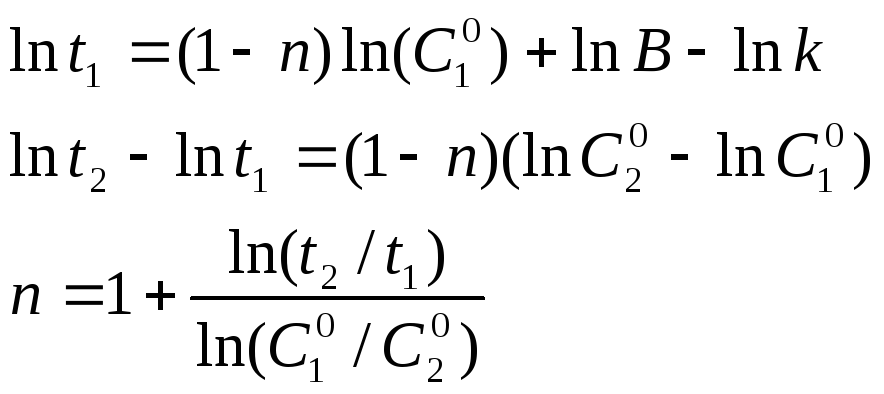
б) Можно определить
порядок, располагая одной полной
кинетической кривой. Выбирают на кривой
два значения а,
связанные между собой соотношением:
![]() и отвечающие этим значениямt2
и t1.
и отвечающие этим значениямt2
и t1.
При этом скобка в левой части уравнения (3.9) для а2 будет иметь вид:
![]() .
.
Записав уравнение (3.9) для второго опыта и для первого и поделив уравнения одно на другое получаем, сократив общие множители:
![]() ,
,
![]() ,
,
![]() .
.
После логарифмирования получаем:
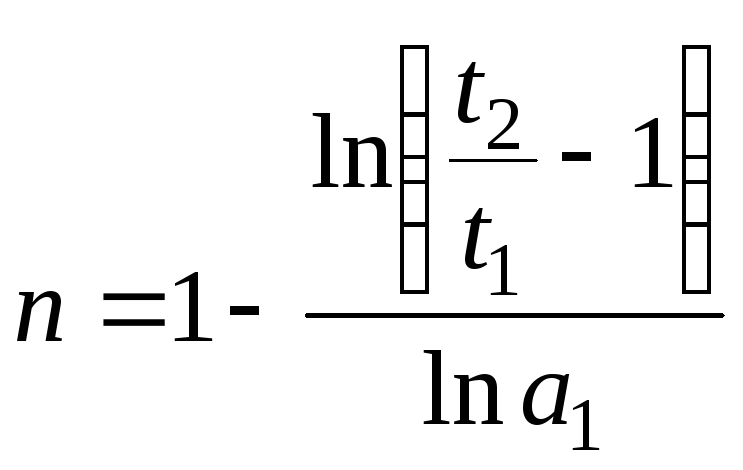 .
.
