- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.6 Вопросы для самоконтроля
1. Зависит ли константа диссоциации от концентрации электролита?
2. Рассчитать а± для Na2SO4 (С = 0,01 моль/л).
3. Объяснить ход
зависимости
![]() =f(C)для сильных и
слабых электролитов.
=f(C)для сильных и
слабых электролитов.
4. Изобразить кривую титрования соляной кислоты кондуктометрическим методом.
5. Составить электрод второго рода, в растворе которого содержится ион Cl-. Записать реакцию на электроде и уравнение для электродного потенциала.
6. Составить химический гальванический элемент с переносом из электродов первого рода. Определить знаки. Записать реакции на электродах, значения φ электродов.
7. Составить концентрационный гальванический элемент с переносом из газовых электродов. Определить знаки электродов, записать уравнения для φ электродов.
8. Провести потенциометрическое титрование Аg+. Выбрать индикаторный электрод и электрод сравнения, составить гальваническую цепь. Выбрать реакцию титрования. Изобразить зависимость φ индикаторного электрода от объема титранта.
9. Провести электролиз водного раствора NaCl. Изобразить поляризационные кривые, записать реакции на катоде и аноде.
10. Законы Фарадея.
Кинетика
Химическая кинетика – учение о химическом процессе, закономерностях протекания его во времени, механизме. Химическая кинетика открывает возможность сознательного управления промышленными процессами, позволяет ставить и решать вопросы интенсификации существующих и создания новых технологических процессов.
Задачи кинетики и термодинамики различны. Термодинамика ставит и решает задачи определения состояния равновесия, константы равновесия, выхода продуктов, но не может определить время достижения равновесия, скорость процесса, концентрации веществ в любой момент времени. Эти задачи решает химическая кинетика. Но химическая кинетика может увеличить скорость только той реакции, которая является термодинамически возможной. Ниже приведены реакции получения из простых веществ водородных соединений неметаллов.
|
|
|
ΔG0, кДж/моль |
|
H2 + |
Cl2 → HCl |
-93,8 |
|
O2 → H2O |
-225,0 | |
|
N2 → NH3 |
-16,4 | |
|
P → PH3 |
13,2 | |
|
C → CH4 |
-50,0 |
Термодинамический
анализ показывает, что все реакции
(кроме четвертой, где
![]() )
возможны. Но, например, реакция 3 имеет
при обычных условиях очень низкую
скорость и аммиак практически не
образуется. И здесь уже задача кинетики
– превратить возможность в действительность,
что на практике достигается повышением
температуры до 5000С
и применением катализатора.
)
возможны. Но, например, реакция 3 имеет
при обычных условиях очень низкую
скорость и аммиак практически не
образуется. И здесь уже задача кинетики
– превратить возможность в действительность,
что на практике достигается повышением
температуры до 5000С
и применением катализатора.
Если реакция протекает в одной фазе (газообразной или жидкой), то их изучением занимается кинетика гомогенных процессов. Если реакции совершаются на поверхности раздела фаз, то изучение их скоростей относится к кинетике гетерогенных процессов.
3.1 Скорость химической реакции
Скорость химической реакции может быть дана через степень превращения. В реакции
|
|
aA |
+ |
bB |
→ |
cC |
+ |
dD |
|
t = 0 |
n0A |
|
n0B |
|
n0C |
|
n0D |
|
t |
nA - n0A |
|
nB - n0B |
|
nC - n0C |
|
nD - n0D |
Во второй строчке
показано количество прореагировавших
веществ ко времени t.
Эта величина разная для различных
веществ и по значению, и по знаку. Но
если каждую из них поделить на
соответствующий стехиометрический
коэффициент, то все отношения будут
одинаковыми и иметь положительный знак,
поскольку а, в < 0, с, d
> 0. Полученная величина называется
химической
переменной
(или степенью протекания реакции),
![]() (кси).
(кси).
![]() .
.
Скорость реакции – это скорость изменения химической переменной (степени превращения, степени протекания реакции) во времени:
![]() >0,
>0,
где dni – изменение количества i-го компонента, νi – стехиометрический коэффициент i-го компонента.
Для большей
наглядности определяют скорость
в единице объема,
то есть вводят величину,
![]() ,
если объем постоянен:
,
если объем постоянен:
![]() >0.
>0.
На практике часто используют в качестве скорости реакции изменение концентрации в единицу времени:
![]()
Величина
![]() может быть положительной (для продуктов)
и отрицательной (для исходных веществ);
для разных веществ она различна, в то
время как величины
может быть положительной (для продуктов)
и отрицательной (для исходных веществ);
для разных веществ она различна, в то
время как величины![]() не зависят от выбора вещества и всегда
положительны.
не зависят от выбора вещества и всегда
положительны.
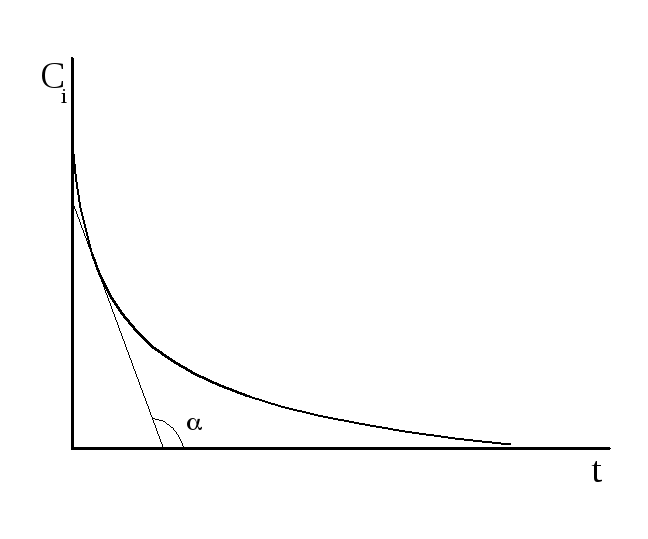
Графическое
изображение С от времени называется
кинетической кривой (рисунок 3.1). Проводя
графическое дифференцирование можно
найти величину производной dC/dt
в любой момент времени, которая и будет
характеризовать скорость реакции,
![]() .
.
|
|
|
Рисунок 3.1 – Пример кинетической кривой
Необходимым условием, определяющим возможность взаимодействия между двумя молекулами, является их взаимное столкновение. Поэтому при заданных внешних условиях (Т, Р, среда) скорость является функцией концентраций реагирующих веществ, так как число столкновений при большей концентрации будет увеличиваться.
Если химическая реакция протекает в одну стадию, то есть является элементарной, то непосредственно по ее стехиометрическому уравнению можно записать математическое выражение для скорости реакции в виде:
![]()
![]() или
или
![]() (3.1)
(3.1)
Для реакции aA
+ bB
![]() cC
+ dD
уравнение (3.1) называется кинетическим
уравнением
химической реакции. Оно отражает основной
постулат кинетики:
cC
+ dD
уравнение (3.1) называется кинетическим
уравнением
химической реакции. Оно отражает основной
постулат кинетики:
Скорость реакции пропорциональна концентрации реагирующих веществ.
Множитель «К», показывающий, с какой скоростью идет химический процесс при концентрациях реагирующих веществ равных единице, называется константой скорости химического процесса.
Наряду со скоростью константа скорости химического процесса является основной величиной в химической кинетике.