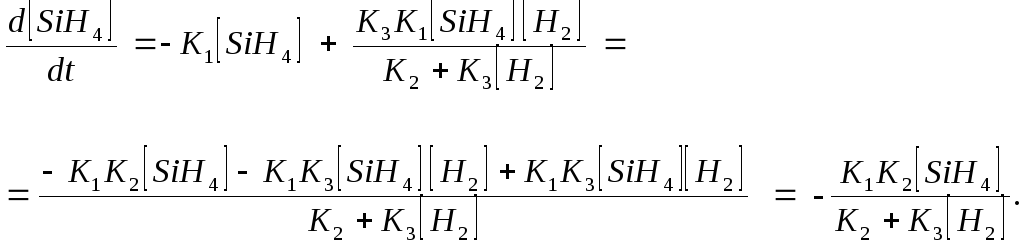- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
3.6 Примеры решения задач
Задача 1
Время половинного разложения уксусно-этилового эфира (С0 = 0,025 моль/л) щелочью (С0 = 0,050 моль/л) равно 6,81 мин. Определить время разложения эфира на 80 %. Реакция второго порядка.
Дано:
![]() =
0,025 моль/л
=
0,025 моль/л
![]() =
0,050 моль/л
=
0,050 моль/л
t1/2 = 681 мин
β = 0,8
n = 2
Решение:
СН3СООС2Н5 + NaOH → СН3СООNa + С2Н5OH
t = 0 0,025 0,050
t1/2 = 6,81 0,025-0,025∙1/2 0,050-0,025∙1/2
t = ? 0,025-0,025∙0,8 0,050-0,025∙0,8
При расчете текущей концентрации следует учесть, что по уравнению реакции исходные вещества реагируют в соотношении 1 : 1, поэтому в любой момент времени количество прореагировавших эфира и щелочи одинаково. Можно рассчитать константу равновесия из данных второй строчки, то есть через 6,81 минут от начала реакции.
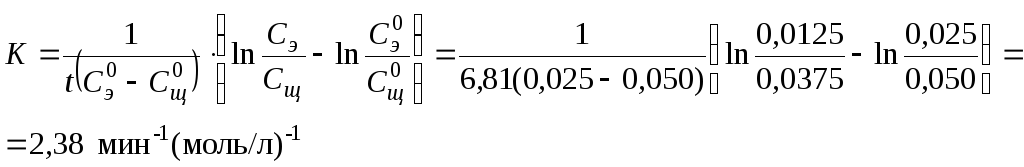 По
рассчитанному значению константы, из
этого же уравнения находится время, в
течение которого прореагирует 80 % эфира,
то есть
По
рассчитанному значению константы, из
этого же уравнения находится время, в
течение которого прореагирует 80 % эфира,
то есть
![]() (данные третьей строки).
(данные третьей строки).
![]()
Задача 2
При 310 0С AsH3 (газ) разлагается с образованием твердого мышьяка и водорода. Во время реакции давление в системе изменяется следующим образом:
|
t, час |
0 |
2,5 |
5,5 |
6,5 |
8,0 |
|
Р, мм.рт.ст. |
733 |
767 |
806 |
818 |
835 |
Показать, что реакция является реакцией первого порядка и вычислить константу скорости.
Решение:
Для подтверждения первого порядка используем графический метод, по которому зависимость lnP от t должна быть линейной. Под логарифмом стоит текущее давление исходного компонента AsH3. В то же время в таблице дано давление в системе, то есть общее давление, состоящее из исходного AsH3 и образующегося Н2, поэтому следует из общего давления выделить давление AsH3.
2AsH3 → 2As + 3 Н2
газ тв газ
t = 0 P0 0
t P0-x 3/2x
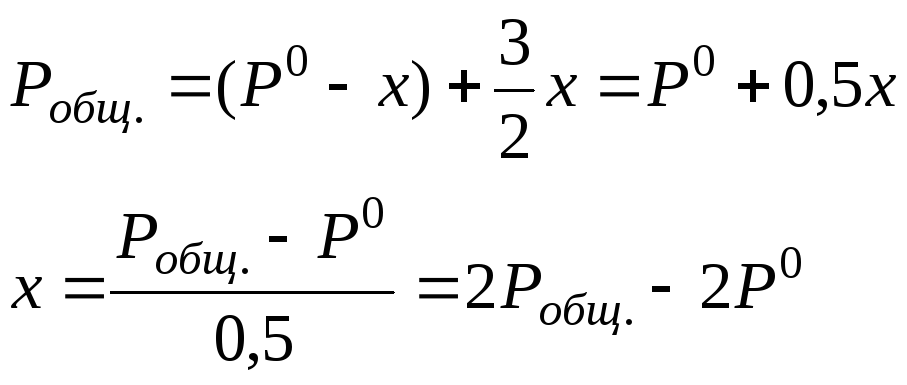
Отсюда текущее давление AsH3:
![]()
Р0 =733 мм.рт.ст. при t = 0.
Данные текущего давления заносим в таблицу, строим график lnP = f (t).
|
t, час |
0 |
2,5 |
5,5 |
6,5 |
8,0 |
|
|
733 |
665 |
587 |
563 |
529 |
|
|
6,597 |
6,500 |
6,357 |
6,333 |
6,271 |
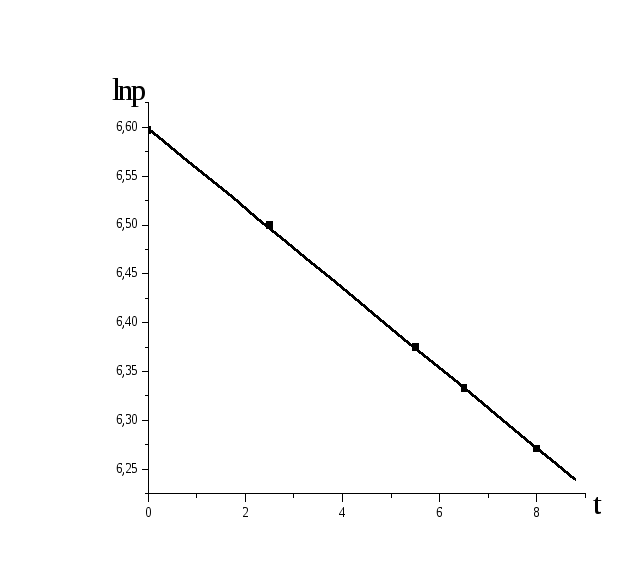
Константу скорости
можно найти из графика, поскольку
![]()
![]()
![]() .
.
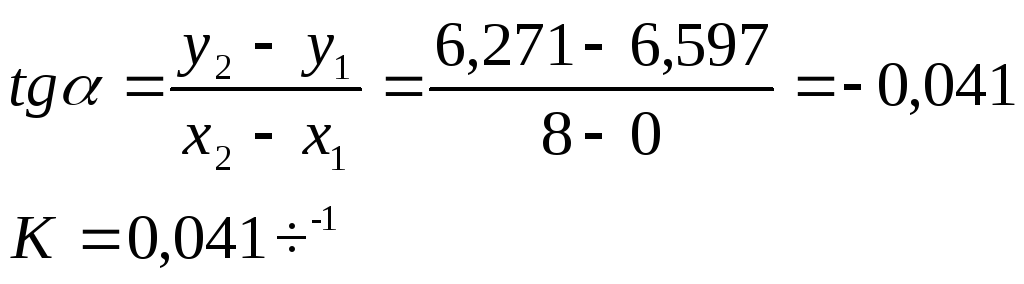
Задача 3
Определить порядок реакции: 2СО → СО2 + С, если при постоянной температуре в одном опыте начальное давление СО упало с 787 до 688 мм.рт.ст. за 10 минут, а в другом с 535 до 468 мм.рт.ст. за это же время.
Дано:
![]() =
787 мм.рт.ст.
=
787 мм.рт.ст.
P1 = 688 мм.рт.ст.
∆t1 = ∆t2 = 10 мин
![]() =535
мм.рт.ст.
=535
мм.рт.ст.
P2 = 468 мм.рт.ст.
n = ?
Решение:
В данном случае порядок можно определить методом начальных скоростей:
![]() ,
,
![]() ,
,
![]() ,
,
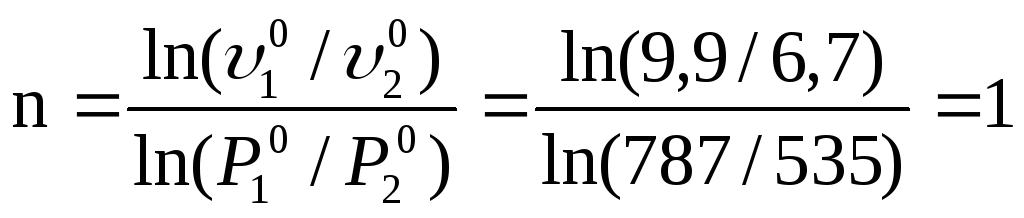 .
.
Задача 4
При изучении реакции 2NO + 2H2 → N2 + 2H2O при начальных давлениях NO и H2 равных 4,72∙104 Па в первом опыте и 2,69∙104 Па во втором половина вещества прореагировала за 81 с и 239 с соответственно. Определить порядок реакции.
Дано:
![]()
![]()
![]()
![]()
а1 = а2 = 1/2
n = ?
Решение:
Поскольку в обоих опытах доля непрореагировавшего вещества одинакова, то порядок определим по уравнению:
![]()
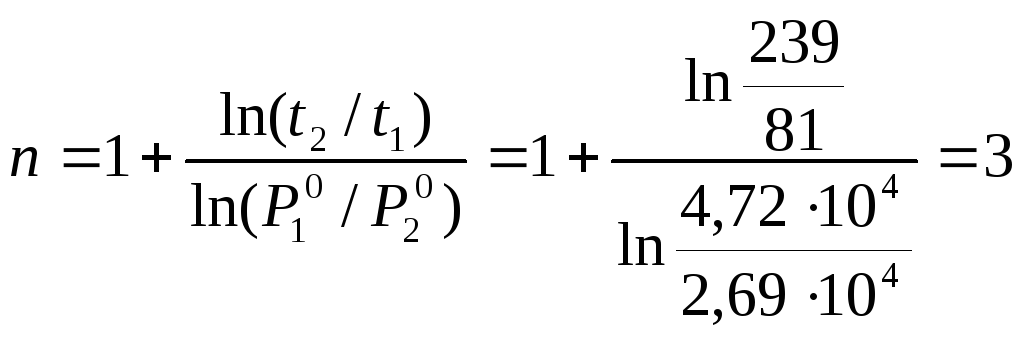 .
.
В данном случае получен общий порядок реакции, так как исходные давления взяты в стехиометрическом соотношении.
Задача 5
Для обратимой газофазной реакции
K1
А
![]() В
В
K2
начальные давления
А
и В
соответственно равны 1,33∙104
Па и 0. Через 10 минут после начала реакции
РА
= 5,3∙103
Па. Определить значение РА
и РВ
через 40 минут после начала реакции, если
![]() =
3. НайтиК1
и К2.
=
3. НайтиК1
и К2.
Дано:
![]() = 1,33∙104
Па
= 1,33∙104
Па
![]() = 0
= 0
t1 = 10 мин
Р1А = 5,3∙103 Па
t2 = 20 мин
![]() =
3
=
3
Р2(А) = ? Р2(В) =? К1=? К2=?
Решение
Представим данные задачи следующим образом:
K1
А
![]() В
В
K2
t
= 0
![]() 0
0
t1
= 10 мин
![]() -x1
x1
-x1
x1
t2
= 20 мин
![]() - x2
x2
- x2
x2
t
= ∞ (равновесие)
![]() - xравн.
xравн.
- xравн.
xравн.
Для нахождения констант скоростей прямой и обратной реакций используем систему уравнений (3.19) и (3.20).
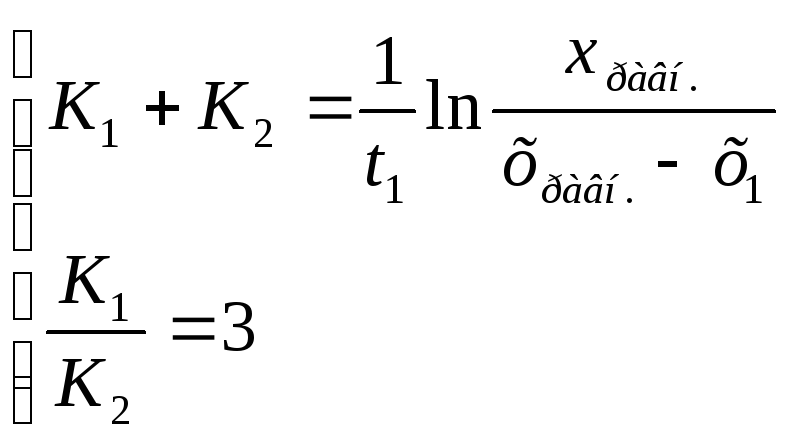
Первое из уравнений может быть отнесено к 10 минутам от начала реакции. По условию
Р1А
=
![]() -x1
= 1,33∙104
-
x1 =
5,3∙103 ,
откуда
-x1
= 1,33∙104
-
x1 =
5,3∙103 ,
откуда
x1 = 1,33∙104 - 0,53∙104 = 0,80∙104 Па.
xравн.
можно найти по закону действующих масс
из константы равновесия, которая равна
Кр
=![]() .
.
![]() =
=
![]() =
3, откуда
xравн.=
1,00∙104
Па
=
3, откуда
xравн.=
1,00∙104
Па
Составляем систему уравнений
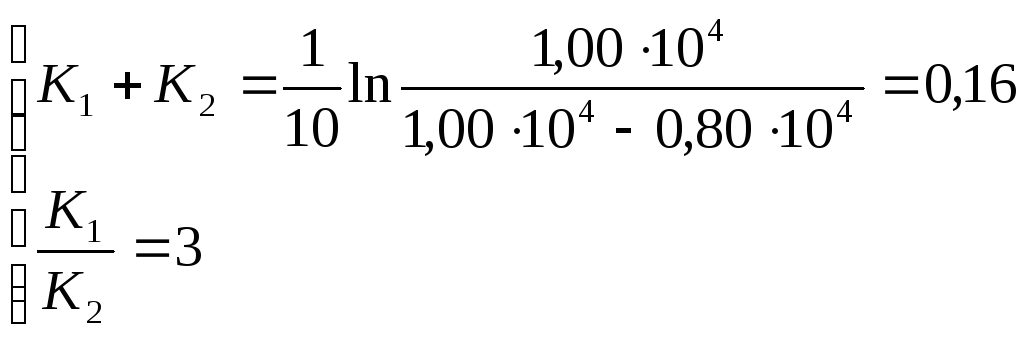
К1 = 0,12 мин-1; К2 = 0,04 мин-1.
Давление А
через 20 минут равно
![]() - x2;
- x2;
x2 находим по уравнению (3.21)
![]()
![]() 1,00∙104
1,00∙104![]()
![]()
Р2(А) =1,33∙104 - 0,96∙104 = 0,37∙104 Па.
Вещества В образовалось столько же, сколько израсходовалось вещества А, то есть Р2(В) = 0,96∙104 Па.
Задача 6
В условиях ацетолиза β-D-глюкопиранозы (А), наряду с пентаацетатом D-глюкопиранозы (В) образуется также некоторое количество продукта (С). Через 20 минут от начала реакции осталось от одного моля А 0,845 моль. При этом образовалось 0,012 моль вещества С. Рассчитать К1 и К2.
Дано:
а = 1 моль
а – х =0,845 моль
t = 20 минут
хс = 0,012 моль
К1=? К2=?
Решение
Реакция является параллельной
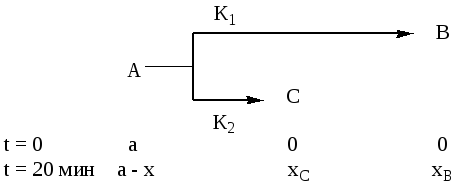
Для нахождения К1 и К2 надо решить систему уравнений
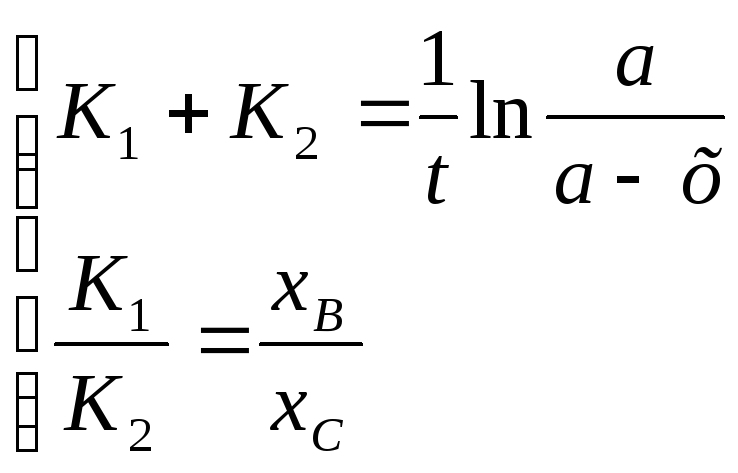
а – х =
0,845
![]() х =
а – 0,845
= 1 - 0,845 = 0,155 моль
х =
а – 0,845
= 1 - 0,845 = 0,155 моль
х = хС
+
хВ
![]() хВ =
х - хС
=
0,155 - 0,012 = 0,143 моль.
хВ =
х - хС
=
0,155 - 0,012 = 0,143 моль.
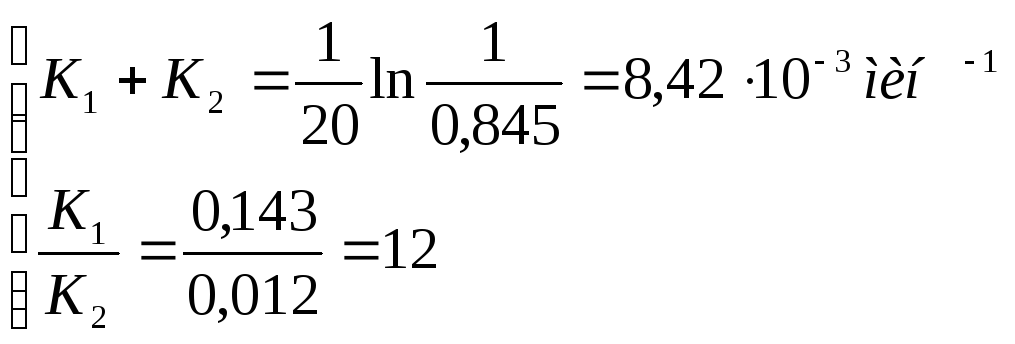
К1= 12 К2
К1 + К2 = 13 К2 = 8,42∙10-3
К2 = 0,65∙10-3 мин-1
К1 = 7,77∙10-3 мин-1
Задача 7
Реакция термического крекинга нефти (Н) является последовательной, причем бензин (Б) является промежуточным продуктом, распадающимся на газообразные вещества (Г). Определить максимальное количество бензина и время его достижения при крекинге 1 тонны нефти, если при 673 К константа образования бензина равна 0,283 ч-1, а распада – равна 0,102 ч-1.
Дано:
m0(H) = 1 т
К1 = 0,283 ч-1
К2 = 0,102 ч-1
tmax(Б) = ?
mmax(Б) = ?
Решение:
Реакция является последовательной, схематически может быть представлена так:
![]()
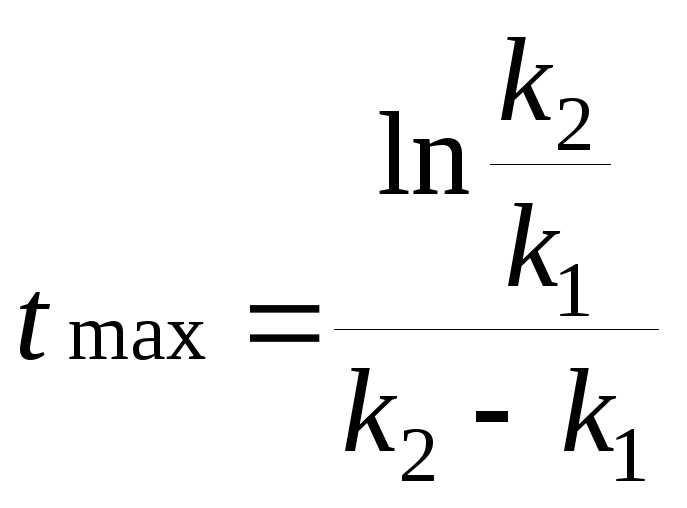
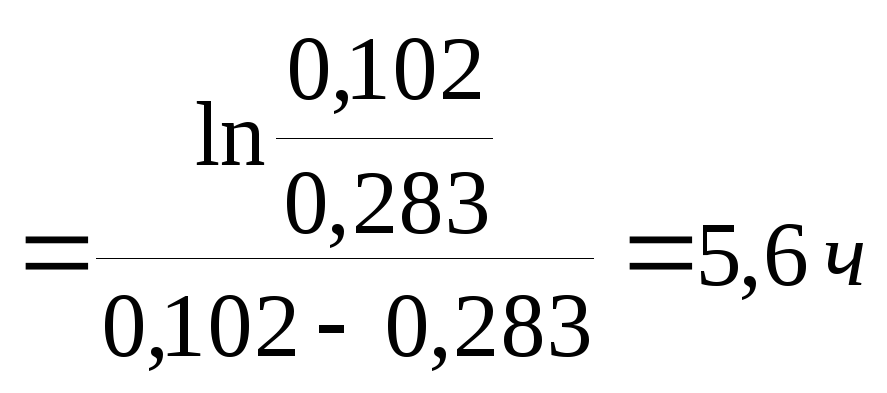 .
.
Количество образовавшегося бензина через 5,6 ч определяем по уравнению (3.22).
m(Б)
=
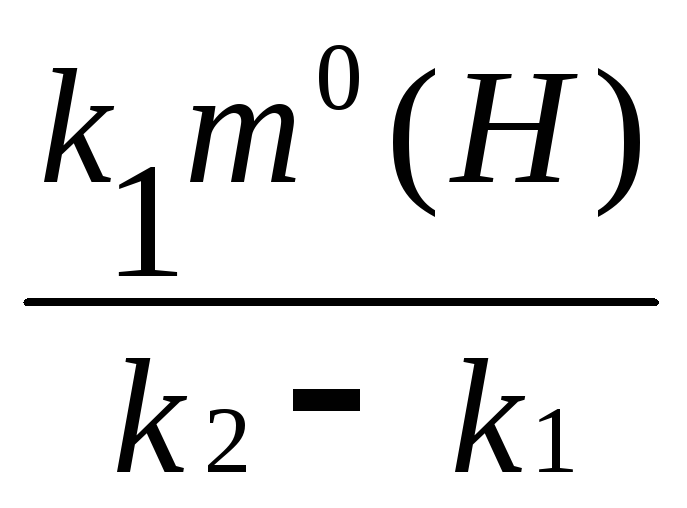 (
e-k1tmax
-
e-k2tmax)=
(
e-k1tmax
-
e-k2tmax)=![]() (e-0,283∙5,6
- e-0,102∙5,6)=
0,58 т
(e-0,283∙5,6
- e-0,102∙5,6)=
0,58 т
Задача 8
Получить выражение скорости реакции разложения гидрида силана
SiH4 → Si + 2H2, протекающей через стадии
SiH4
![]() SiH2+
H2;
SiH2+
H2;
SiH2
![]() Si + H2;
Si + H2;
SiH2
+ H2
![]() SiH4.
SiH4.
Решение:
Запишем общее выражение для искомой скорости. Обозначим концентрацию веществ в виде С(А) ≡ [A].
![]()
Промежуточное вещество SiH2 является неустойчивым и реакционно-активным, следовательно, можно применить к данному процессу метод стационарных концентраций.
![]() .
Откуда находим [SiH2]:
.
Откуда находим [SiH2]:
[SiH2]
=
![]() .
.
Подставив это значение в выражение для скорости разложения SiH4, найдем: