
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.3.2 Классификация электродов
В зависимости от природы веществ, участвующих в электродной реакции, электроды делятся на две группы:
1. Электроды, образованные электрохимически активными металлами, участвующими в токообразующей реакции.
2. Электроды с инертными металлами, не участвующими в токообразующей реакции.
К первой группе относятся электроды первого и второго рода.
Электроды первого рода - системы, состоящие из металла, опущенного в раствор соли этого металла. Например:
Ag+ | Ag; Sn2+ | Sn.
Реакции, протекающие на электродах:
Ag+
+ e
![]() Ag
Ag
Sn2+
+ 2e![]() Sn
Sn
Потенциал рассчитывается по уравнению (2.14)
![]() ,
так как
активность чистого твердого вещества
равна единице.
,
так как
активность чистого твердого вещества
равна единице.
К электродам первого рода также относятся амальгамные электроды и электроды, образованные сплавами, в которых меняется активность металла. Амальгама – металлическая система, одним компонентом которой является ртуть. Это, в основном, твердые растворы, химические соединения, жидкие растворы. Например:
![]()
![]() Na(Hg)
Na(Hg)
![]()
Здесь электродный потенциал зависит также и от активности металла в амальгаме.
К электродам второго рода относят металлические электроды, покрытые труднорастворимым соединением этого металла (солью, гидроксидом или оксидом), погруженные в раствор, содержащий анионы этой соли или ионы ОН- или Н+ (в случае гидроксида или оксида). Восстановление металла в этом случае идет из соли, оксида или гидроксида. При записи электрода вещества, из которых состоит электрод, записываются через запятую. Раствор отделяется вертикальной чертой, показывающей наличие скачка потенциала.
![]()
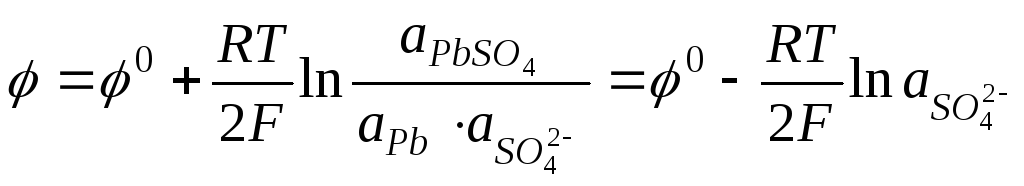 ;
;
![]()
![]()
![]()
В случае оксидно - металлических электродов (б, в, г) электродный потенциал зависит от рН раствора.
Ко второй группе относятся окислительно - восстановительные и газовые электроды.
Газовые электроды состоят из инертного металла (часто платины), к которому подводится электрохимически активный газ. Молекулы газа адсорбируются на поверхности металла, распадаясь на атомы, которые и участвуют в электродном процессе. Платина с адсорбированным газом частично погружена в раствор, содержащий ионы этого газа. Примерами таких электродов могут служить водородный, хлорный, кислородный.
Водородный электрод в кислой среде:
Н+
|
H2,
Pt
; Н+
+ е
![]() 1/2Н2;
1/2Н2;
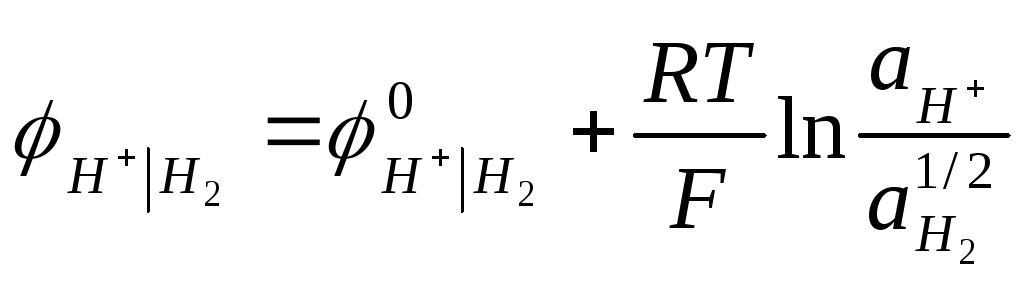 .
.
![]() = 0 при аН+
= 1 и рН = 0.
= 0 при аН+
= 1 и рН = 0.
Водородный электрод в щелочной среде:
ОН-│H2,
Pt
2Н2О
+ 2е
![]() Н2
+ 2 ОН-
Н2
+ 2 ОН-
![]()
![]() В при аОН-
= 1 и рН = 14.
В при аОН-
= 1 и рН = 14.
Кислородный электрод, в отличие от водородного электрода, является необратимым.
Кислородный электрод в кислом растворе:
![]()
![]() (при РО2
= 1)
(при РО2
= 1)
![]() В
при аН+
= 1 и рН = 0
В
при аН+
= 1 и рН = 0
Кислородный электрод в нейтральном или щелочном растворах
![]()
![]()
![]() В при аОН-
= 1 и рН = 14
В при аОН-
= 1 и рН = 14
Уравнения для
![]() и
и![]() термодинамически идентичны. Идентичны
и уравнения для
термодинамически идентичны. Идентичны
и уравнения для![]() и
и![]() .
Это объясняется термодинамической
зависимостью активностей
.
Это объясняется термодинамической
зависимостью активностей![]() и
и![]() через константу диссоциации воды
через константу диссоциации воды![]() (ионное произведение воды).
(ионное произведение воды).
Окислительно-восстановительные (редокс) электроды. Это электроды, составленные из инертного металла (обычно платины), погруженного в раствор, где присутствуют ионы какого-либо вещества, имеющие различную степень окисления. В этом случае реакции окисления – восстановления идут без образования новой фазы.
Множество разнообразных редокс-электродов можно разделить на два класса:
а) не зависящие от рН раствора. К ним относятся некоторые неорганические окислительно – восстановительные системы:
Fe3+, Fe2+ | Pt Fe3+ + e → Fe2+
![]()
б) зависящие от рН раствора. К этой группе относятся часть неорганических и все органические системы.
Н+, MnO4-, Mn2+ | Pt MnO4- + 8H+ + 5e → Mn2+ + 4H2O
H+, HCOOH, HCOH | Pt HCOOH+2H+ + 2e → HCOH + H2O
